第七章 化键与分子结构同步练习、思考题与习题答案
高教版有机化学第三版答案7

4.在下列各组结构中应使用“
”或“
”才能把它们
正确地联系起来,为什么?
(答案)
(1)
课 后 答 案 网
(2) (3) (4) 解:
两组结构都为烯丙型 C+共振杂化体
课 后 答 案 网
5. 写出下列反应物的构造式.(答案) (1) (2) (3) (4) 解:
20.以乙烷、乙烯、乙炔、苯和萘为例子,列表比较烷、烯、炔和芳烃
几类化合物的结构和性质。
(答案)
解:
烷烃
烯烃
炔烃
芳烃
例 乙烷
乙烯乙炔苯Fra bibliotek萘结 两个 C 均以四 分子中,C 采取 分子中,C 采取 分子中,C 采取
构 面体结构与其 SP2 杂化,分子 SP3 杂化,所有原 SP2 杂化,整个分
它原子或基团 中的所有原子 子在一条直线上, 子中,所有 C 原子
1,3,5-三甲苯,即
.
15.比较下列碳正离子的稳定性。
(答案)
解: Ar3C+>Ar2C+H>ArC+H2≈R3C+>CH3 16.下列傅-克反应过程中,哪一个产物是速率控制产物?哪一个是平衡
控制产物?
(答案)
解:
课 后 答 案 网
17.解释下列事实:
(答案)
(1)以
共振贡献结构。 解:
进攻邻位时碳正离子的
(答案)
(5)
解: ⑴ 1,2,3-三甲苯>间二甲苯>甲苯>苯 ⑶ C6H5NHCOCH3>苯>C6H5COCH3
⑵ 甲苯>苯>硝基苯
12.以甲苯为原料合成下列各化合物。请你提供合理的合成路线。
生物化学练习及思考题问答题参考答案

答:蛋白质分离纯化的一般步骤包括 1.样品前处理、粗分级分离和纯化。根据蛋白质的 性质,蛋白超过滤 2)密度梯度离心:物质大小和密度不同,经密度梯度离心后,每种蛋白质颗粒沉
可逆抑制抑制剂以非共价键与酶结合,造成酶活性的暂时丧失,可用透析等 简单方法除去而使酶活性完全或部分恢复,称为可逆抑制。
可逆抑制作用包括竞争性、非竞争性、反竞争性抑制。如磺胺类药物对二氢 叶酸合成酶的竞争性抑制。
3、写出米氏方程,并说明什么是 Km 值及其意义。 米氏方程:
Vmax [S] V= Km + [S] Km 值本身的含义是:酶反应速度达到最大反应速度一半时的底物浓度。 Km 值的意义: ① 不同的酶具有不同 Km 值,它是酶的一个重要的特征物理常数。 Km 值只是在固定的底物,一定的温度和 pH 条件下,一定的缓冲体系中测定的,不 同条件下具有不同的 Km 值。 ② Km 值表示酶与底物之间的亲和程度: Km 值大表示亲和程度小,酶的催化活性低; Km 值小表示亲和程度大,酶的催化活性高。 ③、Km 可判断酶专一性和最适底物:Km 值最小的底物为最适底物。 ④、Km 帮助推断某一代谢反应的方向和途径。 ⑤、已知 Km,可计算出某一底物浓度时,其反应速率相当于 Vmax 的百分率。 ⑥、可用来确定测定酶活性时所需的底物浓度。
2、简述酶的作用机理。
(1)酶能够大幅度降低反应的活化能,使反应体系中活化分子数目增加,因此使反应大大 速度加快。 (2)酶之所以能够降低反应活化能,可以用中间产物学说来解释—酶催化反应时,首先与 底物结合,生成不稳定的中间产物 ES,然后 ES 再分解为产物和酶。由于 ES 的形成,改变 了原来的反应途径,使分子内部的化学键有稳定变成活化状态,因此降低了反应的活化能。 (3)酶如何与底物形成 ES,可用诱导契合学说解释。当 E 和 S 接触时,E 在 S 的诱导下, 空间结构发生一定的变化,使活性中心的活性基团重新排列定向,形成更适合与 S 结合的空 间结构,同时 S 也发生相应的变化,经变化后的 E 和 S 相互吻合,形成 ES。
有机化学第7、8章习题答案

第7章芳烃及非苯芳烃思考题答案思考题7-1苯具有什么结构特征? 它与早期的有机化学理论有什么矛盾?答案:苯分子具有高度的不饱和性,其碳氢比相当于同分子量的炔烃,根据早期的有机化学理论,它应具有容易发生加成反应、氧化反应等特性。
但事实上,苯是一种高度不饱和却具异常稳定性的化合物。
因此,要能够很好地解释这一矛盾是当时有机化学家所面临的重大挑战。
[知识点:苯的结构特征]思考题7-2早期的有机化学家对苯的芳香性认识与现代有机化学家对苯的芳香性认识有什么不同?答案:早期的有机化学把那些高度不饱和的苯环类结构并具有芳香气味的化合物称为芳香化合物,这些化合物所具有的特性具称为芳香性。
随着对事物认识的不断深入,人们已经意识到,除了苯环以外还有一些其他类型的分子结构也具有如苯一样的特别性质。
现在仍然迫用芳香性概念,但其内涵已超出了原来的定义范围。
现在对芳香性的定义为:化学结构上环状封闭的共轭大π键,不易被氧化,也不易发生加成反应,但是容易起亲电反应的性质。
[知识点:苯的芳香性]思考题7-3 关于苯分子的近代结构理论有哪些?其中,由Pauling提出的共振结构理论是如何解释苯分子结构?答案:现代价键理论:苯分子中的六个碳原子都以sp2杂化轨道和相邻的碳和氢原子形成σ键,此sp2杂化轨道为平面其对称轴夹角为120°,此外每个碳原子还有一个和平面垂直的p轨道,六个p轨道相互平行重叠形成了一个闭合共轭体系。
分子轨道理论:基态时,苯分子的六个π电子都处在成建轨道上,具有闭壳层电子结构。
离域的π电子使得所有的C-C键都相同,具有大π键的特殊性质因此相比孤立π键要稳定得多。
Pauling提出的共振结构理论:苯的每个1,3,5-环己三烯都是一种共振结构体,苯的真实结构是由这些共振结构式叠加而成的共振杂化体。
【知识点:苯近代结构理论】思考题7-4什么是休克尔规则? 如何利用休克尔规则判别有机分子的芳香性? 答案:休克尔规则:单环化合物具有同平面的连续离域体系,且其π电子数为4n+2,n为大于等于0的整数,就具有芳香性;如果π电子数为芳香性,符合4n,为反芳香性,非平面的环状共轭烯烃则为非芳香性。
王全瑞主编《有机化学》习题及思考题答案
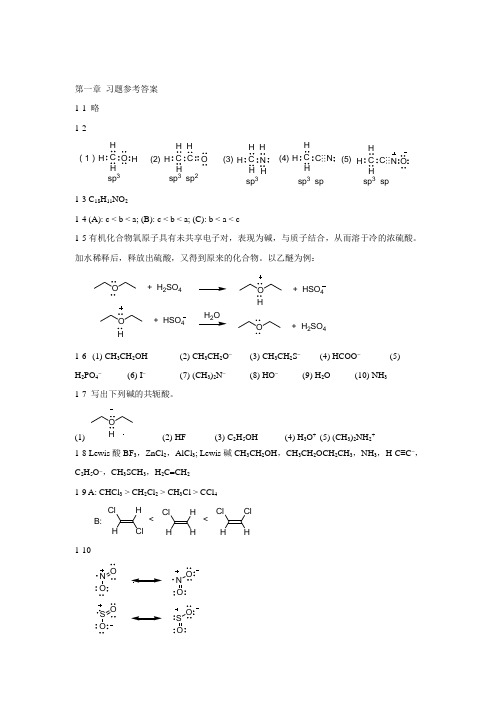
第一章 习题参考答案 1-1 略 1-2C O H H H C C OH H (1)(2)H(3)sp 3sp 3 sp 2C NH H H H C C H H H ⋯⋯N (4)(5)C C HHH ⋯⋯N O sp 3 sp 3sp sp 3 sp1-3 C 18H 11NO 21-4 (A): c < b < a; (B): c < b < a; (C): b < a < c1-5有机化合物氧原子具有未共享电子对,表现为碱,与质子结合,从而溶于冷的浓硫酸。
加水稀释后,释放出硫酸,又得到原来的化合物。
以乙醚为例:O+ H 2SO 4O + HSO 4H+ HSO 4HH OO+ H 2SO 41-6 (1) CH 3CH 2OH (2) CH 3CH 2O - (3) CH 3CH 2S - (4) HCOO -(5)H 2PO 4-(6) I -(7) (CH 3)2N -(8) HO -(9) H 2O (10) NH 31-7 写出下列碱的共轭酸。
(1) O H(2) HF (3) C 2H 5OH (4) H 3O + (5) (CH 3)2NH 2+1-8 Lewis 酸BF 3,ZnCl 2,AlCl 3; Lewis 碱CH 3CH 2OH ,CH 3CH 2OCH 2CH 3,NH 3,H-C ≡C -,C 2H 5O -,CH 3SCH 3,H 2C =CH 2 1-9 A: CHCl 3 > CH 2Cl 2 > CH 3Cl > CCl 4HCl H HHCl Cl H HCl HCl B:<<1-10N ON OS S ON OON OON OO第二章 习题参考答案 2-1(1)3-甲基-4-乙基庚烷;(2)2-甲基-4-异丙基己烷;(3)新壬烷;(4)2-甲基-5-乙基庚烷 (5)2-甲基-3-丙基己烷;(6)4-叔丁基辛烷;2-2 (1)(2)CH 3CHCHCH 3H 3CCH 3C CH 2CH 3CH 3CH 3H 3C (3)CH 3CHCH2CH 2CH 3CH32-3(1)庚烷(2)2-甲基己烷(3)(4)(5)(6)(7)(8)(9)3-甲基己烷2, 2-二甲基戊烷3, 3-二甲基戊烷2, 3-二甲基戊烷2, 4-二甲基戊烷3-乙基戊烷2, 2, 3-三甲基丁烷2-4CH 3—C —CH 2—CH —CH 2—CH 3CH 3CH 3CH 31°2°3°2°4°1°1°1°1°2-5 该化合物分子式为C 8H 18,结构式 命名为:2,2,3,3-四甲基丁烷 2-6 化合物沸点依次降低顺序:(4)>(2)>(3)>(5)>(1)H 3CH 3CC C CH 3CH 3H3CCH 3(7) (CH 3)2CHCH 2CH 3(8) (CH 3)2CHCHCH 2CH 2 CCH 2CH 3CH 2CH 3CH 3CH 2CH 3(9)(10)2-7 熔点:(1)>(2);沸点:(1)<(2) 2-8 稳定性大小:(1)>(3)>(2)>(4)2-9 1,2-二溴乙烷的四种典型构象式(从左到右稳定性依次降低)H HBr H H BrH H H HBrH H H HHHBr HBrH BrBr对位交叉式邻位交叉式 部分重叠式 全重叠式3, 4-二甲基己烷的优势构象为:2-10链引发:Cl 22Cl •链增长:Cl •+Cl•+ HCl•+ Cl 2Cl •+链终止:Cl •Cl •+Cl 2•Cl •+Cl•+•2-11 主要的原因是:甲基环己烷分子结构中有1个3º H ,10个2º H ,3个1º H ,进行溴代CH 3Br25反应时,不同类型氢原子的反应活性大小是3º H ∶2º H ∶1º H = 1600∶82∶1,可以初步计算出3º H 被溴取代后的产物所占百分比例大约是66%,因此反应主要得到 2-13 该化合物为: Cl 2++ HClC C H 3C H 3C H 3C CH 3CH 3CH 3C C H 3C H 3C H 3C CH 3CH 3CH 2Cl第三章 习题参考答案 3-1(1)甲基环戊烷 (2)1-甲基-4-乙基环己烷 (3)2-甲基-3-环丙基-6-环丁基辛烷 (4)反-1-甲基-2-异丙基环丁烷 (5)1-甲基-3-环戊基环己烷 (6)2-甲基-8-乙基螺[4.5]癸烷 (7)2, 7, 7-三甲基二环[4.1.0]庚烷 (8)二环[3.3.3]十一烷(9)1-甲基二环[2.2.2]辛烷(10) (11) (12) (13)3-2 该烃分子可能为下列化合物之一:甲基环己烷 乙基环戊烷 丙基环丁烷 丁基环丙烷 3-3(1)2) H 2OBrBr CH 2BrOHC C H 3C H 3C H 3C CH 3CH 3CH 3(2)HBrBr3-4顺-1-甲基-4-丙基环己烷的椅式构象式 反-1-甲基-4-丙基环己烷的椅式构象式CH 3C(CH 3)3H 3CC(CH 3)3CH 3C(CH 3)3C(CH 3)3CH 3最优势构象 3-5(1)CH 3H 3CC(CH 3)3(2) CH 3C 2H 5CH 3(3)CH 3(4) C(CH 3)3C 2H 5(5)C 2H 5C 2H 5H 5C 23-6 3, 4-二溴-1-叔丁基环己烷可能的构象异构体如下:C(CH 3)3C(CH 3)3Br BrC(CH 3)3BrBr C(CH 3)3BrBrC(CH 3)3Br BrBrBr C(CH 3)3BrBrC(CH 3)3BrBrC(CH 3)3BrBr3-7 化合物A 是: 化合物B 是: Br反应式:溴水褪色BrCH2BrBr3-8溴 水褪 色褪 色无变化无变化褪 色3-9 反-1,2-二甲基环己烷采用ee 构象时,亚甲基和甲基是处在对位交叉式,分子内能较小;而在aa 构象中,亚甲基和甲基是处在邻位交叉式,分子扭转张力相对比较大,同时由于1,3-竖键作用,空间张力大。
化学工艺学思考题和部分答案

《化学工艺学》第二版米田涛主编部分思考题答案课后习题增加部分英语题型专业(词汇)催化裂化,catalytic cracking加氢裂化,hydrocracking延迟焦化,delayed coking凝析油(Natural gasoline)、石脑油(Naphtha)、轻柴油(Atmospheric gas oil)、粗柴油(Vacuum gas oil)、加氢裂化尾油(Hydrogenated tail oil) 苯(Benzene, ),甲苯(Toluene, ),二甲苯(Xylene, );乙烯,ethylene丙烯,propylene丁二烯,butadiene邻二甲苯(Ortho-xylene,)、对二甲苯(Para-xylene,)、间二甲苯(Met-xylene,)聚乙烯, polyethylene;聚氯乙烯, polyvinylchlorid聚苯乙烯, polystyrene第三章3-1根据热力学反应标准自由焓和化学键如何判断不同烃类的裂解反应难易程度、可能发生的裂解位置及裂解产物;解释烷烃、环烷烃及芳烃裂解反应规律。
造成裂解过程结焦生碳的主要反应是哪些?答:由表3-3 各种键能比较的数据可看出:○1同碳数的烷烃C-H键能大于C-C键能,断链比脱氢容易;○2烷烃的相对稳定性随碳链的增长而降低;○3异构烷烃的键能小于正构烷烃,异构烷烃更容易发生脱氢或断链。
由表3-4数值,可看出:○1烷烃裂解是强吸热反应,脱氢反应比断链反应吸热值更高;断链反应的标准自由焓有较大的负值,是不可逆过程,脱氢反应的标准自由焓是正值或为绝对值较小的负值,是可逆过程,受化学平衡的限制;○2乙烷不发生断链反应,只发生脱氢反应,生成乙烯;甲烷在一般裂解温度下不发生变化。
烷烃热裂解的规律:烷烃热裂解的一次反应主要有:①脱氢反应:RCH2-CH3↔CH=CH2+H2②断链反应:RCH2-CH2-R′↔RCH=CH2+R′H不同烷烃脱氢和断链的难易,可以从分子结构中键能数值的大小来判断。
高中化学(新人教版)必修第二册课后习题:第七章测评(课后习题)【含答案及解析】

第七章测评(时间:90分钟分值:100分)一、选择题(本题包括10小题,每小题只有一个正确选项,每小题2分,共20分)1.(2021山东济宁任城区高一期中)下列化学用语表达正确的是()A.乙醇分子的空间填充模型:B.乙酸的结构简式:CH3COOHC.醛基的结构简式:—COHD.乙烯的结构简式:CH2CH2解析为乙酸分子的空间填充模型,A错误;乙酸的结构简式为CH3COOH,B正确;醛基的结构简式为—CHO,C错误;乙烯分子中含有碳碳双键,结构简式为CH2CH2,D错误。
2.C5H12有3种不同结构,甲为CH3(CH2)3CH3,乙为CH3CH(CH3)CH2CH3,丙为C(CH3)4,下列有关叙述正确的是()A.甲、乙、丙互为同系物,均可与氯气、溴蒸气发生取代反应B.光照条件下,甲能与氯气反应生成2种一氯代物C.甲、乙、丙中,丙的沸点最低D.丙有3种二氯代物,A项错误;光照条件下,甲能与氯气反应生成3种一氯代物,B项错误;丙的二氯代物只有2种,D项错误。
3.(2021河北唐山高一期末)法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。
轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2Cl2、丙烯、戊醇等,下列说法不正确的是()A.丙烯能使溴水褪色B.CH2Cl2有两种同分异构体C.戊醇与乙醇都含有羟基D.丙烯可用于合成塑料解析丙烯结构简式是CH2CHCH3,含有碳碳双键,能使溴水褪色,A正确;甲烷是正四面体结构,则CH2Cl2只有一种结构,B错误;戊醇与乙醇都属于醇类,都含有羟基,C正确;丙烯可发生加聚反应生成聚丙烯,用于合成塑料,D正确。
4.(2021广东卷,5)昆虫信息素是昆虫之间传递信号的化学物质。
人工合成信息素可用于诱捕害虫、测报虫情等。
一种信息素的分子结构简式如图所示,关于该化合物说法不正确的是()A.属于烷烃B.可发生水解反应C.可发生加聚反应D.具有一定的挥发性C、H、O三种元素,故不属于烷烃,A 项错误;分子中含有酯基,可以发生水解反应,B项正确;分子中含有碳碳双键,可以发生加聚反应,C项正确;可利用该物质诱捕害虫,故应有一定的挥发性,D项正确。
分子结构答案

分子结构——答案1.下列分子中只含键的为()。
A、HCN;B、H2O;C、CO;D、N2;E、C2H4解答或答案:B。
2.下列化合物中分子极性最大的是()A、CCl4;B、C2H5OH;C、I2;D、H2O;E、H2S解答或答案:D3.下列化合物=0的是()A、H2O;B、NH3;C、BF3;D、CH3Cl;E、HCl解答或答案:C4.在下列分子或离子中,没有孤对电子的是()。
A、H2O;B、NH3;C、H2S;D、NH4+;E、OH-5.乙醇和水之间的作用力为()。
A、色散力;B、取向力和诱导力;C、色散力和诱导力;D、取向力、诱导力和色散力;E、除D所述之外还有氢键解答或答案:E6.惰性气体在低温下能够被液化的原因在于()。
A、单原子分子有一定的体积;B、单原子分子有一定的质量;C、单原子分子间有相互作用;D、单原子分子在低温下形成氢键;E、原子是由带正电荷的核和带负电荷的电子组成的解答或答案:C7.下列说法中正确的是()。
A、p轨道之间以“肩并肩”重叠可形成键;B、p轨道之间以“头碰头”重叠可形成键;C、s轨道和p轨道“头碰头”重叠可形成键;D、s轨道和p轨道“头碰头”重叠可形成键;E、共价键是两个原子轨道“头碰头”重叠形成解答或答案:C8.甲烷(CH4)分子中,碳原子所采用的杂化方式为()。
A、sp;B、sp2;C、sp3;D、dsp2;E、spd2解答或答案:C9.下列各分子之间仅存在着色散力的是()。
A、甲醇和水;B、溴化氢和氯化氢;C、氮气和水;D、乙醇和水;E、苯和四氯化碳解答或答案:B10.下列分子中极性最小的是()。
A、NaF;B、HF;C、HCl;D、HBr;E、HI解答或答案:E11.下列分子中存在氢键的是()。
A、HF;B、CH4;C、HI;D、CCl4;E、CO2解答或答案:A12.下列化合物中,能形成分子内氢键的是()。
A、C O O HO H;B、CH3F;C、COOHHO;D、H2O;E、PH3解答或答案:A13.NH3分子中N原子采取不等性sp3杂化,分子在空间的构型为()。
高分子的结构习题与思考题

第七章高分子的结构习题与思考题1.高分子的结构有何特点高分子结构可以分为哪些结构层次各结构层次包括哪些内容它们对聚合物的性能会产生什么影响特点:①链式结构:结构单元103-105数量级②链的柔顺性:内旋转产生非常多的构象③多分散性,不均一性,长短不一。
④结构单元间的相互作用对其聚集态结构和物理性能有着十分重要的影响。
⑤凝聚态结构的复杂性:包括晶态、非晶态,球晶、串晶、单晶、伸直链晶等。
⑥可填加其它物质改性。
分为:链结构和聚集态结构。
内容:链结构分为近程结构和远程结构。
近程结构主要涉及分子链化学组成、构型、构造;远程结构主要涉及分子链的大小以及它们在空间的几何形态。
聚集态结构包括晶态、非晶态、液晶态、取向态结构及织态结构等。
影响:高分子结构中各个结构层次不是孤立的,低结构层次对搞结构层次的形成具有较大影响,近程结构决定了高分子的基本性能,而聚集态结构直接影响高分子的使用性能。
2.写出线型聚异戊二烯的各种可能构型。
顺式1,4-加成反式1,4-加成 1,2-加成全同立构 1,2-加成间同立构1,2-加成无规立构 3,4-加成全同立构 3,4-加成间同立构 3,4-加成无规立构3.名词解释(1)构型:是指分子中由化学键所固定的原子在空间的几何排列。
(2)构象:由于分子中的单键内旋转而产生的分子在空间的不同形态(3)链柔性:高分子链能够通过内旋转作用改变其构象的性能(4)内聚能密度::单位体积的内聚能,CED = ?E/Vm。
内聚能是克服分子间作用力,把1mol 液体或固体分子移至分子引力范围之外所需的能量(5)结晶形态:试样中结晶部分所占的质量分数(质量结晶度xcm)或者体积分数(体积结晶度xcv)。
(6)取向:聚合物取向是指在某种外力作用下分子链或其他结构单元沿着外力作用方向择优排列(7)液晶:一些物质的结晶结构受热熔融或被溶剂溶解后,表观上虽然变成了具有流动性的液体物质,但结构上仍然保持着晶体结构特有的一维或二维有序排列,形成一种兼有部分晶体和液体性质的过渡状态4.聚合物的构型和构象有何区别假若聚丙烯的等规度不高,能否通过改变构象的方法来提高其等规度全同立构聚丙烯有无旋光性构型是指分子中由化学键所固定的原子在空间的几何排列。
高中化学《分子结构与性质》练习题(附答案解析)

高中化学《分子结构与性质》练习题(附答案解析)学校:___________姓名:___________班级:________________一、单选题1.下列分子中不.存在π键的是()A.CH4B.C2H4C.C2H2D.C6H6ClO 分子的空间构型是()2.气态3A.直线形B.平面三角形C.四面体形D.三角锥形3.化合物X是一种新型锅炉水除氧剂,其结构式如图,下列说法中正确的是()A.X分子中只有极性键没有非极性键B.X分子中的共用电子对数为11C.1molX分子中所含的σ键数目为10N A D.X是共价化合物4.下列叙述正确的是()A.含有极性键的分子一定是极性分子B.MCO3型碳酸盐,其分解温度越高,则分解后生成的金属氧化物的晶格能越大C.共价键产生极性根本原因是成键原子的原子核吸引共用电子对能力不同D.含有共价键的晶体一定是原子晶体5.下列说法中正确的是()A.碘化氢的范德华力比溴化氢的大,碘化氢稳定性强B.甲酸甲酯和乙酸相对分子质量相同,熔点相近C.氯化钠和氯化氢熔化时,破坏的都是离子键D.干冰气化和碘升华克服的作用力相同6.能用键能大小解释的是()A.稀有气体一般很难发生化学反应B.常温常压下,氟气的密度小于氯气C.相同条件下,NH3在水中的溶解度大于PH3D.SiC晶体的熔点比晶体硅的高7.设A N 为阿伏加德罗常数的值。
下列叙述正确的是( )A .78g 苯含有碳碳双键的数目为3A NB .46g 乙醇中的极性键数目为7A NC .420.5molCuSO 5H O ⋅晶体中含有2Cu +数目小于0.5A ND .标准状况下,22.4L 丙炔含有的π键数目为A N8.2CS 是一种重要的化工原料。
工业上可以利用硫(8S )与4CH 为原料制备2CS 。
下列有关说法错误的是( )A .2CS 的熔沸点比2CO 高B .2CS 可氧化为2CO 、2SOC .8S 分子中S 原子采用2sp 杂化D .2CS 是直线形的非极性分子9.第ⅤA 族元素的原子R 与A 原子结合形成RA 3气态分子,其立体结构呈三角锥形。
无机化学第四版第七章思考题与习题答案

U最小);(2) N2的熔点最低,Si最高(Si是原子晶体,N2和NH3是分子晶体,且N2的分子间力小于NH3)。
2. 离子 电子分布式 离子电子构型
Fe3+ 1s22s22p63s23p63d5 9~17
5. 解:(1)极化力: Na+、Al3+、Si4+,变形性:Si4+、Al3、Na+;
(2)极化力:Ge2+、Sn2+、I-,变形性:I-、Sn2+、Ge2+
6. 解:SiCl4、AlCl3、MgCl2、NaCl。
7. 解:(1) 离子极化作用由强到弱:HgS>CdS>ZnS; 溶解度由小到大:HgS<CdS<ZnS.
4. 根据所学晶体结构知识,填出下表。
物 质 晶格结点上的粒子 晶格结点上粒子间的作用力 晶体类型 预测熔点(高或低)
N2 N2分子 分子间力 分子晶体 很低
SiC Si、C原子 共价键 原子晶体 很高
2. (1)NaF的熔点高于NaCl;因为r(F-)<r(Cl-),而电荷数相同,因此,晶格能:NaF>NaCl。所以NaF的熔点高于NaCl。
(2)BeO的熔点高于LiF;由于BeO中离子的电荷数是LiF中离子电荷数的2倍。晶格能:BeO>LiF。所以BeO的熔点高于LiF。
Ag+ 1s22s22p63s23p63d104s24p64d10 18
Ca2+ 1s22s22p63s23p6 8
Li+ 1s2 2
S2- 1s22s22p63s23p6 8
Pb2+ [Xe]4f145d106s2 18+2
结构化学课后习题答案

结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。
有机化学高教版课后标准答案

第一章绪论1、根据碳是四价,氢是一价,氧是二价,把下列分子式写成任何一种可能的构造式:(1)C3H8(2)C3H8O (3)C4H10答案:(1)H CHHCHHCHHH(2)H CHHCHHCHHOH(3)H CHHCHHCHHC HHH2、区别键的解离能和键能这两个概念。
答案:键的解离能:使1摩尔A-B双原子分子(气态)共价键解离为原子(气态)时所需要的能量。
键能:当A和B两个原子(气态)结合生成A-B分子(气态)时放出的能量。
在双原子分子,键的解离能就是键能。
在多原子分子中键的解离能和键能是不相同的,有区别的。
3、指出下列各化合物所含官能团的名称。
(1)CH3CH C HCH3(2)CH3CH2Cl(3)CH3CHCH3OH(4)CH3CH2C HO(5)CH3CCH3O(6)CH3CH2COOH(7)NH2(8)CH3C CCH3答案:(1)双键(2)氯素(3)羟基(4)羰基(醛基)(5)羰基(酮基)(6)羧基(7)氨基(8)三键4、根据电负性数据,用和标明下列键或分子中带部分正电荷和部分负电荷的原子。
答案:第二章烷烃1、用系统命名法命名下列化合物:(1)CH 3CHCHCH2CHCH 3CH3CH2CH3CH3(2)(C2H5)2CHCH(C2H5)CH2CHCH2CH3CH(CH3)2(3)CH3CH(CH2CH3)CH2C(CH3)2CH(CH2CH3)CH3(4)(5)(6)答案:(1)2,5-二甲基-3-乙基己烷(2)2-甲基-3,5,6-三乙基辛烷(3)3,4,4,6-四甲基辛烷(4)2,2,4-三甲基戊烷(5)3,3,6,7-四甲基癸烷(6)4-甲基-3,3-二乙基-5-异丙基辛烷2.写出下列化合物的构造式和键线式,并用系统命名法命名之。
(1) C5H12仅含有伯氢,没有仲氢和叔氢的(2) C5H12仅含有一个叔氢的(3) C5H12仅含有伯氢和仲氢答案:键线式构造式系统命名(1)(2)(3)3.写出下列化合物的构造简式:(1) 2,2,3,3-四甲基戊烷(2) 由一个丁基和一个异丙基组成的烷烃:(3) 含一个侧链和分子量为86的烷烃:(4) 分子量为100,同时含有伯,叔,季碳原子的烷烃(5) 3-ethyl-2-methylpentane(6) 2,2,5-trimethyl-4-propylheptane(7) 2,2,4,4-tetramethylhexane(8) 4-tert-butyl-5-methylnonane答案:(1) 2,2,3,3-四甲基戊烷简式:CH3CH2(CH3)2(CH3)3(2) 由一个丁基和一个异丙基组成的烷烃:(3) 含一个侧链和分子量为86的烷烃:因为CnH2n+2=86 所以 n=6该烷烃为 C6H14,含一个支链甲烷的异构体为:(4) 分子量为100,同时含有伯,叔,季碳原子的烷烃(5) 3-ethyl-2-methylpentaneCH3CH(CH3)CH(C2H5)(6) 2,2,5-trimethyl-4-propylheptaneCH3C(CH3)2CH2CH(CH2CH2CH3)CH(CH3)CH2CH3(7) 2,2,4,4-tetramethylhexane(CH3)3CCH2C(CH3)2CH2CH3(8) 4-tert-butyl-5-methylnonaneCH3CH2CH2CH(C(CH3)3)CH(CH3)CH2CH2CH2CH34.试指出下列各组化合物是否相同?为什么?(1)(2)答案:(1)两者相同,从四面体概念出发,只有一种构型,是一种构型两种不同的投影式(2)两者相同,均为己烷的锯架式,若把其中一个翻转过来,使可重叠.5.用轨道杂化理论阐述丙烷分子中C-C和C-H键的形成.答案:解:丙烷分子中C-C键是两个C原子以SP3杂化轨道沿键轴方向接近到最大重叠所形成的δ化学键,丙烷分子中C-H键是C原子的SP3杂化轨道与氢原子的S 轨道形成的δ化学键.6.(1)把下列三个透视式,写成楔形透视式和纽曼投影式,它们是不是不同的构象呢?(2)把下列两个楔形式,写成锯架透视式和纽曼投影式,它们是不是同一构象?(3)把下列两个纽曼投影式,写成锯架透视式和楔形透视式,它们是不是同一构象?FH H HF F FFH HF H答案:(1)为同一构象。
高中化学练习题 化学键与分子结构 附答案解析

化学键与分子结构【学习目标】1、了解物质中存在的作用及强弱判断;2、学会用价键理论预测和判断分子的空间构型;3、掌握配合物的结构和组成判断;4、理解分子性质的预测和判断方法。
【知识网络】【要点梳理】要点一、共价键与分子间作用力的本质及对物质性质的影响1、共价键的类型和成键方式【注意】①s—sσ键没有方向性。
②通常情况下σ键比π键稳定,但N2分子中π键比σ键稳定。
2、共价键与分子间作用力的比较【注意】①氢键不是化学键(原因:氢键是分子间一种较弱的作用力)。
②共价键影响结构特殊的物质(如原子晶体,后面将学到)的物理性质。
③化学键和分子间作用力都是电性作用。
要点二、分子空间构型的判断杂化轨道理论、价层电子对互斥理论预测分子的空间构型【注意】当中心原子上没有孤电子对时,杂化轨道理论和价层电子对互斥理论对分子空间构型的预测结论一致。
要点三、分子的性质1、分子类型与分子极性、空间构型、共价键类型的关系分子类型空间构型键角键的极性分子极性常见物质A ——————非极性分子He、Ne、Ar等A2——非极性键非极性分子H2、O2、N2等AB ——极性键极性分子HX、CO、NO等AB2180°极性键非极性分子CO2、BeCl2等A2B <180°极性键极性分子H2O、H2S等AB3120°极性键非极性分子BF3、SO3等AB3<120°极性键极性分子NH3、PCl4等AB4109°28′极性键非极性分子CH4、CCl4等【注意】①由成键原子的类型判断键的极性,由分子空间构型的对称性判断分子的极性。
②极性分子中一定有键,可能有键(H2O2);非极性分子中不一定有(CH4);只含非极性键的分子一定是分子。
③“相似相溶规律”:具有相同极性或结构相似的溶质和溶剂,溶质在溶剂中的溶解性。
2、手性碳原子、手性异构体与手性分子①手性碳原子:连接四个不同原子或基团的碳原子,称为手性碳原子,常用*C表示。
新人教版化学第二册第七章课后习题

1第七章 第一节认识有机化合物1、在有机化合物中,碳原子既可以与其他元素的原子形成共价键,也可以相互成键。
两个碳原子之间 可以形成的共价键的类型有 、 和 ;多个碳原子可以相互结合,形成的碳 骨架的类型有 和 。
2、在甲烷分子中,碳原子以最外层的—个电子分别与氢原子形成—个 键。
甲烷分子中的5个原子不在同一平面上,而是形成了 的立体结构:碳原子位于 ,氢原子位于 ;分子中的4个C —H 的长度和强度 ,相互之间的夹角 。
3、下列气体的主要成分不是甲烷的是( )。
A.沼气 B.天然气 C .煤气 D.煤层气4、烷炷分子中的碳原子与其他原子的结合方式是( )。
A,形成4对共用电子对 B .通过非极性键 C.通过两个共价键 D .通过离子键和共价键 5、正丁烷与异丁烷互为同分异构体的依据是( )。
A.具有相似的化学性质B.相对分子质量相同,但分子的空间结构不同C.具有相似的物理性质 D .分子式相同,但分子内碳原子的连接方式不同 6、在一定条件下,下列物质可与甲烷发生化学反应的是( )。
A. Cl 2 B.浓硫酸 C . O 2D.酸性KMnO 4溶液7、戊烷有三种同分异构体,分别是正戊烷、异戊烷和新戊烷。
请参考图7-7,写出它们的结构简式。
8、某种烷雑完全燃烧后生成了 17.6gCO 2和9.0gH 2O 。
请据此推测其分子式,并写出可能的结构简式。
9、天然气和煤气是常见的气体燃料,被人们广泛应用于工业生产和日常生活中。
(1 )査阅资料,了解煤气的主要成分和生产方法。
(2)写出天然气、煤气的主要成分在完全燃烧时发生反应的化学方程式。
(3)根据以上反应,在相同条件下燃烧等体积的天然气和煤气,消耗氧气体积较大的是哪一种?(4)某灶具原来使用的燃料是煤气,如果改用天然气,其进风口应改大还是改小?如不进行调节, 可能产生什么后果?10、甲烷是最简单的有机化合物,很早就被人类发现。
然而化学家为搞清楚甲烷的结构却用了上百年的时间,期间曾相继提出下列图示来表示甲烷的结构:请分析以上图示所蕴含的化学信息,与同学交流讨论,并对其进行评价,从中体验人类对物质结构认识不断深化的探索历程。
化工原理课后思考题答案完整版

第一章流体流动问题1.什么是连续性假定?质点的含义是什么?有什么条件?答1.假定流体是由大量质点组成的、彼此间没有间隙、完全充满所占空间的连续介质。
质点是含有大量分子的流体微团,其尺寸远小于设备尺寸,但比起分子自由程却要大得多。
问题2.描述流体运动的拉格朗日法和欧拉法有什么不同点?答2.前者描述同一质点在不同时刻的状态;后者描述空间任意定点的状态。
问题3.粘性的物理本质是什么?为什么温度上升,气体粘度上升,而液体粘度下降?答3.分子间的引力和分子的热运动。
通常气体的粘度随温度上升而增大,因为气体分子间距离较大,以分子的热运动为主;温度上升,热运动加剧,粘度上升。
液体的粘度随温度增加而减小,因为液体分子间距离较小,以分子间的引力为主,温度上升,分子间的引力下降,粘度下降。
问题4.静压强有什么特性?答4.静压强的特性:①静止流体中任意界面上只受到大小相等、方向相反、垂直于作用面的压力;②作用于任意点所有不同方位的静压强在数值上相等;③压强各向传递。
问题5.图示一玻璃容器内装有水,容器底面积为8×10-3m 2,水和容器总重10N。
(1)试画出容器内部受力示意图(用箭头的长短和方向表示受力大小和方向);(2)试估计容器底部内侧、外侧所受的压力分别为多少?哪一侧的压力大?为什么?题5附图题6附图答5.1)图略,受力箭头垂直于壁面、上小下大。
2)内部压强p=ρgh=1000×9.81×0.5=4.91kPa;外部压强p=F/A=10/0.008=1.25kPa<内部压强4.91kPa。
因为容器内壁给了流体向下的力,使内部压强大于外部压强。
问题6.图示两密闭容器内盛有同种液体,各接一U 形压差计,读数分别为R 1、R 2,两压差计间用一橡皮管相连接,现将容器A 连同U 形压差计一起向下移动一段距离,试问读数R 1与R 2有何变化?(说明理由)答6.容器A 的液体势能下降,使它与容器B 的液体势能差减小,从而R 2减小。
无机化学第四版第七章思考题与习题答案

第七章固体的结构与性质思考题1.常用的硫粉是硫的微晶,熔点为℃,溶于CS2,CCl4等溶剂中,试判断它属于哪一类晶体分子晶体2.已知下列两类晶体的熔点:(1) 物质NaF NaCl NaBr NaI!熔点/℃993801747661SiI4(2)物质SiF4SiCl4、SiBr4熔点/℃-70为什么钠的卤化物的熔点比相应硅的卤化物的熔点高而且熔点递变趋势相反因为钠的卤化物为离子晶体,硅的卤化物为分子晶体,所以钠的卤化物的熔点比相应硅的卤化物的熔点高,离子晶体的熔点主要取决于晶格能,NaF、NaCl、NaBr、NaI随着阴离子半径的逐渐增大,晶格能减小,所以熔点降低。
分子晶体的熔点主要取决于分子间力,随着SiF4、SiCl4、SiBr4、SiI4相对分子质量的增大,分子间力逐渐增大,所以熔点逐渐升高。
3.当气态离子Ca2+,Sr2+,F-分别形成CaF2,SrF2晶体时,何者放出的能量多为什么形成CaF2晶体时放出的能量多。
因为离子半径r(Ca2+)<r(Sr2+),形成的晶体CaF2的核间距离较小,相对较稳定的缘故。
—4. 解释下列问题:(1)NaF的熔点高于NaCl;因为r(F-)<r(Cl-),而电荷数相同,因此,晶格能:NaF>NaCl。
所以NaF的熔点高于NaCl。
(2)BeO的熔点高于LiF;由于BeO中离子的电荷数是LiF中离子电荷数的2倍。
晶格能:BeO>LiF。
所以BeO的熔点高于LiF。
(3)SiO2的熔点高于CO2;SiO2为原子晶体,而CO2为分子晶体。
所以SiO2的熔点高于CO2。
(4)冰的熔点高于干冰(固态CO2);它们都属于分子晶体,但是冰分子中具有氢键。
所以冰的熔点高于干冰。
(5)石墨软而导电,而金刚石坚硬且不导电。
石墨具有层状结构,每个碳原子采用SP2杂化,层与层之间作用力较弱,同层碳原子之间存在大π键,大π键中的电子可以沿着层面运动。
所以石墨软而导电。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章化学键与分子结构同步练习、思考题与习题答案
同步练习
p220:1.(A)2.(D)
p227:1.(B)2.(C)
p235:1.(D)2.(D)3.(C)
p241:1.(C)
2.平面三角形、三角锥形、四面体形、平面三角形;sp2、sp3、sp3、sp2
3.(D)
p249:1.(B)2.(A)3.(C),(A)与(D)4.(C),(F)
p256:1.(B)2.(C)
3.SbH3> AsH3> PH3,高,取向力、诱导力、色散力,氢键作用力
思考题
1.(1)B (2)C (3)D (4)C 、E (5)C、D (6)B (7)A、D (8)A 2.(1)×(2)×(3)√(4)×(5)×(6)×
3.略
4.(1)
(2)
大多数分子中以色散力为主。
(3)
(4)水分子间易形成氢键,导致分子间作用力加强,因此水蒸气易液化。
而氮气分子间以及氢气分子间都只有色散力,且分子量较小,因此分子间作用力相对较弱,故通常条件下不易液化。
(5)CF4、CCl4、CBr4和CI4四化合物均为非极性分子,分子间只存在色散力,随分子量增大,分子间作用力逐渐加强,因此状态由气态到液态再到固态,同时熔点也依次升高。
习题
1.Be2+:2电子构型
Fe2+、Cu2+:9~17电子构型
Ag+、Zn2+、Sn4+:18电子构型
Pb2+:18+2电子构型
S2--、Br–:8电子构型
2.
3.非极性分子:CH4、BCl3、CS2;极性分子:CHCl3、NCl3、H2S
4.(1)色散力(2)取向力、诱导力、色散力、氢键
(3)诱导力、色散力(4)取向力、诱导力、色散力
5.
6.
7.不等性sp 3,角形,H 2O 偶极矩大,△x 大。
8.O 2分子轨道电子排布式为: O 2 :(
1s )2(
*1s
)2(2s )2
(
*2s
)2(2p x )2
(
2p y )2(
2p z )2(
*2p y
)1(*2p z
)1 O 2+、O 2-、O 22-分子轨道电子排布式分别为: O 2+ :(1s )2
(*1s )2(2s )2
(*2s )2(2p x )2
(2p y )2(2p z )2(
*2p y
)1 O 2- :(1s )2(*1s
)2(2s )2(
*2s
)2(2p x )2(
2p y )2(
2p z )2(π*2p y )2(π*2p z )1
O 22-:(
1s )2(
*1s )2(σ2s )2(σ*2s )2(σ2p x )2(2p y )2
(2p z )2(π*2p y )2(π*2p z )2
O 2+、O 2、O 2-、O 22-单电子数分别为1、2、1和0,分别具有顺磁、顺磁、顺磁和反磁性。
O 2+、O 2、O 2-、O 22-键级分别为: O 2+:(8-3)/2 = 2.5, O 2:(8-4)/2 = 2 O 2:(8-5)/2 = 1.5, O 22:(8-6)/2 = 1 ∴O 2+、O 2、O 2-、O 22-键的强度依次下降。
9.(1)分子轨道表示式分别为:
2Li :(
1s )2
(
*1s
)2(2s )2
2Be :(1s )2(*1s )2(2s )2
(*2s
)2 2B :(1s )2
(*1s )2(2s )2
(*2s )2(2p y )1
(2p z )1
2F :(
1s )2(*1s )2(2s )2
(*2s )2(2p x )2
(2p y )2(2p z )2(π*2p y )2(π*2p z )2
2Ne :(
1s )2(*1s )2(2s )2
(*2s )2(2p x )2
(2p y )2(2p z )2(π*2p y )2(π*2p z )2(*2px
)2 (2)Li 2、Be 2、B 2、F 2、Ne 2键级分别为:1,0,1,1,0 ∴2Be 、2Ne 都不稳定,不存在。
(3)顺磁:B 2
分子 VP BP LP VP 排布 杂化类型 分子构型 PCl 3 4 3 1 正四面体 不等性sp 3 三角锥 SO 2 3 2 1 平面三角形 不等性sp 2 V 形 NO 2+ 2 2 0 直线形 sp 直线形 SCl 2 4 2 2 正四面体 不等性sp 3 V 型 SnCl 2 3 2 1 平面三角形 不等性sp 2 V 型 BrF 2+
4
2
2
正四面体
不等性sp 3
V 型
反磁:Li 2、F 2
10.(1)5B (2)B 2:(1s )2
(
*1s )2(
2s )2(
*2s )2 (
2p y )1(
2p z )1
11.略
12.可以形成分子间氢键的有:NH 3、CH 3COOH 、C 2H 5OH
可以形成分子内氢键的有:HNO 3 13.(1)均为非极性分子,只存在色散力
(2)H 2O 为极性分子,N 2为非极性分子,因此存在诱导力与色散力。
(3)CH 3Cl 为极性分子,因此分子间存在取向力、诱导力和色散力。
(4)H 2O 与NH 3均为极性分子,因此存在取向力、诱导力、色散力,同时还存在氢键。
14.
由hess 定律:U E D S I S H 1-++++=∆1/22/12m
f
)9.631(5.3101512/14.622/19.4180.90---⨯+⨯++= )mol ·kJ (9371-=
–U
K +(g) + I -(g)
K(g) I(g) E
I
D S 2
1212+ S 1
KI(s)
m
f H ∆K(s) + (s)I 2
1
2。
