化合价知识点
初中化学之化合价知识点
初中化学之化合价知识点
化合价
含义:由于形成化合物的元素有固定的原子个数比,所以化学上就用“化合价”来表示原子之间相互化合的数目
化合价的表示方法
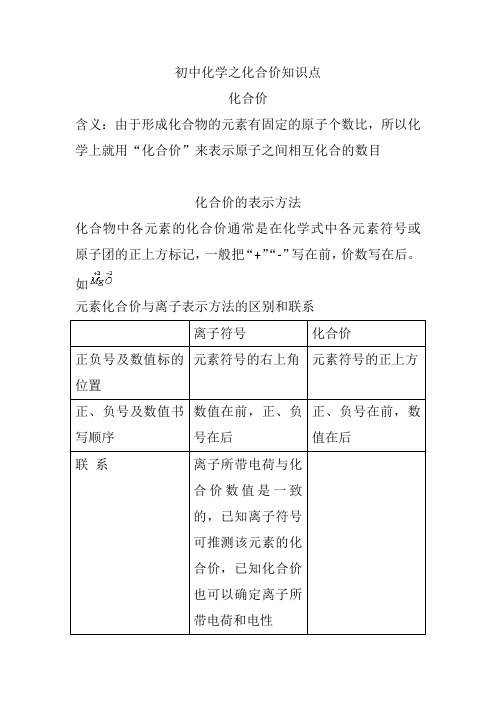
化合物中各元素的化合价通常是在化学式中各元素符号或原子团的正上方标记,一般把“+”“-”写在前,价数写在后。
如
元素化合价与离子表示方法的区别和联系
化合价的一般规律
①单质中,元素的化合价为0,在化合物中,正、负化合价代数和为0
②在化合物中,氢元素的化合价通常为+1价,氧元素的化合价通常显示-2价
③金属元素在化合物里显正价,非金属元素在和金属元素化合时,通常显负价
④一些元素在不同物质中可显不同的化合价,如Fe有+2、+3价,S有-2、+4、-6价
备注:这里介绍两种化合价口诀供给同学们记忆:
口诀1:
一价钾钠氯氢银;
二价氧钙钡镁锌;
三铝四硅五价磷;
二三铁,二四碳;
二四六硫都齐全;
铜汞二价最常见;
莫忘单质为零价。
口诀2:
钾钠银氢正一价,钙镁钡锌正二价;氟氯溴碘负一价,通常氧是负二价;铜正一二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正。
【必背离子】。
初中化学化合价知识点

初中化学化合价知识点第一篇范文:化学式与化合价知识点与练习化学式与化合价知识点1:化合价1.化合价:化合价表示原子之间相互化合的数目2.化合价的表示方法+1-2+2+3HOZnAl3.注意事项(1)化合价有正价和负价之分①氧元素通常显-2价②氢元素通常显+1价。
③金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价④一些元素在不同物质中可显不同的化合价(2)化合物里正负化合价的代数和为0(3)单质分子里,元素的化合价为0【注意】要注意化合价的表示方法与离子符号的区别:头顶价,肩挑离如:试区别Ca与Ca,S与S2-中数字的含义。
;S表示硫元素显-2价。
Ca表示钙元素显+2价(或钙元素的化合价为+2价)Ca2+表示一个钙离子带2个单位的正电荷;S2-表示1个硫离子带2个单位的负电荷。
222+4.牢记常见元素及原子团的化合价:(1)常见元素的化合价(2【归纳】化合价记忆韵语一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁,二四碳二四六硫都齐全铜汞二价最常见条件不同价不同单质为零永不变一些常见原子团的化合价负一硝酸氢氧根负二硫酸碳酸根负三记住磷酸根正一价的是铵根5.化合价的应用(1)根据化合价,写出化合物的化学式。
十字交叉法:写符号PO标化合价化合价绝对值交叉放置元素符号右下角约简检查原子团作为一个整体,当个数不为1时要用括号括起来练习1:写出下列物质的化学式。
氧化钾K2O氯化钾KCl氢氧化钾KOH硫酸钾K2SO4硫酸钙CaSO4硫酸铁FeSO4氢氧化钙Ca(OH)2氢氧化铁Fe(OH)3氯化钙CaCl2氯化亚铁FeCl2氧化钙CaO氧化铁Fe2O3氧化钠Na2O 氧化铝Al2O3氧化镁MgO氧化铜CuO氧化汞HgO氯化钠NaCl氯化钙CaCl2氯化铜CuCl2氯化镁MgCl2氯化铝AlCl3氯化锌ZnCl2氯化铁FeCl3氢氧化钠NaOH氢氧化镁Mg(OH)(OH)(OH)2氢氧化铝Al3氢氧化钙Ca2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2碳酸钠Na2CO3碳酸钾K2CO3碳酸钙CaCO3碳酸镁MgCO3硫酸钠Na2SO4硫酸铁Fe2(SO4)3硫酸铝Al2(SO4)3硝酸银AgNO3注意:某化某:指该物质中含两种元素某酸某:指该物质中含“某酸根”原子团氢氧化某:指该物质中含“氢氧根”原子团某酸亚某:指该物质中正价元素有两种化合价,且取该元素较低的化合价。
高中化学知识点归纳

高中化学知识点归纳1、化合价(常见元素的化合价):碱金属元素:Ag、H:+1 F:—1Ca、Mg、Ba、Zn:+2 Cl:—1,+1,+5,+7Cu:+1,+2 Fe:+2,+3 O:—2 S:—2,+4,+6Al:+3 Mn:+2,+4,+6,+7 P:—3,+3,+5 N:—3,+2,+4,+52、氧化还原反应定义:有电子转移(或者化合价升降)的反应本质:电子转移(包括电子的得失和偏移) 特征:化合价的升降氧化剂(具有氧化性)——得电子——化合价下降——被还原——还原产物还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物口诀:升——失——(被)氧化——还原剂降——得——(被)还原——氧化剂四种基本反应类型和氧化还原反应关系:3、金属活动性顺序表K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au还原性逐渐减弱4、离子反应定义:有离子参加的反应电解质:在水溶液中或熔融状态下能导电的化合物非电解质:在水溶液中和熔融状态下都不能导电的化合物离子方程式的书写:第一步:写:写出化学方程式第二步:拆:易溶于水、易电离的物质拆成离子形式;难溶(如CaCO3、BaCO3、BaSO4、AgCl、AgBr、AgI、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H2CO3、H2S、CH3COOH、HClO、H2SO3、NH3·H2O、H2O等),气体(CO2、SO2、NH3、Cl2、O2、H2等),氧化物(Na2O、MgO、Al2O3等)不拆第三步:删:删去前后都有的离子第四步:查:检查前后原子个数,电荷是否守恒离子共存问题判断:①是否产生沉淀(如:Ba2+和SO42-,Fe2+和OH-);②是否生成弱电解质(如:NH4+和OH-,H+和CH3COO-)③是否生成气体(如:H+和CO32-,H+和SO32-)④是否发生氧化还原反应(如:H+、NO3-和Fe2+/I-,Fe3+和I-)5、放热反应和吸热反应化学反应一定伴随着能量变化。
元素化合价知识点总结归纳

元素化合价知识点总结归纳元素化合价知识点总结归纳一、元素化合价的概念元素化合价,也称为元素的化合力,是指一个元素在化合物中与其他元素结合的能力或倾向。
元素的化合价可以通过化学方程式中原子或离子的个数来表示。
二、元素化合价的规律1. 金属元素的化合价大多数金属元素的化合价是固定的。
例如,钠的化合价为1,铁的化合价为2或3,铜的化合价为1或2等。
但是也有部分金属元素的化合价是可变的,例如铁在氯化铁中可以是2价或3价。
2. 非金属元素的化合价非金属元素的化合价常常不是固定的,而是存在多个可能的值。
例如,氯的化合价可以是1、3、5或7,氧的化合价可以是1或2,氮的化合价可以是1、2、3、4或5等。
3. 元素化合价的趋势元素的化合价通常有一定的规律和趋势。
一般来说,元素的化合价趋向于和其电子结构有关。
通过观察元素的周期表位置可以发现,从左到右在同一周期中,元素的化合价通常递增;而从上到下在同一族中,元素的化合价通常递减。
三、元素化合价的确定方法确定一个元素的化合价主要通过以下几种方法:1. 元素的电子结构:根据元素的电子排布来推断其可能的化合价。
例如,氧的电子结构为1s²2s²2p⁴,根据其外层的6个电子,可以推断氧的化合价为2。
2. 元素的氧化数:氧化数是指元素在化合物或离子中的相对电荷。
通过氧化数的变化,可以推断元素的化合价。
例如,在NaCl(氯化钠)中,钠的氧化数为+1,氯的氧化数为-1,因此可以推断钠的化合价为+1。
3. 元素的化学性质:通过元素的化学性质来推断其可能的化合价。
例如,氟是最活泼的非金属元素,通常具有-1的化合价,而碱金属元素通常具有+1的化合价。
四、元素化合价的应用元素化合价的知识在化学中具有重要的应用价值。
它可以帮助我们理解和推断化学反应的发生方式和机理。
1. 化学方程的平衡在平衡化学方程式中,元素的化合价可以帮助我们平衡方程式的系数。
通过确定化合价,我们可以确定元素在化学反应中的参与及其相对数量,从而平衡方程式中原子和离子的个数。
初中化合价口诀

初中化合价口诀初中体系的化学课程中,学习最重要的知识点之一便是化合价口诀。
化合价口诀是根据元素的原子序数和电荷来记忆元素两两之间的化合价,是理解元素组成物质的构成及其化学性质的关键。
下面就来看看初中化合价口诀有哪些:一、倍价族:两个极性相同,化合价口诀记忆方法:“元素序数加一,倍价族化合价”例如,氯元素的原子序数为17,化合价为17+1=18;铁元素的原子序数为26,化合价为26+1=27。
二、双价族:有一个极性正负,化合价口诀记忆方法:“元素序数减去一,双价族化合价”例如,碘元素的原子序数为53,化合价为53-1=52;氢元素的原子序数为1,化合价为1-1=0。
三、特殊情况:(1)氧族:氧元素的原子序数为8,它的化合价口诀为:“八缺二,氧族化合价”,化合价是6。
(2)氟族:氟元素的原子序数为9,它的化合价口诀为:“九缺一,氟族化合价”,化合价是7。
由此可见,初中化合价口诀的学习至关重要,学生应该认真学习,通过不断掌握,逐渐掌握其知识点与规律,从而能够在化学课堂上见效。
首先,学生需要有良好的口头默写练习,将化合价口诀背诵得胸有成竹。
例如,常用口头练习:氯元素17,倍价族,加一得十八;碘元素53,双价族,减一得五十二。
此外,掌握理论的同时还可以做一些练习题来练习自己的知识,如从原子序数计算出化合价等。
其次,学生还需要掌握化合价如何运用于实践中。
例如,学生可以通过学习化合反应,掌握各类化合反应的机理,从而熟悉阴阳电荷的质量耦合。
此外,学习两个元素之间的双重结合也是非常重要的,两个元素之间可以通过静电力相互结合,可以借助化合价知识来计算出双重结合的密度和电荷分布情况。
最后,学生还可以探究化学的最新发展,学习其中的新知识,包括各类元素的电子结构、结合能量、等价量等。
通过不断探索、实践,可以深入了解元素的基本性质,从而来帮助学生更好地理解化学知识。
综上所述,学习化合价口诀不仅是理解化学原理的基础,也是独立思考的基础,学生应该细心学习,努力掌握化合价背后的规律,从而更好地掌握化学知识。
初中化学化合价知识点归纳通用4篇

初中化学化合价知识点归纳通用4篇初中化学化合价知识点归纳 1化合价口诀:+1价钾钠银铵氢,+2价钡钙镁铜汞锌二三铁、二四碳,三铝四硅五价磷,氟、氯、溴、碘-1价氧硫-2要记清。
氢氧根、硝酸根(OH、NO3 )-1价,硫酸根、碳酸根(SO4 、CO3 )-2价,化合物各元素化合价代数和为零,单质元素化合价是零。
注:铵是NH4原子团;+2价的铁叫“亚铁”;+1价的铜叫“亚铜”无氧时S为-2价,跟氧结合时+4或+6价。
SO32-原子团叫“亚硫酸根”无氧时Cl为-1价,跟氧结合时+1、+3、+5或+7价上面对化合价口诀知识点的总结内容,相信同学们已经能很好的掌握了,希望同学们考试成功。
化学会考知识点总结:实验室制取气体的思路同学们对实验室制取气体的思路知识还熟悉吧,下面我们一起来学习哦。
初中化学化合价知识点归纳 21、化学方程式左写反应物,右边写生成;写对化学式,系数来配平; 中间连等号,条件要注清;生成沉淀气,箭头来标明。
一找元素见面多,二将奇数变成偶;三按连锁先配平,四用观察配其它;有氢找氢无氢找氧,奇数配偶变单成双;出现分数去掉分母,调整系数使支配平。
2、离子方程式客观事实要遵从,书写形式分异同;生成符号要写对,质量电荷要守恒。
3、干燥气体酸干酸,碱干碱,氧化不能干还原,中性干燥剂,使用较普遍,只有不反应,干燥就能成。
4、空气组成空气组成别忘记,主要成分氮氧气;氮七八氧二一,零点九四是稀气;还有两个零点三,二氧化碳和杂气;体积分数要记清,莫要当成质量比;还要注意防污染,环保意识要树立。
5、碳硫磷铁在氧气中燃烧的现象红热木炭剧烈燃烧,发出白光温度很高;燃硫入氧燃烧变旺,火焰紫色美丽漂亮,生成气体气味够“呛”;燃磷入氧现象难忘,浓厚白烟冷却粉状;铁丝燃烧火星四射,生成熔物固态黑色。
6、氧中燃烧的特点氧中余烬能复烯,磷燃白色烟子漫,铁烯火星四放射,硫蓝紫光真灿烂。
7、氯中燃烧的特点磷燃氯中烟雾茫,铜燃有烟呈棕黄,氢燃火焰苍白色,钠燃剧烈产白霜。
化合价知识点

一、化合价
1.定义:一种元素一定数目的原子跟其它元素一定数目的原子化合的性质,叫这种元素的化合价.有正价、负价之分,用+1,+2,-1,-2……表示,标在元素符号的正上方,如:
Na
2.确定
①在离子化合物中,化合价的数值就是一个原子得失电子的数目,失电子的原子为正价,得电子的原子为负价.
②在共价化合物中,化合价的数值就是一个原子跟其它元素的原子形成共用电子对的数目,电子对偏离的原子为正价,电子对偏向的原子为负价.
3.元素化合价的规律
①化合价原则:在化合物里,元素正负化合价的代数和为零.
②单质中元素化合价为零.
③化合物里,氢元素通常显+1价,氧元素通常显-2价,金属元素通常显正价,非金属元素跟金属元素或氢元素化合时通常显负价.
④许多元素具有可变化合价,例:、、、、.
⑤原子团的化合价由构成元素原子的正负化合价的代数和算出根的化合价一定不为零.例如:
OH
⑥熟记常见元素和原子团的化合价
二、化合价规律的应用
1.根据化合价原则,书写化合物的化学式
书写口诀:正在前,负在后;标价数,化简价交叉,检验为零.
2.根据化合价原则,计算未知元素的化合价.。
化合价-高考化学知识点

化合价-高考化学知识点
化合价一、化合价的特点⑴有正负之分(得电子为负,失电子为正);⑵化和价数值等于一个原子得失电子数目或共用电子对数;⑶单质为零价⑷通常情况下,金属元素只有正价;⑸一种元素可以前世不同的化合价[变价];二、化合价的计算
1.根据物质的结构确定元素的化合价2.根据元素在周期表中的位置确定元素的化合价3.根据元素的非金属性确定元素的化合价4.根据物质的性质确定元素的化合价5.根据化学反应确定元素的化合价6.根据离子反应前后电荷守恒确定元素的化合价7.根据氧化还原反应电子得失总数相等确定元素的化合价8.根据化合物的式量确定元素的化合价
三、化合价口诀
一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;铜汞二价最常见。
化合价知识点归纳

化合价知识点归纳一、化合价的定义。
1. 化合价是元素在形成化合物时表现出的一种性质,它反映了原子之间相互化合的数目关系。
例如,在水(H₂O)中,氢原子与氧原子化合的数目比为2:1,我们就说氢的化合价为+1价,氧的化合价为 - 2价。
二、化合价的表示方法。
1. 在元素符号的正上方用“+n”或“-n”来表示元素的化合价,其中n为整数。
例如,镁元素的化合价为+2价,表示为{+2}{Mg};氯元素的化合价为 - 1价,表示为{-1}{Cl}。
三、常见元素的化合价。
1. 金属元素。
- 钾(K)、钠(Na)、银(Ag)通常显+1价。
- 镁(Mg)、钙(Ca)、钡(Ba)、锌(Zn)通常显+2价。
- 铝(Al)通常显+3价。
- 铜(Cu)有+1价(亚铜离子,如Cu₂O中的铜)和+2价(铜离子,如CuO中的铜)。
- 铁(Fe)有+2价(亚铁离子,如FeCl₂中的铁)和+3价(铁离子,如FeCl₃中的铁)。
2. 非金属元素。
- 氢(H)通常显+1价,但在与金属形成的氢化物(如NaH)中显 - 1价。
- 氧(O)通常显 - 2价,但在过氧化物(如H₂O₂)中氧元素显 - 1价。
- 氮(N)有 - 3价(如NH₃)、+2价(如NO)、+4价(如NO₂)、+5价(如HNO₃)等。
- 碳(C)有 - 4价(如CH₄)、+2价(如CO)、+4价(如CO₂)等。
- 氯(Cl)有 - 1价(如HCl)、+1价(如HClO)、+3价(如HClO₂)、+5价(如HClO₃)、+7价(如HClO₄)等。
四、化合价的规律。
1. 在化合物中,各元素正负化合价的代数和为零。
例如,在CaCl₂中,钙元素显+2价,氯元素显 - 1价,(+2)+2×( - 1)=0。
2. 单质中元素的化合价为零。
因为单质是由同种元素组成的纯净物,原子间没有电子的得失或偏移,如氧气(O₂)中氧元素的化合价为0,铁(Fe)中铁元素的化合价为0。
3. 一般情况下,金属元素显正价,非金属元素显负价,但在非金属氧化物中,氧元素显负价,另一种非金属元素显正价,如在CO₂中,碳元素显+4价,氧元素显 - 2价。
九年级化学化合价价知识点

九年级化学化合价价知识点化学是一门研究物质的性质、组成、结构、转化以及反应规律的科学。
在九年级的化学学习中,一个重要的知识点就是化合价。
化合价是化学元素在化合物中的价值表示。
它是我们理解化学反应、预测生成物以及计算反应物质的量的基础。
化合价的概念最早由法国化学家勒鲁瓦提出,用于表示元素的结合能力。
在化合物中,元素主要通过与其他元素共享或转移电子来与其他元素产生结合。
化合价通过帮助我们了解化合物中元素如何进行化学反应,以及元素与元素之间的相互作用。
化合价的表示方法有两种:原子价和化合价。
原子价是指元素中一个原子在单质状态下的氧化态(正或负)数值。
原子价是参照元素在单质状态下与氧元素结合的原子序数来确定的。
而化合价则是指一个元素在与其他元素形成化合物时所具有的价值。
化合价可以是正的、负的或零。
正的化合价表示一个元素在化合物中失去了电子,负的化合价表示一个元素在化合物中获得了电子,而零的化合价表示一个元素在化合物中既没有失去电子也没有获得电子。
化合价有助于我们预测元素与元素之间的反应性。
根据化合价,我们可以预测元素是否会形成离子或共价键。
元素具有相同化合价的趋势,会在反应中更容易相互结合。
通过了解化合价,我们可以预测元素之间的化学反应以及产生的化合物是离子型还是共价型。
除了预测化学反应的能力外,了解化合价还有助于我们计算反应物质的量。
化合价告诉我们在化合物中元素的相对含量,因此我们可以根据化合价来研究反应中物质的量的变化。
这对于斯托伯黎量、计算反应热以及预测反应出现的副反应等方面都很重要。
然而,要理解化合价并不总是一件容易的事情。
化合价的确定是受到其他因素的影响的,如电负性、原子半径、电子云分布以及电子云的共振等。
不同元素在不同化合物中的化合价可能是不同的,即使它们具有相似的原子价。
因此,需要通过不断学习和实践来理解和应用化合价。
化合价的概念是九年级化学学习的基础,也是后续学习的基石。
深入理解化合价的原理和应用,能够帮助我们更好地解释化学反应和物质的性质。
初中必背化学价口诀

初中必背化学价口诀初中化学里,化合价可是个重要的知识点。
要想把化学学好,化合价得记得牢牢的。
那今儿咱就来说说初中必背的化合价口诀。
“一价氢氯钾钠银,二价氧钙钡镁锌,三铝四硅五价磷,二三铁,二四碳,二四六硫都齐全,铜汞二价最常见。
”这口诀是不是挺顺口的?我还记得我当年上初中的时候,我们班有个同学叫小李,化学课上总是迷迷糊糊的。
有一次老师提问化合价,问到他“铁的常见化合价是多少呀?”他一脸懵,支支吾吾半天说不出来。
老师又问“那铜的常见化合价呢?”他还是一脸茫然。
从那以后,小李痛下决心,一定要把化合价口诀背得滚瓜烂熟。
每天早上他都早早到学校,拿着小本子,嘴里念念有词“一价氢氯钾钠银……”。
功夫不负有心人,没几天,再提问他的时候,他都能对答如流啦。
咱们再来说说这口诀怎么用。
比如说,要写氧化铁的化学式,铁是三价,氧是二价,那根据化合价交叉写在右下角的原则,氧化铁的化学式就是Fe₂O₃。
再比如,写氯化镁的化学式,镁是二价,氯是一价,那就是 MgCl₂。
是不是还挺简单的?化合价这东西,在化学里用处可大了。
像判断化学反应能不能发生,配平化学方程式,都得靠它。
要是化合价没搞清楚,那化学题可就容易做错啦。
咱们学化学,不能死记硬背,得理解着来。
比如说,为啥氢通常是一价,氧通常是二价?这跟它们的原子结构有关系。
氢原子只有一个电子,容易失去,所以显正一价;氧原子最外层有 6 个电子,容易得到 2 个电子,所以显负二价。
还有啊,平时多做做题,也能帮助咱们更好地掌握化合价。
做着做着,那些常见元素的化合价就印在脑子里啦。
总之,化合价口诀是咱们初中化学的重要工具,一定要背熟、用好。
别像小李一开始那样,被老师问得哑口无言。
只要用心,相信大家都能把化合价这部分知识学好!希望同学们都能通过这个化合价口诀,在化学的世界里畅游,感受化学的奇妙和乐趣。
加油吧!。
化学式及化合价知识点及练习

化学式与化合价知识点1:化合价1.化合价:化合价表示原子之间相互化合的数目2.化合价的表示方法+1 -2 +2 +3 H O Zn Al 3.本卷须知〔1〕化合价有正价和负价之分①氧元素通常显-2价 ②氢元素通常显+1价。
③金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价 ④一些元素在不同物质中可显不同的化合价 〔2〕化合物里正负化合价的代数和为0 〔3〕单质分子里,元素的化合价为0【注意】要注意化合价的表示方法与离子符号的区别:头顶价,肩挑离如:试区别Ca 与Ca 2+,S 与S 2-中数字的含义。
2Ca +表示钙元素显+2价〔或钙元素的化合价为+2价〕;2S -表示硫元素显-2价。
Ca 2+表示一个钙离子带2个单位的正电荷; S 2-表示1个硫离子带2个单位的负电荷。
4.牢记常见元素及原子团的化合价:〔1〕常见元素的化合价+1 钾、钠、氢、银+2 钡、镁、钙、锌、铜+3 铝-1 氯-2 氧+2、+3 铁〔2〕常见原子团的化合价根的名称铵根氢氧根硝酸根硫酸根碳酸根离子符号NH4+OH-NO3-SO42-CO32-化合价+1 -1 -1 -2 -2【归纳】化合价记忆韵语一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁,二四碳二四六硫都齐全铜汞二价最常见条件不同价不同单质为零永不变一些常见原子团的化合价负一硝酸氢氧根负二硫酸碳酸根负三记住磷酸根正一价的是铵根5.化合价的应用(1)根据化合价,写出化合物的化学式。
十字穿插法:①写符号P O②标化合价③化合价绝对值穿插放置元素符号右下角④约简⑤检查原子团作为一个整体,当个数不为1时要用括号括起来练习1:写出以下物质的化学式。
氧化钾K2O 氯化钾KCl 氢氧化钾KOH 硫酸钾K2SO4硫酸钙CaSO4硫酸铁FeSO4氢氧化钙Ca(OH)2氢氧化铁Fe(OH)3氯化钙CaCl2氯化亚铁FeCl2氧化钙CaO 氧化铁Fe2O3氧化钠Na2O 氧化铝Al2O3氧化镁MgO 氧化铜CuO氧化汞HgO 氯化钠NaCl 氯化钙CaCl2氯化铜CuCl2氯化镁MgCl2氯化铝AlCl3氯化锌ZnCl2氯化铁FeCl3氢氧化钠NaOH 氢氧化镁Mg〔OH〕2氢氧化铝Al〔OH〕3氢氧化钙Ca〔OH〕2氢氧化铁Fe〔OH〕3氢氧化亚铁Fe〔OH〕2氢氧化铜Cu〔OH〕2碳酸钠Na2CO3 碳酸钾K2CO3碳酸钙CaCO3 碳酸镁MgCO3硫酸钠Na2SO4硫酸铁Fe2〔SO4〕3硫酸铝Al2〔SO4〕3硝酸银AgNO3注意:*化*:指该物质中含两种元素*酸*:指该物质中含“*酸根〞原子团氢氧化*:指该物质中含“氢氧根〞原子团*化亚*:*酸亚*:指该物质中正价元素有两种化合价,且取该元素较低的化合价。
化学物质构成之化合价整理

化学物质构成之化合价整理昨日撒下勤奋种,今朝一搏必成功。
鲤鱼一跃便成龙,大鹏展翅震长空。
前程似锦圆美梦,锦衣凯旋沐春风。
寒窗不负苦心人,金榜有你祝高中。
中考顺利,愿你成功!下面是小编给大家带来的化学物质构成之化合价,欢迎大家阅读参考,我们一起来看看吧!化学物质构成之化合价1、O通常显-2价,氢通常显+1价;金属元素通常显正价;化合价有变价。
2、化合价的应用:依据化合物中各元素化合价的代数和为0。
3、书写化学式时注意根据化合价的正负,按左正右负氨特殊来书写。
4、记住常见元素的化合价七、1、元素符号前的数字:表示原子个数 2N2、化学式前面的数字:表示分子个数 2H2O3、离子符号前面的数字:表示离子个数4、元素符号右上角的数字:表示该离子所带的电荷数 Mg2+5、元素符号正上方的数字:表示该元素的化合价6、化学式中元素符号右下角的数字:表示该分子所含有的某原子个数 H2O初三化学知识点:初三化学化合价详细讲解一、什么是化合价化合价是由一定元素的原子构成的化学键的数量。
一个原子是由原子核和外围的电子组成的,电子在原子核外围是分层运动的,化合物的各个原子是以和化合价同样多的化合键互相连接在一起的。
化合键有两种:因为惰性气体最外层电子数已经达到了2个或8个,所以惰性气体(现统称稀有气体)一般不能和其他物质化合。
各元素的化合价参考元素氧化态列表。
化合价的概念就由此而来,那么元素的核外电子相互化合的数目,就决定了这种元素的化合价,便表示原子相互化合的数目而设置的。
学习化合价时你应该了解化合物中元素化合价的规定。
化合价是化合物物质中的原子得失的电子数或共用电子对偏移的数目。
化合价表示原子之间互相化合时原子的得失电子的数目。
化合价也是元素或根在形成化合物时表现出的一种性质。
注意:元素的“化合价”是元素的一种重要性质,这种性质只有跟其他元素相化合时才表现出来。
就是说,当元素以游离态存在时,即没有跟其他元素相互结合成化合物时,该元素是不表现其化合价的,因此单质元素的化合价为“0”。
初中化学化合价知识点总结

初中化学化合价知识点总结
嘿,同学们!今天咱们要来好好唠唠初中化学化合价这个知识点啦!
化合价这玩意儿啊,就像是化学世界里的小标签,告诉你每个原子在化
学反应中的角色呢!比如说,氢气(H2)中,氢原子的化合价就是 0 呀。
化合价有个超重要的规律,那就是化合物中各元素化合价的代数和为 0 呢!这就好比搭积木,得让它们平衡才行,不然就会“翻车”呀!举个例子,水(H2O)中,氢是+1 价,氧就是-2 价,哇,它们加起来不就正好是 0 嘛!神奇不?
还有呢,单质的化合价统统都是 0 哟!就好像是独行侠,自己就站得稳稳的。
像铁单质(Fe),它的化合价就是 0 呀。
化合价还能帮我们写化学式呢!这可太重要啦。
比如说,你想写氧化铝
的化学式,已知铝是+3 价,氧是-2 价,那根据化合价的规律,是不是很快就能写出 Al2O3 啦!
“哎呀,化合价好难记啊!”有的同学可能会这么抱怨。
别担心啦!多做几道题,多看看元素周期表,慢慢地你就会发现,这也没那么难嘛!
同学们,好好掌握化合价这个知识点呀,它可是打开化学大门的一把重要钥匙呢!它就像是一个向导,能带着我们在化学的奇妙世界里畅游呢!加油,我们一定能学好化合价!能学好初中化学!。
【化学知识点】初中化学化合价口诀完整

【化学知识点】初中化学化合价口诀完整钾钠银氢正一价,钡锌钙镁正二价,一二铜,二三铁,亚铜亚铁是低价,铝是正三氧负二,氯是负一最常见,硫有负二正四六,正二正三铁可变,二三铁,二四碳,单质零价永不变。
负一硝酸氢氧根,负二硫酸碳酸根,负三记住磷酸根,正一价的是铵根,其他元素有变价,先死后活来计算。
一价氯氢钾钠银,二价氧钡钙镁锌。
三铝四硅五价磷,二四碳,三五氮。
二四六硫铁二三,铜汞一二是变价。
单质零价永不变。
正一钾钠银氢氨,正二钙铜镁钡锌,铝三硅四磷正五,氯常负一氧负二,铁变二三碳二四,氢氧硝酸根负一,碳酸硫酸根负二,二四六硫均齐全。
正一氢锂钾钠银,正二钙镁钡锌汞。
正三铝,负二氧。
氟氯溴碘负一价。
可变价,也不难。
正一亚铜,正二铜。
正二亚铁,正三铁。
负一氢氧硝酸根,负二硫酸碳酸根,正一价的是铵根。
一价氢氯钠钾银,二价氧镁钙钡锌;三价元素铀鎶铝,四价碳酸五价磷。
化合价口诀:钾、钠、氢、银、铵正一,铜、钙、钡、镁、锌正二,铝三、硅四、磷正五,亚铁正二、铁正三,碳有正二、正四价,氢氧、硝酸根负一,氯化物中氯负一,碳酸、硫酸根负二,硫化物中硫负二,氧为负二要牢记。
特殊化合价口诀硝酸根NO3:-1,硫酸根SO4:-2,碳酸根CO3:-2,氯酸根ClO3:-1,氢氧根OH:-1,铵根NH4:+1,磷酸根PO4:-3,碳酸氢根HCO3:-1,高锰酸根MnO4:-1,氟、氯、溴、碘:-1(氢氟酸,盐酸,氢溴酸和氢碘酸的酸根)。
根价口诀:一价铵根硝酸根;氢氯酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
感谢您的阅读,祝您生活愉快。
化合价

一、化合价掌握元素的化合价,请注意以下几点:(1)记住常见元素的化合价,掌握元素化合价的一些规律,如:①在化合物中,通常氢显+1价;氧显-2价;②单质里元素的化合价为零;③一些元素有变价,其化合价的确定,可以通过不变价元素按化合价规则求得。
(2)使用化合价的规则是:在化合物里,元素正负化合价的代数和为零。
(3)掌握常见原子团的化合价。
原子团是在化学反应中相对稳定的原子集团,又叫做根。
(4)常见的化合价:一价钾钠氯氢银,二价氧钙钡镁锌.三铝四硅五价磷,二三铁,二四碳.二四六硫都齐全,铜汞二价最常见.氢一氧二为标准,看见单质即为零!负一硝酸氢氧根,负二硫酸碳酸根。
负三只有磷酸根,正一价的是铵根。
下表是一些常见原子团的化合价:根的名称根的符号化合价根的名称根的符号化合价氢氧根OH -1碳酸根CO3-2硝酸根NO3-1硫酸根SO4-2碳酸氢根HCO3-1铵根NH4+1氯酸根ClO3-1二、化学式的意义和书写1.化学式的意义①表示一种物质;②表示该物质的组成元素;③由分子构成的物质的化学式可以表示该物质的一个分子及该分子的构成。
2.化学式的书写①单质化学式书写一般用元素符号表示,但像氢气、氧气、氮气、氯气等非金属单质是双原子分子,要在其元素符号的右下角加2;②化合物化学式书写时,正价元素写在左边,负价元素写在右边;正负价总数的代数和为0;③含有原子团的物质,可将原子团看成是一个原子来书写化学式,如氢氧化镁〔Mg(OH)2〕。
三、关于化学式的计算1、利用化学式可进行下列各种计算:①相对分子质量(化学式中各原子的相对原子质量的总和)②物质组成元素的质量比(化学式中个院子的相对原子质量之比)③物质中某元素的质量分数。
公式为例:1.写出下列物质的化学式或名称:高锰酸钾;硫酸钾;碳酸钠;氯化钾;氯气;铁;氢气;氧化铜;水;二氧化碳;氩;四氧化三铁;氢氧化钙;硝酸铵;氯化镁;碳酸氢铵。
2.写出下列物质的名称Cu H2O Ne SiO2P2O5K2O AgCl ZnO NaCl K2MnO4Al2O3SO2NH4Cl CaCO3Mg(NO3)23.用化学符号表示:两个碳原子三个水分子四个氮分子一个二氧化硫分子三个氢原子一个钠原子两个铁原子两个氖分子四、根据化合价写化学式正价在左,负价在右1、交叉法:在元素上方标上化合价,先化简再交叉,如P为+5价,氧为-2价,交叉后为P2O52、最小公倍数法,选求出几种元素化合价的最小公倍数,再根据最小公倍数求各元素的原子数。
初中化学-“化学式、化合价”必考知识点总结

“化学式、化合价”必考知识点总结1.化学式1.概念:用元素符号和数字表示物质组成的式子【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个2.化学式表示的含义(一般包括宏观和微观)义,即只代表几个微观的微粒。
3.化学式的写法和读法2.化合价含义:由于形成化合物的元素有固定的原子个数比,所以化学上就用“化合价”来表示原子之间相互化合的数目化合价的表示方法化合物中各元素的化合价通常是在化学式中各元素符号或原子团的正上方标记,一般把“+”“-”写在前,价数写在后。
如元素化合价与离子表示方法的区别和联系①单质中,元素的化合价为0,在化合物中,正、负化合价代数和为0②在化合物中,氢元素的化合价通常为+1价,氧元素的化合价通常显示-2价③金属元素在化合物里显正价,非金属元素在和金属元素化合时,通常显负价④一些元素在不同物质中可显不同的化合价,如Fe有+2、+3价,S有-2、+4、-6价备注:这里介绍两种化合价口诀供给同学们记忆:口诀1:一价钾钠氯氢银;二价氧钙钡镁锌;三铝四硅五价磷;二三铁,二四碳;二四六硫都齐全;铜汞二价最常见;莫忘单质为零价。
口诀2:钾钠银氢正一价,钙镁钡锌正二价;氟氯溴碘负一价,通常氧是负二价;铜正一二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正。
【必背离子】3.根据化学式的计算(1)某物质的相对分子质量的计算将化学式中所有的原子的相对原子质量相加之和,即是该物质的相对分子质量(2)计算化合物中的原子个数之比在化学式中,元素符号右下角的数字就是表示该元素原子的个数,因此这些数字的比值就是化合物中的原子个数之比,如:Fe2O3 中,铁原子与氧原子个数比就是2:3(3)计算化合物中各元素质量之比化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量积之间的比值(4)计算化合物中某一元素的质量分数(5)计算一定质量的物质中某元素的质量某元素的质量=物质的质量×该元素在物质中的质量分数小结归纳:调皮的数字——不同位置的数字意义元素符号周围数字的意义。
专题一 原子结构与化合价

专题一原子结构与化合价【知识点二】化合价1.化合价的规律(1)元素化合价与原子结构的内在联系最外层电子数决定元素的化合价。
通常当最外层电子数少于4时,该元素通常显正价;当最外层电子数大于或等于4时,该元素通常显负价;失去1个电子就显+1价,得到1个电子就显—1价,依此类推。
(2)代数和为零规律:在化合物中,各元素化合价的代数和为零。
(3)显正价和显负价的规律金属元素只有正化合价;在非金属与非金属元素形成的化合物中,得电子能力强的元素显负价,得电子能力弱的元素显正价。
含氧酸根离子中,氧元素均显负价。
(4)最高正价和最低负价规律最高正化合价=最外层电子数(氟、氧元素例外)最低负化合价=-(8-最外层电子数)最高正价与最低负价的绝对值之和为83.常见元素的化合价钾钠银氢正一价,钙镁钡锌正二价。
铜一二铁二三,三铝四硅五价磷。
其他元素多变价,单质化合价为零价。
(1)除零价外,只有一种化合价的元素:+1:Na、K、Ag +2:Mg、Ca、Ba、Zn +3:Al -1:F (2)除零价外,常有2种化合价的元素:H:+1和-1 O:―1和―2 Si:―4和+4 Fe:+2和+3 Cu:+1和+2 (3)有多种可变化合价的元素:C:N:S:Cl:Mn:(4)常见原子团的化合价多核离子也表现出化合价,其数值与离子电荷数相同,符号也相同。
如:氢氧根离子呈价,硫酸根离子呈价,碳酸根离子呈价,硝酸根离子呈价,磷酸根离子呈价,铵根离子呈价,高锰酸根离子呈价,亚硫酸根离子呈价,碳酸氢根离子呈价。
专题二原子结构与化合价1.画出下列元素的原子结构示意图:①氢原子②氧原子③硅原子④氯原子⑤钾原子⑥镁原子⑦氦原子⑧氩原子2.画出下列离子结构示意图:①氯离子②镁离子③硫离子④钠离子⑤钙离子⑥氧离子3.下列微粒中,属于原子的有,属于阴离子的有A. C.4.标出下列指定元素化合价①氯元素:HCl、Cl2HClO、HClO2、ClO2、KClO3HClO4②氮元素:NH4+、N2H4、N2N2O、NO、N2O3HNO2NO2、N2O4、N2O5、HNO3、Mg(NO3)2、NH4NO③硫元素:H2S、S、SO2、H2SO3SO3、H2SO4、BaSO4、FeS2、CuFeS2、Na2S2O3(硫代硫酸钠)、Na2S2O4(连二硫酸钠)④碳元素:CH4、 C CO CO2Na2CO3NaHCO3CH3OH、C2H5OH、CH2O、H2C2O4⑤磷元素:PH3、P4、PCl3、PCl5 、P2O5H3PO3(亚磷酸)、H3PO4、HPO3(偏磷酸)⑥金属元素:Ag2O、Cu2S、CuO、FeO、Fe2O3、Fe3O4、Na2FeO4、NaHC.O3、KMnO4、K2MnO4、MnO2、Mn2O3、Cr2O3、Cr2(SO4)3、CrO3、K2CrO4、K2Cr2O75.写出常见原子团的化学式硫酸根;硝酸根;碳酸根;氢氧根;铵根;磷酸根;高锰酸根;锰酸根;亚硫酸根;亚硫酸氢根;碳酸氢根;氯酸根。
初中化学化合价知识点

初中化学化合价知识点初中化学化合价知识点化学化合价知识点把握元素的化合价,请注意以下几点:(1)记住常见元素的化合价,把握元素化合价的一些规律,如:①在化合物中,通常氢显+1价;氧显-2价;②单质里元素的化合价为零;③一些元素有变价,其化合价的确定,能够通过不变价元素按化合价规则求得。
(2)使用化合价的规则是:在化合物里,元素正负化合价的代数和为零。
(3)把握常见原子团的化合价。
原子团是在化学反应中相对稳固的原子集团,又叫做根。
下表是一些常见原子团的化合价:根的名称根的符号化合价根的名称根的符号化合价氢氧根OH-1锰酸根-2硝酸根-1碳酸根-2碳酸氢根-1硫酸根-2氯酸根-1铵根+1高锰酸根-1【例题1】下列物质中均含有氯元素,它们的氯元素的化合价按下列顺序排列:①KCl;②;③HClO;④X;⑤。
依照这种排列规律,X不可能是【解析】KCl、、HClO、中氯元素的化合价分别为-1、0、+1、+7,可见题中物质是以氯元素的化合价逐步升高排列的,X中氯元素的化合价应在+1~+7之间。
AgCl、、、中氯元素的化合价分别为-1、+5、+3、+5,只有AgCl中氯元素的化合价不在+1~+7之间。
【答案】A二、化学式的意义和书写1.化学式的意义①表示一种物质;②表示该物质的组成元素;③由分子构成的物质的化学式能够表示该物质的一个分子及该分子的构成。
2.化学式的书写①单质化学式书写一样用元素符号表示,但像氢气、氧气、氮气、氯气等非金属单质是双原子分子,要在其元素符号的右下角加2;②化合物化学式书写时,正价元素写在左边,负价元素写在右边;正负价总数的代数和为0;③含有原子团的物质,可将原子团看成是一个原子来书写化学式,如氢氧化镁〔〕。
【例题2】请在下表中应用横行和纵行的原子或原子团,进行两两组合,写出正确的化学式,完成表中的空白:【答案】【解析】注意:正价在前,负价在后,正负化合价代数和为0的原则。
利用化学式可进行下列各种运算:①相对分子质量;②物质组成元素的质量比;③物质中某元素的质量分数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、化学式的含义
O
1、由分子构成的物质。
例如 H
2
宏观:①表示一种物质:
②表示这种物质的组成:
微观:③表示这种物质的一个分子:
④表示这种物质的一个分子的构成:
2、由原子构成的物质。
例如 Hg ①②③
表示
3、符号的意义 2H表示 2H
2
二、化学式的书写
单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式
铁铜汞氦气氖气氩气磷碳硫硅
氧化镁氧化汞氧化铜氧化钠氧化铝氧化铁氯化钠氯化钾氯化锌
高锰酸钾锰酸钾过氧化氢水
氯酸钾二氧化硫五氧化二磷二氧化锰
三、化合价
1、在化合物里:氧元素常显“”价;氢元素常显“”价;氯元素常显“-1”价
2、在化合物里正负化合价的代数和为,在单质的化合价为“”
3、带、为负价
4、原子团氢氧根离子硝酸根碳酸根,硫酸根
化合物氢氧化钠硫酸钠碳酸钠
氢氧化铜硫酸铜碳酸钙
5、根据化合式求化学价例求K2MnO4中锰元素化合价
四、计算
1、计算相对分子质量,求Fe2O3 的相对分子质量:
2、求组成的各元素质量比,求Fe2O3的铁元素与氧元素质量比
3、求某元素质量分数,求Fe2O3中铁元素的质量分数
4、150g氧化铁中铁元素的质量?。
