CNAS-CL03能力验证计划提供者认可准则
实验室认可相关文件

实验室认可规范文件清单日期:2011-1-20序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期1通用认可规则 CNAS-R01:2010《认可标识和认可状态声明管理规则》2010-11-18 2011-1-1 CNAS-R01:2006《认可标识和认可状态声明管理规则》2006-6-1 2006-7-12007-4-152007-4-15第一次修订2 CNAS-R02:2006《公正性和保密规则》 2006-6-1 2006-7-1 制定3 CNAS-R03:2010《申诉、投诉和争议处理规则》2010-11-18 2010-11-18 CNAS-R03:2006《申诉、投诉和争议处理规则》2006-6-1 2006-7-12008-6-16 2008-6-16 换版修订4实验室专用认可规则 CNAS-RL01:2007《实验室认可规则》(2008年第1次修订)2008-7-15 2008-7-15 CNAS-RL01:2006《实验室和检查机构认可规则》2007-4-16 2008-1-1 修订5 CNAS-RL02:2010《能力验证规则》 2010-12-30 2011-02-01 CNAS-RL02:2006《能力验证规则》 2006-6-1 2006-7-12007-4-30 2007-4-30 第一次修订6 CNAS-RL03:2009《实验室和检查机构认可收费管理规则》 2009-1-14 2009-1-14 CNAS-RL03:2006《实验室和检查机构认可收费管理规则》2006-6-1 2006-7-1 修订7 CNAS-RL04:2009《境外实验室和检查机构受理规则》 2009-3-1 2009-3-1 CNAS-RL04:2006《境外实验室和检查机构受理规则》2006-6-1 2006-7-1 修订8 CNAS-RL05:2008《实验室生物安全认可规则》2008-8-1 2008-8-1 CNAS-RL05:2006《实验室生物安全认可规则》2006-6-1 2006-7-1 修订9 CNAS-RL06:2010《能力验证提供者认可规则》2010-12-31 2011-02-01 制定10 CNAS-RL07:2010《标注物质/标准样品生产者能力认可规则》2010-12-30 2011-01-01 制定1 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期11 实验室基本认可准则 CNAS-CL01:2006《检测和校准实验室能力认可准则》(ISO/IEC17025:2005)2006-6-1 2006-7-1 制定12实验室基本认可准则 CNAS-CL02:2008《医学实验室质量和能力认可准则》(ISO 15189:2007)2008-6-16 2008-12-1 CNAS-CL02:2006《医学实验室质量和能力认可准则》(ISO 15189:2003)2006-6-1 2006-7-1 修订13 CNAS-CL03:2010《能力验证提供者认可准则》(ISO/IEC 17043:2010) 2010-12-31 2011-01-01 CNAS-CL03:2006《能力验证计划提供者认可准则》(ILAC G13:2000)2006-6-1 2006-7-1 修订14 CNAS-CL04:2010《标准物质/标准样品生产者能力认可准则》(ISO Guide34:2009) 2010-12-30 2011-01-01 CNAS-CL04:2007《标准物质/标准样品生产者能力认可准则》2007-8-1 2007-8-1 修订15 CNAS-CL05:2009《实验室生物安全认可准则》(GB19489-2008) 2009-6-30 2009-7-1 CNAS-CL05:2006《实验室生物安全认可准则》(GB19489-2004)2006-6-1 2006-7-1 修订16 CNAS-CL36:2007《医学实验室安全认可准则》(ISO 15190:2003)2007-4-16 2007-4-30 制定17实验室认可应用准则 CNAS-CL06:2006《量值溯源要求》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-CL06:2006《量值溯源要求》 2006-6-1 2006-7-1 修订18 CNAS-CL07:2006《测量不确定度评估和报告通用要求》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL07:2006《测量不确定度评估和报告通用要求》2006-6-1 2006-7-1 修订19 CNAS-CL09:2006《检测和校准实验室能力认可准则在微生物检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL09:2006《实验室能力认可准则在微生物检测领域的应用说明》2006-6-1 2006-7-1 修订2 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期20 CNAS-CL10:2006《检测和校准实验室能力认可准则在化学检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL10:2006《实验室能力认可准则在化学检测领域的应用说明》2006-6-1 2006-7-1 修订21实验室认可应用准则 CNAS-CL11:2006《检测和校准实验室能力认可准则在电气检测领域的应用说明》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-CL11:2006《实验室能力认可准则在电子和电气检测领域的应用说明》2006-6-1 2006-7-1 修订22 CNAS-CL12:2006《实验室能力认可准则在医疗器械检测领域的应用说明》2006-6-1 2006-7-1 制定23 CNAS-CL13:2006《实验室能力认可准则在汽车和摩托车检测领域的应用说明》2006-6-1 2006-7-1 制定24 CNAS-CL14:2010《检测和校准实验室能力准则在无损检测领域的应用说明》 2010-9-1 2010-10-1 CNAS-CL14:2006《实验室能力认可准则在无损检测领域的应用说明》2006-6-1 2006-7-1 修订25 CNAS-CL15:2006《实验室能力认可准则在电声检测领域的应用说明》2006-6-1 2006-7-1 制定26 CNAS-CL16:2006《检测和校准实验室能力认可准则在电磁兼容检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL16:2006《实验室能力认可准则在电磁兼容检测领域的应用说明》2006-6-1 2006-7-1 修订27 CNAS-CL17:2006《检测和校准实验室能力认可准则在玩具检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL17:2006《实验室能力认可准则在玩具检测领域的应用说明》2006-6-1 2006-7-1 修订3 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期28 CNAS-CL18:2006《检测和校准实验室能力认可准则在纺织检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL18:2006《实验室能力认可准则在纺织检测领域的应用说明》2006-6-1 2006-7-1 修订29实验室认可应用准则 CNAS-CL19:2010《检测和校准实验室能力认可准则在金属材料检测领域的应用说明》2010-12-30 2011-04-01 CNAS-CL19:2006《实验室能力认可准则在金属材料检测领域的应用说明》2006-6-1 2006-7-1 修订30 CNAS-CL20:2006《检测和校准实验室能力认可准则在信息技术软件产品检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL20:2006《实验室能力认可准则在信息技术软件产品检测领域的应用说明》2006-6-1 2006-7-1 修订31 CNAS-CL21:2006《检测和校准实验室能力认可准则在卫生检疫领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL21:2006《实验室能力认可准则在卫生检疫领域的应用说明》2006-6-1 2006-7-1 修订32 CNAS-CL22:2006《检测和校准实验室能力认可准则在动物检疫领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL22:2006《实验室能力认可准则在动物检疫领域的应用说明》2006-6-1 2006-7-1 修订33 CNAS-CL23:2006《检测和校准实验室能力认可准则在植物检疫领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL23:2006《实验室能力认可准则在植物检疫领域的应用说明》2006-6-1 2006-7-1 修订34 CNAS-CL24:2006《检测和校准实验室能力认可准则在贵金属、珠宝检测领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL24:2006《实验室能力认可准则在黄金、珠宝检测领域的应用说明》2006-6-1 2006-7-1 修订35 CNAS-CL25:2006《检测和校准实验室能力认可准则在校准领域的应用说明》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-CL25:2006《实验室能力认可准则在校准领域的应用说明》2006-6-1 2006-7-1 修订4 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期36 CNAS-CL26:2007《检测和校准实验室能力认可准则在感官检验领域的应用说明》2007-4-16 2007-4-30 制定37 CNAS-CL27:2010《检测和校准实验室能力认可准则在电子物证检验领域的应用说明》2010-01-20 2010-01-20 制定38实验室认可应用准则 CNAS-CL28:2010《检测和校准实验室能力认可准则在法医物证DNA检测领域的应用说明》2010-01-20 2010-01-20 制定39 CNAS-CL29:2010《检测和校准实验室能力认可准则在微量物证检验领域的应用说明》2010-01-20 2010-01-20 制定40 CNAS-CL30:2010《标准物质/标准样品证书和标签的内容》(ISO Guide 31:2000)2010-12-30 2011-01-01 制定41实验室认可指南 CNAS-GL01:2006《实验室认可指南》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-GL01:2006《实验室认可指南》 2006-6-1 2006-7-1 修订42 CNAS-GL02:2006《能力验证结果的统计处理和能力评价指南》2006-6-1 2006-7-1 制定43 CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》2006-6-1 2006-7-1 制定44 CNAS-GL04:2006《量值溯源要求的实施指南》(2007年第1次修订)2007-4-16 2007-4-30 CNAS-GL04:2006《量值溯源要求的实施指南》2006-6-1 2006-7-1 修订45 CNAS-GL05:2006《测量不确定度要求的实施指南》(2007年第1次修订) 2007-4-16 2007-4-30 CNAS-GL05:2006《测量不确定度要求的实施指南》2006-6-1 2006-7-1 修订5 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期46 CNAS-GL06:2006《化学分析中不确定度的评估指南》2006-6-1 2006-7-1 制定47 CNAS-GL07:2006《电磁干扰测量中不确定度的评估指南》2006-6-1 2006-7-1 制定48实验室认可指南 CNAS-GL08:2006《电器领域不确定度的评估指南》2006-6-1 2006-7-1 制定49 CNAS-GL10:2006《材料理化检验测量不确定度评估指南及实例》2006-12-1 2006-12-1 制定50 CNAS-GL11:2007《检测和校准实验室能力认可准则在软件和协议检测领域的应用指南》2007-4-16 2007-4-30 制定51 CNAS-GL12:2007《实验室和检查机构内部审核指南》2007-4-16 2007-4-30 制定52 CNAS-GL13:2007《实验室和检查机构管理评审指南》2007-4-16 2007-4-30 制定53 CNAS-GL14:2007《医学实验室安全应用指南》2007-4-16 2007-4-30 制定54 CNAS-GL16:2007《最佳测量能力评定指南》2007-6-15 2007-8-1 制定55 CNAS-GL17:2007《医学实验室质量和能力认可准则在实验室信息系统的实施指南》2007-5-15 2007-5-15 制定56 CNAS-GL18:2008《量值溯源要求在医学测量领域的实施指南》2008-10-08 2008-10-08 制定57 CNAS-GL19:2008《医学实验室质量和能力认可准则在临床血液学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL27:2007《医学实验室质量和能力认可准则在临床血液学检验领域的应用说明》2007-4-16 2007-4-30 修订6 / 7序号 文件类别文件名称编号发布日期 实施日期原文件名称编号原文件发布日期原文件实施日期备注注:如果文件被修订,则为最新修订文件的发布和实施日期58 CNAS-GL20:2008《医学实验室质量和能力认可准则在体液学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL28:2007《医学实验室质量和能力认可准则在临床体液学检验领域的应用说明》2007-4-16 2007-4-30 修订59 CNAS-GL21:2008《医学实验室质量和能力认可准则在临床生物化学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL29:2007《医学实验室质量和能力认可准则在临床生物化学检验领域的应用说明》2007-4-16 2007-4-30 修订60实验室认可指南 CNAS-GL22:2008《医学实验室质量和能力认可准则在临床免疫学检验领域的指南》2008-12-01 2008-12-01 CNAS-CL30:2007《医学实验室质量和能力认可准则在临床免疫学检验领域的应用说明》2007-4-16 2007-4-30 修订61 CNAS-GL23:2008《医学实验室质量和能力认可准则在临床微生物学检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL31:2007《医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明》2007-4-16 2007-4-30 修订62 CNAS-GL24:2008《医学实验室质量和能力认可准则在输血医学领域的指南》 2008-12-01 2008-12-01 CNAS-CL32:2007《医学实验室质量和能力认可准则在输血医学领域的应用说明》2007-4-16 2007-4-30 修订63 CNAS-GL25:2008《医学实验室质量和能力认可准则在病理学检查领域的指南》 2008-12-01 2008-12-01 CNAS-CL33:2007《医学实验室质量和能力认可准则在病理学检验领域的应用说明》2007-4-16 2007-4-30 修订64 CNAS-GL26:2008《医学实验室质量和能力认可准则在基因扩增检验领域的指南》 2008-12-01 2008-12-01 CNAS-CL34:2007《医学实验室质量和能力认可准则在基因扩增检验领域的应用说明》2007-4-16 2007-4-30 修订65 CNAS-GL27:2009《声明检测或校准结果及与规范符合性的指南》 2009-09-28 2009-09-28 CNAS-CL08:2006《评价和报告测试结果与规定限量符合性的要求》2006-6-1 2006-7-1 制定66 CNAS-GL28:2010《石油石化领域理化检测测量不确定度评估指南及实例》2010-04-09 2010-04-09 制定67 CNAS-GL29:2010《标准物质/标准样品定值的一般原则和统计方法》(ISO Guide35:2006)2010-12-30 2011-01-01 制定7 / 7。
17025实验室认可准则

ISO17025实验室检测方法:ISO17025实验室检测方法第一是为进行检测工作所规定的技术依据和程序,实验室的基本职责是使用具有适当准确度和符合标准要求的方法进行检测,其职责范围内的有关活动应满足用户对检测的要求。
ISO17025实验室检测方法要求是:ISO17025实验室检测方法第二是将执行的技术依据为国家法律和法规所承认的现行有效的国家标准和行业标准及实验室相应的检测标准方法(或规程)做为作业指导书。
作业指导书应方便工作人员使用。
具体执行《质量体系文件控制程序》。
ISO17025实验室检测标准是:本实验室使用的检测方法标准要求技术负责人对实验室执行标准的有效性负责。
对检测方法的管理执行《检测工作控制管理程序》。
标准方法的使用对于需要使用非标准方法的进行检测时,一定要书面征求委托方的同意。
技术负责人应与委托人签定“协议方法”的执行契约。
这些“协议方法”的制定应尽量引用一些公认的标准:a 其他企业公开的标准或方法b 国际组织标准c 著名技术组织推荐的方法人d 科学权威杂志推荐的方法ISO17025 - 认可机构中国实验室国家认可委员会(CNAS)是我国唯一的实验室认可机构,承担全国所有实验室的ISO17025标准认可。
所有的校准和检测实验室均可采用和实施ISO17025标准,按照国际惯例,凡是通过ISO17025标准的实验室提供的数据均具备法律效应,得到国际认可。
截止2011年4月,国内已有五千余家实验室通过了ISO17025标准认证,通过标准的贯彻,提高了实验数据和结果的精确性,扩大了实验室的知名度,从而大大提高了经济和社会效益。
实验室认可:实验室认可机构对实验室有能力进行规定类型的检测和(或)校准所给予的一种正式承认。
主要职能:实验室是指进行校准或检测的实体。
如果某实验室是一个除了进行校准和检测工作以外,还进行其他活动的组织中的一部分,则"实验室仅指该组织为从事和检测工作的那一部分。
实验室认可规范文件清单
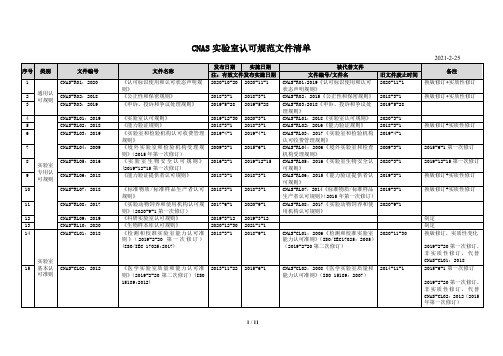
2020-3-1 2018-3-1 2019-4-1
2009-3-1 2015-6-1
2016-2-1 2019-12-15
2018-3-1 2018-3-1
2018-3-1 2018-3-1
2017-6-1 2020-9-1
2019-3-12 2020-12-30 2018-3-1
2019-3-12 2021-1-1 2018-9-1
《实验室认可规则》 《能力验证规则》 《实验室和检验机构认可收费管理 规则》 《境外实验室和检验机构受理规 则》(2015 年第一次修订) 《实验室生物安全认可规则》 (2019-12-15 第一次修订) 《能力验证提供者认可规则》
《标准物质/标准样品生产者认可 规则》 《实验动物饲养和使用机构认可规 则》(2020-9-1 第一次修订) 《科研实验室认可规则》 《生物样本库认可规则》 《检测和校准实验室能力认可准 则 》( 2019-2-20 第 一 次 修 订 ) (ISO/IEC 17025:2017)
CNAS-CL02:2008《医学实验室质量和 2014-11-1 能力认可准则》(ISO 15189:2007)
2021-2-25
备注 换版修订+实质性修订 换版修订+实质性修订
换版修订+实质性修订
2015-6-1 第一次修订 2019-12-15 第一次修订 换版修订+实质性修订 换版修订+实质性修订
序号 类别
文件编号
1
CNAS-R01:2020
2
通用认 可规则
CNAS-R02:2018
3
CNAS-R03:2019
4
CNAS-RL01:2019
5
CNAS文件一览表
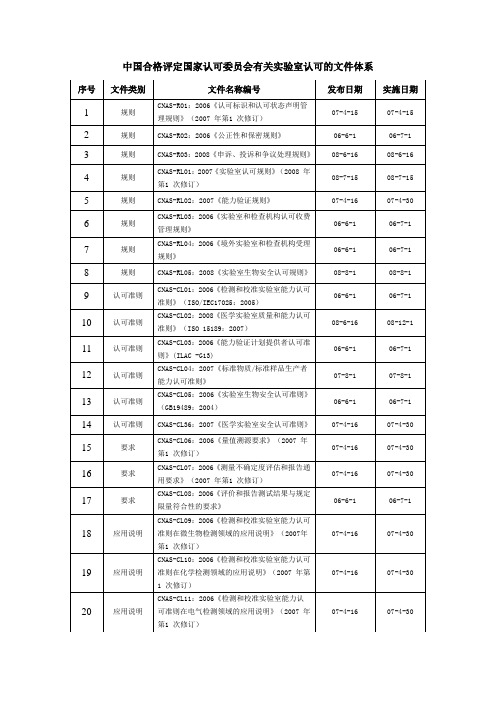
42
应用说明
CNAS-CL33:2007《医学实验室质量和能力认
可准则在病理学检验领域的应用说明》
07-4-16
07-4-30
43
应用说明
CNAS-CL34:2007《医学实验室质量和能力认
可准则在基因扩增检验领域的应用说明》
07-4-16
07-4-30
44
指南
CNAS-GL01:2006《实验室认可指南》(2007年
06-6-1
06-7-1
8
规则
CNAS-RL05:2008《实验室生物安全认可规则》
08-8-1
08-8-1
9
认可准则
CNAS-CL01:2006《检测和校准实验室能力认可准则》(ISO/IEC17025:2005)
06-6-1
06-7-1
10
认可准则
CNAS-CL02:2008《医学实验室质量和能力认可准则》(ISO 15189:2007)
可准则在医疗器械检测领域的应用说明》
06-6-1
06-7-1
22
应用说明
CNAS-CL13:2006《检测和校准实验室能力认
可准则在汽车和摩托车检测领域的应用说明》
06-6-1
06-7-1
23
应用说明
CNAS-CL14:2006《检测和校准实验室能力认
可准则在无损检测领域的应用说明》
06-6-1
06-7-1
的评估指南》
06-6-1
06-7-1
51
指南
CNAS-GL08:2006《电器领域不确定度的评估
指南》
06-6-1
06-7-1
52
指南
能力验证提供者认可规则【模板】

能力验证提供者认可规则(征求意见稿)Rules for the Accreditation of Proficiency Testing Provider中国合格评定国家认可委员会二O一O年X月能力验证提供者认可规则1.目的与范围1.1 中国合格评定国家认可委员会(CNAS)依据国家相关法律法规和国际规范开展认可工作,遵循的原则是:客观公正、科学规范、权威信誉、廉洁高效。
1.2 认可规则是CNAS认可工作公正性和规范性的重要保障,CNAS依据《中国合格评定国家认可委员会章程》制定本规则。
1.3 本规则规定了CNAS能力验证提供者认可体系运作的程序,包括认可条件、认可流程、暂停、恢复、撤销、注销认可以及CNAS和能力验证提供者的权利和义务,是CNAS认可活动相关方应遵循的程序规则。
2.引用文件下列文件中的条款通过引用而成为本文件的条款。
以下引用的文件,注明日期的,仅引用的版本适用;未注明日期的,引用文件的最新版本(包括任何修订)适用。
2.1 GB/T27011:2004《合格评定认可机构通用要求》(ISO/IEC17011:2004,IDT)2.2 CNAS-R01 《认可标识和认可状态声明管理规则》2.3 CNAS-R02 《公正性与保密规则》2.4 CNAS-R03 《申诉、投诉和争议处理规则》2.5 CNAS-RL02 《能力验证规则》2.6 CNAS-RL03 《实验室和检查机构认可收费管理规则》2.7 CNAS-RL04 《境外实验室和检查机构受理规则》2.8 ISO/IEC 17043:2010《合格评定能力验证通用要求》2.9 CNAS-CL01 《检测和校准实验室能力认可准则》2.10 CNAS-CL02《医学实验室质量和能力认可准则》2.11 CNAS-CL04《标准物质/标准样品生产者能力认可准则》3.术语和定义本规则引用GB/T27000、GB/T27011和ISO/IEC17043中的有关术语并采用下列定义:3.1 认可:正式表明合格评定机构具备实施特定合格评定工作的能力的第三方证明。
CNAS-CL03《能力验证提供者认可准则》

CNAS-CL03能力验证提供者认可准则(征求意见稿) Accreditation Criteria for Proficiency Testing Providers中国合格评定国家认可委员会二O一O年X月目录前言 (4)ISO引言 (5)1范围 (6)2规范性引用文件 (6)3术语和定义 (6)3.1指定值 assigned value (6)3.2协调者 coordinator (6)3.3客户 customer (6)3.4实验室间比对 interlaboratory comparison (6)3.5离群值 outlier (7)3.6参加者 participant (7)3.7能力验证 proficiency testing (7)3.8能力验证物品 proficiency testing item (8)3.9能力验证提供者proficiency testing provider (8)3.10能力验证轮次 proficiency testing round (8)3.11能力验证计划proficiency testing scheme (8)3.12稳健统计方法 robust statistical method (8)3.13能力评定标准差standard deviation for proficiency assessment (8)3.14分包方subcontractor (8)3.15计量溯源性 metrological traceability (9)3.16测量不确定度measurement uncertainty (9)4 技术要求 (10)4.1 总则 (10)4.2 人员 (10)4.3 设备、设施和环境 (11)4.4 能力验证计划的设计 (12)4.5 方法或程序的选择 (17)4.6 能力验证计划的运作 (17)4.7 数据分析和能力验证计划结果的评价 (19)4.8 报告 (20)4.9 与参加者的沟通 (21)4.10 保密 (22)5管理要求 (22)5.1 组织 (22)5.2管理体系 (23)5.3文件控制 (24)5.4 要求、标书和合同的评审 (25)5.5分包服务 (26)5.6 服务和供应品的采购 (27)5.7服务客户 (27)5.8投诉和申诉 (27)5.9 不符合工作的控制 (27)5.10 改进 (28)5.11纠正措施 (28)5.12预防措施 (29)5.13记录的控制 (29)5.14 内部审核 (30)5.15 管理评审 (31)附录A(资料性附录) (32)能力验证计划的类型 (32)A.1 总则 (32)A.2顺序参加的计划 (32)A.3 同步参加的计划 (33)A.4 外部质量评价(EQA)计划 (35)附录B (37)能力验证的统计方法 (37)B.1 总则 (37)B.2指定值及其不确定度的确定 (38)B.3 能力统计量的计算 (39)B.4 能力评估 (43)B.5能力验证物品均匀性和稳定性 (44)附录C(资料性附录) (46)能力验证的选择和利用 (46)C.1 总则 (46)C.2 能力验证计划的选择 (46)C.3 参加能力验证计划的政策 (47)C.4 参加者对能力验证的利用 (47)C.5 利益相关方对结果的利用 (48)C.6 监管机构对能力验证的利用 (49)前言本准则是CNAS对能力验证提供者能力进行认可的基本依据,也为能力验证各利益相关方提供协调一致的基础。
CNAS认可规范文件清单
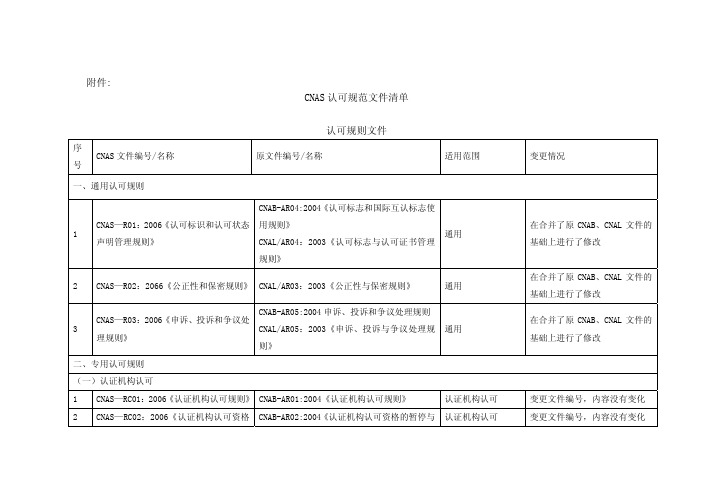
5
实验室认可
可准则》(GB19489:2004)
(GB19489:2004)
(三)检查机构认可
CNAS—CI01:2006《检查机构认可准则》
1
CNAL/AC02:2003《检查机构认可准则》
检查机构认可
(ISO/IEC17020:1998)
变更文件编号,内容没有变化 变更文件编号,内容没有变化 变更文件编号,内容没有变化 变更文件编号,内容没有变化
5
认证机构认可
构通用要求》应用指南
通用要求》应用指南
CNAS—CC62:2006《食品安全管理体系认证机构通 CNAB-AC62:2004《食品安全管理体系认证机构通用
6
认证机构认可
用要求》应用指南
要求》应用指南
CNAS—CC72:2006《人员认证机构通用要求》应用 CNAB-AC72:2004《人员认证机构通用要求》应用指
南》
南》
CNAS—GC41:2006《职业健康安全管理体系认证机 CNAB-AG41:2004《职业健康安全管理体系认证机构
14
构认证业务范围管理实施指南》
认证业务范围管理实施指南》
认证机构认可
认可方案
15
CNAS—SC11:2006《QS-9000 认可方案》
CNAB-AS11:2004《QS-9000 认可方案》
(ISO/IEC17024:2003)
(二)实验室认可
CNAS—CL01:2006《检测和校准实验室 CNAL/AC01:2005《检测和校准实验室能力认
1
实验室认可
能力认可准则》(ISO/IEC17025:2005) 可准则》
变更情况 变更文件编号,内容没有变化 变更文件编号,内容没有变化 变更文件编号,内容没有变化 变更文件编号,内容没有变化 变更文件编号,内容没有变化 变更文件编号,内容没有变化 变更文件编号,内容没有变化
能力验证规则

能力验证规则第一篇:能力验证规则CNAS—RL02能力验证规则Rules for Proficiency Testing 中国合格评定国家认可委员会能力验证规则1.目的和范围1.1 为了确保中国合格评定国家认可委员会(英文缩写:CNAS)认可的有效性,保证CNAS认可质量,CNAS 依据ISO/IEC 有关标准和指南、国际实验室认可合作组织(ILAC)和亚太实验室认可合作组织(APLAC)的相关要求制定本规则。
1.2 本规则阐述了CNAS 能力验证的政策和要求。
1.3 本规则适用于CNAS 认可实验室(含能力验证计划提供者、标准物质/标准样品生产者)和检查机构的活动。
2.引用文件下列文件中的条款通过引用而成为本文件的条款。
以下引用的文件,注明日期的,仅引用的版本适用;未注明日期的,引用文件的最新版本(包括任何修订)适用。
2.1 ISO/IEC 17011:2004《合格评定-认可机构通用要求》2.2 ISO/IEC 指南43《利用实验室间比对的能力验证》(GB/T15483,IDT)2.3 ISO13528:2005《利用实验室间比对的能力验证中的统计方法》2.4 ISO/IEC 17025:2005《检测和校准实验室能力的通用要求》(CNAS/CL01,IDT)2.5 ILAC-P9:2005《参加国家和国际能力验证活动的政策》2.6 ILAC-G13《能力验证计划提供者的能力要求指南》(CNAS/CL03,IDT)2.7 ILAC-G22:2004《应用能力验证作为对检测能力认可的手段》2.8 APLAC MR001《建立和保持APLAC 多边互认协议的程序要求》3.术语和定义本规则参考ISO/IEC17000、ISO/IEC 指南43 和ILAC-G13 等国际文件中的有关术语并采用下列定义:3.1 能力验证:利用实验室间比对确定实验室的校准、检测能力或检查机构的检测能力。
3.2 能力验证活动:用于监控实验室能力的任何实验室间比对或测量审核,例如由国家或区域的认可机构、合作组织、政府、行业组织或提供正式能力验证计划的商业提供者运作的实验室间比对和测量审核。
CNAS-CL03-A001-2019能力验证提供者认可准则在微生物领域的应用说明

CNAS-CL03-A001能力验证提供者认可准则在微生物领域的应用说明Guidance on the Application of Accreditation Criteria for Proficiency Testing Providers in theField of Microbiology中国合格评定国家认可委员会目次前言 (2)1 范围 (3)2 规范性引用文件 (3)3 术语和定义 (3)4 技术要求 (4)5 管理要求 (8)附录A均匀性和稳定性检验 (10)附录B统计分析和能力评定 (14)附录C微生物能力验证统计分析示例 (17)附录D 修订差异对照表 (21)参考文献 (22)前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS依据特定领域微生物能力验证计划特性而对CNAS-CL03:2010《能力验证提供者认可准则》所做的进一步说明及具体解释,并不增加或减少该准则的要求。
本文件对特定领域微生物能力验证组织实施、能力验证样品均匀性和稳定性检验,及结果评价等质量管理特定要求做出说明,明确了特定领域开展微生物能力验证应遵循的要求。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL03: 2010中章、节条款号和名称,解释和说明内容在相应条款后给出。
本文件与CNAS-CL03:2010《能力验证提供者认可准则》同时使用。
能力验证提供者认可准则在微生物领域的应用说明1 范围本文件主要适用于食品、饮用水、饲料、化妆品、环境样品、玩具、纺织品、卫生用品、消毒产品、抗菌材料等非医学检验领域微生物能力验证提供者的认可活动。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T 27405 实验室质量控制规范食品微生物检验GB/T 28043 利用实验室间比对进行能力验证的统计方法(ISO 13528, IDT)GB/T 6379 测量方法与结果的准确度(正确度和精密度)(ISO 5725,IDT)SN/T 1800食品与动物饲料微生物学微生物计数水平法30℃时的菌落计数方法(ISO 4833,IDT)ISO/TS 22117 食品和动物饲料微生物能力验证特定要求和指南(Microbiology of food and animal feeding stuffs-Specific requirements and guidance for proficiency testing by interlaboratory comparison)CNAS-CL01 检测和校准实验室能力认可准则3 术语和定义3.1 目标微生物target microorganism能力验证样品中作为指定分析物的微生物。
实验室认可的依据

4、CNAS-CL04:2006《标准物质/标准样品生产者能力认可准则》(内容等同采用ISO 34:2000和ISO/IEC 17025:2005)
以及在以பைடு நூலகம்基本认可准则的基础上,还针对某些技术领域的特定情况制定了一系列应用指南和应用说明。
2005以及在以上基本认可准则的基础上还针对某些技术领域的特定情况制定了一系列应用指南和应用说明
实验室认可的依据
CNAS开展实验室认可活动主要依据以下基本准则:
1、CNAS-CL01:2006《检测和校准实验室能力认可准则》(内容等同采用ISO/IEC 17025:2005)
2、CNAS-CL02:2006《医学实验室能力认可准则》(内容等同采用ISO 15189:2003)
CNAS-CL03:2010《能力验证提供者认可准则》

CNAS-CL03能力验证提供者认可准则Accreditation Criteria for Proficiency TestingProviders(ISO/IEC 17043:2010)中国合格评定国家认可委员会目次目次 (1)前言 (2)ISO引言 (3)1 范围 (4)2 规范性引用文件 (4)3 术语和定义 (4)4 技术要求 (7)4.1 总则 (7)4.2 人员 (7)4.3 设备、设施和环境 (8)4.4 能力验证计划的设计 (9)4.5 方法或程序的选择 (12)4.6 能力验证计划的运作 (12)4.7 数据分析和能力验证计划结果的评价 (14)4.8 报告 (15)4.9 与参加者的沟通 (16)4.10 保密 (16)5 管理要求 (17)5.1 组织 (17)5.2 管理体系 (18)5.3 文件控制 (18)5.4 要求、标书和合同的评审 (19)5.5 分包服务 (20)5.6 服务和供应品的采购 (20)5.7 服务客户 (20)5.8 投诉和申诉 (21)5.9 不符合工作的控制 (21)5.10 改进 (21)5.11 纠正措施 (21)5.12 预防措施 (22)5.13 记录的控制 (22)5.14 内部审核 (23)5.15 管理评审 (23)附录A (资料性附录)能力验证计划的类型 (25)附录B (资料性附录)能力验证的统计方法 (29)附录C (资料性附录)能力验证的选择和利用 (36)参考文献 (39)本准则规定了能力验证提供者应满足的质量管理和技术要求,是CNAS对能力验证提供者能力进行认可的基本依据。
本准则等同采用ISO/IEC 17043:2010“Conformity assessment - General requirements for proficiency testing”。
本准则的附录是信息性资料,不是要求,旨在帮助理解和实施本准则。
CNAS-实验室认可规范文件清单2021

2013-11-22 2015-6-1
被代替文件
文件编号/文件名
旧文件废止时间
CNAS-R01:2019《认可标识使用和认可 2020-11-1 状态声明规则》
CNAS-R02:2015《公正性和保密规则》 2018-3-1
CNAS-R03:2018《申诉、投诉和争议处 2019-5-28 理规则》
《实验室认可规则》 《能力验证规则》 《实验室和检验机构认可收费管理 规则》 《境外实验室和检验机构受理规 则》(2015 年第一次修订) 《实验室生物安全认可规则》 (2019-12-15 第一次修订) 《能力验证提供者认可规则》
《标准物质/标准样品生产者认可 规则》 《实验动物饲养和使用机构认可规 则》(2020-9-1 第一次修订) 《科研实验室认可规则》 《生物样本库认可规则》 《检测和校准实验室能力认可准 则 》( 2019-2-20 第 一 次 修 订 ) (ISO/IEC 17025:2017)
2019-2-20 第一次修订, 非实质性修订,代替 CNAS-CL07:2018 换版修订,实质性变化
制定 制定
2 / 11
序号 类别 24
25 26 27 28
实验室 认可应 29 用准则
30
31
文件编号 CNAS-CL01-G001:2018
CNAS-CL01-G002:2018 CNAS-CL01-G003:2019 CNAS-CL01-G004:2018 CNAS-CL01-G005:2018 CNAS-CL01-A001:2018 CNAS-CL01-A002:2020 CNAS-CL01-A003:2019
被代替文件
文件编号/文件名
旧文件废止时间
CNAS-CL52:2014《CNAS-CL01<检测和 2020-11-30 校准实验室能力认可准则>应用要求》 (2015 年第一次修订)
CNAS-CL03能力验证计划提供者认可准则

CNAS-CL03能力验证计划提供者认可准则目录前言 (2)第一部分:总则 (3)1.1 范围 (3)1.2 参考文件 (3)1.3 定义 (4)第二部分:管理体系要求 (5)2.1 质量管理体系 (5)2.2 组织和管理 (5)2.3 文件控制 (6)2.4 要求、投标书或合同的评审 (6)2.5 合作方(分包方)的使用 (6)2.6 服务和供给的采购 (6)2.7 客户的反馈 (8)2.8 不符合活动的控制 (8)2.9 纠正措施 (8)2.10 预防措施 (9)2.11 记录 (9)2.12 内部审核 (10)2.13 管理评审 (10)第三部分:技术要求 (11)3.0 总则 (11)3.1 管理、人员和培训 (11)3.2 合作方(分包方) (11)3.3 组织和计划设计的保障 (12)3.4 方法或程序的选择 (16)3.5 能力验证计划的实施 (16)3.6 数据分析和能力验证计划结果的说明 (17)3.7 与参加者的沟通 (19)3.8 保密性 (20)3.9 结果的串通和伪造 (20)前言能力验证是中国合格评定国家认可委员会(英文缩写:CNAS)评定和监督检测、校准、检查等机构技术能力的重要手段之一。
它与现场评审构成了CNAS互为补充的两种能力评价技术。
能力验证也是CNAS维持国际间认可机构相互承认协议(ILAC-MRA 和APLAC-MRA)的基础要求之一。
同时,对于检测、校准、检查机构等,参加能力验证也是一种有效的外部质量保证活动,是其内部质量控制技术的补充。
如果能够证明能力验证计划的运作符合了本准则的要求,CNAS及其评审员就能够更好地利用能力验证计划的结果来为认可的过程提供帮助,同时,也可使计划的其他使用者对能力验证计划的运作产生更多的信任。
本准则为以获得认可或其他承认为目的,在自愿的基础上,欲借助于一套规范化的、符合国际通行的能力验证计划设计和实施要求来证明其能力的能力验证计划提供者提供指导。
最新CNAS实验室认可规范文件一览表2019版
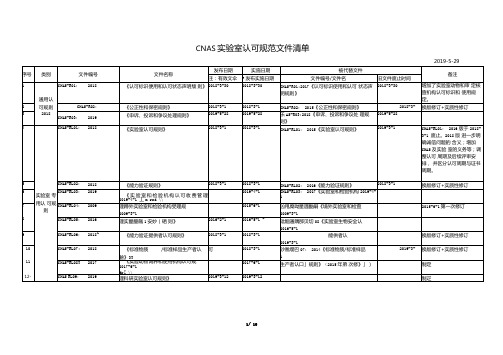
33
34
-^5-
-96-
-St2-
OO
41
4c
类别
文件编号
文件名称
发布日期
实施日期
被代替文件
备注
注:有效文伞
F发布实施日期
文件编号/文件名
旧文件废止时间
CNAS-CL01-A008:2018
《检测和校准实验室能力认可准则 在电磁兼容检测领域的应用说明》
2018-3-1
2018-9-1
am nqj
2020-
-换版修订,实质性变化
2019-2-20第一次修订, 非实质性修订,代替
CNAS-CL01:2018
14
15
实验室 基本认 可准则
CNAS-CL02:2012
CNAS-CL03:2010
《医学实验室质量和能力认可准2015-6-1
则》(2019-2-20第二次修订)(ISO15189:2012)
CNAS-CL08:2013《司法鉴定/法庭科学
30
机构能力认可准则》(2015年第一次修
2020-11-
换版修订,实质性变化
21
CNAS-CL09:2019
《科研实验室认可准则》
2019-3-12
2019-3-12
制定
22
CNAS-CL01-G001:2018
«CNAS-CL01<检测和校准实验室能 力认可准则〉应用要求》
9
CNAS-RL06:
2018~
《能力验证提供者认可规则》
2018-3-1
2018-3-1
能供者认
2019-3-1
换版修订+实质性修订
10
11
能力验证计划提供者评审报告【模板】

能力验证计划提供者评审报告(Report on Provider of Proficiency Testing Schemes)任务编号:机构名称:评审日期:中国合格评定国家认可委员会声明1.本评审报告用于记录中国合格评定国家认可中心(以下简称CNAS)委派的能力验证计划提供者评审活动,并对现场评审结果给出评价,为CNAS评定委员会的评定活动提供可靠依据,其结论在CNAS批准认可前作为参考。
2.现场评审是一种抽样调查活动,不可能包括被评审方的全部活动,评审结果只对评审中检查到的各方面负责,因此,未被评审部分仍可能有不符合存在。
3.评审组人员对评审过程中获得的有关被评审方的所有信息负有保密责任,未经被评审方同意不得向第三方泄露(有关法律要求除外)。
4.本评审报告版权属CNAS所有,未经批准不得翻印。
填表说明1.可用墨笔或计算机填写此表,要求字迹清晰;2.本报告所有填写项目页面不足时,可另附页;3.可选择的项目请在“□”中“∨”;4.本报告附表1“推荐认可的提供者能力范围及其代码”中的描述应细分到CNAS实验室认可领域分类的“分领域”。
当申请的能力范围不能完全覆盖分领域时,应在“备注”栏中填写具备能力或不具备能力的项目的“六位代码”,并在前注明“只做”或“不做”,例如“只做:********,********”;5.本报告附表2中的“授权签字人”指能力验证计划提供者机构中被任命负责签发能力验证计划结果报告的人员;6.评审过程记录和可追溯性信息填写在附件1的“评审说明”栏中;7.“附件4”中关键工作人员应至少包括从事样品制备(含均匀性、稳定性检验或验收)、结果统计和分析、不确定度评价等技术人员;8.对提供者的其他说明可写入“附件5”;9.本评审报告待组长对提供者整改措施有效性(附件6)评价完毕后提交CNAS 能力验证处;10.本报告无评审组成员和被评审方代表的签字无效。
(如有疑问,请与CNAS能力验证处联系。
CNAS—CL03能力验证计划提供者认可准则

CNAS—CL03能力验证计划提供者认可准则CNAS(中国合格评定国家认可委员会)是在国家认可体系下对各类实验室进行认证的机构,其提供的能力验证计划认可准则是评价实验室能力的重要依据。
本文将对CNAS-CL03能力验证计划提供者认可准则进行详细介绍。
首先,CNAS-CL03能力验证计划提供者的认可准则主要包括以下几个方面:1.认可范围:CNAS-CL03能力验证计划提供者认可适用于所有开展实验室能力验证计划的组织,包括实验室、认可机构、生产单位等。
2.认可要求:CNAS-CL03能力验证计划提供者认可要求了解提供者组织的组织结构、人员资质、质量管理体系、资源配置和管理等方面。
提供者组织需要具备足够的技术能力、硬件设施和人员配备,能够根据不同实验室类型和能力范围提供全面的能力验证计划服务。
3.认可过程:CNAS-CL03能力验证计划提供者认可过程包括评审和认可两个阶段。
评审阶段主要是对提供者组织的申请材料进行审核,包括组织结构、人员资质、质量管理体系等。
认可阶段主要是对提供者组织的核心能力进行评估和验证,包括现场考察、技术能力评价等。
4.认可标志:CNAS-CL03能力验证计划提供者认可标志是认可机构对通过认可的提供者组织进行的标识,表明该组织在实验室能力验证计划提供方面具有一定的能力和信誉。
以上是对CNAS-CL03能力验证计划提供者认可准则的简要介绍,下面将进一步探讨其重要性和意义。
首先,CNAS-CL03能力验证计划提供者认可准则对实验室能力验证计划提供者的认证,能够确保他们的技术能力和服务质量得到认可和信任。
这对实验室而言非常重要,因为能力验证计划是评价实验室技术水平和实验室能力的重要手段之一,能力验证计划的准确性和有效性直接关系到实验室的可靠性和可信度。
其次,CNAS-CL03能力验证计划提供者认可准则对实验室能力验证计划提供者的认证,也能够提升市场竞争力。
在众多实验室能力验证计划提供者中,能够通过CNAS-CL03认可的组织将获得公认的认可标志,这将增加客户对其能力验证计划的信任度和选择性,进而提高其市场竞争能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CNAS-CL03能力验证计划提供者认可准则目录前言 (2)第一部分:总则 (3)1.1 范围 (3)1.2 参考文件 (3)1.3 定义 (4)第二部分:管理体系要求 (5)2.1 质量管理体系 (5)2.2 组织和管理 (5)2.3 文件控制 (6)2.4 要求、投标书或合同的评审 (6)2.5 合作方(分包方)的使用 (6)2.6 服务和供给的采购 (6)2.7 客户的反馈 (8)2.8 不符合活动的控制 (8)2.9 纠正措施 (8)2.10 预防措施 (9)2.11 记录 (9)2.12 内部审核 (10)2.13 管理评审 (10)第三部分:技术要求 (11)3.0 总则 (11)3.1 管理、人员和培训 (11)3.2 合作方(分包方) (11)3.3 组织和计划设计的保障 (12)3.4 方法或程序的选择 (16)3.5 能力验证计划的实施 (16)3.6 数据分析和能力验证计划结果的说明 (17)3.7 与参加者的沟通 (19)3.8 保密性 (20)3.9 结果的串通和伪造 (20)前言能力验证是中国合格评定国家认可委员会(英文缩写:CNAS)评定和监督检测、校准、检查等机构技术能力的重要手段之一。
它与现场评审构成了CNAS互为补充的两种能力评价技术。
能力验证也是CNAS维持国际间认可机构相互承认协议(ILAC-MRA 和APLAC-MRA)的基础要求之一。
同时,对于检测、校准、检查机构等,参加能力验证也是一种有效的外部质量保证活动,是其内部质量控制技术的补充。
如果能够证明能力验证计划的运作符合了本准则的要求,CNAS及其评审员就能够更好地利用能力验证计划的结果来为认可的过程提供帮助,同时,也可使计划的其他使用者对能力验证计划的运作产生更多的信任。
本准则为以获得认可或其他承认为目的,在自愿的基础上,欲借助于一套规范化的、符合国际通行的能力验证计划设计和实施要求来证明其能力的能力验证计划提供者提供指导。
本准则是对能力验证计划提供者的能力进行承认的基础。
CNAS依据本准则要求对提供者的能力(含提供者使用的任何分包方和合作方的能力)进行评价。
本准则适用于为能力验证目的而开展的实验室间比对,即确定一个实验室对于特定检测或测量的能力,以及监控实验室的持续能力的活动。
本准则等同采用国际实验室认可合作组织(ILAC)发布的指南文件“ILAC-G13 :Gui delines for the Requirement for the Competence of Providers of Proficiency Testing Schemes”(能力验证计划提供者的能力要求指南)。
对用于能力验证计划中的统计方法和样品制备,CNAS制定了CNAS-GL02《能力验证结果的统计处理和能力评价指南》和CNAS-GL03《能力验证样品均匀性和稳定性评价指南》,供能力验证计划提供者参考。
能力验证计划提供者认可准则第一部分:总则1.1范围本准则规定了能力验证计划的提供者及其有关合作者,为获得CNAS对其提供能力验证计划能力的承认而应遵守的要求。
1.1.1 能力验证计划提供者(以下简称提供者)具有确保其自身及有关合作方都遵守本要求(管理体系要求和技术要求)的责任。
1.1.2 提供者可以使用符合本准则要求的其他方法。
本准则的注释可能提供了指南信息,并不构成本准则的主体部分。
1.1.3 本准则的条款满足ISO/IEC指南43-1:1997、ISO/IEC 17025:1999或ISO 9 000:1994的相关要求。
1.1.4 当用于特定类型能力验证计划的设计和准备时,提供者符合了本准则,也就是符合了ISO9000:1994系列标准的相关要求。
1.2参考文献*ISO/IEC 17025:1999,检测和校准实验室能力的通用要求。
(GB/T15481,IDT)ISO指南35:1989(修订中*),参考物质的认证——综合和统计原理ISO/IEC指南43-1:1997,利用实验室间比对的能力验证——第1部分:能力验证计划的建立和运作。
(GB/T15483.1,IDT)ISO9000:1994(修订中*)系列,质量管理和质量保证标准。
(GB/T19000系列,ID T)欧洲委员会对产品和参考物质认证的准则:1997,BCR/01/97文件A部分(化学)分析实验室能力验证的国际协调议定书。
AOAC 国际期刊,76,No.4, 1993, pp. 926-940基体效应的评价:建议性指南。
NCCLS文件EP-14P。
临床实验室标准国家委员会,Vi llanova,PA,1994Eurachem文件:分析测量中定量的不确定度。
*注:ISO/IEC 17025:2005已经发布,ISO指南35已于2006年正式发布,ISO9000于2000年完成修订并发布。
请各提供者注意使用最新有效版本。
1.3定义本准则除使用了ISO/IEC指南43-1:1997和ISO/IEC17025:1999中所描述的定义之外,还使用下列定义:1.3.1 提供者 Provider从事能力验证计划的设计和实施的机构(公共或私有的组织或公司)。
1.3.2 合作方(分包方) Collaborator/Subcontractor承担能力验证计划提供者的分包活动的机构(公共或私有的组织或公司)。
1.3.3 协调者 Coordinator能力验证计划运作中负责协调所有活动的人。
1.3.4 能力验证计划 Proficiency testing scheme为确定实验室在特定领域的检测、测量或校准能力而设计和运作的实验室间比对。
注:一个计划可覆盖一个特定类型的测试或对一些特定产品、项目或材料的测试。
1.3.5 能力验证轮次 Proficiency testing round一项能力验证计划的一轮独立运作。
第二部分:管理体系要求2.1质量管理体系2.1.1 提供者应建立、实施并维持一个与其活动范围相适应的质量管理体系。
这些活动包括所提供的能力验证的类型、范围和数量。
2.1.2 提供者应确定其方针、目标和承诺并形成文件,以确保和维持能力验证所有方面的质量,包括测试材料质量(例均匀性和稳定性)、特征(例设备校准和测量方法确认)、特性数值的指定(例使用适当的统计程序)、对参加实验室的能力评价、人工制品和测试材料的分发、储存和运输程序、测试结果的统计处理及报告。
质量方针应包含一个依据本准则技术要求(第三部分)实施能力验证计划的承诺。
2.1.3 提供者应建立和维持一个与能力验证类型、范围和数量相适应的文件化的质量管理体系,以确保这些计划符合规定的要求。
提供者的质量体系应涵盖下列内容:a) 能力验证计划的目的、范围、统计设计和图表;b) 运作程序;c) 报告的准备和发布;d) 有关保密和道德程序的政策;e)计算和信息系统;f)有关的合作和分包;g)参加费用;h)可提供的能力验证计划的有效范围;i)参加的总政策;j)计划结果的使用;k)申诉处理程序。
2.1.4 该文件化的质量管理体系应规定提供者及其有关合作方所承担的活动,包括提供者用于确保合作方的所有活动都符合本准则相关条款的政策和程序。
2.1.5 文件化的质量体系应明确技术负责人、质量负责人(无论如何称呼)及协调者的任务和责任,包括确保符合本准则的责任。
2.2 组织和管理2.2.1 提供者或其母体组织应具有法律地位。
2.2.2 提供者:a) 应有经过授权且具有才略的得到且能得到技术人员支持的管理人员,要求这些人员履行其职责、识别质量管理体系或程序中出现的偏离,并采取行动来防止或尽量减少这些偏离;b) 应有措施确保其管理部门和人员能抵御任何商业的、经济的以及其它内外部的可能影响其工作质量的压力;c) 应有政策和程序确保能力验证计划参加者的信息保密和所有权;d) 应有政策和程序避免任何降低其能力、公平性、判断或运作的诚信性的行为;e) 应借助于组织图,确定提供者的组织和管理结构、在母体组织中的地位,以及管理、技术运作、支持服务、合作方和质量管理体系间的关系;f) 应规定可能影响能力验证计划质量的所有管理、执行或核查人员的责任、权力和相互关系;g) 应有为确保能力验证质量所需的技术运作和资源保障负全面职责的技术管理层;h) 应指定一名人员作为质量负责人(无论如何称呼),不管现有的职责,应赋予其在任何时候都能保证本准则得到实施和遵循的责任和权力。
质量负责人应能直接与决定能力验证政策和资源的最高管理层接触;i) 如果可能,为关键管理人员(如协调者、技术负责人和质量负责人)指定代理人。
注:当提供者只有少数人员时,每个人可以担负多项职能,为所有重要职能指定代理人可能并不现实。
2.3 文件控制2.3.1 总则提供者应建立和维持控制所有文件(包括内部形成的文件和来源于外部的文件)以及与质量体系有关的其他信息的程序。
2.3.2 文件的批准和发布2.3.2.1 向质量管理体系中人员发布的所有文件(包括文件化程序),在发布前应由获得授权的人员审核和批准。
应建立质量管理体系文件的目录清单或其他等效方式并易于获得,以识别现行版本的状况,防止使用无效的和/或作废的文件。
2.3.2.2 所用的程序还应确保:a) 所有文件应有唯一性识别;b) 在对能力验证计划有效运作起重要作用的所有作业场所,都能获得相关文件的授权版本;c) 应定期审核文件,必要时应进行修订,以保证持续适用和满足使用的要求;d) 应及时从所有发布或使用处撤除无效或作废的文件,或以其他方式确保防止误用;e) 因法律或知识保存目的而保留的作废文件应有适当的标识。
2.3.3 文件变更2.3.3.1 除非另有特别指定,文件(包括文件化程序)的更改应由原责任人审核和批准。
被指定的人员应获得进行审核和批准所依据的有关背景资料。
只要可行,更改的内容应在文件或适当的附件中标明。
2.4 要求、投标书和合同的评审2.4.1 提供者应评审能力验证计划准备中的每项要求、投标书或合同,以确保:a)这些要求应适当规定、形成文件并易于理解;b)提供者具有满足这些要求的能力和资源;c)解决合同或客户要求与标书间的任何差异。
2.4.2 应保存评审的记录(包括所发生的任何变动), 还应保存在执行合同或要求期间,与客户就其要求或工作结果进行商讨的记录。
2.4.3评审应包括由合作方承担的所有工作。
2.5合作方(分包方)的使用2.5.1 提供者应有评价和选择合作方的程序。
对合作方的评价和选择应基于合作方的能力(包括与任务有关的技术资格和任何特定的质量保证要求)能够符合分包的要求。
合作方需满足的技术要求应等效于本准则第三部分中所阐述的技术要求。
2.5.2 提供者应保存能力验证计划中使用的所有合作方的登记表,包括对其承担分包工作的能力进行评审的记录。
