高中化学硅的性质及其化合物的转化知识点总结归纳
高中化学Si的知识点总结
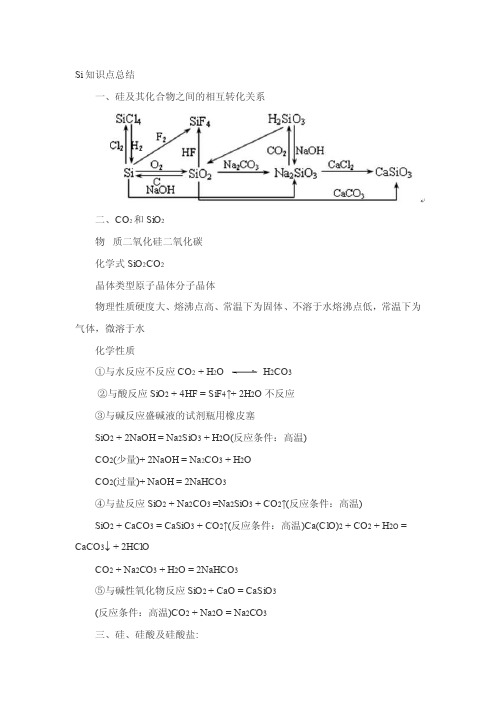
Si知识点总结一、硅及其化合物之间的相互转化关系二、CO2和SiO2物质二氧化硅二氧化碳化学式SiO2CO2晶体类型原子晶体分子晶体物理性质硬度大、熔沸点高、常温下为固体、不溶于水熔沸点低,常温下为气体,微溶于水化学性质①与水反应不反应CO 2 + H2O H2CO3②与酸反应SiO2 + 4HF = SiF4↑+ 2H2O不反应③与碱反应盛碱液的试剂瓶用橡皮塞SiO2 + 2NaOH = Na2SiO3 + H2O(反应条件:高温)CO2(少量)+ 2NaOH = Na2CO3 + H2OCO2(过量)+ NaOH = 2NaHCO3④与盐反应SiO2 + Na2CO3 =Na2SiO3 + CO2↑(反应条件:高温)SiO2 + CaCO3 = CaSiO3 + CO2↑(反应条件:高温)Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClOCO2 + Na2CO3 + H2O = 2NaHCO3⑤与碱性氧化物反应SiO2 + CaO = CaSiO3(反应条件:高温)CO2 + Na2O = Na2CO3三、硅、硅酸及硅酸盐:1.硅:单质硅有晶体硅和无定形硅两种。
晶体硅为原子晶体,灰黑色、有金属光泽、硬度大而脆、熔沸点高。
导电性介于导体和绝缘体之间,是常用的半导体材料。
化学性质:①常温Si + 2F2 = SiF4 ;Si + 4HF = SiF4 + 2H2 ;Si + 2NaOH + H2O = Na2SiO3 + 2H2↑的硅,工业上用焦炭在电炉中还原二氧化硅制取粗硅:SiO2+ 2C = Si + 2CO↑2.硅酸(H2SiO3或原硅酸H4SiO4):难溶于水的弱酸,酸性比碳酸还弱。
3.硅酸钠:溶于水,其水溶液俗称“水玻璃”,是一种矿物胶。
盛水玻璃的试剂瓶要使用橡胶塞。
能与酸性较强的酸反应:Na2SiO3 + 2HCl = H2SiO3↓(白)+2NaCl;Na2SiO3 + CO2 + H2O =H2SiO3↓+ Na2CO3四、水泥、玻璃和陶瓷等硅酸盐产品的主要化学成分、生产原料及其用途硅酸盐材料是传统的无机非金属材料:玻璃、水泥、各种陶瓷等都是以黏土、石英和长石等为原料生产的硅酸盐制品,比较如下(表18—6)硅酸盐产品水泥玻璃原料石灰石、黏土纯碱、石灰石、石英反应原理发生复杂的物理化学变化(不作要求)SiO2 + Na2CO3 Na2SiO3 + CO2↑SiO2 + CaCO3CaSiO3 + CO2↑主要设备水泥回转窑玻璃窑主要成分3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3,Na2SiO3、CaSiO3、SiO2反应条件高温高温陶瓷生产的一般过程:混合→成型→干燥→烧结→冷却→陶瓷,随着现代科学技术的发展,一些具有特殊结构、特殊功能的新型无机非金属材料如高温结构陶瓷、生物陶瓷、压电陶瓷等相继被生产出来。
高一硅及硅的化合物知识点

高一硅及硅的化合物知识点硅(Si)是元素周期表中的第14号元素,属于非金属元素。
硅及其化合物在日常生活和工业生产中具有重要的应用价值。
本文将介绍关于硅及其化合物的知识点。
一、硅的基本性质硅是一种无色、硬度较高、脆性较大的固体物质。
它具有较高的熔点和沸点,不溶于水和大多数常见的溶剂,但能溶于热的氢氟酸和碱性溶液。
硅是一种良好的导热材料,同时具有半导体特性,因此在电子行业中有广泛应用。
二、硅的化合物及应用1. 硅石(SiO2):也称为二氧化硅,是硅最常见的氧化物。
硅石在自然界中广泛存在,常见于石英、石英砂等形式。
它是制备硅金属的重要原料,也用于制备玻璃、陶瓷等材料。
2. 硅酸盐:是一类以硅酸根离子(SiO4^4-)为主的化合物。
硅酸盐在岩石、矿石和土壤中普遍存在,如长石、石英等。
它们具有重要的地质作用,也用于制备建筑材料、陶瓷等。
3. 二氧化硅凝胶:是一种由硅酸盐制备得到的多孔固体材料,具有很高的比表面积和孔隙度。
它被广泛应用于催化剂、吸附剂、保温材料等领域。
4. 硅油:是一种由聚硅氧烷链构成的有机硅化合物,具有良好的润滑性、绝缘性和耐热性。
硅油常用于机械设备的润滑、电子元器件的封装等。
5. 硅树脂:是一类由有机硅聚合物构成的高分子材料,常用于制备塑料、胶黏剂等。
硅树脂具有良好的耐高温性能和化学稳定性,广泛应用于航空航天、电子、汽车等领域。
6. 硅橡胶:是一种由聚硅氧烷和填充剂组成的弹性材料,具有优异的耐高温、耐候性和绝缘性。
硅橡胶常用于制备密封件、隔振垫等。
7. 硅材料在半导体工业中的应用:由于硅具有半导体特性,因此在半导体工业中,硅被广泛应用于制备集成电路、太阳能电池等。
三、硅及其化合物的重要性硅及其化合物在现代工业和科技领域具有重要的地位和应用价值。
硅材料的独特性能使其成为电子行业中不可或缺的材料,半导体工业的发展离不开硅材料。
此外,硅化合物在建筑材料、化工原料、橡胶和塑料等领域也起着重要作用。
高中化学——非金属及化合物知识点总结

高中化学——非金属及化合物知识点总结一、硅及其化合物(一)硅1、硅的存在和物理性质(1)存在:只以化合态存在,主要以SiO2和硅酸盐的形式存在于地壳岩层里,在地壳中含量居第二位。
(2)物理性质:晶体硅是一种灰黑色固体,具有金属光泽,硬而脆的固体,熔沸点较高,能导电,是良好的半导体材料。
2、硅的化学性质3、用途:制造半导体、计算机芯片、太阳能电池。
(二)CO2和SiO2的比较(三)硅酸及硅酸盐1、硅酸(1)物理性质:与一般的无机含氧酸不同,硅酸难溶于水。
(2)化学性质:①弱酸性:是二元弱酸,酸性比碳酸弱,与NaOH溶液反应的化学方程式为:②. 不稳定性:受热易分解,化学方程式为:(3)制备:通过可溶性硅酸盐与其他酸反应制得,如Na2SiO3溶液与盐酸反应:(4)用途:硅胶可用作干燥剂、催化剂的载体等。
2、硅酸盐定义:硅酸盐是由硅、氧、金属所组成的化合物的总称。
(1)硅酸盐结构复杂,一般不溶于水,性质很稳定。
通常用氧化物的形式来表示其组成。
例如:硅酸钠Na2SiO3(Na2O·SiO2),高岭石Al2Si2O5(OH)4(Al2O3·2SiO2·2H2O)。
书写顺序为:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。
注意事项:① 氧化物之间以“·”隔开;②计量数配置出现分数应化为整数。
(2)硅酸钠:Na2SiO3,其水溶液俗名水玻璃,是一种无色粘稠液体,是一种矿物胶,用作黏合剂和木材防火剂。
(四)常见无极非金属材料及其主要用途(五)总结提升1、硅(1)硅的非金属性弱于碳,但碳在自然界中既有游离态又有化合态,而硅却只有化合态。
(2)硅的还原性强于碳,但碳能还原SiO2产生,但Si能跟碱溶液作用放出(3)非金属单质跟碱溶液作用一般无H2H:2(4)非金属单质一般不跟非氧化性酸反应,但硅能跟氢氟酸反应。
(5)非金属单质一般为非导体,但硅为半导体。
2、二氧化硅(1)非金属氧化物的熔沸点一般较低,但SiO2的熔点却很高。
高三化学硅的知识点汇总

引言概述:本文将详细介绍高三化学中硅的知识点,包括硅的性质、制备方法、化合物和应用等方面。
硅是地壳中含量仅次于氧的第二大元素,广泛应用于各个领域,对于学生来说,了解硅的相关知识对于学习化学和理解世界具有重要意义。
正文内容:一、硅的性质1.硅的元素特性:硅是一种非金属元素,具有高熔点、高硬度和较大的晶体结构。
2.物理性质:硅具有金属和非金属的特性,是一种典型的半导体材料。
硅具有较高的熔点和沸点。
二、硅的制备方法1.碳热还原法:通过在高温条件下将二氧化硅与碳反应制备硅。
2.气相沉积法:通过将硅源气体在高温下分解硅沉积在衬底上。
3.电弧法:利用电弧对硅源进行分解制备硅。
三、硅的化合物1.二氧化硅(SiO2):硅最常见的氧化物,广泛应用于建筑材料、光学材料和电子器件中。
2.硅氧烷(SiH4):是一种无色可燃气体,主要用于制备硅材料和有机硅化合物。
3.硅酸盐:硅酸盐是含硅酸根的盐类,具有广泛的用途,如玻璃、水泥等。
四、硅的应用1.电子领域:硅在电子器件中起到重要的作用,如半导体器件、太阳能电池等。
2.建筑材料:硅酸盐玻璃是一种常用的建筑材料,具有优良的透明性和耐高温性。
3.有机硅材料:有机硅材料具有耐高温、耐腐蚀等特性,广泛应用于航天、机械等领域。
4.化妆品和医药领域:有机硅化合物被广泛应用于化妆品和医药领域,如硅油等。
5.硅橡胶:硅橡胶具有优良的耐热性、耐寒性和耐化学侵蚀性,广泛用于制造密封件、导管等。
五、硅的环境意义1.硅对植物生长的影响:硅对植物具有促进生长、增加抗逆性等作用。
2.硅对环境污染的修复:硅可以吸附有机污染物,具有修复污染环境的潜力。
3.硅的循环:硅在自然界中通过硫酸盐和硅酸盐循环,起到重要的地球化学作用。
总结:硅是一种重要的元素,具有广泛的应用和重要的地球化学作用。
通过本文的介绍,我们了解了硅的性质、制备方法、化合物和应用等方面的知识,对于深入学习化学和理解世界有着重要的意义。
希望本文能够帮助读者更好地理解硅的知识点,拓宽知识面。
高中硅知识点总结

高中硅知识点总结1. 硅的性质硅是一种非金属元素,化学性质和碳相似,常温下处于固态。
硅不溶于水,但可溶于浓盐酸和氢氟酸。
硅具有良好的导热性和导电性,因此被广泛应用于半导体行业。
2. 硅的存在形式硅是地壳中最丰富的元素之一,主要以二氧化硅(SiO2)的形式存在于矿物中。
硅也广泛存在于许多天然物质中,如玻璃、水晶、水泥等。
3. 硅的化合物硅主要形成了许多氧化物和硅酸盐。
常见的硅化合物包括二氧化硅、三氧化二硅、硅酸镁、硅酸铝等。
4. 硅的制备硅的制备主要通过还原二氧化硅来实现。
传统的方法是用碳还原法,即在高温下通过碳还原二氧化硅。
近年来,高纯度硅的制备也采用了其他先进的制备方法,如氢气还原法、熔融盐电解法等。
5. 硅的物理性质硅是典型的半导体材料,具有一些特殊的物理性质。
硅的晶体结构属于钻石型结构,具有稳定的晶格和特定的电子能带结构。
此外,硅对光的透射性和折射性也具有特殊的表现,广泛应用于光电子器件中。
6. 硅的化学性质硅在化学反应中表现出一定的反应性,但相对于其他金属元素来说,它的反应性较低。
硅能与氢气、氯气等发生置换和加成反应,产生氢化硅、氯化硅等化合物。
7. 硅的应用硅是现代技术中的重要材料之一,在电子、通讯、光电子、太阳能等领域都有广泛的应用。
硅材料主要应用于半导体器件、太阳能电池、集成电路板等高科技领域。
8. 硅的环境影响硅在环境中的排放和使用会对环境造成一定的影响。
硅的制备和应用过程中会产生高温排放和石棉尘等有害物质,对环境造成污染。
因此,在硅的生产和应用过程中,需要采取有效的环保措施,减少对环境的影响。
综上所述,硅是一种重要的非金属元素,具有广泛的应用价值和发展潜力。
随着技术的不断进步,硅材料在现代科技领域的应用将会越来越广泛,对经济和社会发展都将产生重要的影响。
同时,也需要持续关注硅材料在生产和应用过程中对环境和生态系统的影响,并采取有效的措施加以控制。
硅及其化合物知识结构

硅及其化合物知识结构硅(Si)是地壳中含量第二高的元素,占地壳质量的27.7%,仅次于氧。
在自然界中,硅以硅石(SiO2)的形式存在于石英、玉髓、辉石等矿石中。
硅具有许多重要的特性和广泛的应用,因此对硅及其化合物的研究具有重要意义。
1.硅的物理性质:-硅是一种灰色固体,具有金属和非金属的双重性质。
-具有较高的熔点和沸点,熔点为1414℃,沸点为3265℃。
-硅是一种半导体材料,具有良好的导电性能。
2.硅的化学性质:-硅与氧反应生成二氧化硅(SiO2),是硅的主要氧化物。
Si+O2→SiO23.硅的化合物:-硅在化合物中常以四价态存在,形成四个共价键。
-硅的氢化物:硅的氢化物是一类重要的化合物,如硅烷(SiH4),其化学式为SiH4、硅烷是一种无色有刺激性气体,可由硅与氢反应生成。
Si+2H2→SiH4-硅的卤化物:硅的卤化物包括氟化硅(SiF4)、氯化硅(SiCl4)、溴化硅(SiBr4)和碘化硅(SiI4)。
其中,氯化硅是最重要的一种。
Si+2Cl2→SiCl4-硅的硫化物:硅的硫化物包括二硫化硅(SiS2)和四硫化硅(SiS4)等。
其中,二硫化硅是一种重要的半导体材料,可用于制造光学器件和红外线传感器。
Si+S2→SiS2-硅的氧化物:硅的氧化物主要有二氧化硅(SiO2)和三氧化硅(SiO3)等。
其中,二氧化硅是最常见的氧化物,广泛应用于玻璃、陶瓷、光纤等领域。
Si+O2→SiO24.硅的应用:-硅在电子工业中广泛应用于制造半导体器件,如晶体管、集成电路等。
-硅还可用于制造光纤,用于光通信和光传感器等领域。
-硅的氧化物二氧化硅可用于制造玻璃、陶瓷等材料。
-硅的硅化物可用于制造太阳能电池、LED等光电器件。
-硅的硅烷可用于制造高纯硅材料和化学气相沉积。
总结起来,硅及其化合物的知识结构主要包括硅的物理性质和化学性质,硅的化合物的种类和反应方程式,以及硅的广泛应用领域。
通过深入研究硅及其化合物,我们可以更好地理解和应用这一重要元素。
高中化学硅的知识点

高中化学硅的知识点硅是一种重要的元素,化学符号为Si,位于元素周期表的第14位。
它是地壳中最常见的元素之一,约占地壳质量的27.7%。
硅在自然界中以氧化硅(SiO2)的形式存在,主要以石英、石英砂、硅灰石等矿物的形式存在。
以下是关于高中化学中硅的一些重要知识点:1.硅的性质:硅是一种灰色晶体,与大多数金属不发生化学反应,但在高温下可以与氧、氮、卤素等元素反应。
硅具有高的熔点(1414℃)和沸点(3265℃),是一种良好的导热材料和半导体。
2.硅的制备:硅的主要制备方法是通过冶炼石英矿或其他含硅矿石,通过高温还原的方法得到纯度较高的硅。
3.硅的重要化合物:硅在化合物中形成了许多重要的化合物,如二氧化硅(SiO2),也称为二氧化硅,是最常见的硅化合物。
它是一种无机非金属固体,具有很强的硬度和热稳定性。
另一个重要的硅化合物是硅酸盐,如硅酸钠(Na2SiO3)和硅酸铝(Al2(SiO3)3)等。
4.硅的应用:硅在工业上有广泛的应用。
硅通过加工和改性可以制成硅半导体材料,用于制造电子器件和计算机芯片等高科技领域。
硅也可以制成硅橡胶,用于制造密封件、电线绝缘等。
硅还可以作为合金添加剂,用于改善金属的硬度和耐腐蚀性。
此外,硅还用于生产玻璃、陶瓷、光纤等。
5.硅在生物体中的作用:硅在生物体中也起着重要的作用。
一些植物组织中富含硅,如稻谷的秆和叶片。
硅可以提高植物的机械强度,增加其抗病性和逆境适应能力。
此外,硅还被认为是一种人体所需的微量元素,对于维持骨骼、血管的健康以及预防骨质疏松症等方面有重要作用。
6.硅的环境影响:尽管硅是一种天然存在的元素,但大量的硅可以造成环境问题。
例如,硅在自然界中的含量很高,会导致土壤盐碱化,影响农作物的生长。
此外,硅的粉尘会对人体呼吸系统造成刺激,引发肺部疾病。
7.硅在化学反应中的应用:硅可以用作还原剂,与很多氧化物反应生成相应的金属。
例如,将二氧化硅与铝粉或铁粉加热可以得到相应的金属硅。
高一化学硅知识点思维导图

高一化学硅知识点思维导图硅是一种常见的无机非金属元素,具有广泛的应用领域。
本文将通过思维导图的形式,整理高一化学中与硅相关的知识点,以帮助同学们更好地理解和掌握硅的性质、用途和制备方法。
一、硅的性质1. 物理性质- 硅是地壳中第二丰富的元素,以二氧化硅的形式存在于许多矿石中。
- 硅是无色、无味、无臭、非常稳定的固体,具有金刚石般的硬度和脆性。
- 硅是半导体材料,具有良好的导电性和光电特性。
2. 化学性质- 硅在常温下不与大多数酸和碱反应,但能与氢氟酸和浓硝酸反应。
- 硅能与氧气反应生成二氧化硅,放出大量的热量。
- 硅可与一些金属形成合金,如硅铁、硅铝合金等。
二、硅的用途1. 光电类应用- 因硅具有半导体特性,被广泛应用于光电器件的制造,如太阳能电池板、LED灯等。
- 硅在电子芯片中作为基底材料,用于制造集成电路。
2. 材料类应用- 通过掺杂其他元素和化合物,硅可以改变其电学和光学性质,用于制备硅基材料,如硅胶、硅橡胶。
- 硅是玻璃的主要成分之一,用于制造玻璃器皿、窗户等。
3. 化工类应用- 硅作为添加剂用于制造合成橡胶、油漆、涂料等产品。
- 硅油是一种常见的润滑剂,被广泛应用于机械设备的保养和维护。
三、硅的制备方法1. 硅的提取- 硅的主要提取方法为冶炼石英矿石,石英经过预处理后,与焦炭在高温下反应,生成金属硅。
2. 硅的纯化- 金属硅通过电解法或Zone熔炼法进行纯化,去除杂质,获得高纯度的硅材料。
3. 硅的加工- 高纯度的硅材料可通过溶解、熔融、晶体生长等工艺加工成不同形状和尺寸的硅单晶或多晶。
四、硅材料的性质和应用1. 多晶硅- 多晶硅具有晶粒边界,导电性能较差,用于太阳能电池板的制造。
2. 单晶硅- 单晶硅晶体纯度高,无晶粒边界,电学性能优异,用于制造集成电路的基板。
五、硅的环境和健康风险1. 硅对环境的影响- 工业生产中的硅粉尘、废水和废气可能对环境造成污染,需要进行控制和处理。
2. 硅对人体健康的风险- 长期吸入硅粉尘可能导致硅肺病,对呼吸系统造成危害。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硅的性质及其化合物的转化知识点总结归纳
1、硅的性质及制取
(1)硅的化学性质
①常温下能与F2、HF、强碱等反应
2F2+Si=SiF4,
Si+4HF=SiF4↑+2H2↑,
Si+2NaOH+H2O=Na2SiO3+2H2↑。
②加热下能与O2、Cl2、C等反应
(2)硅的制取
特别提醒
(1)硅与碳相似,常温下化学性质都不活泼。
(2)虽然碳比硅活泼,但碳在自然界中以游离态和化合态存在,而硅只能以化合态存在,原因是硅是亲氧元素。
2、硅及其化合物的转化关系
特别提醒
(1)因为SiO2不溶于水,因此不能用SiO2与水反应制备硅酸。
(2)制备硅酸的原理是“强酸制弱酸”,这一原理可用来设计酸性强弱比较的实验,例如证明酸性:盐酸>碳酸>硅酸。
【名师点睛】硅及其化合物转化关系题中的突破口
(1)硅、二氧化硅的结构:如硅与金刚石结构相似。
(2)硅、二氧化硅的物理性质:如硬度大,熔、沸点高。
(3)特征性质
①与强碱溶液反应放出H2的非金属单质是硅。
②不与H2O反应、能与氢氟酸反应(或雕刻玻璃)的酸性氧化物为SiO2。
③难溶于水的无机酸是H2SiO3。
判断正误(正确的打“√”,错误的打“×”)。
(1)(2017年天津理综,3)硅太阳能电池工作时,光能转化成电能,与氧化还原反应无关。
( )
(2)(2015年江苏,8)下列转化均能一步实现:粗硅SiCl4Si。
( )
(3)(2014年江苏,4)晶体硅熔点高硬度大,可用于制作半导体材料。
( )
(4)(2013年北京理综,6)硅太阳能电池可以将太阳能转化为热能。
( )
【答案】(1)√(2)√(3)×(4)×
判断正误(正确的打“√”,错误的打“×”)。
(1)(2017年江苏,3)SiO2的硬度大,可用于制造光导纤维。
( )
(2)(2016年全国Ⅲ卷,7) HF能与SiO2反应,故常用氢氟酸在玻璃器皿上刻蚀标记。
( )
(3)(2016年江苏,9)下列转化均能一步实现:SiO2SiCl4Si。
( )
(4)(2015年海南,7)可用磨口玻璃瓶保存NaOH溶液。
( )
(5)(2014年海南,9)玻璃容器可长期盛放各种酸。
( )
(6)(2015年安徽理综,9)SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化
物。
( )
【答案】(1)×(2)√(3)×(4)×(5)×(6)×
(2018年天津理综,7节选)下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。
回答下列问题:
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H+除外):,Mg在元素周期表中的位置:,Mg(OH)2的电子式:。
(2)A2B的化学式为。
反应②的必备条件是。
上图中可以循环使用的物质有。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
【答案】(1)r(Mg2+)<r(n3-)<r(cl-)第三周期Ⅱa族mg2+< p=""></r(n3-)<r(cl-)第三周期Ⅱa族mg2+< >
(2)Mg2Si熔融,电解NH3、NH4Cl
(3)SiC
(4)2Mg(OH)2+2SO2+O2 2MgSO4+2H2O
判断正误(正确的打“√”,错误的打“×”)。
(1)(2017年北京理综,10)将SO2通入Na2SiO3溶液中产生胶状沉淀,说明酸性:H2SO3>H2SiO3。
( )
(2)(2016年四川理综,1)硅胶可作袋装食品的干燥剂。
( )
(3)(2016年江苏,5)向Na2SiO3溶液中滴加稀盐酸的离子方程式为
Na2SiO3+2H+H2SiO3↓+2Na+。
( )
(4)(2015年山东理综,12)向Na2SiO3溶液中通入过量SO2的离子方程式为
Si+SO2+H2O H2SiO3↓+S。
( )
(5)(2014年全国Ⅱ卷,7)用含硅胶、铁粉的透气小袋与食品一起密封包装过程没有发生化学反应。
( )
【答案】(1)√(2)√(3)×(4)×(5)×。
