(完整word版)高中化学离子浓度大小比较练习题(附答案)
电解质溶液离子浓度大小比较习题及答案

电解质溶液离子浓度大小比较1.常温下,0.1 mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-10,下列叙述正确的是(D)A.溶液中水电离出的c(H+)=10-10 mol/LB.溶液中c(H+)+c(A-)=0.1 mol/LC.与0.05 mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c (H+)D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大2.0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是D A.c(Na+)>c(Cl-)>c(OH-)>c(H+) B.c(Na+)=c(Cl-)>c(H+)>c(OH-)C.c(Cl-)>c(Na+)>c(OH-)>c(H+) D.c(Na+)=c(Cl-)>c(OH-)>c(H+)3. 0.1 mol•L-1 KHS溶液中下列表达式不正确的是(B)A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-)B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)C.c(HS-)+ c(S2-)+ c(H2S)= 0.1 mol•L-1D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)4. 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。
则下列描述正确的是(A)A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和5.. 在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是(D)A.c (Na+)=c(CH3COO-)+c(CH3COOH)B.c(H+)=c(CH3COO-)+c(OH-)C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+)D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)6. 某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是(A)A. 若溶液中c(A-)=c(Na+),则溶液一定呈中性B. 溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)C. 若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)D. 若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)7. 草酸是二元中强酸,草酸氢钠溶液显酸性。
离子浓度大小比较练习题

离子浓度大小比拟习题一〔12.17〕1. 对于0.1 mol·L-1 Na2SO3溶液,正确的选项是A.升高温度,溶液pH降低B.c(Na+)=2c(SO2-3)+c(HSO-3)+c(H2SO3) C.c(Na+)+c(H+)=2c(SO2-3)+2c(HSO-3)+c(OH-)D.参加少量NaOH固体,c(SO2-3)与c(Na+)均增大2. 常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,那么此溶液中A c(HCOO-) > c(Na+)B c(HCOO-) < c(Na+)C c(HCOO-) = c(Na+)D 无法确定c(HCOO-) 和c(Na+) 的关系3.以下关于电解质溶液的表达正确的选项是A.常温下,在pH=7的醋酸钠和醋酸混合溶液中,c(CH3COO-)>c(Na+)B.稀释醋酸溶液,溶液中所有离子的浓度均降低C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-)D.mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)4.以下溶液中微粒浓度关系一定正确的选项是A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH+4)B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+)C.mol·L-1的硫酸铵溶液中:c(NH+4)>c(SO2-4)>c(H+)D. mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)5. 将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,以下关系式正确的选项是A.c(Cl-)>c(NH+4)>c(OH-)>c(H+) B.c(NH+4)>c(Cl-)>c(H+)>c(OH -)C.c(Cl-)>c(NH+4)>c(H+)>c(OH-) D.c(NH+4)>c(Cl-)>c(OH-)>c(H+) 6. ·L-NaOH溶液中参加同体积、同浓度的HAc溶液,反响后溶液中各微粒的浓度关系错误的选项是A. C〔Na+〕>C〔Ac-〕>C〔H+〕>C〔OH-〕B.C〔Na+〕>C〔Ac-〕>C〔OH-〕>C〔H+〕C.C〔Na+〕=C〔Ac-〕>C〔HAc〕D.C〔Na+〕+C〔H+〕=C〔Ac-〕+C〔OH-〕7.4NO3溶液与0.1mol/L的NaOH溶液等体积混合,以下有关混合溶液中微粒的浓度关系正确的选项是A、c(NH4+)=c(Na+)>c(OH—)>c(NH3·H2O)B、c(NH4+)=c(Na+)>c(NH3·H2O)>c(OH—)C、c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH—)D、c(NH4+)+c(Na+)+c(H+)=c(OH—)+c(NO3—)8.室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,以下关于该混合溶液的表达错误的选项是A.假设pH>7,那么一定是c1V1=c2V2B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.当pH=7时,假设V1=V2,那么一定是c2>c1D.假设V1=V2,c1=c2,那么c(CH3COO-)+c(CH3COOH)=c(Na+)9. HA为酸性略强于醋酸的一元弱酸,mol·L-1 NaA溶液中,离子浓度关系正确的选项是A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+)C.c(Na+)+c(OH-)=c(A-)+c(H+) D.c(Na+)+c(H+)=c(A-)+c(OH-) 10.乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,以下排序正确的选项是A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+) 11. 有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。
高中化学盐溶液中离子浓度大小比较专项训练题(附答案)

高中化学盐溶液中离子浓度大小比较专项训练题一、单选题1.某二元酸(H 2A)在水中的电离方程式为:H 2A=H ++HA -,HA H ++A 2-(Ka=1.0×10-2),下列说法正确的是( )A .在0.1mol/L 的H 2A 溶液中,c(H +)=0.2mol/LB .在0.1mol/L 的Na 2A 溶液中,c(A 2-)+c(HA -)+c(H 2A)=0.1mol/LC .0.1mol/L 的NaHA 溶液中离子浓度为:c(Na +)>c(HA -)>c(H +)>c(A 2-)>c(OH -)D .分别将浓度均为0.1mol/L 的NaHA 和Na 2A 溶液等体积混合,其pH 一定大于72.HClO 4、H 2SO 4、HNO 3和HCl 都是强酸,它们的酸性在水溶液中差别不大。
以下是某温度下这四种酸在冰醋酸中的电离常数:A .在冰醋酸中这四种酸都没有完全电离B .在冰醋酸中HClO 4是这四种酸中最强的酸C .在冰醋酸中H 2SO 4的电离方程式为H 2SO 4=2H ++24SO -D .水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱 3.已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:A.相同条件下,同浓度的H 2SO 3溶液和H 2CO 3溶液的酸性,后者更强B.Na 2CO 3溶液中通入少量SO 2: 22232332SO H O S CO 2HCO O ---++=+C.NaClO 溶液中通入少量CO 2: 22232ClO CO H O 2HClO CO --++=+D.向氯水中分别加入等浓度的NaHCO 3和NaHSO 3溶液,均可提高氯水中HClO 的浓度4.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )A.向0.10-143mol L NH HCO ⋅溶液中通入+-2-2433CO :(NH )(HCO )(CO )c c c =+ B.向0.10-13mol L NaHSO ⋅溶液中通入++2-343NH :(Na )(NH )(SO )c c c >>C.0.10-123mol L Na SO ⋅溶液通入+2--23323SO :(Na )2[(SO )(HSO )(H SO )]c c c c =++D.0.10-13mol L CH COONa ⋅溶液中通入HCl:+-3(Na )(CH COOH)(Cl )c c c >=5.常温下,向等体积(0mL V )、等浓度(0.1 1mol L -)的盐MCl 、NaR 、MR 溶液中分别加入蒸馏水,使其稀释至V mL ,稀释过程中,溶液的pH 与0lg VV 的关系如图所示。
高中化学离子浓度大小比较练习题 附答案

高中化学离子浓度大小比较练习题附答案1. 将0.5mol/L的NaCl溶液和0.3mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
2. 将0.3mol/L的Na2SO4溶液和0.4mol/L的NaCl溶液混合,哪个离子浓度更大?答:Na+离子浓度相同。
3. 将0.2mol/L的K2SO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
4. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Na2SO4溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
5. 将0.4mol/L的NaCl溶液和0.2mol/L的KCl溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
6. 将0.3mol/L的Ca(NO3)2溶液和0.2mol/L的Na2CO3溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
7. 将0.1mol/L的NaOH溶液和0.2mol/L的HCl溶液混合,哪个离子浓度更大?答:H+离子浓度更大。
8. 将0.2mol/L的K2CO3溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:CO32-离子浓度更大。
9. 将0.3mol/L的NaCl溶液和0.1mol/L的MgCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
10. 将0.2mol/L的FeSO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
11. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Ca(NO3)2溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
12. 将0.3mol/L的KCl溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
13. 将0.2mol/L的Na2CO3溶液和0.1mol/L的NaOH溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
高考化学选择题专项训练---离子浓度大小比较和三大守恒式(含答案和解析)
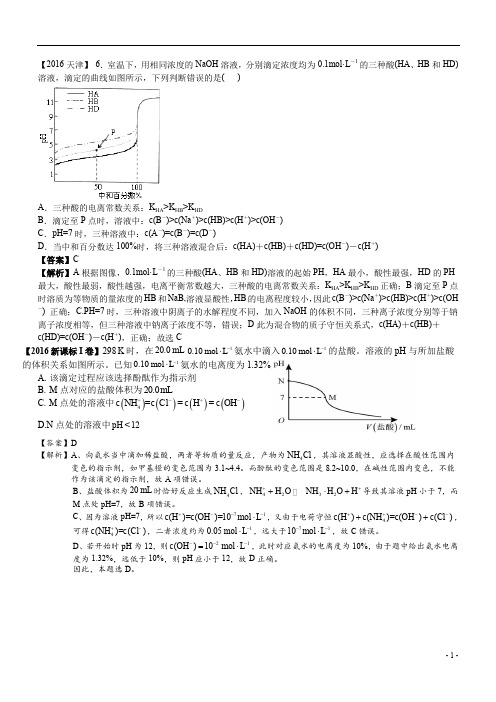
【2016天津】 6.室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol·L -1的三种酸(HA 、HB 和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )A .三种酸的电离常数关系:K HA >K HB >K HDB .滴定至P 点时,溶液中:c(B -)>c(Na +)>c(HB)>c(H +)>c(OH -)C .pH=7时,三种溶液中:c(A -)=c(B -)=c(D -)D .当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH -)-c(H +) 【答案】C【解析】A 根据图像,0.1mol·L -1的三种酸(HA 、HB 和HD)溶液的起始PH ,HA 最小,酸性最强,HD 的PH 最大,酸性最弱,酸性越强,电离平衡常数越大,三种酸的电离常数关系:K HA >K HB >K HD 正确;B 滴定至P 点时溶质为等物质的量浓度的HB 和NaB,溶液显酸性,HB 的电离程度较小,因此c(B -)>c(Na +)>c(HB)>c(H +)>c(OH-) 正确;C.PH=7时,三种溶液中阴离子的水解程度不同,加入NaOH 的体积不同,三种离子浓度分别等于钠离子浓度相等,但三种溶液中钠离子浓度不等,错误;D 此为混合物的质子守恒关系式,c(HA)+c(HB)+c(HD)=c(OH -)-c(H +),正确;故选C【2016新课标I 卷】298K 时,在20.0mL 10.10mol L -⋅氨水中滴入10.10mol L -⋅的盐酸。
溶液的pH 与所加盐酸的体积关系如图所示。
已知10.10mol L -⋅氨水的电离度为1.32%,下列有关叙述正确的是A. 该滴定过程应该选择酚酞作为指示剂B. M 点对应的盐酸体积为20.0mLC. M 点处的溶液中()()()()++4NH Cl =H =OH c =c c c --D.N 点处的溶液中pH <12【答案】D【解析】A 、向氨水当中滴加稀盐酸,两者等物质的量反应,产物为4NH Cl ,其溶液显酸性,应选择在酸性范围内变色的指示剂,如甲基橙的变色范围为3.1~4.4。
盐溶液中的离子浓度大小比较练习题(附答案)

盐溶液中的离子浓度大小比较练习题一、单选题1.—定温度下,下列溶液的离子浓度关系式正确的是( ) A.pH=5的2H S 溶液中,+-5-1(H )(HS )110mol L c c -==⨯⋅ B.pH=a 的氨水溶液,稀释10倍后,其pH=b ,则a =b +1C.pH=2的224H C O 溶液与pH=12的NaOH 溶液任意比例混合:++--24(Na )(H )(OH )(HC O )c c c c +=+D.pH 相同的①3CH COONa ②3NaHCO ③NaClO 三种溶液的+(Na )c :①>②>③ 2.常温下,下列溶液中的微粒浓度关系正确的是( )A .新制氯水中加入固体NaOH :c (Na +)=c (Cl -)+c (ClO -)+c (OH -)B .pH =8.3的NaHCO 3溶液:c (Na +)>c (3HCO -)>c (23CO -)>c (H 2CO 3)C .pH =11的氨水与pH =3的盐酸等体积混合:c (Cl -)=c (+4NH )>c (OH -)=c (H +) D .0.2mol·L -1 CH 3COOH 溶液与0.1mol·L -1 NaOH 溶液等体积混合:2c (H +)-2c (OH -)=c (CH 3COO -)-c (CH 3COOH)3.下列过程或现象与盐类水解无关的是( ) A.纯碱溶液去油污B.铁在潮湿的环境下生锈C.加热氯化铁溶液颜色变深D.浓硫化钠溶液有臭味4.化学与社会、生活密切相关。
对下列现象或事实的解释正确的是( )5.向1L 含0.01mol NaAlO 2和0.02mol NaOH 的溶液中缓慢通入二氧化碳,随n(CO 2)增大,先后发生三个不同的反应,当0.01mol<n(CO 2) ≤0.015时发生的反应是:2NaAlO 2+ CO 2+2H 2O=2Al(OH)3↓+Na 2CO 3。
高中化学学案——离子浓度大小比较(含答案)_定稿

离子浓度大小比较编号:31班级组别姓名 .【学习目标】1、能够准确地判断离子浓度的大小。
2、小组合作探究守恒法判断离子浓度的方法。
3、以极度的热情全力以赴投入课堂,体验学习的快乐。
【使用说明】利用一节课完成导学案,收齐后及时批改。
下节课学生先自纠10分钟,然后针对不会的问题讨论10分钟,学生展示教师点拨20分钟,最后用5分钟搞好落实并进行当堂检测。
【基础自学】离子浓度大小比较1、单一溶质溶液:(离子浓度按由大到小的顺序排列)Na2CO3溶液 _____________________________________________ NaHCO3溶液 _____________________________________________ 2、混合溶液:例1.物质的量浓度相同的CH3COOH与CH3COONa溶液等体积混合后,溶液中离子浓度关系错误的是( )A.c(Na+) + c(H+)=c(OH-) + c(CH3COO-)B.c(CH3COOH) + c(CH3COO-)=2c(Na+)C.c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)D.c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)>c(OH-)练习1.将0.2mol/L HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),下列关系式正确的是( )A.c(HCN)<c(CN-) B.c(H+)<c(OH-)C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.2 mol/L【小结】混合溶液中离子浓度大小的比较方法:3、不同溶液中同一离子浓度大小比较:例2.等物质的量浓度的下列四种溶液中,NH4+浓度最大的是( )A.NH4Cl B.NH4 HCO3 C.NH4HSO4 D.NH4NO3【小结】不同溶液中同一离子浓度大小比较方法:4、溶液中的守恒关系:例3:在Na2CO3溶液中下列关系式错误的是( )A.c(Na+) + c(H+) = c(OH-) + c(CO32-)B.c(OH-) =c(H+) + c(HCO3-) + 2c(H2CO3)C.c(Na+) = 2c(CO32-) + 2c(HCO3-) + 2c(H2CO3)D.c(Na+) + c(H+) = c(OH-) + 2c(CO32-) + c(HCO3-)【合作探究】★★1、某二元酸(化学式H 2A 表示)在水中的电离方程式为:H2A=H+ + HA-;HA-H+ + A2-请回答下列问题:⑴ Na2A 溶液显 (填“酸性”“中性”或“碱性”),理由是(用离子方程式表示)__________⑵ 若0.1mol/LNaHA溶液的PH=2,则0.1mol/LH2A溶液中H+的物质的量浓度可能0.11mol/L(填“>” “<”或“=”),理由是⑶ 0.1mol/LNaHA溶液中各种离子浓度由大到小的顺序是 ______2、现有常温下的0.1mol/L纯碱溶液:⑴ 你认为该溶液呈碱性的原因是(用离子方程式表示):________________________。
高中化学盐溶液中的离子浓度大小比较专项练习(附答案)

2020年03月21日高中化学盐溶液中的离子浓度大小比较专项练习学校:___________考号:___________注意事项:注意事项:1 2、请将答案正确填写在答题卡上第1卷一、单选题-)=0.1mol 的HA 、NaA 混合物溶于水形成1 L 溶液,溶液中c (HA)、c (A -)与pH 的关系如图所示。
下列叙述中正确的是( )A.a 线表示的是c (A -)的变化B.pH=6 时,c (Na +)+c (HA)>0.1 mol/LC.298 K 时,A -的水解平衡常数(K h )的数量级为10-10D.若将等物质的量的HA 、NaA 溶于水中,所得溶液pH 恰好为4.752.常温下,某化学学习小组对某些电解质溶液作出如下分析。
其中正确的是( ) ①将1mL pH=3的强酸溶液加水稀释至100mL 后,溶液的pH=1②1L 0.50mol·L -1的NH 4Cl 溶液与2L 0.25mol·L -1的NH 4Cl 溶液相比,前者所含+4NH 的物质的量大③pH=8.3的NaHCO 3溶液:[Na +]>[-3HCO ]>[2-3CO ]>[H 2CO 3]④pH=4、浓度均为0.1mol·L -1的CH 3COOH 、CH 3COONa 的混合溶液:[CH 3COO -]-[CH 3COOH]=2×(10-4-10-10)mol·L -1A.①②B.②③ C .①③ D.②④3.将0.2mol·L -1NaHCO 3溶液与0.1mol·L -1KOH 溶液等体积混合,下列关于所得溶液的关系式正确的是( )A.0.2mol·L -1=c(HCO 3-)+c(CO 32-)+c(H 2CO 3) B.c(Na +)>c(K +)>c(HCO 3-)>c(CO 32-)>c(OH -)>c(H +)C.c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1mol·L-1D.3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)4.室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
高中化学复习考点知识专题训练43---溶液中离子浓度的大小比较(含答案解析)

D.向 0.1mol·L-1 的氨水中加入少量硫酸铵固体,则溶液中 c(OH-)/c(NH3·H2O)增大
7.物质的量浓度相同的下列溶液:①
Na2CO3 ②
NaHCO3 ③
H2CO3 ④
( NH4
) 2
CO3
按
c(CO32− ) 由小到大顺序排列正确的是( )
A.④<③<②<①
B.③<②<①<④
C.③<②<④<①
c(CH3COO- )- C(CH3COOH) =[2 × (10-4 –l0-10)] mol • L-1
D.室温时,加水稀释 0.1 mol • L-1 CH3COONa 溶液,溶液中 c(CH3COOH) • C(OH)/C(CH3COO- )的值不断增大
11.将 10 mL0.2 mol/L 氨水和 10 mL0.1 mol/L 盐酸混合后,溶液里各种离子物质的量浓 度的关系是 ( )
( ) ( ) ( ) D. c H+ + c (H2RO3 ) = c RO32− + c OH−
( 13.四甲基氢氧化铵
( CH3
) 4
NOH
是强碱,常温下甲胺
CH3 NH2 ⋅ H2O) 的电离常数为
Kb ,且 pKb = -lgKb =3.38 。常温下,在体积均为 20 mL、浓度均为 0.1 mol ⋅ L-1 的四甲基
A. c (OH-) = c( NH+4 ) + c (H+)
B.
c
(Cl-)>
c(
NH
+ 4
)>
c
(H+)
>
c
(OH-)
C.
c(
离子浓度大小比较高考试题(带解析)

例1.下列浓度关系正确的是A .氯水中:c (Cl 2)=2c (ClO -)+c (Cl -)+C(HCl);B .氯水中:c (Cl -)>c (H +)>c (OH -)>c (ClO -)C .等体积等浓度的氢氧化钠与醋酸混合:c (Na +)=c (CH 3COO -)D .Na 2CO 3溶液中:c (Na +)>c (CO 32-)>c (OH -)>c (HCO 3-)>c (H +)解析:氯气在水中与水反应是可逆反应,物料守恒不成立,A 错误;Cl 2+H 2O=HCl+HClO ,HCl 中电离的H +与Cl -浓度相等,再加上HClO 会电离出H +,所以H +浓度一定大于Cl -浓度,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好完全反应生成醋酸钠,因CH 3COO -水解,所以Na +浓度大于CH 3COO -的浓度,C 错误。
答案:D 。
例2.下列各溶液中,微粒的物质的量浓度关系正确的是A .0.1mol ·L -1 Na 2CO 3溶液:c (OH -)=c (HCO 3-)+c (H +)+2c (H 2CO 3)B .0.1mol ·L -1NH 4Cl 溶液:c (NH 4+)=c (Cl -)C .向醋酸钠液中加适量醋酸得酸性混合液:c (Na +)>c (CH 3COO -)>c (H +)>c (OH -)D .向硝酸钠溶液中滴加稀盐酸得到的pH =5的混合溶液:c (Na +)=c (NO 3-)解析: A 根据质子守恒,水电离出的H +和OH -的物质的量相等,Na 2CO 3溶液中H +分别以HCO 3-、H +、H 2CO 3形式存在,故A 对,B 中由于NH 4+水解,c (NH 4+与c (Cl -)不等,B 错,C 中电荷守恒有:c (Na +)+ c (H +)==c (OH -)+ c (CH 3COO -),因为c (H +)>c (OH -),故c (CH 3COO -)>c (Na+),C 错。
离子浓度大小比较专题训练

离子浓度大小比较专题训练考纲要求:它能掌握强弱电解质、电离平衡、水的电离、溶液的pH、离子反应、盐类水解等基本概念。
掌握程度及对这些知识的综合运用能力。
知识精讲:一、离子浓度关系一顺序:大小顺序:①给出量大的>给出量小的。
如Na2CO3溶液中c(Na+)>c(CO32-);②直接给出的>过程产生的。
电离和水解过程一般较微弱,产生的离子的浓度一般都较小。
如氯化铵溶液中c(Cl-)和c(NH4+)一定大于电离或水解产生的c(H+)和c(OH-)。
③主要过程产生的>次要过程产生的。
碳酸氢钠溶液中,碳酸氢根离子即能发生电离又能发生水解,但水解程度大于电离程度,故c(H+)<c(OH-)。
三守恒:理解三种守恒关系以0.1mol/LNa2CO3溶液为例,分析在存在的反应有(写离子方程式)1、大小顺序:。
2、电荷守恒:。
3、物料守恒:考虑水解前后C元素守恒,。
4、质子守恒:由水电离出的c(H+)水=c(OH―)水。
得质子守恒关系为:二、解题思路:确定溶质成分→书写发生的过程方程式→确定过程的主次→排出离子浓度大小顺序.三、典型题型:Ⅰ、单一溶液离子浓度比较:1、弱酸或弱碱溶液例1、在0.1mol/L的H2S溶液中,下列关系错误的是()A.c(H+)=c(HS-)+c(S2-)+c(OH-)B.c(H+)=c(HS-)+2c(S2-)+c(OH-)C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L例2、室温下,0.1mol/L 的氨水溶液中,下列关系式中不正确的是( )A. c(OH -)>c(H +)B.c(NH 3·H 2O)+c(NH 4+)=0.1mol/L C.c(NH 4+)>c(NH 3·H 2O)>c(OH -)>c(H +) D.c(OH -)=c(NH 4+)+c(H +)2、一元强酸弱碱盐或弱酸强碱盐溶液: 例3、 CH 3COONa 溶液中存在如下关系:大小顺序: 电荷守恒: 物料守恒: 质子守恒: 跟踪练习:在氯化铵溶液中,下列关系正确的是( )A.c(Cl -)>c(NH 4+)>c(H +)>c(OH -)B.c(NH 4+)>c(Cl -)>c(H +)>c(OH -)C.c(NH 4+)=c(Cl -)>c(H +)=c(OH -) D.c(Cl -)=c(NH 4+)>c(H +)>c(OH -)3、多元强酸弱碱盐或弱酸强碱盐溶液: 例4、Na 2S 溶液中存在如下关系:大小顺序: 电荷守恒: 物料守恒: 质子守恒: 4.多元弱酸酸式盐溶液:①以水解为主呈碱性的:NaHCO 3 、NaHS 、Na 2HPO 4等; ②以电离为主呈酸性的:NaHSO 4 、NaHSO 3、NaH 2PO 4等。
离子浓度大小比较专题(有答案)

离子浓度大小比较专题1、在0.1mol/L 的NH 3·H 2O 溶液中,下列关系正确的是( A )A 、C(NH 3·H 2O)>C(OH -)>C(NH 4+)>C(H +)B 、C(NH 4+)>C(NH 3·H 2O)>C(OH -)>C(H +)C 、C(NH 3·H 2O)>C(NH 4+)= C(OH -)>C(H +)D 、C(NH 3·H 2O) >C(NH 4+)>C(H +)>C(OH -)2、在氯化铵溶液中,下列关系式正确的是【 A 】A .C (Cl -)>C(NH 4+)>C(H +)>C(OH -)B .C(NH 4+)>C (Cl -)>C(H +)>C(OH -)C .C (Cl -)=C(NH 4+)>C(H +)=C(OH -)D .C(NH 4+)=C (Cl -)>C(H +)>C(OH -)3、在Na 2S 溶液中存在多种微粒,下列关系正确的是【 B 】A .C(OH -) = C (HS -)+ C(H +) + C(H 2S) B. C(OH -) = C (HS -)+ C(H +)+2 C(H 2S)C .C(Na +) = C(S 2-)+ C (HS -) + C(H 2S)D .C(Na +) = C(S 2-)+ C (HS -)+2 C(H 2S)4、用物质的量都是0.1 mol 的CH 3COOH 和CH 3COONa 配制成1L 混合溶液,已知其中C(CH 3COO -)>C(Na +),对该混合溶液的下列判断正确的是【B 】A .C(H +)<C(OH -)B .C(CH 3COOH)+C(CH 3COO -)=0.2mol/LC .C(CH 3COOH)>C(CH 3COO -)D .C(CH 3COO -)+C(OH -)=0.2 mol/L5、某二元弱酸的酸式盐NaHA 溶液,若PH< 7, 则下列关系不正确的是【 B 】A .C(Na +)>C(HA -)> C(H +)>C(A 2-)> C(OH -) B. C(H +) + C(A 2-) = C(OH -)+ C(H 2A)C .C(Na +)+ C(H +) = C(HA -)+2 C(A 2-)+ C(OH -)D .C(Na +)= C(HA -) +C(H 2A) + C(A 2-)6、标准状况下,向3mol/L 的NaOH 溶液100 ml 中缓缓通入4.48LCO 2气体,充分反应后溶液中离子浓度大小排列顺序正确的是【 D 】A. C(Na +) > C(CO 32-) > C(HCO 3-) > C(OH -) > C(H +-)B. C(Na +) > C(CO 32-) = C(HCO 3-) > C(OH -) > C(H +-)C. C(Na +) > C(HCO 3-) > C(OH -) > C(CO 32-) > C(H +-)D. C(Na +) > C(HCO 3-) > C(CO 32-) > C(OH -) > C(H +-)7、某酸式盐NaHY 的水溶液显碱性,下列叙述正确的是【 C 】A .H 2Y 的电离方程式:H 22H + + Y 2-B .HY - 离子水解方程式:HY - + H 23O + + Y 2-C .该酸式盐溶液中离子浓度关系C(Na +) 〉C(HY -) 〉C(OH -) 〉C(H +)〉C(Y 2-)D .该酸式盐溶液中离子浓度关系C(Na +) 〉C(HY -) 〉C(OH -)〉C(Y 2-) 〉C(H +)8、用物质的量都是0.01mol 的HCN 和NaCN 配成1L 混合溶液,已知其中C(CN -)<C(Na +),对该溶液的下列判断不正确的是( A )A 、C(H +)>C(OH -)B 、C(OH -)>C(H +)C 、C(HCN)>C(CN -)D 、C(HCN)+ C(CN -)=0.02mol/L。
最全面高考化学离子浓度大小比较应用专题练习题2021

盐类水解应用练习题1. 25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH = 7 时,下列关系正确的是2-2-+ + A. c(NH 4 )=c(SO 4 ) C. c(NH 4 )<c(SO 4 )2. 室温下,下列溶液等体积混合后,所得溶液的 B. c(NH 4 )>c(SO 4 )2--2-+ + + D. c(OH)+c(SO 4 )=c(H )+c(NH 4 )pH 一定大于 7 的是A. 0.1mol/L 的盐酸和B. 0.1mol/L 的盐酸和C. pH = 4 的醋酸溶液和 3.将 0.2mol/L 的 HCN 是-A. c(HCN) < c(CN )0.1mol/L 的氢氧化钠溶液 0.1mol/L 的氢氧化钡溶液 pH = 10 的氢氧化钠溶液D. pH = 4 的盐酸和 pH = l0 的氨水溶液和 的 溶液等体积混合后, 溶液显碱性, 下列关系式中正确的0.1mol/L NaOH + -B. c(Na )> c(CN )D. c(HCN) + c(CN )= 0.1mol/L盐酸等体积混合后,溶液中有关离子浓度的关系,正确的是 ---C. c(HCN) - c(CN )= c(OH )将 0.2mol/L 醋酸钾溶液与 4. 0.1mol/L --+3COO )> c(Cl )> c(H )> c(CH 3COOH) 3COO)> c(Cl )> c(CH 3 COOH) > c(H )A. c(CHB. c(CHC. c(CHD. c(CH --+--+3COO )>c(Cl )=c(H )> c(CH 3COOH) > c(H ) --+3COO )=c(Cl )>c(CH 3COOH) 若 pH = 3 的酸溶液与 pH = 11 的碱溶液等体积混合后溶液呈碱性,其原因可能是 B. 强酸溶液和弱碱溶液反应 D. 一元强酸溶液和一元强碱溶液反应5. A. 生成了一种强碱弱酸盐 C. 弱酸溶液和强碱溶液反应常温下在 10mL pH=10 的 KOH 溶液中,加入 pH=4 的一元酸 HA 溶液至 pH 刚好等于 7( 假设反应前6. 后体积不变 ),则对反应后溶液的叙述正确的是 --A. c(A )= c(K +) C. V( 总 ) ≥ 20mL 下列叙述正确的是B. c(H +)= c(OH ) D. V( 总 ) ≤ 20mL< c(K +)< c(A +) 7. - 1A. 0.1mol L · -+氨水中, c(OH )=c(NH 4 )- 1- 12 溶液充分混合 ,若混合后溶液的体积为 20L · HCl pH=12溶液与 L · Ba(OH) B. 10 mL 0.02mol mL ,则溶液的 10 mL 0.02mol - 1- +C. 在 0.1mol ·L CH 3 COONa 溶液中, c(OH )=c(CH 3COOH) + c(H ) -D. 0.1mol L · 1NaHA 溶液中, c(Na +2- -某二元弱酸强碱盐)=2c(A ) + c(HA )+ c(H 2 A)HN 3)与醋酸酸性相似,下列叙述中错误的是 叠氮酸( 8. +3 水溶液中微粒浓度大小顺序为: c(HN 3)>c(H )>c(N 3ˉ)>c(OH ˉ) A. HN B. HN 3 与 NH 3 作用生成的叠氮酸铵是共价化合物++C. NaN 3 水溶液中离子浓度大小顺序为: c(Na )>c(N 3ˉ) >c(OH ˉ)>c(H )CO 2 含电子数相等 D. N 3ˉ与 关于小苏打水溶液的表述正确的是A. c (Na )=c (HCO 3 ) + c (CO 3 ) + c (H 2CO 3)9. +-2-+ + - 2- -B. c (Na ) + c (H ) = c (HCO 3 ) + c (CO 3 ) +c (OH )-- 的水解程度C. HCO 的电离程度大于 HCO 3 3 +-, HCO - +2-3+ -D. 存在的电离有:NaHCO 3 =Na +HCO H+ CO L· KHC H 2O H +OH3 3-12O 4 溶液中,下列关系正确的是 10. 草酸是二元弱酸,草酸氧钾溶液呈酸性。
离子浓度大小比较精选(选择题30题)

离子浓度大小比较精选(选择题30题)1.20 mL1 mol / L醋酸溶液跟40 mL0.5 mol / L氢氧化钠溶液相混合,所得溶液中离子浓度由大到小的顺序是(Ac-代表醋酸根离子)A. c(Na+)>c(Ac-)>c(OH-)>c(H+)B. c(Na+)=c(Ac-),c(Ac-)>c(OH-)>c(H+)C. c(Na+)>c(OH-)>c(Ac-)>c(H+)D. c(Na+)>c(OH-)>c(H+)>c(Ac-)2.将0.2 mol / L CH3COOK与0.1 mol / L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是A. c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)B. c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)C. c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)D. c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)3.将20 mL 0.1 mol / L的醋酸与24 mL 0.1 mol / L的氢氧化钠混合后,溶液中各离子摩尔浓度由大到小的顺序是A. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)B. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)C. c(OH-)>c(Na+)>c(H+)>c(CH3COO-)D. c(Na+)>c(OH-)>c(H+)>c(CH3COO-)4.在氯化铵溶液中,下列关系式正确的是A. c(Cl-)>c(NH4+)>c(H+)>c(OH-)B. c(NH4+)>c(Cl-)>c(H+)>c(OH-)C. c(Cl-)=c(NH4+)>c(H+)=c(OH-)D. c(NH4+)=c(Cl-)>c(H+)>c(OH-)5.明矾溶液中各种离子的物质的量浓度大小关系能够确定的是A.c(K+)>c(Al3+)B.c(K+)=c(Al3+)C.c(H+)=c(OH-)D.c(Al3+)<c(H+) 6.100 mL 0.1 mol / L醋酸与50 mL 0.2 mol / L氢氧化钠溶液混合,在所得溶液中A. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)C. c(Na+)>c(CH3COO-)>c(H+)=c(OH-)D. c(Na+)=c(CH3COO-)>c(OH-)>c(H+)7.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是A. c(NH4+)>c(Cl-)>c(H+)>c(OH-)B. c(NH4+)>c(Cl-)>c(OH-)>c(H+)C. c(Cl-)>c(NH4+)>c(H+)>c(OH-)D. c(Cl-)>c(NH4+)>c(OH-)>c(H+)8.物质的量浓度相同的下列溶液中,NH 4+最大的是A. NH 4ClB. NH 4HSO 4C. CH 3COONH 4D. NH 4HCO 39.在物质的浓度均为0.01 mol / L 的CH 3COOH 和CH 3COONa 的混合液中,测得c (CH 3COO -)>c (Na +),则下列关系式正确的是A. c (H +)>c (OH -}B. c (H +)<c (OH -)C. c (CH 3COOH )>c (CH 3COO -)D. c (CH 3COOH )+c (CH 3COO -)=0.02 mol / L10. 0.1 mol ·L -1 NaOH 和0.1 mol ·L -1 NH 4Cl 溶液等体积混合后,离子浓度大小正确的次序是A. c (Na +)>c (Cl -)>c (OH -)>c (H +)B. c (Na +)=c (Cl -)>c (OH -)>c (H +)C. c (Na +)=c (Cl -)>c (H +)>c (OH -)D. c (Cl -)>c (Na +)>c (OH -)>c (H +)11.将0.1 mol 下列物质置于1 L 水中充分搅拌后,溶液中阴离子数最多的是A. KClB. Mg(OH)2C. Na 2CO 3D. MgSO 412.将100 mL 0.1 mol / L 的BaCl 2溶液加入到100 mL 0.2 mol / L 的H 2SO 4溶液中,则溶液中存在的离子浓度关系是A . c (H +)>c (Cl -)>c (Ba 2+)>c (-24SO )B . c (Cl -)>c (H +)>c (-24SO )>c (Ba 2+) C . c (H +)>c (-24SO )>c (Ba 2+)>c (Cl -) D . c (Cl -)>c (H +)>c (Ba 2+)>c (-24SO ) 13.等体积、等浓度的MOH 强碱溶液和HA 弱酸溶液混合后,混合液中有关离子的浓度应满足的关系是A. c (M +)>c (OH -)>c (A -)>c (H +)B. c (M +)>c (A -)>c (H +)>c (OH -)C. c (M +)>c (A -)>c (OH -)>c (H +)D. c (M +)+c (H +)=c (A -)+c (OH -)14.有五瓶溶液分别是:① 10 mL 0.60 mol·L -1 NaOH 水溶液,② 20 mL 0.50 mol·L -1H 2SO 4水溶液,③ 30 mL 0.40 mol·L -1 HCl 水溶液,④ 40 mL 0.30 mol·L -1 HAc 水溶液,⑤ 50 mL 0.20 mol·L -1 蔗糖水溶液。
高三化学溶液中离子浓度大小比较练习题(附答案)

2020年03月09日高三化学溶液中离子浓度大小比较练习题正确填写在答题卡上第1卷一、单选题,原子序数依次增大。
W 是原子半径最小的元素,X 、Y 原子核外L 层的电子数之比为3∶4,X 与Z 同主族,W 、X 、Y 、Z 的最外层电子数之和为17。
下列说法正确的是( ) A.单质的沸点:X>ZB.X 与W 形成的化合物中一定只有极性键C.氢化物的热稳定性:Z>YD.W 、X 、Y 可形成离子化合物2.常温下,向20mL0.1mol·L -1NaHC 2O 4溶液中缓慢滴加pH=13的NaOH 溶液,混合溶液的温度与滴加NaOH 溶液体积的关系如图所示。
下列说法错误的是( )A.E 点存在:2c (Na +)=3c (H 2C 2O 4)+3c (24HC O -)+3c (224C O -)B.F 点存在:c (OH -)>c (H +)+c (24HC O -)+c (H 2C 2O 4)C.在E 、F 和G 点中,G 点对应的K W 最小D.G 点对应的溶液中,c (Na +)>c (OH -)>c (224C O -)>c (24HC O -)3.利用电解原理将SO 2、NO x 转化为(NH 4)2SO 4的装置如图所示。
下列说法错误的是( )NH+xH2OA.阴极的电极反应式:NO x+(2x+3)e-+(2x+4)H+=+4B.溶液C的酸性比硫酸铵稀溶液强C.电极A与电源的负极相连,发生氧化反应D.转移0.2mol电子时消耗0.1mol SO24.研究人员用H2S废气除去空气中的NO x,装置如图所示。
熔融态Ca(HSO4)2为电解质,H+可以在该物质中自由移动,a电极附着Li2S。
Li2S。
下列说法错误的是( )A.电池放电时,电子由电极a经过导线流向电极bB.电池放电时,H+由质子交换膜右侧向左侧迁移C.负极反应式为(7-x)H2S +Li2S-(14-2x)e-=Li2S8-x+(14-2x)H +D.若0.1 mol NO和0.1 mol NO2组成的混合物在b极参与反应,a极增重9.6 g5.海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。
(完整word版)高中化学离子浓度大小比较练习题(附答案).doc

高中化学离子浓度大小比较练习题一、单选题1.25 C°时, H2 CO3,的 K al =4. 2 10-7 , K a2 =5. 6 10-11。
室温下向 10 mL0. 1 mol L-1 Na 2 CO3中逐滴加入 0. 1 mol L-1 HCl 。
图是溶液中含 C 微粒物质的量分数随 pH 降低而变化的图像( CO2因有逸出未画出)。
下列说法错误的是( )A.A 点溶液的pH<11B.B点溶液: c Na+ =c HCO3- +c CO32- +c H2 CO3C.A →B的过程中,离子反应方程式为:CO23-H +HCO 3D.分步加入酚酞和甲基橙,用中和滴定法可测定Na 2CO 3,与 NaHCO 3,混合物组成- 1- 12.实验测得0.5mol ·L CH 3COONa 溶液、 0.5mol L· CuSO4溶液以及 H 2O 的 pH 随温度变化的曲线如图所示。
下列说法正确的是( )A. 随温度升高,纯水中c(H +)>c(OH - )B.随温度升高, CH3COONa 溶液的 c(OH - )减小C.随温度升高, CuSO4溶液的 pH 变化是 K w改变与水解平衡移动共同作用的结果D.随温度升高, CH3COONa 溶液和 CuSO4溶液的 pH 均降低,是因为 CH 3COO -、 Cu 2+水解平衡移动方向不同3.25 C°时,改变0. 1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH 分子的物质的量分数δRCOOH 随之改变 [ 已知δ(RCOOH )=c(RCOOH )- ] ,甲酸(HCOOH) 与丙酸c(RCOOH )+c( RCOO )(CH 3CH 2COOH ) 溶液中 δRCOOH 与 pH 的关系如图所示。
下列说法正确的是( )A. 图中 M 、 N 两点对应溶液中的c(OH - ) 比较:前者 >后者B.丙酸的电离常数 K= 104.88C.等浓度的 HCOONa 和 CH 3 CH 2 COONa 两种榕液的pH 比较:前者 > 后者D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液中 :c Na >c HCOOH >c HCOO - >c OH ->c H +4.常温下 ,Ksp(CaF 2)=4 × 10 -9,K sp (CaSO 4 )=9.1×10 -6。
2020届高考化学三轮冲刺训练 溶液中离子浓度大小的比较(包含答案)

2020届高考化学三轮冲刺训练溶液中离子浓度大小的比较(含答案)1.在0.1mol/L的氨水溶液中,下列关系错误的()A.c(OH-) >c(H+)B.c(NH3·H2O) + c(NH4+) = 0.1mol/LC.c(NH4+)>c(NH3·H2O) >c(OH-) >c(H+)D.c(OH-) =c(NH4+)+c(H+)【答案】C2.对于(NH4)2SO4溶液,下列说法正确的是()A.溶液中存在电离平衡:(NH4)2SO42NH4+ + SO42-B.向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大C.加水稀释,溶液中所有离子的浓度均减小D.溶液中:c(SO42-)=2c(NH4+) + 2c(NH3·H2O)【答案】B3.下列溶液中各微粒的浓度关系正确的是()A.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH+4)大小顺序为①>②>③B.0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO-3)+c(H+)+c(H2CO3)C.0.1 mol·L-1的硫酸铵溶液中:c(NH+4)>c(SO2-4)>c(H+)D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)【答案】C4.草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是()A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)B.c(HC2O4-)+ c(C2O42-)=0.1mol/LC.c(C2O42-)>c(H2C2O4)D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)【答案】CD5.下列关于0.10 mol/L NaHCO3溶液的说法正确的是()A.溶质的电离方程式为NaHCO3→Na++ H++ CO32-B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)C.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大D.温度升高,c(HCO3-) 增大【答案】C6.H2A是一种弱酸,已知常温下0.1mol/L NaHA溶液呈酸性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学离子浓度大小比较练习题一、单选题 1.25 °C 时,23H CO ,的-7al K =4. 210⨯,-11a2K =5. 610⨯。
室温下向10 mL0. 1-1mol L ⋅23Na CO 中逐滴加入0. 1 -1mol L ⋅HCl 。
图是溶液中含C 微粒物质的量分数随pH 降低而变化的图像(2CO 因有逸出未画出)。
下列说法错误的是( )A.A 点溶液的pH<11B.B 点溶液:()()()()-2-33+23c Na =c HCO +c +c H O CO CC.A→B 的过程中,离子反应方程式为:2-+33C H HCO O +=== D.分步加入酚酞和甲基橙,用中和滴定法可测定23Na CO ,与3NaHCO ,混合物组成2.实验测得0.5mol·L −1CH 3COONa 溶液、0.5mol·L −1 CuSO 4溶液以及H 2O 的pH 随温度变化的曲线如图所示。
下列说法正确的是( )A. 随温度升高,纯水中c(H +)>c(OH −)B. 随温度升高,CH 3COONa 溶液的c(OH −)减小C. 随温度升高,CuSO 4溶液的pH 变化是K w 改变与水解平衡移动共同作用的结果D. 随温度升高,CH 3COONa 溶液和CuSO 4溶液的pH 均降低,是因为CH 3COO −、Cu 2+水解平衡移动方向不同3.25 °C 时,改变0. 1 mol/L 弱酸RCOOH 溶液的pH ,溶液中RCOOH 分子的物质的量分数()δRCOOH 随之改变[已知-c()δ()c RCOOH RCOOH =RCOOH RC )+c(OO ()],甲酸(HCOOH)与丙酸32CH CH C )OOH (溶液中()δRCOOH 与pH 的关系如图所示。
下列说法正确的是( )A.图中M 、N 两点对应溶液中的-c(OH )比较:前者>后者B.丙酸的电离常数K= 4.8810-C.等浓度的HCOONa 和32CH CH COONa 两种榕液的pH 比较:前者 > 后者D.将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶液等体积混合,所得溶液中:()()()()()--+>c HCOOH >c HCOO >c O c N H a >c H +4.常温下,K sp(CaF 2)=4×10-9,K sp (CaSO 4)=9.1×10-6。
取一定量的CaF 2固体溶于水,溶液中离子浓度的变化与时间的变化关系如图所示。
下列有关说法正确( )A.M 点表示CaF 2的不饱和溶液B.常温下,CaF 2的饱和溶液中,c(F -) = 10-3 mol/LC.温度不变,t 时刻改变的条件可能是向溶液中加了KF 固体, CaF 2的K sp 增大D.常温下,向100 mL CaF 2的饱和溶液中加入100 mL 0.2 mol/L Na 2SO 4溶液,平衡后溶液中的c (Ca 2+)约为9. 1×10-5 mol/L5.常温下将NaOH 溶液滴加到己二酸(2H X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )A.()a22H X K 的数量级为-610B.曲线N 表示pH 与()()2HX lgH X c c -的变化关系C.NaHX 溶液中()()H OH c c +->D.当混合溶液呈中性时,()()()()()2-Na HX X OH H c c c c c +--+>>>=6.常温下,钠盐(Na 2XO 3)溶液中微粒浓度的变化关系如图所示[pOH=-lg c (OH -)]。
下列说法正确的是( )A.曲线N 表示1g()()233H XO HXO c c -与pOH 的变化关系B.常温下,K a2(H 2XO 3)=10-10C.当pOH=2时;NaHXO 3溶液中:()()2323H XO XOc c -=10-8D.向Na 2XO 3溶液中滴加稀盐酸至中性时,溶液中:c (Na +)=2c(3HXO -)+2c(23XO -) 7.常温下,向20 mL 0. 1 mol •L -1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
则下列说法正确的是( )A.常温下,0.1 mol • L -1氨水中NH 3 • H 2O 的电离常数K 约为1×10-5B.a 、b 之间的点一定满足:c (+4NH )>c (Cl - )>c (OH - )>c (H +) C.c 点溶液中c (+4NH )=c (Cl - )D.d 点代表两溶液恰好完全反应8.根据下列各图曲线表征的信息。
得出的结论正确的是( )A.图1表示常温下向体积为10 mL 0.1 mol •L -1 NaOH 溶液中逐滴加入0.1 mol •L -1 CH 3COOH 溶液后溶液的pH 变化曲线,则b 点处有:c(CH 3COOH)+c(H +)c(OH -)B.图2表示用水稀释pH 相同的盐酸和NH 4Cl 溶液时,溶液的pH 变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH 4Cl 溶液,且溶液导电性:b>c>aC.图3表示的是Al 3+与OH -反应时含铝微粒浓度变化曲线,图中a 点溶液中大量存在Al 3+D.由图4得出若除去Fe 2(SO 4)3溶液中的Cu 2+,可采用向溶液中加入适量Fe 2O 3,调节溶液的pH 至4左右9.下列说法正确的是( )A.ph=1的4NaHSO 溶液:()()()+24H SO OHc c c --<+ B.室温下,Ph=3的3CH COOH 溶液与pH=11的NaOH 溶液等体积混合后,因生成的3CH COONa 水解,所以由水电离出的()+-3-1c H 10mol L ⋅>C.已知常温下()()a 3a CH COOH HCN K K >,则等体积等浓度的NaCN 和3CH COONa 溶液中,3CH COONa 溶液所含的离子数比NaCN 溶液多D.室温下,pH=11和pH=13的NaOH 溶液等体积混合后,则混合后的溶液中()1113+-11010H mol L 2c --+⋅=10.已知34H PO 是一种三元中强酸。
25 °C 时,向某浓度34H PO 溶液中逐滴加入NaOH 溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH 的变化曲 线如右图所示。
下列说法正确的是( )A.曲线2和曲线4分别表示2-4δHPO ()和s 3-4δ(PO )变化B.25 ℃时,34H PO 的电离常数5112K :K =10C.pH = 7. 2 时,浴液屮由水电离出的()+-7.2 c H =10m ol /LD.PH = 12. 3 时,()+2-3-442c Na 5c HPO +5c PO ()+()11.常温下,分别向NaA 溶液和MCl 溶液中加入盐酸和NaOH 溶液,混合溶液的pH 与离子浓度变化关系如下图所示。
下列说法不正确的是( )A.曲线1L 表示+c(M )lg c(MOH)与pH 的变化关系B.() 5.5a K HA =110⨯-C.a 点时两溶液中水的电离程度相同D.0.01-1mol L ⋅ MA 溶液中存在:()()++c M >c A >c ()(OH H )>c --12.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl 气体分子在253K 冰表面吸附和溶解过程的示意图,下列叙述错误的是( )A.冰表面第一层中,HCl 以分子形式存在B.冰表面第二层中,+H 浓度为31510mol L --⨯⋅(设冰的密度为30.9g cm -⋅)C.冰表面第三层中,冰的氢键网络结构保持不变D.冰表面各层之间,均存在可逆反应+H l C +C H l -13.根据下列图示所得出的结论不正确的是( )A.图甲是()()()()222CO g +H O g =CO g +H g 的平衡常数与反应温度的关系曲线,说明该反应的0H ∆<B.图乙是室温22H O 催化分解放出氧气的反应中22()H O c 随反应时间变化的曲线,说明随着反应的进行22H O 分解速率逐渐减小C.图丙是室温下用0.1000mol·L -1 NaOH 溶液滴定20.00mL0.1000mol·L -1某一元酸HX 的滴定曲线,说明HX 是一元强酸D.图丁是室温下用24Na SO 除去溶液中2+Ba 达到沉淀溶解平衡时,溶液中2+()Ba c 与2-4()SO c 的关系曲线,说明溶液中2-4()SO c 越大2+()Ba c 越小二、实验题14.pH 相等的NaOH 溶液与3CH COONa 溶液,分别加热到相同的温度后 3CH COONa 溶液的pH NaOH 溶液的pH (填“>”“=”或“<”)。
(2)将物质的量浓度相同的盐酸与氨水混合后,溶液中的()()4NH Clc c +-=,则盐酸的体积 氨水的体积(填“>”“=”或“<”)。
(3)将-10.2mol L ⋅溶液与-10.1mol l ⋅ NaOH 溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中()()Na A c c +->,则:①混合溶液中,()A c - ()c HA (填“>”<”或“=”,下同)。
②混合溶液中,()()HA A c c -+ -10.1mol L ⋅(4)常温时,取-10.1mol L ⋅溶液与10.1mol L -⋅ NaOH 溶液等体积混合,测得混合溶液的pH =8 ①混合溶液中由水电离出的()OH c -与-10.1mol L ⋅ NaOH 溶液中由水电离出的()OH c -之比为 ②已知4NH X 溶液呈中性,又知将HX 溶液加入23Na CO 溶液中有气体放出,试推断()432NH CO 溶液的Ph 7(填“>”“<”或“=”)。
15.砷()As 是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X ,吸附剂X 中含有2-3CO ,其中原因是________ .(2)33H AsO 和34H AsO 水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系分别如图-1和图-2所示。
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH 溶液逐滴加入到33H AsO 溶液中,当溶液由无色变为浅红色时停止滴加。
