1-1原子结构模型
2.3 原子结构的模型

阴阳离子共同 构成物质
阴、阳离子
所带电 性情况
不显电性
不显电性
显电性
联
分子可以破裂成原子,原子重新组合成分子,原子
系
得失电子形成离子
在原子得失电子形成离子的过程中,质子数、 中子数、核电荷数和核外电子数中哪些发生了 改变?哪些没有?
质子数、中子数、 核电荷数没有发生 改变,核外电子数 发生了改变。
修正和完善了汤姆生的原子模型
玻尔的分层理论
电子只能在特定的轨道上运动
丹麦科学家玻尔
完善了卢瑟福的原子模型
道尔顿 实心球模型
汤姆生 枣糕或西瓜模型
卢瑟福 核式结构模型
玻尔 分层模型
从原子模型的建立过程看,一个模型 的建立需要经历怎样的过程?
建立模型需要不断地完善和修正,才能 使它更加接近事物的本质。 (说明:现在原子模型还在不断修正, 比玻尔的模型又有了很大的改进。)
下图中代表离子的是( D )
(说明:圆圈内数字代表质子数,“+”表 示原子核所带的电荷,黑点代表核外电子)
(1)A原子核中有_8__个质子, _8__个中子。 (2)B原子核中有 _8__个质子,__9_个中子。 (3)C原子核中有_8__个质子,_1__0_个中子。
具有相同核电荷数(即质子数)的一类原子总称为元素
20
核外电子数 1 2 6 7 8 13 16
17
读表:从下表中你能获得哪些规律?
针对原子 ✓ 质子数 = 核电荷数 = 核外电子数
✓ 质子数与中子数没有必然的联系
✓ 有的原子没有中子(如氢原子)
为什么说原子的质量集中在原子核上? 为什么原子呈电中性?
质子 带正电 1.6726×10-27kg
1-105号原子结构示意图
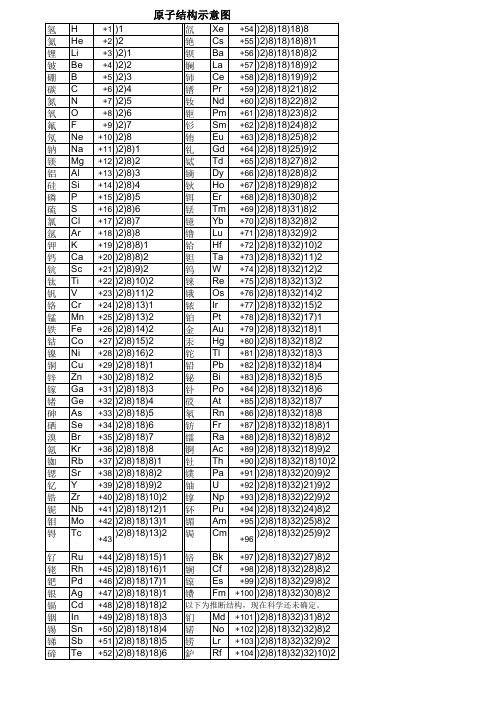
碳C
+6 )2)4
镨 Pr +59 )2)8)18)21)8)2
氮N
+7 )2)5
钕 Nd +60 )2)8)18)22)8)2
氧O
+8 )2)6
钷 Pm +61 )2)8)18)23)8)2
氟F
+9 )2)7
钐 Sm +62 )2)8)18)24)8)2
氖 Ne +10 )2)8
铕 Eu +63 )2)8)18)25)8)2
钒 V +23 )2)8)11)2
锇 Os +76 )2)8)18)32)14)2
铬 Cr +24 )2)8)13)1
铱 Ir &5 )2)8)13)2
铂 Pt +78 )2)8)18)32)17)1
铁 Fe +26 )2)8)14)2
金 Au +79 )2)8)18)32)18)1
镓 Ga +31 )2)8)18)3
钋 Po +84 )2)8)18)32)18)6
锗 Ge +32 )2)8)18)4
砹 At +85 )2)8)18)32)18)7
砷 As +33 )2)8)18)5
氡 Rn +86 )2)8)18)32)18)8
硒 Se +34 )2)8)18)6
钫 Fr +87 )2)8)18)32)18)8)1
碘I
+53 )2)8)18)18)7 钅杜 Db +105 )2)8)18)32)32)11)2
溴 Br +35 )2)8)18)7
镭 Ra +88 )2)8)18)32)18)8)2
§1-1原子结构理论

为了解释氢原子线状光谱这一事实,玻尔在含核原子模型的基础上提
出了核外电子分层排布的原子结构模型。
玻尔原子结构模型的基本观点是: ①原子中的电子在具有确定半径的圆周轨道上绕原子核运动,不辐射能 量。(按能级分层排布)
2 表示微粒在空间某点出现的概率密度
概率密度: 电子在核外某处单位体积内出现的概率称为该处的概率密度
我们常把电子在核外出现的概率密度大小,用点的疏密来表 示,电子出现概率密度大的区域,用密集的小点来表示;电 子出现概率密度小的区域,用稀疏的小点来表示。这样得到 的图像称为电子云,它是电子在核外空间各处出现概率密度 大小的形象画描绘。
ʘ、ϕ分别是角度θ和φ的函数。
通常,将与角度有关的两个函数合并为
Y(θ,φ) 那么有 (r,,) R(r)Y (,)
波函数的径向部分
波函数的角度部分
2.波函数与原子轨道
通过解薛定谔方程得到具体的波函数ψ,每个 解出的波函数被边界条件限制,得到波函数 下具体的解,从而确定三个量子数。 主量子数:n=1,2,3,······,∞ 角量子数:l=0,1,2,······,n-1 磁量子数:m=0,±1,±2,······,±l 用一套三个量子数(n,l,m)解薛定谔方程, 得到波函数的 Rnl (r)和Yl(m ,)
arccosz
r
arctan y
x
x r sin cos
y
r
sin
sin
z r cos
r x2 y2 z2 arccosz
r
原子结构的理论模型及其应用

原子结构的理论模型及其应用原子是构成物质的基本单位,其结构的研究对于了解物质的性质和变化至关重要。
在20世纪初期,人们发现了原子中存在电子,质子和中子的概念,并提出了原子结构的理论模型。
这些理论模型包括了经典物理学,量子力学和统计力学等,并在科学研究和实际应用中得到了广泛的应用。
一、经典物理学模型最早提出的原子结构模型是基于经典物理学的。
这个模型称为“普朗克-玻尔原子模型”,是由德国物理学家玻尔在1913年提出的。
他的模型将电子视为在原子核周围的轨道上运动的粒子,其轨道的半径具有离散的量子能级。
这个模型可以解释氢原子光谱的线性分布和其他原子的光谱现象。
不过这个模型无法解释实际原子中存在的众多问题,例如特定能量电子的存在,几率密度和双重光谱。
二、量子力学模型二十世纪初,在研究黑体辐射和单位分子反应时,人们发现了经典物理学无法解释的现象,这促使他们提出了量子力学的概念。
量子力学是描述原子、分子和物质微观性质的一种理论。
史无前例的大量的实验数据表明,在描述原子和分子的性质时,必须借助于量子力学。
利用量子力学理论可以解释经典物理学无法解释的实验结果,例如光谱线的分裂等现象。
在量子力学理论中,电子被视为自旋和电荷的粒子,其运动遵循薛定谔方程。
薛定谔方程描述电子的概率波函数,它是一个数学函数,用于解释电子在不同能级上的概率分布。
在这个模型中,原子的电子云分布可以很方便地计算出来。
这个模型的优点是比经典物理学模型更精确和可靠。
缺点是仅适用于单电子原子,对于多电子原子产生较强的相互作用的情况,其计算十分复杂。
三、统计力学模型物质由大量粒子组成,而每个粒子皆遵循统计力学规律。
统计力学的基本原则是:不仅要知道体系的宏观状态,还要知道它的微观状态。
在此基础上,科学家可以推导出物质的物理、化学和热力学性质等等。
在原子结构的研究中,统计力学模型指导了我们了解原子各种状态下的能量和随机运动行为。
在统计力学理论中,电子被视为与原子核相互作用的波。
1.1.1 原子结构模型 练习(原卷版)—鲁科版选择性必修2

第一章原子结构与元素性质第1节原子结构模型一.选择题:本题共10小题,每题2分,共20分。
每小题只有一个选项符合题意。
1.原子结构模型的演变如图所示,下列符合历史演变顺序的一组排列是( )A.(1)(3)(2)(4)(5) B.(1)(2)(3)(4)(5)C.(1)(5)(3)(2)(4) D.(1)(3)(5)(4)(2)2.自从1803年英国化学家道尔顿提出原子假说以来,人类对原子结构的研究不断深入、不断发展,通过实验事实不断地丰富、完善原子结构理论。
下列关于原子结构的说法正确的是( ) A.所有的原子都含有质子、中子和电子三种基本构成微粒B.所有的原子中的质子、中子和电子三种基本构成微粒的个数都是相等的C.原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引D.原子中的质子、中子和电子三种基本构成微粒不可能再进一步分成更小的微粒3.电子层数n=3时,电子的空间运动状态(即原子轨道)有( )A.4种B.7种C.8种D.9种4.下列叙述正确的是( )A.能级就是电子层B.每个能层最多可容纳的电子数是2n2C.同一能层中不同能级的能量高低相同D.不同能层中的p能级的能量高低相同5.下列关于电子层与能级的说法正确的是( )A.同一原子中,符号相同的能级,其上电子能量不一定相同B.任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的D.多电子原子中,每个能层上电子的能量一定不同6.下列有关电子云和原子轨道的说法正确的是( )A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云B.s轨道呈球形,处在该轨道上的电子只能在球壳内运动C.p轨道呈哑铃形,在空间有两个伸展方向D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增加而增大7.下列叙述不正确的是( )A.越易失去的电子能量越高B.在离核越远区域内运动的电子能量越高C.p能级电子能量一定高于s能级电子能量D.在离核越近区域内运动的电子能量越低8.下列说法正确的是( )A.同一个电子层中s能级的能量总是大于p能级的能量B.2s原子轨道半径比1s大,说明2s的电子云中的电子比1s的多C.第二电子层上的电子,不论在哪一个原子轨道上,其能量都相等D.N电子层的原子轨道类型数和原子轨道数分别为4和169.下列说法正确的是( )A.1s电子云呈球形,表示电子绕原子核做圆周运动B.电子云图中的小点密度大,说明该原子核外空间电子数目多C.n s能级的原子轨道图可表示为D.3d表示d能级有3个轨道10.下列说法正确的是( )A.1s轨道的电子云形状为圆形的面B.2s的电子云半径比1s大,说明2s能级的电子比1s的多C.4f能级中最多可容纳14个电子D.电子在1s轨道上运动像地球围绕太阳旋转二.选择题:本题共5小题,每题4分,共20分。
第一章_第1节_原子结构模型知识点及练习[选修3]鲁科版
![第一章_第1节_原子结构模型知识点及练习[选修3]鲁科版](https://img.taocdn.com/s3/m/9eab8ef40242a8956bece491.png)
第1节原子结构模型一、原子结构模型的提出1、道尔顿原子模型(1803年):原子是组成物质的基本的粒子,它们是坚实的、不可再分的实心球。
2、汤姆生原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
(“葡萄干布丁模型”)3、卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
(“卢瑟福核式模型”)4、玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
(“玻尔电子分层排布模型”)5、电子云模型(1927年~1935年):现代物质结构学说。
(“量子力学模型”)【例1】下列对不同时期原子结构模型的提出时间排列正确的是()①电子分层排布模型②“葡萄干布丁”模型③量子力学模型④道尔顿原子学说⑤核式模型A、①③②⑤④B、④②③①⑤C、④②⑤①③D、④⑤②①③二、原子光谱和波尔的原子结构模型1、原子光谱:光(辐射)是电子释放能量的重要形式之一,不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素电子的吸收光谱或发射光谱,总称原子光谱。
(1)通常所说的光是指人的视觉所能感觉到的在真空中波长介于400~700nm之间的电磁波。
不同波长的光在人的视觉中表现出不同的颜色,按波长由长到短依次为红橙黄绿青蓝紫。
实际上,广义的光即电磁波,除了可见光外,还包括红外光、紫外光、X射线等。
(2)人们在真空放电管内充入低压氢气,并在放电管两端的电极间加上高压电时,氢气会放电发光,利用三棱镜可观察到不连续的线状光谱。
(3)光谱分为连续光谱和线状光谱,氢原子光谱为线状光谱。
线状光谱:具有特定波长、彼此分离的谱线所组成的光谱(图1-1)锂、氦、汞的发射光谱锂、氦、汞的吸收光谱图1-1连续光谱:由各种波长的光所组成,且相近的波长差别极小而不能分辨所得的光谱,如阳光形成的光谱。
第3节_原子结构模型1[1]
![第3节_原子结构模型1[1]](https://img.taocdn.com/s3/m/8d2caa61a98271fe910ef935.png)
原子是组成物质的基本粒子,它们是坚实的、 不可再分的实心球。
汤姆生原子模型
原子是一个平均分布着正电荷的粒子,其 中镶嵌着许多电子,中和了正电荷,从而形成 了中性原子。
①大多数α粒子不改变 原来的运动方向 ②有一小部分α粒子改 变了原来的运动方向
③极少数α粒子被弹了 回来
α粒子轰击原子
质子与中子的质量几乎相等.
理科班教案—翁海斌
思考:
原子种类 氢原子 氦原子 碳原子 氮原子
分析下表,你能得到哪些信息?
核电荷数 1 2 6 7 质子数 1 2 6 7 中子数 0 2 8 7 核外电子数 1 2 6 7
铝原子 硫原子
氯原子 铁原子
13 16
17 26
13 16
17 26
14 17
20 30
理科班教案—翁海斌
一杯水的微观层次分析
理科班教案—翁海斌
汤姆生 1.________发现了电子. 2.卢瑟福认为,原子是由原子中心一个很小的 原子核 电子 _______,与核外绕核高速运动的______构 行星 成的.这种原子模型又叫______模型. 玻尔认为,电子是分层按一定轨道绕核高速运 分层 动的,这种原子模型又叫______模型. 3.研究原子核结构的一种方法:用 高能量的粒子 ________________撞击、打碎核. 可以发 质子 中子 现原子核由______和______构成. 不显 4.原子是呈电中性的,即原子____(显、不显) 电性.
13 16
17 26
质子数 核外电子数 (1)核电荷数=______=_________。 不一定 (2)质子数与中子数________ (一定、不一定)相等. 中子 (3)个别原子内可以没有_____。 质子 (4)元素不同,____数一定不同.
初中化学原子模型图文详解

初中化学原子模型图文详解原子模型是化学中一个非常重要的概念,它描述了物质的基本组成单位——原子的结构和性质。
本文将详细解释原子模型的发展历程,并通过图文形式给出对每个原子模型的详细描述。
一、“波尔原子模型”的提出波尔原子模型是最早被广泛接受的原子模型之一。
它由丹麦物理学家尼尔斯·波尔于1913年提出,通过实验结果的分析,他发现了氢原子的一些规律,从而提出了波尔原子模型。
波尔原子模型的基本思想是:原子由一个中心的带正电荷的核心(核)和绕核运动的带负电荷的电子组成。
电子只能在能级(轨道)上运动,而且只能在特定的能级上存在。
当电子跃迁时,会吸收或释放特定的能量。
波尔通过这一模型解释了氢光谱中的谱线现象。
图1 展示了波尔原子模型的结构。
核心表示为正电荷,而电子以不同的圆圈代表不同的能级。
每个能级上都有固定数量的电子。
二、“量子力学原子模型”对波尔模型的进一步完善尽管波尔原子模型对氢原子的解释相对较好,但它却无法解释其他元素的光谱,尤其是含有多个电子的元素。
因此,原子模型的研究进一步发展,诞生了量子力学原子模型。
量子力学原子模型的提出归功于一系列科学家的努力,包括德国物理学家薛定谔和海森堡等。
这一模型基于量子力学原理,将原子视为一个稳定的能级系统。
在这个模型中,电子不再固定在特定的轨道上,而是存在于一系列云状的电子轨道中,这些轨道称为轨道云。
每个轨道云具有一定的能量,并且电子的位置不能确定,只能通过波函数的方法得到可能位置的概率分布。
图2 展示了量子力学原子模型的轨道云结构。
不同形状的轨道表示不同的能级,电子存在的可能位置由云状区域表示。
三、原子模型的再次发展——“量子物理学原子模型”量子物理学原子模型是对量子力学原子模型更深层次的研究和发展。
它将电子视为分布在空间中的电子云,而非具体存在于某个轨道上。
与量子力学原子模型类似,量子物理学原子模型更加注重对电子在空间中分布的描述。
量子物理学原子模型的基本概念是:原子中的电子云是由一组原子轨道和不同概率密度分布的电子组成。
1-1-3-1原子结构模型的演变

例题3:已知R2+核内共有N个中子,R的质 量数为A,mgR2+中含电子的物质的量为 ( D) A C
m( A- N ) A ( A- N 2) Am
mol mol
B D
m( A- N 2) A m( A- N -2) A
mol mol
解析:无论是原子还是离子均存在关系式 A=Z+N,故R2+的质子数Z=A-N,而阳离子R2+ 的核外电子数=Z-2=A-N-2。即1molR2+含中子数 m 2+的物质的量为 mol。 为(A-N-2)mol。∴mgR A m mgR2+含电子的物质的量为 A (A-N-2)mol。
M层
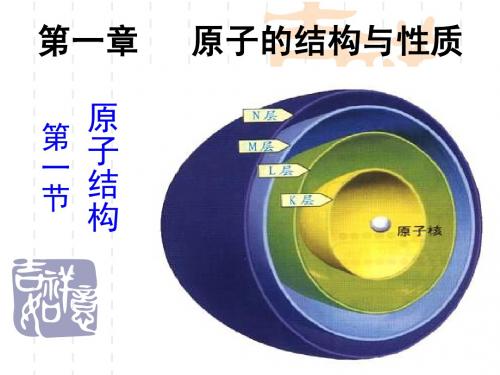
一、核外电子分层排布
对于多电子原子,核外电子是分层排布的
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
得到电子
+8
2
8
O
原子结构示意图
O2离子结构示意图
课堂练习1:
某微粒的结构示意图如图,当X取不同值时, 对应不同的微粒.请写出符合下列条件的微 粒符号:
1)阴离子:_________ 2)阳离子:_________ 3)原子:___________
35Cl的质量数
氯元素的近似相对原子质量 表示__________________________
A 例题2:某微粒用 Z Xn-表示。下列关于该
粒子的叙述中正确的是( B ) A 所含的质子数=A-n B 所含中子数=A-Z
C 所含电子数=Z-n
D 质量数=A+Z
1-1-1‘ 原子结构模型

第1节原子结构模型学案编号:01(第1课时学案)2010年2月19日班级__________ 姓名__________【学习目标】(1)了解“玻尔原子结构模型”,知道其合理因素和存在的不足。
(2)知道原子光谱产生的原因。
(3)能利用“玻尔原子结构模型”解释氢原子的线状光谱。
【学案导学过程】温故知新1.请同学们指出原子是由什么构成的?2.请同学们描述一下核外电子运动有什么特征?一、原子结构理论发展史:1803年提出原子是一个“实心球体”建立原子学说的是英国化学家__ ;1903年汤姆逊在发现电子的基础上提出原子结构的“”模型,1911年英国物理学家卢瑟福提出了原子结构的模型;1913年丹麦科学家玻尔提出的原子结构模型;建立于20世纪20年代中期的模型已成为现代化学的理论基础。
利用上述知识回答下列问题:①“道尔顿原子学说”有那些不足之处?②“卢瑟福原子结构的核式模型”能解释氢原子的光谱是线状光谱吗?二、氢原子光谱和玻尔的原子结构模型1、氢原子光谱知识支持:光谱是研究原子结构的重要方法原子光谱:。
连续光谱:。
线状光谱:。
2、玻尔原子结构模型的基本观点(1)原子中的电子在具有________的圆周轨道上绕原子核运动,并且______能量。
(2)在不同轨道上运动的电子具有不同的能量(E),而且能量是_________的,即能量是“一份一份”的。
轨道能量依n值(1,2,3,……)的增大而___________。
①基态:最低能量状态。
处于最低能量状态的原子称为基态原子。
②激发态:能量高于基态的状态。
处于激发态的原子称为激发态原子。
(3)只有当电子从一个轨道(能量为E i)跃迁到另一个轨道时,才会_______或______能量。
如果辐射或吸收的能量以光的形式表现并记录下来,就形成了______________。
该理论重大贡献在于指出了原子光谱源自____________在能量不同的________之间的跃迁,而电子所的处轨道的能量是_________的。
原子的核式结构模型

描述微观粒子运动的基本方程, 用于求解原子中电子的波函数和
能量。
原子轨道
由量子力学计算得出的电子在原子 中的概率分布区域,决定了元素的 化学性质。
自旋和磁矩
电子自旋和轨道运动产生的磁矩是 原子磁性的来源。
多电子原子中电子排布规律研究进展
泡利原理
确定每个电子状态的独特性,保证电子排布的稳 定性。
原子中心有一个带正电的原子核,电子绕核旋转。该模型预测了α粒子散射实 验的结果,即大多数α粒子穿过原子时不受影响,少数α粒子受到大角度偏转, 极少数α粒子被反弹回来。
实验结果与预测一致
α粒子散射实验结果与卢瑟福的核式结构模型预测相符,从而验证了该模型的正 确性。同时,其他相关实验结果也支持了核式结构模型的理论预测。
局限性
玻尔理论虽然成功地解释了氢原子光谱和类氢离子光谱,但对于复杂原子(多电 子原子)的光谱现象却无法解释。此外,玻尔理论也无法解释原子的化学性质和 化学键的形成。
03
原子核式结构模型具体内容
原子核组成与性质
原子核位于原子的中心,由质子和中 子组成。
原子核的半径约为原子半径的万分之 一,但质量却占原子总质量的99.9% 以上。
04
电子云密度越大,表明 电子在该区域出现的概 率越高。
能量层级
原子中的电子按照能量高低分 布在不同的能级上,每个能级 对应一定的电子云形状和取向
。
当电子从一个能级跃迁到另一 个能级时,会吸收或释放能量 ,表现为光的吸收或发射。
电子跃迁遵循一定的选择定则 ,如偶极跃迁选择定则、自旋
原子核的发现
卢瑟福根据α粒子散射实验现象提出了原子核式结构模型。在 原子的中心有一个很小的核,叫原子核,原子的全部正电荷 和几乎全部质量都集中在原子核里,带负电的电子在核外空 间里绕着核旋转。
1-1原子结构ppt
(负电) 与物质化学性质 密切相关
一、开天辟地──原子的诞生
1、现代大爆炸宇宙学理论
大 宇 诞生于 爆 约2h后 宙 炸
大量氢
少量氦 极少量锂
原子核的熔 合反应
其 他 元 素
2、
氢
是宇宙中最丰富的元素,是所有元素之母。
3、宇宙年龄距今约140亿年,地球年龄已有46亿 年。 4.地球上的元素绝大多数是金属,非金属(包括 稀有气体)仅22种。
电子一般总是尽先排布在能量最低的电子 层里,即最先排布K层;当K层排满后,再 排布L层;当L层排满后,再排布M层;……
2、能级(电子亚层)
同一个能层中电子能量不同的电子亚层 能级名称:s、p、d、f…… 能级符号:ns、np、nd、nf…… n代表能层 不同能层中的s、p、d、f能级最多能容纳的电 子数是相同的,依次为1、3、5、7的两倍: s:2 p:6 d:10 f:14(成等差数列)
三、构造原理与电子排布式
1、构造原理
原子核外电子一般是按一定的能级顺序填 充的,填满一个能级再填一个新能级,这 种规律称为构造原理。
构造原理是绝大多数基态原子(处于最低能 量的原子)核外电子排布所遵循的顺序。
能量相近的能 级划为一组, 称为能级组
1s--能 2s---2p--量 由 3s---3p--存在着能级交错 低 4s---3d---4p-到 电子填 5s---4d---5p--高 入轨道 6s--4f---5d---6p--次序图 7s--5f---6d---7p
核 构外 造电 原子 理排 图布
7个能级组共7组数字: 1、22、33、434、545、6456、7567,找一找数字排 列规则,就很容易记住了。
第一组数字“1”表示一个轨道:1s 第二组数字“22”表示两个轨道:2s、2p 第三组数字“33”表示两个轨道:3s、3p 第四组数字“434”表示三个轨道,依次是:4s.3d.4p 第五组数字“545”表示三个轨道,依次是:5s.4d.5p 第六组数字“6456”表示四个轨道,依次是:6s、4f、 5d、6p 第七组数字“7567”表示四个轨道,依次是:7s、5f、 6d、7p
1-1原子结构模型

玻尔的核外电子分层排布的原子结构模型成功
地解释了氢原子光谱是线状光谱的实验事实,阐明了
原子光谱源自核外电子在能量不同的轨道之间的跃迁, 而电子所处的轨道的能量是量子化的。玻尔提出的这 些重要概念和观点至今还为人们所使用。
但玻尔理论仍有很大的局限性:
不能解释氢原子的精细光谱; 不能解释多电子原子、分子或固体的光谱。
二、量子力学对原子核外电子运动状态的描述
1、原子轨道与四个量子数 根据量子力学理论,原子中的单个电子的 空间运动状态可以用原子轨道来描述,而每个 原子轨道须由三个量子数n、l、n共同标记。
⑴主量子数n:
n的取值为正整数1,2,3,4,5,6…
对应的符号为 K,L,M,N,O,P… n越大,电子离核的平均距离越远,能量越高。 人们将n 所表示的运动状态称为电子层。
1.以下能级符号正确的是( A、D )。 A. 6s B. 2d C. 3f D. 7p 2.下列各能层中不包含p能级的是( D )。 A. N B. M C. L D. K
3.下列能级中轨道数为3的是( B ) A. s能级 B. p能级 C. d能级
D. f能级
4.下列关于1s轨道电子云图的说法中,正确的是( C ) A. 通常用小黑点来表示电子的多少 B. 小黑点密表示在该核外空间的电子多
C. 小黑点密表示在该核外空间的单位体积内电子出现的概率大
D. 通常用小黑点来表示电子绕核作高速圆周运动
练习:找出下列条件下原子轨道的数目 A. n=1 1 1s 2s 2px 2py 2pz
B. n=2 4
C. n=3 9
3s 3px 3py 3pz 3dxy 3dyz
3dxz 3dx2-y2 3dz2
规律:每层的原子轨道数为层数的平方(n2)
1-1-2 原子结构模型

角量子数l和磁量子数m地关系即能级与原子轨道个数地关系.对于一个确定地l值,m值个数值.
②原子轨道地表示方法
s能级只有_____个原子轨道,可表示为s.
p能级有_____个原子轨道,可表示为px、py、pz.
d能级有_____个原子轨道,f能级有_____个原子轨道.
③对于第n层地s轨道,可记作_______,对于第n层地3个p轨道,可记作__________________.
请写出下列电子层各有哪几个能级:
K:__________
L:__________
M:__________
N:__________
3磁量子数m
当氢原子由n=2跃迁到n=1,可以观察到两条靠得很近地谱线,用角量子数ι无法解释这个现象,因此还必须引入新地量子数.
磁量子数即原子轨道个数.原子轨道是指一个电子空间运动状态.根据光谱现象,科学家发现同一能级电子空间运动状态不尽相同,一个能级包含着一个或若干个原子轨道.
4自旋磁量子数ms
氢原子上地电子由n=2地状态跳回到n=1地状态,会产生两条靠得很近地谱线,为什么?
自旋磁量子数ms表示同一轨道中电子地二种自旋状态
ms=
ms=
总结
1、原子轨道是由那几个量子数ห้องสมุดไป่ตู้定地?
2、电子地运动状态包括自旋状态是由那几个量子数决定地?
申明:
所有资料为本人收集整理,仅限个人学习使用,勿做商业用途.
<6)知道四个量子数决定地内容
【学案导学过程】
原子轨道及四个量子数
钠原子光谱由n=4地状态跃迁到n=3地状态,会产生多条谱线,以上事实能用玻尔理论解释吗?
玻尔原子模型地成功之处:
原子结构第一节原子结构模型

第1节原子结构模型[课标要求]1.了解原子核外电子的运动状态。
2.知道原子核外电子在一定条件下会发生跃迁,了解其简单应用。
1.能级符号及所含轨道数:s、1,p、3,d、5,f、7。
2.每个电子层所含能级类型:K:s;L:s、p;M:s、p、d;N:s、p、d、f。
3.s轨道呈球形,p轨道呈“∞”形。
4.原子轨道能量高低关系:同电子层不同能级:n f>n d>n p>n s;不同电子层同能级:n s>(n-1)s>(n-2)s>(n-3)s;同电子层同能级:n p x=n p y=n p z。
氢原子光谱和玻尔的原子结构模型1.不同时期的原子结构模型原子结构理论发展史:1803年提出原子是一个“实心球体”建立原子学说的是英国化学家,1903年汤姆逊提出原子结构的“”模型,1911年卢瑟福提出了原子结构的模型,1913年玻尔提出的原子结构模型,建立于20世纪20年代中期的模型已成为现代化学的理论基础。
1.道尔顿原子模型(1803年):原子是组成物质的基本粒子,它们是坚实的、不可再分的实心球。
2.汤姆逊原子模型(1903年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
3.卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
4.玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
5.原子结构的量子力学模型(20世纪20年代中期):现代物质结构学说。
2.光谱和氢原子光谱(1)光谱①概念:利用仪器将物质 或 的波长和强度分布记录下来的谱线。
②形成原因:电子在不同轨道间 时,会辐射或吸收能量。
(2)氢原子光谱:属于 光谱。
过渡:为了解释原子的稳定性和 的实验事实,丹麦科学家玻尔在 原子模型的基础上提出了 的原子结构模型,3.玻尔原子结构模型的基本观点[(1)基态原子吸收能量释放能量激发态原子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
习题 1.下列各电子层,不包含d能级的是( C、D )。
A.N电子层 B. M电子层 C. L电子层 D. K电子层
2.下列能级中,轨道数为5的是( C )。 A.s能级 B.p能级 C.d能级
3.以下各能级能否存在?如果能存在,各包含多 少轨道?(1)2s (2)2d (3)4p(4)5d
答:(1)2s存在,轨道数为1 (2)2d不能存在
1-1 原子结构模型 (第2课时)
[联想· 质疑]波尔只引
入一个量子数n,能比 较好地解释了氢原子 线状光谱产生的原因; 但复杂的光谱解释不 了。
实验事实:
在钠原子中
n=4
电子跃迁
n=3
在氢原子中
n=2
电子跃迁
n=1
也得到两条靠得很近的谱线…
原子轨道与四个量子数 (1)原子光谱带来的疑问? ①钠原子光谱在n=3到n=4之间会产生两(多)条谱线.
D. 1、0、 0、 0
规律:n>l≥︱m︱ ms只取-1/2、 +1/2
6.下列电子层中,原子轨道的数目为4的是 B A. K 层 B.L层 C.M层 D.N层 7.玻尔理论不能解释 (D) A.H原子光谱为线状光谱 B.在一给定的稳定轨道上,运动的核外电 子不发射能量----电磁波 C.H原子的可见光区谱线 D.H原子光谱的精细结构 8.P轨道电子云形状正确叙述为 ( C ) A.球形对称; B.对顶双球; C.极大值在X、Y、Z轴上的双梨形 D.互相垂直的梅花瓣形.
【巩固练习】 1、道尔顿的原子学说曾经起了很大的作 用。他的学说中包含有下述三个论点: ①原子是不能再分的粒子;②同种元素 的原子的各种性质和质量都相同;③原 子是微小的实心球体。从现代的观点来 看,你认为这三个论点中不确切的是 D A.只有③ B.只有①③ C.只有②③ D.①②③ 2.汤姆逊的原子学说中葡萄干指的是什么?
若电子n、 l 的相同,则电子的能量相同.
在一个电子层中,l的取值有多少个,表示电子 层有多少个不同的能级.
规律: 每层的能级数值=电子层数
③磁量子数m: 描述磁场中原子轨道的能量状态 m可以取0、±1、±2 … ±l共(2l +1)个数值.
规律:每层的原子轨道数为层数的平方(n2)
④自旋量子数ms:描述在能量完全相同时电子 运动的特殊状态(简称为电子自旋状态). 处于同轨道上的电子的自旋状态只有两种. 分别用符号↑、↓表示). 注意:自旋并不是”自转”,实际意义更为深远.
C. n=3 3 3s 3p 3d
D. n=4 4 4s 4p
4d 4f
规律: 每层的能级数值=电子层数
电子云:描述电子在空间出现的概率大小的图形.
电子云和原子轨道
原子轨道的图像描述 根据量子力学理论,将原子轨道在空间的分布 以图象方式在直角坐标系中表示出来. 原子轨道示意图:
d 轨道(l = 2, m = +2, +1, 0, -1, -2) m 五种取值, 空间五种取向, 五条等价(简并) d 轨道.
f 轨道 ( l = 3, m = +3, +2, +1, 0, -1, -2, -3 ) m 七种取值, 空间七种取向, 七条等价(简并) f 轨道.
(3)磁量子数m: 每一电子亚层的原子轨道数 描述磁场中原子轨道的能量状态 m可以取(2l +1)个数值. 如l =0, m只可以取0,对应的谱线只有一条. 如l =1, m可以取0,±1,对应的谱线有三条. n、 l 、m确定,原子轨道就确定了.
【小结】人类对原子结构的认识历史:
德谟克利特:朴素原子观 道尔顿:原子学说 汤姆生:“葡萄干面包式” 模 型 卢瑟福:带核原子结构模型 玻尔:原子轨道模型 现代量子力学模型
小结: 1、氢原子光谱
连续光谱 线状光谱 2、玻尔(Bohr)的原子结构模型 (玻尔理论的三个假设)。 3、解释、应用: 追根寻源、身边的化学等
9.下列说法中正确的是 (D) A.一个原子轨道上只能有一个电子 B.处在同一原子轨道上的电子运动状态完全 相同 C.处在同一电子层上的电子(基态)能量一 定相同 D.处在同一能级中的电子(基态)能量一定 相同 10.如果每个轨道只能容纳2个电子,那么L电 子层最多可容纳的电子数为 (B ) A.3个 B.8个 C.9个 D.18个
结构知识来解释原子的发光现象?
1、氢原子光谱
狭义的光:波长400~700nm之间的电磁波;
广义的光:即电磁波,包括可见光、红外光、 紫外光、X射线等。
[知识支持] 连续光谱(continuous spectrum):
若由光谱仪获得的光谱是由各种波长的光 所组成,且相近的波长差别极小而不能分辨, 则所得光谱为连续光谱。如阳光等。
2、量子数和原子轨道的关系
n l m 原子轨道
符号 1s 2s 2px 2py 2pz 3s 3px 3py 3pz
ms
取值
±1/2 ±1/2 ±1/2 ±1/2
取值 符号 取值 符号 取值 1 K 0 0 s s 0 0
2
L
1
0
p
s
0, ±1 0 0, ±1 0, ±1 ±2
1
3 M 2
p
d
±1/2
(3)4p存在,轨道数为3 (4)5d存在,轨道数为5
4.写出下列各组量子数表示的原子轨道的符号。
(1)n=1,l = 1
2p 4s 5d
(2)n=4,l = 0
(3)n=5,l = 2
5.下列几组量子数能够同时存在的 是(
A )。
A. 3、2、 2、 -1/2
B. 3、0、-1、+1/2
C. 2、2、 2、 2
(4)自旋量子数ms: 描述在能量完全相同时电子运动的特殊状态 (简称为电子自旋状态). 处于同轨道上的电子的自旋状态只有两种. 分别用符号↑、 ↓表示). 注意:自旋并不是”自转”,实际意义更为深远. (阅读教材P8 [化学与技术]) 练习:实验证明,同一原子中电子的运动状态均 不相同.试推断: 每个原子轨道最多有几个电子? 每个电子层最多有多少个电子?
4
2s:1
2p : 3
C. n=3 9
3s : 1 3p : 3 3d : 5
规律:每层的原子轨道数为层数的平方(n2)
量子理论对钠原子光谱的解释
由于钠原子的n电子层可以分为L个不
同的能级:n = 4, L = 0, 1, 2, 3; n = 3, L = 0, 1, 2;所以,当钠原子受激变成 激发态后,处于n=4的电子层的电子跃 迁到n=3的电子层的不同能级时形成的 光谱含有多条谱线。
②氢原子光谱在n=1到n=2之间谱线实际上是两条靠
得非常近的谱线.
③在磁场中所有原子光谱可能会分裂成多条谱线.
这些问题用玻尔的原子模型无法解释. 原子中电子的运动状态应用多个量子数来描述.
量子力学中单个电子的空间运动状态称为原子轨道.
每个原子轨道可由三个只能取整数的量子数n、
l 、m共同描述.
玻尔理论的局限:
光谱呢?
2、在卢瑟福的原子结构模型的基础上提 出玻尔(Bohr)的原子结构模型 (玻尔理 论的三个假设)。 (1) 原子中的电 子在具有确定半径 的圆周轨道上绕原
子核运动,并且不
辐射能量;
(2)不同轨道上运动的电子具有不同能 量,而且能量是量子化的,轨道能量依n 值(1、2、3、· · · · · )的增大而升高,n称 为量子数。对氢原子而言,电子处在n=1 的轨道是能量最低,称为基态,能量高于 基态的状态,称为激发态;
线状光谱(原子光谱)(line spectrum):
若由光谱仪获得的光谱是由具有特定波长 的、彼此分立的谱线所组成的,则所得光谱为 线状光谱。如氢原子光谱等。图1-1-3
氢原子的线状光谱
太阳光的连续光谱
[质疑] 根据卢瑟福的原子结构模型和经典的 电磁学观点,围绕原子核高速运动的电子 一定会自动且连续地辐射能量,其光谱应 是连续光谱而不应是线状光谱。那么,氢 原子的光谱为什么是线性光谱而不是连续
(2)角量子数l :描述(电子云)原子轨道的形状.
l取值为
符号为
0,1,2,3… (n-1).共n个数值.
s, p, d, f
等.
若电子n、 l 的相同,则电子的能量相同.
在一个电子层中,l 的取值有多少个,表示电子
层 有多少个不同的能级.
练习:找出下列条件下能级的数目,并写出其能级的符号
A. n=1 1 1s B. n=2 2 2s 2p
3dxy 3dyz 3dxz ±1/2 3dx2-y2 3dz2
四个量子数 ①主量子数n: 描述电子离核的远近. n取值为正整数1,2,3,4,5,6… 对应符号为 K,L,M,N,O,P… n 表示的运动状态称为电子层 ②角量子数l :描述(电子云)原子轨道的形状.
l取值为
符号为
0,1,2,3… (n-1).共n个数值. s, p, d, f 等.
二、量子力学对原子核外电子运动状态的描述
本节课的关键词:
原子轨道
主量子数 n
角量子数 l
磁量子数 m
自旋磁量子数 ms
电子云
1、原子轨道与四个量子数
(1)主量子数n: 对应符号为 描述电子离核的远近. K,L,M,N,O,P…
n取值为正整数1,2,3,4,5,6… n 所表示的运动状态称为电子层 练习:下列各层电子能量的从高到低的顺序是 A. M层 B . K层 C . N层 D . L层
物质结构理论是现代化学的重要组成部分,
也是医学、生命科学、材料科学、环境科学、能
源科学、信息科学的重要基础。
它揭示了物质构成的奥秘、物质结构与性质
的关系,有助于人们理解物质变化的本质,预测
