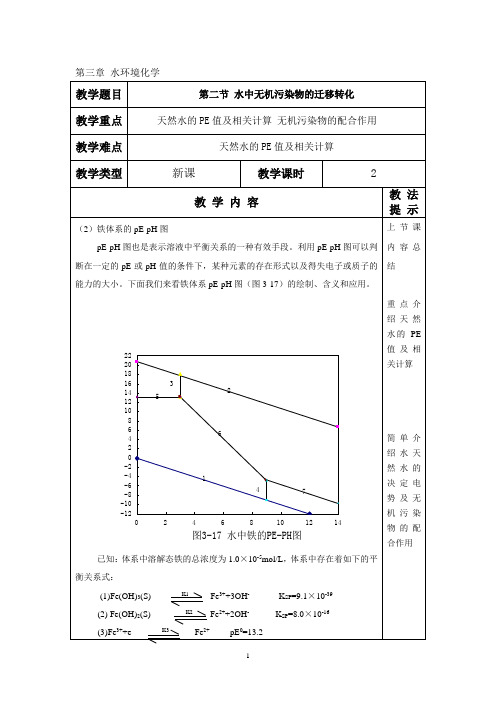
第三篇水环境化学无机污染物迁移
合集下载
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化知识交流

之,pE越大,电子浓度越低,体系接受电子的倾向就越强。
(2)氧化还原电位E和pE的关系
Ox +ne→Red
(1)
根据Nernst方程
E=E0-(2.303RT/nF)lg[Red]/[Ox] (2) 当反应达平衡时,定义
E0=(2.303RT/nF) lgK
(3)
从上述化学方程式(1),可写出
K= [Red]/{[Ox][e]n }
如果考虑到羟基配合作用,那么金属氧化物或氢氧化物的 溶解度(MeT)表征为:
MeT = [ Mez+ ] +∑[ Me(OH)nz-n ]
固体的氧化物和氢氧化物具有两性的特征,它们和质子或 羟基离子都发生反应,存在一个pH值,在该值下溶解度为最 小值。在碱性或酸性更强的pH值区域内,溶解度都会变得更 大。
因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子 的饱和浓度为: [Me2+]=Ksp/[S2-]=Ksp [H+]2/Ksp´ =Ksp [H+]2/(0.1K1K2)
3、碳酸盐
——多相平衡,pH通过控制碳酸根浓度影响沉淀平衡
封闭体系: 只考虑固相和液相,把 H2CO3* 当作不挥发酸类处理。
吸附量随粒度增大而减少,并且当溶质浓度范围固定 时,吸附量随颗粒物浓度增大而减少。
温度变化、几种离子共存(竞争作用)等。
3、沉积物中重金属的释放——属于二次污染问题
诱发释放的主要因素有: (1)盐浓度升高:碱金属和碱土金属阳离子可将被吸附在固体颗
粒上的金属离子交换出来。
(2)氧化还原条件的变化:有机物增多,产生厌氧环境、铁锰氧 化物还原溶解,使结合在其中的金属释放出来。
2、它在中性表面甚至在与吸附离子带相同电荷符号的表面 也能进行吸附作用。
环境化学第3章水环境化学-2-无机污染物的迁移转化

随pH值的变化而改变。铝可发生聚合反应,最终生成
[Al(OH)3]∞的无定形沉淀物。 ②铁:铁是丰量元素,水解反应和形态与铝类似。 ③锰:锰与铁类似,其丰度不如铁,但溶解度比铁高。 ④硅:硅酸能生成聚合物,并可生成胶体以至沉淀物。
2Si(OH)4 H6SiO7 + H2O
(SinO2n-m(OH)2m )
属污染物在水环境中迁移转化的基本原理。
思考题
1. 叙述天然水体中存在哪几类颗粒物?
2. 什么是表面吸附作用、离子交换吸附作用和专属吸附
作用?
3. 根据腐殖质在溶液中的溶解度不同划分为哪几类?
4. 叙述水中颗粒物以哪些方式进行聚集?
2.1颗粒物与水之间的迁移
★2.1.1水中颗粒物的类别 矿物微粒和黏土矿物 金属水合氧化物
吸 引
吸 引
(1)水中离子浓度高
天然水环境和水处理过程中所遇到的颗粒聚集方式: (1)压缩双电层凝聚:
由于水中电解质浓度增大而离子强度升高,压缩扩散
层,使颗粒相互吸引结合凝聚。 实质:电解质加入--与反离子同电荷离子↑--压缩双 电层--ξ电位↓--凝聚
对于水中的负电荷胶体,投入的电解质——混凝剂应是正 电荷或聚合离子,如Na+、Ca2+、Al3+等,其作用是压缩 胶体双电层。
2.2水中颗粒物的聚集
凝聚(Coagulation):由电介质促成的聚集; 絮凝(Flocculation):由聚合物促成的聚集
电位离子 反离子
滑动面
胶团边界
胶核
吸附层 扩散层
胶粒
ξ电位
Ψ电位
胶体的双电层结构
– 胶体的结构:
按照以上的描述胶体粒子的结构式可写为:
环境化学第3.2章水环境化学水中无机污染物的溶解和沉淀课件

纯水封闭体系中金属碳酸盐的溶解度
20
第三章/第二节/2.3 溶解和沉淀
2.3.4 碳酸盐 四、碳酸盐在开放体系的溶解度(二价金属)
[H2CO3*] = KHpCO2 [CO32-] = K1K2KHpCO2/[H+]2
pH>pK2(10.33) pK1<pH<pK2 (6.35~10.33) [Me2+] ≈ Ksp[H+]2/K1K2KHpCO2 pH<pK1(6.35)
第三章/第二节 水中无机污染物的迁移转化
2.3 溶解和沉淀
溶解/沉淀对迁移过程的影响
溶解/沉淀影响金属化合物溶解度,溶解度决定随水迁移能力 溶解度大,迁移能力大;溶解度小,迁移能力小
溶解/沉淀理论
溶解/沉淀受反应平衡和反应速率控制(化学热力学和动力学控制) 固-液平衡体系中,用溶度积来表征溶解度
第三章/第二节/2.3 溶解和沉淀
2.3.3 硫化物
二、金属硫化物的溶解度(以二价金属为例)
1. 金属硫化物的沉淀-溶解平衡
MeS (s) ⇌ Me2+ + S2-
[Me2+] = Ksp/[S2-]
2. H2S的电离平衡
H2S ⇌ H+ + HS- K1 = 8.9×10-8
HS- ⇌ H+ + S2-
= 2.532×10-3 mol/L
15
第三章/第二节/2.3 溶解和沉淀
2.3.4 碳酸盐
一、碳酸盐的沉淀-溶解平衡(以二价金属为例)
MeCO3 ⇌ Me2+ + CO32[Me2+] = Ksp/[CO32-] = Ksp/(CTα2)
H2CO3* ⇌ HCO3- + H+
20
第三章/第二节/2.3 溶解和沉淀
2.3.4 碳酸盐 四、碳酸盐在开放体系的溶解度(二价金属)
[H2CO3*] = KHpCO2 [CO32-] = K1K2KHpCO2/[H+]2
pH>pK2(10.33) pK1<pH<pK2 (6.35~10.33) [Me2+] ≈ Ksp[H+]2/K1K2KHpCO2 pH<pK1(6.35)
第三章/第二节 水中无机污染物的迁移转化
2.3 溶解和沉淀
溶解/沉淀对迁移过程的影响
溶解/沉淀影响金属化合物溶解度,溶解度决定随水迁移能力 溶解度大,迁移能力大;溶解度小,迁移能力小
溶解/沉淀理论
溶解/沉淀受反应平衡和反应速率控制(化学热力学和动力学控制) 固-液平衡体系中,用溶度积来表征溶解度
第三章/第二节/2.3 溶解和沉淀
2.3.3 硫化物
二、金属硫化物的溶解度(以二价金属为例)
1. 金属硫化物的沉淀-溶解平衡
MeS (s) ⇌ Me2+ + S2-
[Me2+] = Ksp/[S2-]
2. H2S的电离平衡
H2S ⇌ H+ + HS- K1 = 8.9×10-8
HS- ⇌ H+ + S2-
= 2.532×10-3 mol/L
15
第三章/第二节/2.3 溶解和沉淀
2.3.4 碳酸盐
一、碳酸盐的沉淀-溶解平衡(以二价金属为例)
MeCO3 ⇌ Me2+ + CO32[Me2+] = Ksp/[CO32-] = Ksp/(CTα2)
H2CO3* ⇌ HCO3- + H+
【环境化学】第3.2章 水环境化学——第二节 水中无机污染物的迁移转化

影响因素:表面积越大,吸附作用越强 特点:表面吸附属于物理吸附
22
吸附等温线和等温式
吸附等温线: 在固定的温度下,当吸附达到平衡时, 颗粒物表面上的吸附量(G)与溶液中溶质平衡浓度 (C)之间的关系,可用吸附等温线来表示。
吸附等温线类型:
Henry型(H型) Freundlich型(F型) Langmuir型(L型)
腐植质分子与金属络合的机理★
Hum
COO OH
-
+[Fe(OH)(H2O)x-1]2+
低pH
Hum
COO O
Fe
OH (O) x-1
+ H+
在低pH时,从腐植质的酸性基团中置换出一个质子
Hum COOHO-+ [Fe(OH)(H2O)x-1]2+
高pH
[ Hum
COO O
Fe
OOHH(H2O)x-2]-+2H+
23
H型等温式为: G = kc
k: 分配系数;等温线为直线型
F型等温式为:G = kc(1/n)
1)k 是c=1的吸附量,大致表示 吸附能力的强弱; 2)1/n为斜率,表示吸附量随 浓度增长的强度; 3)该等温线不能给出饱和吸附 量。
L型等温式: G = G0c/(A+c)
G0—单位面积上达到饱和时的 最大吸附量; A—常数。
胶体表面的化学反应(见下页胶片)
25
胶体表面的化学反应
是氢氧化物和氧化物的典型行为 与pH值有关
在酸性介质中 M(OH)n (s) + H+ → M(OH)n-1(H2O)+(s) 粒子带净正电荷
在碱性介质中 M(OH)n (s) → MO(OH)n-1-(s) + H+ 粒子带净负电荷
22
吸附等温线和等温式
吸附等温线: 在固定的温度下,当吸附达到平衡时, 颗粒物表面上的吸附量(G)与溶液中溶质平衡浓度 (C)之间的关系,可用吸附等温线来表示。
吸附等温线类型:
Henry型(H型) Freundlich型(F型) Langmuir型(L型)
腐植质分子与金属络合的机理★
Hum
COO OH
-
+[Fe(OH)(H2O)x-1]2+
低pH
Hum
COO O
Fe
OH (O) x-1
+ H+
在低pH时,从腐植质的酸性基团中置换出一个质子
Hum COOHO-+ [Fe(OH)(H2O)x-1]2+
高pH
[ Hum
COO O
Fe
OOHH(H2O)x-2]-+2H+
23
H型等温式为: G = kc
k: 分配系数;等温线为直线型
F型等温式为:G = kc(1/n)
1)k 是c=1的吸附量,大致表示 吸附能力的强弱; 2)1/n为斜率,表示吸附量随 浓度增长的强度; 3)该等温线不能给出饱和吸附 量。
L型等温式: G = G0c/(A+c)
G0—单位面积上达到饱和时的 最大吸附量; A—常数。
胶体表面的化学反应(见下页胶片)
25
胶体表面的化学反应
是氢氧化物和氧化物的典型行为 与pH值有关
在酸性介质中 M(OH)n (s) + H+ → M(OH)n-1(H2O)+(s) 粒子带净正电荷
在碱性介质中 M(OH)n (s) → MO(OH)n-1-(s) + H+ 粒子带净负电荷
第三章 水环境化学水中无机污染物的迁移转化汇总

20
1. 胶体颗粒凝聚的基本原理和方式
1) 带电胶粒稳定性的经典理论--DLVO理论 带电胶粒的两种相互作用力
双电层重叠时的静电排斥力 粒子间的长程范德华吸引力
DLVO理论认为,当吸引力占优势时,溶胶发生聚 沉; 当排斥力占优势,并大到足以阻碍胶粒由于 布朗运动而发生聚沉时,则胶体处于稳定状态。 颗粒在相互接近时两种力相互作用的总位能随相 隔距离的变化而变化: 总位能 VT=VR+VA 式中:VA——由范德华力所产生的位能; VR——由静电排斥力所产生的位能。
4
一 、 颗粒物与水之间的迁移
2、水环境中颗粒物的吸附作用
专属吸附是指吸附过程中,除了化学键的作
用外,尚有加强的憎水键和范德华力或氢键在 起作用。
专属吸附作用不但可使表面电荷改变符号, 而且可使离子化合物吸附在同号电荷的表面上。
5
表3-8水合氧化物对金属离子的专属吸附 与非专属吸附的区别
项目 非专属吸附 专属吸附 发生吸附的表面净电荷的符号 - -、0、+ 金属离子所起的作用 反离子 配位离子 吸附时发生的反应 阳离子交换 配位体交换 发生吸附时体系的PH值 >零电位点 任意值 吸附发生的位置 扩散层 内层 对表面电荷的影响 无 负电荷减少, 正电荷增多 注:本表摘自陈静生主编,1987。
(4)水体悬浮沉积物
悬浮沉积物是以矿物微粒,特别是粘土矿物 为核心骨架,有机物和金属水合氧化物结合在矿 物微粒表面上,成为各微粒间的粘附架桥物质, 把若干微粒组合成絮状聚集体(聚集体在水体中 的悬浮颗粒粒度一般在数十微米以下),经絮凝 成为较粗颗粒而沉积到水体底部。
(5)其他
3
一、 颗粒物与水之间的迁移
环境化学-第三章-第2节-水中无机污染物的迁移转化概述

1/ G 1/ G0 ( A / G0 )(1/ C)
G0—单位表面上达到饱和时的最大吸量
A—常数
(p122 图3-4)
2021/3/25
15
4 沉积物中重金属的释放(p125)
沉积物中的重金属可能重新进入水体,这 是产生二次污染的主要原因。
碱金属和碱土金属离子可将吸附在颗粒 物表面的重金属离子置换出来,这是重金属 从颗粒物表面解吸的重要途径之一。
氧化还原条件的变化,使金属以水合离 子解吸。
2021/3/25
16
4 沉积物中重金属的释放(p125)
水环境pH值的降低,导致硫酸盐和氢 氧化物的溶解
废水中配合剂的含量增加,和重金属 形成稳定的可溶性配合物,使重金属 重新进入水体,以上几种途径都有可 能构成环境水体重金属的二次污染
2021/3/25
聚多胺,聚丙烯酰胺,阳离子型 (淀粉-二甲基二烯丙基氯化铵接枝 共聚物), 两性絮凝剂等。
复合型絮凝剂
2021/3/25
24
三、沉淀和溶解
1. 金属氧化物和氢氧化物
M (OH )n (S ) M n nOH
KSP [M n ][OH ]n
[M
n
]
K SP [OH
]n
2021/3/25
25
将[Fe(OH)+] = 1.0×10-7 mol/L代入,
pH = 11.6
(2)
2021/3/25
49
pE – pH 图
Fe(OH)3(S) Fe2+的边界 Fe(OH)3(S) + 3H+ + e = Fe2+ + 3H2O
K
Re d Ox en
G0—单位表面上达到饱和时的最大吸量
A—常数
(p122 图3-4)
2021/3/25
15
4 沉积物中重金属的释放(p125)
沉积物中的重金属可能重新进入水体,这 是产生二次污染的主要原因。
碱金属和碱土金属离子可将吸附在颗粒 物表面的重金属离子置换出来,这是重金属 从颗粒物表面解吸的重要途径之一。
氧化还原条件的变化,使金属以水合离 子解吸。
2021/3/25
16
4 沉积物中重金属的释放(p125)
水环境pH值的降低,导致硫酸盐和氢 氧化物的溶解
废水中配合剂的含量增加,和重金属 形成稳定的可溶性配合物,使重金属 重新进入水体,以上几种途径都有可 能构成环境水体重金属的二次污染
2021/3/25
聚多胺,聚丙烯酰胺,阳离子型 (淀粉-二甲基二烯丙基氯化铵接枝 共聚物), 两性絮凝剂等。
复合型絮凝剂
2021/3/25
24
三、沉淀和溶解
1. 金属氧化物和氢氧化物
M (OH )n (S ) M n nOH
KSP [M n ][OH ]n
[M
n
]
K SP [OH
]n
2021/3/25
25
将[Fe(OH)+] = 1.0×10-7 mol/L代入,
pH = 11.6
(2)
2021/3/25
49
pE – pH 图
Fe(OH)3(S) Fe2+的边界 Fe(OH)3(S) + 3H+ + e = Fe2+ + 3H2O
K
Re d Ox en
第三章 第二节 水中无机污染物的迁移转化要点

吸附:指溶液中的溶质在界面层浓度升高的现象。
常见的吸附等温线
G G
n是一个经验 值,不是由一个 过程控制,一般 适用于有机物 lgG
lgK
H型
G0/2
单分子吸附 适用于金属
L型 c
L型 1/c
0 A
当溶质浓度甚低时,可能在初始阶段呈现 H 型,当浓度较 高时,可能表现为 F 型,但统一起来仍属于 L 型的不同区段。
2、异体凝聚理论
(1)适用条件:适用于物质本性不同、粒径不等、电荷符
号不同、电位高低不等的分散体系。 (2)主要论点: A、电荷符号相异的胶体微粒接近时,吸引力总是占优势; B、电荷符号相同但电性强弱不等,则位能曲线上的能峰高 度总是决定于荷电较弱而电位较低的一方。
因此异体凝聚时,只要有一种胶体的稳定性甚低而电位
纯饱和溶液中 [S2-]= Ksp/ [H+]2 = 1.16×10-23 / 8.9×10-9 = 1.3×10-15mol/L 任意水体中 [S2-]= 1.16×10-23 / [H+]2 [Me2+] [S2-]=Ksp 因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子
的饱和浓度为:
2、硫化物
H2S H++ HSK1 = 8.9×10-8 HSH++ S2K2 = 1.3×10-15 两者相加可得: H2S 2H+ + S2K12 = K1·K2 = 1.16×10-22
在饱和水溶液中,H2S 浓度总是保持在 0.1mol/L,因此可认
为饱和溶液中 H2S 分子浓度也保持在 0.1mol/L,得: [H+]2[S2-] =1.16×10-22×0.1 = 1.16×10-23 = Ksp´
常见的吸附等温线
G G
n是一个经验 值,不是由一个 过程控制,一般 适用于有机物 lgG
lgK
H型
G0/2
单分子吸附 适用于金属
L型 c
L型 1/c
0 A
当溶质浓度甚低时,可能在初始阶段呈现 H 型,当浓度较 高时,可能表现为 F 型,但统一起来仍属于 L 型的不同区段。
2、异体凝聚理论
(1)适用条件:适用于物质本性不同、粒径不等、电荷符
号不同、电位高低不等的分散体系。 (2)主要论点: A、电荷符号相异的胶体微粒接近时,吸引力总是占优势; B、电荷符号相同但电性强弱不等,则位能曲线上的能峰高 度总是决定于荷电较弱而电位较低的一方。
因此异体凝聚时,只要有一种胶体的稳定性甚低而电位
纯饱和溶液中 [S2-]= Ksp/ [H+]2 = 1.16×10-23 / 8.9×10-9 = 1.3×10-15mol/L 任意水体中 [S2-]= 1.16×10-23 / [H+]2 [Me2+] [S2-]=Ksp 因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子
的饱和浓度为:
2、硫化物
H2S H++ HSK1 = 8.9×10-8 HSH++ S2K2 = 1.3×10-15 两者相加可得: H2S 2H+ + S2K12 = K1·K2 = 1.16×10-22
在饱和水溶液中,H2S 浓度总是保持在 0.1mol/L,因此可认
为饱和溶液中 H2S 分子浓度也保持在 0.1mol/L,得: [H+]2[S2-] =1.16×10-22×0.1 = 1.16×10-23 = Ksp´
环境化学教案 第三节水中无机污染物的迁移转化(氧化还原2)
水中有机物可以通过微生物的作用,而逐渐降解转化为无机物。在有机物进入水体后,微生物利用不中的溶解氧对有机物进行有氧降解。其反应式中表示为
由此反应可知,当有机物进入天然水后,水体中溶解氧的含量会迅速降低。如果有机物的数量非常多的话,可以使水体中溶解氧全部被消耗掉,甚至可以使水体转换成为沼泽。在水中,NH4+只有被氧化成NO3-后,氮才能被藻类利用。
例2求被大气氧所饱合的中性天然水的pE值。
解:该体系溶解氧起决定电势作用,溶解氧的氧化还原反应为:
pE=pE0+ [H+]
已知:pE0=20.75
pH=7 [H+]=10-7
将已知条件代入pE的表达式,得:pE=13.58。该体系pE值较高,是一个氧化性体系。
例3求微生物作用产生甲烷的中性厌氧水的pE值及溶解氧的分压
天然水是一个非常复杂的混合体系,其中存在着众多的氧化剂和还原剂。其中常见的氧化剂包括溶解氧、Mn(IV)、Fe(III)、和S(VI),常见的还原剂包括有机物、Mn(II)、Fe(II)、S(-II)。当我们要求得某种天然水的pE值时,首先需要确定哪种物质起决定电势作用,然后根据起决定电势作用物质的氧化还原反应,求得体系的pE值。一般的天然水体中起决定电势作用的物质是溶解氧,当有机物含量非常高时,则有机物起决定电势作用。铁和锰起决定电势作用的情况则比较少见。下面我们来看两种极端情况下体系的pE值。
pE=-4.13
将已知条件代入pE的表达式,得: =3.0×10-72atm。
由此可见该体系中溶解氧的分压非常低,一般水体中的溶解氧的分压均超过此值。由于天然水的pE值随水中溶解氧的减少而降低,因此表层水pE值较高,底层水pE值较低。
例3:从湖水中取出深层水,其PH=7.0,含溶解氧浓度0.32mg/L,请计算PE和Eh。(KH=1.26*10-8[mol/(L·Pa)]
由此反应可知,当有机物进入天然水后,水体中溶解氧的含量会迅速降低。如果有机物的数量非常多的话,可以使水体中溶解氧全部被消耗掉,甚至可以使水体转换成为沼泽。在水中,NH4+只有被氧化成NO3-后,氮才能被藻类利用。
例2求被大气氧所饱合的中性天然水的pE值。
解:该体系溶解氧起决定电势作用,溶解氧的氧化还原反应为:
pE=pE0+ [H+]
已知:pE0=20.75
pH=7 [H+]=10-7
将已知条件代入pE的表达式,得:pE=13.58。该体系pE值较高,是一个氧化性体系。
例3求微生物作用产生甲烷的中性厌氧水的pE值及溶解氧的分压
天然水是一个非常复杂的混合体系,其中存在着众多的氧化剂和还原剂。其中常见的氧化剂包括溶解氧、Mn(IV)、Fe(III)、和S(VI),常见的还原剂包括有机物、Mn(II)、Fe(II)、S(-II)。当我们要求得某种天然水的pE值时,首先需要确定哪种物质起决定电势作用,然后根据起决定电势作用物质的氧化还原反应,求得体系的pE值。一般的天然水体中起决定电势作用的物质是溶解氧,当有机物含量非常高时,则有机物起决定电势作用。铁和锰起决定电势作用的情况则比较少见。下面我们来看两种极端情况下体系的pE值。
pE=-4.13
将已知条件代入pE的表达式,得: =3.0×10-72atm。
由此可见该体系中溶解氧的分压非常低,一般水体中的溶解氧的分压均超过此值。由于天然水的pE值随水中溶解氧的减少而降低,因此表层水pE值较高,底层水pE值较低。
例3:从湖水中取出深层水,其PH=7.0,含溶解氧浓度0.32mg/L,请计算PE和Eh。(KH=1.26*10-8[mol/(L·Pa)]
第3节 无机污染物的迁移转化

胡敏素(黑色不溶物) 腐殖质 用 0.2MNaOH 萃取 溶液 用盐酸酸化分为 溶液: 富里酸 沉积物: 腐殖酸
其中:腐殖酸是能溶于碱而沉于酸的组分;富里酸是兼能 溶于碱和酸的组分;胡敏素是酸碱皆不溶的组分。
水环境中发现的腐殖质大部分为富里酸这一类,原因在于 易溶于水,来源有二:一部分是水生植物的分泌物和降解产物; 另一部分来自土壤,由土壤淋溶液和泾流带入水体。河水中腐 殖质平均含量在10~15mg/L,但起源于沼泽地带的河流其含量 要丰富的多。
1 1 1 1 G b ab c
3
沉积物中重金属的释放
此为二次污染问题,诱发释放的主要因素有: (1) 盐浓度升高:碱金属及碱土金属离子浓度较高时可将 颗粒表面吸附的重金属离子交换而释放出来。
(2) 氧化还原条件的变化:在较低电位下铁锰氧化物溶解 度大增,使被吸附或共沉淀的重金属离子释放出来。
2 3 3 3 1 1 2 3 2 1 2 2 2 3 3 3 1 1 2
2
2= CO
3
CO KK H CO HCO CO H K H K K
CT = [ CO32- ] + [ HCO3- ] + [ H2CO3 ]
Ca
将各氢氧化物的Ksp 代入并以lg [Men+] 对 pH 作图即可得到p.132.图3-11各金属氢氧化物的溶解 度。 用的更多的是将其溶解度表达式写为:
pc = pKsp - n pKw + n pH
例:已知氧化铅与羟基配合物的反应和平衡常数如下 (25℃): PbO(s) + 2 H+ = Pb2+ + H2O lg Ks0 = 12.7 PbO(s) + H+ = PbOH+ lg Ks1 = 5.0 PbO(s) + H2O = Pb(OH)20 lg Ks2 = -4.4 PbO(s) + 2 H2O = Pb(OH)3- + H+ lg Ks3 = -15.4 画出可溶性各型体的溶解度曲线并求出其溶解度。 解:Ks0 = [Pb2+] / [H+]2 [Pb2+] = Ks0 [H+]2 lg [Pb2+] = lg Ks0 -2 pH [PbOH+] = Ks1 [H+] lg [PbOH+] = lg Ks1 - pH [Pb(OH)20] = Ks2 lg [Pb(OH)20] = lg Ks2 [Pb(OH)3-] = Ks3 / [H+] lg[Pb(OH)3-] = lg Ks3 + pH 在画线时同时要画出[H+]和[OH-]这两条线: lg [H+] = - pH 而 lg [OH-] = pH- 14 以 lg c ~ pH 作图即为 P. 133. 图 3-12 PbO溶解度图。
其中:腐殖酸是能溶于碱而沉于酸的组分;富里酸是兼能 溶于碱和酸的组分;胡敏素是酸碱皆不溶的组分。
水环境中发现的腐殖质大部分为富里酸这一类,原因在于 易溶于水,来源有二:一部分是水生植物的分泌物和降解产物; 另一部分来自土壤,由土壤淋溶液和泾流带入水体。河水中腐 殖质平均含量在10~15mg/L,但起源于沼泽地带的河流其含量 要丰富的多。
1 1 1 1 G b ab c
3
沉积物中重金属的释放
此为二次污染问题,诱发释放的主要因素有: (1) 盐浓度升高:碱金属及碱土金属离子浓度较高时可将 颗粒表面吸附的重金属离子交换而释放出来。
(2) 氧化还原条件的变化:在较低电位下铁锰氧化物溶解 度大增,使被吸附或共沉淀的重金属离子释放出来。
2 3 3 3 1 1 2 3 2 1 2 2 2 3 3 3 1 1 2
2
2= CO
3
CO KK H CO HCO CO H K H K K
CT = [ CO32- ] + [ HCO3- ] + [ H2CO3 ]
Ca
将各氢氧化物的Ksp 代入并以lg [Men+] 对 pH 作图即可得到p.132.图3-11各金属氢氧化物的溶解 度。 用的更多的是将其溶解度表达式写为:
pc = pKsp - n pKw + n pH
例:已知氧化铅与羟基配合物的反应和平衡常数如下 (25℃): PbO(s) + 2 H+ = Pb2+ + H2O lg Ks0 = 12.7 PbO(s) + H+ = PbOH+ lg Ks1 = 5.0 PbO(s) + H2O = Pb(OH)20 lg Ks2 = -4.4 PbO(s) + 2 H2O = Pb(OH)3- + H+ lg Ks3 = -15.4 画出可溶性各型体的溶解度曲线并求出其溶解度。 解:Ks0 = [Pb2+] / [H+]2 [Pb2+] = Ks0 [H+]2 lg [Pb2+] = lg Ks0 -2 pH [PbOH+] = Ks1 [H+] lg [PbOH+] = lg Ks1 - pH [Pb(OH)20] = Ks2 lg [Pb(OH)20] = lg Ks2 [Pb(OH)3-] = Ks3 / [H+] lg[Pb(OH)3-] = lg Ks3 + pH 在画线时同时要画出[H+]和[OH-]这两条线: lg [H+] = - pH 而 lg [OH-] = pH- 14 以 lg c ~ pH 作图即为 P. 133. 图 3-12 PbO溶解度图。
第三章水环境化学

总含盐量(TDS):
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
第三章水环境化学水中无机污染物的迁移

3.2 硫化物
H2S = H+ + HS— HS— = H+ + S2— 即: H2S = 2H+ + S2— 则:K1,2 = [H+][S2—]/[H2S] =K1 K2 = 1.16×10-22 如溶液中存在二价金属离子Me2+,则有: [Me2+][S2-] = Ksp
5、配合作用
5.1 配合物在溶液中的稳定性 5.2 羟基对重金属离子的配合作用 5.3 氯离子对重金属的配合作用 5.4 腐殖质的配合作用 5.5 有机配体对重金属迁移的影响
5.4 腐殖质的配合作用
天然水中对水质影响最大的有机物是腐殖质。 它有生物体物质在土壤、水和沉积物中转化而 来。可分为: 腐殖酸(Humic acid):可溶于稀碱液,但不 溶于酸的部分 富里酸(Fulvic acid) :可溶于碱液,又可溶于 酸的部分 腐黑物(Humin):不能被酸和碱提取的部分 研究表明:重金属在天然水中主要以腐殖酸的 配合物存在。
4.4 无机氮氧化物的氧化还原转化
水中氮主要以NH4+或NO3—形态存在, 在某种情况下也可能有中间产物NO2—。
4.5 无机铁的氧化还原转化
Fe3+ + e → Fe2+ pE0=13.05 当pE<<pE0时, [Fe3+]<<[Fe3+] 当pE>>pE0时, [Fe3+]>>[Fe3+]
第二节 水中无机污染物的迁移转化
1、颗粒物与水之间的迁移 2、水中颗粒物的聚集 3、溶解和沉淀 4、氧化-还原
水中无机物的迁移转化part

静电位能
范德华力位能
第一最小值 (发生永久性凝聚)
第二最小值 (发生可逆凝聚)
图3-1 总位能曲线
影响位能曲线的因素
①不同溶液离子强度有不同VR曲线,颗粒间的距离 ↑→VR按指数律↓;
②VA与溶液中离子强度无关, 颗粒间的距离↑→ VA↑(绝对值变小);
③不同溶液离子强度有不同的VT曲线。
在溶液离子强度较小时,总位能曲线上出现较大位能峰 (Vmax)。此时,排斥作用占较大优势,颗粒借助于热运 动能量不能超越此位能峰,彼此无法接近,体系保持分 散稳定状态。
(2)氧化还原条件的变化 水环境中有较多耗氧物质,使一定深度下的沉积 物中的氧化还原电位↓→Fe(Ⅲ)、Mn(Ⅳ)等被还 原成Fe(Ⅱ)、Mn(Ⅱ)从而释放出来。
❖ 诱发释放的主要因素
(1)盐浓度升高 (2)氧化还原条件的变化 (3)降低pH值
pH降低,导致碳酸盐和氢氧化物的溶解,H+的竞争作用 增加了金属离子的解吸量。
第二节 水中无机污染物的迁移转化
一、颗粒物与水之间的迁移
1.水中颗粒物的类别 2.水环境中颗粒物的吸附作用 3.沉积物中金属的释放
二、水中颗粒物的聚集
1.胶体颗粒凝聚的基本原理和方式 2.胶体颗粒絮凝动力学
三、溶解和沉淀
1.氧化物和氢氧化物 2.硫化物 3.碳酸盐
四、氧化-还原 五、配合作用
第二节 水中无机污染物的迁移转化
❖ 吸附:指溶液中的溶质自动附着在固体表面的现象, 或者,溶质在固液两相界面层浓度升高的现象
❖ 固体表面具有多余的表面能,通常表面能减小的过 程是通过颗粒物的聚集或对溶质的吸附来完成的
❖ 吸附过程的分类 ①物理吸附:由分子间力引起,无选择性 ②化学吸附:由化学键引起,有选择性
环境化学第三章__水环境化学(PPT)

氧的分压为(1.0130-0.03167)×105×0.2095 =0.2056×105 Pa
第十二页,共九十页。
代入亨利定律即可求出氧在水中的摩尔(mó ěr)浓度为:
[O2(aq)]= KH·PO2=1.26×10-8×0.2056×105 =2.6×10-4 mol/L
氧的分子量为32,因此其溶解度为8.32 mg/L。
第三章 水环境 化学 (huánjìng)
第一节 天然水的根本特征及污染物的存在形态(xíngtài)
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化
第一页,共九十页。
内容提要: 本章主要介绍天然水的根本特征,水中重要污染物存在形态及分布, 污染物在水环境中的迁移转化(zhuǎnhuà)的根本原理。
第二十三页,共九十页。
❖❖[图CO中3的2p-]H可=以8.3忽可略以不作计为,一水个分中界只点有,[CpOH2<〔8.a3q,〕很]、小[,H22CO3]、
❖[HCO3-],可以只考虑一级电离平衡(pínghéng),即此时:
❖
❖❖❖当溶所液以的ppHH>=8p[.3KH时1-],lg[[KHH122[CC[HHOO23C3C**]OO3]+3可*]l]g以[H忽C略O不3-计]。,水中只存在
P↑↓R
C 1 0 6H 2 6 3 O 1 1 0N 1 6P 1 3 8 O 2
第十七页,共九十页。
〔二〕天然水的性质(xìngzhì)
1、碳酸平衡〔重点〕
对于CO2-H2O系统,水体中存在着CO2〔aq〕、H2CO3、HCO3-和CO32-等 四种化合态,常把CO2(aq)和H2CO3合并为H2CO3*,实际上H2CO3含量 (hánliàng)极低,主要是溶解性气体CO2(aq)。
第十二页,共九十页。
代入亨利定律即可求出氧在水中的摩尔(mó ěr)浓度为:
[O2(aq)]= KH·PO2=1.26×10-8×0.2056×105 =2.6×10-4 mol/L
氧的分子量为32,因此其溶解度为8.32 mg/L。
第三章 水环境 化学 (huánjìng)
第一节 天然水的根本特征及污染物的存在形态(xíngtài)
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化
第一页,共九十页。
内容提要: 本章主要介绍天然水的根本特征,水中重要污染物存在形态及分布, 污染物在水环境中的迁移转化(zhuǎnhuà)的根本原理。
第二十三页,共九十页。
❖❖[图CO中3的2p-]H可=以8.3忽可略以不作计为,一水个分中界只点有,[CpOH2<〔8.a3q,〕很]、小[,H22CO3]、
❖[HCO3-],可以只考虑一级电离平衡(pínghéng),即此时:
❖
❖❖❖当溶所液以的ppHH>=8p[.3KH时1-],lg[[KHH122[CC[HHOO23C3C**]OO3]+3可*]l]g以[H忽C略O不3-计]。,水中只存在
P↑↓R
C 1 0 6H 2 6 3 O 1 1 0N 1 6P 1 3 8 O 2
第十七页,共九十页。
〔二〕天然水的性质(xìngzhì)
1、碳酸平衡〔重点〕
对于CO2-H2O系统,水体中存在着CO2〔aq〕、H2CO3、HCO3-和CO32-等 四种化合态,常把CO2(aq)和H2CO3合并为H2CO3*,实际上H2CO3含量 (hánliàng)极低,主要是溶解性气体CO2(aq)。
优选环境化学第三章水中无机污染物的迁移转化

2020/9/4
21
水处理中新型絮凝剂
无机高分子絮凝剂 以三氯化铁、硫酸铝和碱式氯化铝等 为基体制备 如:聚合硫酸铁(poly ferric sulfate, PFS)、含硼聚硅硫酸铁、聚合硅铝酸铁 等Al2(SO4)3- CPAM(阳离子聚丙烯胺)
2020/9/4
22
水处理中新型絮凝剂
有机高分子絮凝剂
2020/9/4
18
天然水环境和水处理条件下主要的颗 粒物聚集方式
1.压缩双电层的聚集
水中电解质浓度增大而离子强度增大, 压缩扩散层,颗粒物吸引而聚集
2. 专属吸附凝聚
胶体颗粒专属吸附异电的离子化合态, 降低表面电位,产生电中和现象,使颗粒 物聚集
2020/9/4
19
天然水环境和水处理条件下主要的颗 粒物聚集方式
2020/9/4
7
一、颗粒物与水之间的迁移
悬浮沉积物
各种环境胶体物质的聚集物,组成不固定
其他
湖泊中的藻类、污水中的细菌、病毒、废 水中的表面活性剂或油滴。
2020/9/4
8
2.水环境中颗粒物的吸附作用
表面吸附—物理吸附,与胶体的比表面 积有关。
离子交换吸附—物理化学吸附,水环境中 一部分胶体带负电荷,吸附一部份阳离子, 同时释放等量其它阴离子。
属可逆反应,不受温度影响,交换吸附能力 与溶质的性质、浓度、吸附剂性质有关
2020/9/4
9
2.水环境中颗粒物的吸附作用
专属吸附—受化学键作用外,还受加强 的憎水键、 范德华力、氢键等的作用。 在水环境中:配合离子、无机高分子、有 机离子、 有机高分子专属吸附强烈,水 合氧化物胶体对金属离子有较强的专属吸 附。 氧化物表面配位吸附模式(p124)
资源与环境化学 第三章 第一部分(天然水组成与化学平衡)

不同温度下气体在水中的溶解度:Clausius-Clapeyron方程
C2 H 1 1 lg ( ) C1 2.303 R T1 T2 C1 , C2 为绝对温度为T1 , T2时气体在水中的溶解度 H 溶解热, J/mol R 气体常数,8.314 J/mol K
《资源与环境化学》 第三章 水环境化学
第三章 水环境化学
Chapter 3. Aquatic Environmental Chemistry
第一部分 天然水的组成与化学平衡
主讲:刘耀驰
中南大学化学化工学院
第1页
《资源与环境化学》 第三章 水环境化学
本章重点
无机污染物在水体中进行沉淀-溶解、氧化还原、配合作用、吸附-解吸、絮凝-沉淀的基 本原理; 计算水体中金属存在形态;
《资源与环境化学》 第三章 水环境化学
(3) 气体在水中的溶解性
亨利定律:大气中的气体与溶液中同种气体间的平衡为:
kH 是各种气体在一定温度 下的亨利定律常数 (mol/L· Pa),pg为分压
[G(aq)] = kH×pg
亨利定律并不能说明气体在溶液中进一步的化学反应 溶解于水中的实际气体量,可以大大高于亨利定律表示的量
K2
2 ] [H ][CO 3 -] [HCO 3
K1[H 2CO3 ] [HCO 3 ] [H ] 2 ] K 2 K1[H 2CO3 ] [CO3 [H ]
第10页
《资源与环境化学》 第三章 水环境化学
(4) 水生生物
生态系统、食物链中的一个重要环节; 生产者、消费者、分解者; 自养生物、异养生物; 生产率、富营养化、C、N、P
第11页
第3章:水环境化学2-1

一、颗粒物与水之间的迁移
1、水中颗粒物的类别
天然水中颗粒物主要包括五大类:矿物、金属水合氧 化物、腐殖质、悬浮物、其他泡沫、表面活性剂等半胶体 以及藻类、细菌、病毒等生物胶体。
(1)非粘土矿物和粘土矿物:都是原生岩石在风化过程 中形成的。
非 粘 土 矿 物 : 天 然 水 中 常 见 为 石 英 (SiO2) 、 长 石 (KalSi3O8)等,晶体交错,结实、颗粒粗,不易碎裂,缺 乏粘结性(例如沙子主要成分为:SiO2)。
第二节、水中无机污染物的迁移转化
一、颗粒物与水之间的迁移 二、水中胶体颗粒物聚集的基本原理和方式 三、溶解和沉淀 四、氧化—还原
五、配合作用
无机污染物,特别是重金属和准金属等污染物,一旦进入 水环境,不能被生物降解;
主要通过吸附—解吸、沉淀—溶解、氧化—还原、配合作 用、胶体形成等一系列物理化学作用进行迁移转化,参与和 干扰各种环境化学过程和物质循环过程; 最终以一种或多种形式长期存留在环境中,造成永久性的 潜在危害。 重点介绍重金属污染物在水环境中迁移转化的基本原理。
在水环境中,配合离子、有机离子、有机高分子和无机高 分子的专属吸附作用特别强烈。例如,简单的Al3+、Fe3+高 价离子并不能使胶体电荷因吸附而变号,但其水解产物却 可达到这种效果,这就是发生专属吸附的结果。 水合氧化物胶体对重金属离子有较强的专属吸附作用,这 种吸附作用发生在胶体双电层的 Stern层中,被吸附的金属 离子进入Stern层后。不能被通常提取交换性阳离子的提取 剂提取,只能被亲和力更强的金属离子取代,或在强酸性 条件下解吸。
粘土矿物:天然水中常见为云母、蒙脱石、高 岭石,层状结构,易于碎裂,颗粒较细,具有粘 结性,可以生成稳定的聚集体。
第三章 水中无机污染物的迁移转化

腐殖酸和腐黑物: 碳:50%~60%,
氧:30%~35%, 氢:4%~6%, 氮:2%~4%
富里酸 :
碳和氮:44%~50%和1%~3%。氧:44%~50%
(不同地区和不同来源的腐殖质其分子量组成和元素组成都有区别)
腐殖质结构特点: 腐殖质结构特点
苯环、羧基、醇基和酚基
14
富里酸结构式
15
水环境中的配位作用--腐殖质配合作用 腐殖质配合作用
天然水、污水的氧化天然水、污水的氧化-还原反应
----微生物催化反应 ---电子迁移+质子迁移 氧化-还原反应缓慢 还原反应缓慢) (氧化 还原反应缓慢)
pE---pH 天然水体的 pE--pH 图
氧化还原体系,H+或OH¯参与转移。 pE除了与氧化态和还原态浓度有关外,受体系pH的影响,可以 用pE-pH 图来表示。 pE -pH 图可显示水中各形态的稳定范围及边界线。
胶体微粒吸附高分子电解质而凝聚。 聚合物具有链状分子,可以同时吸附在若干个胶体微粒上,在微 粒之间架桥粘结,使它们聚集成团。
(7)无机高分子的絮凝 (8)絮团卷扫絮凝 (9ห้องสมุดไป่ตู้颗粒层吸附絮凝 10) (10)生物絮凝
藻类、细菌等具有胶体性质,带电荷,发生凝聚。 胶体性质,带电荷,发生凝聚。 胶体性质
7
9
水体环境的氧化-还原作用
--污染物氧化还原转化 --污染物氧化还原转化 1. 2. 3. 4. 重金属 氮化物 硫 砷
砷可能存在的形态:H3AsO3、H2AsO3-、H3AsO4、H2AsO4-、 HAsO42-,最主要的是以H2AsO4-和HAsO42-五价形态存在。 pH< 4酸性水体,可能存在H3AsO4和AsO+ pH> l2.5碱性水体,还可能存在AsO43-,甚至HAsO32-及AsO33-形态
氧:30%~35%, 氢:4%~6%, 氮:2%~4%
富里酸 :
碳和氮:44%~50%和1%~3%。氧:44%~50%
(不同地区和不同来源的腐殖质其分子量组成和元素组成都有区别)
腐殖质结构特点: 腐殖质结构特点
苯环、羧基、醇基和酚基
14
富里酸结构式
15
水环境中的配位作用--腐殖质配合作用 腐殖质配合作用
天然水、污水的氧化天然水、污水的氧化-还原反应
----微生物催化反应 ---电子迁移+质子迁移 氧化-还原反应缓慢 还原反应缓慢) (氧化 还原反应缓慢)
pE---pH 天然水体的 pE--pH 图
氧化还原体系,H+或OH¯参与转移。 pE除了与氧化态和还原态浓度有关外,受体系pH的影响,可以 用pE-pH 图来表示。 pE -pH 图可显示水中各形态的稳定范围及边界线。
胶体微粒吸附高分子电解质而凝聚。 聚合物具有链状分子,可以同时吸附在若干个胶体微粒上,在微 粒之间架桥粘结,使它们聚集成团。
(7)无机高分子的絮凝 (8)絮团卷扫絮凝 (9ห้องสมุดไป่ตู้颗粒层吸附絮凝 10) (10)生物絮凝
藻类、细菌等具有胶体性质,带电荷,发生凝聚。 胶体性质,带电荷,发生凝聚。 胶体性质
7
9
水体环境的氧化-还原作用
--污染物氧化还原转化 --污染物氧化还原转化 1. 2. 3. 4. 重金属 氮化物 硫 砷
砷可能存在的形态:H3AsO3、H2AsO3-、H3AsO4、H2AsO4-、 HAsO42-,最主要的是以H2AsO4-和HAsO42-五价形态存在。 pH< 4酸性水体,可能存在H3AsO4和AsO+ pH> l2.5碱性水体,还可能存在AsO43-,甚至HAsO32-及AsO33-形态
