BIO-RAD电穿孔
BIO-RAD电穿孔

与任何电穿孔缓冲液都兼容,包括Bio-Rad的Gene Pulser电穿孔缓冲液
电转化仪
仪器型号:GenePulser II
生产商:USA Bio-Rad工作原理:Gene PulserⅡ电转化仪器可用于原核细胞、酵母和哺乳动物细胞的转化。仪器采用Pulse Trac波形传送系统,能产生最精确的指数衰减的脉冲,可在电转化杯里获得最佳的细胞转化。
同时取100μl感受态加0.01ngpuc18直接电穿孔转化,检测转化效率。
9.次日观察转化子生长情况,并记录。
2.连接产物纯化
1.将连接产物转移至一1.5mlEppendorf管中,加入下列试剂:
10ul of ddH2O
2ul of 3M NaAC(PH5.2)
50ul of无水乙醇
轻轻混匀,稍微离心并将其置于-20℃放置1小时以上;
系统参数:
输入电压220-240V,50-60HZ
输入电流15A
最大输出电压和电流2500V,125A(正常负荷)
电弧时限定值1500A
输出波形Pulse Trac指数衰减,RC时间常数取决于所选的样品和电容器
输出电压调节50-2500V范围(取决于电容器)内,低电压范围(50-500V)和
高电压范围分别具有2V和10V的调节精度。
工作环境温度0-35oC
湿度0-95%,无冷凝
简易操作指南:1:打开电源
2:根据自己的情况设置参数:如电容 c=25F, 电压 v=1.8kV (0.1cm电击杯),R=200
3:将电击杯两壁水檫干
4:电转:所产生的时间常数一般为4.6—5.0ms
美国伯乐电转化仪使用说明

Gene pulser xcell TM Electroporation system quick guide产品名称: Gene Pulser Xcell 电穿孔系统产品型号: Gene Pulser Xcell 电穿孔系统产品展商: 众磊(北京)生物科技发展有限公司驻沪办简单介绍Gene Pulser Xcell 电穿孔系统Gene Pulser Xcell 电穿孔系统的详细介绍【介绍】电穿孔是功能强大的将核酸、蛋白及其它分子导入多种细胞的高效技术。
通过高强度的电场作用,瞬时提高细胞膜的通透性,从而吸收周围介质中的外源分子。
这种技术可以将核苷酸、DNA 与RNA 、蛋白、糖类、染料及病毒颗粒等导入原核和真核细胞内。
电转化相对其它物理和化学转化方法,是一种有价值和有效的替代方法。
Gene Pulser Xcell 系统的设计,基于Bio-Rad 15 年来在电转化技术上经验积累,它提供指数波和方波波型选择、系统配置选择及友好的用户界面。
主要特点指数波和方波波型确保所有细胞类型(原核及真核)均可获得最佳的电转化效果Bio-Rad 专利的* PulseTrac 电路和电弧保护设计,确保可重复性并保护样品模块化设计可根据研究需要选择系统用户友好的数字化界面,具有直观的编程以控制所有参数,包括附属模块的参数包括人工操作、预设规程、用户规程、一个优化规程及其它先进功能等程序选择指数波或方波脉冲选择Gene Pulser Xcell 系统可产生指数波和方波波型,使你选择最适合你细胞的波型与规程。
指数波和方波均能有效地用于电转化及电融合。
电穿孔波型对不同类型细胞的转化效率有很重要的影响。
左,指数衰变脉冲。
当一个充电至电压为V 0 的电容器放电到细胞,加在细胞上的电压随时间以指数方式下降。
从起始电压下降到V0 / e 所需的时间称为为时间常数τ, 一种方便的脉冲时间表达方式。
右,方波脉冲。
放电到样品后截断电容器脉冲可产生方波脉冲。
biorad荧光通道波段

Biorad荧光通道波段1. 什么是Biorad荧光通道波段?Biorad荧光通道波段是指生物雷达(Biorad)系统中用于检测和分析生物体内发出的荧光信号的不同波段。
2. Biorad荧光通道波段的作用Biorad荧光通道波段在生物科学研究中具有重要的作用。
通过选择不同的波长范围,可以检测和分析不同类型的生物标记物,从而揭示细胞和组织的结构、功能以及分子相互作用等信息。
3. Biorad荧光通道波段的分类根据不同的应用需求,Biorad荧光通道波段可以分为以下几类:3.1 激发波长激发波长是指用于激发样品中的荧光标记物发出信号所使用的特定波长。
常见的激发波长包括紫外线(UV)、蓝色、绿色等。
不同类型的标记物对于激发波长有着不同的选择性。
3.2 发射波长发射波长是指荧光标记物发出的荧光信号的特定波长范围。
通过选择不同的发射波长,可以实现对不同标记物的检测和分析。
3.3 滤光片滤光片是Biorad荧光通道波段中重要的组成部分。
它们用于选择性地传递或屏蔽特定波长的光线,从而实现对特定标记物的检测和分析。
4. Biorad荧光通道波段在生物研究中的应用Biorad荧光通道波段在生物研究中有广泛的应用。
以下是一些常见的应用领域:4.1 细胞成像Biorad荧光通道波段可用于细胞成像,通过标记特定蛋白质、核酸等分子,可以观察细胞内部结构和功能。
例如,在细胞周期研究中,可以使用DNA染料标记细胞核,并观察细胞在不同阶段的形态变化。
4.2 药物筛选Biorad荧光通道波段可用于药物筛选。
通过标记特定靶点并使用荧光探针,可以评估候选药物对靶点的亲和力和选择性。
这有助于筛选出具有潜在药理活性的化合物,从而加速药物研发过程。
4.3 蛋白质相互作用研究Biorad荧光通道波段可用于研究蛋白质相互作用。
通过标记不同蛋白质,并使用不同波长的荧光探针,可以观察它们之间的相互作用和结合情况。
这有助于揭示蛋白质功能和信号传导途径等重要生物学过程。
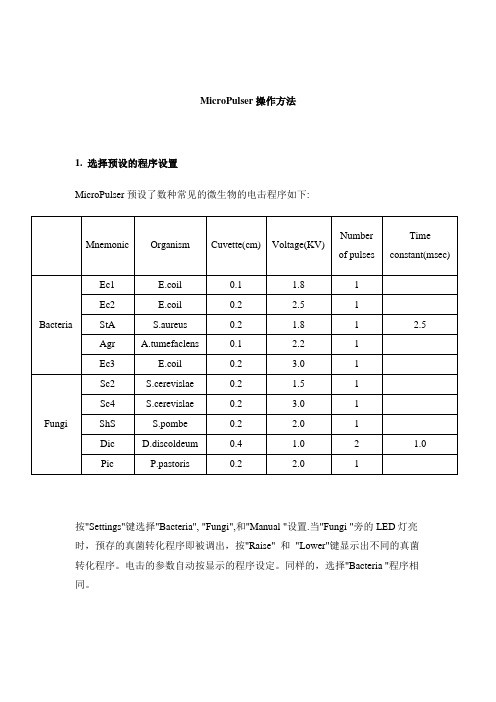
MicroPulser电穿孔仪的操作及维护规程

Bio-Rad MicroPulser电穿孔仪的操作及维护规程1、功能介绍选择预设程序电穿孔仪预设了常用的微生物电击程序,包括5个细菌和5个真菌电击程序。
如下:按程序即被调出,按"Raise"和"Lower"键显示出不同的真菌转化程序。
电击的参数自动按显示的程序设定。
同样的,选择"Bacteria "程序相同。
选择手动模式A.改变电压按"Settings"键,当"Manual"旁的LED灯亮时,显示屏显示电压值(单位kV)。
按"Raise"和"Lower"键在kV to kV之间改变电压设置。
如果仪器刚刚打开,显示值为""。
B.截短脉冲当"Manual"旁的LED灯亮时,同时按"Raise"和"Lower"键LED屏显示“t —表示为脉冲选择了时间。
开机时的默认设置为标准的指数衰减脉冲,衰减过程并不被截短,显示为“一一”。
同时按"Raise"和"Lower"键后只松开"Lower"键,显示数字为截短的脉冲持续时间,单位为毫秒( ms),从1毫秒开始以毫秒为增量一直到4毫秒。
限定脉冲时间在1-4毫秒之间。
同时按"Raise"和"Lower"键后只松开"Raise"键,可以调整脉冲时间到更短。
脉冲功能按"Pulse"键到电容充电至设定电压;"PLS"显示在显示屏上。
脉冲完成后会发出一声响,如果是一次设置好的多重脉冲则在整个脉冲过程中每次脉冲后发出一声响,"PLS" —直在显示屏上显示。
要想手动多重脉冲,则可以在一次脉冲完成发出一声响后,再次按"Pulse"键。
BIO-RAD电转化仪使用教程(自制)

BIO-RAD Gene Pulser Xcell Electroporation SystemBIO-RAD电转化仪使用教程(自制)cexoihtydx 20110902一电转仪示意图Figure 1 connecting the shockpad to the Gene Pulser Xcell main unit.Figure 2 Shockpod with cuvette.Figure 3 Gene Pulser Xcell front panel.二电转仪主界面在主界面中,我们经常会用到:4. Pre-set protocols和5. User protocolsPre-set protocols(预置方案)中,有Bacterial,Fungal和Mammalian三种预置方案。
下面简单介绍一下Bacterial中E. coli和Fungal中Pichia pastoris的电转化方案和注意事项。
三Electroporation of Bacterial Cells (E. coli)1 制备电转化感受态细胞1). Inoculate 5 ml of a fresh overnight E. coli culture into 500 ml of L-broth ina 2.8 L Fernbach flask.2). Grow the cells at 37°C shaking at 300 rpm to an OD600 of approximately 0.5–0.7. The best resultsare obtained with cells that are harvested at early- to mid-log phase; the appropriate cell densitydepends on the strain and growth conditions but should be about 4–5 x 107cells/ml.3). Chill the cells on ice for ~20 min. For all subsequent steps, keep the cells as close to 0°C as possi-ble (in an ice/water bath) and chill all containers in ice before adding cells. Transfer the cells to asterile, cold 500 ml centrifuge bottle and centrifuge at 4000 xg for 15 minutes at 4°C.4). Carefully pour off and discard the supernatant. It is better to sacrifice yield by pouring off a fewcells than to leave any supernatant behind.5). Gently resuspend the pellet in 500 ml of ice-cold 10% glycerol. Centrifuge at 4000 xg for 15 minutes at 4°C; carefully pour off and discard the supernatant.6). Resuspend the pellet in 250 ml of ice-cold 10% glycerol. Centrifuge at 4000 xg for 15 minutesat4°C; carefully pour off and discard the supernatant.7). Resuspend the pellet in ~20 ml of ice-cold 10% glycerol. Transfer to a 30 ml sterile Oakridge tube.Centrifuge at 4000 xg for 15 minutes at 4°C; carefully pour off and discard the supernatant.8). Resuspend the cell pellet in a final volume of 1–2 ml of ice-cold 10% glycerol. The cell concentration should be about 1–3 x 1010cells/ml.9). This suspension may be frozen in aliquots on dry ice and stored at -70°C. The cells are stable forat least 6 months under these conditions.2 电转化转化参数:Pre-set protocols (E. coli)V oltage(V) 1800Capacitance(µF) 25Resistance(ohm) 200Cuvette(mm) 11). Thaw the cells on ice. For each sample to be electroporated: place a 1.5 ml microfuge tube onice, place either a 0.1 or 0.2 cm electroporation cuvette on ice, and place a 17 x 100 mm tubewith 1 ml of SOC at room temperature.2). To a cold, 1.5 ml polypropylene microfuge tube, add 20 µl of cell suspension if electroporating in 0.1 cmcuvettes, or 20–40 µl of cell suspension if electroporating in 0.2 cm cuvettes. Add 1 to 2 µlof DNA(DNA should be in a low ionic strength buffer such as water or TE). Mix well and incubateon ice for ~1 minute. (Note: it is best to mix the plasmids and cells in a microfuge tube since the narrow gap ofthe cuvettes prevents uniform mixing.)3). From the Home screen on Gene Pulser Xcell open the Pre-set Protocols screen, then the BacterialProtocol screen (press 4, then Enter twice). When using the 0.1 cm cuvettes, press Enter to open E. coli, 1mm cuvette Protocol Detail screen. When using the 0.2 cm cuvettes, press 2 then Enter, or 3 then Enter, to select the Protocol Detail screens for E. coli to pulse at 2.5 or 3.0 kV, respectively.4). Transfer the mixture of cells and DNA to a cold electroporation cuvette and tap the suspension to the bottom. Place the cuvette in the ShockPod. Push the chamber lid down to close.5). Pulse once.6). Remove the cuvette from the chamber and immediately add 1 ml of SOC medium to the cuvette.Quickly but gently resuspend the cells with a Pasteur pipette. (The period between applying the pulse and transferring the cells to out growth medium is crucial for recovering E. coli transformants (Dower et al., 1988). Delaying this transfer by even 1 minute causes a 3-fold drop in transformation.This decline continues to a 20-fold drop by 10 minutes.)7). Transfer the cell suspension to a 17 x 100 mm polypropylene tube and incubate at 37°C for 1 hour,shaking at 225 rpm.8). Check and record the pulse parameters. The time constant should be close to 5 milliseconds. Thefield strength can be calculated as actual volts (kV) / cuvette gap (cm).9). Plate on LB plates with antibiotic.3 溶液和试剂1). L-Broth: 10 g Tryptone peptone, 5 g Yeast extract, 5 g NaCl; dissolve in 1.0 L water.Autoclave.2). LB agar plates with selective antibiotic: prepare L broth as above, adding 15g of agar perliter. Autoclave. Cool to 55–60°C and add antibiotic. Pour 12–15 ml per 100 mm plate.3). 10% (v/v) Glycerol: 12.6 g glycerol (density = 1.26 g/cc) in 90 ml of water. Autoclave or filtersterilize.4). TE: 10 mM Tris-HCl pH 8.0, 1 mM EDTA.5). SOB: 2.0 g Tryptone peptone, 0.5 g Yeast extract, 0.2 ml 5 M NaCl, 0.25 ml 1 M KCl; dissolvein 90 ml water. Adjust pH to 7.0. Bring volume to 100 ml. Autoclave. Add 1.0 ml sterile 1 M MgCl2and 1.0 ml sterile 1 M MgSO4.6). SOC: to 100 ml SOB, add 2.0 ml sterile 1 M glucose (sterilize by filtration).4 注意事项1). 细菌电转化电压一般默认为1.8 KV即可,某些细菌可能会需要更高的电压,可以参考电转化仪器厂商的相关资料以及文献报道。
Bio-radMicroPulser电穿孔仪中文说明书

MicroPulser 电穿孔仪操作手册2018 年12 月27 日1、介绍(1 )基本原理MicroPulser 电穿孔仪用于细菌、酵母和其他众多微生物的电击转化,转化时,高压电脉冲作用于悬浮在小体积高阻介质中的样品。
本系统由一个脉冲发生器(pulse generator )模块、一个电击腔(shocking chamber )和一个装有电极的电击杯(cuvette )组成。
样本放置于电击杯的电极之间。
MicroPulser 模块包含一个电容器,将电容器充电至高电压,然后模块将电容器中的电流放电到试管中的样品中。
MicroPulser 的电容放电电路产生具有指数衰减波形的电脉冲,如下图。
当电容器放电至样品时,跨越电极的电压迅速上升至最大电压(or 峰值电压,peak voltage ;也称为初始电压,Vo ),并随时间(t )减小,如下式:其中τ=R · C,为时间常数,是脉冲长度的简便表达式。
R 为电路电阻,单位为ohms (欧姆)。
C 为电容,单位为microfarad (微法拉)。
根据方程1 ,τ是电压下降至峰值电压1/e (~37% )的时间。
MicroPulser 的内部电路被设计以使E.coli 、酿酒酵母及其他许多微生物可以得到最佳电穿孔,最佳转化效率发生在大约5ms 的时间常数内。
这些电穿孔条件是通过使用10 微法拉电容器和将600 欧姆电阻与样品池并联以及将30 欧姆电阻与样品池串联来实现的。
除时间常数外,电场强度是另一个决定转化效率的重要参数。
电场强度E,是施加于电极间的电压,公式为:其中,V 为施加的电压,d 为电极间的距离,单位为cm 。
电场强度和细胞的尺寸(size )决定了横贯每个细胞的电压降,正是电压降可能是电穿孔中电压效应的重要表现。
30 欧姆串联电阻的目的是在发生电弧的情况下保护设备电路。
在正常操作条件下,当样本在高电阻介质中,电阻不会影响施加在样本上的电压。
电穿孔质粒DNA转染

电穿孔质粒DNA转染作为一种基因转导办法,电穿孔已被广泛用于各种细胞类型,包括细菌、酵母、植物和动物细胞;而且,它还能作为注射办法(称为电注射),把各种外源物质引入活细胞内。
与其他常用的导入外源物质的办法相比,电穿孔具有无数优点。
首先,不必像显微镜那样用法玻璃针,不需要技术培训和昂贵的设备,可以一次对成百万的细胞举行注射。
其次,与用化学物质相比,电穿孔几乎没有生物或化学副作用。
第三,由于电穿孔是一种物理办法,较少依靠细胞类型,因而应用广泛。
事实上,对大多数细胞类型,用电穿孔法基因的转移效率比化学办法高得多。
试验原理当细胞置于十分高的电场中,细胞膜就变得具有通透性,能让外界的分子蔓延进细胞内,这一现象称为电穿孔。
运用这一技术,许多物质,包括DNA、 RNA、蛋白质、药物、抗体和荧光探针都能载入细胞内。
材料(试剂及设备) (1) 缓冲液与溶液PBS缓冲液(配方参考《分子克隆试验指南》)。
(2)核酸与寡核苷酸质粒DNA:转染前将所要转的质粒在细胞室内无菌沉淀(1/10体积的3moUL NaAC, 2倍体积的无水乙醇),在超净台中用70%的乙醇(无水乙醇与灭菌水在无菌状态下配制)清洗2次,晾干,加灭菌水溶解。
用0. 1×TE(pH 7.6)溶解DNA至终浓度25 μg/ml,每毫升培养基需要50μl质粒溶液。
(3)培养基:为彻低培养基。
(4)其他设备电穿孔仪、细胞培养用培养箱((37℃, 5% CO2的加湿培养箱)、超净台、冰箱、离心机、Vortex 振荡器(选用)、1. 5mlEP管、移液器及tip头、试管架、计时器和60mm组织培养皿或12孔板。
(5)细胞:指数生长的哺乳动物细胞培养物。
细胞预备:转染前一到两天将细胞传代至平皿中(视目的不同所用平皿规格不同),使细胞密度在做转染时达到所需密度(详细细胞密度视细胞生长速度而定,标准是在收细胞时细胞密度达到100%)。
转染办法 (1)贴壁细胞用胰酶消化后离心(室温,1000r/min, 3min)收集细胞,悬浮细胞挺直离心收集细胞。
BIORAD电泳仪及SDS-PAGE凝胶电泳操作规范

使用BIO-RAD电泳仪进行SDS-PAGE凝胶电泳的操作规范实验原理根据蛋白分子量亚基的不同而分离蛋白,在样品介质和丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移速率主要取决于亚基分子量的大小。
实验所用仪器FR-200A全自动紫外与可见分析装置上海复日科技有限公司电泳仪 BIO-RAD公司TS-1型脱色摇床江苏海门市其林贝尔仪器制造有限公司实验用试剂低分子量蛋白Maker TAKARA4*上样缓冲 TAKARAPagn Blue protein staining solution Fermentas试剂的配制1.贮液的配制(1)凝胶储液取30g丙烯酰胺+0.8g甲叉双丙烯酰胺0.8g ,先用35ml双蒸水溶解,搅拌,直到溶液变成透明,再用双蒸水稀释至100ml,过滤。
棕色瓶4℃保存一个月。
(2)1 mol/l Tris-HCL (PH 8.8)12.1g Tris(三羟甲基氨基甲烷)溶解在80ml双蒸水中,用4mol/l盐酸调PH至8.8。
再用双蒸水稀释至100ml,保存在4℃冰箱。
(3)1.0 mol/l Tris-HCL (PH 6.8)6.06g Tris溶解在40ml双蒸水中,用用4mol/l盐酸调PH至6.8。
再用双蒸水稀释至50ml,保存在4℃冰箱。
(4)10%过硫酸铵(APS)0.1g过硫酸铵+1ml双蒸水。
使用前新鲜配制(5)Tris–甘氨酸电泳缓冲液的配制(25mmol/L Tris;250mmol/L甘氨酸(pH8.3))30.3gTris+ 144.2g甘氨酸+ 10gSDS,双蒸水定容至1L。
每次使用时10倍稀释。
(6)样品缓冲液使用4*SDS-PAGE loading buffer(Takara公司),上样缓冲与样品比例1:3混匀,之后煮沸5min。
2.凝胶的配制注:上表所标体积为配制两块胶的用量。
若配制一块或多块,可按比例减半或加倍。
具体步骤如下:1、样品制备:40 µL蛋白+5*上样缓冲液10 µL,煮沸5 min,冷却后放冰箱下层保存,备用2、制胶1)用专用的医用棉口罩将胶板擦拭干净,电泳槽清洗干净,组装模具。
Bio-rad 双向电泳系统标准操作规程

Bio-rad 双向电泳系统标准操作规程1、目的:正确使用Bio-rad 双向电泳系统,确保Bio-rad 双向电泳系统正常运行。
2、适用范围:Bio-rad 7cm/11cm/17cm双向电泳系统。
3、责任人:双向电泳系统操作人员。
4、程序:4.1、第一向等电聚焦4.1.1、准备工作及注意事项用标配的刷子小心将聚焦盘清洗干净,注意聚焦盘两端的两根电极丝,晾干后备用;根据样品使用合适的水化上样液,对于不同的聚焦盘的上样体积可参考下表:4.1.2、上样4.1.2.1、从冰箱中取-20℃冷冻保存的水化上样缓冲液(不含DTT,不含Bio-Lyte)一小管,置室温溶解,加入合适的DTT与Bio-Lyte,充分混匀。
4.1.2.2、从小管中取出适量水化上样缓冲液与样品充分混匀。
4.1.2.3、取出-20℃冷冻保存的IPG预制胶条,室温中放置10分钟。
4.1.2.4、沿着聚焦盘或水化盘中槽的边缘至左而右线性加入样品。
在槽两端各1cm左右不要加样,中间的样品液一定要连贯。
注意:不要产生气泡。
否则影响到胶条中蛋白质的分布。
4.1.2.5、当所有的蛋白质样品都已经加入到聚焦盘或水化盘中后,用镊子轻轻的去除预制IPG胶条上的保护层。
4.1.2.6、分清胶条的正负极,轻轻地将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极(标有+)对应于聚焦盘的正极。
确保胶条与电极紧密接触。
不要使样品溶液弄到胶条背面的塑料支撑膜上,因为这些溶液不会被胶条吸收。
同样还要注意不使胶条下面的溶液产生气泡。
如果已经产生气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶到胶条以外。
4.1.2.7、在每根胶条上覆盖1-3ml矿物油,防止胶条水化过程中液体的蒸发。
需缓慢的加入矿物油,沿着胶条,使矿物油一滴一滴慢慢加在塑料支撑膜上。
4.1.2.8、对好正、负极,盖上盖子。
设置等电聚焦程序。
4.1.3、设置程序4.1.3.1、打开电源;4.1.3.2、根据情况选择水化(REHYDRATION),预设的程序(PRESET METHOD),储存的程序(STORED METHOD),新的程序(NEW METHOD);4.1.3.3、如果只需要水化,选择水化(REHYDRATION)选项,在接下来的界面选择主动水化或者被动水化、水化温度、水化时间;4.1.3.4、如果需要跑完整的程序,选择新的程序(NEW METHOD), 在接下来的界面选择是否水化,并设置相应的等电聚焦程序,设置完成后,在最后的界面选择总的胶条数、限电流和聚焦温度,然后开始运行程序。
电穿孔技术

电穿孔技术电穿孔缓冲液:配方1:200mM/L葡萄糖,5mM硫酸镁2mM/L疏基乙醇20mM/LTris-HCI ,pH值7.6Universal Electroporation Solution通用电转染缓冲液性能特点:1. 显著提高转染效率和细胞存活率2. 适用于难转染细胞等几乎所有细胞类型3. 与所有电融合/电穿孔仪兼容产品货号:UES0001产品规格:1ml保存:Universal Electroporation Solution保存于4度建议-20度长期保存保质期:正确的使用和保存条件下,保质期为6个月电转染次数:1ml Universal Electroporation Solution用0.4cm电极杯可进行5组实验用0.2cm电极杯可进行10组实验电转染条件:电压260V电容950μF操作步骤:1.收集细胞:用胰酶消化细胞,将细胞培养液吸入到15ml离心管中,1000rpm,5min,弃其上清。
2.用不含血清的培养液洗涤一次,弃其上清。
3.取2~10ug质粒加入到100ul电转缓冲液中,充分混匀。
4.用100ul混有质粒的电转缓冲液充分溶解细胞,转入0.2cm电转导入杯中。
5.将电转导入杯放入样品槽中,释放电脉冲,电击参数按电容1000 mF,电压150-500 V,间隔20V取值,取得最佳效果。
6.立即取出电击杯,分别用一次性吸管将混和液转移至加有完全培养基的一次性细胞培养瓶中,放入细胞培养箱中培养。
电穿孔法转染哺乳动物细胞来源: 发布时间:2009-08-31 查看次数:1935站长注:下文是发表于Nature Methods中的一篇关于电穿孔转染方法的文章,站长对其作了注释,方便大家理解。
电穿孔转染理论上可转染所有的组织细胞,因此对其他如脂质体、磷酸钙沉淀等方法转染效果不明显的细胞可选用此方法。
电转过程中,最重要的就是电穿孔仪的电压、电容以及与电泳缓冲液的选择。
提到电转仪,最出名的恐怕就属BIO-RAD了,他在1986年推出了世界上第一台电穿孔仪,并发布了多种细胞仪电转过程中的电压,电容,电转缓冲液等可省却大家很多的摸索过程,具体资料可到其主页上查找相关Nature Methods 3, 67 - 68 (2006)Transfection of mammalian cells by electroporationPulsed electrical fields can be used to introduce DNA into a wide variety of animal cells1, 2. Electroporation works well with cell lines that are refractive to other techniques, such as calcium phosphate–DNA coprecipitation. But as with other transfection methods, the optimal conditions for electroporation of untested cell lines must be determined experimentally.电穿孔转染可用于磷酸钙转染效率低下的细胞,具有操作简便,转染效率高等优点,但对于不同的细胞,其转染条件有很大的不同,需要进行摸索。
Electroporation

Electroporation1 原理细胞电穿孔的研究始于70年代。
所谓电穿孔(Electroporation)即是在外加短时强电脉冲时,在细胞膜双脂层上形成瞬时微孔,使细胞膜的通透性增强,离子,亲水分子,病毒颗粒,DNA,蛋白质以及染料颗粒等正常情况下不能通过细胞膜的分子得以进出细胞的一个生物物理过程。
目前,电穿孔技术已广泛用于生物技术,基因工程,临床医学等许多领域。
利用电穿孔可实现基因转染,细胞融合,以及将外源蛋白质分子插入细胞膜或导入细胞,激活细胞膜的传输因子,提高酶的活性,并可提高药物进入细胞的能力,增强癌症的化疗效果。
参考*低强度瞬态电磁脉冲对细胞膜的电穿孔效应及机理研究*2 应用Classic Applications for molecular delivery using electroporation include:Transformation of bacteria, yeast, and plantsTransfection of mammalian cellsElectroincorporation & Electroinsertion of proteinsSmall Molecule Delivery (RNA & oligos (knockouts), peptides & amino acids (proteomics)) Plant Hybrid & Hybridoma (monoclonal) productionEmerging Applications include:Adherent Cell Electroporation in situ (ACE & ACT)High Throughput Electroporation (HTE & HTC)Large Volume Processing (LVP)Electroincorporation & Electroinsertion of proteins (proteomics)in vivo Gene Delivery & In vivo Gene Therapyin ovo Gene Delivery (IOGD) and In & ex utero Gene Delivery (IUGD & EUGD)Cell Fusion & Nuclear Transfersource from:http://www.bioflow.co.kr/5 电转染常见细胞系,多为悬浮细胞African Green Monkey Kidney CV-1Embryonic Stem Cells (D3 cells)Rat Pituitary Tumar (GH3)Human Fibroblasts (GM0847)Human Cervical Carcinoma cells (HeLa)Human hepatocellular carcinoma Hep G2Primary Human Fetal Fibroblasts IMR-90Human Hematopoietic K562 CellsJurkat cellsL Cell L929LBRM cells (mouse T-cell lymphoma)Normal human melanocytesMouse Embryo Fibroblasts NIH3T3Primary Human Peripheral Blood LymphocytesPrimary Human Peripheral Blood Lymphocytes CCRF-CEM Tlymphoblastoid cells Raji Burkitt's lymphomaWEHI-3B Murine Myelomonocytic LeukemiaNamalwa Human Lymphoblastoid cellsCos 7 cellsHuman Neuroblastoma TP410NRat Cardiac MyocyteFibroblast NIH3T3 MouseHuman Melanoma (SKMe125)Hepatoma CellsMouse MacrophageMurine Fibroblast / C3H strainMurine T-LymphomaSmooth muscle HumanHuman 293 (Embryonic kidney cell)Breast Carcinoma MCF-7Mouse Melanoma (B16BL6)BHKB-LymphocyteProstate Tumor Cells LNCapRat Anterior Pituitary cellPC12COS 1Human Neuroblastoma SH-SY5YHuman FibroblastRat HepatocyteCOS 7 (Coaxial Electrode P/N 491)CR Mouse Skeletal MuscleT2 Cells (Hybrid of B & T Cells)Mouse Adrenal Carcinoma CellsRat Adipose CellsMyeloid Progenitor Cell (M07e)Bovine Aortic Endothelial CellsPrimary T CellsJurkatA549 Epithelial cells (human carcinoma tissue)NRK 52E Rat Kidney CellsNCI-H1299 Noon Small Cell Lung CancerHuman MyoblastK562 Human Chronic Myeloid LeukemiaCD 34+ Progenitor-derived Langerhans cellsCD 34+ Progenitor-derived Dendritic cellsMonocyte-derived Dendritic CellsMurine T-cellsHuman T-cellsHuman B lymphocytesDrosophila embryosPancreatic CellsHuman Bronchial Epithelial CellsPC12Rat Glioma C6Human prostatic stromal cellsPC3T24 Human Bladder CarcinomaMonocyte-derived Dendritic CellsHuman Dendritic cellsHippocampal neuron-HN2 cells Squamous cell carcinomaA549Human aortic smooth muscle cellsBone marrowMesenchymal cellsPrimary Neural Culture (small granular cells) Primary neural cell culture (Astrocytes) Chronic Lymphocytic Leukemia (CLL) source from*附有具体protocol及相关文献*: //附上图片一张电镜图片,看穿孔瞬间胞浆喷出。
电穿孔简介

GPX和指数波
• GPX产生指数波的电路结构
基本电路
3ohm 电阻 Charger
电容器
电击杯
充电回路
放电回路
GPX和指数波
• GPX产生指数波的电路结构
充电
3ohm 电阻r Charger
电容器
电击杯
充电回路
放电回路
根据具体电压及电容的选择,可以采用主单元或者CE模块对电容进行充电
GPX和指数波
Ions collect above sample
特点: 模块化设计
系统部件
PC模块
CE模块
主机 ShockPod电击槽
特点: 友好的操作界面
• 图表化的操作界面可以设置所有的实验参数,包括附属模块的参数
特点: 可选择的程序设置
主菜单
HOME 1. 2. 3. 4. 5. Exponential protocol Time constant protocol Square wave protocol Pre-set protocols User protocols
附属模块的参数
• 提供多种操作模式,包括手动设置、预设模式、用户编程 等多种方式
主要的优点、特点:2种波型
电穿孔的过程中可以有2种波型来控制外界电压的变化
The Gene Pulser Xcell可以提供2种波型,即指数波和方波
Exponential Decay
• 电容器充电到预定的电压(v0)放电后, 即向样品释放脉冲,细胞表面的电压随 时间按指数方式下降的 • 电容器的电压值达到峰值释放脉冲后迅 速的衰减 • 电场强度 E (V/cm) 是用来描述电击杯外 界电场环境的一个参数(E=V/d) • 脉冲时间是一般用时间常数来进行衡量 (~37% of V0, V0/e) • 脉冲的时间是由电阻和电容的大小所决 定的
Bio-rad MicroPulser电穿孔仪(中文)
MicroPulser操作方法1. 选择预设的程序设置MicroPulser预设了数种常见的微生物的电击程序如下:按"Settings"键选择"Bacteria", "Fungi",和"Manual "设置.当"Fungi "旁的LED灯亮时,预存的真菌转化程序即被调出,按"Raise" 和"Lower"键显示出不同的真菌转化程序。
电击的参数自动按显示的程序设定。
同样的,选择"Bacteria "程序相同。
2. 使用Micropulser的手动模式A. 改变电压按"Settings" 键,当"Manual".旁的LED灯亮时,显示屏显示电压值(单位kV). 按"Raise" 和"Lower"键在0.20 kV to 3.00 kV.之间改变电压设置。
如果仪器刚刚打开,显示值为"0.00"B. 截短脉冲.当"Manual".旁的LED灯亮时,同时按"Raise" 和"Lower"键LED屏显示“t—”,表示为脉冲选择了时间。
开机时的默认设置为标准的指数衰减脉冲,衰减过程并不被截短,显示为“——”。
同时按"Raise" 和"Lower"键后只松开"Lower"键,显示数字为截短的脉冲持续时间,单位为毫秒,从1毫秒开始以0.1毫秒为增量一直到4毫秒。
限定脉冲时间在1-4毫秒之间。
同时按"Raise" 和"Lower"键后只松开"Raise"键,可以调整脉冲时间到更短。
3. 脉冲功能按"Pulse"键到电容充电至设定电压;"PLS"显示在显示屏上。
细胞电穿孔技术的研究

中国民航大学硕士学位论文细胞电穿孔技术的研究姓名:孙云申请学位级别:硕士专业:通信与信息系统指导教师:徐宝强20070220中N民航人学硕卜学位论叟:物增敏、临床医学等诸多方面,给医疗技术带来了一场革命。
21世纪是生物工程的时代,电穿孔技术也在不断发展完善,在应用领域出现了方兴未艾的局面,有着巨大的应用潜力。
因此分析研究细胞电穿孔的机理,研制我国具有自主知识产权的电转基因仪器和与之配套的多种电极,将具有重大意义,不仅会推动我国的生物工程的发展,而且必将产生良好的经济和社会效益。
1.2国内外研究现状1.2.1细胞膜结构细胞膜的结构非常复杂,主要是由脂质和蛋白质两类物质组成的复杂的超分子动态系统。
1972年Singer和Nicolson提出的液态镶嵌模型124|,目前已得到人们的承认。
液态镶嵌模型认为细胞膜是一种可流动的、嵌有蛋白质的脂类双分子层结构。
嵌入其中的蛋白质具有多种功能,如离子通道、受体及各种酶等。
构成细胞膜的脂类主要有甘油磷脂、鞘磷脂、类固醇和糖脂,如图1-1所示。
这些脂类除了类固醇外,都有亲水的极性的头部和疏水的非极性的尾部。
脂类分子极性头部向外,疏水的尾部在内,构成细胞膜的基质——脂双分子层。
图1-1细胞膜的生物结构1.2.2细胞膜电穿孔模型对于细胞膜的可逆电穿孔,众多的理论模型都没有对电穿孔过程进行系统的描述,只有JamesWeaver建立的瞬叁亲水孔模型1251,对电穿孔进行了宏观描述。
定性地说,电穿孔现象是由电能(因跨膜电位提高而产生的决定性能量)和“KT能量”(因热波动而产生的随机性能量)共同作用而引起的。
大量的观察发现,电穿孔图3-5组合电容3.1.5其他方面为了实现产业化,对原有的放电小池进行彻底改造,先后设计研制出几套模具,实现了lmm、2ram、4mm三种不同规格的放电小池。
其中2ram、4mm小池的电极有粘贴型的,1lnIn、2ram小池电极有采用工字铝注塑型的,如图3-6所示。
Bio-rad_Gene_Pulser_Xcell电穿孔系统(中文说明书)

Bio-rad Gene Pulser Xcell电穿孔系统一Gene Pulser Xcell电穿孔系统介绍电穿孔的过程中可以有2种波型来控制外界电压的变化,Gene Pulser Xcell可以提供2种波型,即指数波和方波。
1.Exponential Decay Wave(指数波)所谓指数波的方式,就是将已经充电到指定电压的电容进行快速的放电,放电的方式是以指数的形式进行的(如上面的slide显示)。
该种方式的电穿孔取决于2个参数,电场强度(kV/cm)和时间常数(ms)。
在实验过程中,采用具体的电击杯调整电压即可调整不同的电场强度。
此外,电容和电阻的具体值也可以在Gene Pulser Xcell的界面上进行设置。
•电容器充电到预定的电压(V0)放电后,即向样品释放脉冲,细胞表面的电压随时间按指数方式下降的•电容器的电压值达到峰值释放脉冲后迅速的衰减•电场强度 E (V/cm) 是用来描述电击杯外界电场环境的一个参数(E=V/d )•脉冲时间是一般用时间常数来进行衡量(~37% of V0,V0/e)•脉冲的时间是由电阻和电容的大小所决定的备注:PC module作用PC(Parallel Capacitor)模块的本质就是在放电回路中在样品上并联一套电阻。
在放电回路中设置PC模块的目的:如果实验样品具有很高的电阻值,那么脉冲就需要维持相当长的时间,这样对细胞是会有损伤的,长时间的电场作用会导致细胞的裂解。
并联了PC模块后对样品而言电击是的电压并没有变化,但是PC 模块起到了分流的作用,可以使得脉冲的时间常数大大减小,可有效的维持细胞的活性。
并联了PC模块后,时间常数取决于该模块的电阻,电阻越小,那么放电的时间也就越短。
2. Square Wave(方波)对于某些细胞而言,采用指数波进行实验特别容易导致细胞的死亡。
对于这种细胞而言,采用方波的形式来进行电穿孔既可以进行有效的转染,又可以很好的保护细胞,维持细胞的活性。
Bio-RAD荧光定量PCR仪使用
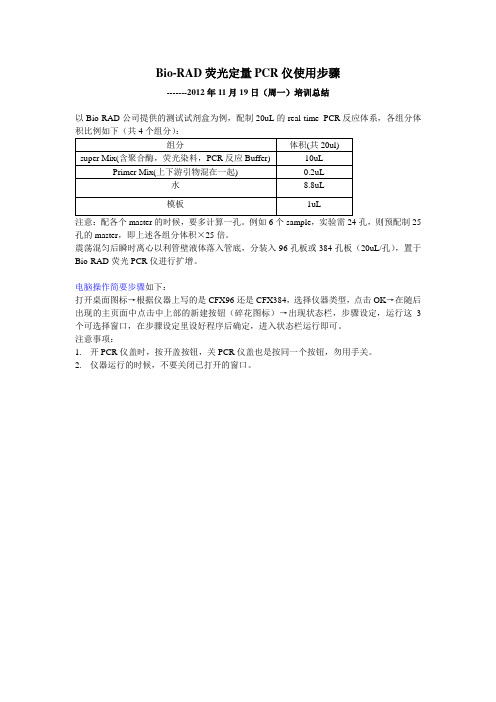
Bio-RAD荧光定量PCR仪使用步骤
-------2012年11月19日(周一)培训总结
以Bio-RAD公司提供的测试试剂盒为例,配制20uL的real-time PCR反应体系,各组分体积比例如下(共4个组分):
注意:配各个master的时候,要多计算一孔。
例如6个sample,实验需24孔,则预配制25孔的master,即上述各组分体积×25倍。
震荡混匀后瞬时离心以利管壁液体落入管底,分装入96孔板或384孔板(20uL/孔),置于Bio-RAD荧光PCR仪进行扩增。
电脑操作简要步骤如下:
打开桌面图标→根据仪器上写的是CFX96还是CFX384,选择仪器类型,点击OK→在随后出现的主页面中点击中上部的新建按钮(碎花图标)→出现状态栏,步骤设定,运行这3个可选择窗口,在步骤设定里设好程序后确定,进入状态栏运行即可。
注意事项:
1.开PCR仪盖时,按开盖按钮,关PCR仪盖也是按同一个按钮,勿用手关。
2.仪器运行的时候,不要关闭已打开的窗口。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.第二天,以1:100的比例将这10ml菌液倒入1000ml LB液体培养基中,37度,220rpm-250,振摇2-3小时,每半小时测一次OD,当OD值达到0.3-0.4-0.6时,停止培养。
[削减到达所需量的繁衍世代数,以削减菌的变异。]
Gene Pulser Xcell微生物电穿孔系统(货号165-2662)—用于细菌和真菌的电穿孔,以及对小体积样本施加高压脉冲的其他应用;包含PC模块
更多信息
功能可修改的传送参数包括时间常数、施加的实际电压、脉冲间隔和脉冲时间,具体取决于选择的波型(指数波或方波)
提供一系列用于手动操作、预设实验方案、用户实验方案和优化实验方案的相关程序
通用电穿孔—转染所有细胞类型(从原代细胞和干细胞到细菌和酵母菌)
预设实验方案—包括最常见的哺乳动物和细菌细胞类型
灵活性—预设实验方案、优化实验方案、手动操作和/或用户实验方案的程序选择
实验方案库—一系列电穿孔实验方案,适用于包括原代细胞、永生细胞和细菌细胞在内的各种细胞类型
数据管理—能够存储和调用前100次试验中使用的参数,有助于故障排除
cicelyzh(站内联系TA)
不能。两种感受态的原理不同,LS的正解。
电转化感受态细胞的制备主要是脱盐。
略
Gene Pulser Xcell™系统是用于转染每种细胞类型的模块化电穿孔系统。
系统包括主单元、ShockPod™电击槽以及选择的附件模块:电容扩增器(CE模块)和脉冲控制器(PC模块)。
功能和优点
重点:
1.电转化感受态细胞的制备
第一天:
0.高温灭菌大的离心管(25-50ml)以备第二天用
0.准备几瓶灭菌水(总量约1.5升),保存于冷冻室中以备第二天重悬浮细胞用
1.用枪头挑取单克隆菌落,投入盛有10ml LB液体培养基的50ml离心管中。(同时做培养基和枪头的空白对照)
2.过夜,37℃,220rpm。
4.以下步骤务必在超净工作台和冰上操作。
在超净工作台中,将菌液分装于大的灭菌离心管(提前高压灭菌)中,在冰上预冷20-30分钟(至少15 min,但是也有人说10min,时间不要太长,特别是夏天),4℃,4000rpm离心10分钟。
[使细菌的成长中止,代谢减慢。由于这时现已没有培育基了,假如细菌仍有很高的代谢功率,则有很多细菌逝世。] [冰浴是为了降低细性筛选转化子时,用转化细胞铺平板的密度要低(90mm平板上不得超过105个菌落),同时37℃培养不应超过20小时,具氨苄青霉素抗性的转化体可将
β-内酰胺酶分泌到培养基中,迅速灭活菌落周围的抗生素,从而导致对氨苄青霉素敏感的卫星菌落的出现。
4.电击杯清洗流程
1.用清水将电击杯稍冲一下。
4.打开电转仪,调至Manual,调节200Ω,25 uF,电压为2.5KV,时间不低于3毫秒,应接近5毫秒。
转化的电压一般选择1.8kv(转细胞或是大质粒可以选择2.5kv)。
5.从冰中取出电极杯,用纸巾吸干表面水分,务必擦干电转杯外的水气。
6.将电极杯推入电转化仪,按一下pulse键,听到蜂鸣声后,向电击杯中迅速加入预热的1mlSOC液体培养基,快速而轻柔地重悬细胞后,转移到1.5ml的离心管中。(越快越好)电击后立即在电转杯中加入培养基(室温),很关键哦!
与0.1 cm、0.2 cm和0.4 cm Gene Pulser®/Micropulser™电穿孔比色皿兼容
与任何电穿孔缓冲液都兼容,包括Bio-Rad的Gene Pulser电穿孔缓冲液
电转化仪
仪器型号:GenePulser II
生产商:USA Bio-Rad工作原理:Gene PulserⅡ电转化仪器可用于原核细胞、酵母和哺乳动物细胞的转化。仪器采用Pulse Trac波形传送系统,能产生最精确的指数衰减的脉冲,可在电转化杯里获得最佳的细胞转化。
3.电转化
1.从-80℃冰箱中取出感受态细胞,置于冰上解冻;
将0.1CM的电极杯和1.5 ml灭菌离心管一起置于冰上预冷
2.取1-2μl纯化后的DNA(DNA不要太多,防止向感受态里多带进了离子)于100ul融化的感受态细胞中,用粗口吸头的枪轻柔混匀,越温柔越好,小心混匀混匀!,
3.将上述混合物转移到预冷的电极杯中,轻轻敲击电极杯,使混合物均匀,无气泡,进入电极杯的底部,静置冰浴5-10min。(怕感受态细胞量不够,吸得很多,电转时效果反而不好。)
工作环境温度0-35oC
湿度0-95%,无冷凝
简易操作指南:1:打开电源
2:根据自己的情况设置参数:如电容 c=25F, 电压 v=1.8kV (0.1cm电击杯),R=200
3:将电击杯两壁水檫干
4:电转:所产生的时间常数一般为4.6—5.0ms
5:立即加入培养液恢复培养
注意:电击杯两壁水一定要檫干;所制备的感受态细胞一定要干净,否则电流过大
电穿孔是一个物理过程,利用电脉冲瞬时穿透原核细胞或真核细胞的细胞膜,使得细胞能够吸收各种不同种类的生物分子。当用化学或其他物理方法转化某些类型的细胞效率不高或有毒性时,电转化则可能是一种有用的方法。
Gene PulserⅡ电穿孔仪由三个部分组成:Gene PulserⅡ装置及两个附属设备Pulse Controller PLUS和Capacitance Extender PLUS。Gene PulserⅡ可与另两个附属设备中的任意一个一起使用:对于细菌和酵母细胞的电转化(高电压/低电容),使用Pulse Controller PLUS;对于哺乳动物细胞和胚胎组织的电转化(低电压/高电容),则应使用Capacitance Extender PLUS。
注:1.不同样品使用的电击杯应分开;
2.每周用1%酒精浸泡30分钟。
电转杯清洁处理:一般先冲洗,洗净;然后浸泡在75%的乙醇中;
使用前我们都是放在超净台上,开启紫外,边吹风晾干,边进行紫外照射。
电转杯的新包装或重复使用可能对转化率有一定的影响。
低温操作,擦干电转杯外的水气。
2.4℃,top Speed离心30分钟;
3.小心移去上清,避免接触到管底的沉淀物;
4.加入500ul70%的乙醇,轻轻颠倒几次洗涤沉淀(注:不要离心混匀);
5.4℃,top Speed离心5分钟;
6.小心移去上清,将此Eppendorf管置空气中直至无乙醇气味;
7.加入10ulddH2O重新溶解沉淀,4℃短期保存,-20℃长期保存备用;
2.向电击杯中加入的75%酒精浸泡2hr。
3.弃去酒精,再用蒸馏水冲洗2~3遍,然后用1ml的枪吸取超纯水反复吹打电击杯10遍以上。
4.加入无水乙醇2ml于电击杯中,浸泡30分钟。
5.弃去无水乙醇,于通风厨内挥干乙醇。(电转杯用酒精消毒后一定要让酒精挥发干净)
6.将清洗好的电击杯放入-20℃冰箱内待用。
同时取100μl感受态加0.01ngpuc18直接电穿孔转化,检测转化效率。
9.次日观察转化子生长情况,并记录。
2.连接产物纯化
1.将连接产物转移至一1.5mlEppendorf管中,加入下列试剂:
10ul of ddH2O
2ul of 3M NaAC(PH5.2)
50ul of无水乙醇
轻轻混匀,稍微离心并将其置于-20℃放置1小时以上;
系统参数:
输入电压220-240V,50-60HZ
输入电流15A
最大输出电压和电流2500V,125A(正常负荷)
电弧时限定值1500A
输出波形Pulse Trac指数衰减,RC时间常数取决于所选的样品和电容器
输出电压调节50-2500V范围(取决于电容器)内,低电压范围(50-500V)和
高电压范围分别具有2V和10V的调节精度。
可重复性—使用PulseTrac™电路和电弧保护功能以确保可重复性和样品防护
系统选项
Gene Pulser Xcell总电穿孔系统(货号165-2660)—用于转染真核细胞和原核细胞的完整电穿孔系统;包含CE模块和PC模块
Gene Pulser Xcell真核电穿孔系统(货号165-2661)—用于大多数真核细胞(包括哺乳动物细胞和植物原生质体)的电穿孔;包含CE模块
7.弃上清,往离心杯中加入少量10%甘油(灭菌,预冷),重悬菌体,再加预冷灭菌的10%甘油至离心管的2/3体积, 4℃, 4000rpm,离心10min,小心弃去上清液(沉淀可能会很松散)。
重复两次。
8.小心弃去上清液,每个离心杯中加入5ml10%的甘油(就是1000ml菌液:5 ml 10%甘油的比例,500 ml菌液就加2-3 ml 10%甘油),使沉淀悬浮后,将菌液以150ul/管分装于1.5ml的离心管中,直接用于电转化或-80℃冰箱中保存。
5.弃上清(将一切上清倒光,能够将离心管倒过来),离心杯中加入少量预冷灭菌ddH2O,轻吹,(建议不要用枪吹,用10 ml移液管)使沉淀悬浮后,然后加水稀释至离心管的2/3体积,4℃,4000rpm离心10分钟。
6.弃上清,加少量预冷灭菌灭菌水,轻吹,重悬菌体,然后加水稀释至离心管的2/3体积,4000rpm,4℃,离心10min。
/html/201312/6824083.html
制备的电转化的感受态细胞可以用于化学转化操作吗?
举报删除此信息
ljy525380(站内联系TA)
一般来说,电转感受态制备时都要用水和10%甘油洗数遍,其目的是为了尽可能的去除其中的盐离子成分,电击时才可以使电压附加在细胞两极,从而形成电穿孔,而不是电子直接通过盐离子传递;而热激感受态则是通过Ca2+等离子和试剂的作用改变细胞膜两侧渗透压,造成低渗的环境,菌会变得膨胀,细胞膜变薄,从而热激时吸收附着在菌表面的DNA。所以我感觉电转感受态是不太可能用于热激的,这些都是我认为的,供你参考吧
7.37℃,轻摇120 rpm,复苏1小时。
