《基础化学》期末复习资料
(整理)《基础化学》有机化学复习题.

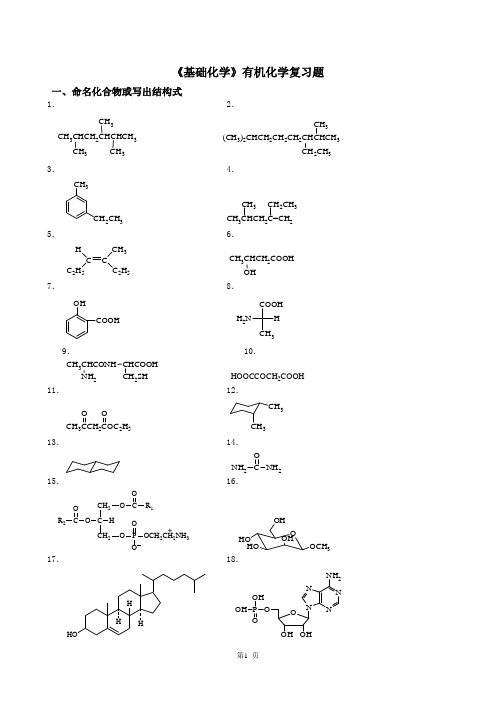
《基础化学》有机化学复习题一、命名化合物或写出结构式1. 2.CH 3CHCH 2CHCHCH 3CH 3CH 3CH 3(CH 3)2CHCH 2CH 2CH 2CHCHCH 3CH 2CH 3CH 33. 4.CH 3CH 2CH 3 CH 3CHCH 2C=CH 2CH 3CH 2CH 35. 6.C C H C 2H 5CH 3C 2H 5CH 3CHCH 2COOH7. 8.OHCOOHCOOHH 2NH CH 39. 10. CH 3CHCONH 2CHCOOH2SH HOOCCOCH 2COOH 11. 12.CH 322H 5O O3CH 313. 14. NH 2NH 2O15. 16.CH 2C CH 2O O OR 1HO C P OCH 2CH 2NH 3O OO R 2+O HOHOOHOCH 3OH17. 18.HHH HONNNN NH 2OOHOH P OH OH19.乙醚 20.顺-2-丁烯 21.异丙醇 22.乙酰苯胺 23.柠檬酸24.乙酸乙酯 25.阿司匹林 26.油酸 27.卵磷脂 28.葡萄糖29.半胱氨酸 30.赖氨酸 31.缩二脲 32.ATP二、是非题(正确的打 ,错误的打×)1.具有C n H2n通式的烃一定是烯烃。
()2.烷烃中的碳原子都是sp3杂化,烯烃中的碳原子都是sp2杂化。
()3.环己烯分子中的碳原子都是sp2杂化的。
()4.凡是双键碳原子都是sp2杂化。
()5.乙烷有两种构象,一种是重叠式构象,一种是交叉式构象。
()6.碳原子的类型分为伯、仲、叔、季碳,氢原子的类型也分为伯、仲、叔、季氢。
()7.具有旋光性的物质一定存在对映异构现象。
()8.一对对映体的混合物能用蒸馏的办法分开。
()9.左旋2-丁醇和右旋2-丁醇的混合液可用蒸馏方法分开。
()10.只有一个手性碳原子的分子一定具有旋光性。
()11.一个分子结构中含有3个手性碳原子,则这个分子一定是手性分子。
《基础有机化学及实验》期末复习题

《基础有机化学及实验》期末考试复习题(SGS)一. 填空题1、根据名称写出相应物质的结构简式酒精 邻二甲苯 氯仿 β-萘酚 苯磺酸 丙炔 2-丁炔 环丙烷 环戊烷 石炭酸 安息香酸 TNT 2,4-二硝基苯肼 甘油 木精 甘醇 1,3-丁二烯 苯 呋喃 吡咯 吡啶 卢卡斯试剂 阿斯匹林 蚁酸 乙酸异戊酯 六六六 萘 2、请写出下列常见的有机基团的名称:CH 3甲基CH 2CH 3乙基CH 3CCH 3异丙基苯基CH 2苄基CHCH 3CH 丙烯基CHCH 2CH 2烯丙基NO 2硝基OH 羟基NH 2氨基CHO醛基COOH 羧基OCH 3甲氧基CCH 3O不知道3、请说出两个有机化合物种类繁多的原因:a 、 碳链异构 。
b 、 结构异构(我猜的) 。
4、水分子中的一个H 原子被 烷基 取代后的产物称为醇,水分子中的一个H原子被苯基取代后的产物称为酚。
5、苯酚俗称石碳酸。
6、亲核加成反应是指:。
7、可发生卤仿反应的两种结构为:和。
8、俗称“三乙”的化合物的构造式为:。
9、杂环化合物是指:。
10、—N2—官能团的两端都和碳原子直接相连的化合物称为偶氮化合物化合物,如果—N2—官能团的一端与非碳原子直接相连的化合物称为重氮化合物化合物。
11、蜜峰蛰人时产生的肿痛是由于分泌了所致。
12、水杨酸构造式为:,硝化甘油构造式为:,苦味酸构造式为:,13、亚硫酸氢钠可与,,反应析出白色结晶。
14、苯酚酸性比羧酸强,比碳酸弱。
15、饱和一元羧酸的烃基上连有吸电子基团时,其酸性会变强。
饱和一元羧酸的烃基上连有供电子基团时,其酸性会变弱。
16、饱和一元羧酸中,最强的为甲酸。
17、根据俗名写出相应物质的结构简式:偶氮苯苦味酸呋喃三乙胺硝化甘油18、饱和一元脂肪族羧酸的烃基上连有吸电子基团时,其酸性会。
19、只与一个碳原子相连的碳原子叫伯碳原子,与两个碳原子相连的碳原子叫仲碳原子,与三个碳原子相连的碳原子叫叔碳原子,与四个碳原子相连的碳原子叫季碳原子。
《基础化学》有机化学复习题
《基础化学》有机化学复习题一、命名化合物或写出结构式1. 2.H 3CHCH 2CHCHCH 3CH 3CH 3CH 3CH 3)2CHCH 2CH 2CH 2CHCHCHCH 2CH 3CH 33. 4.H 3CH 2CH 3H 3CHCH 2C=CH 2CH 3CH 2CH 35. 6.CH C 2H 5CH 3C 2H 5H 3CHCH 2COOH OH7. 8.HCOOHOOHH 2NH CH 39. 10. H 3CHCONH NH 2CHCOOH CH 2SHOOCCOCH 2COOH11. 12.H 3CCH 2COC 2H 5O OH 3CH 313. 14.NH 2NH 2O15. 16.C H 2CC H 2O OC OR 1HOCP O C H 2C H 2N H 3O OO R 2+17. 18.HHH H O19.乙醚 20.顺-2-丁烯 21.异丙醇 22.乙酰苯胺 23.柠檬酸 24.乙酸乙酯 25.阿司匹林 26.油酸 27.卵磷脂 28.葡萄糖 29.半胱氨酸 30.赖氨酸 31.缩二脲 32.ATP二、是非题(正确的打 ,错误的打×)1.具有C n H 2n 通式的烃一定是烯烃。
( ) 2.烷烃中的碳原子都是sp 3杂化,烯烃中的碳原子都是sp 2杂化。
( ) 3.环己烯分子中的碳原子都是sp 2杂化的。
( ) 4.凡是双键碳原子都是sp 2杂化。
( ) 5.乙烷有两种构象,一种是重叠式构象,一种是交叉式构象。
( ) 6.碳原子的类型分为伯、仲、叔、季碳,氢原子的类型也分为伯、仲、叔、季氢。
( ) 7.具有旋光性的物质一定存在对映异构现象。
( ) 8.一对对映体的混合物能用蒸馏的办法分开。
( ) 9.左旋2-丁醇和右旋2-丁醇的混合液可用蒸馏方法分开。
( ) 10.只有一个手性碳原子的分子一定具有旋光性。
( ) 11.一个分子结构中含有3个手性碳原子,则这个分子一定是手性分子。
基础化学复习题

基础化学复习题单项选择题1. 理想气体绝热自由膨胀时,则 BA . 0U ∆>,0S ∆=B .0U ∆=,0S ∆>C . 0U ∆>,0S ∆>D .0U ∆=,0S ∆= 2.下面关于标准摩尔生成焓的描述中,不正确的是 CA.生成反应中的单质必须是稳定的相态单质B.稳态单质的标准摩尔生成焓被定为零C.生成反应的温度必须是D.生成反应中各物质所达到的压力必须是100KPa 3. 理想气体在可逆的绝热膨胀过程中是 BA . 内能增加B . 熵不变C . 熵增大D . 温度不变 4. 封闭系统中吉布斯函数G 与热力学U 的关系是 DA. G > UB. G < UC. G = UD. 无固定关系A. 零级反应 B . 一级反应 C . 二级反应 D . 三级反应 5.工作在100℃和25℃的两个大热源间的卡诺机其效率是 AA . 20%B . 25%C . 75%D . 100% 6.若将人作为一个体系,则该体系是 CA .孤立体系 B.封闭体系 C.敞开体系 D.半封闭系统7.在100℃, kPa 下,1 mol 水全部向真空气化为100℃, kPa 的水蒸气,则该过程为 B A . ΔG < 0,不可逆 B . ΔG = 0,不可逆 C . ΔG > 0,不可逆 D . ΔG < 0,可逆 8. 液态水在100℃及 kPa 下汽化,则该过程的 DA . ΔH = 0B . ΔS = 0C . ΔA = 0D . ΔG = 0 9.对于封闭体系的热力学 , 下列各组状态函数之间的关系正确的是 B A . A > U B . A < U C . G < U D . H< A 10. 下列各式表示偏摩尔量的是 A A . )(..(B A n P T B A n U≠⎪⎭⎫ ⎝⎛∂∂ B . )(..S (B A n P B A n H ≠⎪⎭⎫ ⎝⎛∂∂C . )(..(B A n V T B A n A≠⎪⎭⎫ ⎝⎛∂∂ D . )(..B (B A n P T B A n ≠⎪⎭⎫ ⎝⎛∂∂μ 11.刚性绝热箱内发生一化学反应,则反应体系是 AA.孤立体系B.敞开体系C.封闭体系D.绝热体系 12. 已知反应Cs+O 2g →CO 2 g 的ΔH,下列说法中不正确的是 C A . ΔH 为CO 2g 的生成热 B . ΔH 为CS 的燃烧热 C . ΔH 与反应的ΔU 数值不等 D . ΔH 与反应的ΔU 数值相等 13.封闭系统中吉布斯函数A 与热力学U 的关系为 BA . A > UB . A < UC . A = UD . 无固定关系 14. 热力学第三定律可以表示是 BA . 在0K 时,任何晶体的熵等于零B . 在0K 时,纯物质完美晶体的熵等于零 C. 在0℃时,任何晶体的熵等于零 D . 在0℃时,完美晶体的熵等于零 15. 一级反应完成%所需时间是完成50%所需时间是 CA . 2倍B . 5倍C . 10倍D . 20倍 16. 选出下列性质参数中属于容量性质的量是 CA . 温度TB . 浓度cC . 体积VD . 压力p17. 在恒温,恒压下,已知反应A →2B 和2A →C 的反应热分别为ΔH 1和ΔH 2,则反应C →4B 的反应热ΔH 3是 DΔH 1+ΔH 2 B . ΔH 2-2ΔH 1 C . ΔH 1+ΔH 2 D . 2ΔH 1-ΔH 2 18. 不挥发的溶质溶于溶剂中形成溶液之后将会引起C A . 熔点升高 B . 沸点降低 C . 蒸汽压降低 D . 总是放出热量 19.下列是化学势的是 C A . )(..(B A n P T B A n U≠⎪⎭⎫ ⎝⎛∂∂ B . )(..(B A n P T B A n H ≠⎪⎭⎫ ⎝⎛∂∂ C . )(..(B A n V T B A n A≠⎪⎭⎫ ⎝⎛∂∂ D . )(..(B A n V T B A n G ≠⎪⎭⎫ ⎝⎛∂∂ 20. 在 - 10 °C, 下,水的化学式势μ水与冰的化学势μ冰的大小关系应为 CA . μ水=μ冰B . μ水 >μ冰C . μ水 <μ冰D . 无法确定21. 理想气体从状态p 1V 1T 自由膨胀至p 2V 2T ;此过程的ΔA 与ΔG 的关系是 C A . ΔA>ΔG B . ΔA<ΔG C . ΔA=ΔG D . 不能确定22. 某反应的反应物消耗一半的时间正好是反应物消耗1/4的时间的2倍,则该反应的级数是BA . 0.5级反应B . 0级反应 级反应 级反应23. 在25℃下反应COg+2H 2g =CH 3OHg 的16.90-⋅-=∆mol KJ H m r θ ,为提高反应的平衡产率,应采取的措施是 DA .升高温度和压力B . 降低温度和压力C .升高温度,降低压力D . 降低温度,升高压力24. 某二级反应,反应物消耗 1/3 需时间 10 min ,若再消耗 1/3 还需时间为 C A . 10 min B . 20 min C . 30 min D . 40 min 25. 对于某反应,若反应物反应掉其43所需时间恰是它反应掉21所需时间的2倍,则该反应的级数是 B填空题1.按标准摩尔生成焓与标准摩尔燃烧焓的定义,在C 石墨、COg 和CO 2g 之间, CO 2g 的标准摩尔生成焓正好等于 C 石墨 的标准摩尔燃烧焓;2. 亨利常数随温度的升高而 增大 增大、减小或不变;3. 反应2A → B ,则-dc A /dt 和dc B /dt 之间的关系是 -dc A /dt=2dc B /dt ;4. 在绝热、体积恒定的容器中发生一化学反应,使容器中温度、压力都增加,则该过程的∆U = 0;5. 设理想气体反应)(3)()(g C g B g A =+达化学平衡,在等温下维持系统总压不变,向系统中加入惰性气体,平衡__向右__移动;6. 反应A → 2B ,则-dc A /dt 和dc B /dt 之间的关系是 -2dc A /dt=dc B / ;7. A 、B 两理想液态混合物在T-x 图上出现最高点,则该混合物对拉乌尔定律产生 负偏差 偏差;8. 在恒温恒压下,一切相变化必然朝着化学势 降低 的方向自动的进行; 9. 化学反应热会随反应温度改变而改变的原因是 .r 0p m C ∆≠ ; 10. 实际气体绝热自由膨胀,则该过程的∆S _>__ 0;11. 糖可以顺利溶解在水中,说明固体糖的化学势较糖水中的糖的化学势__高__;12. 卡诺热机在T 1=600K 的高温热源和T 2=300K 的热源间工作,其热机效率η= 50% ; 13. 按标准摩尔生成焓与标准摩尔燃烧焓的定义,在C 石墨、COg 和CO 2g 之间, C 石墨的标准摩尔燃烧焓正好等于 CO 2g 的标准摩尔生成焓;14.在总压不变时,加入惰性气体的结果与___降低_____压强的结果是相同的; 15. 在绝热、体积恒定的容器中发生一化学反应,使容器中温度、压力都增加,则该过程的ΔU_____=_____0;名词解释 1. 偏摩尔量均相系统中,系统的广度性质Z 在恒温恒压除B 组分其它组分保持不变的条件下,Z 函数随B 组分的变化量为B 组分的偏摩尔量:..(,)Z Z m B T p n c c B n ≠⎛⎫∂= ⎪∂⎝⎭ 2. 分解压化合物的分解压是指该化合物纯液体或纯固体分解出气体的分解反应在指定温度下达到平衡时,生成物气体的总压力; 3. 化学势均相系统中,系统广度性质吉布斯函数在恒温恒压除B 组分其它组分保持不变的条件下,吉布斯函数随B 组分的变化量为B 组分的化学势即偏摩尔吉布斯函数:B ..(,)G m B T p n c c B G n μ≠⎛⎫∂== ⎪∂⎝⎭ 4. 卡诺循环热机以理想气体为工作介质,工作过程由两个等温可逆过程和两个绝热可逆过程组成,它的循环工作过程成为卡诺循环; 5. 吉布斯自由能吉布斯自由能G 是系统状态函数的组合即G=H -TS,也是系统的状态函数;封闭系统在恒温恒压非体积功为零的条件下,吉布斯自由能的变化量可以作为判据,判断过程的方向; 6. 化学反应速率化学反应速率的定义:设化学反应0B BB ν=∑ ,反应速率1BB dn d dt dtξν= 定容反应时反应速率1BB dc v dtν=7. 卡诺定理在两个不同温度热源之间工作的所有热机,以可逆热机效率最大;热机效率η只与两个热源的温度有关:121T T T η-=T 1是高温热源的温度,T 2是低温热源的温度 8. 亥姆霍兹自由能亥姆霍兹自由能A 是系统状态函数的组合即A=U —TS,也是系统的状态函数;封闭系统在恒温恒容非体积功为零的条件下,亥姆霍兹自由能的变化量可以作为判据,判断过程的方向;9. 稀溶液依数性稀溶液溶质是非挥发性的的某些性质只依赖溶液中溶质分子的数量,而与溶质分子本性无关的性质;如溶剂蒸汽压降低,凝固点降低,沸点升高和渗透压; 10. 标准平衡常数标准平衡常数K Θ的定义式:exp[/()]m K rG RT θθ=-∆标准平衡常数在理想气体化学反应中是一定温度下平衡时的压力商, 即()/BeqB BK p p νθθ=∏ 计算题1、4mol N 2 在27℃,等压升温至127℃,求此过程的W 、Q 、△U 和△H ; 该气体可视为理想气体,其 = ; 解:.21Q ()11.20p m H nC T T kJ =∆=-= .21U ()()7.874p m n C R T T kJ ∆=--=3.326W U Q kJ =∆-=-计算该反应CO 2g+4H 2g →CH 4g+2H 2Og 在时的G m r θ∆和K θ; 解:反应CO 2g+4H 2g →CH 4g+2H 2Og 的θm rH ∆=θνm f BB H ∆∑B,=θm f H ∆ CH 4,g +2θm f H ∆ H 2O,g- θm f H ∆ CO 2,g -4θm f H ∆ H 2,g =mol()∑=∆Bm B m K S K rS )15.298(15.298θθν=θm S CH 4,g +2θm S H 2O,g- θm S CO 2,g -4θm S H 2,g =所以1113.45.r m m m G rH T rS kJ mol θθθ-∆=∆-∆=-ln 45.77mrG K RTθθ∆=-= K Θ=3、已知水在100℃,下的摩尔蒸发焓140.668Vap m H kJ mol -∆=⋅,试计算1kg 水在100℃,条件下,蒸发为水蒸气的Q 、W 、△U 及△H;水蒸气可按理想气体处理2311810H O M kg mol --=⨯⋅解:. 100040.668/2259.318p Q H mol kJ mol kJ =∆=⨯= 310008.314373.1510172.3518W nRT kJ kJ -=-=-⨯⨯⨯=2087.05U W Q kJ ∆=+=4. 化学反应)(2)(2)()(224g H g CO g CO g CH +=+,已知25℃时热力学数据1利用θB m f H .∆θB m S .,求上述反应在25℃时θm rS ∆,θm rG ∆2利用θB m f G .∆,求上述反应在25℃时θm rG ∆及K θ; 解:1反应)(2)(2)()(224g H g CO g CO g CH +=+1242.269.247)()()(2)(2-=∆-∆-∆+∆=∆mol kJ CO H CH H H H CO H rH m f m f m f m f m θθθθθ242112()2()()()256.712..m m m m m rS S CO S H S CH S CO J K molθθθθθ--∆=+--=1.73.170-=∆-∆=∆mol kJ S T H G m r m r m r θθθ224212()2()()()170.74.m f m f m f m f m rG G CO G H G CH G CO kJ molθθθθθ-∆=∆+∆-∆-∆=ln 68.88mrG K RTθθ∆=-=- K 1Θ=5. 25℃下,密闭恒容的容器中有10g 固体萘)(810s H C 在过量的()g O 2中完全燃烧成()g CO 2和()l O H 2;过程放热;已知 1810.128)(-=mol g H C M ,求1()()()108222()12104C H s O g CO g H O l +=+的反应进度; 2)(810s H C 的θm c U ∆; 3)(810s H C 的θm c H ∆; 解:1mol M m 078125.012810===ξ 2 1.1.5142078125.0727.401--=-==∆mol kJ molkJQ U Vm c ξθ311131.06.5147.)96.41.5142(.1015.298314.82.1.5142------=--=⨯⨯⨯--=∆+∆=∆mol kJ mol kJ mol kJ molkJ nRTU H m c m c θθ6、 已知下列数据 物质COg H 2g CH 3OHg 11../--K mol J S m θ1./-∆mol kJ H m f θ求时,下列反应COg + 2H 2g == CH 3OHg 的θm rG ∆和θK ; 解:反应COg + 2H 2g == CH 3OHg 的 ∑--=∆-=∆1,.18.90molkJ H rH B m f Bm θθν11,..53.219--∑-==∆K mol J S rS B m B m θθν所以1.72.24--=∆-∆=∆mol kJ rS T rH G m m m r θθθ975.9ln =∆-=RTrG K mθθK Θ=7. 2mol 双原子理想气体从始态300K 、50dm 3,先恒容加热至400K,再恒压加热至体积增大到100 dm 3,求整个过程的Q,W.ΔU,及ΔH;已知R c m v 25.= 解:过程为⎪⎩⎪⎨⎧==−→−⎪⎩⎪⎨⎧==−→−⎪⎪⎩⎪⎪⎨⎧===23333)2(2122)1(1311100400503002pp dm V T p V V K T p dm V KT mol2为定压过程 所以K T V V T 8002233=⨯=J J J K R mol K R T T nC T T nC Q Q Q m p m v 2.274362.232794157)400800(272)300400(252mol )()(23.12.21=+=-⨯+-⨯=-+-=+= JK R T T nR V V p W W W W 2.6651)400800(2mol )()(23232221-=-⨯-=--=--==+=J K K R T T nC U m v 20785)300800(252mol )(13.=-⨯=-=∆ JK K R T T nC H m p 29099)300800(272mol )(13.=-⨯=-=∆ 8、 已知25℃时的下列数据: 物质Ag 2Os CO 2g Ag 2CO 3s11/.m S J mol K θ--⋅1/f m H kJ mol θ-∆⋅求25℃时Ag 2CO 3s 的分解反应Ag 2CO 3s →Ag 2Os + CO 2g 的m rG θ∆和K θ; 解:25℃时反应Ag 2CO 3s → Ag 2Os + CO 2g ∑-=∆-=∆1,.241.81mol kJ H rH B m f Bm θθν11,..64.167--∑==∆K mol J S rS B m B m θθν所以1.26.31-=∆-∆=∆mol kJ rS T rH G m m m r θθθ617.12ln -=∆-=RTrG K mθθK 1Θ=9. 1mol 理想气体于27℃,状态下等容升温至97℃,则压力升到;求整个过程的Q,W, ΔU 及ΔH;已知该气体的C v,m 恒定为mol; 解:已知: 1mol 理想气体 = J/Q =ΔU = T 2 – T 1 = kJ ΔH = T 2 – T 1 = kJ W = 010、已知在有如下数据 物质CO 2g NH 3g H 2Og CONH 22s 11/.m S J mol K θ--⋅1/f m H kJ mol θ-∆⋅求时,反应CO 2g+ 2NH 3g → H 2Og + CONH 22s 的m rG θ∆及标准平衡常数K Ө ; 解:,11m B f m BrH H θθν--∆=∆=⨯⋅=⋅∑(-241.83-333.19+393.51+246.19)kJ mol -89.13kJ mol ,1111188.82+104.60213.762192.61 305.56m B m BrS S J mol K J mol K θθν----∆==--⨯⋅⋅=-⋅⋅∑() 31189.13298.15305.56101.97.r m m mG rH T rS kJ mol kJ mol θθθ---∆=∆-∆=-+⨯⨯⋅=() ln 0.795mrG K RTθθ∆=-=- K Θ=。
《基础化学》复习题

《基础化学》复习题填空题1 .[Ag(NH3)2]+习惯名称______________。
2. 五羰基铁、银氨配离子的化学式分别为 ____________。
3.四氨合铜(Ⅱ)配离子的化学式是________________4. 2Cu+ Cu+Cu2+中,既为氧化剂又为还原剂是______,Cu与Cu2+氧化性强的是____________。
5.指出化学反应方程式 2KMnO4+5H2O2+6HNO3=2Mn(NO3)2+ 2KNO3+8H2O+5O2↑中氧化剂是__________,还原剂为_____________。
6.写出电对I2/I-的半反应: ________________________。
7. Fe3+,Fe2+,Fe三种氧化值不同的物种,氧化性最强的是Fe3+,还原性最强的Fe。
8.Hg2Cl2中Hg元素的氧化值为___________。
9. 赤铁矿的主要成分为________。
10.电子层,电子亚层,电子云的伸展方向,电子的自旋方向可以分别用_________,_________,________,____符号表示。
11.. Fe 原子在基态时有4个未配对的电子。
12.下列反应处于平衡状态, X(g)+Y(g) 4Z(g) △H=-45kJ·mol-1当同时升高温度加入正催化剂时,正反应速度将__________,化学平衡将________。
13.已知: A+B=C为简单反应,则此反应速度常数的单位是______________。
14.影响化学反应速率的外界条件主要有_____________、______________、_____________。
15.正反应的活化能大于逆反应的活化能,则______________为吸热反应。
16. 标准平衡常数的计算中,规定标准压力为_________,标准浓度为___________。
17. 可逆反应指的是__________________________。
《基础化学》期末考试试卷附答案

《基础化学》期末考试试卷附答案一、选择题(共10小题,每小题4分,共40分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大B、不变C、减小D、先增大后减小2、当主量子数n=3时,则角量子数l的取值为()。
A、1、2、B、0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等D、反应物均已消耗完毕4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2OB、NaBrC、CH3OHD、Na2O25、蔗糖的凝固点为()。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、s区B、d区C、f区D、p区7、质量作用定律只适用于()。
A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应D、已进行完的反应8、对于反应Cr2O72-+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。
A、1B、6C、3D、129、下列物质中熔点最高的是()。
A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是()。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应二、填空题(共15空,每空2分,共30分)1、原电池(-)Pt |Fe2+(C1),Fe3+(C2)|| Fe2+(C3),Fe3+(C4)| Pt(+)负极上发生的电极反应式:____________________;正极上发生的电极:______________________________________。
基础化学复习要点

4.5 第五节 分散系统与混合物的组成标度 [TOP] 4.5.1 分散系统及分类一种或数种物质分散在另一种物质中所形成的系统称为分散系。
被分散的物质称为分散相,容纳分散相的连续介质称为分散介质。
按照分散相粒子的大小,可以把分散系分为真溶液、胶体分散系和粗分散系,它们具有不同的扩散速度、膜的通透性和滤纸的通透性能。
真溶液的分散相粒子小于1 nm ,粗分散系分散相粒子大于100 nm ,介于两者之间的是胶体分散系。
分散系又可分为均相分散系和非均相分散系两大类。
4.5.2 混合物的组成标度 (一)物质的量物质的量是表示物质数量的物理量,用符号n B 表示。
下标B 泛指计量的物质B ,对具体物质,例如水,其物质的量的符号写做n (H 2O)。
物质的量的单位是摩尔(mole),单位符号为mol 。
摩尔的定义是:“摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg 碳12的原子数目相等。
在使用摩尔时,基本单元应予指明,可以是原子、分子、离子、电子及其他粒子,或这些粒子的特定组合。
”1 mol 物质的基本单元数是阿伏加德罗常数的数值,但受测量技术水平的限制,不能绝对准确。
因此定义摩尔时使用12g 碳12作为计量系统,虽然它的原子数目还不能确切知道,但它是一个确定的数值,不随测量技术而改变。
使用摩尔时须指明基本单元,如n (H)、n (H 2)、n (21SO 42-)、n (2H 2+O 2) 等。
相同的计量系统可以有不同的基本单元,例如氢,可以定义氢原子或是氢分子的物质的量, 所以说“1mol 氢”就不确定了。
用摩尔还可以计量化学反应,例如中和反应H 2SO 4 + 2NaOH = Na 2SO 4 + 2H 2O就可以用反应物(H 2SO 4 + 2NaOH )作基本单元。
B 的物质的量可以通过B 的质量m B 和摩尔质量M B 求算: M B = m B /n B (1.1)以g·mol -1为摩尔质量的单位,原子的摩尔质量的数值等于其相对原子质量A r ,分子的摩尔质量的数值等于其相对分子质量M r 。
《基础化学》有机化学复习题.doc

15.oIIO CH2-O-C-R!IIR2_C—O—C—H ©I II +CH2—O-P-OCH2CH2NH3o~17.《基础化学》有机化学复习题一、命名化合物或写出结构式1.CH3CHCH2CHCHCH3乩CH33.C 2H5 C2H57.OHCCXDH9.CH3CHCONH - CHCOOHNH2 CH2SH11.o o II II CH3CCH2COC2H513.HO2.CH3(CH O)2CHCH9CH0CH9CHCHCH OCH2CH34.CH3 CH2CH3CH.CHCH7C=CH9 。
,匕6.CH R CHCH'COOH•J■OH8.COOHH^N—J—HCH310.HOOCCOCH2COOH14.oIINH广C-NH,16.OH OH19.乙醍20.顺-2■丁烯21.异丙醇22.乙酰苯胺23.柠檬酸24.乙酸乙酯25.阿司匹林26.油酸27.卵磷脂28.葡萄糖29.半胱氨酸30.赖氨酸31.缩二脉32. ATP二、是非题(正确的打/,错误的打X)1.具有CJK通式的炷一定是烯炷。
()2.烷炷中的碳原子都是sp'杂化,烯炷中的碳原子都是s"杂化。
()3.环己烯分子中的碳原子都是s"杂化的。
()4.凡是双键碳原子都是sj杂化。
()5.乙烷有两种构象,一种是重叠式构象,一种是交叉式构象。
()6.碳原子的类型分为伯、仲、叔、季碳,氢原子的类型也分为伯、仲、叔、季氢。
()7.具有旋光性的物质一-定存在对映异构现象。
()8.一-对对映体的混合物能用蒸儒的办法分开。
()9.左旋2-丁醇和右旋2-丁醇的混合液可用蒸儒方法分开。
()10.只有一个手性碳原子的分子一定具有旋光性。
()11.一个分子结构中含有3个手性碳原子,则这个分子一•定是手性分子。
()12.手性分子具有旋光性,旋光度不等于妄,非手性分子无旋光性,旋光度为零。
内消旋酒石酸的旋光度为零,虽然内消旋酒石酸的分子有2个手性碳原子,但它一定是非手性分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.原子轨道和电子云角度分布图形
角度分布图:
径向波函数(radial wave function),Rn,l(r)是由 n 和 l 确定的只与半径 r 有关的函数。 角度波函数(angular wave function),Yl,m(θ,)是由 l 和 m 确定的与方位角θ、有关的函数。 s 轨道的角度波函数是常数。p 轨道的角度波函数的值随θ和φ的改变而改变。d 轨道有 2 个节面,4 个
或标准氢电极(SHE)。
使用最广泛的 pH 指示电极为玻璃电极。或氢电极 H+(c)| H2(p)| Pt(s)。
7.电位法测定溶液的 pH
复合电极为
(-)玻璃电极 | 待测 pH 溶液 | SCE(+)
pH pH
.303
pH 为标准缓冲溶液的 pH; 是标准缓冲溶液与电极组成的电池电动势。
第十章 原子结构与元素周期律
(3)金属–金属难溶盐–阴离子电极 在金属表面涂有该金属难溶盐的固体,然后浸入与该盐具有相
同阴离子的溶液中所构成的电极。如 Ag–AgCl 电极,在 Ag 的表面涂有 AgCl,然后浸入有一定浓度的 Cl–
溶液中。
电极组成式 Ag(s)| AgCl(s)| Cl–(c) 电极反应 AgCl(s)+e–—→Ag(s)+CI–(aq)
第六章 化பைடு நூலகம்热力学基础
1.概念:状态函数、热力学三个定律、热化学方程、热效应、自发过程 广度性质(Extensive Property):这类性质具有加和性,如体积、物质的量等。 强度性质(Intensive Property):这些性质没有加和性,如温度、压力等。 2.能量守恒和化学反应热 热力学第一定律(the first law of thermodynamics):自然界的一切物质都具有能量,能力有各种不同的
(4)氧化还原电极 将情性导体漫入含有同种元素的两种不同氧化值状态的离子溶液中所构成的电
极。如将 Pt 浸入含有 Fe2+、Fe3+的溶液,构成 Fe3+/Fe2+电极。
电极组成式 Pt(s)| Fe2+(c1),Fe3+(c2) 电极反应 Fe3+(aq)+e–—→Fe2+(aq)
3.电池电动势与 Gibbs 自由能变的关系
物体会自发的向蒸汽压力小的方向转化。
3.溶液的沸点升高和凝固点降低
Δ
0
Δ
0
沸点升高发和凝固点降低法常用与测定溶质的 Mr。但多数 > ,用凝固点降低法测量误差更小。
4.溶液的渗透压力
(1)产生渗透现象的两条件:①存在半透膜;②半透膜两侧单位体积内溶剂的分子数不相等。
(2)概念:渗透压力、渗透浓度、等渗(临床上规定等渗溶液浓度为 280~320mmol·L-1)、低渗、高
第十一章 共价键和分子间力
第 6 页 共 12 页
1.概念:等性杂化、不等性杂化、氢键 能量相近的原子轨道杂化后,所形成的几个杂化轨道所含原来轨道成分的比例相等,能量完全相同时 的杂化为等性杂化,若杂化轨道中,有的含有单电子,有的被孤对电子占据,则这些杂化轨道能量是不完 全相同的,此类杂化为不等性杂化。 2.用杂化轨道理论解释简单分子的空间构型 CH4 分子的 4 个 C-H 键的键角是 109°28'。 在原子间形成共价键的过程中激发、杂化及轨道重叠同时进行 离域π键的表示方法:П 其中 m 表示参与成键的电子数,n 表示表示参与成键的原子数。 3.同核双原子分子核外电子排布以及键级的计算 物质的磁性:抗磁性物质中的电子都已成对,在顺磁性物质中则含有单电子。 键级(bond order):表示键的牢固程度。一般说来,键级愈高,键能愈大,键愈稳定;键级为零,则 表明原子不可能结合成分子。
波函数ψ(wave function)。ψ本身物理意义并不明确,但|ψ|2 却有明确的物理意义。|ψ|2 表示在原子核
外空间某点处电子出现的概率密度(probability density)。概率密度:在该点处微单位体积中电子出现的概
率。三个量子数 n、l、m 确定一个原子轨道即波函数ψn,l,m。
Δr
Θ m
Θ
如果 E>0,则Δr m<0,正向反应自发。
如果 E<0,则Δr m>0,逆向反应自发。
如果 E=0,则Δr m 0,反应达到平衡。
4..电池电动势与平衡常数关系
ln Θ
Θ
Θ
ln Θ
5.电极电位的 Nernst 方程式表示为
( 极 ) Θ( 极 )
(Ox) ln
(Red)
Θ
除氧化型和还原型外,若有 H+、OH–或 Cl–等介质参加电极反应,则它们的浓度也必须写入 Nernst 方
低。
②Pauli 不相容原理(Pauli exclusion principle)。同一原子中不可能有 2 个电子具有四个完全相同的量
子数,即一个原子轨道中不存在自旋相同的两个电子。
③Hund 规则(Hund’s rule)。电子在能量相同的轨道(简并轨道)上排布时,总是尽可能以自旋相同
的方向,分占不同的轨道,因为这样的排布方式总能量最低。
第三章 沉淀溶解平衡
1.溶度积及溶度积规则:设难溶强电解质 AaBb 的溶解度为 S,沉淀溶解达平衡时:
AaBb(s)
aAn+(aq)+bBm–(aq)则:
Ksp=[An+]a[Bm–]b
sp
第四章 缓冲溶液
1.概念:缓冲溶液、缓冲作用、缓冲容量
2.缓冲溶液 pH 3.缓冲容量
B pH=p a lg HB
(B )
pa
lg (HB)
d a(b) dpH
HB B .303 × HB B
缓冲比
B HB
越接近
1,总浓度
c
总
越大,缓冲容量β越大。
4.缓冲范围:pH=pKa±1 5.血液中的缓冲系 在人体中碳酸缓冲体系(H2CO3-HCO3-)的浓度最高,缓冲能力最强,在维持血液的 pH 正常范围 发挥的作用最重要。虽然血浆中 HCO3--CO2(aq)缓冲系的缓冲比已超出体外缓冲溶液的有效缓冲比范 围,但碳酸缓冲系仍然是血液中的一个重要的缓冲系。这是因为人体是一个敞开系统,HCO3-和 CO2(aq) 浓度的改变可通过肺的呼吸作用和肾的生理功能进行补充或调节,使得血浆中的 HCO3-和 CO2(aq)的浓 度保持相对稳定,从而维持血液 pH 的恒定。
第 1 页 共 12 页
a
3.酸碱溶液 pH 的计算
弱酸 ca Ka≥20Kw,ca/Ka≥500: H3O
aa
弱碱 cb Kb≥20Kw,cb/Kb≥500: OH
两性物质 cKa≥20Kw,c>20Ka′: pH ( a
a)
Ka 为两性物质作为酸时的解离常数,而 Ka′ 则是两性物质作为碱时其对应的共轭酸的解离常数。 多元弱酸第二步解离平衡所得的共轭碱的浓度近似等于 Ka2。例如:[CO32-]≈Ka2(H2CO3)。
n
l
m
波函数ψ
同层轨道数(n2) 容纳电子数(2n2)
1
0
0
ψ1s
1
2
0
0
ψ2s
2
0
ψ2pz
4
8
1
±1
ψ2px,ψ2py
0
0
ψ3s
0
ψ3pz
1
±1
ψ3px,ψ3py
3
9
18
0
ψ3dz2
2
±1
±2
ψ3dxz,ψ3dyz ψ3dxy,ψ3dx2-y2
Ψ2,1,+1 和Ψ2,1,-1 是复波函数,可以线性组合为实波函数ψ2px、ψ2py,但不存在一一对应关系。
t ln t
a(
)
第九章 氧化还原反应与电极电位
1.概念:氧化值、原电池、盐桥
2.会写电池以及电极的组成式
原电池组成式
(-)Zn(s)| Zn2+(1mol·L-1)|| Cu2+(1mol·L-1)| Cu(s)(+)
常用电极可分为四种类型:
(1)金属–金属离子电极 以金属为电极板,插入含有该金属离子的溶液中构成的电极。如 Zn2+/Zn
橄榄形波瓣。p、d 电子云图形比相应角度波函数的图形“瘦”,且无“+”、“-”号。
径向分布函数图的特点:概率最大的地方并不是概率密度最大的地方(概率=概率密度×体积)。 3.多电子原子核外电子排布(高中化学选修三以详细介绍,在此未做梳理)
4.能级组、周期、族、分区(高中化学选修三以详细介绍,在此未做梳理) 同周期中相邻两元素的原子半径减小的平均幅度是:
稳定单质的Δc
mΘ 与其完全燃烧的稳定产物的Δf
mΘ 相等。如Δc
Θ m
(H2,g)=Δf
mΘ (H2O,l)
4.自由能变的计算以及判断反应方向
标准摩尔熵(温度对熵的影响不大)
Δr
Θ m
标准状态下的 Gibbs 自由能变
Δr
Θ m
Θ m
(产物)
Δf mΘ (产物)
Θ m
(反应物)
Δf mΘ (反应物)
一、按章节梳理的知识点及公式
第一章 稀薄溶液的依数性质
1.混合溶液的组成标度
物质的量浓度
B
质量摩尔浓度
B
A
摩尔分数 x
2.溶液的蒸气压下降–Raoult 定律
(适用范围:难挥发性的非电解质稀薄溶液(bB≤0.2mol·kg-1 的溶液))
0x
Δ
0
0x
Δ
0
(K 是比例系数取决于 MA) 无论是固体或是液体,同温度下蒸气压力大的称为易挥发性的物质,蒸气压小的叫难挥发性物质。
