临床试验项目总结报告分中心小结表盖章申请表
临床试验项目总结报告分中心小结表盖章申请表

临床试验项目名称
申办方/CRO
经办人/TEL:
专业科室
主要研究者
主要研究者意见:
报告中筛选、入组、脱落、剔除及完成例数等数据是否与实际发生一致?□是□否
报告中SAE、方案偏离/违背情况是否与实际发生一致?□是□否
其他需要说明情况:_____________________________________________________________
试验项目归档资料是否完整、规范?□是□否
责任人(签字)
年月日
机构办公室主任(签字)
年月日
盖章人(签字)
年月日
申请人上交申请表及总结报告后7个工作日联系机构办公室取回,联系人孟老师275572xx
责任人(签字)
年月日
伦理委员会意见:
中期报告、年度报告及总结报告是否上报伦理委员会且完整?□是□否
报告中SAE、方案偏离/违背情况是否与上报伦理委员会情况一致?□是□否
跟踪审查问题说明(如适用):_____________________________________________________
责任人(签字)
年月日
机构质控组意见:
知情同意书、研究病历及CRF是否记录完整,且数据可溯?□是□否
试验筛选、入组等是否执行试验方案?□是□否
质控发现问题是否及时解决并反馈?□是□否
责任人(签字)
年月日
机构财务管理员意见:ຫໍສະໝຸດ 试验经费到账情况是否与试验协议一致?□是□否
责任人(签字)
年月日
机构资料管理员意见:
药物临床试验分中心小结表
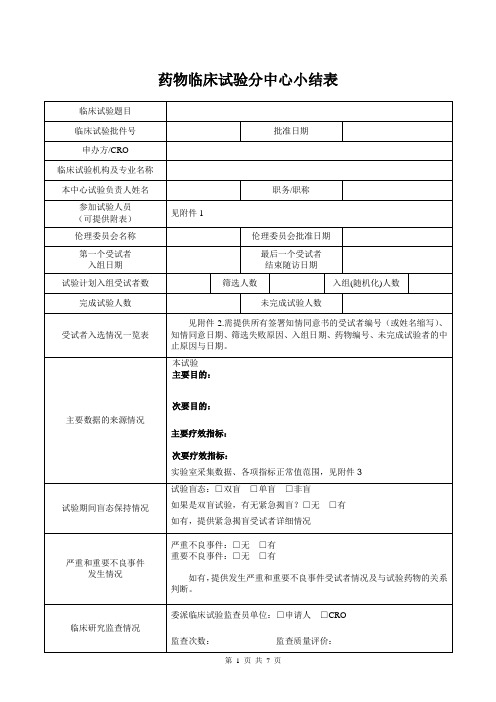
药物临床试验分中心小结表
附件1
参加试验人员信息
姓名职称所在科室研究分工
注:研究分工代码信息
1. 知情同意书获取
2. 病人入排标准确定
3. 体检/病史
4. CRF填写及更改
5. 签署原件CRF
6. 伦理联系
7. 病人联系/跟踪
8. 严重不良事件报告
9. 药物发放追踪管理
10. 试验用药指导
11. 样本管理
12. 中心实验室联系
13. IVRS/IWRS
14. 饮食和运动指导
15. 差异解决
附件2
分中心小结附表:受试者入选情况一览表
项目名称:研究中心方案号:药物名称:
第 4 页共7 页
附件3
实验室采集数据、正常值范围
第 5 页共7 页
附件4
重要不良事件
第 6 页共7 页
附件5
严重不良事件
第7 页共7 页。
分中心小结
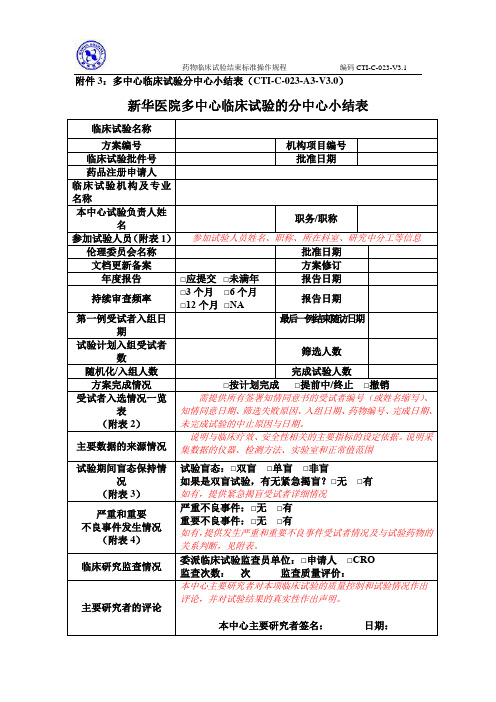
新华医院多中心临床试验的分中心小结表
临床试验名称
方案编号
机构项目编号
临床试验批件号
批准日期
药品注册申请人
临床试验机构及专业名称
本中心试验负责人姓名
职务/职称
参加试验人员(附表1)
参加试验人员姓名、职称、所在科室、研究中分工等信息
伦理委员会名称
批准日期
文档更新备案
方案修订
年度报告
□应提交□未满年
报告日期
本中心临床试验机构
管理部门审核意见
盖章:日期:
附表1:参加试验人员列表
姓名
科室
职称
职务
研究中分工
附表2:受试者入选完成情况一览表
受试者
筛选号
姓名
缩写
知情日期
筛选失败
原因
入组日期
是否服药
是否随机
完成试验
未完成试验者
备注
是/否
药物编号
是/否
随机日期
随机号
完成日期
退出原因
退出日期
附表3:紧急揭盲受试者详细情况
重要不良事件:□无□有
如有,提供发生严重和重要不良事件受试者情况及与试验药物的关系判断,见附表。
临床研究监查情况
委派临床试验监查员单位:□申请人□CRO
监查次数:次监查质量评价:
主要研究者的评论
本中心主要研究者对本项临床试验的质量控制和试验情况作出评论,并对试验结果的真实性作出声明。
本中心主要研究者签名:日期:
受试者编号
药物编号
揭盲日期
揭盲原因
备注
附表4:SAE发生及报告表(本中心)
受试者编号
SAE名称
与试验药物关系
临床试验分中心小结表盖章申请审批表
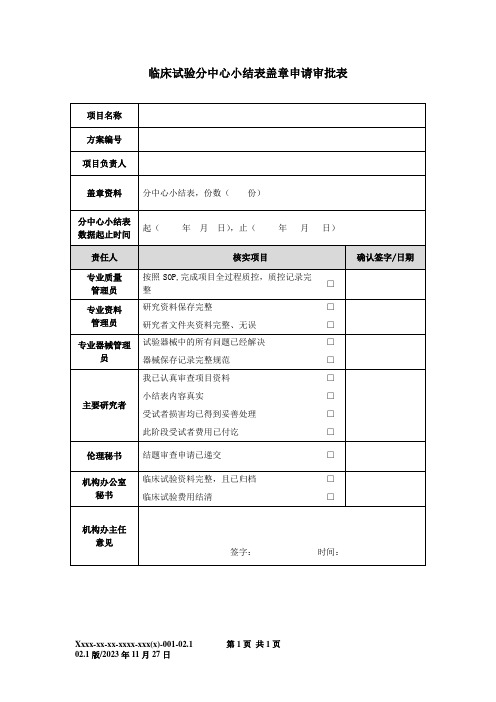
项目名称
方案编号
项目负责人
盖章资料
分中心小结表,份数( 份)
分中心小结表
数据起止时间
起( 年 月 日),止( 年 月 日)
责任人
核实项目
确认签字/日期
专业质控记录完整
□
专业资料
管理员
研究资料保存完整
□
研究者文件夹资料完整、无误
□
专业器械管理员
试验器械中的所有问题已经解决
□
器械保存记录完整规范
□
主要研究者
我已认真审查项目资料
□
小结表内容真实
□
受试者损害均已得到妥善处理
□
此阶段受试者费用已付讫
□
伦理秘书
结题审查申请已递交
□
机构办公室
秘书
临床试验资料完整,且已归档
□
临床试验费用结清
□
机构办主任
意见
签字: 时间:
多中心临床试验的分中心小结表
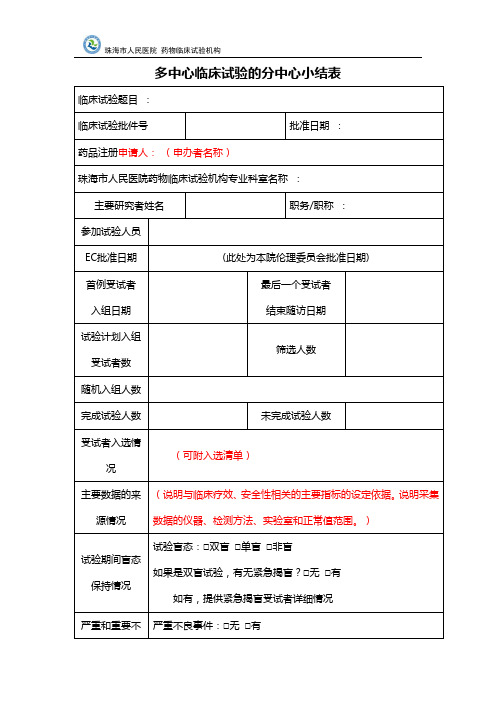
严重不良事件:□无□有
重要不良事件:□无□有
临床试验监查情况
委派临床试验监查员单位:□申请人□CRO
监查次数:监查质量评价:
主要研究者的评论
本中心主要研究者对本项临床试验的质量控制和试验情况作出评论,并对试验结果的真实性作出心临床试验机构办公室意见
盖章:日期:
多中心临床试验的分中心小结表
临床试验题目:
临床试验批件号
批准日期:
药品注册申请人:(申办者名称)
珠海市人民医院药物临床试验机构专业科室名称:
主要研究者姓名
职务/职称:
参加试验人员
EC批准日期
(此处为本院伦理委员会批准日期)
首例受试者
入组日期
最后一个受试者
结束随访日期
试验计划入组受试者数
筛选人数
随机入组人数
完成试验人数
未完成试验人数
受试者入选情况
(可附入选清单)
主要数据的来源情况
(说明与临床疗效、安全性相关的主要指标的设定依据。说明采集数据的仪器、检测方法、实验室和正常值范围。)
试验期间盲态保持情况
试验盲态:□双盲□单盲□非盲
如果是双盲试验,有无紧急揭盲?□无□有
如有,提供紧急揭盲受试者详细情况
严重和重要不良事件发生情况
临床试验项目总结报告分中心小结表盖章申请表

临床试验项目总结报告/分中心小结表盖章申请表
申请人上交申请表及总结报告后7个工作日联系机构办公室取回,联系人孟老师
27557209
松开的记忆,飘落的莫名的尘埃,像起伏的微风,拂过脑海,留下一份情愁。
一条街,没有那些人,那些身影,却能来回徘徊穿梭。
街,行走时,纵然漫长,漫长,有时只为听一颗流动的心的呓语。
沉默,倔强,回望,忘记,记住,一切像断了的弦,有时希望生活简单就好,有时却又莫名的颓废其中。
有些路,只能一个人走;有些事,只能一个人去经历。
粗读加缪、萨特的存在主义,它告诉我,人就是非理性的存在。
光秃秃的枝桠、清寂的清晨、流动的阳光,飘落于心,或快意,或寂寥,映照心境,然而,有时却只属于那一刻。
总之,一切只是心情。
人生的画面一幅幅地剪辑,最后拼凑出的是一张五彩斑斓的水彩画,有艳丽的火红色,凝重的墨黑以及一抹忧郁的天蓝色。
人的记忆很奇特,那些曾经的过往,就像一幅幅的背景图,只有一个瞬间,却没有以前或以后。
比如,只能记得某个瞬间的微笑,只能在记忆的痕迹寻觅某时刻骑着单车穿过路口拐角的瞬间,却都不知晓为何微笑,为何穿过街角。
一切,有时荒诞得像一场莫名情景剧。
然而,这就是生活。
曾经的梦,曾经的痛,曾经的歌,曾经的热情相拥,曾经的璀璨星空。
临床试验项目分中心小结总结报告盖章信息确认表

临床试验项目分中心小结/总结报告盖章信息确认表
试验项目名称:
申办者/CRO:
主要研究者:
试验用药品/医疗器械/体外诊断试剂已返还至申办者,相关文件记录已与项目组交接。
是☐否☐不适用☐
试验用药品/医疗器械/体外诊断试剂管理员签字/日期:
质控检查通过。
是☐否☐不适用☐机构质控员签字/日期:
本人承诺对本项临床试验数据的真实性、完整性负责并已仔细核对分中心小结/总结报告,确认内容准确无误。
主要研究者签字/日期:
分中心小结初审通过。
是☐否☐不适用☐机构质控员签字/日期:
分中心小结复核通过。
是☐否☐不适用☐机构办公室秘书签字/日期:
已完成费用结算,支付尾款。
是☐否☐不适用☐主要研究者签字/日期:
是☐否☐不适用☐机构办公室秘书签字/日期:
资料合格,已归档。
是☐否☐不适用☐档案管理员签字/日期:
同意分中心小结盖章。
是☐否☐不适用☐机构办公室主任签字/日期:
是☐否☐不适用☐机构副主任签字/日期:
临床试验总结报告审核通过。
是☐否☐不适用☐机构办公室主任签字/日期:
是☐否☐不适用☐机构副主任签字/日期:
同意临床试验总结报告盖。
是☐否☐不适用☐机构主任签字/日期:
注:选项选择请打“×”。
医疗器械临床试验项目总结报告盖章申请表
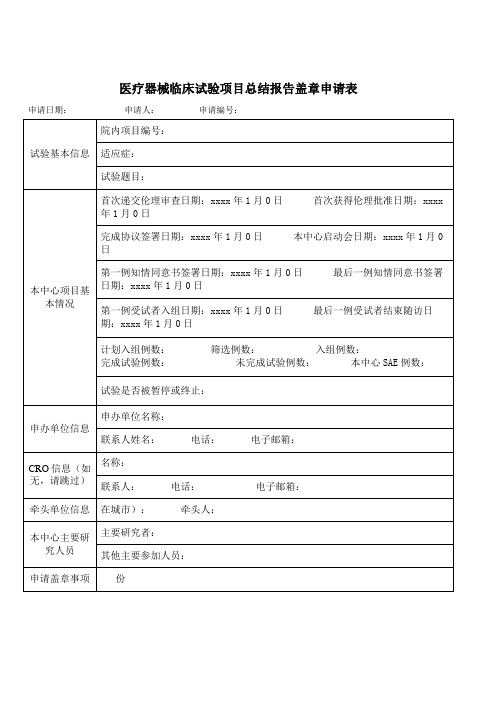
计划入组例数: 筛选例数: 入组例数: 完成试验例数: 未完成试验例数: 本中心E例数:
试验是否被暂停或终止:
申办单位信息
申办单位名称:
联系人姓名: 电话: 电子邮箱:
CRO信息(如无,请跳过)
名称:
联系人: 电话: 电子邮箱:
医疗器械临床试验项目总结报告盖章申请表
申请日期:申请人: 申请编号:
试验基本信息
院内项目编号:
适应症:
试验题目:
本中心项目基本情况
首次递交伦理审查日期:xxxx年1月0日 首次获得伦理批准日期:xxxx年1月0日
完成协议签署日期:xxxx年1月0日 本中心启动会日期:xxxx年1月0日
第一例知情同意书签署日期:xxxx年1月0日 最后一例知情同意书签署日期:xxxx年1月0日
牵头单位信息
在城市): 牵头人:
本中心主要研究人员
主要研究者:
其他主要参加人员:
申请盖章事项
份
申请人意见
(简述本临床试验的实施是否遵守了临床试验方案、GCP、赫尔辛基宣言,以及数据是否真实可靠、结论是否客观、科学。)
签名 日期 年 月 日
专业主任意见
签名 日期 年 月 日
机构办公室意见
签名 日期 年 月 日
机构主任意见
签名 日期 年 月 日
医院临床试验结题小结盖章申请表

关中心函已完成
是口否口不适用口
资料归档
提交资料是否齐全
是口否□不适用口
机构档案管理员签名签日期:
盖章(以上满足要求才能在小结表和总结报告上盖章并径记)
机构办主任签字盖章:
编号:RY3.0
临床试验结题(小结表盖章)申请表
信息
试验项目名称:
研究药物/医疗器械/体外诊断试剂名称
申办方/CRO:
专业:
主要研究者
临床试验批件号
本中心伦理委员会批件
号
研究时间
年月——年月
试脸计划入组受试者数
筛选人数
入组人数
完成试验人数
SAE发生
有口无口
发生SAE的药物编号/受试者编号
本中心药研经费编号(经费核查用)
统计报告中本中心有效病例数、无效病例数是否一致
是口否□不适用口
是否审签全部试脸资料并对所有文件进行自查
是口否口不适用口
1ห้องสมุดไป่ตู้
机构质控
试验过程中机构是否进行质量控制检查
是□否□不适用□
机构质量管理员签名签日期:
机构是否进行试验结束质控检查并合乎要求
是□否口不适用口
经费、关中心函
试脸经费是否全部支付
是口否口不适用口
试验过程中机构是否进行质量控制检查
是□否□不适用□
专业科室质控员签名签日期:
主要研究者
统计报告中本中心完成病例数是否一致(包括筛选、入组、脱落、剔除病例)
是□否□不适用口
主要研究者签名签日期:
统计报告中本中心不良事件的发生率是否一致
是□否□不适用口
统计报告中本中心不良事件的描述是否一致
是口否□不适用口
分中心小结表临床试验报告签审意见表
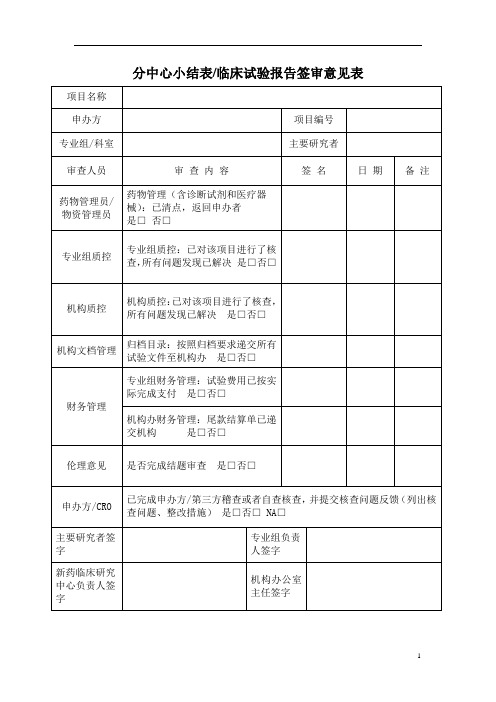
专业组负责人签字
新药临床研究中心负责人签字
机构办公室主任签字
机构文档管理
归档目录:按照归档要求递交所有试验文件至机构办是□否□
财务管理
专业组财务管理:试验费用已按实际完成支付是□否□
机构办财务管理:尾款结算单已递交机构是□否□
伦理意见
是否完成结题审查是□否□
申办方/CRO
已完成申办方/第三方稽查或者自查核查,并提交核查问题反馈(列出核查问题、整改措施)是□否□ NA□
分中心小结表专业组/科室
主要研究者
审查人员
审 查内 容
签 名
日 期
备 注
药物管理员/物资管理员
药物管理(含诊断试剂和医疗器械):已清点,返回申办者
是□否□
专业组质控
专业组质控:已对该项目进行了核查,所有问题发现已解决是□否□
机构质控
机构质控:已对该项目进行了核查,所有问题发现已解决是□否□
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
责任人(签字)
年月日
机构办公室主任(签字)
年月日
盖章人(签字)
年月日
申请人上交申请表及总结报告后7个工作日联系机构办公室取回,联系人孟老师275572xx
责任人情同意书、研究病历及CRF是否记录完整,且数据可溯?□是□否
试验筛选、入组等是否执行试验方案?□是□否
质控发现问题是否及时解决并反馈?□是□否
责任人(签字)
年月日
机构财务管理员意见:
试验经费到账情况是否与试验协议一致?□是□否
责任人(签字)
年月日
机构资料管理员意见:
临床试验项目总结报告/分中心小结表盖章申请表
临床试验项目名称
申办方/CRO
经办人/TEL:
专业科室
主要研究者
主要研究者意见:
报告中筛选、入组、脱落、剔除及完成例数等数据是否与实际发生一致?□是□否
报告中SAE、方案偏离/违背情况是否与实际发生一致?□是□否
其他需要说明情况:_____________________________________________________________
责任人(签字)
年月日
伦理委员会意见:
中期报告、年度报告及总结报告是否上报伦理委员会且完整?□是□否
报告中SAE、方案偏离/违背情况是否与上报伦理委员会情况一致?□是□否
跟踪审查问题说明(如适用):_____________________________________________________
