医疗器械公司流程图-精选.pdf
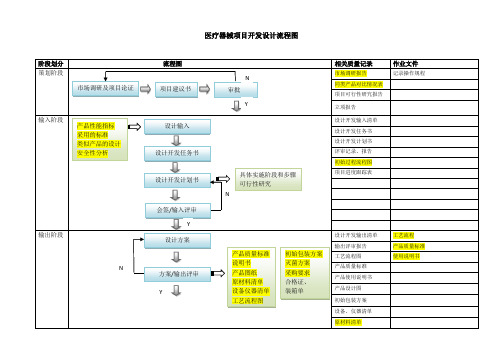
医疗器械项目开发设计流程图详图
wjkz
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
页脚内容7
wjkz 页脚内容8
Y
试产方案、 验证管理规定
报告
自更测改报、告 完善
采购与供方评 估管理制度
N 型式检验 生产岗位标准
报告
操作规程
验证记录、 设备/仪器 SOP
报告
原材料质量标 批生产记
准和检验操 录
作规程
批 检 验 记 成品/半成品检
录
验规程
页脚内容5
定型 阶段
wjkz
批号和有效期 留样记录
管理制度
进货验证 物料和产品编 记录、报告 号管理制度
wjkz
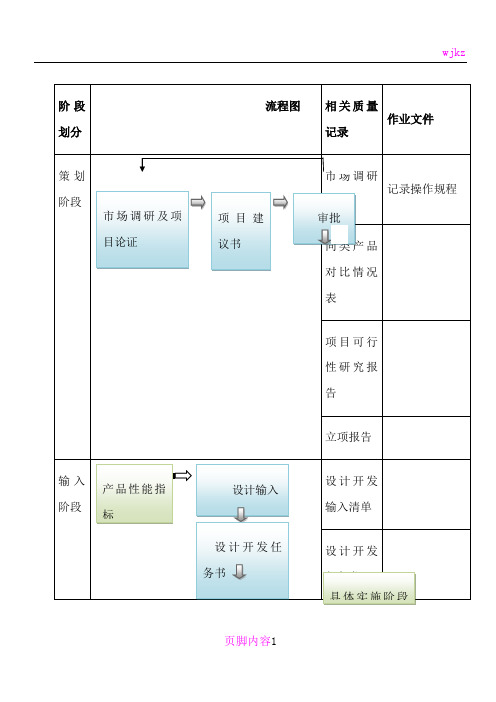
阶段 划分
流程图
相关质量 作业文件
记录
策划
阶段 市场调研及项
目论证
项目建 议书
市N场 调 研 记录操作规程 报告 审批
同Y类 产 品 对比情况
表
项目可行 性研究报 告
立项报告
输入 阶段
产品性能指 标
采用的标准
类似产品的 设计
安全性分析
设计输入 设计开发任 务书
页脚内容1
设计开发 输入清单
设计开发 任务书 具体实施阶段 和步骤
图
产品质量 标准
产品使用 说明书
产品设计 图
初始包装 方案
设备、仪器 清单
原材料清
页脚内容3
小试 阶段
加速老化 测试 包装运输 测试 内毒素测 定 重要性能 测试
wjkz 单
小样研制
性能检测 小试评审
实验原始
安全防护规定
记录
原辅料准
灭菌记录
备 实验室管理制 工度艺优化
医疗器械项目开发设计流程图详图

医疗器械项目开发设计流程图
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入 设计开发任务书
设计开发计划书 会签/输入评审
Y
N 审批
Y
具体实施阶段和步骤 可行性研究 N
页脚内容
相关质量记录
作业文件
小样研制 性能检测
设计开发输出清单
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图
初始包装方案 灭菌方案 采购要求 合格证、 装箱单
输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案
设备、仪器清单
原材料清单
实验原始记录
更改、完善
原辅料准备 工艺优化 包装确定
市场调研报告
记录操作规程
同类产品对比情况表
项目可行性研究报告
立项报告
设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
新法规下的医疗器械研发流程/管理体系
输出阶段 N
小试阶段 加速老化测试 包装运输测试 内毒素测定 重要性能测试
设计方案 方案/输出评审 Y
小试评审 N
Y
ቤተ መጻሕፍቲ ባይዱ小试验证:试生产
更改、完善 设计验证:型式检验
N Y
定型阶段
设计确认:临床试验 N
确定临床医院 入组病人选择 实验过程跟踪 页结脚果内容统 计
采购合同 供应商评估
不合格品管理规程 不合格品销毁管理规定
试产方案、报告
验证管理规定
自测报告
医疗器械项目开发设计流程图详图

试产方案、报告 自测报告 型式检验报告 验证记录、报告 批生产记录 批检验记录 留样记录 进货验证记录、报告
验证管理规定 采购与供方评估管理制度 生产岗位标准操作规程 设备/仪器 SOP 原材料质量标准和检验操作规程 成品/半成品检验规程 批号和有效期管理制度 物料和产品编号管理制度
车间温、湿度监测记录 生产人员、产品清洁度的管理办法
医疗器械项目开发设计流程图
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入 设计开发任务书 设计开发计划书
输出阶段
会签/输入评审 Y
设计方案
N 方案/输出评审 Y
N 审批
Y
具体实施阶段和步骤 可行性研究 N
相关质量记录
市场调研报告 同类产品对比情况表 项目可行性研究报告
确认记录、报告 评审记录、报告 临床试验方案 临床试验合同 临床试验报告
产品技术报告
风险分析报告
技术文件定稿
会签批准 产品注册
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
产品说明书 临床试验报告
立项报告
设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
作业文件
记录操作规程
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图
初始包装方案 灭菌方案 采购要求 合格证、 装箱单
设计开发输出清单 输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案 设备、仪器清单 原材料清单
工艺流程 产品质量标准 使用说明书
医疗器械项目开发设计流程图详图

Y
设计确认:临床 试验
总结评ห้องสมุดไป่ตู้ Y
技术文件定稿
会签批准
试产方案、报 验证管理规定
告
自测报告
采购与供方评估管理 制度
生产岗位标准操作规
型式检更验改报告、完程 验证善记录、报
设备/仪器 SOP 告
批生产记录
N
批检验记录
原材料质量标准和检 验操作规程
成品/半成品检验规 程
留样记录
批号和有效期管理制 度
进 货 验 证 记 物料和产品编号管理
阶段 图
划分
策划
阶段
市场调研及项目 论证
输入 阶段
产品性能指标 采用的标准 类似产品的设 计 安全性分析
流程 相关质 作业文件 量记录
项目建议 书
设计输入 设计开发任务 书
设计开发计划 书
会签/输入评审 Y
市场调研报告
N
同类产品对比 情况表
项审目可批行性研 究报告 Y
立项报告
记录操作规程
设计开发输入
采购要求
Y
原材料清单
产品设计图
合格证、
设备仪器清 装箱单
初始单包装方案
设备工、艺仪器流清程图
单
原材料清单
小样研制
实验原始记录 灭菌记录
安全防原护规辅定料准备 实验室工管理艺制优度化
包装确定
阶段
加速老化测 试 包装运输测 试 内毒素测定 重要性能测 试
性能检测 小试评审
Y
实验室生物安全规章 性能测试报告
制度
评审记录、报 实验室样品管理制度
告 更改、完 设计善更改申请 配液等实验标准操作
表
规程
采购合同
(完整版)医疗器械项目开发设计流程图详图
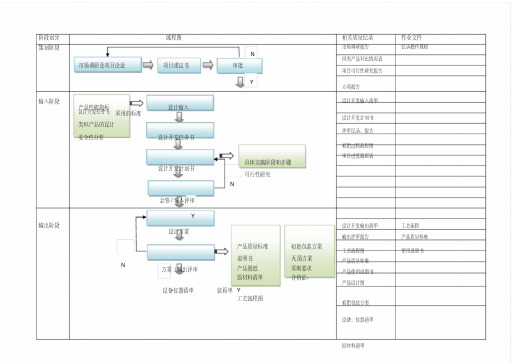
阶段划分流程图相关质量记录作业文件策划阶段市场调研报告记录操作规程
N
同类产品对比情况表市场调研及项目论证项目建议书审批
项目可行性研究报告
Y
立项报告
输入阶段设计开发输入清单产品性能指标设计输入
设计开发任务书采用的标准
设计开发计划书类似产品的设计
评审记录、报告安全性分析设计开发任务书
初始过程流程图
项目进度跟踪表
具体实施阶段和步骤
设计开发计划书
可行性研究
N
会签/ 输入评审
Y
输出阶段设计开发输出清单工艺流程
设计方案
输出评审报告产品质量标准
产品质量标准初始包装方案
工艺流程图使用说明书
N
方案/输出评审说明书
产品图纸
原材料清单
灭菌方案
采购要求
合格证、
产品质量标准
产品使用说明书
产品设计图
设备仪器清单装箱单Y
工艺流程图
初始包装方案
设备、仪器清单
原材料清单。
医疗器械项目开发设计流程图详图

加速老化测试 包装运输测试 内毒素测定 重要性能测试
中试阶段
软件:试产方案 岗位操作规程 包装、灭菌工艺 硬件:人员 原辅料 生产、检验设备
定型阶段 N
注册资料 准备阶段
小样研制 性能检测
更改、完善
原辅料准备 工艺优化 包装确定
小试评审 N
Y
小试验证:试生产
设计验证:型式检验 Y
更改、完善 N
立项报告
设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图 工艺卡片
初始包装方案 灭菌方案 采购要求
设计开发输出清单 输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案 设备、仪器清单 原材料清单 实验原始记录
会签批准 产品注册
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入 设计开发任务书 设计开发计划书
输出阶段
会签/输入评审 Y
设计方案
N 方案/输出评审 Y源自小试阶段N 审批Y
具体实施阶段和步骤 可行性研究 N
相关文件
市场调研报告 同类产品对比情况表 项目可行性研究报告
设计确认:临床试验
总结评审 Y
技术文件定稿
确定临床医院 入组病人选择 实验过程跟踪 结果统计
性能测试报告 评审记录、报告 设计更改申请表 采购合同 供应商评估
试产方案、报告 自测报告 型式检验报告 验证记录、报告 批生产记录 批检验记录 留样记录 进货验证记录、报告 车间温、湿度监测记录 确认记录、报告 评审记录、报告 临床试验方案 临床试验合同 临床试验报告 产品技术报告 风险分析报告 产品说明书 临床试验报告
医疗器械招标流程图
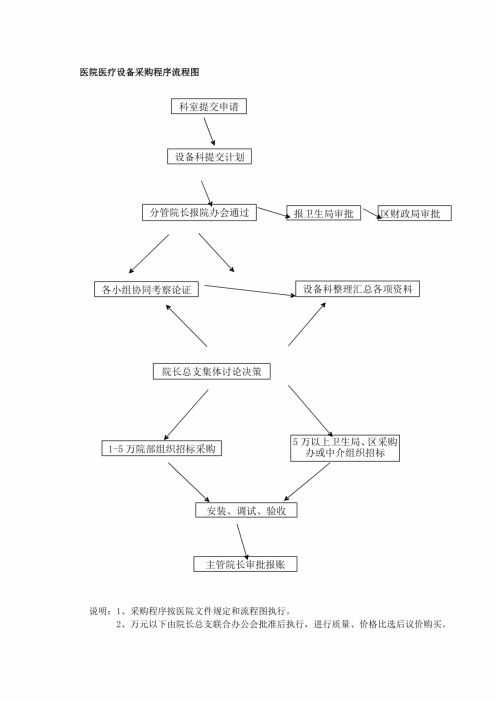
说明:1、采购程序按医院文件规定和流程图执行。 2、万元以下由院长总支联合办公会批准后执行,进行质量、价格比选后议价购买。
- 3、万元以上经论证后报卫生局批准:1 5 万元由院领导、纪检监督、专家小组、使用科
室、职工代表、共同参与招标采购,招标结果在院公告栏公告七天后,无异义方可签定合同。 4、5 万以上报区卫生局区财政局审批后,由区卫生局、区招标采购中心、或委托有资质
的招标采购中介公司招标采购,招标网上公告结果。 5、考祭论证要素:设备资质、在用设备使用情况、售后服务、公司信用度、价格性能比。
医院医疗设备采购程序流程图 过 报 卫 生 局 审 批 区 财 政 局 审 批
—— I ^ 各小组协同考察论证|
J i| ~ 设备科整理汇总各项资
院长总支集体讨论决策
-1 5 万院部组织招标采购
5 万以上卫生局、区采购 办或中介组织招标
安装、调试、验收
医疗器械项目开发设计流程图详图
设计开发输出清单 输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案 设备、仪器清单 原材料清单 实验原始记录 灭菌记录 性能测试报告
工艺流程 产品质量标准 使用说明书
安全防护规定 实验室管理制度 实验室生物安全规章制度
N Y
中试阶段
软件:试产方案 岗位操作规程 包装、灭菌工艺 硬件:人员 原辅料 生产、检验设备
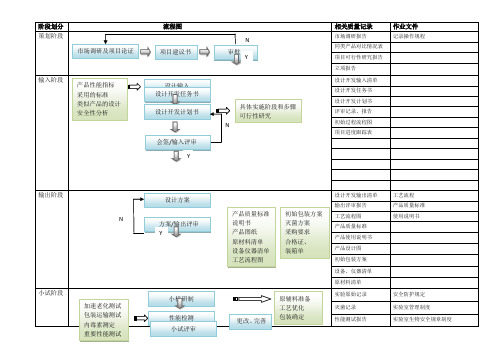
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入 设计开发任务书
设计开发计划书
会签/输入评审 Y
N 审批
Y
具体实施阶段和步骤 可行性研究 N
相关质量记录
市场调研报告 同类产品对比情况表 项目可行性研究报告 立项报告 设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
作业文件
记录操作规程
输出阶段 N
小试阶段
加速老化测试 包装运输测试 内毒素测定 重要性能测试
设计方案 方案/输出评审 Y
小样研制 性能检测 小试评审
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图
初始包装方案 灭菌方案 采购要求 合格证、 装箱单
更改、完善
原辅料准备 工艺优化 包装确定
确认记录、报告 评审记录、报告 临床试验方案 临床试验合同 临床试验报告
产品技术报告
风险分析报告
产品说明书
临床试验报告
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
试产方案、报告 自测报告 型式检验报告 验证记录、报告 批生产记录 批检验记录 留样记录 进货验证记录、报告
医疗器械项目开发设计流程图详图
工艺流程 产品质量标准 使用说明书
小试阶段
加速老化测试 包装运输测试 内毒素测定 重要性能测试
中试阶段
软件:试产方案 岗位操作规程 包装、灭菌工艺 硬件:人员 原辅料 生产、检验设备
定型阶段 N
注册资料 准备阶段
小样研制 性能检测
更改、完善
原辅料准备 工艺优化 包装确定
小试评审 N
Y
小试验证:试生产
确认记录、报告 评审记录、报告 临床试验方案 临床试验合同 临床试验报告
产品技术报告
风险分析报告
技术文件定稿
会签批准 产品注册
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
产品说明书 临床试验报告
医疗器械项目开发设计流程图
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入 设计开发任务书 设计开发计划书
输出阶段
会签/输入评审 Y
设计方案
N 方案/输出评审 Y
பைடு நூலகம்
N 审批
Y
具体实施阶段和步骤 可行性研究 N
相关质量记录
市场调研报告 同类产品对比情况表 项目可行性研究报告
立项报告
设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
作业文件
记录操作规程
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图
初始包装方案 灭菌方案 采购要求 合格证、 装箱单
设计开发输出清单 输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案 设备、仪器清单 原材料清单
医疗器械注册流程图

分类一类二类三类医疗器材注册存案注册流程周期递交部门1、编写存案资料;编写资料需2-3 个月设区的市级食品药品监2、提交资料,合格即当督管理部门场存案,不合格更正后边再存案;3、网站上予以宣布。
(不需办理生产允许,生产存案即可)1、编写产品注册资料;8-18 个月省、自治区、直辖市食2、递交资料(临床需具品监察管理部门体剖析);3、技术审评;4、质量系统核查;5、监督管理总局作出决定;6、下发注册证1、编写产品注册资料;8-18 个月国家食品药品监察管理2、递交资料(临床需具总局体剖析);3、技术审评;4、质量系统核查;5、监察管理总局作出决定;6、下发医疗器材注册证一类医疗器材存案流程编写存案资料资料提交给设区的市级食品药品监察管理部门受理颁发医疗器材存案凭(2-3 个月)证网站予以宣布递交存案复印件和生产资料设区的市级食品药品监督管理部门受理颁发生产存案凭据二类医疗器材产品注册、生产允许流程编写申报资料递交给资料省、自治区、直辖市食品药品监察管理部门受理(3 个工作日)(30 个工作日)技术审评机构进质量系统审查( 60 个工作日)行技术审评(163 个工作日)(20个工作日内决定)(10 个工作日)颁发医疗器材注册证递交医疗器材生产资料由省级、自治区、直辖市食品( 30 个工作日)药品监察管理部门进行审查(10 个工作日)颁发《医疗器材生产允许》三类医疗器材注册、生产允许流程编写三类医疗器材注册申报资料递交给国家食品药品监察管理总局受理(3 个工作日)(30 个工作日)技术审评机构进质量系统审查( 90 个工作日)行技术审评(193 个工作日)(20个工作日内决定)(10 个工作日)颁发医疗器材注册证递交医疗器材生产资料由国家食品药品监察管理总( 30 个工作日)局进行审查(10 个工作日)颁发《医疗器材生产允许》。
治疗仪工艺流程图
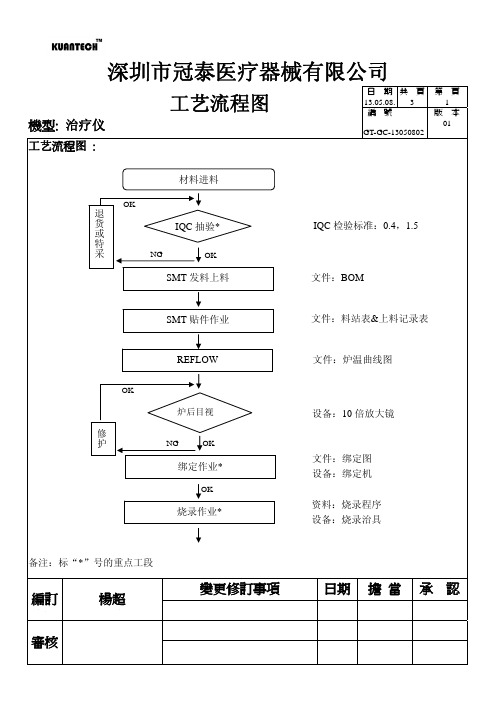
组装作业
文件:SOP
成品测试*
OK
文件:SIP 设备:功能测试治具
包装作业
文件:SOP
备注:标“*”号的重点工段
編訂 審核
楊超
符號
變更修訂事項日期擔来自當承認深圳市冠泰医疗器械有限公司
工艺流程图
機型: 治疗仪
工艺流程图 :
OK 日 期 共 頁 13.05.08 3 編 號 GT-GC-13050802 第 3 版 本 01 頁
文件:料站表&上料记录表
REFLOW
OK
文件:炉温曲线图
炉后目视
设备:10 倍放大镜
修 护
NG OK
绑定作业*
OK
文件:绑定图 设备:绑定机 资料:烧录程序 设备:烧录治具
烧录作业*
备注:标“*”号的重点工段
編訂 審核
楊超
變更修訂事項
日期
擔 當
承
認
深圳市冠泰医疗器械有限公司
工艺流程图
機型: 治疗仪
工艺流程图 :
OK 日 期 共 頁 13.05.08. 3 編 號 GT-GC-13050802 第 2 版 本 01 頁
PCBA 功能测试 修 护 OQC 抽验
NG OK NG OK
文件:SIP 设备:功能测试治具
文件:产品检验规范
PCBA 后焊作业 修 护
NG OK
文件:SOP
半成品测试*
OK
文件:SIP 设备:功能测试治具
深圳市冠泰医疗器械有限公司
工艺流程图
機型: 治疗仪
工艺流程图 :
材料进料 退 货 或 特 采
OK 日 期 共 頁 13.05.08. 3 編 號 GT-GC-13050802 第 1 版 本 01 頁
