化学竞赛夏令营分子结构演示课件
合集下载
安徽高中化学竞赛-结构化学 5 多原子分子的结构和性质(共152页PPT)
渡金属化合物(具有全充满、半充满或全
空的d轨道的化合物除外)
§5.2 杂化轨道理论
一、杂化概念的提出
1931 年 Pauling 和 Slater 提出杂化概念,为了解 释键角的变化。
50年代,唐敖庆提出构成杂化轨道的矩阵变换法
二、 杂化轨道
§杂化轨道理论
同一原子中能量相近的各个原子轨道线性组合 ,形成 (hybridization), 这种新的原子轨道叫杂化 ( 原子 ) 轨道 (hybrid atomic orbital)
1 2 + 6 + 3 5 4 1 2 + 6
1 2 +6 1 + + 3 5 2 + 6 4 3 + 5 4 1 + 4 6 5 2 3
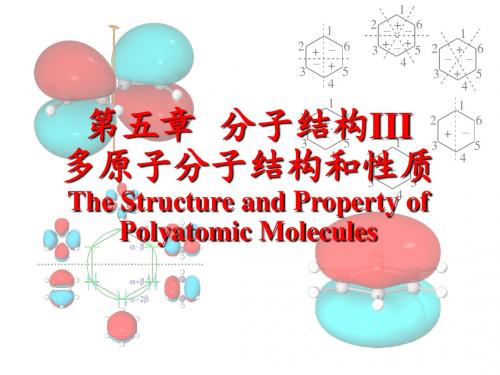
第五章 分子结构III 多原子分子结构和性质
3 4 5 1 2
The Structure and Property of Polyatomic Molecules
2.按照经典的共价单键、双键和三键结构式加以 处理,将双键、三键和单键均作为一个键区 计算原子间互斥作用;键区间排斥力大小顺 序为:
三键-三键 > 三键-双键 > 双键-双键 >双键-单键 > 单键-单键
例:如右图:b3lyp/aug-cc-pvdz A(2,1,3) A(2,1,4) A(3,1,4) 124.1˚ 124.1˚ 111.9˚
4
3
+
6
5
5.1 价层电子对互斥理论(VSEPR)
VSEPR : 1940 年英国化学家西奇威克( Sidgwick ) 和 鲍 威 尔 (Powell) 提 出 价 层 电 子 对 互 斥 理 论 (Valence Shell Electron Pair Repulsion)简称VSEPR
全国化学奥林匹克竞赛讲义第十五讲分子结构课件

价电子对互斥理论对极少数化合物判断 不准,如:CaF2、SrF2、BaF2,是弯曲型 而不是预期的直线型。
五、分子轨道理论
● O2有磁矩,为2.62×10-23 A·m2
● 存在H2+和He2+
物种
键长/pm
H
2
106
He
2
108
键能/kJ·mol-1 268 299
● NO等含奇数电子的分子结构
二、价键理论
1927 年 德 国 化 学 家 Heitler 和 London 首 先把量子力学应用到分子结构中,后来 Pauling等人又加以发展,建立了现代价键 理论,简称VB理论(又称电子配对理论)
2.1 共价键的本质
电子自旋
2.1 共价键的本质
原子相互接近时轨道重叠,原子间通过共用自旋相反 的电子对使能量降低而成键。
内容提要
➢ Lewis理论 ➢ 价键理论 ➢ 杂化轨道理论 ➢ 价层电子对互斥理论 ➢ 分子轨道理论 ➢分子间作用力和氢键
一、Lewis理论
➢ 分子中每个原子均应具有稳定的稀有气体原子
理 的外层电子构型;
论 要
➢ 分子中原子间通过共用一对或多对电子形成化
点 学键,这种化学键称为共价键,形成的分子为共
过键轴的一个平面呈镜面反对称性,轨道重叠程度相 对较小,稳定性较低,是化学反应的积极参与者。
2.3 共价键的类型
形成条件:成键原子一方有孤对电子, 配位键
另一方有空轨道。
例:NH
4
BF4
CO
H
F
HNH
H
FBF C O
F
2s2 2p2 2s2 2p4
2.4 价键法的缺陷
价键理论虽然解释了许多分子(特别 是双原子分子)的形成,但对于一些多原 子分子的空间结构和性能却难以说明。 如:CH4分子的正四面体构型,价键理论 就无法解释。
五、分子轨道理论
● O2有磁矩,为2.62×10-23 A·m2
● 存在H2+和He2+
物种
键长/pm
H
2
106
He
2
108
键能/kJ·mol-1 268 299
● NO等含奇数电子的分子结构
二、价键理论
1927 年 德 国 化 学 家 Heitler 和 London 首 先把量子力学应用到分子结构中,后来 Pauling等人又加以发展,建立了现代价键 理论,简称VB理论(又称电子配对理论)
2.1 共价键的本质
电子自旋
2.1 共价键的本质
原子相互接近时轨道重叠,原子间通过共用自旋相反 的电子对使能量降低而成键。
内容提要
➢ Lewis理论 ➢ 价键理论 ➢ 杂化轨道理论 ➢ 价层电子对互斥理论 ➢ 分子轨道理论 ➢分子间作用力和氢键
一、Lewis理论
➢ 分子中每个原子均应具有稳定的稀有气体原子
理 的外层电子构型;
论 要
➢ 分子中原子间通过共用一对或多对电子形成化
点 学键,这种化学键称为共价键,形成的分子为共
过键轴的一个平面呈镜面反对称性,轨道重叠程度相 对较小,稳定性较低,是化学反应的积极参与者。
2.3 共价键的类型
形成条件:成键原子一方有孤对电子, 配位键
另一方有空轨道。
例:NH
4
BF4
CO
H
F
HNH
H
FBF C O
F
2s2 2p2 2s2 2p4
2.4 价键法的缺陷
价键理论虽然解释了许多分子(特别 是双原子分子)的形成,但对于一些多原 子分子的空间结构和性能却难以说明。 如:CH4分子的正四面体构型,价键理论 就无法解释。
全国高中化学竞赛分子结构课件
U = H1 + H 2 + H 3 + H 4 - H 6
=
S + 1/2 D +
上页 下页 目录
I返1 回-
E
- f HmӨ
U = 108.8 + 119.7 + 496 - 348.7 + 410.9 = 786.7 ( kJ·mol-1 )
以上关系称为 Born - Haber 循环 。 利用盖斯定律,也可以计算 NaCl 的离子键的键能。
颜色 银灰色 黄绿色
无色
状态 固体 导电性 极强
气体
晶体
极弱 极弱,熔融导电
通电下 无变化 无变化 熔融下反应逆转
上页 下页 目录 返回
不同的外在性质反映了不同的内部结构
各自内部的结合力不同
Pauling L在《The Nature of The Chemical Bond》 中提出了用得最广泛的化学键定义:如果两个原子( 或原子团)之间的作用力强得足以形成足够稳定的、 可被化学家看作独立分子物种的聚集体,它们之间就 存在化学键。简单地说,化学键是指分子内部原子之 间的强相互作用力。
Cl- ( g )
H 6
NaCl ( s ) H 5
H 6 = f HmӨ = - 410.9 kJ·mol-1 , NaCl 的标准生成热。
由盖斯定律 所以 即
H 6 = H 1 + H2 + H 3 + H 4 + H 5
H 5 = H 6 - ( H1 + H 2 + H 3 + H 4 )
2.2 离子键理论 Ionic bond theory 2.3 共价键的概念与路易斯结构式 Concept of the
全国高中化学竞赛分子结构课件
55
2.0
63
2.2
70
2.4
76
也可用 Hannay & Smyth 公式 2.6
82
来计算键的离子性。
2.8
86
3.0
89
离子性=[16(△x)+3.5 (△x)2]×100% 3.2
92
上页 下页 目录 返回
2.2.2 晶格能 (lattice energy)
◆ 定义:1mol 的离子晶体解离为自由气态离子时所吸收的能量,以符号
● 波恩-哈勃循环 ● 玻恩-兰达公式
● 水合能循环法
f Hθ
SI 1D(E)(U) 2
Uf
Hθ
SI
1DE 2
上页 下页 目录 返回
2 玻恩 -哈伯循环 ( Born - Haber Circulation )
Born 和 Haber 设计了一个热力学循环过程,从已知的热力 学数据出发,计算晶格能。具体如下:
特征,会用价电子对互斥理论和杂化轨道理论解释 简单的分子结构; 5.初步认识分子轨道,掌握第二周期元素的分子轨道 特点; 6.理解金属键理论,特别是能带理论,会用能带理论 解释固体分类; 7.认识分子间作用力和氢键的本质,会解释其对物质 性质的影响。
上页 下页 目录 返回
2.1 化学键的定义 Definition of chemical bond
◆ 晶体类型相同时,晶格能与正、负离子数成正比,与它们之间的距离 r0成反比.
◆ 晶格能越大,正、负离子间结合力越强,相应晶体的熔点越高、硬度 越大、压缩系数和热膨胀系数越小。
上页 下页 目录 返回
4 硬度高 延展性差
因离子键强度大,所以硬度高 。 但受到外力冲击时,易发生位错,导致破碎 。
化学竞赛 分子结构课件

七、分子轨道理论(MO法) 1932年前后,美国人Mulliken和德国人Hund提出了分子轨道 理论,分子轨道理论和现代价键理论构成了现代共价键理论。 氢分子离子H2+ 是可以存在的。 1、分子轨道理论的要点 (1)分子轨道是由分子中原子的原子轨道线性组合而成,简 称 LCAO。 组合形成的分子轨道数与组合前的原子轨道数相等。
对称性不匹配
·· x _
_
+
+
· _·
+
+
它们重叠的结果是:一半正正重叠部分使系统能量降低, 另一半正负重叠部分使能量升高,两者效果抵消。系统 的总能量没有发生变化,形成非键轨道。
b. 能量近似原则 c. 最大重叠原则
-
+
-
+
-
+
-
ψ是两个对称性匹配的原子轨道同号叠加而成。在两核间电子 概率密度增大,对两核产生强烈的吸引作用,其能量低于原子 轨道,对成键有利。——成键轨道 成键轨道用符号σ,π,δ 表示 ψ* 是两个对称性匹配的原子轨道异号叠加 (或同号相减)而成。 电子在两核间出现概率密度减小,能量升高,对分子的稳定不 利,对原子的键合会起反作用——反键轨道 节面 反键轨道用符号σ*,π*,δ*表示 3、分子轨道中电子的填充顺序也遵从原子轨道填充电子的三 原理 4、分子轨道理论中,用键级的大小来说明两个相邻原子间成 键的强度,BO 键级可为整数,也可为分数,只要键级大于零,就可得到不同 稳定程度的分子。 5、按分子轨道沿键轴在空间分布的特征,可分为σ轨道、π轨 道和δ轨道三种
1 c1 a c2 b
* 1
c1 a c2 b
(2)成键轨道、反键轨道和非键轨道。 分子轨道能量低于组合前原子轨道能量者称为成键轨道(ψ1 ) 原子轨道线性组合成分子轨道后,分子轨道中能量高于组合前 原子轨道能量者称为反键轨 道 (ψ 1 * )。 组合前后能量相等者称为非键轨道。 2、有效组成分子轨道的条件 a.对称性匹配 只有对称性相同的原子轨道才能组成分子轨道。 此条件是指原子轨道ψa和ψb相对于成键原子间的键轴应有相 同的对称性。 原子轨道相互叠加组合成分子轨道时象波的叠加一样,须考虑 位相的正负号;原子轨道重叠的部分必须有相同的符号。 上述三种情况满足对称性匹配要求。 如果原子轨道在组成分子轨道时,一部分是(+,+ )重叠,另一部 分却是 ( +, -)重叠。
《分子结构》课件

氯化铁等。
生物分子
如蛋白质、核酸、糖类 等,具有复杂的空间结
构和功能。
02
共价分子结构
共价键的形成与类型
共价键的形成
原子间通过共享电子来形成共价 键,这些共享电子对构成了分子 中的共价键。
共价键的类型
根据电子云的偏移程度,共价键 可以分为非极性键、极性键和配 位键等类型。
分子轨道理论
分子轨道理论的基本概念
距离无关。
氢键
定义
氢键是一种特殊的分子间作用力,它是由一个氢原子与另一个原子的电负性较强的原子( 如氧、氮等)之间的相互作用。
形成条件
氢键的形成需要满足一定的条件,即氢原子与电负性较强的原子之间的距离要适中,一般 在200pm左右。同时,还需要考虑分子的几何构型和电子云的分布等因素。
特点
氢键是一种较强的分子间作用力,其作用力大小仅次于化学键。氢键的形成会影响分子的 性质,如熔点、沸点、溶解度等。在生物体系中,氢键的形成对于维持生物大分子的结构 和功能具有重要意义。
05
分子的振动与转动
分子的振动
分子振动是指分子中的原子或分子的运动,这种运动可以以不同的方式 进行,包括伸缩振动和弯曲振动等。
伸缩振动是指原子或分子的键长发生变化,导致分子整体形状发生变化 。弯曲振动则是指原子或分子的键角发生变化,导致分子整体形状发生
变化。
分子的振动频率和能量与分子内部的结构有关,因此通过研究分子的振 动可以了解分子的内部结构和性质。
共价分子的对称性和稳定性
分子的对称性和稳定性与其几何形状密切相关,某些形状的分子具有更高的稳定 性。
共价分子的极性
共价分子的极性定义
共价分子的极性是指分子中正负电荷中心不重合的现象,这 种现象会导致分子具有电偶极矩。
生物分子
如蛋白质、核酸、糖类 等,具有复杂的空间结
构和功能。
02
共价分子结构
共价键的形成与类型
共价键的形成
原子间通过共享电子来形成共价 键,这些共享电子对构成了分子 中的共价键。
共价键的类型
根据电子云的偏移程度,共价键 可以分为非极性键、极性键和配 位键等类型。
分子轨道理论
分子轨道理论的基本概念
距离无关。
氢键
定义
氢键是一种特殊的分子间作用力,它是由一个氢原子与另一个原子的电负性较强的原子( 如氧、氮等)之间的相互作用。
形成条件
氢键的形成需要满足一定的条件,即氢原子与电负性较强的原子之间的距离要适中,一般 在200pm左右。同时,还需要考虑分子的几何构型和电子云的分布等因素。
特点
氢键是一种较强的分子间作用力,其作用力大小仅次于化学键。氢键的形成会影响分子的 性质,如熔点、沸点、溶解度等。在生物体系中,氢键的形成对于维持生物大分子的结构 和功能具有重要意义。
05
分子的振动与转动
分子的振动
分子振动是指分子中的原子或分子的运动,这种运动可以以不同的方式 进行,包括伸缩振动和弯曲振动等。
伸缩振动是指原子或分子的键长发生变化,导致分子整体形状发生变化 。弯曲振动则是指原子或分子的键角发生变化,导致分子整体形状发生
变化。
分子的振动频率和能量与分子内部的结构有关,因此通过研究分子的振 动可以了解分子的内部结构和性质。
共价分子的对称性和稳定性
分子的对称性和稳定性与其几何形状密切相关,某些形状的分子具有更高的稳定 性。
共价分子的极性
共价分子的极性定义
共价分子的极性是指分子中正负电荷中心不重合的现象,这 种现象会导致分子具有电偶极矩。
其它-第2讲分子结构ppt

π键的键能较小,键的活泼性较大。 3)所有共价单键均为σ键,共价双键中有一个σ键和一
个π键。 4)普通σ键和π键为 定域键, 多个原子间构成的大π键 为离域键。
Π4
极性单质
3
二、分子轨道理论
1、物质的磁性 顺磁性物质在磁场中被磁场所吸引。 抗磁性物质在磁场Fra bibliotek被磁场所排斥。
磁矩:描述物质的顺磁性强弱 。 nn 2
1s22s22p42d1 1s22s22p42d63s23p43d63f7
• (5)写出前112号元素电负性最大和最小的元素的原子序数;
13
101
• (6)写出第二周期中可能的杂化轨道。
sp、sp2、sp2d、sp2d2、sp2d3、 pd、pd2、pd3、p2d、p2d2、p2d3
• (7)在这个星球中的有机化学是最可能以哪一种元素为基础的? 写出原子序数。
• (7)在这个星球中的有机化学是最可能以哪一种元素为基础的? 写出原子序数。
• (8)在这个星球中,有哪些规则和地球上所用的8电子和18电子 规则相当?
• 作业讲评:在我们地球的物质世界里的周期系是根据4个量子数建 立的,即 n=1,2,3,……; l=0,1,…,(n-1); m=0,±1,±2…,±l;ms=±1/2。如果在另一个星球,那里 的周期系也是由4个量子数建立的,但它们的关系为: n=1,2, 3…; l=0,±1,±2,…,±(n-1); m=0,1,2,…,l-1; ms=±1/2。如果在地球上的基本原理在这个星球上也是适用的 (但不发生能级交错现象),回答下列问题:
我爱奥赛网第三届 化学奥赛网络夏令营
主 讲 杨 德 生
• 作业讲评:在我们地球的物质世界里的周期系是根据4个量子数建 立的,即 n=1,2,3,……; l=0,1,…,(n-1);
个π键。 4)普通σ键和π键为 定域键, 多个原子间构成的大π键 为离域键。
Π4
极性单质
3
二、分子轨道理论
1、物质的磁性 顺磁性物质在磁场中被磁场所吸引。 抗磁性物质在磁场Fra bibliotek被磁场所排斥。
磁矩:描述物质的顺磁性强弱 。 nn 2
1s22s22p42d1 1s22s22p42d63s23p43d63f7
• (5)写出前112号元素电负性最大和最小的元素的原子序数;
13
101
• (6)写出第二周期中可能的杂化轨道。
sp、sp2、sp2d、sp2d2、sp2d3、 pd、pd2、pd3、p2d、p2d2、p2d3
• (7)在这个星球中的有机化学是最可能以哪一种元素为基础的? 写出原子序数。
• (7)在这个星球中的有机化学是最可能以哪一种元素为基础的? 写出原子序数。
• (8)在这个星球中,有哪些规则和地球上所用的8电子和18电子 规则相当?
• 作业讲评:在我们地球的物质世界里的周期系是根据4个量子数建 立的,即 n=1,2,3,……; l=0,1,…,(n-1); m=0,±1,±2…,±l;ms=±1/2。如果在另一个星球,那里 的周期系也是由4个量子数建立的,但它们的关系为: n=1,2, 3…; l=0,±1,±2,…,±(n-1); m=0,1,2,…,l-1; ms=±1/2。如果在地球上的基本原理在这个星球上也是适用的 (但不发生能级交错现象),回答下列问题:
我爱奥赛网第三届 化学奥赛网络夏令营
主 讲 杨 德 生
• 作业讲评:在我们地球的物质世界里的周期系是根据4个量子数建 立的,即 n=1,2,3,……; l=0,1,…,(n-1);
高中化学竞赛课件分子结构

5
9.2.1 共价键的形成和本质
1.共价键的形成 说两明个2个独H立的的、1s距轨离道很发远生的了H相重互叠接,近在形两成核H2间时,形有成两e-种概情率况密:
1)若两个H各带一个自旋相反的电子,当靠近到一定距离时
度(大74的pm区)域,。体系这的不能仅量减最弱低两。此核时的两斥核力间,电还子概增率强密了度核最间大电, 子对云2个对原两子个核核的的吸引引力力最,强使,体形系成稳E降定低的H,2分形子成。共价键。
5个杂化轨道与5个Cl原子含单电子的p轨道重叠成共 价键,所以 PCl5是三角双锥。
的吸引作用。
化学键种类:共价键、离子键、金属键。
共价键理论:
Lewis理论
(1916年)
价键理论
(1927年)
杂化轨道理论
(1931年)
价层电子对互斥理论 (1940年)
分子轨道理论
(20世纪20年代末)
3
§9.1 Lewis理论
理论要点: 原子间通过形成共用电子对,使每个原子
最外层达8e-稳定结构,即满足八隅体规则。
sp3杂化
4个不等性sp3杂化轨道
有2个杂化轨道含有孤对电子,对成键的2个电子对 的排斥作用更大,使O-H键之间的键角更小于109.5 °
25
H2O分子形成时的轨道杂化。
26
spd型杂化
• sp3d杂化
实测 PCl5 三角双锥
P: 3s23p3
3d
3p
3s
激发 3s
3p
3d
sp3d杂化
5个sp3d轨道
6
2) 两个H各带自旋相同的电子靠近时,排斥力占主要,两核间 电子概率密度减小,体系的能量升高,不能形成H2分子。
9.2.1 共价键的形成和本质
1.共价键的形成 说两明个2个独H立的的、1s距轨离道很发远生的了H相重互叠接,近在形两成核H2间时,形有成两e-种概情率况密:
1)若两个H各带一个自旋相反的电子,当靠近到一定距离时
度(大74的pm区)域,。体系这的不能仅量减最弱低两。此核时的两斥核力间,电还子概增率强密了度核最间大电, 子对云2个对原两子个核核的的吸引引力力最,强使,体形系成稳E降定低的H,2分形子成。共价键。
5个杂化轨道与5个Cl原子含单电子的p轨道重叠成共 价键,所以 PCl5是三角双锥。
的吸引作用。
化学键种类:共价键、离子键、金属键。
共价键理论:
Lewis理论
(1916年)
价键理论
(1927年)
杂化轨道理论
(1931年)
价层电子对互斥理论 (1940年)
分子轨道理论
(20世纪20年代末)
3
§9.1 Lewis理论
理论要点: 原子间通过形成共用电子对,使每个原子
最外层达8e-稳定结构,即满足八隅体规则。
sp3杂化
4个不等性sp3杂化轨道
有2个杂化轨道含有孤对电子,对成键的2个电子对 的排斥作用更大,使O-H键之间的键角更小于109.5 °
25
H2O分子形成时的轨道杂化。
26
spd型杂化
• sp3d杂化
实测 PCl5 三角双锥
P: 3s23p3
3d
3p
3s
激发 3s
3p
3d
sp3d杂化
5个sp3d轨道
6
2) 两个H各带自旋相同的电子靠近时,排斥力占主要,两核间 电子概率密度减小,体系的能量升高,不能形成H2分子。
高中化学竞赛辅导分子结构精品

高中化学竞赛培优 分子结构
一、路易斯结构式:
分子中还存在未用于形成共价键的非键合电子,又 称孤对电子。添加了孤对电子的结构式叫路易斯结 构式。如: H∶H 或 H—H ∶N≡N∶ ∶ O=C=O ∶ C2H2 (H—C≡C—H)
有些分子可以写出几个式子(都满足8电子结构), 如HOCN,可以写出如下三个式子:
2020/8/20
高中化学竞赛培优 分子结构
2、VB法基本要点
*自旋相反的未成对电子相互配对时,因其波函数符号相 同,此时系统的能量最低,可以形成稳定的共价键。
*若A﹑B两原子各有一未成对电子且自旋反平行,则互 相配对构成共价单键,如H—H单键。如果A、B两原 子各有两个或三个未成对电子,则在两个原子间可以 形成共价双键或共价三键。如N≡N分子以三键结合, 因为每个N原子有3个未成对的2p电子。
2020/8/20
高中化学竞赛培优 分子结构
2020/8/20
Lewis
1875年10月25日路易斯出生于 美国麻萨诸塞州的西牛顿市。 他从小聪明过人,在三岁时, 父母就开始在家里让他接受教 育 。 1893 年 进 入 著 名 的 哈 佛 大 学 学 习 , 1896 年 获 理 学 士 学位,以后在T.W.理查兹 指导下继续研究化学,于 1899 年 24 岁 时 获 哲 学 博 士 学 位。
*若原子A有能量合适的空轨道,原子B有孤电子对,原 子B的孤电子对所占据的原子轨道和原子A的空轨道能 有效地重叠,则原子B的孤电子对可以与原子A共享, 这样形成的共价键称为共价配键,以符号AB表示。
2020/8/20
高中化学竞赛培优 分子结构
1、共价键的形成
• A、B 两原子各有一个成单电子,当 A、 B 相互接近时,两电子以自旋相反的方式 结成电子对,即两个电子所在的原子轨道 能相互重叠,则体系能量降低,形成化学 键,亦即一对电子则形成一个共价键。
一、路易斯结构式:
分子中还存在未用于形成共价键的非键合电子,又 称孤对电子。添加了孤对电子的结构式叫路易斯结 构式。如: H∶H 或 H—H ∶N≡N∶ ∶ O=C=O ∶ C2H2 (H—C≡C—H)
有些分子可以写出几个式子(都满足8电子结构), 如HOCN,可以写出如下三个式子:
2020/8/20
高中化学竞赛培优 分子结构
2、VB法基本要点
*自旋相反的未成对电子相互配对时,因其波函数符号相 同,此时系统的能量最低,可以形成稳定的共价键。
*若A﹑B两原子各有一未成对电子且自旋反平行,则互 相配对构成共价单键,如H—H单键。如果A、B两原 子各有两个或三个未成对电子,则在两个原子间可以 形成共价双键或共价三键。如N≡N分子以三键结合, 因为每个N原子有3个未成对的2p电子。
2020/8/20
高中化学竞赛培优 分子结构
2020/8/20
Lewis
1875年10月25日路易斯出生于 美国麻萨诸塞州的西牛顿市。 他从小聪明过人,在三岁时, 父母就开始在家里让他接受教 育 。 1893 年 进 入 著 名 的 哈 佛 大 学 学 习 , 1896 年 获 理 学 士 学位,以后在T.W.理查兹 指导下继续研究化学,于 1899 年 24 岁 时 获 哲 学 博 士 学 位。
*若原子A有能量合适的空轨道,原子B有孤电子对,原 子B的孤电子对所占据的原子轨道和原子A的空轨道能 有效地重叠,则原子B的孤电子对可以与原子A共享, 这样形成的共价键称为共价配键,以符号AB表示。
2020/8/20
高中化学竞赛培优 分子结构
1、共价键的形成
• A、B 两原子各有一个成单电子,当 A、 B 相互接近时,两电子以自旋相反的方式 结成电子对,即两个电子所在的原子轨道 能相互重叠,则体系能量降低,形成化学 键,亦即一对电子则形成一个共价键。
全国高中化学竞赛分子结构课件
第2章
化学键与分子结构
Chapter 2
Chemical Bond and Molecular Structure
atomic orbital
molecular orbital
本章教学要求
1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3.掌握离子的特征,离子极化概念; 4.掌握价键理论的内容;会用价键理论解释共价键的
而 H 5 = - E i , 所以通过 I1 ,E ,U 和 S 可求出键能 Ei 。
上页 下页 目录 返回
碱金属卤化物的晶格能
卤化物
实验值 (热化学循环 )
Lattice energy
计算值 (波恩-兰达公式)
最佳值
LiF LiCl LiBr LiI NaF NaCl NaBr NaI KF KCl KBr KI
H 4 = -E = -348.7 kJ·mol-1 ,
Cl 的电子亲合能 E 的相反数;
H 5 = -U = ? ,
NaCl 的晶格能 U 的相反数;
上页 下页 目录 返回
Na ( s ) H 1
Na ( g )
+ 1/2 Cl2 ( g ) H 2
Cl ( g )
H 3
H 4
Na + ( g ) +
H = E i
NaCl ( g )
Na ( g ) + Cl ( g )
Na ( g ) + Cl ( g ) H5 = - E i NaCl ( g )
H1
H2
Na+ ( g ) + Cl-( g )
H3
上页 下页 目录 返回
H4 NaCl ( s )
化学键与分子结构
Chapter 2
Chemical Bond and Molecular Structure
atomic orbital
molecular orbital
本章教学要求
1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3.掌握离子的特征,离子极化概念; 4.掌握价键理论的内容;会用价键理论解释共价键的
而 H 5 = - E i , 所以通过 I1 ,E ,U 和 S 可求出键能 Ei 。
上页 下页 目录 返回
碱金属卤化物的晶格能
卤化物
实验值 (热化学循环 )
Lattice energy
计算值 (波恩-兰达公式)
最佳值
LiF LiCl LiBr LiI NaF NaCl NaBr NaI KF KCl KBr KI
H 4 = -E = -348.7 kJ·mol-1 ,
Cl 的电子亲合能 E 的相反数;
H 5 = -U = ? ,
NaCl 的晶格能 U 的相反数;
上页 下页 目录 返回
Na ( s ) H 1
Na ( g )
+ 1/2 Cl2 ( g ) H 2
Cl ( g )
H 3
H 4
Na + ( g ) +
H = E i
NaCl ( g )
Na ( g ) + Cl ( g )
Na ( g ) + Cl ( g ) H5 = - E i NaCl ( g )
H1
H2
Na+ ( g ) + Cl-( g )
H3
上页 下页 目录 返回
H4 NaCl ( s )
化学竞赛基础化学键与分子结构 PPT

U = -△rHm ø
晶格能 U 越大,则形成离子键得到离子晶体时放出的能
量越多,离子键越强。
晶格能测定:玻恩 -哈伯循环 ( Born - Haber Circulation )
Born 和 Haber 设计了一个热力学循环过程,从已 知的热力学数据出发,利用Hess定律计算晶格能。
以NaCl为例, Born-Haber循环
注意:
(1)只有能量相近的原子轨道才可进行杂化,杂化指 中心原子而言,配体一般不杂化(ABn); (2)杂化轨道数等于参加杂化的原子轨道数; (3)分子中有π键时,形成π键的原子轨道不发生杂化
例:为什么PCl5能够稳定存在,而NCl5不能存在?
答:P是第三周期元素,价电子构型是3s23p3,另 有空的3d轨道,在与氯化合时,P的1个3s电子激 发到3d 空轨道上,进而发生sp3d杂化形成5个 sp3d杂化轨道,并各填充1个电子。P原子利用5个 sp3d杂化轨道与5个Cl原子成键,形成稳定的三角 双锥形的PCl5分子。N是第二周期元素,价电子构 型是2s22p3,价电子层没有d轨道,只有3个单电 子,因此不能形成NCl5分子。
返回
1.3 离子特征
(1)离子的电荷 电荷高,离子键强
(2)离子的电子层构型
正离子的电子层构型大致有5种
1) 2电子构型
2) 8电子构型
3) 18电子构型 4)(18+2)电子构型
5) 9 — 17电子构型
在离子的半径和电荷大致相同条件下,不同构型的正离子对同种负 离子的结合力的大小规律: 8电子层构型的离子<9—17电子层构型的离子 <18或18+2电子层构型的离子
1/2D
I Na (g) + Cl (g)
全国高中化学竞赛分子结构课件

H = E i
NaCl ( g )
Na ( g ) + Cl ( g )
Na ( g ) + Cl ( g ) H5 = - E i NaCl ( g )
H1
H2
Na+ ( g ) + Cl-( g )
H3
上页 下页 目录 返回
H4 NaCl ( s )
H = E i
NaCl ( g )
NaCl
CsCl
这个例子能够说明一个离子周围的异电荷离子数与各自所带电荷 的多少(或者说由引而产生的作用力的强弱)无关.
上页 下页 目录 返回
离子键中键的极性
xA-xB 离子性百分率(%)
与 0.2
元素电负性的关系
0.4 0.6
01 04 09
0.8
15
1.0
22
1.2
30
1.4
39
1.6
47
1.8
● 波恩-哈勃循环 ● 玻恩-兰达公式
● 水合能循环法
f Hθ
SI 1D(E)(U) 2
Uf
Hθ
SI
1DE 2
上页 下页 目录 返回
2 玻恩 -哈伯循环 ( Born - Haber Circulation )
Born 和 Haber 设计了一个热力学循环过程,从已知的热力 学数据出发,计算晶格能。具体如下:
(单、双、 叁键)
非极性键
化 学 键
子共
价键 共
价 键
多原
子共
单电子键 三电子键 共轭 π 键
金 价键 多中心键
属 键
上页 下页 目录 返回
2.2 离子键理论 ( ionic bond theory )
高中化学竞赛辅导素材 分子结构110PPT

.
原子轨道对称性示意图
2019/12/21
61
② 能量相近原则 只有能量接近的两个对称性匹配的原子轨道才能 有效地组合成分子轨道.
两原子轨道的能量越接近,组合成的分子轨道 越有效。
62
H原子的1s轨道的能量为-1312kJ·mol-1
F原子的1s、2s和2px轨道的能量分别为: -67181 kJ·mol-1、 -3870.8 kJ·mol-1、 -1797.4 kJ·mol-1。
所形成的共价键。
形成σ键时,原子轨道的重叠部分对于键轴呈圆 柱形对称分布。
2019/12/21
15
++
s-s
++ - ++ -
s-px px-px
(二)π键 原子轨道垂直于键轴以 “肩并肩” 方式重 叠所形成的共价化学键。
形成π键时,原子轨道的重叠部分对键轴呈镜 面反对称。
2019/12/21
17
molecular orbital theory
一、分子轨道理论的基本要点 二、分子轨道的形成 三、同核双原子分子的分子轨道能级图 四、分子轨道理论的应用实例
2019/12/21
67
两个原子轨道沿着连接两个核轴线(x 轴)以 “头 碰头” 方式组合成的分子轨道称为σ分子轨道;
成键σ分子轨道 反键σ分子轨道 两个原子轨道垂直于轴线以 “肩并肩” 方式组合 成的分子轨道称为π分子轨道。 成键π分子轨道 反键π分子轨道
从对称性匹配原则:
从能量相近原则: 1s 和 2px
63
③ 轨道最大重叠原则 能量相近、对称性匹配的两个原子轨道线性组合 成分子轨道时,应尽可能使原子轨道重叠程度最大, 以使成键分子轨道的能量尽可能降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
美国化学家路易斯(G N Lewis)提出了共价键 (covalent bond)的电子理论:原子间可 共用一对或几对电子,以形成稳定的分子。 这是早期的共价键理论
09.10.2020
10
09.10.2020
Lewis
1875年10月25日路易斯出生于 美国麻萨诸塞州的西牛顿市。 他从小聪明过人,在三岁时, 父母就开始在家里让他接受教 育 。 1893 年 进 入 著 名 的 哈 佛 大 学 学 习 , 1896 年 获 理 学 士 学位,以后在T.W.理查兹 指导下继续研究化学,于 1899 年 24 岁 时 获 哲 学 博 士 学 位。
• 结构 — 颗粒物质的几何结构,以及在此结构 下物质所具有的能量。
• 化学在以下两个层次上讨论物质结构
1)原子如何组成各种分子 2)分子如何聚集形成各种形态的物质
09.10.2020
3
分子结构
分子的组成 化学键 空间构型 分子间力
09.10.2020
4
第一节 分子结构的基础知识
本节主要讨论分子中直接相邻的原子间的强 相互作用力,即化学键问题和分子的空间 构型(即几何形状)问题。
离子键(ionic bond)理论是1916年德国 化学家柯塞尔(W.Kossel)提出的,他认 为原子在反应中失去或得到电子以达到 稀有气体的稳定结构,由此形成的正离 子(positive ion)和负离子(negative ion)以静电引力相互吸引在一起。
离子键的本质就是正、负离子间的静电
按照化学键形成方式与性质的不同,化学键 可分为三种基本类型:离子键﹑共价键和 金属键。
09.10.2020
5
化学键——分子中相邻原子间较强烈的
相互结合力。 125-900 kJ/mol 既是电子对核的吸引力,也是核对电子的
吸引力。 电子云偏向对电子吸引力大的原子。
09.10.2020
6
一、离子键
11
1、路易斯结构式
确定步骤 1)计算可用价电子的数目。 2)画出结构草图。 3)计算所画结构的电子总数。 4)画出双键或三键。
09.10.2020
12
1927年英国物理学家海特勒(W Heitler)和德 国物理学家伦敦(F London)成功地用量子 力学处理H2分子的结构。
09.10.2020
09.10.2020
18
鲍林 Linus Pouling
美国化学家。1901年2月28日出生于 一个药剂师家中。自幼对父亲在药 房配药发生兴趣。在中学时代他就 喜欢做化学实验。由于化学成绩优 秀,老师破格让他做高一级的化学 实验并参加老师的研究工作。1922 年毕业于俄勒冈州立大学化工系, 加州理工学院攻读化学。1925年获 博士位,曾到欧洲各国作访问学者。 1927年回到加州大学理工学院, 1931年升任教授。1969年任斯坦 福大学化学教授一职直到退休。 1974年任该校荣誉教授。
13
氢分子的形成
当具有自旋状态反平行的未成对电子的两个 氢原子相互靠近时,它们之间产生了强烈的 吸引作用,形成了共价键,从而形成了稳定 的氢分子。
09.10.2020
14
量子力学从理论上解释了共价键形成原因:
当核外电子自旋平行的两个氢原子靠近时,两核
间电子云密度小,系统能量E 始终高于两个孤立氢
09.10成.202了0 稳定的共价键,形成了氢分子。
15
自旋方向相同
09.10.2020
自旋方向相反
16
量子力学对氢分子结构的处理阐明了共价键 的本质是电性的。
由于两个氢原子的1s原子轨道互相叠加,两个
1s 都是正值,叠加后使核间的电子云密度加
大,这叫做原子轨道的重叠,在两个原子之间 出现了一个电子云密度较大的区域。
吸引作用。
பைடு நூலகம்
09.10.2020
7
离子键的要点
由于离子键是正负离子通过静电引力作用
相连接的,从而决定了离子键的特点是没有方 向性和饱和性。正负离子近似看作点电荷,
所以其作用不存在方向问题。没有饱和性是指 在空间条件许可的情况下,每个离子可吸引尽
NaCl晶体,其化学式仅表示Na离子与Cl离子 的离子数目之比为1∶1,并不是其分子式,整 个NaCl晶体就是一个大分子。
原 子 的 能 量 之 和 Ea+Eb , 称 为 推 斥 态 , 不 能 形 成
H2 分子。
若电子自旋反平行的两个氢原子靠近时,两核间
的电子云密度大,系统的能量E 逐渐降低,并低于
两个孤立氢原子的能量之和,称为吸引态。
当两个氢原子的核间距L = 74 pm时,其能量达
到
最低点,Es = 436 kJmol1,两个氢原子之间形
09.10.2020
19
2、VB法基本要点
*自旋相反的未成对电子相互配对时,因其波函数符号相 同,此时系统的能量最低,可以形成稳定的共价键。
*若A﹑B两原子各有一未成对电子且自旋反平行,则互 相配对构成共价单键,如H—H单键。如果A、B两原 子各有两个或三个未成对电子,则在两个原子间可以 形成共价双键或共价三键。如N≡N分子以三键结合, 因为每个N原子有3个未成对的2p电子。
09.10.2020
8
问:分子为什么会形成一定的几何结构? 答:是化学键让原子连接成一定的结构。
问:化学键是什么? 答:相邻原子共用成对电子。
问:电子是如何配成对的?
09.10.2020
9
二、 价键理论
离子键理论能很好解释电负性差值较大的离 子型化合物的成键与性质,但无法解释其 他类型的化合物的问题。
一方面降低了两核间的正电排斥,另一方面又 增强了两核对电子云密度大的区域的吸引,这 都有利于体系势能的降低,有利于形成稳定的 化学键。
09.10.2020
17
1931年美国化学家鲍林和斯莱特将 其处理H2分子的方法推广应用于其他分 子系统而发展成为价键理论(valence bond theory),简称VB法或电子配对法。
浙江省化学夏令营
第四讲 分子结构
09.10.2020
1
09.10.2020
2
什么是物质结构
{ • 物质
颗粒物质
宏观物质(生物体、机械建筑、天体…) 介观物质(原子、分子、分子聚集体)
能量(场) 微观物质(原子核、电子、基本粒子…)
国际著名学术期刊《STRUCTURE》- 建筑结构 国际著名学术期刊《MOLECULAR STRUCTURE》- 分子结构
09.10.2020
10
09.10.2020
Lewis
1875年10月25日路易斯出生于 美国麻萨诸塞州的西牛顿市。 他从小聪明过人,在三岁时, 父母就开始在家里让他接受教 育 。 1893 年 进 入 著 名 的 哈 佛 大 学 学 习 , 1896 年 获 理 学 士 学位,以后在T.W.理查兹 指导下继续研究化学,于 1899 年 24 岁 时 获 哲 学 博 士 学 位。
• 结构 — 颗粒物质的几何结构,以及在此结构 下物质所具有的能量。
• 化学在以下两个层次上讨论物质结构
1)原子如何组成各种分子 2)分子如何聚集形成各种形态的物质
09.10.2020
3
分子结构
分子的组成 化学键 空间构型 分子间力
09.10.2020
4
第一节 分子结构的基础知识
本节主要讨论分子中直接相邻的原子间的强 相互作用力,即化学键问题和分子的空间 构型(即几何形状)问题。
离子键(ionic bond)理论是1916年德国 化学家柯塞尔(W.Kossel)提出的,他认 为原子在反应中失去或得到电子以达到 稀有气体的稳定结构,由此形成的正离 子(positive ion)和负离子(negative ion)以静电引力相互吸引在一起。
离子键的本质就是正、负离子间的静电
按照化学键形成方式与性质的不同,化学键 可分为三种基本类型:离子键﹑共价键和 金属键。
09.10.2020
5
化学键——分子中相邻原子间较强烈的
相互结合力。 125-900 kJ/mol 既是电子对核的吸引力,也是核对电子的
吸引力。 电子云偏向对电子吸引力大的原子。
09.10.2020
6
一、离子键
11
1、路易斯结构式
确定步骤 1)计算可用价电子的数目。 2)画出结构草图。 3)计算所画结构的电子总数。 4)画出双键或三键。
09.10.2020
12
1927年英国物理学家海特勒(W Heitler)和德 国物理学家伦敦(F London)成功地用量子 力学处理H2分子的结构。
09.10.2020
09.10.2020
18
鲍林 Linus Pouling
美国化学家。1901年2月28日出生于 一个药剂师家中。自幼对父亲在药 房配药发生兴趣。在中学时代他就 喜欢做化学实验。由于化学成绩优 秀,老师破格让他做高一级的化学 实验并参加老师的研究工作。1922 年毕业于俄勒冈州立大学化工系, 加州理工学院攻读化学。1925年获 博士位,曾到欧洲各国作访问学者。 1927年回到加州大学理工学院, 1931年升任教授。1969年任斯坦 福大学化学教授一职直到退休。 1974年任该校荣誉教授。
13
氢分子的形成
当具有自旋状态反平行的未成对电子的两个 氢原子相互靠近时,它们之间产生了强烈的 吸引作用,形成了共价键,从而形成了稳定 的氢分子。
09.10.2020
14
量子力学从理论上解释了共价键形成原因:
当核外电子自旋平行的两个氢原子靠近时,两核
间电子云密度小,系统能量E 始终高于两个孤立氢
09.10成.202了0 稳定的共价键,形成了氢分子。
15
自旋方向相同
09.10.2020
自旋方向相反
16
量子力学对氢分子结构的处理阐明了共价键 的本质是电性的。
由于两个氢原子的1s原子轨道互相叠加,两个
1s 都是正值,叠加后使核间的电子云密度加
大,这叫做原子轨道的重叠,在两个原子之间 出现了一个电子云密度较大的区域。
吸引作用。
பைடு நூலகம்
09.10.2020
7
离子键的要点
由于离子键是正负离子通过静电引力作用
相连接的,从而决定了离子键的特点是没有方 向性和饱和性。正负离子近似看作点电荷,
所以其作用不存在方向问题。没有饱和性是指 在空间条件许可的情况下,每个离子可吸引尽
NaCl晶体,其化学式仅表示Na离子与Cl离子 的离子数目之比为1∶1,并不是其分子式,整 个NaCl晶体就是一个大分子。
原 子 的 能 量 之 和 Ea+Eb , 称 为 推 斥 态 , 不 能 形 成
H2 分子。
若电子自旋反平行的两个氢原子靠近时,两核间
的电子云密度大,系统的能量E 逐渐降低,并低于
两个孤立氢原子的能量之和,称为吸引态。
当两个氢原子的核间距L = 74 pm时,其能量达
到
最低点,Es = 436 kJmol1,两个氢原子之间形
09.10.2020
19
2、VB法基本要点
*自旋相反的未成对电子相互配对时,因其波函数符号相 同,此时系统的能量最低,可以形成稳定的共价键。
*若A﹑B两原子各有一未成对电子且自旋反平行,则互 相配对构成共价单键,如H—H单键。如果A、B两原 子各有两个或三个未成对电子,则在两个原子间可以 形成共价双键或共价三键。如N≡N分子以三键结合, 因为每个N原子有3个未成对的2p电子。
09.10.2020
8
问:分子为什么会形成一定的几何结构? 答:是化学键让原子连接成一定的结构。
问:化学键是什么? 答:相邻原子共用成对电子。
问:电子是如何配成对的?
09.10.2020
9
二、 价键理论
离子键理论能很好解释电负性差值较大的离 子型化合物的成键与性质,但无法解释其 他类型的化合物的问题。
一方面降低了两核间的正电排斥,另一方面又 增强了两核对电子云密度大的区域的吸引,这 都有利于体系势能的降低,有利于形成稳定的 化学键。
09.10.2020
17
1931年美国化学家鲍林和斯莱特将 其处理H2分子的方法推广应用于其他分 子系统而发展成为价键理论(valence bond theory),简称VB法或电子配对法。
浙江省化学夏令营
第四讲 分子结构
09.10.2020
1
09.10.2020
2
什么是物质结构
{ • 物质
颗粒物质
宏观物质(生物体、机械建筑、天体…) 介观物质(原子、分子、分子聚集体)
能量(场) 微观物质(原子核、电子、基本粒子…)
国际著名学术期刊《STRUCTURE》- 建筑结构 国际著名学术期刊《MOLECULAR STRUCTURE》- 分子结构
