初中化学元素_化合价
初中化学化合价口诀

初中化学口诀1、常见元素的化合价:一价钾钠氯氢银,二价钙钡镁锌,三铝四硅五价磷;二三铁,二四碳;二四六硫都齐全,铜汞二价最常见。
2、实验室制取氧气的步骤:“茶(查)、庄(装)、定、点、收、利(离)、息(熄)”“查”检查装置的气密性“装”盛装药品,连好装置“定”试管固定在铁架台“点”点燃酒精灯进行加热“收”收集气体“离”导管移离水面“熄”熄灭酒精灯,停止加热。
3、用CO还原氧化铜的实验步骤:“一通、二点、三灭、四停、五处理”“一通”先通氢气,“二点”后点燃酒精灯进行加热;“三灭”实验完毕后,先熄灭酒精灯,“四停”等到室温时再停止通氢气;“五处理”处理尾气,防止CO污染环境。
4、电解水的实验现象:“氧正氢负,氧一氢二”:正极放出氧气,负极放出氢气;氧气与氢气的体积比为1:2。
6、组成地壳的元素:养闺女(氧、硅、铝)7、原子最外层与离子及化合价形成的关系:“失阳正,得阴负,值不变”:原子最外层失电子后形成阳离子,元素的化合价为正价;原子最外层得电子后形成阴离子,元素的化合价为负价;得或失电子数=电荷数=化合价数值。
8、化学实验基本操作口诀:固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖液体应盛细口瓶,手贴标签再倾倒;读数要与切面平,仰视偏低俯视高滴管滴加捏胶头,垂直悬空不玷污;不平不倒不乱放,用完清洗莫忘记托盘天平须放平,游码旋螺针对中;左放物来右放码,镊子夹大后夹小试纸测液先剪小,玻棒沾液测最好;试纸测气先湿润,粘在棒上向气靠酒灯加热用外焰,三分之二为界限;硫酸入水搅不停,慢慢注入防沸溅实验先查气密性,隔网加热杯和瓶;排水集气完毕后,先撤导管后移灯9、金属活动性顺序:金属活动性顺序由强至弱:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au (按顺序背诵)钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金10、“十字交叉法”写化学式的口诀:“正价左负价右,十字交叉约简定个数,写右下验对错”11、过滤操作口诀:斗架烧杯玻璃棒,滤纸漏斗角一样;过滤之前要静置,三靠二低莫忘记。
初三化学化合价详细讲解

初三化学化合价详细讲解一、常见元素及原子团的化合价:钾K 钠Na 氢H 银Ag +1价,氟F 氯Cl 溴Br 碘I -1价钙Ca 镁Mg 钡Ba 锌Zn +2价,+1、+2铜Cu,+2、+3铁Fe铝Al+3 硅Si+4 氧O-2常见带电离子团:硫酸根SO42+,硝酸根NO3-,氢氧根OH-,氯酸根ClO3-,碳酸根CO32-铵根NH4+,高锰酸根MnO4- 锰酸根MnO42-,磷酸根PO43-注意:标原子团的化合价时,应标在原子团的上方,如:书写离子符号时,应在原子团右上角标明带电荷数,如硫酸根离子:SO42-一个亚铁离子Fe2+,一个铁离子Fe3+。
二、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
初中化学元素_化合价

初中化学元素_化合价元素的化合价是指一个元素在化合物中的原子价或电价。
化合价是元素形成化合物时所表现出来的元素的化学性质。
化合价的大小可以通过元素的原子结构和电子排布来解释。
在化学元素中,元素的原子结构是由质子和中子组成的原子核,以及围绕原子核运动的电子云组成的。
元素的化合价取决于元素的原子结构中电子的排布情况。
化合价可以分为单价、二价、三价、四价等等。
单价元素是指元素的最外层电子层中只有一个电子,并且容易失去或得到一个电子。
常见的单价元素有氢、锂、钠、钾等。
这些元素在化合物中呈阳离子的形式存在。
二价元素是指元素的最外层电子层中有两个电子,这些元素倾向于失去或得到两个电子。
常见的二价元素有镁、钙、银等。
这些元素在化合物中呈二价阳离子的形式存在。
三价元素是指元素的最外层电子层中有三个电子,这些元素倾向于失去或得到三个电子。
常见的三价元素有铝、硼、镓等。
这些元素在化合物中呈三价阳离子的形式存在。
四价元素是指元素的最外层电子层中有四个电子,这些元素倾向于失去或得到四个电子。
常见的四价元素有碳、硅等。
这些元素在化合物中呈四价阴离子或共价键的形式存在。
除了单价、二价、三价、四价元素,还有一些元素的化合价可以有多种选择。
例如,氧元素在一氧化碳中呈现-2的化合价,而在过氧化氢中呈现-1的化合价。
化合价的大小决定了元素在化合物中的化学性质。
不同化合价的元素在化合物中会形成不同的离子或共价键,从而决定了化合物的性质。
总结起来,化合价是指元素在化合物中的原子价或电价。
化合价的大小取决于元素的原子结构和电子排布。
常见的化合价有单价、二价、三价、四价等。
化合价的大小决定了元素在化合物中的化学性质。
初中常见化合价化学式化学方程式
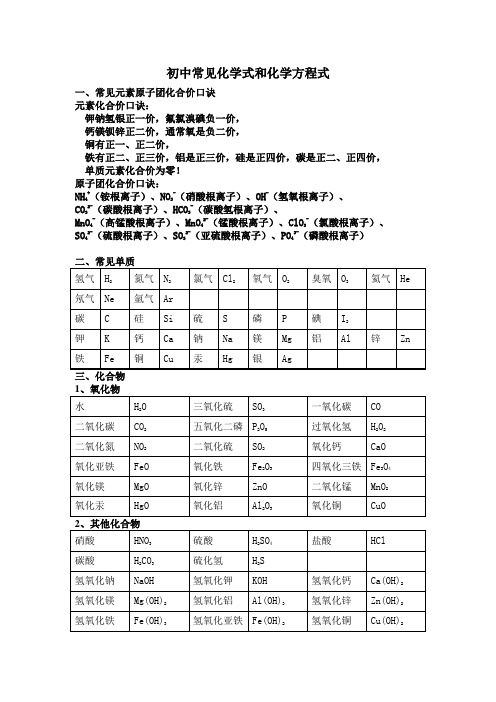
初中常见化学式和化学方程式一、常见元素原子团化合价口诀元素化合价口诀:钾钠氢银正一价,氟氯溴碘负一价,钙镁钡锌正二价,通常氧是负二价,铜有正一、正二价,铁有正二、正三价,铝是正三价,硅是正四价,碳是正二、正四价,单质元素化合价为零!原子团化合价口诀:NH4+(铵根离子)、NO3-(硝酸根离子)、OH-(氢氧根离子)、CO32-(碳酸根离子)、HCO3-(碳酸氢根离子)、MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO42-(硫酸根离子)、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)初中常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P+5O2 2P2O52、氢气在空气中燃烧生成水:2H2+O22H2O3、硫磺在空气(或氧气)中燃烧:S+O2SO24、镁条在空气(或氧气)中燃烧:2Mg+O22MgO5、铁丝在氧气中燃烧:3Fe+2O2Fe3O46、木炭在空气(或氧气)中完全燃烧:C+O2 CO27、木炭不充分燃烧:2C+O22CO8、一氧化碳燃烧:2CO+O2 2CO29、二氧化碳和水反应生成碳酸:CO2+H2O ==H2CO310、二氧化碳通过灼热的炭层:CO2+C 2CO点燃点燃点燃点燃点燃点燃点燃高温点燃11、生石灰作为干燥剂:CaO +H2O == Ca(OH)2二、分解反应11、高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑12、氯酸钾制氧气:2KClO32KCl+3O2↑13、双氧水制氧气:2H2O22H2O + O2↑14、电解水:2H2O 2H2↑+ O2↑15、碳酸分解:H2CO3H2O+CO2↑16、高温煅烧石灰石(工业制取二氧化碳):CaCO3 CaO +CO2↑三、置换反应17、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag +Cu(NO3)218、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO419、锌和硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑20、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑21、木炭还原氧化铁:3C+2Fe2O34Fe + 3CO2↑木炭还原氧化铜:C+2CuO 2Cu +CO2↑木炭还原四氧化三铁:2C+Fe3O43Fe +2CO2↑氢气还原氧化铜:H2+ CuO Cu + H2O四、复分解反应(一)酸 + 碱→盐 + 水22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H2O23、氢氧化钠与硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O25、氢氧化镁与硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O(二)酸 + 盐→新酸 + 新盐26、盐酸与硝酸银溶液反应:HCl+AgNO3== AgCl↓+HNO3△MnO2△MnO2通电高温高温高温高温高温27、氯化钡溶液与硫酸溶液反应:BaCl2 +H2SO4== BaSO4↓+ 2HCl28、碳酸钠与稀盐酸:Na2CO3+2HCl == 2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸:NaHCO3+HCl == NaCl+H2O+CO2↑29、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO3+2HCl =CaCl2+H2O+CO2↑(三)碱 + 盐→另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓31、氯化铁溶液和氢氧化钠溶液反应:FeCl3+3NaOH==Fe(OH)3↓+3NaCl(四)盐 + 盐→两种新盐32、硝酸银溶液与氯化钠溶液反应:AgNO3 + NaCl == AgCl↓+ NaNO333、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl(五)金属氧化物 + 酸→盐 + 水34、稀盐酸清洗铁锈:6HCl+Fe2O3== 2FeCl3+3H2O35、氧化铜与稀硫酸反应:CuO+H2SO4== CuSO4+H2O五、非金属氧化物 + 碱→盐 + 水36、二氧化碳通入澄清石灰水中:CO2+Ca(OH)2== CaCO3↓+H2O37、氢氧化钠在空气中变质:CO2+2NaOH=Na2CO3+H2O38、氢氧化钠溶液吸收二氧化硫:SO2+2NaOH==Na2SO3+H2O39、氢氧化钠溶液吸收三氧化硫:SO3 +2NaOH==Na2SO4+H2O六、其他反应类型40、一氧化碳还原氧化铜:CO + CuO Cu + CO241、一氧化碳还原氧化铁:3CO+ Fe2O32Fe + 3CO2↑42、一氧化碳还原四氧化三铁:4CO+ Fe3O43Fe + 4CO2↑43、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O44、甲烷燃烧:CH4 + 2O2CO2+ 2H2O△点燃点燃高温高温。
初中化学知识点归纳元素的化合价及化合物的命名

初中化学知识点归纳元素的化合价及化合物的命名化学是一门研究物质的性质、组成、结构、变化和相互关系的科学。
在初中化学学习中,了解元素的化合价及化合物的命名是非常重要的基础知识。
本文将对初中化学知识点进行归纳,主要涉及元素的化合价和化合物的命名。
一、元素的化合价元素的化合价是指元素在化合物中与其他元素结合时的价态。
化合价的大小决定了化合物中的元素相对含量。
对于初中化学学习而言,我们主要关注非金属元素和金属元素的化合价。
1. 非金属元素的化合价非金属元素的化合价取决于其最外层电子数目。
主要有以下几种情况:- 单价离子:氢(H)的化合价为+1,氧(O)的化合价为-2,氯(Cl)的化合价为-1等。
- 多价离子:例如氮(N)的化合价既可以是+3,也可以是-3,具体取决于其所在化合物中的其它元素。
2. 金属元素的化合价金属元素的化合价较为复杂,一般情况下,金属元素的化合价可以通过元素的周期数和族别进行判断:- 主族金属元素的化合价等于它们的主族号,例如一族元素钠(Na)的化合价为+1。
- 过渡金属元素的化合价一般为它们的主族号减2,例如二价过渡金属元素铁(Fe)的化合价为+2。
二、化合物的命名化合物的命名规则是根据其化学式来确定的。
根据化合物中的元素种类和元素的化合价,我们可以采用以下方法进行命名。
1. 二元化合物二元化合物是由两种元素组成的化合物。
命名规则如下:- 非金属元素+非金属元素:先写第一个元素的名称,然后写第一个元素的化合价(用罗马数字表示),再写第二个元素的名称末尾加“化”。
例如氢氧化物(H2O)。
- 金属元素+非金属元素:先写金属元素的名称,然后写非金属元素的名称末尾加“化”。
例如氧化钠(Na2O)。
2. 酸化物酸化物是由金属元素和氧元素组成的化合物,命名规则如下:- 金属元素的名称末尾加“酸化物”。
例如氧化铁(Fe2O3)。
3. 酸酸是一类具有特定化学性质的化合物,命名规则如下:- 以氢作为阴离子的酸:先写酸根离子的名称,加上“酸”。
初中化学元素_化合价_化学式_方程式整理

一、常见元素化合价元素名称元素符号常见化合价元素名称元素符号常见化合价钾氢钠氯Cl银溴Br -1钙Ca +2 碘I -1镁Mg +2 氧O -2硫S -2 +4 +6 钡Ba +2碳 C +2 +4 锌Zn +2硅Si +4 铜Cu +2 -1氮N -3 +2 +4 +5 铝Al +3磷P +5 铁Fe +2 +3二、常见原子团化合价原子团名称原子团名称原子团符号原子团化合价原子团名称原子团符号原子团化合价氢氧根OH -1 碳酸氢根HCO3-1 硫酸根SO4-2 磷酸根PO4-3 碳酸根CO3-2 亚硫酸根SO3-2 硝酸根NO3-1 铵根NH4+1 醋酸根CH3COO -1 氯酸根ClO3-1 锰酸根MnO4-2 高锰酸根MnO4-1 磷酸根PO4-3 磷酸氢根HPO4-2 磷酸二氢根H2PO4-1三、元素周期表四、化学式1、非金属单质:氢气H2金刚石/石墨C 氮气N2氧气O2磷P 硫S 氯气Cl22、金属单质:钠Na 镁Mg 铝Al 钾K 钙Ca 铁Fe 锌Zn 铜Cu 钡Ba 钨W 汞Hg3、非金属氧化物:水H2O 一氧化碳CO 二氧化碳CO2 五氧化二磷P2O5二氧化氮NO2二氧化硅SiO2二氧化硫SO2三氧化硫SO3一氧化氮NO4、金属氧化物:氧化镁MgO 氧化铜CuO 氧化钡BaO 氧化亚铜Cu2O 氧化钠Na2O 氧化亚铁FeO 三氧化二铁(铁红)Fe2O3四氧化三铁Fe3O4三氧化二铝Al2O3二氧化锰MnO25、常见的酸:硫酸H2SO4盐酸HCl 硝酸HNO3磷酸H3PO4硫化氢H2S 溴化氢HBr 碳酸H2CO3醋酸CH3COOH6、常见的碱:氢氧化钠NaOH 氢氧化钙Ca(OH)2氢氧化钡Ba(OH)2氢氧化镁Mg(OH)2氢氧化铜Cu(OH) 2氢氧化钾KOH 氢氧化铝Al(OH) 3氢氧化铁Fe(OH) 3氢氧化亚铁Fe(OH) 27、常见的盐—氯化物/盐酸盐:氯化钾KCl 氯化钠(食盐)NaCl 氯化镁MgCl2氯化钙CaCl2氯化铜CuCl2氯化锌ZnCl2氯化钡BaCl2氯化铝AlCl3氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl8、常见的盐—硫酸盐:硫酸铜CuSO4硫酸钡BaSO4硫酸钙CaSO4硫酸钾K2SO4硫酸镁MgSO4硫酸亚铁FeSO4硫酸铁Fe2 (SO4) 3硫酸铝Al2 (SO4) 3硫酸氢钠NaHSO4硫酸氢钾KHSO4亚硫酸钠NaSO39、常见的盐—硝酸盐:硝酸钠NaNO3硝酸钾KNO3硝酸银AgNO3硝酸镁MgNO3硝酸铜Cu(NO3)2硝酸钙Ca(NO3) 2亚硝酸钠NaNO310、常见的盐—碳酸盐/碳酸氢盐:碳酸钠Na2CO3碳酸氢钠NaHCO3碳酸钙CaCO3碳酸镁MgCO3碳酸钾K2CO3碳酸氢钾KHCO311、常见的盐—酸式盐/碱式盐:碳酸氢钠NaHCO3碳酸氢钾KHCO3碳酸氢铵NH4HCO3磷酸二氢钾KH2PO4 / 碱式碳酸铜Cu2 (OH) 2CO312、常见有机物:甲烷CH4乙炔C2H2甲醇CH3OH 乙醇C2H5OH 乙酸CH3COOH13、常见结晶水合物:石膏CaSO4•2H2O 明矾KAl(SO4)2•12H2O 绿矾FeSO4•7H2O 蓝矾CuSO4•5H2O 碳酸钠晶体Na2CO3•10H2O14、常见化肥:尿素CO(NH2)2硝酸铵NH4NO3硫酸铵(NH4)2SO4碳酸氢铵NH4HCO3磷酸二氢钾KH2PO415、常见沉淀及其颜色:碳酸钙CaCO3(白色)氯化银AgCl(白色)碳酸钡BaCO3(白色)硫酸钡BaSO4(白色)氢氧化亚铁Fe(OH) 2(白色)氢氧化铁Fe(OH) 3(红褐色)氢氧化铜Cu(OH)2(天蓝色)氢氧化铝Al(OH) 3(白色)二氧化锰MnO2(黑色)氢氧化银AgOH (白色)碳酸银Ag2CO3(淡黄色)(黄色)氢氧化镁Mg(OH) 2(白色))碱式碳酸铜Cu(OH) CO3(暗绿色)216、常见俗名与化学式:硫酸盐类:1.皓矾:ZnSO4·7H2O2.钡餐,重晶石:BaSO43.绿矾,皂矾,青矾:FeSO4·7H2O4.芒硝,朴硝,皮硝:Na2SO4·10H2O5.明矾:KAl(SO4) 2·12H2O6.生石膏:CaSO4·2H2O 熟石膏:2CaSO4·H2O7.胆矾、蓝矾:CuSO4·5H2O矿石类:5.磁铁矿石:Fe3O46.赤铁矿石:Fe2O322.大理石(方解石、石灰石):CaCO323.孔雀石:CuCO3、Cu(OH)2气体类:1.高炉煤气:CO、CO2等混合气体2.水煤气:CO、H23.天然气(沼气):CH44.液化石油气:C3H8,C4H10为主2.有机类:1.福尔马林(蚁醛):HCHO2.蚁酸:HCOOH3.尿素:(NH4CNO)或CO(NH2)2 5.木精(工业酒精):CH3OH 13.葡萄糖:C6H12O614.蔗糖:C12H22O11其他类:2.石灰乳、消石灰、熟石灰:Ca(OH) 23.熟石膏:2CaSO4·H2O 5.铜绿:Cu2 (OH) 2CO3 6.纯碱(碱面):Na2CO39.小苏打:NaHCO310.苏打:Na2CO311.大苏打(海波):Na2S2O3 19.波尔多液:CuSO4、Ca(OH) 221. 纯碱、苏打、口碱:Na2CO322. 双氧水:H2O223.生石灰:CaO 24. 火碱、烧碱、苛性钠:NaOH17、常见固体、液体颜色:固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁液体的颜色1、无色液体:水,双氧水2、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液3、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液4、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液5、紫红色溶液:高锰酸钾溶液6、紫色溶液:石蕊溶液气体的颜色1、红棕色气体:二氧化氮2、黄绿色气体:氯气3、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
元素化合价口诀初中顺口溜

元素化合价口诀初中顺口溜
初中化学中,元素化合价的记忆可以通过以下顺口溜来帮助:
1.一价钾钠银氢正一价,钡锌钙镁正二价,一二铜,二三铁,亚铜
亚铁是低价,铝是正三氧负二,氯是负一最常见,硫有负二正四六,正二正三铁可变,二三铁,二四碳,单质零价永不变。
2.负一硝酸氢氧根,负二硫酸碳酸根,负三记住磷酸根,正一价的
是铵根。
3.氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙
钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;
一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
初中常见物质化学式与元素化合价

盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
氯离子
Cl-
硫酸根离子
SO4-2
硝酸根离子
NO-
元素化合价
-1
原子团化合价
-2
原子团化合价
-1
氯化钠
NaCl
硫酸钠
Na2SO4
硝酸钠
NaNO3
氯化钾
KCl
硫酸钾
K2SO4
硝酸钾
KNO3
氯化银
AgCl
硫酸银
AgSO4
硝酸银
AgNO3
氯化铵
ClNH4
硫酸铵
NH4SO4
3.常见有机化合物
常见有机化合物
甲烷
CH4
甲醇
CH3OH
葡萄糖
C6H12O6
乙烷
C2H6
乙醇
C2H5OH
果糖
C6H12O6
丙烷
C3H8
丙醇
C3H7OH
麦芽糖
C12H22O11·H2O
丁烷
C4H10
丁醇
C4H9OH
淀粉
C6H12O6n
戎烷
C5H12
戎醇
C5H11OH
…
己烷
C6H14
己醇
C6H13OH
庚烷
硝酸亚铁
FeNO₃₂
氯化铁
FeCl3
硫酸铁
Fe2SO43
硝酸铁
FeNO33
氯化铝
AlCl3
硫酸铝
Al2SO43
硝酸铝
AlNO33
续表
碳酸
H2CO3
氢氧根离子
OH
氢氧化铁
FeOH23
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
—
Cu2+
不
溶
溶
溶
不
Ag+
—
溶
不
微
不
Fe
+2 +3
二、常见原子团化合价原子团
名称原子团
名称
原子团
符号
原子团
化合价
原子团
名称
原子团
符号
原子团
化合价
氢氧根
OH
-1
碳酸氢根
HCO3
-1
硫酸根
SO4
-2
磷酸根
PO4
-3
碳酸根
CO3
-2
亚硫酸根
SO3
-2
硝酸根
NO3
-1
铵根
NH4
+1
醋酸根
CH3COO
-1
氯酸根
ClO3
-1
锰酸根
MnO4
-2
高锰酸根
一、常见元素化合价
元素名称
元素符号
常见化合价
元素名称
元素符号
常见化合价
钾
K
+1
氢
H
+1
钠
Na
+1
氯
Cl
-1 +5 +7
银
Ag
+1
溴
Br
-1
钙
Ca
+2
碘
I
-1
镁
Mg
+2
氧
O
-2硫Βιβλιοθήκη S-2 +4 +6
钡
Ba
+2
碳
C
+2 +4
锌
Zn
+2
硅
Si
+4
铜
Cu
+2 -1
氮
N
-3 +2 +4 +5
铝
Al
+3
磷
P
+5
铁
MnO4
-1
磷酸根
PO4
-3
磷酸氢根
HPO4
-2
磷酸二氢根
H2PO4
-1
溶解度表
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶,挥
溶,挥
溶
溶,挥
NH4+
溶,挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
—
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
