《酸碱平衡》习题
酸碱平衡习题

一、 选择题1.下列各组混合液中,能作为缓冲溶液的是…………………( )(A) 10 cm 3 0.2 mol ·dm -3 HCl 和10 cm 3 0.1 mol ·dm -3 NaCl(B) 10 cm 3 0.2 mol ·dm -3 HAc 和10 cm 3 0.1 mol ·dm -3 NaOH(C) 10 cm 3 0.2 mol ·dm -3 HAc 和10 cm 3 0.3 mol ·dm -3 NaOH(D) 10 cm 3 0.2 mol ·dm -3 HCl 和10 cm 3 0.2 mol ·dm -3 NaOH2.在0.1 mol ·dm -3 NaH 2PO 4溶液中,离子浓度由大至小的顺序是…( )( 1K ≈ 10-3, 2K ≈ 10-8, 3K ≈ 10-13)(A) Na +,H PO 24-,HPO 42-,H 3PO 4,PO 43-(B) Na +,H PO 24-,HPO 42-,PO 43-,H 3PO 4(C) Na +,HPO 42-,H PO 24-,H 3PO 4,PO 43-(D) Na +,HPO 42-,H PO 24-,PO 43-, H 3PO 43.下列溶液的浓度均为0.10mol·L -1,其pH 最大的是 ( )(A) Na 2HPO 4 (B) Na 2CO 3 (C) NaHCO 3 (D) Na 3PO 4 (H 3PO 4 K a1 = 7.52×10-3, K a2 = 6.23×10-8, K a3 = 3.6×10-13)(H 2CO 3 K a1 = 4.30×10-7, K a2 = 5.61×10-11)二、 填空题1. pH = 3 的 HAc(K a = 1.8 ⨯ 10-5)溶液其浓度为______________ mol ·dm -3,将此溶液和等体积等浓度的NaOH 溶液混合后,溶液的pH 约为____________。
病理生理学酸碱平衡试题

试题[A型题:单选]1.缺钾性碱中毒时,尿液呈现:AA.酸性尿B.碱性尿C.酸、碱度正常D.蛋白尿E.血尿2. 输入大量库存全血引起的代谢性碱中毒的机制是:CA.氢离子经消化道丢失过多B.氢离子经肾丢失过多C.柠檬酸盐经代谢后生成HCO3-增多D.碳酸根离子在血中含量过多E.库存血中钾离子含量低A3.经消化道丢失氢离子过多,引起代谢性碱中毒的原因不包括:DA.胃管引流B.高位肠梗阻C.大量应用阳离子交换树脂D.氯摄入不足E.幽门梗阻4.高位肠梗阻出现的剧烈呕吐易引起:BA.代谢性酸中毒B.代谢性碱中毒C.呼吸性酸中毒D.呼吸性碱中毒E.代谢性酸中毒合并呼吸性碱中毒5.甘草摄入过度引起的代谢性碱中毒,下述哪项描述是正确的:CA.对用生理盐水治疗有效B.对用生理盐水治疗后无效C.尿液呈碱性D.尿液酸碱度正常E.尿中氯含量高6.二氧化碳结合力增高提示:BA.代谢性酸中毒或代偿性呼吸性碱中毒B.呼吸性碱中毒或代偿性代谢性酸中毒C.代谢性酸中毒或代偿性呼吸性碱中毒D.代谢性碱中毒或代偿性呼吸性酸中毒E.代谢性酸中毒合并呼吸性酸中毒7.碱中毒时,出现神经肌肉应激性亢进,手足抽搐的主要原因是:CA.血清K+减少B.血清CI-减少C.血清Ca2+减少D.血清Na+减少E.血清H+减少8.引起急性呼吸性酸中毒的原因包括:BA.老年性肺气肿B.气道异物堵塞C.胸廓畸形D.重症低钾血症E.重症肌无力9. 呼吸性酸中毒时,血浆生化指标变化是:CA.血浆PH趋于降低而SB、AB、BB和PaCO2均下降B.血浆PH趋于降低,而AB升高并大于SBC.血浆PH趋于降低,而AB升高并大于SB,PaCO2>6.25kPaD.血浆PH趋于降低,而AB升高并大于SB,经调节BE负值增大E.血浆PH趋于降低,AB、P a CO2升高,SB、BB降低10.代谢性酸中毒时,肺功能变化及调节,下列哪一种代偿意义项相对较大:EA.氢离子的作用引起呼吸深度增加B.氢离子的作用引起呼吸频率增加C.二氧化碳的作用引起呼吸深度增加D.二氧化碳的作用引起呼吸频率增加E.氢离子与二氧化碳引起的呼吸深度、频率均增加11.碳酸酐酶抑制剂(乙酰唑胺)大量应用易引起:AA.AG正常型低氯性酸中毒B.AG正常型高氯性酸中毒C.AG增大型高氯性酸中毒D.AG增大型低氯性酸中毒E.AG减少型低氯性酸中毒12.摄入过量阿斯匹林的酸碱平衡紊乱的特征是:BA.AG增大,高氯性酸中毒B.AG增大,血氯正常性酸中毒C.AG正常,血氯正常性酸中毒D.AG正常,高氯血性酸中毒E.AG减少,氯血升高型酸中毒13.急性呼吸性酸中毒时,AB和SB变化特征为:DA.AB(实际碳酸氢盐)升高B.SB(标准碳酸氢盐)升高C.AB<SBD.AB>SBE.AB↓、SB↓、AB=SB14. 呼吸性碱中毒时,血中下列指标变化特征是:DA.PaCO2下降,AB、SB正常B.PaCO2下降,AB、SB减少C.PaCO2下降,AB>SBD.PaCO2下降,AB<SBE.PaCO2升高,AB>SB15.婴儿过度啼哭易引起:DA.代谢性酸中毒B.代谢性碱中毒C.呼吸性酸中毒D.呼吸性碱中毒E.代谢性酸中毒合并呼吸性碱中毒16.慢性呼吸性碱中毒时机体强有力的代偿方式是:CA.细胞内外离子交换B.血液中缓冲系统缓冲的缓冲作用C.肾脏代偿性调节D.肺脏代偿性调节E.以上都不是17.癔病时出现的呼吸运动急促常引起:AA.呼吸性碱中毒B.呼吸性酸中毒C.代谢性酸中毒D.代谢性碱中毒E.代谢性酸中毒合并呼吸性碱中毒18.严重复合性创伤患者,抢救时呼吸停止,应用人工呼吸造成通气过度,使患者酸碱平衡紊乱的类型为:EA.呼吸性酸中毒B.呼吸性碱中毒C.代谢性酸中毒D.代谢性碱中毒E.代谢性酸中毒合并呼吸性碱中毒19.标准碳酸氢盐和实际碳酸氢下列哪一种变化能说明体内酸碱紊乱是以急性呼吸性碱中毒为主:CA.AB升高B.SB升高C.AB<SBD.AB>SBE.AB↓、SB↑、AB=SB20.标准碳酸氢盐和实际碳酸氢盐值均下降说明:CA.代谢性酸中毒B.呼吸性酸中毒C.代谢性酸中毒或代偿后呼吸性碱中毒D.代谢性酸中毒或代偿后呼吸性酸中毒E.代谢性酸中毒合并呼吸性酸中毒21.引起急性呼吸性酸中毒的原因不包括:AA.脑血管意外B.气道异物堵塞C.慢性肺气肿D.呼入过量的二氧化碳E.严重气胸22.AB>SB能有:BA.代谢性酸中毒B.呼吸性酸中毒C.呼吸性碱中毒D.代谢性碱中毒E.混合性碱中毒23. 对呼吸性H+的缓冲,主要靠:BA.HCO3-缓冲系统B.HCO3-以外的缓冲系统C.血浆蛋白缓冲系统D.磷酸盐缓冲系统E.其他缓冲系统24.对代谢性H+的缓冲主要靠:AA.HCO3-缓冲系统B.血浆蛋白缓冲系统C.血红蛋白缓冲系统D.磷酸盐缓冲系统E.HbO2缓冲系统25. 某慢性肺心病患者,血气分析及电解质测定结果如下:PH 7.40 PaCO267mmHg, HCOI3-40mmol/人血Na+140mmol/人CI- 90mmol/人诊患者的酸碱平衡诊断为HCO3-:AA.呼吸性酸中毒B.代谢性碱中毒C.代谢性酸中毒合并代谢性碱中毒D.呼吸性酸中毒合并代谢性碱中毒E.呼吸性碱中毒26.某肺心病患者,血气分析及电解质测定结果如下:PH 7.26,PaCO285.8mmHg, HCO3- 37.8mmol/人 CI- 90mmol/人 Na+140mmol/人下列诊断中最有可能是哪一种:AA.呼吸性酸中毒B.代谢性酸中毒C.呼吸性酸中毒合并代谢性酸中毒D.呼吸性酸中毒合并代谢性碱中毒E.呼吸性碱中毒27.肝功能异常并合并代谢性酸中毒患者,在纠正酸中毒时,不宜采用下列:哪一种药物:CA.0.9% NaClB.1.5%NaHCOC.乳酸钠D.三羟甲基氨基甲烷E.氯化镁28.代谢性酸中毒时,二氧化碳结合力为45~30%状态下,中枢神经系统常出现:DA.轻度的烦躁B.萎糜C.昏睡D.昏迷E.精神错乱29.呼吸性酸中毒时,对中枢神经系统功能影响较大的因素是:DA.氢离子浓度升高B.r-氨基丁酸减少C.PH下降D.二氧化碳升高E.高血钾30.酸中毒时对机体影响危害最大的是:AA.对中枢的抑制作用B.对血管的扩张作用C.高血钾对心肌细胞的毒性作用D.低血钾对心肌细胞的毒性作用E.溶骨作用31.急性碱中毒时出现手足搐搦和四肢抽动的主要原因是:CA.血清K+减少B.血清ClC.血清Ca2+减少D.血清Na+减少E.血清Mg2+减少32.下列指标中哪一项是反映酸碱平衡呼吸困难的最佳指标:BA.pHB.PaCOC.SBD.AB33. 低血钾引起的酸碱失衡紊乱的特点是:A___________________________________________________________ 血浆HCO3-血浆H+细胞内H+尿液H+____________________________________________________________A.↓↑↑↑B.↓↑↓↓C.↑↓↓↓D.↑↓↑↑E.↓↑↑↑_____________________________________________________________34. 血气分析测定结果为PaCO2降低,同时伴有HCO3-升高,可诊断为:EA.呼吸性酸中毒B.代谢性酸中毒C.呼吸性碱中毒D.代谢性碱中毒E.呼吸性碱中毒合并代谢性碱中毒35.碱中毒时血红蛋白氧离曲线呈现:BA.右移B.左移C.先左移后右移D.先右移后左移E.不移动36.慢性呼吸性酸中毒时机体主要代偿方式是:DA.细胞外液缓冲B.呼吸代偿C.细胞内缓冲D.肾脏代偿E.骨骼代偿37.呼吸性酸中毒合并代谢性酸中毒可见于:CA.慢性肺心病患者长期服用利尿剂B.水杨酸中毒C.心跳呼吸聚停D.革兰阴性杆菌败血症E.幽门梗阻长时间进食少38. 血液中pH值主要取决于血浆中:DA.CO2CPB.PaCO2C.HCO3-D.HCO3-与H2CO3的比值E. H2CO339. 反映血浆中HCO3-实际量的指标是:AA.碳酸氢盐缓冲系统B.磷酸盐缓冲系统C.血红蛋白缓冲系统D.氧合血红蛋白缓冲系统E.其他缓冲系统40.慢性呼吸性酸中毒时,机体代偿的主要方式:DA.细胞外液缓冲B.呼吸代偿C.细胞内缓冲D.肾脏代偿E.血液系统的缓冲41.某溺水窒息患者,经抢救后其血气分析结果为:PH 7.15 PaCO2 80mmHg,HCO3-27mmol/L应诊断:CA.代谢性酸中毒B.代谢性碱中毒C.急性呼吸性酸中毒D.慢性呼吸性酸中毒E.呼吸性碱中毒42. 碱中毒时出现神经肌肉应激性亢进,手足抽搐的主要原因是:CA.血清K+减少B.血清CI-减少C.血清Ca2+减少D.血清Na+减少E.血清Mg2+减少43.不同类型脱水的分型依据是:BA.体液丢失的总量B.电解质丢失的总量C.细胞外液的总量D.细胞外液的晶体渗透压E.细胞外液的胶体渗透压44. 血浆中含量最多的阴离子是:DA.HCO3-B.HPO42-C.SO42-D.CI-E.NO245.体内体液中各部分间渗透压关系是:EA.细胞内高于细胞外B.细胞内低于细胞外C.血浆低于组织间液D.组织间液低于细胞内液E.细胞内外基本相等46. 细胞内外渗透压的平衡主要靠哪一种物质的移动来维持:BA.Na+B.K+C.H20D.葡萄糖E.Ca2+47. 组织间液和血浆所含的溶质含量的主要差别是:CA.Na+B.CIC.蛋白质D.有机酸E.Ca2+48. 决定细胞外液渗透压的主要因素是:CA.球蛋白B.白蛋白C.Na+D.K+E.Ca2+49.中度高渗性脱水患者的失水量相当于体重的:AA.1~2%B.2~5%C.5~10%D.10~15%E.15%~20%50.低渗性脱水时,下列描述哪项正确:CA.细胞外液渗透压增高,容量降低B.细胞内液渗透压增高,容量降低C.细胞外液渗透压降低,容量降低D.细胞内液渗透压降低,容量降低E细胞内液渗透压不变,容量不变51.高渗性脱水患者的处理原则是补充:CA.5%葡萄糖液B.0.9%NaCl液C.先5%葡萄糖液后0.9%NaCl液D.先3%NaCl液后5%葡萄糖液E.同时给予5%葡萄糖液和3%NaCI液52."失盐性肾炎"患者的肾脏内,哪一部位对钠重呼吸发生障碍:DA.近曲小管B.髓袢升支粗段C.髓袢降支D.远曲小管和集合管E.髓袢升支细段53.低渗性脱水患者体液丢失的特点是:BA.细胞内液和外液均有明显丢失B.细胞内液无丢失,仅丢失细胞外液C.细胞内液无丢失,仅丢失血浆D.细胞内液无丢失,仅丢失组织间液E.细胞内液丢失,细胞外液无丢失54.下列哪一种情况的早期出现精神神经症状:BA.急性水中毒B.高渗性脱水C.低渗性脱水D.等渗性脱水55.急性低钾血症对神经肌肉组织中生理的影响是:A_____________________________________________________________ 静息电位(负值) 阈电位静息电与阈电位差值_____________________________________________________________A.↑不变↑B.↓不变↓C.↑↑不变D.↓↓不变E.↓↓不变_____________________________________________________________ 56.急性低钾血症时心肌电生理特点是:D___________________________________________________________ 静息电位与阈电位差值兴奋性___________________________________________________________A. ↑↑B. ↓↓C. ↑↓D. ↓↑E.不变不变__________________________________________________________57.低钾血症对心肌的影响是:C___________________________________________________________兴奋性传导性自律性收缩性____________________________________________________________A. ↑↑↑↑B. ↓↑↑↑C. ↑↓↑↑D. ↑↑↓↑E.↓↓↓↓_____________________________________________________________58.高钾血症对心肌的影响是:A____________________________________________________________兴奋性传导性自律性收缩性_____________________________________________________________A. ↑→↓↓↓↓B. ↓→↑↓↓↓C. ↓↑↑↑D. ↑↓↓↓E. ↓↓↓↓____________________________________________________________59.神经肌肉应激性增强可见于:BA.低血磷B.低血钾C.高血钙D.低血镁E.高血钾60.下列哪种情况可产生低镁血症:BA.甲状旁腺功能低下B.甲状腺激素分泌过多C.促性腺激素分泌过多D.肾上腺功能减退E.高血钾61.AG增高反映发生了:BA.高氯血性代谢性酸中毒B.正常氯血性代谢性酸中毒C.代谢性碱中毒D.呼吸性酸中毒E.呼吸性碱中毒62.从动脉抽取血样后,如不与大气隔绝,下列哪一项指标将受影响:BA.SBB.ABC.BED.BBE.BD63.急性代谢性酸中毒,最主要的代偿方式是:AA.肾脏代偿B.血液代偿C.呼吸代偿D.细胞外液缓冲E.骨骼缓冲64.某慢性肾功能不全患者,因上腹部不适呕吐而急诊入院,血气分析结果:PH 7.39 PaCO2 43.8mmHg HCO3- 26.6mmol/人 Na+ 142mmol/人 Cl- 96.5mmol/人诊断属哪一种酸碱失衡:DA.AG增高性代谢性酸中毒B.AG正常性代谢性酸中毒C.AG增高性代谢性酸中毒合并代谢性碱中毒D.AG正常性代谢性酸中毒合并代谢性碱中毒E.AG增高性代谢性酸中毒合并呼吸性酸中毒65.下列疾病中哪一种不引起高输出量性心衰:BA.甲状腺功能亢进症B.贫血C.心肌病D.维生素B1缺乏E.动-静脉瘘66.常引起呼吸性酸中毒合并代谢性酸中毒的疾病是:BA.严重的肝功能衰竭合并败血症B.严重的慢性阻塞性肺病合并中毒性休克C.糖尿病患者合并剧烈呕吐D.剧烈呕吐伴有严重腹泻E.严重高热67.剧烈呕吐伴有严重腹泻的患者可引起的酸碱平衡紊乱类型为:AA.代谢性酸中毒合并代谢性碱中毒B.代谢性酸中毒合并呼呼性碱中毒C.代谢性碱中毒合并呼吸性碱中毒D.代谢性碱中毒E.代谢性酸中毒68.剧烈呕吐合并感染并有发热时,易引起:BA.呼吸性碱中毒+代谢性酸中毒B.代谢性碱中毒+呼吸性碱中毒C.代谢性碱中毒+呼吸性酸中毒D.呼吸性酸中毒+代谢性酸中毒E.代谢性碱中毒+代谢性酸中毒69.下列哪一项混合性酸碱失衡不可能出现:BA.代谢性酸中毒合并代谢性碱中毒B.呼吸性酸中毒合并呼吸性碱中毒C.代谢性酸中毒合并呼吸性碱中毒D.代谢性酸中毒合并呼吸性酸中毒E.代谢性碱中毒合并呼吸性碱中毒70. 对代谢性H+的缓冲主要依靠:AA.HCO-3缓冲系统 B.血浆蛋白缓冲系统C.Hb缓冲系统D.磷酸盐缓冲系统E.HbO2缓冲系统71. 机体新陈代谢时产生的挥发性酸是:BA.r-羟丁酸B.H2CO3C.H2SO4D.尿酸E.磷酸72.肾脏产氨的主要部位是:CA.远曲小管B.近曲小管C.集合管D.髓袢E.肾小球73.关于PH值的描述,下列哪项是错误的:DA.PH值代表[H+]的负对数B.可由Henderson-Hasselbalch公式计算C.PH值的变化不能区别代谢性或呼吸性酸碱平衡紊乱D.PH值正常表明无酸碱平衡紊乱E.PH值正常不排除有酸碱平衡紊乱74.下述哪种情况不引起呼吸性碱中毒:CA.大气氧分压过低B.人工呼吸时过度通气C.长时间在密闭小室中D.癔病发作E.革兰阴性杆菌败血症75. 血液中具有最强缓冲能力的缓冲对是:AA.NaHCO3/H2CO3B.Na2HPO4/NaH2PO4C.Na-Pr/H-HbD.KHCO3/H2CO3E.K-Hb/H-Hb76.下列哪一项混合性酸碱失衡不可能出现:BA.代谢性酸中毒合并代谢性碱中毒B.呼吸性酸中毒合并呼吸性碱中毒C.代谢性酸中毒合并呼吸性碱中毒D.代谢性酸中毒合并呼吸性酸中毒E.代谢性碱中毒合并呼吸性碱中毒77. PaCO2升高至何种程度能使肺的通气量增加2倍:AA.PaCO2为5.32kPaB.<5.32KPaC.>5.32kPaD.>8.3kPaE. >9.0kPa78.下列哪一种对血PH意义是错误的:BA.PH= -Log[H+]B.PH= Log[H+]C.PH= pka +Log[HCO-]/0.03×PCO2D.PH= 6.1+Log[HCO-]/H CO]E.PH= 6.1+Log[HCO-]/ a×PCO79.对二氧化碳结合力的表述,下列哪一项是错误的:DA.其正常范围是25~35mmol/LB.是指血浆中化学结合的二氧化碳量C.以容积表示时正常值为50-70ml%D.可以反映血浆中碳酸氢钠的含量E.正常血浆平均为27mmol/L80.能反映血液中全部缓冲碱的指标是:DA.ABB.PaCOC.SBD.BBE.BE81.PaCO 4.39KPa(33mmHg)常提示:BA.代谢性碱中毒B.呼吸性碱中毒C.呼吸性酸中毒D.代谢性碱中毒合并呼吸性酸中毒E.代谢性酸中毒合并呼吸性酸中毒82.AG增高提示机体可发生:BA.高氯血性代谢性酸中毒B.正氯血性代谢性酸中毒C.代谢性碱中毒D.呼吸性酸中毒E.呼吸性碱中毒83.酸中毒时血钾的变化规律是:AA.升高B.不变C.降低D.先升后降E.先降后升84.严重的心力衰竭患者发生酸碱平衡紊乱的类型:AA.乳酸增多的代谢性酸中毒B.酮体增多的代谢性酸中毒C.代谢性碱中毒D.呼吸性酸中毒E.呼吸性酸中毒合并代谢性碱中毒85. 溃疡病并发幽门梗阻患者,因反复呕吐入院,血气分析结果如下:PH>7.48,PaCO26.4kPa(48mmHg),HCO-336mmol/L该病人酸碱失衡的类型是:BA.代谢性酸中毒B.代谢性碱中毒C.呼吸性酸中毒D.呼吸性碱中毒E.混合性酸碱中毒86. 氯摄入不足引起代谢性碱中毒的机制是:BA.H+经消化道丢失过多B.H+—Na+交换加强致重吸收HCO3-C.H+—Na+交换减少,致HCO重吸增加D.H+—Na+交换减少,致HCO重吸收减少E.H+—Na+交换无改变而致HCO重吸收增加87.呼吸性碱中毒,经肾脏代偿调节后,血生化指标常为:CA.AB.SB.BB和CO C P均正常,BE正常B.AB.SB.BB和CO C P均升高,BE负值升高C.AB.SB.BB和CO C P均下降,BE负值增大D.AB.SB.BB和CO C P均下降,BE增大E. AB.SB.BB和CO C P均正常,BE减小88.饥饿引起的酸碱平衡紊乱属于:BA.乳酸酸中毒B.酮症酸中毒C.呼吸性酸中毒D.呼吸性碱中毒E.代谢性碱中毒89.严重腹泻常引起:CA.代谢性酸中毒B.代谢性碱中毒C.AG正常高氯血性酸中毒D.AG增大低氯性酸中毒E.呼吸性酸中毒90.阴离子间隙(AG)增高的代谢性酸中毒常见于:CA.腹泻B.使用乙酰唑胺利尿C.糖尿病D.肾小管性酸中毒E.大量输入生理盐水91.输入大量生理盐水引起:DA.AG增大,高氯性酸中毒B.AG正常,低氯性中毒C.AG增大,低氯血性酸中毒D.AG正常,高氯血性酸中毒E.AG降低性高氯性酸中毒92.应用人工呼吸机治疗呼吸衰竭和无自主呼吸的病人,若通气量过小,可导致:AA.呼吸性酸中毒B.呼吸性碱中毒C.代谢性酸中毒D.代谢性碱中毒E.呼吸性碱中毒合并代谢性酸中毒93.矿井塌陷引起通风不良可引起酸碱平衡紊乱的类型是:BA.呼吸性碱中毒B.呼吸性酸中毒C.代谢性酸中毒D.代谢性碱中毒E.代谢性酸中毒合并呼吸性碱中毒94.慢性呼吸性酸中毒时,机体代偿的主要方式是:AA.细胞外液缓冲B.呼吸代偿C.细胞内缓冲D.肾脏代偿E.骨骼代偿95.下列哪一项不是呼吸性酸中毒病因:EA.呼吸中枢及呼吸肌麻痹B.气道阻塞C.肺部疾患通气障碍D.肺泡弥散障碍E.通风不良96.慢性呼吸性酸中毒时,机体代偿的主要方式是:DA.细胞外液缓冲B.呼吸代偿C.细胞内缓冲D.肾脏代偿E.骨骼代偿97.酸中毒对心肌收缩性的影响是:CA.先增强后减弱B.先减弱后增强C.减弱D.增强E.不变[X型题:多选]98.阴离子间隙增大型正常血氯性酸中毒常见于:ACDA.酮症酸中毒患者B.晚期慢性肾功能衰竭患者C.乳酸酸中毒患者D.水杨酸中毒患者E.呕吐患者99.呼吸性碱中毒时机体的代谢调节包括:ACEA.细胞内外离子交换代偿增强,细胞外液氢离子升高,钾离子下降B.细胞内外离子交换代偿增强,细胞外液氢离子钾离子均升高C.经肾脏代偿调节,肾小管上皮细胞排氢离子减少D.呼吸运动加快,二氧化碳排出过多E.呼吸运动减弱二氧化碳排出减少100. 呼吸性酸中毒初期表现为:BDA.血浆中H2CO3浓度原发性降低B.血浆中H2CO3浓度原发性增高C.PaCO2>6.25kPa,AB<SBD.PaCO2>6.25kPa, AB>SBE. PaCO2<6.25kPa, AB>SB101. 代谢性酸中毒时,对中枢神经系统危害较大的因素是:ADA.pH下降B.高钾血症C.CO2升高D.r- 氨基丁酸增多E. r- 氨基丁酸减少102.低氯性碱中毒常见于:A.使用过多的速尿、利尿酸等利尿剂B.原发性醛固酮增多症C.Cushin氏综合症D.碳酸氢盐摄入过多E.纠正酸中毒时,乳酸钠溶液输注过量103.对氯反应性碱中毒时,下列哪些叙述是正确的:ACA.补充生理盐水可纠正低氯性代谢性的碱中毒B.补充生理盐水后不能纠正低氯性代谢性碱中毒C.速尿利尿剂应用过多可引起低氯性代谢性碱中毒D.严重呕吐可引起低氯性代谢性碱中毒E.碱性液体输注过量104.阴离子间隙(AG)正常型高氯性酸中毒见于:ABCDA.近端肾小管性酸中毒B.急性重症性肾功能衰竭C.慢性肾功能衰竭早期D.严重腹泻E.急性呼吸道阻塞105.高热时可引起酸碱平衡紊乱的类型有:BDA.代谢性酸中毒合并呼吸性酸中毒B.代谢性酸中毒合并呼吸性碱中毒C.代谢性碱中毒合并呼吸性碱中毒D.代谢性酸中毒E.代谢性碱中毒[B型题:单选]A.血液中缓冲系统的作用B.肺的调节作用C.肾的调节作用D.组织细胞的缓冲作用E.中枢神经的调节作用106.对排出挥发性酸性物质具有重要作用的是:BA.缓冲能力最持久B.缓冲能力强,但有一定限制C.缓冲作用发生最快D.调节能力最强E.缓冲能力最小,调节能力也小107.肺的调节作用:A108.细胞的缓冲作用:B109.肾的调节作用:D110.骨骼的缓冲:E111.血液的缓冲系统:CA.代谢性酸中毒B.代谢性碱中毒C.呼吸性酸中毒D.呼吸性碱中毒E.酸碱平衡正常112. HCO3-原发性减少见于:A113. HCO3-原发性增加见于:B114. HCO3-继发性增加见于:CA.代谢性酸中毒B.代谢性碱中毒C.呼吸性酸中毒D.呼吸性碱中毒E.酸碱平衡正常115.碳酸根离子原发性减少见于:A116.碳酸根离子原发性增加:B117.碳酸根离子继发性增加:CA.呼吸系统代偿B.细胞内、外液缓冲作用C.肾脏代偿D.骨骼缓冲作用E.心血管代偿作用118.急性呼吸性酸中毒时机体对酸碱平衡紊乱的主要代偿方式是:A119.慢性呼吸性酸中毒时机体对酸碱平衡紊乱的主要代偿方式是:C120.引起代谢性酸中毒合并代谢性碱中毒:CA.心跳,呼吸骤停B.慢性肺源性心脏病C.急性胃肠炎剧烈加腹泻D.发热呕吐121.引起代谢性酸中毒合并呼吸性碱中毒:[名词解释]122.代谢性酸中毒细胞外液氢离子浓度增加或碳酸氢根丢失引起的Ph下降,以血浆碳酸氢根原发性减少为特征。
酸碱平衡试题及答案高一

酸碱平衡试题及答案高一一、选择题(每题2分,共20分)1. 以下哪种物质属于酸?A. NaOHB. HClC. NaClD. H2O答案:B2. 酸碱反应的实质是:A. 离子交换B. 电子转移C. 质子转移D. 能量转换答案:C3. 根据酸碱理论,下列哪种物质是碱?A. H2SO4B. NH3C. Na2CO3D. HCl答案:C4. 强酸和强碱反应生成的产物是:A. 盐和水B. 酸和水C. 碱和水D. 盐和酸答案:A5. 溶液的pH值小于7,则该溶液是:A. 碱性B. 中性C. 酸性D. 无法判断答案:C6. 以下哪种物质是两性物质?A. NaOHB. H2SO4C. Al2O3D. HCl答案:C7. 以下哪种物质属于强碱?A. KOHB. NH3·H2OC. Ca(OH)2D. Na2CO3答案:A8. 以下哪种物质属于强酸?A. H2SO4B. CH3COOHC. H2CO3D. HClO答案:A9. 以下哪种物质属于弱酸?A. HClB. H2SO4C. HNO3D. CH3COOH答案:D10. 以下哪种物质属于弱碱?A. NaOHB. NH3C. Ca(OH)2D. KOH答案:B二、填空题(每空1分,共10分)1. 酸的定义是能够释放________(质子)的物质。
答案:H+2. 碱的定义是能够接受________(质子)的物质。
答案:H+3. 溶液的pH值等于7时,该溶液是________。
答案:中性4. 溶液的pH值大于7时,该溶液是________。
答案:碱性5. 溶液的pH值小于7时,该溶液是________。
答案:酸性6. 强酸和强碱反应生成的产物是________和________。
答案:盐;水7. 两性物质是指既能表现出酸性,又能表现出碱性的物质,例如________。
答案:Al2O38. 强酸是指在水溶液中完全电离的酸,例如________。
答案:HCl9. 强碱是指在水溶液中完全电离的碱,例如________。
03章酸碱平衡习题
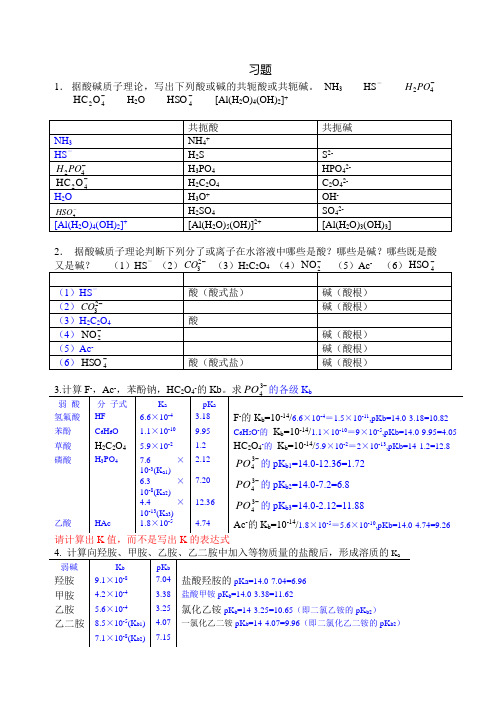
习题1. 据酸碱质子理论,写出下列酸或碱的共轭酸或共轭碱。
NH 3 HS --42PO H-42O HC H 2O -4HSO [Al(H 2O)4(OH)2]+2. 据酸碱质子理论判断下列分了或离子在水溶液中哪些是酸?哪些是碱?哪些既是酸--2-------3请计算出K 值,而不是写出K 的表达式5.人体正常血液pH 值在7.35~7.45之间变动,试计算此正常范围的[H +]是多少?因为:pH=-lg[H +], 所以pHH -+=10][ [H +]=10-7.35~10-7.45=4.5×10-8~3.55×10-86.向0.1mol/L 的磷酸溶液中加入固体NaOH (体积不变),至pH =7.0,求磷酸各型体的分布系数及平衡浓度。
3212121330][][][][a a a a a a K K K H K K H K H H +++=++++δ =13837832733737104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[----------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+=8×10-6760431081081.0][--⨯=⨯⨯==δc PO H32121213211][][][][a a a a a a a K K K H K K H K H H K +++=++++δ =138378327337273104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[106.7-----------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯=0.6130613.0613.01.0][142=⨯==-δc PO H32121213212][][][][a a a a a a a a K K K H K K H K H H K K +++=++++δ =138378327337783104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[103.6106.7------------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯⨯⨯=0.3870387.0387.01.0][224=⨯==-δc HPO321212133213][][][a a a a a a a a a K K K H K K H K H K K K +++=+++δ=1383783273371383104.4103.6106.7]10[103.6106.7]10[106.7]10[104.4103.6106.7------------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯⨯⨯⨯⨯=1.7×10-676334107.1107.11.0][---⨯=⨯⨯==δc PO7、计算0.2 mol ·dm -3H 2C 2O 4溶液中每种离子的浓度。
第九章 酸碱平衡 习题

第九章 酸碱平衡1根据酸碱质子理论,下列各离子中,既可作酸又可作碱的是………………………( )(A) H 3O +(B)CO 32- (C)NH 4+ (D) [Fe (H 2O)4(OH)2]2在反应BF 3 + NH 3−→−F 3BNH 3中,BF 3为…………………………………………( )(A) Arrhenius 碱(B) Br φnsted 酸 (C) Lewis 碱(D) Lewis 酸3 NH 4+的共轭碱是 …………………………………………………………………… ( )(A) OH -(B) NH 3 (C)NH 2- (D) NH 2-4不是共轭酸碱对的一组物质是………………………………………………………( )(A) NH 3、NH 2- (B) NaOH 、Na(C) OH -、O 2-(D) H 3O +、H 2O 5H PO 24-的共轭碱是 …………………………………………………………………( )(A) H 3PO 4 (B)HPO 42-(C)H PO 23-(D)PO 43- 6化学反应Ag(NH )32+ + Br -AgBr ↓ + 2NH 3按照路易斯酸碱理论,它应属于…………………………………………………………………………………………… ( )(A) 碱取代反应 (B) 置换反应(C) 酸取代反应 (D) 沉淀反应7根据软硬酸碱概念,下列物质属软酸的是……………………………………………( )(A) H (B) Ag (C) NH 3 (D) AsH 38根据酸碱的溶剂理论,在液态 SO 2 体系中的碱是…………………………………( )(A) SOCl 2 (B) Na 2SO 3 (C) Na 2SO 4 (D) PCl 39Fe 3+、Cl -、H +、SO 3 中能作路易斯酸的是 _______________,能作路易斯碱的是____________________。
酸碱平衡练习题

酸碱平衡练习题一、选择题(单选题)1.用电导实验测定强电解质溶液的解离度,总是达不到100%,其原因是(D)。
A、电解质本身不全部解离;B、电解质不纯;C、电解质与溶剂有作用;D、正负离子相互作用。
2.根据酸碱质子理论,下列叙述中正确的是(C)。
A、碱只能是阴离子;B、质子理论适用于水溶液和一切非水溶液;C、任何一种酸失去质子就成为碱;D、碱愈强,其共轭酸也愈强。
3.OH-的共轭酸是()。
A、H+;B、H2O;C、H3O+;D、O2-。
4.CH3OH的共轭酸是()。
A、H3O+;B、OH-;C、CH3OH2+;D、CH3O-。
5.H3O+的共轭碱是.()。
A、H+;B、OH-;C、H2O2;D、H2O。
6.根据酸碱质子理论,下列物质中可作为碱的是()。
A、NH4+;B、[Co(OH)(H2O)5]+;C、[Fe(H2O)6]3+;D、H3O+。
7.根据酸碱质子理论,对于反应HCl+NH3NH4++Cl-来说,下列各组物质都是酸的是()。
A、HCl和Cl-;B、HCl和NH4+;C、NH3和Cl-;D、NH3和NH4+。
8.根据酸碱电子理论,下列物质中,可作为Lewis碱的是()。
A、Fe3+;B、Cu2+;C、F-;D、SO3。
9.下列酸溶液浓度相同,其中c(H+)最大的是()。
A、H2S(aq);B、H2SO4(aq);C、H3PO4(aq);D、H2C2O4(aq)。
10.SbCl3水解产物为.()。
A、Sb(OH)3;B、SbOCl;C、Sb2O3;D、Sb(OH)2Cl。
11.BiCl3水解产物为()。
A、Bi2O3;B、Bi(OH)3;C、BiOCl;D、Bi(OH)Cl2。
12.SnCl2水解产物为()。
A、SnOCl;B、Sn(OH)2;C、SnO;D、Sn(OH)Cl。
13.已知:K(HCN)=6.2×10-10,则NaCN的标准水解常数为()。
A、1.6×10-6;B、6.2×10-10;C、6.2×10-24;D、1.6×10-5。
酸碱平衡习题

酸碱平衡练习题一。
是非题1.由于乙酸的解离平衡常数)()()(HAc c Ac c H c K a -+=θ,所以只要改变乙酸的起始浓度即c(HAc ),a K θ必随之改变。
2。
缓冲溶液的缓冲能力一般认为在pH=Pka ⊕±1范围内。
3。
稀释可以使醋酸的电离度增大,因而可使其酸性增强. 4。
溶液的酸度越高,其pH 值就越大。
5.在共轭酸碱体系中,酸、碱的浓度越大,则其缓冲能力越强。
6。
溶液的酸度越高,其pH 值就越小。
7.根据酸碱质子理论,强酸反应后变成弱酸。
8.在浓度均为0.01 mol ·L -1的HCl ,H 2SO 4,NaOH 和NH 4Ac 四种水溶液中,H + 和OH -离子浓度的乘积均相等。
9。
将氨水的浓度稀释一倍,溶液中OH — 离子浓度就减小到原来的一半。
,可以组成缓冲溶液.11.缓冲溶液中,当总浓度一定时,则c (A —)/c(HA )比值越大,缓冲能力也就越大。
12。
某些盐类的水溶液常呈现酸碱性,可以用来代替酸碱使用. 13。
由质子理论对酸碱的定义可知, NaHCO 3只是一种碱。
,可以组成缓冲溶液。
二.选择题1.某弱酸HA 的K a θ=1×10-5,则其0。
1 mol·L -1溶液的pH 值为 A. 1.0 B.2.0 C. 3。
0 D.3.52.有下列水溶液:(1)0.01 mol ·L —1CH 3COOH ;(2)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1HCl 溶液混合;(3)0。
01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L —1NaOH 溶液混合; (4)0。
01 mol ·L —1CH 3COOH 溶液和等体积0。
01mol ·L—1NaAc 溶液混合。
则它们的pH 值由大到小的正确次序是A.(1)〉(2)〉(3)〉(4) B 。
高二化学酸碱平衡专项练习题及答案

高二化学酸碱平衡专项练习题及答案一、选择题1. 下列酸溶液中,酸性最强的是:A. H2SO4B.H2CO3C.HClD.HF2. 弱电解质的电离程度较低,是因为:A. 共价键较强B. 局域化电子较多C. 极性分子较少D. 分子间作用力较强3. 当溴离子浓度增大时,下列变化中,与氢氧根离子浓度变化相反的是:A. pH值增大B. 溶液酸性增强C. 溶液呈碱性D. 溶液电导率变小4. 酸溶液和碱溶液发生中和反应时,生成的产物是:A. 氨B. 醋酸C. 水D. 氢气5. 酸性溶液的pH值是:A. 大于7B. 等于7C. 小于7D. 可以小于或大于76. 在水中加入醋酸会影响水的pH值,这是因为醋酸具有:A. 高电离能B. 低电离能C. 高溶解度D. 低溶解度7. 下列物质中,具有酸性的是:A. KClB. Na2SO4C. NaClOD. NaNO28. 酸碱中和反应的特点是:A. 氧化还原反应B. 离子交换反应C. 酸溶液与碱溶液反应D. 温度变化明显9. 在酸碱中和反应中,酸和碱的组成:A. 总是H+和OH-B. 可能含有H+或OH-C. 总是H3O+和OH-D. 通常不含H+和OH-10. NaOH和HCl溶液发生中和反应时,生成的盐是:A. NaClOB. NaClO2C. NaClO3D. NaCl二、解答题1. 写出下列酸碱平衡方程式,并标明反应物和生成物:i) HClO4 + H2O →ii) NH3 + H2O →2. 根据酸碱理论回答问题:i) Na2CO3溶液为什么能碱性?ii) HClO4为何不是酸性最强的酸?三、计算题1. 已知HCl溶液的质量浓度为0.1 mol/L,若取10 mL的HCl溶液和10 mL的NaOH溶液进行中和反应,请计算所需要的NaOH溶液的质量浓度。
四、实验题设计一个实验来测试一种酸性溶液的pH值,并写出实验步骤及原理。
答案:一、选择题答案1. C2. B3. A4. C5. C6. B7. C8. C9. B 10. D二、解答题答案1.i) HClO4 + H2O → H3O+ + ClO4-ii) NH3 + H2O → NH4+ + OH-2.i) Na2CO3溶液能碱性是因为其中含有氧化态为+2的离子Na+,它与水反应生成氢氧根离子OH-,使溶液呈碱性。
化学酸碱平衡练习题

化学酸碱平衡练习题一、选择题1. 在下列酸性溶液中,哪个溶液的酸性最强?A. pH = 3B. pH = 4C. pH = 5D. pH = 62. 高碱度溶液的pOH值为13,该溶液的pH值为多少?A. 1B. 7C. 11D. 133. 下列物质中,哪个物质是强酸?A. HClO4B. HCNC. H2SO3D. HF4. 在以下溶液中,哪个溶液是弱碱性溶液?A. pOH = 2B. pOH = 7C. pOH = 10D. pOH = 125. 酸性溶液的pH值为2,该溶液的[H+]浓度是多少?A. 10^2 MB. 10^4 MC. 10^10 MD. 10^12 M二、填空题1. 在酸性溶液中,[H+]的浓度是(填上具体数值)。
2. 在碱性溶液中,[OH-]的浓度是(填上具体数值)。
3. 强碱性溶液的pOH值为(填上具体数值)。
4. 若溶液的pOH值为5,则该溶液的酸性/碱性为(填上酸或碱)。
5. 当[H+]浓度为1x10^-8 M时,该溶液的pH值为(填上具体数值)。
三、计算题1. 某溶液的pOH值为9.6,请计算该溶液的pH值和[H+]浓度。
2. 高碱度溶液的pH值为12.2,请计算该溶液的[H+]浓度和[OH-]浓度。
四、解析题1. 请解释酸性溶液和碱性溶液的区别及特征。
2. pH和pOH的计算公式是什么?请列举pH和pOH分别为5和9的溶液中[H+]和[OH-]的浓度公式。
3. 请解释溶液中[H+]浓度和[pH]值的关系,并说明pH值越小,溶液的酸性强度如何变化。
4. 酸碱中和反应的化学方程式是什么?以HCl和NaOH为例,请写出完整的化学方程式。
五、应用题1. 用酸碱指示剂制备一个酸性溶液,要求pH值为3,请问应选择哪个酸碱指示剂,并根据选择理由解释其原理。
2. 通过调整NaOH溶液的浓度,制备一个弱碱性溶液,要求pOH 值为9,请计算所需的NaOH溶液浓度应为多少?3. 假设有一种溶液,其pH值为6.2,你认为这是酸性溶液还是碱性溶液?给出你的理由。
酸碱平衡习题答案

第三章 酸碱平衡习题一、选择题1、pH=1的溶液是pH=4的溶液的[H+]的倍数是〔 C 〕A.3倍B.4倍C. 1000倍D. 300倍2、某弱碱的b θK 10-9,那么其0.1 mol L -1水溶液的pH 为〔C 〕A. 3.0B. 5.0C. 9.0D.3、某缓冲溶液含有等浓度的HA 与A -,假设A - 的b θK 10-10,那么该缓冲溶液的 pH为〔 B 〕A. 10.0B. 4.0C. 7.0D.4、以下物质中是弱电解质的是〔D 〕A. NaAcB. NH 4ClC. KNO 3D. H 2S 5、以下物质的水溶液呈中性的是〔A 〕A. NaClB. K 2CO 3C. Al 2(SO 4)3D. (NH 4)2SO 4 6、0.1 m ol·L -1 H 2SO 4溶液中H + 浓度为〔B 〕A. 0.1 mol·L -1B. 0.2 mol·L -1C. 0.3 mol·L -1D. 0.4 mol·L -17、在 H 2CO 3 H + + HCO 3- 平衡体系中,能使电离平衡向左移动的条件是〔B 〕 A. 加NaOH B. 加盐酸 C. 加水 D. 升高温度8、在含有 mol·L -1 HCl 与 mol·L -1 CH 3COOH 溶液中,c (H +)同c (Ac -)关系正确的选项是〔 C 〕A. c (H +) = c (Ac -)B. c (Ac -) > c (H +)C. c (H +)>> c (Ac -)D. 无法知道9、某二元弱酸H 2A 的a1θK = 6 10-8,a2θK = 8 10-14,假设其浓度为0.05mol·L -1,那么溶液中A 2- 浓度约为〔B 〕A. 6 10-8 mol·L -1B.8 10-14 mol·L -1C. 3 10-8 mol·L-1D.4 10-14mol·L-110、以下说法正确的〔C〕A. 但凡物质都能承受质子B. 中性溶液的C. 但凡能给出质子的物质都是酸D. 酸与共轭碱只是所含质子数的不同二、判断题1、强酸性水溶液中不含OH-,强碱性水溶液中不含H+。
酸碱平衡练习题

酸碱平衡练习题一.是非题1.由于乙酸的解离平衡常数)()()(HAc c Ac c H c K a -+=θ,所以只要改变乙酸的起始浓度即c(HAc),aK θ必随之改变。
2.缓冲溶液的缓冲能力一般认为在pH=Pka ⊕±1范围内。
3.稀释可以使醋酸的电离度增大,因而可使其酸性增强.4.溶液的酸度越高,其pH 值就越大。
5.在共轭酸碱体系中,酸、碱的浓度越大,则其缓冲能力越强。
6.溶液的酸度越高,其pH 值就越小。
7.根据酸碱质子理论,强酸反应后变成弱酸。
8.在浓度均为0.01 mol ·L -1的HCl ,H 2SO 4,NaOH 和NH 4Ac 四种水溶液中,H + 和OH -离子浓度的乘积均相等。
9.将氨水的浓度稀释一倍,溶液中OH - 离子浓度就减小到原来的一半。
10.0.2mol.L -1HAc 和0.1mol.L -1NaOH 等体积混合,可以组成缓冲溶液。
11.缓冲溶液中,当总浓度一定时,则c(A -)/c(HA)比值越大,缓冲能力也就越大。
12.某些盐类的水溶液常呈现酸碱性,可以用来代替酸碱使用。
13.由质子理论对酸碱的定义可知, NaHCO 3只是一种碱。
14.0.2mol.L -1NaHCO 3和0.1mol.L -1NaOH 等体积混合,可以组成缓冲溶液。
二.选择题1.某弱酸HA 的K a θ=1×10-5,则其0.1 mol·L -1溶液的pH 值为 A. 1.0 B.2.0 C.3.0 D.3.52.有下列水溶液:(1)0.01 mol ·L -1CH 3COOH ;(2)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1HCl 溶液混合;(3)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1NaOH 溶液混合; (4)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01mol ·L -1NaAc 溶液混合。
酸碱平衡习题

酸碱平衡练习题一.是非题1.由于乙酸的解离平衡常数)()()(HAc c Ac c H c K a -+=θ,所以只要改变乙酸的起始浓度即c(HAc),a K θ必随之改变。
2.缓冲溶液的缓冲能力一般认为在pH=Pka ⊕±1范围内。
3.稀释可以使醋酸的电离度增大,因而可使其酸性增强.4.溶液的酸度越高,其pH 值就越大。
5.在共轭酸碱体系中,酸、碱的浓度越大,则其缓冲能力越强。
6.溶液的酸度越高,其pH 值就越小。
7.根据酸碱质子理论,强酸反应后变成弱酸。
8.在浓度均为0.01 mol ·L -1的HCl ,H 2SO 4,NaOH 和NH 4Ac 四种水溶液中,H + 和OH -离子浓度的乘积均相等。
9.将氨水的浓度稀释一倍,溶液中OH - 离子浓度就减小到原来的一半。
,可以组成缓冲溶液。
11.缓冲溶液中,当总浓度一定时,则c(A -)/c(HA)比值越大,缓冲能力也就越大。
12.某些盐类的水溶液常呈现酸碱性,可以用来代替酸碱使用。
13.由质子理论对酸碱的定义可知, NaHCO 3只是一种碱。
,可以组成缓冲溶液。
二.选择题1.某弱酸HA 的K a θ=1×10-5,则其0.1 mol·L -1溶液的pH 值为A. 1.0B. 2.0C. 3.0D.3.52.有下列水溶液:(1)0.01 mol ·L -1CH 3COOH ;(2)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1HCl 溶液混合;(3)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1NaOH 溶液混合; (4)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01mol ·L -1NaAc 溶液混合。
则它们的pH 值由大到小的正确次序是 A.(1)>(2)>(3)>(4) B.(1)>(3)>(2)>(4) C.(4)>(3)>(2)>(1) D.(3)>(4)>(1)>(2)3.下列离子中只能作碱的是( )。
酸碱平衡复习题

肾重吸收 HCO 3-opH4. 机体酸碱平衡的维持是靠 的调节来完成的行缓冲的最主要缓冲系统是10. 颈动脉体和主动脉体的外周化学感受器可感受的变化刺激 , 反射性影响呼吸中枢的兴奋性。
11. 肾排 酸保 碱维 持机体 酸碱 平衡 的三 种机制 是12. 肾上腺皮质功能亢进时 ,肾重吸收 HCO 3-1. 正常人动脉血 pH 的变动范围是, 细胞内 pH 比细胞外液2. 血 液 PH 的 正常 取 决 于的浓度比为3. 体内的酸性物质可分为 两类。
5. 体液缓冲系统主要是由缓冲对、 缓冲对、缓冲对和缓冲对组成的。
6. 对固定酸进行缓冲的最主要缓冲系统是 对碳酸进7. 排泄固定酸的器官是 , 排出挥发酸的器官是8. 碳酸氢盐缓冲系统主要在发挥缓冲作用 ,磷酸盐缓冲系统主要在发挥缓冲作用。
9. 肺通过调节血浆的浓度来维持机体的酸碱平衡。
; 血钾增加时 ,13.肾小管腔内PH 愈低,NH 3的分泌14. 在 疾病状 态 下, SB 与 AB 可以不 相 等 。
SB>AB 表示 有,SB<AB 表示有15.BE 的正常值是( 0±3)mml/L 。
当 BE>3mml/L 时,病人可能16. 代谢性酸中毒时,血浆 [HCO 3-] 原发性 17. 失 代 偿 性 代 谢 性 酸 中 毒 时,血[K +]182008 年 6 月 1 日 星期日 7:18 PM 固定酸增多而引起的 AG 增21. 代谢性碱中毒可造成造成中枢神经系统的功能成心肌代谢紊乱外 ,还与性酸中毒时 ,机体的主要代偿措施是有原发性 或代偿后的, 当 BE<-3mml/L 时 , 病人可能有原发性或代偿后的,[H 2CO 3] 代偿pH,SB ,BB ,BE ,PaCO大性代谢性酸中毒的原因是酸中毒和酸中毒。
20. 酸中毒常伴有血钾; 碱中毒常伴有血钾。
22. 代谢性酸中毒可引起心肌收缩力其发生机制除造有关。
酸碱平衡诊断试题及答案

酸碱平衡诊断试题及答案一、选择题1. 人体血浆中最重要的缓冲对是:A. Na+/HCO3-B. K+/HPO42-C. Ca2+/HPO42-D. Mg2+/HCO3-答案:A2. 下列哪项不是代谢性酸中毒的原因?A. 腹泻B. 糖尿病酮症酸中毒C. 乳酸酸中毒D. 长期碱摄入过多答案:D3. 呼吸性碱中毒的常见原因包括:A. 慢性阻塞性肺疾病(COPD)B. 肺栓塞C. 肝硬化D. 所有以上选项答案:D二、填空题4. 血气分析中的pH值主要反映的是________(填“代谢性”或“呼吸性”)酸碱平衡状态。
答案:代谢性5. 标准温度下(37°C),人体血浆中HCO3-的浓度正常值范围是_________mmol/L。
答案:22-28三、简答题6. 简述如何通过血气分析结果判断患者的酸碱平衡状态。
答案:通过血气分析中的pH值、PaCO2(二氧化碳分压)和HCO3-(碳酸氢盐)的浓度,可以判断患者的酸碱平衡状态。
pH值小于7.35通常表示酸中毒,而pH值大于7.45则表示碱中毒。
PaCO2的升高通常与呼吸性酸中毒有关,而PaCO2的降低则与呼吸性碱中毒有关。
HCO3-的浓度变化则反映了代谢性酸碱平衡的变化。
7. 描述代谢性酸中毒的临床表现。
答案:代谢性酸中毒的临床表现可能包括呼吸加深加快(Kussmaul呼吸)、疲劳、头痛、意识模糊、甚至昏迷。
在严重的情况下,患者可能会出现心律失常、休克和多器官功能衰竭。
四、计算题8. 如果一个患者的血气分析结果显示pH值为7.48,PaCO2为35mmHg,HCO3-为28mmol/L,请问该患者的酸碱平衡状态是什么?答案:该患者的pH值高于正常值,表明存在碱中毒。
然而,PaCO2略低于正常值,表明可能存在呼吸性碱中毒的影响。
但是,HCO3-的浓度在正常范围内,这意味着没有代谢性碱中毒或酸中毒。
因此,该患者的酸碱平衡状态主要是由于呼吸性碱中毒。
五、论述题9. 论述在临床治疗中,如何纠正代谢性酸中毒。
无机化学练习题(含答案)第4章酸碱平衡

第4章酸碱平衡4-1: 对于下面两个反应,指出其中的酸和碱,并说明各个过程是配合物的生成过程还是酸碱置换过程。
(a) SO3 + H2SO4→H2S2O7(b) H2S2O7(H2SO4·SO3) + H2O→H2SO4 + H2SO4答:(a) 路易斯酸SO3, 碱H2SO4, 配合物的生成过程;(b) 两个碱: H2O 和H2SO4·SO3 中的H2SO4, 置换过程。
4-2: 给出用HF 腐蚀SiO2 玻璃的反应式,并用路易斯和布朗斯特酸碱理论解释SiO2+ 4HF = SiF4+ 2H2O, 其中,SiO2 和SiF4 为碱,HF 和H2O 为酸。
4-3: 苯甲酸(可用弱酸的通式 HA 表示,相对分子质量122)的酸常数Ka= 6.4×10-5,试求:(1)中和1.22g苯甲酸需用0.4 mol·L-1的 NaOH 溶液多少毫升?(2)求其共轭碱的碱常数Kb。
(3)已知苯甲酸在水中的溶解度为2.06 g·L-1,求饱和溶液的pH 。
4-4: 将下列路易斯酸按照最强酸到最强碱的顺序排序:(a) BF3 , BCl3 , BBr3 ; (b) SiF4 , SiCl4 , SiBr4 , SiI4 ; (c) BeCl2 , BCl3 .请解释。
答:路易斯酸性是表示物种接受电子对能力的强弱。
在上述(a)、(b)两卤化物序列中,卤素原子的电负性越大,中心原子上电荷密度越小,接受外来电子对的能力应该越强,序列(b)符合这种情况。
序列(a)则相反,原因在于BX3 中形成了π键,而B 原子的体积较小,形成的π键比较强,同时卤素原子的体积按F,Cl,Br 的顺序增大,形成的π键依次减弱的缘故。
4-5: 计算下列各种溶液的 pH :(1)10mL 5.0×10-3 mol·L-1 的 NaOH 。
(2)10mL 0.40 mol·L-1 HCl 与 10mL 0.10 mol·L-1 NaOH 的混合溶液。
酸碱平衡习题

c(HAc) , K a 必随之改变。
2. 缓冲溶液的缓冲能力一般认为在 pH=Pka ±1范围内。
3. 稀释可以使醋酸的电离度增大,因而可使其酸性增强4. 溶液的酸度越高,其pH 值就越大。
5. 在共轭酸碱体系中,酸、碱的浓度越大,则其缓冲能力越强。
6. 溶液的酸度越高,其pH 值就越小。
7. 根据酸碱质子理论,强酸反应后变成弱酸。
8. 在浓度均为mol • L -1的HCI , HSO, NaOH 和NHAc 四种水溶液中,rf 和OF 离子浓度的乘积均相等。
,可以组成缓冲溶液。
.选择题有下列水溶液: ⑴mol • L -1CHCOOH ⑵ mol •L -1ChCOO 溶液和等体积 mol • L -1HCI 溶液混合;(3) mol • L-1CHCOOH 溶液和等体积mol •匚1NaOI 溶液混合; ⑷mol •匚tHCOO 溶液和等体 积-匚1NaA (溶液混合。
贝尼们的pHfi 由大到小的正确次序是A.(1)>(2)>(3)>(4)B.(1)>(3)>(2)>(4)C.(4)>(3)>(2)>(1)D.(3)>(4)>(1)>(2) 3. 下列离子中只能作碱的是( A. HO B . HCO C . S 2-D . [Fe(H 2O)6].是非题酸碱平衡练习题1.由于乙酸的解离平衡常数K 聲驕),所以只要改变乙酸的起始浓度即9.将氨水的浓度稀释一倍,溶液中 0H 离子浓度就减小到原来的一半。
,可以组成缓冲溶液。
11. 缓冲溶液中,当总浓度一定则c(A -)/c(HA)比值越大,缓冲能力也就越大。
12.某些盐类的水溶液常呈现酸碱性 ,可以用来代替酸碱使用。
13.由质子理论对酸碱的定义可知,NaHCO 只是一种碱。
1.某弱酸HA 的K a= 1X 10-5,则其 mol •L -1溶液的pH 值为A. 1.0B. 2.0C.A.相等B. 高2倍C. 高10倍D. 高100倍4. 在饱和溶液中加入 (H 2S) ~ mol • L-15. 按质子理论,下列物质中何者不具有两性 A. HCQ -6.把 100 cm 3 mol - dm HCN (K a = 10-1?)溶液稀释到 400 cm 3,[H +]约为原 来的1 1A. -B. 1C. 2247. 下列各组混合液中,10.将pH=与pH=的两种溶液以等体积混合后,溶液的pH 值为 对反应HPO -+ H 2O HkPO +OH 来说12. 在纯水中加入一些酸,则溶液中 A. c(H +) • c(OH)的乘积增大mol • L -1HCI 则下列式子错误的是 (HS -)<c(H +) +2-(H)=2c(S )D.(H+)= j 0.10 Ka1 H 2S8.根据酸碱质子理论, A.任何一种酸失去质子后就成为碱 可以得出() B. 碱不可能是阳离子 C.碱可能是电中性的分子.D.同一物质不可能既作为酸又作为碱的解离常数表达式为 c H c CN Ka~c HCN~,下列那种说法是正确的A.加HCl , K a变大B. 加NaCN K a变大C.加HCN Ka 变小D. 加HO, Ka 不变可作为缓冲溶液使用的是 ()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HAc溶液 溶液〔 HAc溶液 溶液〔 的两倍。 4.0.2mol.L-1HAc溶液〔H+〕是0.1mol.L-1HAc溶液〔H+〕的两倍。 (× )
结束
判断题
7.强酸的共轭碱一般都很弱。 7.强酸的共轭碱一般都很弱。 强酸的共轭碱一般都很弱 (√ ) 8.酸性缓冲液(HAc-NaAc)可以抵抗少量外来酸对pH的影响, 8.酸性缓冲液(HAc-NaAc)可以抵抗少量外来酸对pH的影响, 酸性缓冲液 pH的影响 × 而不能抵抗少量外来碱的影响。 而不能抵抗少量外来碱的影响。 ( ) 9.纯水中 纯水中Kw=c(H c(OH (25℃),加入强酸后因H+ H+离 9.纯水中Kw=c(H+)·c(OH-)=10-14(25℃),加入强酸后因H+离 子浓度大大增加, Kw也大大增加 也大大增加。 子浓度大大增加,故Kw也大大增加。 (×) 10.在 溶液里通入CO 便可得到一种缓冲液. 10.在NaHCO3溶液里通入CO2,便可得到一种缓冲液. (
√
) )
11.pH值相等的缓冲液,未必具有相同的缓冲容量。 11.pH值相等的缓冲液,未必具有相同的缓冲容量。 ( √ 值相等的缓冲液 12.将氨水和HCl混合,不论两者比例如何, 12.将氨水和HCl混合,不论两者比例如何, 将氨水和HCl混合 一定不可能组成缓冲溶液。 一定不可能组成缓冲溶液。
(× )
结束
简答题
2.简述HAc—NaAc缓冲溶液的缓冲原理。 答:在HAc—NaAc缓冲溶液中:由于存在同离子效应, [HAc]、[Ac-]都很大。在此溶液中, 加少量的强酸时:Ac-+ H+ ≒ HAc ; 加少量的强碱时:HAc + OH— ≒H2O+ Ac均生成弱电解质,对溶液体系pH值影响很小,因此体系 的pH值能在一定范围维持基本不变。
结束
填空题 8.在氨溶液中,加入NH Cl则氨的 则氨的α 8.在氨溶液中,加入NH4Cl则氨的α 减小,溶液的 在氨溶液中 同离子效应 pH值 pH值 , 。 减小 这一作用称为 9.对于二元弱酸H 其逐级解离常数为K 9.对于二元弱酸H2A,其逐级解离常数为K1 、K2, 对于二元弱酸 很小时,那么c(A 当K2很小时,那么c(A2-)= 。 K2 10.质子酸碱理论认为:H2O既是酸又是碱, 10.质子酸碱理论认为:H2O既是酸又是碱,其共轭 质子酸碱理论认为 既是酸又是碱 H3O+ ,其共轭碱是 酸是 OH- 。 11.已知CH COONa的水解常数是 =7.69× 的水解常数是K 11.已知CH3CH2CH2COONa的水解常数是Kh=7.69×10-10,它 已知 , 的共轭酸是 CH3CH2CH2COOH 该酸的Ka Ka值应等于 该酸的Ka值应等于 。 1.3×10-5 ×
− 2− 2 4 4
结束
Happy Study!!!
结束
结束
选择题
11.某混合液中含有0.2MNaHCO3和0.1MNa2CO3,其PH值应取( B 11.某混合液中含有 PH值应取 A:Pka2+㏒2 B:Pka2 -㏒2 C:Pka1+㏒2 D:Pka1-㏒2
)
12.为了保证某工作液的PH值为4--5 应选用( 12.为了保证某工作液的PH值为4--5,应选用( C 为了保证某工作液的PH值为 配制缓冲溶液。 配制缓冲溶液。 A:Na2CO3+NaHCO3 C:HAC-NaAc HAC-
HCN溶液中 加少量固体NaCN 溶液中, NaCN后 2. HCN溶液中,加少量固体NaCN后,则( A ) A: HCN 酸度下降 电离度升高
结束
选择题
4.等量的酸和碱中和,得到的pH值应是:( 4.等量的酸和碱中和,得到的pH值应是:( D )。 等量的酸和碱中和 pH值应是 A. 呈酸性 B. 呈碱性 C. 呈中性 D. 视酸碱相对强弱而定 5.NaAc溶液被稀释后 溶液被稀释后:( 5.NaAc溶液被稀释后:( A )。 • pH值上升了 水解度增大 B. pH值上升了 C. OH-浓度增高 D. 前三者都对 6.在氨溶液中加入氢氧化钠, 6.在氨溶液中加入氢氧化钠,使:( B )。 在氨溶液中加入氢氧化钠 溶液OH A. 溶液OH-浓度变小 B. NH3的Kb变小 pH值变小 C. NH3的α降低 D. pH值变小 7.可逆反应HCO 各物质中质子酸是: 7.可逆反应HCO3-+OH- → CO32-+H2O 各物质中质子酸是: 可逆反应 ( B ) A. HCO3-和CO32- B. HCO3-和H2O D. OH-和CO32- C. H2O和OH-
结束
课后习题 1.计算下列混合溶液的pH值。 (1)20ml 0.1mol·L-1HCl与20ml 0.1mol·L-1NaOH (2)20ml 0.10mol·L-1HCl加20ml 0.10mol·L-1NH3·H2O (3)20ml 0.10mol·L-1HAc加20ml 0.10mol·L-1NaOH 2.配制pH为5.00的缓冲溶液,需称取多少克结晶乙酸钠 (NaAc·3H2O,摩尔质量为136g·mol-1)溶于300ml0.50 mol·L-1 HAc中(忽略体积变化)? 3.维持人体血液、细胞液pH的稳定,H2PO4--HPO42- 缓冲体 系起了重要作用。(1)解释为什么该缓冲体系能起到缓冲 作用?(2)溶液的缓冲范围是多少? C H PO = 0.050 mol⋅ L−1 , C HPO = 0.15 mol⋅ L−1 时缓冲溶液 (3)当 的pH是多少? 4.某一元弱碱(MOH)的分子量为125,在298K时取0.500g 溶于50.0ml水中,测得溶液的pH=11.30,试计算MOH的Kb 值。
Ka. Kb = Kw
。
6. NH3 + H2O≒NH4++OH-,用质子理论分析,其中属 用质子理论分析, 质子酸的为_________, 质子酸的为_________,属质子碱的为————— -。. _________ H2O .NH4+ NH3 .OH 7.同一弱电介质,溶液越稀,电离度_______. 7.同一弱电介质,溶液越稀,电离度_______. 相同 同一弱电介质 越 大 浓度的不同弱电介质,电离常数越大,电离度_____ _____。 浓度的不同弱电介质,电离常数越大,电离度_____。 越 大
)缓冲对
B:NH3.H2O- NH4Cl D: D:NaH2PO4- Na2HPO4
结束
判断题
1.在一定温度下,改变溶液的PH值 水的离子积不变( 1.在一定温度下,改变溶液的PH值,水的离子积不变( √ ) 在一定温度下 PH 2.在 溶液中, 2.在0.1mol/LH2S溶液中,[H+]=2[S2-]。 是缓冲溶液的缓冲对。 3.H2CO3——Na2CO3是缓冲溶液的缓冲对。 Na ( ×) (× )
结束
选择题
8.下列能做缓冲溶液的是( 8.下列能做缓冲溶液的是( A )。 下列能做缓冲溶液的是 mol·L HAc和 mol·L NaOH混合液 A. 60mL 0.1 mol L-1HAc和30mL 0.1 mol L-1NaOH混合液 B. 60mL 0.1 mol·L-1HAc和30mL 0.2 mol·L-1NaOH混合液 mol L HAc和 mol L NaOH混合液 mol·L HAc和 mol·L HCl混合液 C. 60mL 0.1 mol L-1HAc和30mL 0.1 mol L-1HCl混合液 mol·L NaCl和 mol·L Cl混合液 D. 60mL 0.1 mol L-1NaCl和30mL 0.1 mol L-1NH4Cl混合液 9.在氨水中加入NH Cl后 pH值变化是 值变化是:( 9.在氨水中加入NH4Cl后,NH3的α和pH值变化是:( D ) 在氨水中加入 A. α和pH值都增大 α和pH值都增大 B. α减小,pH值增大 α减小,pH值增大 减小 α增大 pH值变小 增大, pH值都减小 C. α增大,pH值变小 D. α 、pH值都减小 10.弱酸的电离常数值由下列哪项决定?( 10.弱酸的电离常数值由下列哪项决定?( D ) 弱酸的电离常数值由下列哪项决定 A. 溶液的浓度 B. 酸的电离度 C. 酸分子中含氢数 D 酸的本质和溶液温度
盐效应使弱电解质的电离度 电解质的电离度 增 _大 ,盐效应使弱电解质的电离度 _
2 3
4.在 的缓冲溶液中,抗酸成份是__________, 4.在NaHCO3- Na2CO3的缓冲溶液中,抗酸成份是__________, Na CO 抗碱成份是 NaHCO3 。
结束
填空题 5.根据酸碱质子理论,共轭酸碱对的酸常数Ka和碱 5.根据酸碱质子理论,共轭酸碱对的酸常数Ka和碱 根据酸碱质子理论 Ka 度常数K 度常数Kb之间的关系为
结束
选择题
1.为了保证某工作液PH值为9 应选用( 1.为了保证某工作液PH值为9,应选用( B )缓冲对配制 为了保证某工作液PH值为 缓冲溶液。 缓冲溶液。
A:Na2CO3 –NaHCO3 NaHCO C: HAC –NaAc NaAc pKa2θ=10.25 pKaθ=4.75 B: B:NH3·H2O – NH4CI H D: D:NaH2PO4 – Na2HPO4 pKbθ=4.75 pKa2θ=7.20
课件制作: 课件制作:应用化学教研室
酸 碱 平 衡
结束
填空题
1.根据酸碱质子理论, 1.根据酸碱质子理论,HAc的共轭碱为 Ac根据酸碱质子理论 _ 的共轭酸_____ _____。 NH3的共轭酸_____。 NH +
4
2.酸碱电离理论认为酸碱中和反应的实质是 2.酸碱电离理论认为酸碱中和反应的实质是 H+ + OH- == H2O 。 酸碱质子理论认为酸碱中和反应的实质是______________。 酸碱质子理论认为酸碱中和反应的实质是______________。 ______________ 质子的传递反应 3.同离子效应使弱电解质的电离度 3.同离子效应使弱电解质的电离度 减 稍微增大 小 ,稀释溶液使弱
