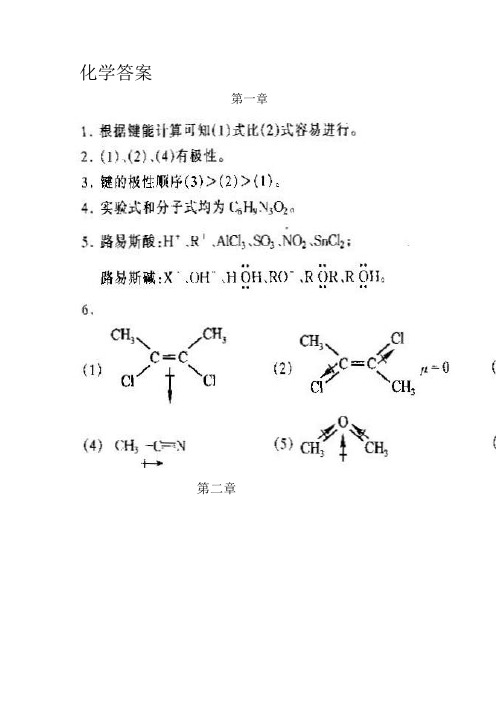
新大学化学1--3章答案
(完整版)大学化学课后习题1,2,3答案

D.Δf H mΘ=0,Δf G mΘ=0,S mΘ=05. 某反应在高温时能自发进行,低温时不能自发进行,则其( B )A.ΔH>0,ΔS<0;B. ΔH>0,ΔS>0C.ΔH<0,ΔS<0;D.ΔH<0,ΔS>06.1mol气态化合物AB和1mol气态化合物CD按下式反应:AB(g)+CD(g)→AD(g)+BC(g),平衡时,每一种反应物AB 和CD都有3/4mol转化为AD和BC,但是体积没有变化,则反应平衡常数为( B )A.16B.9C.1/9D.16/97.400℃时,反应3H2(g)+N2(g)→2NH3(g)的K673Θ=1.66×10-4。
同温同压下,3/2H2(g) +1/2N2(g)→NH3(g)的Δr G mΘ为( D )KJ.mol-1。
A.-10.57 B.10.57 C.-24.35 D.24.358. 已知下列反应的标准Gibbs函数和标准平衡常数:(1)C(s)+O2(g) → CO2(g) ΔG1Θ,K1Θ(2)CO2(g) → CO(g)+1/2O2(g) ΔG2Θ,K2Θ(3)C(s)+1/2O2(g) → CO(g) ΔG3Θ,K3Θ则它的ΔGΘ,KΘ之间的关系分别是( A )A.ΔG3Θ=ΔG1Θ+ΔG2ΘB.ΔG3Θ=ΔG1Θ×ΔG2ΘC.K3Θ= K1Θ- K2ΘD.K3Θ= K1Θ+ K2Θ9. 若反应A+B → C对A,B来说都是一级反应,下列说法正确的是( C )A.该反应是一级反应B.该反应速率常数的单位可以用min-1C.两种反应物中,无论哪一种物质的浓度增加1倍,都将使反应速率增加一倍D.两反应物的浓度同时减半时,其反应速率也相应减半.10. 对一个化学反应来说,下列叙述正确的是( C )A.ΔGΘ越小,反应速率越快B.ΔHΘ越小,反应速率越快C.活化能越小,反应速率越快D.活化能越大,反应速率越快11. 化学反应中,加入催化剂的作用是( C )A.促使反应正向进行B.增加反应活化能C.改变反应途径D.增加反应平衡常数12. 升高温度,反应速率常数增加的主要原因是( A )A.活化分子百分数增加B.活化熵增加C.活化能增加D.压力增加13. 某反应298K时, Δr GΘ=130KJ•mol-1, Δr HΘ=150KJ•mol-1,下列说法错误的是( C )A.可以求得298K时反应的Δr SΘB.可以求得298K时反应的平衡常数C.可以求得反应的活化能D.可以近似求得反应达平衡时的温度14. 某基元反应2A(g)+B(g)→C(g),其速率常数为k.当2molA与1molB在1L容器中混合时,反应速率是( A )A.4kB.2kC.1/4kD.1/2k15. 某反应在370K时反应速率常数是300K时的4倍,则这个反应的活化能近似值是( A ) KJ·mol-1A.18.3B.-9.3C.9.3D.数值不够,不能计算第2章溶液与离子平衡一.是非题1.高分子溶液与溶胶都是多相不稳定系统。
大化-新大学化学参考答案

大学化学习题参考答案第一章:化学反应基本规律一、判断题1〔×〕2〔√〕3〔×〕4〔×〕5〔×〕6〔×〕7〔×〕8〔√〕9〔√〕二、选择题10<D>11<B>12<C>13<B>14<B>15<D>16<A>17<C>18<C>19<C>20<A>21<C>2 2<A>三、填空题23等容;等压24降低;增加25⊿r G m〔封闭系统〕26自发的;非自发的27状态函数;初态;终态;途径28 60.75kPa;4.15×10-3mol29 2.25×10-4;不变;左;不变;不〔V不变时〕;增加;右30<1>k[A][B]2 <2>k[A][B]-1<3>k[A]31 基元反应;非基元反应32大于;小于;等于〔近似〕;小于;小于;大于第二章溶液与离子平衡一、判断题1〔×〕2〔√〕3〔×〕4〔×〕5〔×〕6〔×〕7〔×〕8〔×〕9〔×〕10〔×〕11〔√〕12〔×〕13〔√〕二、选择题14<C>15<A>16<C>17<B>18<C>19<A>20<c>21<D>22<B>23<B>24<A>25<D>三、填空题26蒸气压降低;沸点升高;凝固点降低;具有渗透压;量27 1*10-141*10-20 28 k sΘ<Ag2CrO4>=[b<CrO42->/bΘ][b<Ag+>/bΘ]2k sΘ=4S3<bΘ>-3 29填表:30 底浓度往高浓度31. 形成难解离的配离子32HPO42-; HO-; SO42-; [Fe<OH><H2O>5]2+33=<1.0×10-14>/<1.76×10-5>=5.68×10-1034 NH4+、H3PO4、H2S为酸;PO43-、CO32-、CN-、OH-、NO2-为碱;[Fe<OH><H2O>5]2+、HSO3-、HS-、H2PO4-、HPO42-、H2O为两性物质第三章氧化还原反应电化学一、判断题1〔×〕2〔√〕3〔×〕4〔×〕5〔×〕6〔×〕7〔×〕二、选择题8 <A>9<B>10<C>11<A>12<D>13<C>14<B>15<D>16<C>17<C>18<A>三、填空题19 CrO72-; Sn2+20 自发;电子的转移或偏移21 正极的电极电势大于负极的电极电势22 负极23〔-〕Pt Fe3+<b1>,Fe2+<b2> Cl-<b3> Cl2<p> Pt<+> 24 0.797V25 降低;升高26 0.0034V;-2×96485×0.0034=656.098 j mol-1;ln kΘ=<2×96485×0.0034>/<8.314×298.15>=0.2647 kΘ=1.3030 27 Cu-2e=Cu2+; Cu2+ +2e=Cu;4OH- -4e=O2+2H2O; Cu2+ +2e=Cu; Cu-2e=Cu2+; Cu2+ +2e=Cu;29〔注:第四空可能不严密,该电池的负极为Ag涂布AgCl插入Cl-〔如NaCl〕中;正极为Pt涂布I2插入I-〔如NaI〕,根据电极反应,电池反应可以写成I2+2Ag+2Cl-= 2I-+2AgCl,但I-可以借助盐桥进入负极区<Na+也可进入正极区>,因此AgCl将发生沉淀的转化形成AgI,因此最终电池反应应为2Ag+I2 = 2AgI。
《大学化学》课后习题答案大全

《⼤学化学》课后习题答案⼤全第⼀章课后作业答案1-4.判断下列⼏种说法是否正确,并说明理由。
(1)原⼦是化学变化中最⼩的微粒,它由原⼦核和核外电⼦组成;正确原⼦是化学变化中的最⼩粒⼦。
原⼦是由居于原⼦中⼼的原⼦核和核外电⼦构成,原⼦核⼜由质⼦和中⼦两种粒⼦构成的。
构成原⼦的基本粒⼦是电⼦、质⼦、中⼦。
(2)相对原⼦质量就是⼀个原⼦的质量;错误相对原⼦质量是指以⼀个碳-12原⼦质量的1/12作为标准,任何⼀个原⼦的真实质量与⼀个碳-12原⼦质量的1/12的⽐值。
(3)4g H2和4g O2所含分⼦数⽬相等;错误4g H2含有2mol氧⽓分⼦。
氢⽓相对分⼦质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧⽓分⼦。
氧⽓相对分⼦质量32,4g/(32g/mol)=0.125mol。
所以分⼦数⽬不相等。
(4)0.5mol的铁和0.5mol的铜所含原⼦数相等;正确铁和铜都是由原⼦构成的⾦属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表⽰原⼦数相同。
(5)物质的量就是物质的质量;错误物质的量:表⽰物质所含微粒数(N)(如:分⼦,原⼦等)与阿伏加德罗常数(NA)之⽐,即n=N/NA。
物质的量是⼀个物理量,它表⽰含有⼀定数⽬粒⼦的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置⽽改变,是物质的基本属性之⼀,通常⽤m表⽰物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最⾼?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最⾼,所以尿素的肥效最⾼。
新大学化学1--3章答案

1.2 习题及详解一.判断题1. 状态函数都具有加和性。
(×)2. 系统的状态发生改变时,至少有一个状态函数发生了改变。
(√)3. 由于CaCO3固体的分解反应是吸热的,故CaCO3的标准摩尔生成焓是负值。
(×)4. 利用盖斯定律计算反应热效应时,其热效应与过程无关,这表明任何情况下,化学反应的热效应只与反应的起,始状态有关,而与反应途径无关。
(×)5.因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的ΔS大大增加。
(×)6. ΔH, ΔS受温度影响很小,所以ΔG受温度的影响不大。
(×)7. 凡ΔGθ大于零的过程都不能自发进行。
(×)8. 273K,101.325KPa下,水凝结为冰,其过程的ΔS<0, ΔG=0。
(√)9.反应Fe3O4(s)+4H2(g) → 3Fe(s)+4 H2O(g)的平衡常数表达式为2244(/)(/)H OTHp pKp pθθθ=。
(√)10.反应2NO+O2→2NO2的速率方程式是:)()(22OcNOkcv⋅=,该反应一定是基元反应。
(×)二.选择题1. 某气体系统经途径1和2膨胀到相同的终态,两个变化过程所作的体积功相等且无非体积功,则两过程( B )A.因变化过程的温度未知,依吉布斯公式无法判断ΔG是否相等B.ΔH相等C.系统与环境间的热交换不相等D.以上选项均正确2. 已知CuCl2(s)+Cu(s)→2CuCl(s) Δr H mΘ(1) =170KJ•mol-1Cu(s)+Cl2(g) → CuCl2(s) Δr H mΘ(2) =-206KJ•mol-1则Δf H mΘ(CuCl,s)应为(D )KJ.mol-1A.36B. -36C.18D.-183. 下列方程式中,能正确表示AgBr(s)的Δf H mΘ的是( B )A.Ag(s)+1/2Br2(g)→ AgBr(s)B.Ag(s)+1/2Br2(l)→AgBr(s)C.2Ag(s)+Br2(l)→ 2AgBr(s)D.Ag+(aq)+Br-(aq)→ AgBr(s)4. 298K下,对参考态元素的下列叙述中,正确的是( C )A.Δf H mΘ≠0,Δf G mΘ=0,S mΘ=0B.Δf H mΘ≠0,Δf G mΘ≠0,S mΘ≠0C.Δf H mΘ=0,Δf G mΘ=0,S mΘ≠0D.Δf H mΘ=0,Δf G mΘ=0,S mΘ=05. 某反应在高温时能自发进行,低温时不能自发进行,则其( B )A.ΔH>0, ΔS<0 ;B. ΔH>0, ΔS>0C.ΔH<0, ΔS<0 ;D.ΔH<0, ΔS>06.1mol气态化合物AB和1mol气态化合物CD按下式反应:AB(g)+CD(g)→AD(g)+BC(g),平衡时,每一种反应物AB 和CD都有3/4mol转化为AD和BC,但是体积没有变化,则反应平衡常数为( B )A.16B.9C.1/9D.16/97.400℃时,反应3H2(g)+N2(g)→2NH3(g)的K673Θ=1.66×10-4。
大一有机化学课后答案

第三章单烯烃1.写出戊烯的所有开链烯烃异构体的构造式,用系统命名法命名之,如有顺反异构体则写出构型式,并标以Z,E。
答案:解: CH3CH2CH2CH=CH2 1-戊烯2-甲基-1-丁烯3-甲基-1-丁烯2-甲基-2-丁烯(Z)-2-戊烯(E)-2-戊烯2.命名下列化合物, 如有顺反异构体则写出构型式,并标以Z,E (1)(CH3)2C CHCH(CH3)CH2CH2CH3(2)(CH3)3CCH2CH(C2H5)CH=CH2(3)CH3HC=C(CH3)C2H5(4)(5)(6)答案:(1)2,4-二甲基-2-庚烯(2)5,5-二甲基-3-乙基-1-己烯(3)3-甲基-2-戊烯(Z)-3-甲基-2-戊烯或反3-甲基-2-戊烯(E)-3-甲基-2-戊烯或顺-3-甲基-2-戊烯注:当顺反命名与Z,E命名矛盾时,以Z,E命名为好.(4)4-甲基-2-乙基-1-戊烯(5)3,4-二甲基-3-庚烯C CCH3C3H7C2H5CH3(E)C CCH3CH3C2H5C3H7(Z)(6)(Z)3,3,4,7-四甲基-4-辛烯(Z)(E)3、写出下列化合物的构造式(键线式)。
(1)2,3-dimethyl-pentene (2)cis-3,5- dimethyl-2-heptene(3)(E)-4-ethyl-3-methyl-2-hexene(4)3,3,4-trichloro-1- pentene答案:(1)(2)(3)(4)4、写出下列化合物的构造式:⑴ (E)-3,4-二甲基-2-戊烯 (2) 2,3-二甲基-1-己烯⑶反-3,3-二甲基-2-戊烯 (4) (Z)-3-甲基-4-异丙基-3-庚烯⑸ 2,2,3,6-四甲基-5-乙基-3-庚烯(Z)答案:(1)(2)(3)(4)(5) (Z)5、对下列错误的命名给于纠正。
(1)2-甲基-3-丁烯(2)2,2-甲基-4-庚烯(3)1-溴-1-氯-2-甲基-1-丁烯(4)3-乙烯基-戊烷答案:(1)3-甲基-1-丁烯(2)6,6-二甲基-3-庚烯(3)2-甲基-1-溴-1-氯-1-丁烯(4)3-甲基-1-戊烯6、完成下列反应式。
大学有机化学习题及答案

第一章绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCI与KBr各1mol溶于水中所得的溶液与NaBr及KCI各1mol溶于水中所得溶液是否相同?如将CH4及CCI4各1mol混在一起,与CHCI3及CH3CI各1mol的混合物是否相同?为什么?答案:NaCI与KBr各1moI与NaBr及KCI各1moI溶于水中所得溶液相同。
因为两者溶液中均为Na+, K+ , Br - , CI -离子各1mol。
由于CH4与CCI4及CHCI3与CH3CI在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:CH2s1s 2s 2pCH4中C中有4个电子与氢成键CH41.4 写出下列化合物的Lewis电子式。
a. C2H2b. CH3CIc. NH 3d. H2Se. HNO 3f. HCHOg. H3PO4h.C2H6i. C2H2 j. H 2SO4答案:a. H-C 二C-H 或I I 以H HO.e H—0 — N0 : f.:O :iiH — C—Hg.Hi “H—C Cl :i ・・HOII ・・H—O—P—O—H 或:O;IHc. H—N —HId.H S-H■ «i. H—C 三C—HoHSHo• «■•O —H* ■1.5 下列各化合物哪个有偶极矩?画出其万向。
答案:O■ • I ••H_O_P_O_H9 V I ■■OIHHHIC—H-H IC—H-H n« «O或H—O-S—O—HIO…a. I2b. CH2CI2c. HBrd. CHCl 3e. CH 3OHf. CH 3OCH 3c. H ——BrH1.6 根据S 与0的电负性差别, 出0与H 2S 相比,哪个有较强的偶极 -偶极作用力或氢键?答案:电负性 0 > S , H 20与H 2S 相比,H 20有较强的偶极作用及氢键。
(完整版)大学化学习题与答案

第一章化学反应基本规律1、在标准态的规定中,下述表达不正确的是( )A、标准压力PӨ=100.00KPaB、T=298.15KC、bӨ=1.00mol·kg-1D、纯固体或纯液体处于标准压力。
2、在标准条件下,下列反应式中能表示CO2的Δf H mӨ(298.15K)的反应式为( )A、C(金刚石)+ O2(g)= CO2(g)B、C(石墨)+O2(g)= CO2(g)C、CO(g)+1/2O2(g)= CO2(g)D、CO2(g)=CO(g)+1/2O2(g)3、已知下列反应在一定温度下的热效应:4Fe2O3(s)+Fe(s)=3Fe3O4(s), Δr H mӨ=-74 kJ·mol-14Fe(s)+3O2(g)=2Fe2O3(s), Δr H mӨ=-1664kJ·mol-1则可计算出Fe3O4(s)的标准摩尔生成焓等于( )4、等压过程,高温非自发,低温自发的条件是( )5、等温条件下,某反应Δr G mӨ=10kJ·mol-1,这表示该反应在标准状态下( )A、自发进行B、非自发进行C、自发与否,需具体分析6、汽车尾气中的CO,可用加入催化剂催化其热分解的方法消除。
已知热分解反应CO(g)= C(s)+O2(g)的Δr H mӨ=110.5kJ·mol-1,Δr S mӨ=-0.089kJ·mol-1·K-1这一方法正确与否?解释其原因:7、(1)U,S,H,G均为( )(2)Δr H m>0为( )(3)Δr G m <0为( )(4)KӨ为( )8、反应的Δr H mӨ <0,温度升高时(T2>T1)则平衡常数( )当Δr H mӨ>0,温度升高时则( )9、碳燃烧反应为基元反应,其方程式为C(s)+O2 (g)→CO2 (g)则其反应速率方程式为( )A、υ=kc(C)c(CO2)B、υ=kc(O2)c(CO2)C、υ=kc(CO2)D、υ=kc(O2)10、升高温度,可增加反应速度,主要因为( )A、增加了分子总数B、增加了活化分子百分数C、降低了活化能D、促进平衡向吸热方向移动11、已测得高温时焦炭与二氧化碳反应C+CO2→2CO的活化能为167kJ·mol-1。
新大学化学第4版前三章答案

新大学化学第4版前三章答案1、以芦丁为指标成分进行定性鉴别的中药是()[单选题] *A葛根B黄芩C槐花(正确答案)D陈皮2、以黄芩苷、黄芩素、汉黄芩素为指标成分进行定性鉴别的中药是()[单选题] * A葛根B黄芩(正确答案)C槐花D陈皮3、不属于木脂素类化合物的物理性质的是()[单选题] *A一般没有挥发性B有光学活性C易溶于有机溶剂D有色晶体(正确答案)4、具有挥发性的香豆素成分是()[单选题] *A游离小分子简单香豆素(正确答案)B香豆素苷C呋喃香豆素D双香豆素5、E连续回流提取法(正确答案)能用乙醇作溶剂提取的方法有(多选)()* A浸渍法(正确答案)B渗漉法(正确答案)C煎煮法D回流提取法(正确答案)6、与水不分层的溶剂是()[单选题] *A正丁醇B石油醚C三氯甲烷D丙酮(正确答案)7、中药丹参中的主要有效成分属于()[单选题] *A苯醌类B萘醌类C蒽醌类D菲醌类(正确答案)8、在分配色谱中,属于反相色谱的是()[单选题] *A固定相的极性大于流动相B固定相的极性小于流动相(正确答案)C固定相的极性等于流动相D以上都不是9、即有一定亲水性,又能与水分层的是()[单选题] *A正丁醇B乙酸乙酯C二者均是(正确答案)D二者均非10、所有游离香豆素均可溶于热的氢氧化钠水溶液,是由于其结构中存在()[单选题]* A酮基B亚甲二氧基C内酯环(正确答案)D酚羟基对11、由两个苯环通过三碳链相互连接成的具有6C-3C-6C基本骨架的一系列化合物是()[单选题] *A苷类B黄酮类(正确答案)C醌类D生物碱类12、下列化合物中具有强烈天蓝色荧光的是()[单选题] *A七叶内脂(正确答案)B大黄素C麻黄碱D大豆皂苷13、香豆素与浓度高的碱长时间加热生成的产物是()[单选题] *A脱水化合物B顺式邻羟基桂皮酸(正确答案)C反式邻羟基桂皮酸D醌式结构14、除了能够沉淀有羧基或邻二酚羟基成分,还能沉淀一般酚羟基成分的是()[单选题]A碱式醋酸铅(正确答案)B中性醋酸铅C酸碱沉淀法D以上都不对15、游离木脂素易溶于下列溶剂,除了()[单选题] *A乙醇B氯仿C乙醚D水(正确答案)16、以下哪种方法是利用混合中各成分在溶剂中的溶解度不同或在冷热情况下溶解度显著差异的原理而达到分离的()[单选题] *A沉淀法B分馏法C结晶法(正确答案)D升华法17、与明胶反应生成沉淀的成分是()[单选题] *A强心苷B皂苷C有机酸D鞣质(正确答案)18、当一种溶剂无法结晶时,常常使用混合溶剂,下列不是常用的混合溶剂是()[单选题] *A甲醇-水B乙酸-水C乙醚-丙酮D石油醚-水(正确答案)19、二萜的异戊二烯单位有()[单选题] *A5个B6个C3个(正确答案)D4个20、倍半萜和二萜在化学结构上的明显区别是()[单选题] *A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同21、在简单萃取法中,一般萃取几次即可()[单选题] * A3~4次(正确答案)B1~2次C4~5次D3~7次22、E何首乌生物碱沉淀反应的条件是()[单选题] *A酸性水溶液(正确答案)B碱性水溶液C中性水溶液D盐水溶液23、牛蒡子属于()[单选题] *A香豆素类B木脂内酯(正确答案)C苯丙酸类D24、以橙皮苷为指标成分进行定性鉴别的中药是()[单选题] *A葛根B黄芩C槐花D陈皮(正确答案)25、碱性最强的生物碱是()[单选题] *A季铵碱类(正确答案)B哌啶类C吡啶类D吡咯类26、E连续回流提取法(正确答案)用乙醇作溶剂提取时,下列说法正确的是()* A对植物细胞壁穿透力强(正确答案)B溶解范围广,提取较全面(正确答案)C提取液中蛋白质、多糖等水溶性杂质少(正确答案)D有防腐作用,提取液不易发霉变质(正确答案)27、凡具有()的木脂素,与三氯化铁反应,呈阳性()[单选题] *A酚羟基(正确答案)B羧酸C醇羟基D氨基28、大黄素型蒽醌母核上的羟基分布情况是()[单选题] * A一个苯环的β位B苯环的β位C在两个苯环的α或β位(正确答案)D一个苯环的α或β位29、中药补骨脂中的补骨脂内脂具有()[单选题] *A抗菌作用B光敏作用(正确答案)C解痉利胆作用D抗维生素样作用30、南五味子具有的主要化学成分是()[单选题] *A色原酮B胆汁酸C多糖D木脂素(正确答案)。
大一有机化学答案
化学答案第一章第二章•3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷•2,2,3-三甲基丁烷(5) 2,3,4-三甲基己烷(6) 2,2,5-三甲基-6-异丙基壬烷(4)5. (1) .(2)都是等同的6. (1)第三章7. 属于同分异构体的是(1) (2),(3) (4) 属于同种物质的是(3) (5)属于同系物的是(1)(3), (2)(3), (1)(4), (2)(4)第三章 习题参考答案•(1) 3,4-二甲基-1,3-戊二烯 (2)5-甲基-3-己烯-1-炔(3) (E)-3-甲基-2-戊烯 (4)(Z)-2-甲基-3-乙基-3-己烯(5)2,6-二甲基-2-庚烯 (6) 丙炔银 (7) 3,3-二甲基-1-戊烯 (8) 4-甲基-2-戊炔2. (3)(4) (5)(2) CH 2C HCCH+Br 2BrH 2CC H Br C CH3. (2) ,(3)有顺反异构体。
结构式略。
4.(6) C H3C C H2C H2C H2C H2C CH3O O(8) (9)(10) (11)(12 )CH3CH3(13)CH3CH2CH2Br(14) (15) OHOH 5.(1)(2)1-丁炔2-丁炔丁烷[Ag(NH3)2+]白色沉淀无现象无现象溴水褪色无变化(C H3C H2C H2)3B,C H3C H2C H2OH6.7. 其结构式为:8. (2) > (3) > (1)9. 其结构式为:10. A,B的结构式分别为:第四章•(1) 1,1-二甲基-2-异丙基环丙烷(2) 5-甲基螺[2,4]庚烷(3) 2-甲基-3-环丙基丁烷(4) 1-甲基-3-乙基环己烷(5) 2-硝基苯磺酸(6)1,7-二甲基萘(7) 双环[3,2,1]辛烷(8)1-甲基-1,3-环戊二烯(9) 4-硝基-2-氯甲苯(10)1,2-二苯乙烯3. (3),(5),(6) 有芳香性,因为其结构为平面共轭的,且 电子数符合(4n+2)(1),(2),(4) ,(7),(8)无芳香性。
大学化学课后题答案

第一章 物质结构基础1.de Bloglie 关系式:hmv λ=又 22J kg m s -=⋅⋅ 已知319.109510m kg -=⨯;615.010v m s -=⨯⋅;346.62610h J s -=⨯⋅;代入,34342210316131616.62610 6.62610 1.45510145.59.109510 5.0109.109510 5.010J s kg m s sm pm kg m s kg m sλ--------⨯⋅⨯⋅⋅⋅===⨯=⨯⨯⨯⋅⨯⨯⨯⋅2. (1) 3d ;n=3, l=2, m=0,±1, ±2,共5个轨道,每一轨道至多两个电子,即:3,2,0, ±1/2;3,2,1,±1/2;3,2,-1, ±1/2;3,2,+2, ±1/2;3,2,-2, ±1/2; (2) 4s ;n=4, l=0, 即4,0,0 (±1/2);(3) 氧原子中的4个p 电子:n=2, l=1, m=0, ±1, 即2,1,0, ±1/2;2,1,1, +1/2(或-1/2);2,1,-1,+1/2(或-1/2);(4) 4s 1电子,4,0,0,+1/2或4,0,0,-1/2。
3.根据周期数、族序数和主、副族规律:(1)第3周期,零族,主族;(2)第5周期,ⅣA 族,主族;(3)第4周期ⅣB ,副族; (4)第4周期,ⅠB ,副族。
5. (1)②, (2)③;②;④, (3)①②, (4)⑤6. (1)Ga 价电子构型为4s 24p 1,价电子数为3; (2)W 原子的电子构型为[Xe] 4f 145d 46s 2; (3)最外层有6个电子的元素应为ⅥA ;(4) Sb 原子的电子构型为[Kr]4d 105s 25p 3,未成对电子数为3。
7.(1)该元素属于ⅡA ;(2)金属性强,电负性小;(3)一般氧化值为+2,其氧化物的化学式可表示为XO 。
大学化学课后习题答案

第一章化学反应热教学内容1.系统、环境等基本概念; 2. 热力学第一定律; 3. 化学反应的热效应。
教学要求掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。
知识点与考核点1.系统(体系)被划定的研究对象。
化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。
2.环境(外界)系统以外与之密切相关的部分。
系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。
系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换);封闭体系(系统与环境之间没有..能量交换);..物质交换,只有孤立系统(体系与环境之间没有物质交换,也没有能量交换)系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为的边界,目的是确定研究对象的空间范围。
3.相系统中物理性质和化学性质完全相同的均匀部分。
在同一个系统中,同一个相可以是连续的,也可以是不连续的。
例如油水混合物中,有时水是连续相,有时油是连续相。
4.状态函数状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些宏观性质描述的,这些宏观性质又称为系统的状态函数。
状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。
5*.过程系统状态的变化(例如:等容过程、等压过程、等温可逆过程等)6*.途径完成某过程的路径。
若系统的始、末态相同,而途径不同时,状态函数的变量是相同的。
7*.容量性质这种性质的数值与系统中的物质的量成正比,具有加合性,例如m(质量)V、U、G等。
8*.强度性质这种性质的数值与系统中的物质的量无关,不具有加合性,例如T、 (密度)、p(压强)等。
9.功(W)温差以外的强度性质引起的能量交换形式[W=W体+W有]。
《大学化学》课后习题答案大全

第一章课后作业答案1-4.判断下列几种说法是否正确,并说明理由。
(1)原子是化学变化中最小的微粒,它由原子核和核外电子组成;正确原子是化学变化中的最小粒子。
原子是由居于原子中心的原子核和核外电子构成,原子核又由质子和中子两种粒子构成的。
构成原子的基本粒子是电子、质子、中子。
(2)相对原子质量就是一个原子的质量;错误相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一个原子的真实质量与一个碳-12原子质量的1/12的比值。
(3)4g H2和4g O2所含分子数目相等;错误4g H2含有2mol氧气分子。
氢气相对分子质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧气分子。
氧气相对分子质量32,4g/(32g/mol)=0.125mol。
所以分子数目不相等。
(4)0.5mol的铁和0.5mol的铜所含原子数相等;正确铁和铜都是由原子构成的金属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表示原子数相同。
(5)物质的量就是物质的质量;错误物质的量:表示物质所含微粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。
物质的量是一个物理量,它表示含有一定数目粒子的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置而改变,是物质的基本属性之一,通常用m表示物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最高?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最高,所以尿素的肥效最高。
新大学化学第3章答案

3.2习题及详解一.判断题1. 在25℃及标准状态下测定氢的电极电势为零。
( X )2. 已知某电池反应为,21212B A B A +→+++而当反应式改为B A B A +→+++222时,则此反应的E Θ不变,而Δr G m Θ改变。
( √ ) 3. 在电池反应中,电动势越大的反应速率越快。
( X ) 4. 在原电池中,增加氧化态物质的浓度,必使原电池的电动势增加。
( X ) 5. 标准电极电势中θE 值较小的电对中的氧化态物质,都不可能氧化θE 值较大的电对中 的还原态物质。
( X ) 6. 若将马口铁(镀锡)和白铁(镀锌)的断面放入稀盐酸中,则其发生电化学腐蚀的阳极反应是相同的。
( X )7. 电解反应一定是0,0<∆>∆G G r r θ的反应。
( X ) 8. 超电势会导致析出电势高于平衡电势。
( X )二.选择题1. 下列关于氧化数的叙述正确的是( A )A.氧化数是指某元素的一个原子的表观电荷数B.氧化数在数值上与化合价相同C.氧化数均为整数D.氢在化合物中的氧化数皆为+12. 若已知下列电对电极电势的大小顺序E Θ(F 2/F -) > E Θ(Fe 3+/Fe 2+) > E Θ(Mg 2+/Mg) >E Θ(Na +/Na),则下列离子中最强的还原剂是( B )A.F -B.Fe 2+C.Na +D.Mg 2+3. 已知电极反应Cu e Cu →+-+22的标准电极电势为0.342V ,则电极反应+-→-2242Cu e Cu 的标准电极电势应为( C )A.0.684VB.-0.684VC.0.342VD.-0.342V 4. 已知E Θ(Ni 2+/Ni)= -0.257V ,测得镍电极的E(Ni 2+/Ni)= -0.210V ,说明在该系统中必有( A )A.121)(-+⋅>kg mol Nim B. 121)(-+⋅<kg mol Ni mC. 121)(-+⋅=kg mol Ni mD.)(2+Ni m 无法确定 5. 下列溶液中,不断增加H +的浓度,氧化能力不增强的是( D )A.MnO 4-B.NO 3-C.H 2O 2D.Cu 2+ 6. 将下列反应中的有关离子浓度均增加一倍,使对应的E 值减少的是( C )A.Cu e Cu →+-+22B. +-→-22Zn e ZnC. --→+Cl e Cl 222D. +-+→+242Sn e Sn7. 某电池的电池符号为(-)Pt|A 3+,A 2+ ¦¦ B 4+,B 3+|Pt(+),则此电池反应的产物应为( B )A. A 3+, B 4+B. A 3+, B 3+C. A 2+, B 4+D. A 2+, B 3+ 8. 在下列电对中,标准电极电势最大的是( D )A.AgCl/AgB.AgBr/AgC.[Ag(NH 3)2]+/AgD.Ag +/Ag 9. A 、B 、C 、D 四种金属,将A 、B 用导线连接,浸在稀硫酸中,在A 表面上有氢气放 出,B 逐渐溶解;将含有A 、C 两种金属的阳离子溶液进行电解时,阴极上先析出C ;把D 置于B 的盐溶液中有B 析出。
大学化学第一章答案

第一章答案一、选择题1、对于实际气体,处于下列哪种情况时,其行为与理想气体相近。
( B )A.高温高压B.高温低压C.低温高压D.低温低压2、在温度为T 的抽空容器中,加入0.3molN2、0.1molO2、0.1molAr,容器总压为101325Pa,此时O2 的分压为( A )A.20265Pa B.60795Pa C.40530Pa D.50663Pa6、298K时G 和H 两种气体在某一溶剂中溶解的亨利系数为kG 和kH,且kG>kH,当A和 B 的压力相同时,在该溶剂中溶解的量是( B )A.G 的量大于H 的量B.G 的量小于H 的量C.G 的量等于H 的量二、计算题1.计算273.15K、100kPa 时甲烷气体(视作理想气体)的密度。
解:2.某地空气中含N、O 和CO 的体积分数分别为0.78、0.21 和0.01,求N、O 22222和CO 的摩尔分数和空气的摩尔质量。
(空气可视作理想气体) 2解:摩尔分数等于体积分数,所以N、O 和CO 的摩尔分数分别为0.78、0.21 和0.01。
222-3 ,求它的摩kg·m27℃时,密度为2.61 3.某气体(可视作理想气体)在202.650kPa 和尔质量。
解:3 ,求混合气体的总压和各组分25℃时体积为0.4m 3molH1molN4.和混合,在22的分压。
解:)求1(。
10 7 Pa×1.52 ,原料气的总压为1∶3 .合成氨原料气中氢和氮的体积比是5.氢和氮的分压;(2)若原料气中还有气体杂质4%(体积百分数),原料气总压不变,则氢和氮的分压各是多少?解:(1)氢和氮的体积比是3∶1,所以(2)3下收集,体积为℃及101.325kPa 100cm 盐酸中,产生的氢气在20.将6 10gZn加入到3。
℃时水的饱和蒸汽压是2.33kPa2.00dm 。
问气体干燥后体积是多少?已知203的容器中放入0.13molPCl 气体,在250℃时有80%的PCl气体按下.在7 1dm 5 5式分解:PCl (g)= Cl (g)+ PCl(g)。
大一有机化学课后答案

第三章单烯烃1.写出戊烯的所有开链烯烃异构体的构造式,用系统命名法命名之,如有顺反异构体则写出构型式,并标以Z,E。
答案:解: CH3CH2CH2CH=CH2 1-戊烯2-甲基-1-丁烯3-甲基-1-丁烯2-甲基-2-丁烯(Z)-2-戊烯(E)-2-戊烯2.命名下列化合物, 如有顺反异构体则写出构型式,并标以Z,E (1)(CH3)2C CHCH(CH3)CH2CH2CH3(2)(CH3)3CCH2CH(C2H5)CH=CH2(3)CH3HC=C(CH3)C2H5(4)(5)(6)答案:(1)2,4-二甲基-2-庚烯(2)5,5-二甲基-3-乙基-1-己烯(3)3-甲基-2-戊烯(Z)-3-甲基-2-戊烯或反3-甲基-2-戊烯(E)-3-甲基-2-戊烯或顺-3-甲基-2-戊烯注:当顺反命名与Z,E命名矛盾时,以Z,E命名为好.(4)4-甲基-2-乙基-1-戊烯(5)3,4-二甲基-3-庚烯C CCH3C3H7C2H5CH3(E)C CCH3CH3C2H5C3H7(Z)(6)(Z)3,3,4,7-四甲基-4-辛烯(Z)(E)3、写出下列化合物的构造式(键线式)。
(1)2,3-dimethyl-pentene (2)cis-3,5- dimethyl-2-heptene(3)(E)-4-ethyl-3-methyl-2-hexene(4)3,3,4-trichloro-1- pentene答案:(1)(2)(3)(4)4、写出下列化合物的构造式:⑴ (E)-3,4-二甲基-2-戊烯 (2) 2,3-二甲基-1-己烯⑶反-3,3-二甲基-2-戊烯 (4) (Z)-3-甲基-4-异丙基-3-庚烯⑸ 2,2,3,6-四甲基-5-乙基-3-庚烯(Z)答案:(1)(2)(3)(4)(5) (Z)5、对下列错误的命名给于纠正。
(1)2-甲基-3-丁烯(2)2,2-甲基-4-庚烯(3)1-溴-1-氯-2-甲基-1-丁烯(4)3-乙烯基-戊烷答案:(1)3-甲基-1-丁烯(2)6,6-二甲基-3-庚烯(3)2-甲基-1-溴-1-氯-1-丁烯(4)3-甲基-1-戊烯6、完成下列反应式。
大学化学普通化学习课后题答案

普通化学 马家举 第一章 物质结构基础习题4 假定有下列电子的各套量子数,指出哪几套不可能存在,并说明原因。
(1)3,2,2,1/2;(2)3,0,-1,1/2;(3)2,2,2,2;(2)当角量子数l 取0时,磁量子数m 不能取-1。
(3)当主量字数取2时,角量子数不能取2;自旋量子数不能取2,只能取+1/2或-1/2。
5写出原子序数为47的银原子的电子分布式,并用四个量子数表示最外层电子的运动状态。
Ag :1s 22s 22p 63s 23p 63d 104s 24p 64d 105s 1 5,0,0,+1/2。
试用杂化轨道理论解释:(1) H 2S 分子的键角为920,而PCl 3的键角为1020。
(2) NF 3分子为三角锥形构型,而BF 3分子为平面三角形构型。
(1) H 2S 分子与H 2O 分子一样,中心原子采取sp 3不等性杂化,在两个孤电子对的作用下,两个H-S键键角减小。
之所以键角小于H 2O 分子中两个H-O 键的键角104045’,是因为H-S 键的成键电子对更靠近H 原子,两个H-S 键之间的斥力小,被压缩的程度更大。
PCl 3分子与NH 3分子一样,也是中心原子采取sp 3不等性杂化,同理Cl-P 键的成键电子对更靠近Cl 原子,所以两个P-Cl 键的键角小于NH 3分子中两个N-H 键的键角。
(2) NF3分子与NH 3分子一样中心原子采取sp 3不等性杂化,使分子产生三角锥形构型;BF 3分子中心原子B 采用sp 2等性杂化,使分子产生平面三角形构型。
7 为什么(1)室温下CH 4为气体,CCl 4为液体,而CI 4为其固体?(2)水的沸点高于H 2S ,而CH 4的沸点低于SiH 4?(1) 从CH 4→CCl 4→CI 4分子量增加,分子间色散力增大,而色散力在范德华力中占较大比例,即分子间力是增大的,而分子间力越大,熔沸点越高。
(2) H 2O 分子与H 2S 分子相比,水中H 2O 分子之间存在氢键,虽然H 2O 分子间的色散力较小,氢键的存在却使沸点更高一些。
大化-新大学化学参考答案
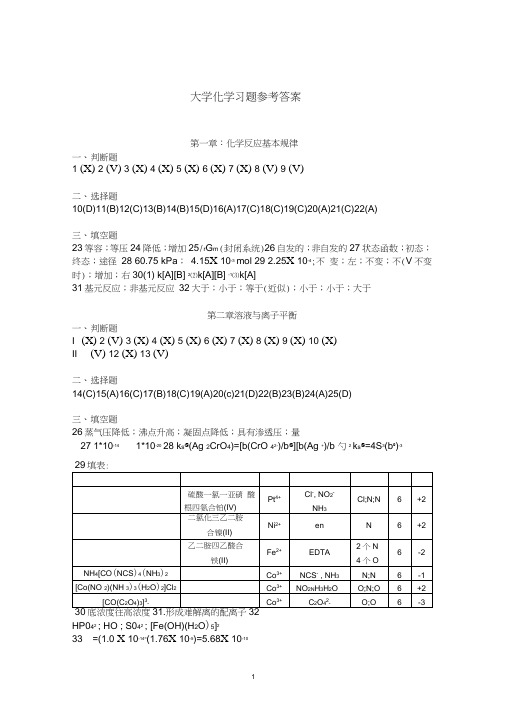
大学化学习题参考答案第一章:化学反应基本规律一、判断题1 (X)2 (V)3 (X)4 (X)5 (X)6 (X)7 (X)8 (V)9 (V)二、选择题10(D)11(B)12(C)13(B)14(B)15(D)16(A)17(C)18(C)19(C)20(A)21(C)22(A)三、填空题23等容;等压24降低;增加25/r G m (封闭系统)26自发的;非自发的27 状态函数;初态;终态;途径28 60.75 kPa;4.15X 10-3mol 29 2.25X 10-4;不变;左;不变;不(V不变时);增加;右30(1) k[A][B] 2⑵k[A][B] -1⑶k[A]31基元反应;非基元反应32大于;小于;等于(近似);小于;小于;大于第二章溶液与离子平衡一、判断题I (X) 2 (V) 3 (X) 4 (X) 5 (X) 6 (X) 7 (X) 8 (X) 9 (X) 10 (X)II (V) 12 (X) 13 (V)二、选择题14(C)15(A)16(C)17(B)18(C)19(A)20(c)21(D)22(B)23(B)24(A)25(D)三、填空题26蒸气压降低;沸点升高;凝固点降低;具有渗透压;量27 1*10-141*10-2028 k s@(Ag 2CrO4)=[b(CrO 42-)/b@][b(Ag +)/b 勺2k s@=4S3(b0)-3填表:HP042; HO ; S042; [Fe(OH)(H2O)5]233 =(1.0 X 10-14”(1.76X 10-5)=5.68X 10-1034 NH4+、H3PO4、H2S 为酸;PO43-、CO32-、CN-、OH-、NO2-为碱;[Fe(OH)(H2O)5]2+、HSO3-、HS-、H2PO4-、HPO42-、H2O 为两性物质第三章氧化还原反应电化学一、判断题1(X)2 (V) 3 (X) 4 (X) 5 (X) 6 (X) 7 (X)二、选择题8 (A)9(B)10(C)11(A)12(D)13(C)14(B)15(D)16(C)17(C)18(A)三、填空题19 CrO72-; Sn2+20自发;电子的转移或偏移21正极的电极电势大于负极的电极电势22 负极23 ( — ) Pt| Fe3+(b1), Fe2+(b2)|C「(b3)Cl2(p)|Pt(+) 24 0.797V25 降低;升高26 0.0034V; -2X 96485X 0.0034= 656.098 j mol-1; In k@=(2X 96485 X 0.0034)/(8.314X 298.15)=0.2647 k@=1.3030 27 Cu-2e= Cu2+; Cu2++2e= Cu; 4OH- -4e= O2+2H2O; Cu2++2e= Cu; Cu-2e= Cu2+; Cu2++2e= Cu;(注:第四空可能不严密,该电池的负极为Ag涂布AgCI插入CI-(如NaCI) 中;正极为Pt涂布12插入I-(如Nal),根据电极反应,电池反应可以写成h+2Ag+2CI-= 2l-+2AgCI,但I-可以借助盐桥进入负极区(Na+也可进入正极区), 因此AgCI将发生沉淀的转化形成Agl,因此最终电池反应应为2Ag+l2 = 2AgI < 30填表:。
大学化学(第二版)部分习题参考答案

(PNH3/Pө)2
(PN2/Pө)1 ·(PH2/Pө)3
ΔrGm(T) = ΔrGmө(T)+2.303RT lgQ
Sn(s)+O2(g)= SnO2(s)
[P34:8题] 设汽车内燃机内温度因燃料燃烧反应达到1300℃, 试计算该反应: N2 (g) + O2 (g) = 2NO(g) 在1300℃时的标准摩尔吉布斯函数变和标准平衡常数Kө。
p(O2) = 101.325Kpa×21% = 21.28Kpa
P(O2)
Pө
1
P(O2)/Pө
21.28Kpa
100Kpa
解: 查表可知: Sn(s) + O2(g) = SnO2(s) ΔfGmө (298.15K)/( kJ·mol-1) 0 0 -519.7
(1) 在标准态下自发进行的温度T的计算:
△rSmө(298.15K) =∑viSmө(生成物) -∑viSmө(反应物) =[ 1×106.7] –[1×39.75 + 1×248.22 + 1/2×205.14] = -283.84J·mol-1·K-1
(1000/100)1 ·(1000/100)3
(1000/100)2
ΔrGm(T) = ΔrGmө(T) + 2.303RTlgQ = -21.63 + 2.303×8.314×10-3×573.15×lg(100) = 0.318(kJ·mol-1)
ΔrGm(T) =ΔrGmө(T) +2.303RTlgQ = -145.28 + 2.303×8.314×10-3×1250×lg(22.37) = -112.98kJ·mol-1<0
大学化学课后习题参考答案

第1章 化学热力学参考答案:(一)选择题1.A 2.A 3.C 4.B 5.D 6.C 7.C 8.C 9. A 10. C 11. A 12.C (二)填空题1.40;2.等温、等容、不做非体积功,等温、等压,不做非体积功; 3.>,<,=,> 4.增大、不变 5.不变 6.3.990 kJ·mol -1(三)判断题1. ×2. ×3. ×4. ×5. √6. ×7. ×8. ×9. × 10. × (四)计算题1.解:(g)O N (l)H 2N 4242+O(l)4H (g)3N 22+(l)H N 42摩尔燃烧热为 2.解:)mol ·(kJ 28.254166.963.502)84.285(401f B r --=-⨯--⨯+=∆=∆∑HH ν)mol ·(kJ14.627211r-Θ-=∆=H Q pK 1077.3109.9824.37333mr r ⨯=⨯--=∆∆=-S T 转)mol ·(kJ 78.34357.86)15.137(36.3941f B r --=---=∆=∆∑G ν)K ·mol ·(J 9.9865.21056.1975.191216.21311B r ---=--⨯+==∆∑νNO(g)CO(g)+(g)N 21(g)CO 22+)mol ·(kJ 24.37325.90)52.110(5.3931f B r --=----=∆=∆∑H ν此反应的 是较大的负值,且)(,)(-∆-∆S H 型反应,从热力学上看,在 T 转的温度以内反应都可自发进行。
3.解:外压kPa 50e =p ,11p nRT V =,22p nRTV =,2e p p = 系统所做功:定温变化,0=∆U0=+=∆W Q U ,所以Q =1 247.1(J ) 定温过程pV =常数 ∆(pV )=0 所以 0)(=∆+∆=∆pV U H 4.解:查表知CaO(s) + SO 3(g) = CaSO 4(s)求得同理求得 因为 所以根据经验推断可知,反应可以自发进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.2 习题及详解一.判断题1. 状态函数都具有加和性。
(×)2. 系统的状态发生改变时,至少有一个状态函数发生了改变。
(√)3. 由于CaCO3固体的分解反应是吸热的,故CaCO3的标准摩尔生成焓是负值。
(×)4. 利用盖斯定律计算反应热效应时,其热效应与过程无关,这表明任何情况下,化学反应的热效应只与反应的起,始状态有关,而与反应途径无关。
(×)5.因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的ΔS大大增加。
(×)6. ΔH, ΔS受温度影响很小,所以ΔG受温度的影响不大。
(×)7. 凡ΔGθ大于零的过程都不能自发进行。
(×)8. 273K,101.325KPa下,水凝结为冰,其过程的ΔS<0, ΔG=0。
(√)9.反应Fe3O4(s)+4H2(g) → 3Fe(s)+4 H2O(g)的平衡常数表达式为2244(/)(/)H OTHp pKp pθθθ=。
(√)10.反应2NO+O2→2NO2的速率方程式是:)()(22OcNOkcv⋅=,该反应一定是基元反应。
(×)二.选择题1. 某气体系统经途径1和2膨胀到相同的终态,两个变化过程所作的体积功相等且无非体积功,则两过程( B )A.因变化过程的温度未知,依吉布斯公式无法判断ΔG是否相等B.ΔH相等C.系统与环境间的热交换不相等D.以上选项均正确2. 已知CuCl2(s)+Cu(s)→2CuCl(s) Δr H mΘ(1) =170KJ•mol-1Cu(s)+Cl2(g) → CuCl2(s) Δr H mΘ(2) =-206KJ•mol-1则Δf H mΘ(CuCl,s)应为(D )KJ.mol-1A.36B. -36C.18D.-183. 下列方程式中,能正确表示AgBr(s)的Δf H mΘ的是( B )A.Ag(s)+1/2Br2(g)→ AgBr(s)B.Ag(s)+1/2Br2(l)→AgBr(s)C.2Ag(s)+Br2(l)→ 2AgBr(s)D.Ag+(aq)+Br-(aq)→ AgBr(s)4. 298K下,对参考态元素的下列叙述中,正确的是( C )A.Δf H mΘ≠0,Δf G mΘ=0,S mΘ=0B.Δf H mΘ≠0,Δf G mΘ≠0,S mΘ≠0C.Δf H mΘ=0,Δf G mΘ=0,S mΘ≠0D.Δf H mΘ=0,Δf G mΘ=0,S mΘ=05. 某反应在高温时能自发进行,低温时不能自发进行,则其( B )A.ΔH>0, ΔS<0 ;B. ΔH>0, ΔS>0C.ΔH<0, ΔS<0 ;D.ΔH<0, ΔS>06.1mol气态化合物AB和1mol气态化合物CD按下式反应:AB(g)+CD(g)→AD(g)+BC(g),平衡时,每一种反应物AB 和CD都有3/4mol转化为AD和BC,但是体积没有变化,则反应平衡常数为( B )A.16B.9C.1/9D.16/97.400℃时,反应3H2(g)+N2(g)→2NH3(g)的K673Θ=1.66×10-4。
同温同压下,3/2H2(g)+1/2N2(g)→NH3(g)的Δr G mΘ为(D )KJ.mol-1。
A.-10.57 B.10.57 C.-24.35 D.24.358. 已知下列反应的标准Gibbs函数和标准平衡常数:(1)C(s)+O2(g) → CO2(g) ΔG1Θ,K1Θ(2)CO2(g) → CO(g)+1/2O2(g) ΔG2Θ,K2Θ(3)C(s)+1/2O2(g) → CO(g) ΔG3Θ,K3Θ则它的ΔGΘ,KΘ之间的关系分别是( A )A.ΔG3Θ=ΔG1Θ+ΔG2ΘB.ΔG3Θ=ΔG1Θ×ΔG2ΘC.K3Θ= K1Θ- K2ΘD.K3Θ= K1Θ+ K2Θ9. 若反应A+B → C对A,B来说都是一级反应,下列说法正确的是( C )A.该反应是一级反应B.该反应速率常数的单位可以用min-1C.两种反应物中,无论哪一种物质的浓度增加1倍,都将使反应速率增加一倍D.两反应物的浓度同时减半时,其反应速率也相应减半.10. 对一个化学反应来说,下列叙述正确的是( C )A.ΔGΘ越小,反应速率越快B.ΔHΘ越小,反应速率越快C.活化能越小,反应速率越快D.活化能越大,反应速率越快11. 化学反应中,加入催化剂的作用是( C )A.促使反应正向进行B.增加反应活化能C.改变反应途径D.增加反应平衡常数12. 升高温度,反应速率常数增加的主要原因是( A )A.活化分子百分数增加B.活化熵增加C.活化能增加D.压力增加13. 某反应298K时, Δr GΘ=130KJ•mol-1, Δr HΘ=150KJ•mol-1,下列说法错误的是( C )A.可以求得298K时反应的Δr SΘB.可以求得298K时反应的平衡常数C.可以求得反应的活化能D.可以近似求得反应达平衡时的温度14. 某基元反应2A(g)+B(g)→C(g),其速率常数为k.当2molA与1molB在1L容器中混合时,反应速率是( A )A.4kB.2kC.1/4kD.1/2k15. 某反应在370K时反应速率常数是300K时的4倍,则这个反应的活化能近似值是( A )KJ·mol-1A.18.3B.-9.3C.9.3D.数值不够,不能计算三.填空题1. 对于一封闭系统,定温定容且不做非体积功的条件下,系统热力学能的变化,数值上等于恒容反应热;定温定压且不做非体积功的条件下,系统的焓变,数值上等于恒压反应热。
2. 一种溶质从溶液中结晶析出,其熵值减小 ,纯碳与氧气反应生成CO,其熵值增加。
3. 定温定压下, ΔG可以作为过程自发性的判据。
4. 当ΔH<0,ΔS<0时,低温下反应可能是自发进行,高温下反应可能是非自发进行。
5.U、S、H、G是状态函数,其改变量只取决于系统的始态和终态 ,而与变化的途径无关,它们都是容量性质,其数值大小与参与变化的物质的量有关。
6. 在300K,101.3KPa条件下,100cm3煤气中CO的体积百分数为60% ,此时CO的分压为60.78 KPa,CO的物质的量是 2.437×10-3mol。
7.在一固定体积的容器中放置一定量的NH4Cl,发生反应NH4Cl(s) → NH3(g)+HCl(g),Δr HΘ=177KJ•mol-1,360℃达平衡时测得P(NH3)=1.50KPa.则该反应在360℃时的KΘ= 2.25×10-4 ,当温度不变时,加压使体积缩小到原来的1/2, KΘ值不变,平衡向左移动;温度不变时,向容器内充入一定量的氮气, KΘ值不变,平衡不移动;升高温度, K Θ值增大 ,平衡向右移动。
8. 反应A(g)+B(g)→AB(g),根据下列每一种情况的反应速率数据,写出反应速率方程式: (1)当A浓度为原来的2倍时,反应速率也为原来的2倍;B浓度为原来的2倍时,反应速率为原来的4倍.则V= kC A C B2。
(2)当A2倍;B浓度为原来的2倍时,反应速率为原来的1/2倍.则V= kC A C B-1。
(3)反应速率与A B浓度无关.则V= kC A。
9. 非基元反应是由若干基元反应组成的.质量作用定律不适合非基元反应(复杂反应)。
10.指出下列过程的ΔSΘ大于零还是小于零:(1)NH4NO3爆炸ΔSΘ>0 ;(2)KNO3从溶液中结晶ΔSΘ<0 ;(3)水煤气转化为CO2及H2ΔSΘ>0 ;(4)臭氧的生成:3O3(g)→2O3(g) ΔSΘ<0 ;(5)向硝酸银溶液中滴加氯化钠溶液ΔSΘ<0 ;(6)打开啤酒瓶盖的过程ΔSΘ>0 。
四.计算题1. 标准状态下,下列物质燃烧的热化学方程式如下(1)2C2H2(g)+5O2(g) →4CO2(g)+2H2O(l) ΔH1=-2602 KJ(2)2C2H6(g)+7O2(g) →4CO2(g)+6H2O(l) ΔH2=-3123 KJ(3)H2(g)+1/2O2(g) →H2O(l) ΔH3=-286 KJ根据以上反应焓变,计算乙炔(C2H2)氢化反应:C2H2(g)+2H2(g) →C2H6(g)的焓变。
(ΔH= -312 KJ)2.在100℃,101.3KPa时,2.00molH2(g)与1.00molO2(g)反应生成2.00molH2O(g),反应中释放出484.5KJ热量。
计算生成每mol H2O(g)时的焓变ΔH和热力学能的变化ΔU。
(ΔH=-242.3KJ·mol-1ΔU=-240.7KJ·mol-1)3. 已知下列物质的生成焓:NH3(g) NO(g) H2O(g)ΔH f(KJ/mol) -46.11 90.25 -241.818试计算在25℃标态时,5molNH3(g)氧化为NO(g)及H2O(g)的反应热效应。
(5molNH3(g)的热效应为: ΔH=(-226.376×5)KJ=-1131.85KJ)4. 计算说明用以下反应合成乙醇的条件(标准状态下):4CO2(g)+6H2O(l)→2C2H5OH(l)+6O2(g)(如此高的温度,无实际意义。
)5由锡石(SnO2)冶炼制金属锡(Sn)有以下三种方法,请从热力学原理讨论应推荐哪一种方法。
实际上应用什么方法更好?为什么?(1) SnO2(s)→Sn(s)+O2(g)(2) SnO2(s)+C(s) →Sn(s)+CO2(g)(3) SnO2(s)+2H2(g) →Sn(s)+2H2O(g)6. Ag2O遇热分解:2Ag2O(s)→4Ag(s)+O2(g), 已知在298K时,Ag2O的Δf HΘ=-31.1 KJ·mol-1,Δf G mΘ=-11.2 KJ·mol-1,试求在298K时P(O2)的压力是多少(Pa)?Ag2O的最低分解温度?(p(O2)=11.9Pa T> 465.6 K)7. 反应CaCO3(s)→CaO(s)+CO2(g)在973K时Kθ=2.92×10-2,900℃时Kθ=1.04,试由此计算该反应的9731173,r r G G θθ∆∆及r m r m H S θθ∆∆,。
(r m H θ∆=169.5 KJ·mol -Δr S m Θ=144.8 J·mol -1·K -1Δr G 973Θ=28.6 KJ·mol -1Δr G 1173Θ=-0.382KJ·mol -1)8. 金属钙极易与空气中的氧反应:Ca(s)+1/2O 2(g)→CaO(s) Δf G Θ=-604 KJ ·mol-1 欲使钙不被氧化,在298K 空气中氧气的分压不能超过多少Pa ?( p<1.2×10-207Pa)9. 气体混合物中的氢气,可以让它在200℃下与氧化铜反应而较好的除去:CuO(s)+H 2(g)→Cu(s)+H 2O(g)在298K 时,查表计算反应的ΔG Θ, ΔH Θ, ΔS Θ,和K Θ。
