(完整版)大学化学后7章答案
天津大学物理化学第五版(下)答案(完整版...[1]
![天津大学物理化学第五版(下)答案(完整版...[1]](https://img.taocdn.com/s3/m/9025bd3e5a8102d276a22f55.png)
第七章 电化学7.3 用银电极电解AgNO 3溶液。
通电一定时间后,测知在阴极上析出0.078g 的Ag ,并知阳极区溶液中23.376g ,其中含AgNO 30.236g 。
已知通电前溶液浓度为1kg 水中溶有7.39g AgNO 3。
求Ag +和3NO -迁移数。
解法1:解法1:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。
显然阳极区溶液中Ag +的总量的改变如。
n 电解后(Ag +)= n 电解前(Ag +)+ n 电解(Ag +)- n 迁移(Ag +)则:n 迁移(Ag +)= n 电解前(Ag +)+ n 电解(Ag +)- n 电解后(Ag +)n 电解(Ag +)=()()4Ag 0.0787.22910mol Ag 107.9m M -==⨯()3323.3760.2367.3910(Ag) 1.00710mol 169.87n -+--⨯⨯==⨯解前电30.236(Ag ) 1.38910mol 169.87n +-==⨯电解后n 迁移(Ag +) = 1.007×10-3+7.229×10-4-1.389×10-3=3.403×10-4mol()44Ag 3.40310Ag 0.477.22910n t n +-+-⨯==⨯移解()=迁电 则:t (3NO -)= 1 - t (Ag +)= 1 – 0.471 = 0.53解法2:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。
显然阳极区溶液中3NO -的总量的改变如下:n 电解后(3NO -)= n 电解前(3NO -) + n 迁移(3NO -)则:n 迁移(3NO -)=n 电解后(3NO -)- n 电解前(3NO -)n 电解后(3NO -)=30.236(Ag) 1.38910mol 169.87n +-==⨯解后电n 电解前(3NO-)=()3323.3760.2367.3910(Ag) 1.00710mol 169.87n -+--⨯⨯==⨯解前电n 迁移(3NO -) = 1.389×10-3-1.007×10-3 = 3.820×10-4moln 电解(Ag +)=()()4Ag 0.0787.22910mol Ag 107.9m M -==⨯()4334NO 3.82010NO 0.537.22910n t n ----⨯==⨯移解()=迁电 则: t (Ag +)= 1 - t (3NO -)= 1 – 0.528 = 0.477.5 已知25℃时0.02mol·dm -3KCl 溶液的电导率为0.2768S·m -1。
《大学化学》课后习题答案大全

《⼤学化学》课后习题答案⼤全第⼀章课后作业答案1-4.判断下列⼏种说法是否正确,并说明理由。
(1)原⼦是化学变化中最⼩的微粒,它由原⼦核和核外电⼦组成;正确原⼦是化学变化中的最⼩粒⼦。
原⼦是由居于原⼦中⼼的原⼦核和核外电⼦构成,原⼦核⼜由质⼦和中⼦两种粒⼦构成的。
构成原⼦的基本粒⼦是电⼦、质⼦、中⼦。
(2)相对原⼦质量就是⼀个原⼦的质量;错误相对原⼦质量是指以⼀个碳-12原⼦质量的1/12作为标准,任何⼀个原⼦的真实质量与⼀个碳-12原⼦质量的1/12的⽐值。
(3)4g H2和4g O2所含分⼦数⽬相等;错误4g H2含有2mol氧⽓分⼦。
氢⽓相对分⼦质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧⽓分⼦。
氧⽓相对分⼦质量32,4g/(32g/mol)=0.125mol。
所以分⼦数⽬不相等。
(4)0.5mol的铁和0.5mol的铜所含原⼦数相等;正确铁和铜都是由原⼦构成的⾦属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表⽰原⼦数相同。
(5)物质的量就是物质的质量;错误物质的量:表⽰物质所含微粒数(N)(如:分⼦,原⼦等)与阿伏加德罗常数(NA)之⽐,即n=N/NA。
物质的量是⼀个物理量,它表⽰含有⼀定数⽬粒⼦的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置⽽改变,是物质的基本属性之⼀,通常⽤m表⽰物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最⾼?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最⾼,所以尿素的肥效最⾼。
普通化学第七章课后习题解答

第七章沉淀反应参考答案P 142【综合性思考题】:给定体系0.02mol/LMnCl 2溶液(含杂质Fe 3+),经下列实验操作解答问题。
(已知K θSPMn(OH)2=2.0×10-13,K θSPMnS =2.5×10-13,K θbNH3=1.8×10-5,K θaHAc =1.8×10-5①与0.20mol/L 的NH 3.H 2O 等体积混合,是否产生Mn(OH)2沉淀?解:等体积混合后浓度减半,[Mn 2+]=0.01mol/L ,c b =[NH 3.H 2O]=0.10mol/L∵是一元弱碱体系,且c b /K b θ>500∴10.0108.1][5⨯⨯=⋅=--b b c K OH θ又∵ 622108.101.0][][--+⨯⨯=⋅=OH Mn Q c=1.8×10-8> K θSPMn(OH)2=2.0×10-13∴ 产生Mn(OH)2沉淀。
②与含0.20mol/L 的NH 3.H 2O 和0.2mol/LNH 4Cl 的溶液等体积混合,是否产生Mn(OH)2沉淀? 解:混合后属于NH 3.H 2O~NH 4Cl 的碱型缓冲液体系此时浓度减半:c b =[NH 3.H 2O]=0.2V/2V=0.1(mol.L -1)c S= [NH 4+]=0.2V/2V=0.1(mol.L -1)[Mn 2+]=0.02V/2V=0.01(mol.L -1)A 、求[OH -] 用碱型缓冲液计算式求算:s b b c c K OH ⋅=-θ][ 55108.11.01.0108.1--⨯=⨯⨯= B 、求Qc 22][][-+⋅=OH Mn Q c=0.01×[1.8×10-5]2=3.24×10-12C 、比较θ2)(,OH Mn SP K ∵13)(,100.22-⨯=>θOH Mn SP C K Q故有Mn(OH)2沉淀产生。
高教第五版分析化学课后习题及思考题答案第7章

第七章习题7.1 下列情况,有无沉淀生成?(1)0.001mol·L-1Ca(NO3)2溶液与0.01mol·L-1NH4HF2溶液以等体积相混合;(2)0.01mol·L-1MgCl2溶液与0.1mol·L-1NH3-1mol·L-1NH4Cl溶液等体积相混合。
解:(1)已知:K sp(CaF2)=3.4×10-11两溶液等体积混合后:[Ca2+]=5.0×10-4mol·L-1, [F-]=5.0×10-3mol·L-1,[Ca2+][F-]2=5.0×10-4×(5.0×10-3)2=2.5×10-8>K sp(CaF2)=3.4×10-11∴有沉淀生成。
(2)已知:K b(NH3)=1.8×10-5 K sp (Mg(OH)2)=1.8×10-11[Mg2+]=5.0×10-3mol·L-1, [NH3]=0.05mol·L-1, [NH4]=0.5mol·L-1,[OH-]=K b(NH3)×[NH3]=1.8×10-5×0.05=1.8×10-6mol·L-1 [NH4+] 0.5[Mg2+][OH-]2=5.0×10-3×(1.8×10-6)2=1.6×10-14<K sp∵Q <K sp∴无沉淀生成。
7.2 求氟化钙的溶解度:(1)在纯水中(忽略水解);(2)在0.01 mol·L-1CaCl2溶液中;(3)在0.01mol·L-1HCl溶液中。
解:(1)已知:K sp (CaF2)=3.4×10-11,K a(HF)=3.5×10-4[Ca2+][F-]2= s·(2s)2 = 4s3∴s = 2.0×10-4 mol·L-1(2)考虑同离子效应:[Ca2+][F-]2=0.01×(2s)2=3.4×10-11s =2.9×10-5 mol·L-1(3)考虑酸效应:δF-= Ka(HF)=3.5×10-4=3.5×10-2 Ka+[H+] 3.5×10-4+0.01αF-=1=28.6 3.5×10-2[Ca2+][F-]2=[Ca2+][F-]2·α2=K sp·α2s =1.9×10-3 mol·L-17.3 计算PH=5.0,草酸总浓度为0.05 mol·L-1时,草酸钙的溶解度.如果溶液的体积为300mL,将溶解多少克CaC2O4?解: 已知:K a1(H2C2O4)=5.9×10-2,K a2=6.4×10-5 , K sp(CaC2O4)=1.8×10-9M(CaC2O4)=128.1α (H)=1 δ同理得:α=1.16[Ca2+][C2O42-]总= Ksp(CaC2O4) ·αC2O42-s×0.05=1.8×10-9×1.16 s = 4.2×10-8 mol·L-1溶解损失:m(CaC2O4)=4.2×10-8×0.3×128.1=1.6×10-6(g)= 1.6×10-3(mg)7.4 25℃时,铬酸银的溶解度为每升0.0279g,计算铬酸银的溶度积.解: 已知:M(Ag2CrO4)=331.73设:铬酸银(Ag2CrO4)的溶解度为S.s = 0.0279=8.41 ×10-5mol·L-1 331.73K sp =[Ag+]2[CrO42-]=( 2×8.41×10-5)2×8.41×10-5=2.38×10-127.5 为了使0.2032g (NH4)2SO4中的SO42-沉淀完全,需要每升含63g BaCl2·2H2O的溶液多少亳升?解:已知M((NH4)2SO4)=132.14, M(BaCl2·2H2O)2SO4)=244.3考虑问题的思路是,沉淀剂过量20%~50% 。
有机化学课后习题答案7第七章答案
4.
V2O5, O2
一. 命名或写出结构式
1.
2. C2H5
NO2
Br2 Fe
NO2 Br
O
O
O
O
浓H2SO4
AlCl3 O
COOH
O
习题 B 答案
CH3 3.
OH 4.
SO3H
H3C
5.
6.
7. 2-乙基-9,10-蒽醌 8. 2-环丙基萘
9. 1,4-二甲基萘 10. 邻苯二甲酸酐
二.用休克尔规则判断下列化合物是否有芳香性
CHO
CHO
CH3 NBS
O2, V2O5 400-500℃
CH2MgBr 无水乙醚
CH2Br Mg 无水乙醚
CH2MgBr
O
O AlCl3
O
O Zn-Hg HCl
HOOC
H2SO4 HOOC
H3O+
H2/Ni HO CH2
H2SO4 HO CH2
O CH2
5.
O
O
Zn-Hg
浓H2SO4
O AlCl3
第七章 稠环芳香烃
一.写出下列化合物的结构式
习题 A 答案
NO2
Cl
Br
OH
1.
2.
3. NO2
4.
5.
6.
7.
8.
CH3 H3C
9.
10.
二.用系统命名法命名下列化合物 1、8-溴-1-萘甲醚 2、1-萘甲醛(α-萘甲醛) 3、8-氯-1-萘甲酸 4、2-氯-6ˊ-溴联苯 5、9-硝基菲 6、2-甲基蒽 7、2,6-二甲基萘 8、2-萘酚(β-萘酚) 三、选择题 1、C 2、A 3、B 4、AD 5、C 6、D 四.下列化合物有无芳香性,为什么? 解:(1)的π电子数为 4 个,不符合 4n+2 规则,没有芳香性。
无机及分析化学 第七章氧化还原反应课后习题答案
K 9.62 1018
由于K 数值很大,化学计量点时反应进行较完全。
18.常采用K2Cr2O7法测定水体中的化学耗氧量(COD),取废水样 100.0mL,用硫酸酸化后,加入0.02000mol· L-1的K2Cr2O7溶液25.00 mL,在Ag2SO4存在下煮沸以氧化水样中还原性物质,再以试铁灵 为指示剂,用0.1000mol· L-1的FeSO4溶液滴定剩余的Cr2O72-,用去 18.20mL,计算废水样中的化学耗氧量(以O2计,mg· L-1表示)。
2
0.0592 2 E H / H lg 0.1 2 2 0.0592V
(4)在1.0L上述(3)的溶液中加入0.10mol固体NaOH,
E H / H2 ?
0.0592 (cH / c ) E H / H2 E H / H lg 2 n (p H2 /p)
2S2 O32 I 2 S4 O62 2 I Cr2O72 ~ 3I 2 ~ 6S2O32
6nCr O2 nS O2
2 7 2 3
mK2Cr2O7 M K2Cr2O7
25 6 cNa S O VNa S O 2 2 3 2 2 3 100
0.4903 6 cNa S O 25 103 2 2 3 294.18 4 cNa S O 0.1000mol L1
3、对于下列氧化还原反应:(1)指出哪个是氧化剂, 哪个是还原剂?写出对应的半电池反应。(2)按这 些反应设计成原电池,并写出原电池符号。
2 Ag aq Zn s 2 Ag s Zn2 aq
正极反应: Ag e Ag , 氧化剂为Ag 负极反应: Zn -2e- Zn2+ , 还原剂为Zn (-)Zn Zn2+(c1) Ag+(c2) Ag(+)
南昌大学大学化学第七章习题答案
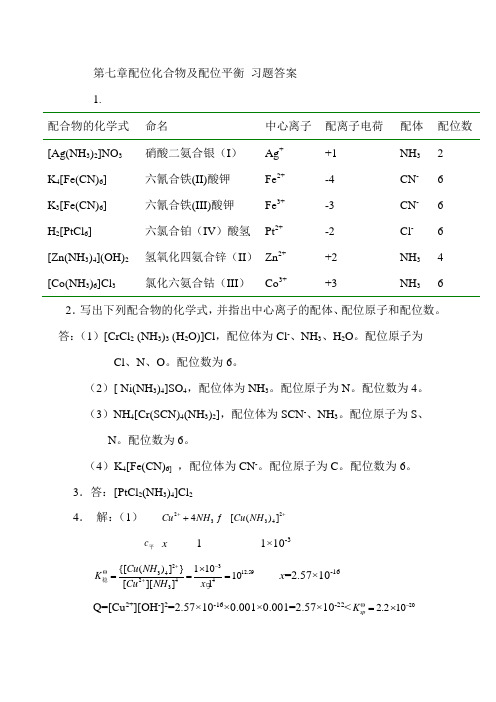
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。
物理化学中国石油大学课后习题答案第7章

Ag + 和NO3的迁移数分别为
t Ag +
=
n迁 n电
=
0.0003399 0.0007229
= 0.47
tNO3 = 1 − tAg+ = 0.53
6、在 298K时电解用Pb(s)作电极的Pb(NO3)2溶液,该溶液的浓度为每 1000g水中含有 Pb(NO3)216.64g,当与电解池串联的银库仑计中有 0.1658g银沉积后就停止通电。阳极部 溶液质量为 62.50g,经分析含有Pb(NO3)21.151g,计算Pb2+的迁移数。
n迁 = n始 − n终 + n电
= ⎡⎣(3.082 − 3.475 + 0.7683)×10−3 ⎤⎦ mol = 3.753×10−4 mol
t Pb 2+
=
n迁 n电
=
3.753 × 10−4 7.683 × 10− 4
= 0.49
7、以银为电极通电于氰化银钾(KCN+AgCN)溶液时,银(Ag)在阴极上析出。每通 过 1mol电子的电量,阴极部失去 1.40mol的Ag+和 0.8mol的CN-,得到 0.6mol 的K+,试求:
n终
=
WAgNO3 M AgNO3
=
⎛ ⎜⎝
0.236 169.91
⎞ ⎟⎠
mol
=
0.001389mol
电解前后,阳极部 Ag + 物质的量的变化是由 Ag + 的迁出和 Ag + 的电解所引起的,则
n迁 = n始 − n终 + n电
= (0.001006 − 0.001389 + 0.0007229) mol = 0.0003399mol
大学化学第七章习题答案

大学化学第七章习题答案大学化学第七章习题答案第一题:化学反应速率的大小与哪些因素有关?请列举并解释。
化学反应速率的大小与以下因素有关:1. 温度:温度升高会增加反应物分子的平均动能,使反应物分子的碰撞频率和能量增加,从而增加反应速率。
2. 浓度:反应物浓度的增加会增加反应物分子的碰撞频率,从而增加反应速率。
3. 催化剂:催化剂可以提供反应的可行路径,降低反应的活化能,从而增加反应速率。
4. 反应物的物理状态:气体态反应速率大于液体态反应速率,液体态反应速率大于固体态反应速率。
因为气体分子的平均自由路径较长,碰撞频率较高。
5. 表面积:反应物的表面积越大,反应速率越快。
因为反应物分子在固体表面上的碰撞更容易发生。
第二题:化学平衡是指什么?请简要解释。
化学平衡是指在封闭系统中,反应物与生成物之间的反应速率相等,反应物与生成物的浓度保持不变的状态。
在化学平衡下,虽然反应仍在进行,但反应物和生成物的浓度不再发生变化。
化学平衡是动态平衡,意味着反应物和生成物之间的反应仍在进行,只是正反应和逆反应的速率相等,所以浓度保持不变。
化学平衡是一种动态的、稳定的状态,可以通过改变温度、压力、浓度等条件来调节平衡位置。
第三题:什么是离子反应?请举例说明。
离子反应是指反应中涉及到离子的反应。
在离子反应中,离子之间发生交换或结合,形成新的化合物。
例如,NaCl溶解在水中时会产生离子反应。
NaCl溶解后,钠离子(Na+)和氯离子(Cl-)与水分子发生作用,形成水合离子。
这个过程可以用离子方程式表示为:NaCl(s) + H2O(l) → Na+(aq) + Cl-(aq)在这个反应中,固体NaCl溶解为水相中的离子Na+和Cl-。
离子反应在化学中非常常见,它不仅可以发生在溶液中,还可以发生在固体之间或气体之间。
离子反应的速率和平衡位置可以通过改变反应物浓度、温度等条件来调节。
第四题:什么是酸碱中和反应?请举例说明。
酸碱中和反应是指酸和碱反应生成盐和水的反应。
分析化学课后习题答案(第7章)

7.1 计算下列重量因数:测定物 称量物(1)FeO Fe 2O 3(2)KCl (→K 2PtCl 6→Pt ) Pt(3)Al 2O 3 Al(C 9H 6ON)3 (4)P 2O 5 (NH 4)3PO 4·12MoO 3答案:232(FeO)271.85(1)0.8999(Fe O )159.69M M ⨯== 2(KCl)274.55(2)0.7643(Pt)195.08M A ⨯== 23963(Al O )101.96(3)0.11102(Al(C H ON))2459.44M M ==⨯ 254343(P O )141.94(4)0.037822((NH )PO 12MoO )21876.3M M ==⨯ 7.2 称取某可溶性盐0.3232g ,用硫酸钡重量法测定其中含硫量,得BaSO 4沉淀0.2982g ,计算试样含SO 3的质量分数。
答案:3443(SO )(BaSO )(BaSO )(SO )100%0.29820.3430 100%31.65%0.3232s M m M w m =⨯⨯=⨯= 7.3 用重量法测定莫尔盐(NH 4)2SO 4·FeSO 4·6H 2O 的纯度,若天平称量误差为0.2mg ,为了使灼烧后Fe 2O 3的称量误差不大于0.1%,应最少称取样品多少克?答案:323424423234244230.210100%0.1%(Fe O )2(NH )SO FeSO 6H O0.210100%(Fe O )0.1%2((NH )SO FeSO 6H O)0.210 100%1(g)1600.1%2392s s M m M m M M ---⨯⨯≤⋅⋅⨯≥⨯⋅⋅⨯=⨯=⨯⨯ 7.4 计算下列微溶化合物在给定介质中的溶解度(除(1)题外均采用I =0.1时的常数)。
(1) ZnS 在纯水中(p K 0sp (ZnS)=23.8,H 2S 的p K a1=7.1,p K a2=12.9);(2) CaF 2在0.01mol ·L -1 HCl 溶液中(忽略沉淀溶解所消耗的酸);(3) AgBr 在0.01mol ·L -1 NH 3溶液中;(4)BaSO4在pH7.0,EDTA浓度为0.01mol·L-1的溶液中;(5)AgCl在0. 10 mol·L-1的HCl溶液中。
大学化学课后习题答案解析..

第一章化学反应热教学内容1.系统、环境等基本概念;2. 热力学第一定律;3. 化学反应的热效应。
教学要求掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。
知识点与考核点1.系统(体系)被划定的研究对象。
化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。
2.环境(外界)系统以外与之密切相关的部分。
系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。
系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换);封闭体系(系统与环境之间没有..物质交换,只有..能量交换);孤立系统(体系与环境之间没有物质交换,也没有能量交换)系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为的边界,目的是确定研究对象的空间范围。
3.相系统中物理性质和化学性质完全相同的均匀部分。
在同一个系统中,同一个相可以是连续的,也可以是不连续的。
例如油水混合物中,有时水是连续相,有时油是连续相。
4.状态函数状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些宏观性质描述的,这些宏观性质又称为系统的状态函数。
状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。
5*.过程系统状态的变化(例如:等容过程、等压过程、等温可逆过程等)6*.途径完成某过程的路径。
若系统的始、末态相同,而途径不同时,状态函数的变量是相同的。
7*.容量性质这种性质的数值与系统中的物质的量成正比,具有加合性,例如m(质量)V、U、G等。
8*.强度性质这种性质的数值与系统中的物质的量无关,不具有加合性,例如T、 (密度)、p(压强)等。
9.功(W)温差以外的强度性质引起的能量交换形式[W=W体+W有]。
兰叶青无机化学课后习题答案7

第七章 习题答案7—1解:设BaSO 4在水中的溶解度为S 1(mol ·L -1);在0.10mol•L -1Na 2SO 4溶液中的溶解度为S 2(mol ·L -1).由 )()()(aq SO aq Ba s BaSO 2424-++= 222222sp 441010BaSO Ba SO c S .S K c /c c /c S /c ΘΘΘΘΘ+-⋅+⎡⎤⎡⎤===⎣⎦⎣⎦()()()()()(纯水中) (Na 2SO 4中)已知 10sp 4BaSO 10710K .Θ-=⨯()解得 S 1=1.03×10-5mol•L -1由同离子效应知,S 2<S 1=1.03×10-5mol•L -1所以 0.10+ S 2≈0.10 解得S 2=1.1×10-9mol•L -17—2解:(1)7213sp AgBr 88107710K ..Θ--=⨯=⨯()()(2)5313sp 44Mg NH PO 63102510K ..Θ--=⨯=⨯(())() (3)55213sp 32Pb IO 3110101210K ..Θ---=⨯⨯⨯⨯=⨯(())(2 3.1) 7—3 解:两液混合后,13132L mol 1001L mol 1001001001002Pb ----+⋅⨯=⋅+⨯⨯=.....c)()( 11L mol 0200L mol 1001001000400I ---⋅=⋅+⨯=.....c )()(22PbI s Pb aq 2I aq +-+()()()根据溶度积规则,计算离子积Q :22327Q Pb I 101000204010c /c c /c ...ΘΘ+---⎡⎤⎡⎤==⨯⨯=⨯⎣⎦⎣⎦()()查表得 9sp 2PbI 84910K .Θ-=⨯()即 )(2sp PbI Q ΘK 〉 应有PbI 2沉淀产生. 7—4解:查表39sp 3Fe OH 26410K .Θ-=⨯(())17sp 2Fe OH 48710K .Θ-=⨯(()) Fe (OH )3沉淀完全时,c (Fe 3+)≤1.0×10-5mol·L -1,此时OH c /c Θ-==()解得 c (OH -)=6.4×10-12 mol·L -1pH=14-pOH=2.81,即pH 至少为2.81。
中南大学物化课后习题答案-7--章-化学动力学

第7章化学动力学1.以氨的分解反应2NH3==== N2+3H2为例,导出反应进度的增加速率与,,之间的关系,并说明何者用于反应速率时与选择哪种物质为准无关。
解:∴,,2.甲醇的合成反应如下:CO+2H2 ===== CH3OH已知,求,各为多少?(答案:2.44,4.88mol·dm-3·h-1)解:,3.下列复杂反应由所示若干简单反应组成,试根据质量作用定律写出以各物质为准的速率方程式。
(1) (2)(3) (4)解:(1) ,,(2)(3)(4)4.理想气体反应 2N 2O 5 → 4NO 2+O 2,在298.15 K 的速率常数k 是1.73×10-5s-1,速率方程为。
(1)计算在298.15K 、、12.0 dm 3的容器中,此反应的和即各为多少?(2)计算在(1)的反应条件下,1s 内被分解的N 2O 5分子数目。
(答案:(1)7.1×10-8,-1.14×10-7md·dm -3·s -1 (2)1.01×1018 )解:(1) mol·dm -3mol·dm-3·s-1∴mol·dm-3·s-1(2)1.4×10-7×12.0×6.022×1023=1.01×1018个分子5.已知每克陨石中含238U 6.3×10-8g,He为20.77×10st1:chmetcnv UnitName="cm"SourceValue="6" HasSpace="False" Negative="True" NumberType="1" TCSC="0">-6cm3(标准状态下),238U的衰变为一级反应:238U → 206Pb+84He由实验测得238U的半衰期为=4.51×109 y,试求该陨石的年龄。
大学《有机化学》课后习题答案

第一章绪论2. (1) (2) (5) 易溶于水;(3) (4) (6) 难溶于水。
4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C 3H6F2第二章有机化合物的结构本质及构性关系1. (1) sp 3(2) sp (3) sp 2 (4) sp (5) sp 3 (6)sp2第四章开链烃1. (1) 2- 甲基-4,5- 二乙基庚烷(2) 3- 甲基戊烷(3) 2,4- 二甲基-3- 乙基戊烷(4) ( 顺)-3- 甲基-3- 己烯or Z-3- 甲基-3- 己烯(12) 3- 甲基-1- 庚烯-5- 炔2.CH3(1)CH3CH2CH C H (CH2)4CH3 (2) (CH3)2CHCH2CH2CH3C2H5CH3C H3(3) (CH3)2CHC CH(CH3)2 (4) CH3CH2CH C(CH2)3CH3C2H5 (5) (CH3)2CHC CH(CH2)3CH3C2H5H3C(6) C CHHCH2CH2CH3H3C CH2CH3(7) (8) (CH3)2CHC C C CCH(CH3)2C CH CH3(9)H3CC CCH2 CHC CH HHCH3H5C2 C2H5(1 0) C CH3CCH37.(1)Br BrBr H HCl Cl H(2) (3)HBrH H H HH HBrBr11.(1) CH3CHCH2CH2CH3 (2) (CH3)2CCH2CH3Br BrCH3(3) (CH3)2CCH( C H3)2(4) C H3CH2CC2H5BrBr 12.(1) (2) CH3CH2CH2CH3 (3) CH3CHCH2CH3(CH3)2CCH2CH3ClOHH3C (4) CH3COOH + C OH3C (5) C H3CH2CHCH3OSO3HOC H3CH2CHCH3OH(6) CH3CH2CH2CBr2C H3 (7)C H3CCH2CH3Br(8) ( C H3)2CCH CH2 + (CH3)2C CH C H2BrCH CH2CHO (9) ( CH2C CH C H2 ) n (10)+ ( CH2 C ) nClCl14. (5) >(3) >(2) >(1) >(4) 即:+HCH + CH2=CHC 3 >(CH3) 3C+HCH +H +H>CH3CH2C 3 >CH3CH2CH2C 2>(CH3) 2CHC216. (1)1-戊烯√溴褪色+ ×Ag(NH 3)21-戊炔B r 2/CCl 4室温,避光√溴褪色√灰白色戊烷×(2)1-丁炔+Ag(NH 3)2√灰白色↓√溴褪色Br2/CCl 42-丁炔×室温,避光×丁烷×(3)1,3-丁二烯√溴褪色+ ×Ag(NH 3)2Br2/CCl 4 1-己炔√溴褪色√灰白色↓2,3-二甲基丁烷×17.(2)H2OCH CH [CH2 CHOH]H2SO4,H g SO4C H3CHO21 A B.10.(1)CH3-CH=CH2KMnO / H4 CH3COOH(2)CH3- C≡CH+HB(r 2mol)CH 3CBr2CH3HBr (1mol )(3)CH3- C≡CH CH3-C=CH2 Br2 CH3CBr2CH2BrBr第四章环烃2.C(CH 3 )3(1) (2) (3)CH 33.(1)(3)C H 3Br反式顺式4.Br ClCl +Cl(1)(2)(3)( C H 3)2CCH (CH 3)2 O 2NC H 3BrClB r(4)(5)H 3CCOOHC 2H 5+ Br C 2H 5(6) (CH 3)3CCOOH(7) CH 3COCH 3(8) 1molCl2/ h, 苯/ 无水 AlCl 3CH 3N H COCH 3NO 2(9) (10)SO 3HC H 37. (2) 有芳香性 10.第六章 旋光异构6-32. (1) × (2) × (3) × (4) √ (5) √ (6) √7. [ ] 20 Dc l18.85.678 20 166.2第七章卤代烃2、Cl白↓ClAgNO 3/乙醇,室温(2)×白↓AgNO 3/乙醇,加热××Cl4、第八章醇、酚、醚1. (1) 3- 甲基-3- 戊烯-1- 醇(2) 2- 甲基苯酚(3) 2,5- 庚二醇(4) 4- 苯基-2- 戊醇(5) 2-溴-1- 丙醇(6) 1- 苯基乙醇(7) 2- 硝基-1- 萘酚(8) 3- 甲氧基苯甲(9) 1,2- 二乙氧基乙烷(乙二醇二乙醚)3、(2)(1)4. (1) 甲醇分子间氢键(6) 邻硝基苯酚分子内氢键、分子间氢键5、(1)H3 CO OH(5) (6) (7)H OHCH2I OCH 36、(1)OH+O,△浓硫酸,△H 3OHBr(2)浓硫酸,△Br2/CCl4OHBrKOH/EtOH△10、OH O ClA B C D第九章醛、酮、醌一、命名下列化合物。
第7章参考答案

第七章参考答案思考题7-1(1)4-甲基-2-环己烯 R-2-氯-1-丙醇 S-1-氯-2-丙醇(2)①CH3CH2OH②CH3CH3O H③CH3CH3O H④CH3CH2OHC H3⑤CH3C H3C H3O H⑥CH3C H3CH2OH⑦CH3C H3CH3O H⑧CH3CH3C H3CH2OH思考题7-2(1)CH CHCH3CH3C lC H3(2)CO2(3)O思考题7-3因硝基是很强的吸电子基团,使苯环上电子云密度减小, 从而使O-H键极性增强, 更易断裂给出氢质子,酸性更强,特别是受到三个硝基的影响,以致酸性比乙酸、碳酸强,因而pKa值比乙酸的pKa值(4.74)小, 能溶于碳酸氢钠水溶液。
思考题7-4(1)O H+C2H5I(2)二苯醚中氧原子以sp2方式杂化,其未参与杂化的p轨道与苯环的大Π键形成p-Π共轭体系,使C-O键增强,不易断裂,因而二苯醚难被HI分解。
思考题7-5(1)OH CH2I(2)1,2-环氧化合物为极性三元环状化合物,具有较强的环张力而不稳定,性质非常活泼,因而比一般的醚类化合物更容易发生碳氧键的断裂反应。
思考题7-6(1)O H O HS HCOOH(2)醇类的氧化反应发生在与羟基相连的碳原子上,氧化产物为醛、酮、羧酸。
而硫醇氧化反应发生在硫原子上,生成二硫化物、磺酸。
习题1. 命名下列化合物。
(1)2-丁醇(2)1,3-丁二醇(3)4-甲基-3-戊烯-1-醇(4)顺-3-甲基环戊醇(5)苯甲醚(6)对甲氧基苯酚(7)7-甲基-2-萘酚(8)1-甲氧基-1-丙烯(9)4-甲基-4’-氯二苯醚(10)4-甲基-3-环己烯(11)2-溴-3-甲氧基-1-丙醇(12)2-丁硫醇(13)4-溴苯硫酚(14)2,3-二巯基-1-丙醇(15)二乙硫醚2. 写出下列化合物的结构式。
(1)CH3C C C H3C H3C H3O H O H(2)HCH3(3)O HCl(4)O(5)OCH3OCH3(6)O HO2N(7)O HNO2O2NNO2(8)C2H5SH(9)HO CH3CH=CH2C2H5(10)CH3SCH3O(11)SC2H5(12)SH3. 沸点由高到低:(4)›(3)›(2)›(1)4. 酸性由强到弱:(4)›(3)›(2)›(1)5. 完成下列化学反应式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.2 习题及详解一.判断题1.铝、铬金属表面的氧化膜具有连续结构并有高度热稳定性,故可做耐高温的合金元素。
(√)2.在Δr G -T图中,直线位置越低,Δf G 越负,则反应速率越快。
(×)3.Mg 是活泼金属,但由于常温下不与冷水反应,所以不容易腐蚀。
(×)4.Na 与H 2O 反应时,水是氧化剂。
(√)5.298K 时,钛可与氧、氮、硫、氧等非金属生成稳定化合物,故在炼钢时加入钛以除去 这些杂质。
(×)6.某溶液中可同时含有Na +、[Al(OH)4]- 和Cr 2O 72–。
(×)7.MnO 4–的还原产物只与还原剂有关。
(×)8.反应Zn(s)+Cu 2+(aq)→Zn 2+(aq)+Cu(s)的发生可用电离能说明。
(×)二.选择题1.下列元素在常温时不能与氧气(空气)作用的是 (B )A . LiB . SnC . ScD .Mn2.常温下,在水中能稳定存在的金属是 (D )A .CeB . CaC . CrD .Ni3.下列金属中,能与水蒸气作用生成相应氧化物的是 (B )A .BaB .FeC .HgD . Pb4.过渡元素的下列性质中错误的是(A )A .过渡元素的水合离子都有颜色B . 过渡元素的离子易形成配离子C .过渡元素有可变的氧化数D . 过渡元素的价电子包括ns 和(n-1)d 电子5.第一过渡系元素的单质比第二、第三过渡系活泼,是因为 (D )A .第一过渡系元素的原子半径比第二、第三过渡系小B .第二、第三过渡系元素的单质的外层电子数比第一过渡系多C .第一过渡系元素的离子最外层d轨道屏蔽作用比第二、第三过渡系的小D .第二、第三过渡系比第一过渡系元素原子的核电荷增加较多,且半径相近6.易于形成配离子的金属元素位于周期系中的(D )A .p 区B .s 区和p 区C .s 区和f 区D .d 区和 ds 区7.钢铁厂炼钢时,在钢水中加入少量钛铁,是因为 (A )A .钛铁可除去钢中的非金属杂质B . 钛铁具有抗腐蚀性C . 钛铁密度小D .钛铁机械强度大8.在酸性溶液中,下列各对物质能共存的是 (C )A .SO 32- 、 MnO 4-B . CrO 2- 、 Sc 3+C .MnO 4- 、 Cr 2O 72-D . CrO 3 、 C 2H 5OH9.贮氢合金是两种特定金属的合金,其中一种可大量吸进氢气的金属是 (D )A . s 区金属B .d 区金属C .ds 区金属D .稀土金属10.需要保存在煤油中的金属是 (A )(A )Ce (B) Ca (C) Al (D) Hg θm θm三.填空1. 将金属按化学活泼性分类,活泼金属元素在_ s 区和IIIB _____ 区,中等活泼金属元素在_ d ,ds ,P _____ 区,不活泼金属元素在__ d ,ds _____ 区。
2.冶金工业上把金属分为__黑色_____ 金属和___有色______ 金属两大类,前一类包括___铁、锰、铬及其合金___ ,后一类包括__除黑色金属以外的所有金属及其合金。
____ 。
3.轻金属一般是指__密度小于5g·cm -3__ 的金属,其特点是__质轻、化学性质活泼_______ 。
化学性质特别稳定,在地壳中含量很少,___开采__ 和 ___提取___都比较困难、因而价格昂贵的金属称为__贵金属 _______。
4.自然界含量较少,分布___稀散_____ ,发现较晚,难提取的金属称为__稀有金属_______ 。
放射性金属指__原子核能自发地放射出射线的金属___________ 。
5.常温下,__ s ____区金属易与氧化合,P 区金属中___ ⅢA 族的Al _____易与氧化合,在d 及ds 区金属中只有__第4_____ 周期金属能与氧作用,生成相应氧化物。
6.根据Δr G -T图,分别写出有关Mg 、Al 与它们的氧化物间能自发进行的置换反应的方程式。
1273K 时:__3Mg + Al 2O 3 = 3MgO + 2Al ;1733K 时:__2Al + 3MgO = 3Mg + Al 2O 3 。
7.根据Δr G -T 图,碳的还原性强弱与温度的关系是__温度升高还原性增强________ ,在1273K 时C 、Mg 、Al 的还原能力由强到弱的顺序是____ Mg,Al,C ______________; 在2273K 时,Mg__不能____ 还原Al 2O 3。
8.金属与水作用的难易程度与金属的___电极电势____ 和___反应产物的性质______有关。
所以在金属Ca 、Co 、Cr 中只有___ Ca __ 可以与H 2O 反应。
9.下列物质的化学式为:金红石___ TiO 2___ 、铬绿___ Cr 2O 3___ 、红矾钾__ K 2CrO 7______。
10.在Mg 2+、Cr 3+ 、Mn 2+、 Ca 2+ 的混合溶液中加入过量氨水后,溶液中存在有___[Cr(NH 3)6]3+、Ca 2+ _ 离子,沉淀中有____ Mg(OH)2、 Mn(OH)2 __(_ MnO 2• H 2O ) 。
11.写出下列离子或分子的颜色:MnO 42- __绿色___,Cr 3+ ___绿色__,TiO 2(金红石)_ 红色或黄色 ,Mn 2+_浅粉色___ ,K 2Cr 2O 7__橙红色___ ,K 2CrO 4___黄色____ 。
12.填表 单质特性 化学符号 原子外层电子结构式 最硬的金属 Cr3d 54s 1 熔点最低的金属 Hg 5d 106s 2导电性最好的金属 Ag 4d 105s 1熔点最高的金属 W 3d 46s 2密度最大的金属 Os 5d 64s 213.周期系中从原子序数58~71,称为__镧系 元素,用___ Ln 表示。
ⅢB 族的__钪、钇_ 和__镧系元素__ 性质相似,它们统称为___稀土__ 元素,用__ RE _ 表示。
14.镧系元素的原子半径和三价离子半径随__原子序数__的增加而逐渐_缓慢减小__的现象,称为__镧系收缩___ 。
15.稀土元素一般以__+3_____氧化数比较稳定,这反映了___ ⅢB _____ 族元素的特点。
16.由于钛和钛合金具有__质轻__、__机械强度大___ 、__抗腐蚀性强___ 、__熔点高___等特点,因此,被称为___第三金属__,成为很有发展前途的__新型轻金属__ 材料。
θm θm17.贮氢合金中,一种金属能__大量吸进H 2 ___ ,另一种金属与___氢的亲和力要小______ ,第一种金属的作用是__控制H 2的吸藏量___ ,第二种金属的作用是____控制吸氢、放氢的可逆性____6.2 习题及详解一.判断题1.热稳定性比较:HNO 3<NaNO 3, HClO 3< HClO 4, CaCO 3>BeCO 3(√) 2.酸性比较:HF<HCl, HNO 3< HNO 2(×) 3.卤素能与金属反应而不与非金属反应(×) 4.铜和浓硫酸反应的主要的产物有SO 2 气体。
(√) 5.用来与氯气反应制备漂白粉的物质是氢氧化钙。
(√) 6.王水能溶解金而硝酸不能,是因为王水对金有配合性,又有氧化性。
(√) 7.单质碘I 2与碱NaOH 作用,不能发生歧化反应。
(×) 8.亚硝酸钠的主要工业用途是食品防腐剂。
(√) 9.离子极化作用越强,所形成的化合物的离子键的极性就越弱。
(√) 10.(×)二.选择题1. 下列生成HX 的反应不能实现的是(B )(A )(B )(C )(D )2. 下列盐中,热稳定性大小顺序正确的是(D )(A )NaHCO 3 < Na 2CO 3 < MgCO 3(B )Na 2CO 3 < NaHCO 3 < MgCO 3(C )MgCO 3 < NaHCO 3 < Na 2CO 3(D )NaHCO 3 < MgCO 3 < Na 2CO 33. 浓HNO 3与B 、C 、As 、Zn 反应,下列产物不存在的是(B )(A)和B 反应得到H 3BO 3(B)和C 反应得到H 2CO 3(C)和Zn 反应得到Zn(NO 3)2(D)和As 反应得到H 3AsO 44. 下列含氧酸中酸性最弱的是(B )(A)HClO ; (B )HIO ; (C )HIO 3; (D )HBrO5. 下列酸中,酸性由强至弱排列顺序正确的是(B ) O H FO F OH F 222++→+---4243PO NaH HI (+−→−+∆浓)PO H NaI 4242SO K 2HBr SO H 2KBr +→+(浓)3322PO 2H 6HI O 6H 2P 3I +→++HCl NaHSO SO H NaCl 442+→+(浓)(A)HF 〉HCl 〉HBr 〉HI(B )HI 〉HBr 〉HCl 〉HF(C )HClO 〉HClO 2 〉HClO 3 〉HClO 4(D )HIO 4 > HClO 4 > HBrO 46. 所示反应:2Pb(NO 3)2的产物是( D ) (A) Pb(NO 2)2(s)+NO 2(g)(B) Pb(NO 2)2(s)+O 2(g)(C) PbO(s)+O 2(g)(D) PbO(s)+NO 2(g)+O 2(g)7. 下列过渡金属的氯化物是共价化合物的是( A )(A)TiCl 4(B)FeCl 3 (C)NiCl 2 (D)CuCl三.填空题1. 周期系中非金属元素有 22 种,它们分布在 p (H 在s 区) 区、 ⅢA-ⅦA 及零 族。
在非金属元素的单质中,熔点最高的是 金刚石 ,沸点最低的是 氦 ,硬度最大的是 金刚石 ,密度最小的是 H 2 ,非金属性最强的是 F 22. 比较下列几组卤化物熔点的高低:SnCl 2和SnCl 4中, SnCl 2 〉 SnCl 4 ;NaCl 和AgCl 中, NaCl 〉 AgCl ;KCl 和NaCl 中, NaCl 〉 KCl 。
3.填入恰当的化学式:两性氧化物有 Al 2O 3 , ZnO ;可作磨料的物质有 Al 2O 3 , Cr 2O 3 ;酸性耐火材料的主要成分为 SiO 2 ;中性耐火材料的主要成分为 Al 2O 3 ;可做盐浴剂的氯化物有 NaCl , KCl ;具有半导体性质的化合物有 GaAs 等ⅢA 和ⅤA 族化合物 ;目前临界温度最高的超导材料为 Ca-Cu-Ba(Tc=123K) ;应用最多的气体激光材料为 He-Ne 。
