电化学3
电化学第3章电化学极化讲解

电化学第3章电化学极化讲解第3章电化学极化(电荷转移步骤动⼒学)绪论中曾提到:⼀个电极反应是由若⼲个基本步骤形成的,⼀个反应⾄少有三个基本步骤:00R R ze O O s s →→+→-1) 反应粒⼦⾃溶液深处向电极表⾯的扩散——液相传质步骤。
2) 反应粒⼦在界⾯得失电⼦的过程——电化学步骤。
3) 产物⽣成新相,或向溶液深处扩散。
当有外电流通过电极时,?将偏离平衡值,我们就说此时发⽣了极化。
如果传质过程是最慢步骤,则?的偏离是由浓度极化引起的(此时0i s i C C ≠,e ?的计算严格说是⽤s i C 。
⽆浓度极化时0i s i C C =,?的改变是由s i C 的变化引起)。
这时电化学步骤是快步骤,平衡状态基本没有破坏。
因此反映这⼀步骤平衡特征的Nernst ⽅程仍能使⽤,但须⽤?代e ?,s i C 代0i C ,这属于下⼀章的研究内容。
如果传质等步骤是快步骤,⽽电化学步骤成为控制步骤,则这时?偏离e ?是由电化学极化引起的,也就是本章研究的内容。
实际上该过程常常是⽐较慢的,反应中电荷在界⾯有积累(数量渐增),?随之变化。
由此引起的?偏离就是电化学极化,这时Nernst ⽅程显然不适⽤了,这时?的改变将直接以所谓“动⼒学⽅式”来影响反应速度。
3.1 电极电位与电化学反应速度的关系电化学反应是⼀种特殊的氧化—还原反应(⼀个电极上既有氧化过程,⼜有还原过程)。
若⼀个电极上有净的氧化反应发⽣,⽽另⼀个电极上有净的还原反应发⽣,则在这两个电极所构成的电化学装置中将有电流通过,⽽这个电流刚好表征了反应速度的⼤⼩,)(nFv i v i =∝[故电化学中总是⽤i 表⽰v ,⼜i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也⽤i 表⽰v 。
i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为mol/(cm 2.s )]。
既然电极上有净的反应发⽣(反应不可逆了),说明电极发⽣了极化,?偏离了平衡值,偏离的程度⽤η表⽰,极化的⼤⼩与反应速度的⼤⼩有关,这⾥就来研究i ~?⼆者间的关系。
3电化学三电极体系
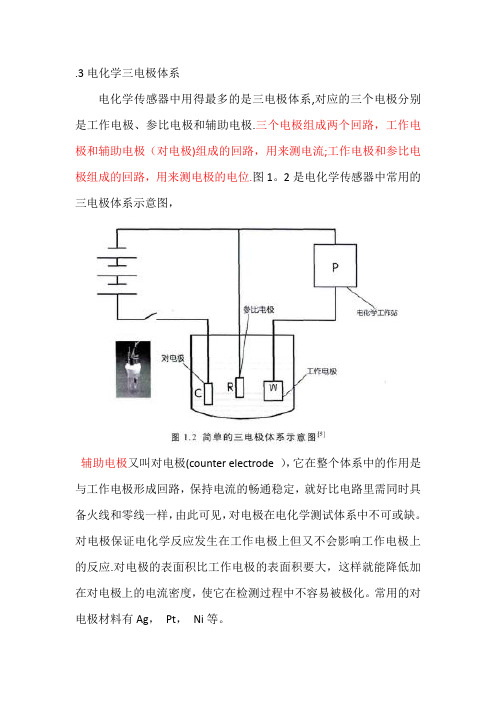
3电化学三电极体系work Information Technology Company.2020YEAR.3电化学三电极体系电化学传感器中用得最多的是三电极体系,对应的三个电极分别是工作电极、参比电极和辅助电极。
三个电极组成两个回路,工作电极和辅助电极(对电极)组成的回路,用来测电流;工作电极和参比电极组成的回路,用来测电极的电位。
图1.2是电化学传感器中常用的三电极体系示意图,辅助电极又叫对电极(counter electrode ),它在整个体系中的作用是与工作电极形成回路,保持电流的畅通稳定,就好比电路里需同时具备火线和零线一样,由此可见,对电极在电化学测试体系中不可或缺。
对电极保证电化学反应发生在工作电极上但又不会影响工作电极上的反应。
对电极的表面积比工作电极的表面积要大,这样就能降低加在对电极上的电流密度,使它在检测过程中不容易被极化。
常用的对电极材料有Ag, Pt, Ni等。
参比电极(reference electrode)是指具有己知恒定电位,且接近理想不极化的电极,基本上没有电流通过它。
在电化学检测的三电极体系中,参比电极一方面在热力学上提供参比,另一方方面则是将工作电极隔离起来。
为了满足电化学检测体系的需要,参比电极必须是良好的可逆电极,且电极电势要符合能斯特方程,在很小的电流流经过后,电极的电势能快速回到原状,当然电势的稳定和重现性必须很好。
常用的参比电极主要有三种:标准氢电极(normal hydrogenelectrode , NHE );甘汞电极(calomel electrode ) }}0 g' 20};银/氯化银电极(Ag/AgCI协”,’‘]。
其中的甘汞电极和银/氯化银电极在实验室最为常用。
甘汞电极的电极反应是:Hg2Cl2 + 2e二2Hg十2C1",而银/氯化银电极的电极反应则是AgCI + e一Ag +Cl",从反应式中可看出,二者的电位皆与氯离子的浓度有关。
电化学原理3

银-氯化银电极
silver-silver chloride electrode
由一根表面镀AgCl 的Ag丝插入到用 AgCl饱和的KCl溶 液中构成。电极端 的管口用多孔物质 封住。
优点是在升温的情况下比 甘汞电极稳定。
35
36
• (4)气体电极:由惰性金属(Pt、Au等)吸 附气体浸入含有相应离子的溶液中构成。
• (5)氧化还原电极:惰性电极浸入含有某 种离子的不同氧化态溶液中构成。
37
习题
1.可逆电极有哪几种?各举一例说明。
38
3.3 液接电位 (liquid junction potential)
• 液接电位: 两个组成或浓度不同的电解质溶液相接 触,其界面上产生的电位差,又叫扩散 电位(diffusion potential)。
• (3)电池中所进行的其他过程也必须可逆, 即当反向电流通过电池时,电极反应以外的其 他部分的变化也应当趋向于恢复到原来的状态。
17
严格来说,凡是由两个不同电解质溶 液构成的具有液体接界的电池,都是 热力学不可逆的。
两个可逆电极浸在同一电解质溶液中构 成的电池,在无限小电流通过的条件下 才是真正的可逆电池。
• (3)金属-难溶氧化物电极:由金属表面覆盖一 层该金属的难溶氧化物组成的固体浸入碱溶液 中构成。
– 第(2)(3)类最常用的有甘汞电极、银-氯化银电极、 氧化汞电极以及硫酸亚汞电极等。这些电极都可 用做参比电极。
32
饱和甘汞电极示意图
saturated calomel electrode(SCE)
– 对比:界面电位差(interfacial potential difference): 两相间内电位之差。
分析化学 第06章 电化学3

13
例如:锑-三氧化二锑电极 在酸性环境中:H+(a)∣Sb2O3(S)∣Sb Sb2O3 (s)+6e-+6H+(a) → 2Sb +3H2O 在碱性环境中:OH-(a)∣Sb2O3(S)∣Sb Sb2O3(s) +6e-+3H2O → 2Sb+6OH-(a)
H
, Sb2O3 / Sb
RT 1 H , Sb O / Sb ln 2 3 6F aH
18
试将下列化学反应设计成电池
1.Zn(s) + H2SO4(aq) → ZnSO4 + H2(g) Zn(s) ︱ZnSO4(a1) ‖ H2SO4(a2) ︱H2(pθ )︱Pt 2. Pb(s) + 2HCl(aq) → PbCl2(s) + H2(g) Pb ︳PbCl2(s) ︳HCl(a) ︳H2(pθ )︳Pt 3. Fe2++Ag+ → Fe3++Ag(s) Pt ︳Fe2+(a1) ,Fe3+(a2) ‖Ag+(a3) ︳Ag 4. Ag+(a1) +Cl- (a2)→ AgCl(s) Ag(s) ︳ AgCl(s) ︳Cl-(a2) ︳ Ag+(a1) ︳Ag(s)
一、界面电势差
23
二、液体接界电势和盐桥
产生原因:两种不同电解质溶液间或浓度不 相同的同种电解质溶液间,由于 溶液中离子的扩散速率不同,在 溶液界面处形成双电层,产生微 小的电势差
常用盐桥来消除液体接界电势
24
25
E = ε- + ε(液接) + ε+ ε(液接)用盐桥基本消除后,整个电池的电动 势可以写为: E = ε- + ε+ 由于电极-溶液界面电势差的绝对值无法知 道,上式只是电池电动势理论组成。真正的 计算用电极电势。
3电化学部分理论

(6)气体析出反应: 气体析出反应: 溶液中的非金属离子发生还原或氧化反 应产生气体而析出, 应产生气体而析出,非金属离子的浓度不断 减小。 减小。 (7)腐蚀反应: 腐蚀反应: 金属的溶解反应, 金属的溶解反应,指金属或非金属在一 定的介质中发生溶解,电极的重量不断减轻。 定的介质中发生溶解,电极的重量不断减轻。
(3)极化的原因 )
a. 浓差极化: 因离子扩散的迟缓性而导致电极表面附近离 子浓度与本体溶液中不同, 子浓度与本体溶液中不同,从而使电极电势与 发生偏离的现象,叫做“浓差极化” ψ可逆发生偏离的现象,叫做“浓差极化”。
例:铜电极在溶液中 Cu=Cu2++2e-
(ψCu,不可逆)阴<ψCu,可逆 ; Cu, Cu, (ψCu,不可逆)阳>ψCu,可逆 Cu, Cu, 因浓差极化而造成的电极电势与ψ可逆之差的绝 因浓差极化而造成的电极电势与ψ 对值,称为“浓差过电势” 对值,称为“浓差过电势”。 η浓差=|ψ平-ψ|=|ψ可逆-ψ|
式中: 析出物质的摩尔数; 式中:n—析出物质的摩尔数; 析出物质的摩尔数 Z—电极反应中 电极反应中1mol的电解质得失的电子数; 的电解质得失的电子数; 电极反应中 的电解质得失的电子数 Q—电量;I—电流;k—比例系数 电量; 电流 电流; 电量 比例系数
对于电极反应:OX + ze → Red 根据电流的定义和法拉第定律: i = dQ/dt 反应速度v可表示式: v=-(dnOx/dt) =-(dne/dt)=dnRed/dt= i/ZF 若电极反应是异相的,则 v = i/ZFA = J/ZF 式中:A—电极面积;J—电流密度 dn = dQ/ZF
(4)伴随着化学反应的电子迁移反应: 伴随着化学反应的电子迁移反应: 指存在于溶液中的氧化或还原物种借 助于电极实施电子传递反应之前或之后发生 了化学反应。 了化学反应。 (5)多孔气体扩散电极中的气体还原或氧 化反应: 化反应: 指气相中的气体( 指气相中的气体(如O2或H2)溶解于 溶液后,再扩散到电极表面得到或失去电子。 溶液后,再扩散到电极表面得到或失去电子。 如镍氢电池。 如镍氢电池。
电化学原理3

28
任何电极与标准氢电极构成原电池所测 得的电动势作为该电极的电极电位。 电池电动势是在电流强度趋近于零、电池 反应极为微弱、电池中各反应物浓度基本 上维持恒定的条件下测定的。电池电动势 是指电池正负极之间的平衡电位差。
29
比较下列概念
• 标准电极电位(standard electrode potential) • 平衡电极电位(equilibrium electrode potential) • 电极电位 (electrode potential)
– 第(2)(3)类最常用的有甘汞电极、银-氯化银电极、 氧化汞电极以及硫酸亚汞电极等。这些电极都可 用做参比电极。
33
饱和甘汞电极示意图
saturated calomel electrode(SCE)
甘汞电极的电极反应为: Hg2Cl2 (s) + 2e- → 2Hg (l) + 2Cl-(a ) 以饱和氯化钾溶液为电解液 的甘汞电极25℃下的电极电 势为0.245V,饱和氯化钾溶 液浓度高,起着盐桥的作用
– 对比:界面电位差(interfacial potential difference): 两相间内电位之差。
10
内电位=外电位+表面电位差
Φ=Ψ+Χ
M
r0
10-4~10-5 cm
试验电荷q
表面电位差
Mq
r
2
r0
dr
Mq
r0
外电位 内电位
11
3.1.3 电化学势
(Electrochemical Potential) • 化学势:恒温恒压下,向指定组成 的体系中加入微量组分所引起的 Gibbs 自由能的变化。
理论电化学第三章

1、双电层界面带有剩余电荷,产生排 斥作用,使界面扩大,界面张力减小。
2、带点界面的张力比不带电的要小。 3、电极表面电荷越多,界面张力就越
小,q=0时,界面张力最大,但φ 不一 定为0.
电毛细曲线微分方程的推导
由Gibbs等温吸附方程:界面张力的变化 与表面剩余量Гi有关
第三章 电极/溶液界面的结构 与性质
重点要求
研究双电层结构的主要方法的基本原理、 优缺点和用途;
界面结构的物理图像(模型); 特性吸附对双电层结构、性质的影响; 相关概念
第一节 概述
一. 研究电极/溶液界面性质的意义 电极材料的化学性质和表面状态对电极
反应速度和反应机理有很大影响 界面电场强度对电极反应速度可控制的、
对理想极化电极: di 0无反应
∴ =-q
或:
q
u
电毛细曲线微分方程 ( Lippmann方程 )
对电毛细曲线微分方程的实验解释
当电极表面存在正的剩余电荷时:
q 0 : 0
对应电毛细曲线左半部分(上升分支); 当电极表面存在负的剩余电荷时,
基本线路
交流讯 号源
交流电桥
直流极 化回路
电极电位测量 回路
交流电桥法测定微分电容的基本线路
电解池的设计及其等效电路分析
Cab
Ra
a
Rf
R
, f
Rl
Rb
b
Cd
C
, d
由于电极本身是金属材料,导电性能好, 可不考虑Ra和Rb;同时由于两电极间距离 大,所以Cab<<Cd,此时,电路简化为:
电化学3

P ( H 2 ) / Pθ RT ln 2F a ( H + )2 P ( H 2 ) / P θ ⋅ a (OH − )2 RT ln 2 2F ⋅ a ( H 2O )2 Kw P ( H 2 ) / P θ ⋅ a (OH − ) 2 RT RT ln K w − ln F 2F a ( H 2O )2
对氢离子可逆的氧化还原电极——醌氢醌电极 (常用于测定溶液中的pH值) 醌氢醌: 等分子比的醌(C6H4O2,以Q表示)和氢醌(C6H4(OH)2,以 H2Q表示)的复合物。(一般是1:1构成的分子晶体) 它在水溶液中按下式分解: C6H4O2⋅C6H4(OH)2→ C6H4O2 + C6H4(OH)2
e上一内容 f下一内容 回主目录
§7.8 电极的种类
氢电极——碱性溶液 在碱性溶液中的氢电极: 电极反应分为二步: 1. 2H+ + 2e-=H2(g) 2. 2H2O=2H+ +2OH-(在水溶液中处于平衡状态,ΔG=0) 总的电极反应为: 2H2O+ 2e-=H2(g) +2OH-
2返回
e上一内容 f下一内容 回主目录
e上一内容 f下一内容 回主目录
6H+
6e-→
2返回
2返回
§7.8 电极的种类
§7.8 电极的种类
氢醌是弱有机酸,可按下式解离,其解离度很小。 C6H4(OH)2→ C6H4O22- + 2H+ C6H4O22-离子与C6H4O2可发生氧化还原反应 C6H4O22-→ C6H4O2 + 2e- 醌氢醌电极的电极反应为: C6H4O2 + 2e-→ C6H4O22- C6H4O22-+ 2H+ → C6H4(OH)2 C6H4O2 + 2H+ + 2e-→ C6H4(OH)2
电化学原理第三章

2021/12/31
微分电容曲线可求给定电极电位下的电极表面剩余电荷q Cd=dq/dQ 积分后可得
qCdd积分常数
无电荷排斥作用,界面张力最大; 此时的电极电位称为零电荷电位,常用符号Φ0表示。
q( )i
3.6
无论电极表面存在剩余电荷符号如何,界面张力均随剩余电 荷数量的增加而降低。 由上式
可直接由电毛细曲线斜率求某一电位密度下电极电位 表面剩余电荷密度q判断表面剩余电荷密度符号 及零电荷电位。
2021/12/31
由微分电容定义和李普曼方程,由电毛细曲线很易求得微分电容 值
因
q
所以 Cd2
2
(3.25)
2021/12/31
可根据电毛细曲线确定零电荷电位φO,从而可利用式(3.24)求得 任-电极电位下的电极表面剩余电荷密度q,即
q
qodq
oCdd
(3.3)6
故可计算从零电荷电位φO到某一电位φ之间的平均电容值Ci
即由3.21和3.22求得该浓度下的离子表面剩余量。
2021/12/31
§ 双电层的微分电容
一、 双电层的电容
界面剩余电荷的变化将引起界面双电层电位差改变,因而电极/溶 液界面具有贮存电荷的能力,即具有电容的特性。
理想极化电极可作为平板电容器处理,即把电极/溶液界面的两个 剩余电荷层比拟成电容器的两个平行板,由物理学知,该电容器 的电容值为一常数,即
d为紧贴电极表面排列的水化离子的电荷中心与电极表面的 距离,也为离子电荷能接近表面的最小距离。紧密层厚度为d, 若假定d内介电常数为恒定值。则该层内电位分布是线性变化的。 从x=d到溶液中远处剩余电荷为零的双电层部分即为分散层。其 电位分布是非线性变化的。
3 电化学解读

电解池:正极(流出电子) ━阳极;负极(流入电子)━阴极
2. 法拉第定律
Q = nzF F法拉第常数,一摩尔质子的电荷(即一摩尔电子所带 电量的绝对值) F=L· e=6.022×10²³ mol‾¹×1.60221×10‾19 C =96484.6 C·mol‾¹≈96500C·mol‾¹ n=Q/Fz;m=QM/zF=ItM/zF
2 1
RT [氧化态]1 ln 2 zF [还原态]
10. 液接电势及其消除
⑴液接电势 对1—1型
E液 t t RT a ,1 ln F a , 2
⑵液接电势的消除 盐桥的构成:饱和KCl溶液加3%琼脂凝聚而成
三、电化学例题解析
1. 选择题
⑴已知铜的摩尔质量为63.5,在一精炼铜的电解 池中通过2000A的电流,1小时后,阴极析出铜的质 量为: (A)74.6g;(B)78.9g;(C)4738g; (D)2369g。
⑵298K,当H2SO4溶液的浓度从0.01mol· kg-1增加
到0.1 mol· kg-1时其电导率κ和摩尔电导率Λm将: (A)κ减小,Λm增加; (B)κ增加,Λm增加; (C)κ减小,Λm减小; (D)κ增加,Λm减小。
上等于导体的电导。 电阻定律:
G 1 A l
R U I G I U G Q tU
当导体两端的电势差为1V时,单位时间通过的电量在数值
l A
R
G
1 A l
⑵电导率κ
① 定义:κ=1/ρ ② 单位: S•m-1 ③ 物理意义:当截面积A为1m² ,长度l为1m时, 导体的电导(单位体积的电导)
分析化学第06章电化学3解析

写出下列电池所对应的化学反应
Sn (s)︱SnSO4 (m1)‖H2SO4 (m2)︱H2 (g,Pθ)(Pt)
Cd (s) ︱Cd2+(m1) ‖HCl(m2)︱H2 (g,Pθ) (Pt) (Pt)︱Fe3+, Fe2+ ‖Hg22+︱Hg (l)
Pb-PbSO4 (s)︱K2SO4 (m1)‖KCl(m2)︱PbCl2-Pb(s)
16
三、电池的书面表示法
1. 左边为负极,起氧化作用; 右边为正极,起还原作用。
2.“|”表示相界面,(有时也用逗号)这类界面 包括电极与溶液的界面,一种溶液与另一种溶液 的界面,或同一种溶液但两种不同浓度之间的界面。
3.“||”表示盐桥,使液接电势降到可以忽略不计。
4.要注明温度,不注明就是298.15 K;要注明 物态,气体要注明压力;溶液要注明浓度。
5. 气体电极和氧化还原电极要写出导电的惰性电
Ag2O(s)+H2O+2 e→2Ag(s)+2OH-(a-)
Ag2O+2H+(a+)+2e→2Ag(s)+H2O
15
第三类电极 第三类电极是氧化-还原电极,在这类电极 的溶液中,含某种元素的两种不同氧化态, 电极物质只起导电作用。
例如: 含有Fe3+和Fe2+的溶液中: 电极表达式: Fe3+(a1), Fe2+(a2)|Pt 电池反应式: Fe3+(a1)+e- →Fe2+(a2)
气体电极 (gas electrode) 氧电极 卤素电极
9
第一类电极及其反应
电极
电极反应
Mz+(a+)|M(s) H+ (a+)|H2(p),Pt OH-(a-)|H2(p),Pt H+(a+)|O2(p),Pt OH-(a-)|O2(p),Pt Cl- (a-)|Cl2(p),Pt
3电化学三电极体系
.3电化学三电极体系电化学传感器中用得最多的是三电极体系,对应的三个电极分别是工作电极、参比电极和辅助电极.三个电极组成两个回路,工作电极和辅助电极(对电极)组成的回路,用来测电流;工作电极和参比电极组成的回路,用来测电极的电位.图1。
2是电化学传感器中常用的三电极体系示意图,辅助电极又叫对电极(counter electrode ),它在整个体系中的作用是与工作电极形成回路,保持电流的畅通稳定,就好比电路里需同时具备火线和零线一样,由此可见,对电极在电化学测试体系中不可或缺。
对电极保证电化学反应发生在工作电极上但又不会影响工作电极上的反应.对电极的表面积比工作电极的表面积要大,这样就能降低加在对电极上的电流密度,使它在检测过程中不容易被极化。
常用的对电极材料有Ag,Pt,Ni等。
参比电极(reference electrode)是指具有己知恒定电位,且接近理想不极化的电极,基本上没有电流通过它.在电化学检测的三电极体系中,参比电极一方面在热力学上提供参比,另一方方面则是将工作电极隔离起来。
为了满足电化学检测体系的需要,参比电极必须是良好的可逆电极,且电极电势要符合能斯特方程,在很小的电流流经过后,电极的电势能快速回到原状,当然电势的稳定和重现性必须很好.常用的参比电极主要有三种:标准氢电极(normal hydrogenelectrode , NHE );甘汞电极(calomel electrode )}}0 g’20};银/氯化银电极(Ag/AgCI协”,’‘]。
其中的甘汞电极和银/氯化银电极在实验室最为常用。
甘汞电极的电极反应是:Hg2Cl2 + 2e二2Hg十2C1",而银/氯化银电极的电极反应则是AgCI + e一Ag +Cl”,从反应式中可看出,二者的电位皆与氯离子的浓度有关.在本课题中所使用的三电极系统中,参比电极均为银/氯化银电极。
所研究的反应发生在工作电极(working electrode)上,各种能导,一匕的材料都能用作工作电极,既可以是固体,也可以是液体。
电化学 第3章 电化学极化讲解

第3章 电化学极化 (电荷转移步骤动力学)绪论中曾提到:一个电极反应是由若干个基本步骤形成的,一个反应至少有三个基本步骤:00R R ze O O s s →→+→-1) 反应粒子自溶液深处向电极表面的扩散——液相传质步骤。
2) 反应粒子在界面得失电子的过程——电化学步骤。
3) 产物生成新相,或向溶液深处扩散。
当有外电流通过电极时,ϕ将偏离平衡值,我们就说此时发生了极化。
如果传质过程是最慢步骤,则ϕ的偏离是由浓度极化引起的(此时0i s i C C ≠,e ϕ的计算严格说是用s i C 。
无浓度极化时0i s i C C =,ϕ的改变是由s i C 的变化引起)。
这时电化学步骤是快步骤,平衡状态基本没有破坏。
因此反映这一步骤平衡特征的Nernst 方程仍能使用,但须用ϕ代e ϕ,s i C 代0i C ,这属于下一章的研究内容。
如果传质等步骤是快步骤,而电化学步骤成为控制步骤,则这时ϕ偏离e ϕ是由电化学极化引起的,也就是本章研究的内容。
实际上该过程常常是比较慢的,反应中电荷在界面有积累(数量渐增),ϕ随之变化。
由此引起的ϕ偏离就是电化学极化,这时Nernst 方程显然不适用了,这时ϕ的改变将直接以所谓“动力学方式”来影响反应速度。
3.1 电极电位与电化学反应速度的关系电化学反应是一种特殊的氧化—还原反应(一个电极上既有氧化过程,又有还原过程)。
若一个电极上有净的氧化反应发生,而另一个电极上有净的还原反应发生,则在这两个电极所构成的电化学装置中将有电流通过,而这个电流刚好表征了反应速度的大小,)(nFv i v i =∝[故电化学中总是用i 表示v ,又i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也用i 表示v 。
i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为mol/(cm 2.s )]。
既然电极上有净的反应发生(反应不可逆了),说明电极发生了极化,ϕ偏离了平衡值,偏离的程度用η表示,极化的大小与反应速度的大小有关,这里就来研究i ~ϕ二者间的关系。
电化学 第3章 电化学极化讲解

电化学第3章电化学极化讲解电化学极化是指在电池或电化学反应中,由于电流通过电解质溶液或固体电解质内部所引起的电势变化和电化学反应过程,使得电极表面的电位波动而导致的极化现象。
这种现象会对电化学反应的速度和效果产生影响,并且还会对电池的使用寿命产生影响。
因此,研究电化学极化对于电化学研究和应用具有十分重要的意义。
电化学极化产生的原因主要有三种:电阻极化、化学极化和双极化。
其中,电阻极化是由于电解质的电阻对电流的阻碍所导致的电极电位下降;化学极化是因为电化学反应产生的中间物质在电极表面积累,妨碍了电荷的传输而导致的电极电位变化;而双极化则是化学极化和电阻极化的综合效果。
这三种极化加起来就是总极化。
电阻极化是电解质电导率降低或电池电解液中溶质浓度增加所引起的。
电解质溶液中的电离度影响电导率,溶液浓度越大,电离度越高,导电性也越高。
但是在一定条件下,由于电解质的抵抗和电荷的平衡,电离度会下降,导致电导率降低。
在电化学反应中,当电流通过电解液时,会引起内部电场的变化,从而引起电位的变化,使得电极表面电位下降,产生电阻极化。
电阻极化的产生会使得电化学反应的速率降低,因此需要采取措施来消除电阻极化。
解决电阻极化的方法包括增加电极表面积、缩短电解质厚度等。
化学极化是指在电化学反应过程中,由于反应产物在电极表面积累,导致电位的变化。
这种极化既可以是消极的,也可以是积极的。
消极的化学极化通常是由于电极表面积累的反应产物造成了反应的中止,而积极的化学极化则会催化反应,促使反应速率的提高。
如果化学极化过于严重,会导致电极表面被覆盖,阻碍电流的传输,从而造成电位的下降。
为了避免化学极化的影响,可以采用刷新电极表面、增加电极表面积、调整电解质中的反应物浓度等方法。
双极化是指电阻极化和化学极化同时存在,两者综合起来导致电位的变化。
双极化是一种复杂的极化,它的产生需要考虑多种因素,如电荷的传输速度、电解质电导率、化学反应等。
为了消除双极化,可以采用加速电荷传输速度、采用高电导率的电解质、优化反应条件等方法。
电化学三电极体系工作原理

电化学三电极体系工作原理电化学三电极体系是一种重要的电化学实验系统,它由三个电极组成,分别为工作电极、参比电极和计量电极。
工作电极是进行电化学反应的主要电极,参比电极是用来确定电位的参考电极,计量电极则是用来测量电化学反应的电流或电势。
这种三电极体系被广泛应用于电化学分析、电化学合成、电化学腐蚀等领域,具有重要的科学研究和工程应用价值。
一、电化学三电极体系的基本组成1. 工作电极工作电极是电化学反应发生的主要电极,它通常是由金属、碳材料或半导体等制成的,具有良好的电化学活性和导电性能。
工作电极的形状和大小可以根据实验需要进行设计和制备,常见的有圆形、方形、条形等形状。
在电化学实验中,工作电极的表面通常会进行预处理,例如:抛光、清洗、电化学氧化等处理,以提高其表面的电化学活性和稳定性。
2. 参比电极参比电极是用来确定电位的参考电极,它通常是由一种稳定电位的材料制成,例如:银/银离子电极、铜/铜离子电极、铂/氢电极等。
参比电极的电位是稳定的,可以作为电化学反应的参照标准,以便准确地测量工作电极的电位。
3. 计量电极计量电极是用来测量电化学反应的电流或电势的电极,它通常是由一种灵敏的电位测量装置制成,例如:电势计、电流计等。
计量电极的选择要根据实验需要和电化学反应的性质进行选择,以保证测量结果的准确性和可靠性。
二、电化学三电极体系的工作原理电化学三电极体系的工作原理是基于电化学反应的电位和电流的测量,通过测量工作电极和参比电极之间的电位差,以及工作电极和计量电极之间的电流或电势,来确定电化学反应的性质和动力学参数。
在电化学反应过程中,工作电极和参比电极之间的电位差可以通过参比电极和计量电极之间的电位差来测量。
参比电极的电位是稳定的,可以作为电化学反应的参照标准,以便准确地测量工作电极的电位。
通过测量工作电极和参比电极之间的电位差,可以确定工作电极的电位和电化学反应的性质,例如:反应的标准电位、反应速率常数、反应机理等。
电化学三要素

电化学三要素
电化学三要素是指电压、电流和电解质。
在电化学反应中,这三个要素是相互关联的。
1. 电压(电位差):电压是电化学反应进行的推动力,也称为电动势。
它是由电池或电源提供的,在电解池的两个电极之间建立的电位差。
电压的大小决定了电荷在电解质中移动的速度和方向。
2. 电流:电流是指在电解质中电荷的流动。
电流的大小决定了电化学反应的速度和效率。
它是通过电解质中的离子在电压的作用下移动而产生的,电流的方向由正电荷的移动方向决定。
3. 电解质:电解质是指能够在溶液中离解出离子的化合物,例如盐、酸和碱。
电解质在电化学反应中起到导电媒介和提供离子的作用,在电解质溶液中离子的浓度决定了反应速率和产物生成的选择性。
这三个要素的相互关系决定了电化学反应的性质和特点,对于电化学分析、电池和电解过程的研究具有重要的意义。
电化学 第3章 电化学极化概述

第3章 电化学极化 (电荷转移步骤动力学)绪论中曾提到:一个电极反应是由若干个基本步骤形成的,一个反应至少有三个基本步骤:0R R ze O O ss→→+→-1) 反应粒子自溶液深处向电极表面的扩散——液相传质步骤。
2) 反应粒子在界面得失电子的过程——电化学步骤。
3) 产物生成新相,或向溶液深处扩散。
当有外电流通过电极时,ϕ将偏离平衡值,我们就说此时发生了极化。
如果传质过程是最慢步骤,则ϕ的偏离是由浓度极化引起的(此时0i s i C C ≠,e ϕ的计算严格说是用s i C 。
无浓度极化时0i s i C C =,ϕ的改变是由s i C 的变化引起)。
这时电化学步骤是快步骤,平衡状态基本没有破坏。
因此反映这一步骤平衡特征的Nernst 方程仍能使用,但须用ϕ代e ϕ,s i C 代0i C ,这属于下一章的研究内容。
如果传质等步骤是快步骤,而电化学步骤成为控制步骤,则这时ϕ偏离e ϕ是由电化学极化引起的,也就是本章研究的内容。
实际上该过程常常是比较慢的,反应中电荷在界面有积累(数量渐增),ϕ随之变化。
由此引起的ϕ偏离就是电化学极化,这时Nernst 方程显然不适用了,这时ϕ的改变将直接以所谓“动力学方式”来影响反应速度。
3.1 电极电位与电化学反应速度的关系电化学反应是一种特殊的氧化—还原反应(一个电极上既有氧化过程,又有还原过程)。
若一个电极上有净的氧化反应发生,而另一个电极上有净的还原反应发生,则在这两个电极所构成的电化学装置中将有电流通过,而这个电流刚好表征了反应速度的大小,)(nFv i v i =∝[故电化学中总是用i 表示v ,又i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也用i 表示v 。
i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为mol/(cm 2.s )]。
既然电极上有净的反应发生(反应不可逆了),说明电极发生了极化,ϕ偏离了平衡值,偏离的程度用η表示,极化的大小与反应速度的大小有关,这里就来研究i ~ϕ二者间的关系。
电化学(三)

则由Nernst方程:
E
Eq
RT
ln
a a 1 2 O2 H 2
2F
aH 2O
6
常压下:
aH2
fH2 pq
pH2 pq
aO2
fO2 pq
pO2 pq
电解顺利进行时,O2和H2的压力分别为p=101.325kPa,代入 上式:
E Eq 阳q 极 阴q 极 0.401( 0.828)1.229V
E为理论分解电压。 实际分解电压: E分解 E理论分解 IR E不可逆
IR 电解池内阻引起的电压降。 E不可逆 由于电极极化作用所致。
由于电解池内阻和电极极化的存在,使得电解过程 中要多消耗能量。
7
§2 极化作用
我们在原电池中所讨论的电极电势、电动势及电动势与 G的等热力学关系式,电极均处于平衡状态,即并无电流 通过电极。但当有电流通过电极时,电极的电势会偏离上述
(1)实际分解电压
(2)在电极上析出的产物 如:
电解熔融盐时,如NaCl ,只有Na+, Cl-两种离子,所以电解时,
阳极: Cl- ½Cl2 + e
阳极得到氯气
阴极: Na+ + e Na
阴极得到金属钠
但对于电解质水溶液时,如ZnSO4水溶液中,除了Zn2+、 SO42-外还有H+和OH-,因此电解时,还应考虑H+,OH-离子 是否发生反应。因此电解电解质水溶液时可能的电极反应 有:
由阳极极化曲线知: 阳极的不可逆电极电势随电流密度增
大而增大。 阳,不可逆 = 阳,平 + 阳
16
从电解池的极化曲线可知:
① 当J=0时,阴= 阳=0
当J增大, 阴和阳也增大,使得实际分解电压:
第三章 氧化还原反应 电化学 3, 4节

②外加电流法:被保护金属链接直流电源负极,通以 阴极电流。
(2)阳极保护法 把被保护金属与电源正极相联,使其生成耐腐
蚀的钝化膜。多用于铝。
5.改善环境 干燥空气、真空…
A、B、C、D四种金属,将A、B用导线连接,浸 在稀硫酸中,在A表面上有氢气放出,B逐渐溶解;将 含有A、C两种金属的阳离子溶液进行电解时,阴极上 先析出C;把D置于B的盐溶液中有B析出。则这四种金 属的还原性由强到弱的顺序是( )
使电解能够顺利进行所需要的最小电压叫做 分解电压
➢ 分解电压产生的原因
阳极:2OH- - 4e- → 2H2O + O2 阴极:2H2O + 2e- → H2 + 2OH-
电解生成的H2 和O2分别吸附在铂片上形成氢 电极和氧电极,组成电动势与外接电源相反的原 电池: (-) Pt H2 NaOH (0.1mol·kg-1) O2 Pt (+)
E <0 ΔG >0 E =0 ΔG =0 E >0 ΔG <0
反应正向非自发; 反应处于平衡状态; 反应正向自发。
3. 判断氧化剂和还原剂的相对强弱
✓ E(O/R)越大,电对中氧化态物质是强 的氧化剂,对应的还原态物质是弱的 还原剂。
✓ E(O/R)越小,电对中还原态物质是强 的还原剂,对应的氧化态物质是弱的 氧化剂 。
4. 判断氧化还原反应进行的程度
zE lg K
0.0592V
五、电解
1. 电解池 2. 分解电压 3. 电解产物
六、金属的腐蚀与防护
▪ P128-35 ▪ P129-38
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
η阴极 = E阴,平 − E阴
(1)当有电流通过电极时 ,电极电位会偏离平衡电 极电位,而且偏离程度随 电流密度而变。
(2)对于阳极来讲,有电 流通过时,阳极极化的结果 是电极电位变大。
η阳极 = E阳 − E阳,平
η = E平 − E测
3、 极化产生原因
产生极化的原因较多,一般分为两大类:浓差极化 和电化学极化。 (1) 浓差极化 由于电极表面浓度偏离本体溶液的浓度而产生的极 化称为浓差极化。
(2) 电化学极化 由于电极上发生的电化学反应的迟缓性引起的 极化称为电化学极化。
不管是电解池还是原电池都会发生极化现象。
ห้องสมุดไป่ตู้
极化的结果: 阴极电极电位变得更负,阳极的电极电位变得更正。 4、极化曲线的测定
E分解,理
实际分解电压应大于相应原电池电动势的原因主 要是由于析出电极电势偏离理论计算的平衡电极 电势的缘故。
7-12 极化作用
1、电极的极化 当电流通过电极时,电极电势偏离平衡电极电势 的现象称为电极的极化。 2、超电势 η 在某一电流密度下,电极电势与其平衡电极电势之 差的绝对值称为超电势。
η = E电极 − E电极,e
7-11 分解电压
1、分解电压的测定
分解电压定义: 使电解质在两极继续 不断地进行分解时所 需的最小外加电压。 析出电位: 当外加电压等于分解电压 时,两极的电极电位。
E理论分解 = E原电池
分解电压
(1)对于HNO3、H2SO4和NaOH的分解电压值相同。
(2) E分解,测 ≠ E分解,理
E > 分解,测
极化曲线: 描述电流密度与电极电势之间关系的曲线。
因在两电极体系中,电 流发生变化时,阴、阳 两电极的电极电势均发 生变化,所以不能用两 电极体系法测定极化曲 线或超电势。
常用三电极体系法测定极化曲线或超电势。
辅助电极
参比电极
工作电极
鲁金毛细管
(1)当有电流通过电极时, 电极电位会偏离平衡电极电位 ,而且偏离程度随电流密度而 变。
氢超电压与电流密度的关系为:
η = a + b lg i
——塔费尔公式
5、电解池与原电池极化的差别
电解池
原电池
6、电解时的电极反应
极化电极电势越大的优先在阴极反应;极化电 极电势越小的优先在阳极反应。
η阴极 = E阴,平 − E阴
E阴 = E阴,平 −η阴极
η阳极 = E阳 − E阳,平
E阳 = E阳,平 + η阳极
E分解 = E阳 − E阴
