物理化学__华东理工大学(16)--单元测试卷
物理化学__华东理工大学(18)--单元测试卷

第十章 电化学单元测试卷一、选择题(每小题1分,共30分)1. 电池在恒温恒压条件下可逆放电,则它吸收或放出的热量应为 。
A :m r Δ H ;B :r m ΔG ;C :m r ΔS T2. 适用于恒温恒压下电化学过程的可逆性判据为 。
A :W G ′≥∆;B :0≤∆G ;C :W G ′≤∆3. 关于阴极阳极和正极负极,以下说法不准确的是 。
A :电势较高的电极称为正极,反之为负极;B :在阴极上发生得到电子的还原反应,反之发生失去电子的氧化反应;C :正极就是阳极,负极就是阴极4. 电化学反应的热力学特征是 。
A :反应中吉氏函数的变化值大于系统与环境间交换的电功;B :反应中吉氏函数的变化值小于系统与环境间交换的电功;C :反应中吉氏函数的变化值等于系统与环境间交换的电功5. 已知H 2O(l)的标准摩尔生成焓为1285.85kJ mol −−⋅,标准摩尔生成吉氏函数为1237.14kJ mol −−⋅。
若采用电解的方法使1molH 2O 分解产生氢气和氧气,且反应进度∆ξ =1mol ,以下说法正确的是 。
A :理论上输入的电功至多为237.14 kJ ;B :理论上输入的电功至少为237.14 kJ ;C :理论上与外界交换的热量为285.85 kJ6. 氢氧燃料电池的电池反应为o o 222H ()0.5O ()H O(l)p p +→,在298K 时o 1.229V E =,则电池反应的平衡常数o K 为 。
A :1.0;B :1.44×1020;C :3.71×10417. 若o 2{Fe |Fe}E a +=,o 23{Fe ,Fe |Pt}E b ++=,则o 3{Fe |Fe}E += 。
A :(2a -b )/3;B :(2a +b )/3;C :(a +b )/28. 电池反应2-20.5Cu 0.5Cl 0.5Cu Cl +++的标准电势为o 1E ,2-2Cu Cl Cu 2Cl ++=+的标准电势为o 2E ,则o 1E o 2E 。
华东理工大学《物理化学》(下)单元测试卷(二)

华东理工大学《物理化学》(下)单元测试卷(二)独立子系统的统计热力学一、选择题(每小题1分,共30分)1. 液态理想混合物属于 。
A :独立的离域子系统;B :离域的相倚子系统;C :独立的定域子系统2.晶体中的原子、分子或离子属于 。
A :独立的离域子系统;B :离域的相倚子系统;C :定域子系统 3.以下属于独立的离域子系统是 。
A :绝对零度的晶体;B :理想液体混合物;C :理想气体的混合物 4. 平动能的最低能级等于 。
A :2t 2/33h mV ε=;B :0;C :2t 2/338h mVε= 5. 一平动子处于能量3/2247mVh t =ε的能级上,则该能级的简并度i g t,= 。
A :6;B :5;C :46.NO 分子在转动的第一激发态上的简并度与其基态的简并度之比= 。
A :1; B :2; C :3 7.CO 分子在振动的第k 能级比k -1能级的能量高 。
A :0.2h ν; B :0.5h ν; C :h ν 8.在不同能级中,与系统体积有关的是 。
A :振动能级; B :转动能级; C :平动能级 9. 在不同能级中,能级间隔相等的是 。
A :振动能级;B :转动能级;C :平动能级10. 对于常温下的氮气,以下说法正确的是 。
A :振动能级间隔最大;B :转动能级间隔最大;C :平动能级间隔最大11. 在相同体积下,子的质量越大,平动能级间隔 。
A :不变;B :越大;C :越小12. 体积越大,平动能级间隔 。
A :不变;B :越大;C :越小13. 子的转动惯量越大,转动能级间隔 。
A :不变;B :越大;C :越小14. 振动频率越大,振动能级间隔 。
A :不变;B :越大;C :越小15. 有七个独立的可区别的粒子,分布在简并度为1、3和2的ε0, ε1, ε2三个能级中,数目分别为3个、3个和1个子,问这一分布拥有多少微观状态等于 。
16. 在含大量粒子的系统中,ωmax /Ω 的值很小,ln ωmax /ln Ω 的值接近 。
物理化学__华东理工大学(2)--单元测试卷

第二章 热力学定律和热力学基本方程单元测试卷一、选择题(每小题1分,共30分)1. 下列叙述不正确的是 。
A :不可逆过程发生的实质都归结于能量品位的降低;B :凡是不违背能量守恒原理的过程都能发生;C :一个不可能进行的过程假设已经进行,必将使能量的品位升高2. 在800K 的高温热源和300K 的低温热源之间运转的热机,当其从高温热源吸收800kJ 的热量并对外做功时,则热机至少需将 kJ 的热量传给低温热源。
A :300;B :400;C :5003. 从熵的统计意义可判断下列过程的熵变S ∆大于零的是 。
A :苯乙烯聚合成聚苯乙烯;B :气体在催化剂上吸附;C :液态苯汽化成气态苯4. 下列说法中不正确的是 。
A :可逆绝热过程的ΔS 总是等于零;B :不可逆绝热过程的ΔS 总是大于零;C :不可逆绝热过程的ΔS 总是小于零5.绝热不可逆过程中,系统(Sys )与环境(Sur )的熵变,正确的是 。
A :Sys Sur Δ0,Δ0S S ==;B :Sys Sur Δ0,Δ0S S >=;C :Sys Sur Δ0,Δ0S S =< 6. 在一绝热恒容的系统中发生了一个爆炸反应,系统的温度和压力都升高了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>=;B :Δ0,Δ0,Δ0U H S =>>;C :Δ0,Δ0,Δ0U H S ==>7. 一化学反应在恒压绝热的条件下发生(W /=0),反应系统的温度升高且体积增加了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>>;B :Δ0,Δ0,Δ0U H S >=>;C :Δ0,Δ0,Δ0U H S <=>8. 恒温恒容条件下进行某化学反应,其1135kJ mol A −∆=−⋅,以下不正确的是 。
A :理论上最多可对外做135kJ 的非体积功;B :要使化学反应逆向进行,则外界至少需提供135kJ 的非体积功;C :理论上至少可对外做135kJ 的非体积功9. 关于吉布斯函数G ,下列说法中正确的是 。
物理化学下 单元测试卷wh_xia_2

华东理工大学《物理化学》(下)单元测试卷(二)独立子系统的统计热力学一、选择题(每小题1分,共30分)1. 液态理想混合物属于 。
A :独立的离域子系统;B :离域的相倚子系统;C :独立的定域子系统2.晶体中的原子、分子或离子属于 。
A :独立的离域子系统;B :离域的相倚子系统;C :定域子系统 3.以下属于独立的离域子系统是 。
A :绝对零度的晶体;B :理想液体混合物;C :理想气体的混合物 4. 平动能的最低能级等于 。
A :2t 2/33h mV ε=;B :0;C :2t 2/338h mVε= 5. 一平动子处于能量3/2247mVh t =ε的能级上,则该能级的简并度i g t,= 。
A :6;B :5;C :46.NO 分子在转动的第一激发态上的简并度与其基态的简并度之比= 。
A :1; B :2; C :3 7.CO 分子在振动的第k 能级比k -1能级的能量高 。
A :0.2h ν; B :0.5h ν; C :h ν 8.在不同能级中,与系统体积有关的是 。
A :振动能级; B :转动能级; C :平动能级 9. 在不同能级中,能级间隔相等的是 。
A :振动能级;B :转动能级;C :平动能级10. 对于常温下的氮气,以下说法正确的是 。
A :振动能级间隔最大;B :转动能级间隔最大;C :平动能级间隔最大11. 在相同体积下,子的质量越大,平动能级间隔 。
A :不变;B :越大;C :越小12. 体积越大,平动能级间隔 。
A :不变;B :越大;C :越小13. 子的转动惯量越大,转动能级间隔 。
A :不变;B :越大;C :越小14. 振动频率越大,振动能级间隔 。
A :不变;B :越大;C :越小15. 有七个独立的可区别的粒子,分布在简并度为1、3和2的ε0, ε1, ε2三个能级中,数目分别为3个、3个和1个子,问这一分布拥有多少微观状态等于 。
16. 在含大量粒子的系统中,ωmax /Ω 的值很小,ln ωmax /ln Ω 的值接近 。
华东理工大学《物理化学》 练习题答案

第1章 物质的pVT 关系和热性质基本概念1.(1) (3)。
2. (1)分子无体积;(2)分子间无相互作用。
3.气。
4.气液共存区的边界线;不稳定区的边界线。
375.0ccc c ==RT V p Z ,得到普遍化的范德华方程以及对应状态原理。
5.a 气体;b 饱和气体;c 气液共存;d 饱和液体;e 液体。
6.不能,MPa 8.59=p7.状态一定,状态函数的量值一定;状态函数量值的变化仅与系统的初终状态有关。
对于一个均相系统,如果不考虑除压力以外的其他广义力,为了确定平衡态,除了系统中每一种物质的数量外,还需确定两个独立的状态函数。
8. (1) 外p p =,(2) =常数外p p =。
9. (1)封闭系统;(2)封闭系统,恒容过程,非体积功为零;(3)封闭系统,恒压过程,非体积功为零。
10. 压力为0.1MPa 下处于理想气体状态的气态纯物质。
压力为0.1MPa 下的液态和固态纯物质。
压力为0.1MPa 下浓度为3dm mol 1-⋅或1kg mol 1-⋅的理想稀溶液中的溶质。
11. 降低;=。
12.BB B )0(νζn n -=。
从数量上统一表达反应进行的程度。
13.<, =。
14.=, <。
15.=, >。
16. (1)×;(2)×;(3)√。
17. 实验测定;经验半经验方法;理论方法。
18. 反应前后气体的物质的量之差。
计算题1. 解:mol 1071.6mol )15.27330(3145.8101001021.169363--⨯=⎥⎥⎦⎤⎢⎢⎣⎡+⨯⨯⨯⨯==RT pV n []211122112211 )-(1 M y M y n M n y M y n M n M n m +=+=+= []2211) -( M M M y n +=836.001.4601.30101.461071.6219.0132121=-⋅⎪⎭⎫ ⎝⎛-⨯=-⋅⎪⎭⎫⎝⎛-=∴-M M M n m y 2. 解:以“1”代表空气,以“2”代表H 2O ,()mol 613.0mol 15.273253145.8100.1510325.1013311=⎥⎦⎤⎢⎣⎡+⨯⨯⨯⨯==-RT pV n3.174kPa kPa 01982.0613.001982.0325.10121222=⎪⎭⎫⎝⎛+⨯=+⋅==n n n p y p p331121dm 5.15dm 0.15613.001982.0613.0=⨯+=⋅+=V n n n V3. 解:以“1”代表NO ,以“2”代表“Br 2”,以“3”代表NOBr 开始时,p 1(0) = 23.102kPa9.76kPa Pa 10055.13003145.8)81.159/660.0()/()0(32222=⨯⨯⨯===-V RT M m V RT n p 平衡时,[]3213323132121)0()0(21)0()0(p p p p p p p p p p p p -+=+⎥⎦⎤⎢⎣⎡-+-=++=[]14.25kPa kPa )737.2576.9102.23(2)0()0(2213=-+=-+=∴p p p p 8.85kPa kPa )25.14102.23()0(311=-=-=p p p 2.64kPa kPa )25.142176.9(21)0(322=⨯-=-=p p p 4. 解:()RT b V p =-m , b pRTV +=m ,1,m 2,m kV V = 即kb p RT k b p RT k b p RT +=⎪⎪⎭⎫ ⎝⎛+=+112, ⎪⎪⎭⎫ ⎝⎛-=-=-21121)1(p p k p RT p RT p RT k k b ⎪⎪⎭⎫ ⎝⎛-⋅-=∴21111p p k p RT k b 133mol m 10132.5101.3250.01107510101.325273.15)(08.31450.01107511-⋅⎪⎭⎫ ⎝⎛-⋅⨯+⨯⋅-=135mol m 102.437--⋅⨯=A 3*m 3444N r V b ⋅⋅==π0.134nm m 100.134m 10022.61610437.2316393/12353/1A =⨯=⎪⎪⎭⎫⎝⎛⨯⨯⨯⨯=⎪⎪⎭⎫ ⎝⎛=∴--ππN b r5. 解:(1) I ,液-固;II ,气-液;III ,气-固。
物理化学__华东理工大学(15)--单元测试卷

第八章 界面现象单元测试卷一、选择题(每小题1分,共30分)1. 关于界面张力的说法不正确的是 。
A. 界面中单位长度的收缩张力;B. 界面张力等于增加单位界面面积时系统必须得到的可逆界面功;C. 界面张力是恒温恒容下,单位表面积中的分子所具有的吉布斯函数值2. 对于平面液体,下列物理量中量值为零的是 。
A. 表面张力;B. 附加压力;C. 表面吉布斯函数3. 一定体积的水,当聚成一个大水球或分散成许多小水滴时,同温度下,两种状态相比,以下性质保持不变的是 。
A. 表面张力;B. 表面能;C. 比表面4. 溶液表面张力总是随溶液浓度的增大而减小,这一说法 。
A. 正确;B. 错误;C. 无法判断5. 相同温度下,纯水、盐水、皂液相比,其表面张力的排列顺序是 。
A.盐水 > 纯水 > 皂液;B. 纯水 > 盐水 > 皂液;C. 皂液 > 纯水 > 盐水6. 在铂丝框中有一层液膜,如果不在可移动的铂丝上施加外力f ,液膜将缩小。
已知可移动的铂丝长度L =0.2m ,液膜的表面张力为0.04 N .m -1。
要使液膜稳定存在,所施加的外力f 应等于 N 。
A. 0.008;B. 0.016;C. 0.0327. 铺展压的定义为def πσσ∗==−,下列正确的说法是 。
A. 铺展压会使溶液的气液界面更为铺展;B. 铺展压会使溶液的气液界面更为收缩;C. 铺展压与溶液的浓度无关8. 已知25℃时水的表面张力-10.0720N m σ=⋅,如环境对液态水施加144 J 的功,理论上可使水的表面积增加 m 2。
A. 500;B. 1000;C. 20009. 下列说法中,不正确的是 。
A. 实际界面层中物质i 的量永远为正值;B. 采用吉布斯界面相模型时,界面相中物质i 的量可以为负值;C. 采用吉布斯界面相模型时,界面相中物质i 的量不会等于零10. 根据(1)i Γ的定义,下列说法中,不正确的是 。
物理化学__华东理工大学(6)--单元测试卷

第四章 相平衡单元测试卷一、选择题(每小题1分,共30分)1. 只要知道纯物质的饱和蒸汽压与温度的定量关系,即可得到二元混合物气液平衡相图的是 。
A :实际溶液;B :理想溶液;C :理想稀溶液2. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :液相线示意了溶液的蒸气压随液相组成的变化关系;B :液相线为直线是理想混合物的一个特征;C :液相线为泡点线3. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :气相线示意了溶液的蒸气压随气相组成的变化关系;B :气相线为曲线;C :气相线为露点线4. 对于二元理想混合物的气液平衡相图(恒压),以下说法不正确的是 。
A :液相线为泡点线,气相线为露点线;B :液相线示意了沸点随液相组成的变化;C :液相线为直线5. 如二元混合物气液平衡相图中出现正偏差时,下列正确的说法是 。
A : i i i x p p *<;B :正偏差强烈时,可形成最高恒沸混合物;C :正偏差强烈时,可形成最低恒沸混合物6. 如二元混合物气液平衡相图中出现负偏差时,下列正确的说法是 。
A : *i i i p p x >;B :负偏差强烈时,可形成最低恒沸混合物;C :负偏差强烈时,可形成最高恒沸混合物7. 二元混合物气液平衡相图中出现正偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :第二种物质的加入使分子的缔合程度降低;C :溶液中不同组分分子间的相互吸引比纯物质弱8. 二元混合物气液平衡相图中出现负偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :不同组分间生成氢键而相互缔合;C :溶液中不同组分分子间的相互吸引比纯物质弱9. 关于恒沸混合物,不正确的说法是 。
A :恒沸混合物是一种具有确定组成的化合物;B :恒沸混合物并不是一种具有确定组成的化合物;C :在恒沸点,泡点线与露点线重合10. 二元系的气液平衡相图(恒压)中,恒沸点的自由度为 。
华东理工大学2024年物理化学考研试题

已知25℃时电池 的电池反应的电势为1.1566 V, , 。
(1)写出该电池的电极反应和电池反应。
(2)求 ZnCl2溶液的离子平均活度 ,离子平均活度因子 以及ZnCl2作为整体的活度 。
(3)若有1 mol Zn进行电池反应,电池最多可输出多少电功?
(4)已知AgCl的溶度积 ,试求
9.某化合物能与水作用,若它的初浓度为1 ,1小时以后降为0.8 ,
2小时以后降为0.6 ,则此反应为级反应。
10.有少数气体,例如 、 等,它们的光谱熵要比量热熵(大,小),这是因为。
11.对于独立的离域子系统,当温度不太低,密度不太高,子的质量不太小时,每个能级的简并度 与该能级上的离子数 之间的关系为 。(>, =, < )
设冰的温度为-1℃;与冰接触的冰刀宽3mm,长20cm。冰的摩尔体积比水的摩尔体积大9%(设不随压力和温度改变)。冰的熔化热 = (设不随压力和温度改变)。
四、(26分)
1.某温度时,质量分数 的乙醇水溶液可视为志向稀溶液,其蒸气总压为101.325kPa,纯水的饱和蒸气压为91.3kPa。试求 时的蒸气总压和气相组成。
一、(24分)
1.一化学反应在烧杯中进行,放热为 ,焓变为 。若在电池中可逆进行,放热为 ,焓变为 。 与 是否相等?(是,否), 与 是否相等?(是,否)
2.肯定量的志向气体经绝热可逆过程从初态的 改变到终态的 ,则初终态压力、体积之间的一容器中热分解并且达到平衡,该平衡系统的自由度f=。
(1)试求298 K下,由单质生成1 mol 的 。
(2)上升温度对提高产率是否有利?为什么?
(3)若生成 的反应在298 K和101325 Pa下进行,平衡气相混合物中 的摩尔分数能否达到0.1?
物理化学__华东理工大学(5)--单元测试卷

第三章 多组分系统的热力学,逸度和活度单元测试卷一、选择题(每小题1分,共30分)1. 系统中所有的状态函数均存在偏摩尔量,这一说法 。
A :正确;B :错误;C :无法判断2. 根据偏摩尔量的定义,下列正确的是 。
A :(),,/j i i T p n G n ≠∂∂;B : (),,/j i i T V n G n ≠∂∂;C : ()m ,,/j ii T p n G x ≠∂∂ 3. 在下列偏导数中,是偏摩尔量的为 。
A :(),,/j i i T V n G n ≠∂∂;B :(),,/j i i S V n U n ≠∂∂;C :(),,/j ii T p n S n ≠∂∂ 4. 在下列偏导数中,不是化学势的为 。
A :(),,/j i i S V n U n ≠∂∂;B :(),,/j i i T p n H n ≠∂∂;C :(),,/j ii T p n G n ≠∂∂ 5. 同一物质不同偏摩尔量间存在一定关系,以下错误的是 。
A :i i i H U pV =+;B :i i i A U TS =−、i i i G H TS =−;C :(),/ji i p n G T S ∂∂= 6. 在化学势与温度压力间的关系中,以下错误的是 。
A : (),/j i i p n T S µ∂∂=−;B : (),/j i i p n T S µ∂∂=;C : (),/ji i T n p V µ∂∂= 7. 以下偏导数中,即是化学势也是偏摩尔量的是 。
A :(),,/j i i S V n U n ≠∂∂;B :(),,/j i i S p n H n ≠∂∂;C :(),,/j ii T p n G n ≠∂∂ 8. 由A 和B 组成的二元混合物,当4.0B =x 时,A 和B 的偏摩尔体积分别为3125.0cm mol −⋅和3130.0cm mol −⋅,则混合物的摩尔体积= 13mol cm −⋅。
华东理工大学《物理化学》(上)单元测试卷(二)

华东理工大学《物理化学》(上)单元测试卷(二)热力学定律和热力学基本方程一、选择题(每小题1分,共30分)1. 下列叙述不正确的是 。
A :不可逆过程发生的实质都归结于能量品位的降低;B :凡是不违背能量守恒原理的过程都能发生;C :一个不可能进行的过程假设已经进行,必将使能量的品位升高2. 在800K 的高温热源和300K 的低温热源之间运转的热机,当其从高温热源吸收800kJ 的热量并对外做功时,则热机至少需将 kJ 的热量传给低温热源。
A :300;B :400;C :5003. 从熵的统计意义可判断下列过程的熵变S ∆大于零的是 。
A :苯乙烯聚合成聚苯乙烯;B :气体在催化剂上吸附;C :液态苯汽化成气态苯4. 下列说法中不正确的是 。
A :可逆绝热过程的ΔS 总是等于零;B :不可逆绝热过程的ΔS 总是大于零;C :不可逆绝热过程的ΔS 总是小于零5.绝热不可逆过程中,系统(Sys )与环境(Sur )的熵变,正确的是 。
A :Sys Sur Δ0,Δ0S S ==;B :Sys Sur Δ0,Δ0S S >=;C :Sys Sur Δ0,Δ0S S =< 6. 在一绝热恒容的系统中发生了一个爆炸反应,系统的温度和压力都升高了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>=;B :Δ0,Δ0,Δ0U H S =>>;C :Δ0,Δ0,Δ0U H S ==>7. 一化学反应在恒压绝热的条件下发生(W /=0),反应系统的温度升高且体积增加了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>>;B :Δ0,Δ0,Δ0U H S >=>;C :Δ0,Δ0,Δ0U H S <=>8. 恒温恒容条件下进行某化学反应,其1135kJ mol A -∆=-⋅,以下不正确的是 。
A :理论上最多可对外做135kJ 的非体积功;B :要使化学反应逆向进行,则外界至少需提供135kJ 的非体积功;C :理论上至少可对外做135kJ 的非体积功9. 关于吉布斯函数G ,下列说法中正确的是 。
物理化学6

华东理工大学《物理化学》(上)单元测试卷(六)上册综合测试一、选择题(每小题1分,共30分)1. 以下三组性质中,都是强度性质的是 。
A :U 、S 、H ;B :p 、ρ、T ;C :U 、S 、V m2. 一化学反应在烧杯中进行,放热为Q 1,焓变为△H 1。
若在电池中可逆进行,放热为Q 2,焓变为△H 2,则 。
A :Q 1= Q 2、△H 1=△H 2;B :Q 1= Q 2、△H 1≠△H 2;C :Q 1≠Q 2、△H 1=△H 23. 400K 、101325Pa 下,1mol 气体的体积为22.85 dm 3,则气体的压缩因子等于 。
A :0.6962;B :1;C :1.25324. 下图为某物质的压缩因子图,图中标有三条等温线,则三条线上注明的温度T 1、T 2、T 3,其大小关系是 。
A :321T T T <<;B :123T T T >>;C :321T T T ≥≥5. 在两个玻璃容器中分别装有理想气体A 和B ,它们的温度和密度都相同,测得A 的压力是B 的 1.3754倍。
若A 的摩尔质量为132 g mol -⋅,则B 的摩尔质量为 1g mol -⋅。
A :32;B :38;C :446. 甲、乙、丙三种物质的临界温度分别为343.05K 、373.65K 和405.65K ,其中最易液化的气体为 。
A :甲物质;B :乙物质;C :丙物质7. 范德华气体分子的微观模型为 。
A :只具有吸引力的硬球;B :只具有吸引力的软球;C :不具有吸引力的硬球8. 物质A 在温度为T 时,焓的规定值等于零,此温度下,热力学能U 的规定值 。
A : 大于零 ;B :等于零;C :小于零9. 关于热容,下列说法不正确的是 。
A :热容是物质的特性;B :同一物质,热容大小与物质所处的相态无关;C :对于理想气体定压摩尔热容和定容摩尔热容之差等于R10. 25℃时,H 2O (l )和H 2O (g )的O f m ΔH -分别为-285.830和-241.818 1mol kJ -⋅,则水的标准摩尔蒸发焓等于 kJ·mol -1。
华东理工大学《物理化学》上单元测试卷三

华东理工大学《物理化学》(上)单元测试卷(三)多组分系统的热力学,逸度和活度一、选择题(每小题1分,共30分)1. 系统中所有的状态函数均存在偏摩尔量,这一说法 。
A :正确;B :错误;C :无法判断2. 根据偏摩尔量的定义,下列正确的是 。
A :(),,/j i i T p n G n ≠∂∂;B : (),,/j i i T V n G n ≠∂∂;C : ()m ,,/j ii T p n G x ≠∂∂ 3. 在下列偏导数中,是偏摩尔量的为 。
A :(),,/j i i T V n G n ≠∂∂;B :(),,/j i i S V n U n ≠∂∂;C :(),,/j ii T p n S n ≠∂∂ 4. 在下列偏导数中,不是化学势的为 。
A :(),,/j i i S V n U n ≠∂∂;B :(),,/j i i T p n H n ≠∂∂;C :(),,/j ii T p n G n ≠∂∂ 5. 同一物质不同偏摩尔量间存在一定关系,以下错误的是 。
A :i i i H U pV =+;B :i i i A U TS =-、i i i G H TS =-;C :(),/ji i p n G T S ∂∂= 6. 在化学势与温度压力间的关系中,以下错误的是 。
A : (),/j i i p n T S μ∂∂=-;B : (),/j i i p n T S μ∂∂=;C : (),/ji i T n p V μ∂∂= 7. 以下偏导数中,即是化学势也是偏摩尔量的是 。
A :(),,/j i i S V n U n ≠∂∂;B :(),,/j i i S p n H n ≠∂∂;C :(),,/j ii T p n G n ≠∂∂ 8. 由A 和B 组成的二元混合物,当4.0B =x 时,A 和B 的偏摩尔体积分别为3125.0cm mol -⋅和3130.0cm mol -⋅,则混合物的摩尔体积= 13mol cm -⋅。
华东理工大学物化上自测练习
o f Hm (298.15K) kJ mol1 C p,m (298.15 K) J K mol
1 H 2 (g) O 2 (g) H 2O (g) 2
3 N 2 H 4 (g) O 2 (g) N 2O (g) 2H 2O (g) 2
M g mol
H2O(g) N2H4(g) N2O(g)
393.51 74.81 ( 484.09) k J m ol1 15.77 k J m ol1
o f H m (C H3C O O H, l)
CH3COOH(l)
(g) CH4 (g) CO2 (g)在1000 K时的 三、 试求反应 CH3COOH o 标准摩尔反应焓 r Hm 。已知数据如下: CH3COOH(g) CH3COOH(l) CH4 (g) CO2 (g) 物质 o f H m ( 298.15 K) -484.09 -74.81 -393.51 1
五、将0.1256g蔗糖放在氧弹量热计中完全燃烧,开始时温度为 25℃,燃烧后温度升高了1.743℃。已知燃烧产物和量热计的总 热容为1195J K 1,蔗糖的摩尔质量为 342.3 g mol1 ,燃烧反应 C12 H22O11 (s) 12O2 (g) 12CO 为: 2 (g) 11H 2O (l) 。 CO 2 (g) 和 1 1 H2O(l)的摩尔生成焓分别为 393.5 kJ mol 和 285.8 kJ mol 。试 计算25℃时蔗糖的摩尔燃烧焓和摩尔生成焓。 解: C12H22O11(s)+12O2(g) 12CO2(g) +11H2O(l) 26.743 ℃ 25℃
12CO2(g) +11H2O(l) 0 U U 1 U 2
华东理工大学《物理化学》上单元测试卷一

华东理工大学《物理化学》(上)单元测试卷(一)物质的pVT 关系和热性质一、选择题(每小题1分,共30分)1. 以下三组性质中,都是广延性质的是 。
A :U 、S 、H ;B :p 、ρ、T ;C :U 、S 、V m2. 在使用物质的量时,必须指明物质的基本单元。
以下不正确的是 。
A :1 mol (3AlCl 31);B :1 mol 铜离子;C :1 mol (+32Al )3. 一定温度和压力下,一定量的气体所占体积为8 dm 3,如按理想气体状态方程计算时的体积为10 dm 3,则此时气体的压缩因子等于 。
A :1;B :0.8;C : 1.254. 下列三种说法中,正确的是 .A :实际气体的压缩因子不可能等于1;B :理想气体的压缩因子一定等于1;C :压缩因子等于1的气体必定是理想气体.5. 压力趋近于零时,物质在任何温度下的压缩因子都趋近于 。
A : 1;B :0;C :无法确定6. 对于实际气体的压缩因子,以下错误的说法是 。
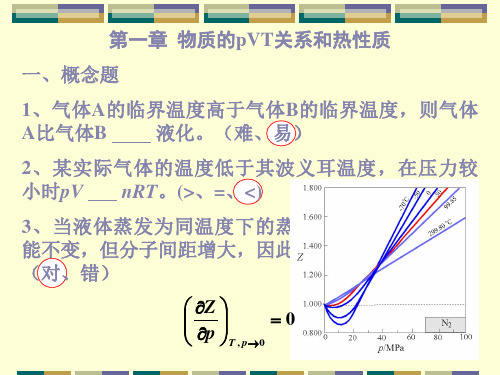
A :压缩因子是温度和压力的函数;B :压缩因子仅是压力的函数;C :压力一定时,压缩因子是温度的函数7. 考察压力接近于零时Z 随p 变化的斜率(∂Z/∂p )T ,p →0,发现低温时<0,高温时>0,其间必有一温度使(∂Z/∂p )T ,p →0=0,这一温度称为 。
A :波义耳温度;B :临界温度;C :沸点8. 某气体的状态方程为pV m =A +Bp +Cp 2+…,其中A , B ,C 等均是温度的函数,则在400K 时,A 的值等于 。
A :3325.6;B :4325.6;C :无法确定9. 当压力发生变化时,物质的性质不发生变化的是 。
A :临界温度;B :沸点;C :摩尔体积10. 为使纯物质气体经恒温压缩而液化,其温度必须低于它的 温度。
A :冰点;B :三相点;C :临界11. 在一定温度和压力下求解范德华方程,得到三个摩尔体积的值:0.0523、0.2534和2.9523 31m mol -⋅,其中饱和液体的摩尔体积为 。
物理化学(下)(华东理工大学)智慧树知到答案章节测试2023年

第一章测试1.反应,其速率方程为或,则的关系是( )。
A:B:C:答案:C2.A:B:C:答案:A3.A:恒容B:恒压C:恒温答案:A4.A:零级B:二级C:一级答案:B5.A:它是一个二级反应B:反应物与产物分子间的计量关系C:它是一个双分子反应答案:B6.零级反应( )基元反应。
A:不一定是B:肯定不是C:肯定是答案:B7.对于反应 2NO2= 2NO + O2,当选用不同的反应物和产物来表示反应速率时,其相互关系为( )。
A:- d[NO2]/2dt = d[NO]/2dt = d[O2]/dt = V-1 dx/dtB:- d[NO2]/2dt = d[NO]/2dt = d[O2]/dt = dx/dtC:-2d[NO2]/dt = 2d[NO]/dt = d[O2]/dt答案:A8.实验测得反应:2A+B ─→2C + D 的速率方程为= k[A][B]。
如以[A]0= 2[B]0开始实验,可将方程式改写成= ka[A]2,则ka与k的关系为( )。
A:ka=kB:ka=0.5kC:0.5 ka=k答案:B9.A:B:C:答案:C10.A:B:C:答案:B11.A:B:C:答案:B12.反应2N2O5─→ 4NO2+ O2 在328 K时,O2(g)的生成速率为0.75×10-4mol·dm-3·s-1。
则该反应的反应速率以及N2O5的消耗速率分别为( )mol·dm-3·s-1。
A:B:C:答案:A13.A:该反应不一定是基元反应B:该反应一定是基元反应;C:该反应一定不是基元反应;答案:A14.基元反应2A→B为双分子反应,此反应为( )反应。
A:零级B:二级;C:一级;答案:B15.A:B:C:答案:B16.为零级反应,A的半衰期为40 min,则A消耗1/4时所需时间为( )。
A:40 min;B:60 minC:20 min;答案:C17.A:0.50;B:0.25C:0.75;答案:C18.A:T-1B:L3N-1T-1C:NL-3T-1答案:C19.无法定义其反应级数。
东华理工大学 物理化学试题和答案

物理化学模拟题一、选择题(30分,每题2分)1. 热力学第三定律可以表示为┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A).在0K 时,任何晶体的熵等于零 (B).在0K 时,任何完整晶体的熵等于零 (C).在0℃时,任何晶体的熵等于零 (D).在0℃时,任何完整晶体的熵等于零2. 理想气体从状态p 1,V 1,T 等温膨胀到p 2,V 2,T ,此过程的ΔA 与ΔG 的关系为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A). ΔA >ΔG (B). ΔA <ΔG (C ). ΔA =ΔG (D).无法确定3.一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V 1、V 2。
┈┈┈( ) (A). V 1 < V 2 (B). V 1 = V 2(C ). V 1 > V 2 (D). 无法确定4.方程mmV T H T Pβαβα∆∆=d d 适用于以下哪个过程┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A).NH 4Cl(s)= NH 3(g)+ HCl(g) (B).NH 4Cl(s)溶于水形成溶液 (C).H 2O (s)= H 2O (l) (D).H 2和O 2化合为水 5. 两液体的饱和蒸汽压分别为p*A ,p *B ,它们混合形成理想溶液,液相组成为x ,气相组成为y ,若 p *A > p *B ,则:┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A) y A > x A (B) y A > y B (C) x A > y A (D) y B > y A6. 在通常情况下,对于二组分物系能平衡共存的最多相为:┈┈┈┈┈┈( ) (A) 1 (B) 2 (C) 3 (D) 47. 25℃时水的饱和蒸气压为3.168kPa, 此时液态水的标准生成吉布斯自由能Δf G m 为-237.19kJ ·mol -1,则水蒸气的标准生成吉布斯自由能为:┈┈┈( ) (A) -245.76kJ ·mol -1 (B) -229.34kJ ·mol -1 (C) -245.04kJ ·mol -1 (D) -228.60kJ ·mol -18. 已知反应 3O 2(g) = 2O 3(g) 在25℃时θm r H ∆ =-280J ·mol -1,则对该反应有利的条件是:┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A) 升温升压 (B) 升温降压 (C) 降温升压 (D) 降温降压 9. 298K 0.01mol•kg -1的CaCl 2水溶液中,CaCl 2的离子平均活度系数γ±为( )(A )0.847 (B )0.791 (C )0.889 (D )0.66610. 某反应表观速率常数k 与基元步骤速率常数间的关系为21412)(k kk k =,则表观活化能与各基元步骤活化能的关系为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A )E=E 2+21(E 1-E 4) (B )E=E 2+21(E 1+E 4) (C )E=E 2+E 1-E 4 (D )E=E 2(41E E)2111. 由MgCO 3(s)、BaCO 3(s)、BaO(s)、MgO(s)及CO 2(g)构成的一个平衡系统,其独立组分数和自由度分别为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A) 5,3 (B) 4,2 (C) 3,1 (D) 3,0 12. 同一温度和压力下,一定量某物质的熵值存在┈┈┈┈( ) (A).s l g S S S 〈〈 (B). s l g S S S 〉〉 (C). s l g S S S == (D). s l g S S S =〉13.某反应物的速率常数为0.099min -1,反应物初始浓度为0.2mol·dm -3,则反应的半衰期为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A). 7 min (B). 1.01 min (C). 4.04 min (D).50.5 min14.在α、β这两相中均含有A 、B 两种物质,当达到相平衡时下列化学势关系中正确的是┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A). ααμμB A = (B). βαμμA A = (C). αβμμB A = (D). ββμμB A =15.已知电极反应(1) Cu e Cu →++22 ,E 1 =0.34V (2) ++→+Cu e Cu 2,E2=0.167V则Cu e Cu →++的标准电极电势E 3为┈┈┈┈┈┈┈┈┈( ) (A).0.507V (B). 0.513V (C). 0.173V (D). 0.267V二、填空题(10分,每题2分)1、25℃时,0.5molA 与0.5molB 形成理想液态混合物,则混合过程的 ΔS=________。
物理化学智慧树知到答案章节测试2023年华东理工大学

绪论单元测试1.物理化学是研究速率规律和()的平衡。
A:前3个选项都正确B:相变化C:pVT变化sD:化学变化答案:A第一章测试1.下列叙述中不属于状态函数特征的是()。
A:系统状态确定后,状态函数的值也确定B:系统变化时,状态函数的改变值仅由系统的始、终态决定而与过程无关C:状态函数均有加和性答案:C2.在使用物质的量时,必须指明物质的基本单元,以下不正确的是()。
A:1 mol ( )B:1 mol ( )C:1 mol铜离子答案:C3.400K、101325Pa下,1mol气体的体积为22.85 dm3,则气体的压缩因子=()。
A:0.6962B:1C:1.2532答案:A4.下图为某物质的压缩因子图,图中标有三条等温线,则三条线上注明的温度T1、T2、T3,其大小关系是()。
A:B:C:答案:A5.甲、乙、丙三种物质的临界温度分别为343.05K、373.65K和405.65K,其中最易液化的气体为()。
A:乙物质B:甲物质C:丙物质答案:C6.范德华气体分子的微观模型为()。
A:只具有吸引力的软球B:只具有吸引力的硬球C:不具有吸引力的硬球答案:B7.在一定温度和压力下求解范德华方程,得到三个摩尔体积的值:0.0523、0.2534和2.9523 ,其中饱和液体的摩尔体积为()。
A:B:C:答案:B8.物质A和B的对比温度相等、对比压力也相等,按对应状态原理,以下结论不一定正确的是()。
A:它们的压缩因子相同B:它们的对比体积相同C:它们的体积相同答案:C9.一隔板将一刚性绝热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去,左、右气体的压力达到平衡。
若以全部气体作为系统,则()。
A:W< 0、Q >0、 =0B:W=0、Q =0、 =0C:W>0、Q < 0、 =0答案:B10.物质的标准摩尔蒸发焓为,标准摩尔熔化焓为,标准摩尔升华焓为,三者间的关系为()。
物理化学__华东理工大学(6)--单元测试卷

第四章 相平衡单元测试卷一、选择题(每小题1分,共30分)1. 只要知道纯物质的饱和蒸汽压与温度的定量关系,即可得到二元混合物气液平衡相图的是 。
A :实际溶液;B :理想溶液;C :理想稀溶液2. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :液相线示意了溶液的蒸气压随液相组成的变化关系;B :液相线为直线是理想混合物的一个特征;C :液相线为泡点线3. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :气相线示意了溶液的蒸气压随气相组成的变化关系;B :气相线为曲线;C :气相线为露点线4. 对于二元理想混合物的气液平衡相图(恒压),以下说法不正确的是 。
A :液相线为泡点线,气相线为露点线;B :液相线示意了沸点随液相组成的变化;C :液相线为直线5. 如二元混合物气液平衡相图中出现正偏差时,下列正确的说法是 。
A : i i i x p p *<;B :正偏差强烈时,可形成最高恒沸混合物;C :正偏差强烈时,可形成最低恒沸混合物6. 如二元混合物气液平衡相图中出现负偏差时,下列正确的说法是 。
A : *i i i p p x >;B :负偏差强烈时,可形成最低恒沸混合物;C :负偏差强烈时,可形成最高恒沸混合物7. 二元混合物气液平衡相图中出现正偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :第二种物质的加入使分子的缔合程度降低;C :溶液中不同组分分子间的相互吸引比纯物质弱8. 二元混合物气液平衡相图中出现负偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :不同组分间生成氢键而相互缔合;C :溶液中不同组分分子间的相互吸引比纯物质弱9. 关于恒沸混合物,不正确的说法是 。
A :恒沸混合物是一种具有确定组成的化合物;B :恒沸混合物并不是一种具有确定组成的化合物;C :在恒沸点,泡点线与露点线重合10. 二元系的气液平衡相图(恒压)中,恒沸点的自由度为 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章 电解质溶液单元测试卷一、选择题(每小题1分,共30分) 1. 电解质HCl 在溶剂中电离HCl H ++Cl -并达到平衡,则未电离电解质HCl 的化学势HClµ与正负离子的化学势H µ+和-Cl µ之间的关系式为 。
A: HCl µ>H µ++-Cl µ;B :HCl µ=H µ++-Cl µ;C :HCl µ<H µ++-Cl µ2. 24H SO 在溶剂中电离24H SO 242H +SO +−并达到平衡,则未电离电解质24H SO 的化学势24H SO µ与正负离子的化学势+H µ、24SO µ−之间的关系式为 。
A: 24H SO µ=+H µ+24SO µ−;B :24H SO µ=+2H µ+24SO µ−;C :24H SO µ=2+H µ+24SO µ− 3. 在1-1型、1-2型、2-2型、3-1型第一类电解质溶液中,b ±=b 的是 。
A. 1-1型和2-2型;B. 1-2型和3-1型;C. 1-1型和1-2型4. 在1-1型、1-2型、2-2型、3-1型第一类电解质溶液中,b ±>b 是 。
A. 1-1型和2-2型;B. 1-2型和3-1型;C. 1-1型和1-2型5. 电解质溶液中含+4NH 、OH −和+H 三种离子,它们的质量摩尔浓度分别记为a 、b 和 c (-1mol kg ⋅),则电中性条件是 。
A. 0a b c ++=;B. a c b +=;C. a c b −= 6. 对于第一类电解质溶液,电解质作为整体的活度B a 与±a 间的关系为 。
A. ν±=a a B ; B . ±=a a B ; C. ν/1B ±=a a7. 要使K 2SO 4水溶液的离子强度I 与-11.20mol kg b ⋅的KCl 水溶液的离子强度相等,则K 2SO 4水溶液的浓度b = -1mol kg ⋅。
A. 1.20; B . 0.80; C. 0.408. CuSO 4的水溶液与LaCl 3的水溶液,如它们的浓度相同,则两溶液的离子强度之比()()43CuSO /LaCl I I = 。
A. 1.667; B . 0.667; C. 0.2679. KCl 水溶液的浓度为1kg mol 20.1−⋅=b ,则b ±= -1mol kg ⋅。
A. 0.80; B . 1.00; C. 1.2010. 溶液中同时溶解有MgCl 2和KCl 两种盐,它们的浓度均为1kg mol 20.1−⋅=b ,则溶液的离子强度=I -1mol kg ⋅。
A. 2.40; B . 3.60; C. 4.8011. 对于理想稀溶液,溶剂的渗透系数φx 1。
A. >; B . =; C. <12. 溶液中同时溶解有MgCl 2和KCl 两种盐,采用ln Az z γ±+=MgCl 2的平均离子活度因子时,正确的做法是 。
A. z +=2、z -=-1、离子强度只需考虑MgCl 2的贡献; B . z +=1、z -=1、离子强度包括所有离子的贡献; C. z +=2、z -= -1、离子强度包括所有离子的贡献13. 今有浓度相同的三种电解质溶液,其价型分别为1-1型、2-1型和2-2型,则它们的平均离子活度因子的大小排序为 。
A. (11)(21)(22)γγγ±−±−±−>>;B. (11)(21)(22)γγγ±−±−±−<<;C. (11)(21)(22)γγγ±−±−±−== 14. 298.15K 时,浓度同为0.002-1mol kg ⋅的KCl 、CaCl 2、CaSO 4三种水溶液的平均离子活度因子分别为1γ±、2γ±、3γ±,则它们的关系为 。
A. 1γ±=2γ±=3γ±;B. 1γ±<2γ±<3γ±;C. 1γ±>2γ±>3γ±15. 2Ni 2e Ni +−+→的电极反应,要得到2mol 的Ni ,则通过的电量为 。
A. 2F ;B. 3F ;C. 4F16. 如果电解质溶液的导电依赖OH −和K +的迁移和电极反应实现,已知OH −离子的迁移速度约为K +离子的3倍,则 。
A. K 1/4t +=,OH 3/4t −=;B. OH K /3t t −+=, 但OH K 1t t −++<;C. OH K 0.5t t −+== 17. 在电解水(事先加入了KOH )的过程中,电流的传导主要靠K +和OH -离子,它们对传导的贡献可用迁移数来表征,K 1/4t +=,OH 3/4t −=且OH K 1t t −++=。
现假设电解水时加入的电解质为KOH 和NaOH 两种,则+K OH t t −+ 1。
A. >;B. =;C.<18. 如果电解质溶液的导电依赖M +和X -的迁移和电极反应实现,已知M +和X -的电迁移率相等,则 。
A. t t +−>;B. t t +−=, 但1t t +−+<;C. 0.5t t +−==19. 有HCl 、KOH 、NaCl 三种稀的电解质溶液,浓度均为0.01mol ﹒dm -3 ,它们的摩尔电导率m Λ值由大到小的正确排列是 。
A. HCl >KOH >NaCl ;B. KOH >HCl >NaCl ;C. HCl >NaCL >KOH20. HCl 、NaAc 和NaCl 的无限稀释摩尔电导率分别为a ,b 、和c ,则HAc 的无限稀释摩尔电导率等于 。
A. a +b +c ;B. a +b -c ;C. a -b -c21. 291K 时,H 2SO 4溶液的浓度从3dm mol 01.0−⋅增加到3dm mol 1.0−⋅,其电导率和摩尔电导率的变化情况为 。
A. κ增加,m Λ增加;B. κ减小,m Λ增加;C. κ增加,m Λ减小22. 只有强电解质的电导率随浓度的变化才出现极大值,这一说法 。
A . 错误;B. 正确;C. 不确定23. 科尔劳施经验公式mm ΛΛ∞=−的适用条件为 。
A. 强电解质稀溶液;B. 弱电解质稀溶液; C. 两者均适用24. 有HCl 、KOH 、NaCl 三种浓度均相同的电解质溶液,它们的电导率κ值由大到小的正确排列是 。
A. HCl >KOH >NaCl ;B. KOH >HCl >NaCl ;C. HCl >NaCL >KOH25. 将电导率为0.141 S·m -1的某电解质溶液A 装进电导池,测得电阻为500Ω,将电解质溶液B 装进同一电导池,电阻为1000Ω,则电解质溶液B 的电导率为 S·m -1。
A. 0.141;B. 0.282;C. 0.070526. 离子独立运动定律适用于 。
A. 强电解质稀溶液;B.强电解质浓溶液;C.无限稀释的电解质溶液27. 298.15K 时,LiCl 和LiNO 3无限稀释摩尔电导率之差()()m m 3LiCl LiNO ΛΛ∞∞−等于3210.4910S m mol −−×⋅⋅。
下列两种盐的无限稀释摩尔电导率之差可以确认等于3210.4910S m mol −−×⋅⋅的是 。
A: ()()3m,NaCl m,KNO ΛΛ∞∞−;B :()()3m,KCl m,KNO ΛΛ∞∞−;C :()()3m,KCl m,NaNO ΛΛ∞∞− 28. 已知弱电解质溶液的无限稀释摩尔电导率为a ,现测得在某浓度下弱电解质溶液的摩尔电导率为b ,则电解质在该浓度下的解离度等于 。
A. a +b ;B. a /b ;C. b /a29. 在一定温度下,实测微溶盐溶液的电导率为a ,同温度下水的电导率为b ,则微溶盐的溶解度为 。
A. m a b Λ∞−;B. m a Λ∞;C. mb Λ∞30. 采用m m αΛΛ∞=计算解离度,下列正确的叙述是的 。
A. 适用于所有电解质;B. 适用于弱电解质;C. 适用于强电解质二、(每小题5分,共10分)1. 强电解质3LaCl 溶液的质量摩尔浓度为b ,平均离子活度因子±γ。
试分别写出该电解质溶液的±b 、±a 以及ν±a 与b 的关系。
2. 计算1kg mol 0.2−⋅=b 的2MgCl 水溶液在25℃时的平均离子浓度、平均离子活度、电解质作为整体的活度。
已知051.1=±γ。
三、(此题总分10分)298.15K 时,氯化银饱和溶液的溶度积为6210dm mol 1072.1−−⋅×,纯水的电导率为14m S 1060.1−−⋅×,银离子和氯离子的无限稀释摩尔电导率分别为4109.61−×和4104.76−×12mol m S −⋅⋅。
计算氯化银饱和溶液的电导率。
四、(此题总分10分)浓度为3dm mol 001.0−⋅的42SO Na 溶液的电导率12m S 106.2−−⋅×=κ。
若将4CaSO 溶于上述溶液中,达饱和后测得此溶液的电导率12m S 100.7−−⋅×=′κ。
已知124m mol m S 101.50)Na (−−+∞⋅⋅×=λ,1242m mol m S 105.59)Ca 21(−−+∞⋅⋅×=λ。
设这两种溶液均可视为无限稀释的溶液。
试求:42SO Na 溶液的摩尔电导率)SO Na (42m Λ以及4CaSO 在42SO Na 溶液中的溶解度。
五、(此题总分10分)电解质溶液的电导率测定实际是测量其电阻,而电导率κ与电阻R 的关系可表示为:κ=K cell /R 。
对于一个固定的电导池,K cell 为定值,称为电导池常数,单位为m -1。
298.15K 时将电导率为0.141 S·m -1的KCl 溶液装进电导池,测得电阻为525Ω,如在该电导池中装进0.1 mol·dm -3的NH 4OH 溶液,测得电阻为2030Ω,计算NH 4OH 的解离度和解离平衡常数。
已知:421m 4(NH )73.410S m mol λ∞+−−=×⋅⋅,421m (OH )198.310S m mol λ∞−−−=×⋅⋅。
