化学竞赛PPT-第八章 芳烃-第8章_3
合集下载
化学竞赛PPT-第八章 芳烃-第82
30℃
CH3 NO2 +
CH3
NO2
§8.4 取代苯的亲电取代反应——定位效应
大量实验证明,一取代苯发生亲电取代反应时, 苯环上原有取代基的性质对发生亲电取代反应的速度 和亲电试剂(第二个取代基)进入苯环位置都有影响。 也影响反应的难易程度。
这种原有取代基对新引入取代基进入苯环位置的 决定作用称为取代基的定位效应。
(1) 含有未共用电子对的原子与芳环成键,形成大键 ; (2) 含有电子的基团,例如: C C C6H5(3) 可通过诱导效应或超共轭效应产生给电子效应的烷基等。
2. 第二类定位基——间位定位基
使新引入的取代基主要进入原基团间位(间位产物大于 50%),且钝化苯环,使取代反应比苯难进行。此类定位基 为吸电子基,钝化基。
XY
有 些 容 易 混 淆 的 基 团 , 譬 如 —COOCH3 和 — OCOCH3 、 —CONHCH3 和 —NHCOCH3 , 按 此 方 法 均 可以正确判断:
—COOCH3 和 —CONHCH3 为 吸 电 子 基 , 而 — OCOCH3和—NHCOCH3为给电子基。
对于—CH2Cl、—CH2OH、—CH2OCH3、—CH2CN 则属例外,它们仍是给电子基。这些基团可以看成—CH3 上的1个H被取代,但其余C—H还可以通过σ-p超共轭作用 发挥给电子作用。
:OCH3
C 第三类定位基(卤素)定位效应的解释
第三类定位基卤素的电负性X > C, 具有 -I 效应;但X 的电子对与苯形成 p-π 共轭,具有 + C 效应。由于卤素 的+C < -I,因而苯环上的电荷密度总体降低,反应速度 减慢,但+C效应使邻、对位电荷密度较大,因而为邻对
CH3 NO2 +
CH3
NO2
§8.4 取代苯的亲电取代反应——定位效应
大量实验证明,一取代苯发生亲电取代反应时, 苯环上原有取代基的性质对发生亲电取代反应的速度 和亲电试剂(第二个取代基)进入苯环位置都有影响。 也影响反应的难易程度。
这种原有取代基对新引入取代基进入苯环位置的 决定作用称为取代基的定位效应。
(1) 含有未共用电子对的原子与芳环成键,形成大键 ; (2) 含有电子的基团,例如: C C C6H5(3) 可通过诱导效应或超共轭效应产生给电子效应的烷基等。
2. 第二类定位基——间位定位基
使新引入的取代基主要进入原基团间位(间位产物大于 50%),且钝化苯环,使取代反应比苯难进行。此类定位基 为吸电子基,钝化基。
XY
有 些 容 易 混 淆 的 基 团 , 譬 如 —COOCH3 和 — OCOCH3 、 —CONHCH3 和 —NHCOCH3 , 按 此 方 法 均 可以正确判断:
—COOCH3 和 —CONHCH3 为 吸 电 子 基 , 而 — OCOCH3和—NHCOCH3为给电子基。
对于—CH2Cl、—CH2OH、—CH2OCH3、—CH2CN 则属例外,它们仍是给电子基。这些基团可以看成—CH3 上的1个H被取代,但其余C—H还可以通过σ-p超共轭作用 发挥给电子作用。
:OCH3
C 第三类定位基(卤素)定位效应的解释
第三类定位基卤素的电负性X > C, 具有 -I 效应;但X 的电子对与苯形成 p-π 共轭,具有 + C 效应。由于卤素 的+C < -I,因而苯环上的电荷密度总体降低,反应速度 减慢,但+C效应使邻、对位电荷密度较大,因而为邻对
化学竞赛PPT-有机复习

1. 威廉逊(A. W. Williamson)合成法
2. 醇脱水 3. 醇与烯烃的加成
四、环醚 1. 命名
(1) 碱性条件下开环
2. 环氧化合物的反应 (2) 酸性条件下的开环
五、冠醚
(3) 还原开环
3. 环氧化合物的制法
C6H5ቤተ መጻሕፍቲ ባይዱH + CH3CH2CH2I
苯酚
1-碘丙烷
CH3CH2ONa CH3CH2OH
3 转变成烯烃——消去反应
三、 一元醇的制法
1. 羰基化合物的还原 2. 用格利雅试剂合成醇 3. 烯烃的水合 (1)直接水合法:马氏醇和反马氏醇
(2)间接水合
4. 卤代烃的水解
四、二元醇 五、一元酚的反应
第十一章 醚
一、命名
二、醚的反应 三、醚的制法
1. 碱性 2. 醚链的断裂: 3. 自动氧化 4. 克莱森(L. Claisen)重排
四、亲核取代反应的机理
五、卤代烃的制法
1 烷烃卤代 2 由醇制备 3 烯、炔加HX、X2 六、金属有机化合物
1 有机镁化合物——格氏试剂 2 有机锂化合物 3 二烃基铜锂
第六章 烯 烃
一、烯烃的结构、异构和命名 二、烯烃的相对稳定性 三、烯烃的制法
1 消除方法制备 2 醇脱水 3 消除反应机理
四、烯烃的化学性质
第二章 烷烃
一 烷烃的同系列和同分异构体 二 烷烃的命名 三 烷烃的结构
1 碳原子的四面体构型和sp3杂化 2乙烷、正丁烷的构象 四 烷烃的物理性质 五 烷烃的反应 六 烷烃的氯化
第三章 环烷烃
一、环烷烃的异构和命名 二、环烷烃的性质 三、环己烷的构象 四、取代环己烷的构象分析 五、多环烃
2020-2021学年高中化学竞赛第八章 电化学基础课件共78张

❖ 在Cu-Zn原电池中,电子由Zn传递给Cu2+ (或者说电流由Cu流向Zn),而不是从Cu 传递给Zn2+?这是因为原电池中Zn电极的电 极电势比Cu电极的电极电势更负(或更低)。
❖ 电极电势是怎样产生的?是什么原因引起各 个电极的电势不同呢?
1. 双电层理论 金属晶体里有金属阳离子和公共化 电子。当把金属放入含有该金属离 子的浓溶液时,有两种反应倾向存 在。一方面金属表面构成晶格的金 属离子和极性大的H2O分子相互 吸引,从而使金属离子进入水层。
第八章 氧化还原反应
8-1 氧化还原反应
一、 氧化值(氧化数、氧化态)的概念
氧化值是元素一个原子的表观荷电数,这种荷 电数是将成键电子指定给电负性较大的原子求 得。
规定: (1)单质中,元素的氧化值为零,H2 、 Cl2 、Fe (2)正常氧化物中,氧的氧化值为-2, (3)过氧化物中(H2O2 和Na2O2)氧的氧化值为-1。 (4)超氧化物如KO2中氧 的氧化值为-0.5。 (5)H 一般为+1,如PH3; 但在NaH中为- 1。
P4 4PO43– 氧化值升高20
最小公倍数60
10 HClO3 + 3P4 10HCl + 12H3PO4
10HClO3 + 3P4 +18H2O 10HCl + 12H3PO4
方程式左边比右边少36个H原子,少18个O原子, 应在左边加18个H2O。
2、离子--电子法或半反应法 (1)写出相应的离子反应式。 (2)将反应分成两部分,即还原剂的氧化反应和
半反应
SO32– SO42– + 2e MnO4– + 5e Mn 2+
将反应分成两部分
配平半反应:
❖ 电极电势是怎样产生的?是什么原因引起各 个电极的电势不同呢?
1. 双电层理论 金属晶体里有金属阳离子和公共化 电子。当把金属放入含有该金属离 子的浓溶液时,有两种反应倾向存 在。一方面金属表面构成晶格的金 属离子和极性大的H2O分子相互 吸引,从而使金属离子进入水层。
第八章 氧化还原反应
8-1 氧化还原反应
一、 氧化值(氧化数、氧化态)的概念
氧化值是元素一个原子的表观荷电数,这种荷 电数是将成键电子指定给电负性较大的原子求 得。
规定: (1)单质中,元素的氧化值为零,H2 、 Cl2 、Fe (2)正常氧化物中,氧的氧化值为-2, (3)过氧化物中(H2O2 和Na2O2)氧的氧化值为-1。 (4)超氧化物如KO2中氧 的氧化值为-0.5。 (5)H 一般为+1,如PH3; 但在NaH中为- 1。
P4 4PO43– 氧化值升高20
最小公倍数60
10 HClO3 + 3P4 10HCl + 12H3PO4
10HClO3 + 3P4 +18H2O 10HCl + 12H3PO4
方程式左边比右边少36个H原子,少18个O原子, 应在左边加18个H2O。
2、离子--电子法或半反应法 (1)写出相应的离子反应式。 (2)将反应分成两部分,即还原剂的氧化反应和
半反应
SO32– SO42– + 2e MnO4– + 5e Mn 2+
将反应分成两部分
配平半反应:
化学竞赛PPT-第八章 芳烃-杂环化合物

★ 孤对电子因为p-π共轭,而呈给电子效应。
★ 吡咯中氮原子为sp2杂化状态;形成三个σ键,一对孤
对电子所在p轨道与四个碳原子的p轨道平行重叠。 ★ 孤对电子因为p-π共轭,而呈给电子效应。
亲电取代反应的活性大于苯, 环上电子云密度比苯大.
芳香性顺序:
环上电子云分布不均,芳香性不如苯。
>
>物
O
O
非芳香性杂环化合物具有与相 O
应脂肪族化合物相类似的性质。 O
体现各自功能团的性质
O
Aromatic Heterocycles 芳香杂环化合物
N H
NO H
一 .Classification & Nomenclature:
按环的大小
Five-membered ring Six-membered ring
2、与NaNH2反应,往吡啶环上引入胺基。 将吡啶与氨基钠在N,N-二甲基苯胺溶液中加热到110℃,
吡啶环上2-位上的氢负离子被亲核性极强的氨基负离子取代, 同时有氢气放出。齐齐巴宾(Chichibabin)反应。
3、与苯基锂作用生成2-苯基吡啶,反应中间体已分离鉴 定,证明为1,2-加成产物:
五、氧化还原反应
N3 2
S 1
CH3 4 3 Br
5 O 2 Br 1
第一节 吡咯、呋喃和噻吩
它们都含有由五个原子和六个π-电子所组成的共轭体系,环 内原子上的电子云密度大于苯环。因此,是富电子的芳香杂环化 合物。如以苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物
的有效电荷分布为
一、结构
★ 分子呈平面型,氧原子为sp2杂化状态;形成两个σ键, 一对孤对电子所在p轨道与四个碳原子的p轨道平行重叠。
★ 吡咯中氮原子为sp2杂化状态;形成三个σ键,一对孤
对电子所在p轨道与四个碳原子的p轨道平行重叠。 ★ 孤对电子因为p-π共轭,而呈给电子效应。
亲电取代反应的活性大于苯, 环上电子云密度比苯大.
芳香性顺序:
环上电子云分布不均,芳香性不如苯。
>
>物
O
O
非芳香性杂环化合物具有与相 O
应脂肪族化合物相类似的性质。 O
体现各自功能团的性质
O
Aromatic Heterocycles 芳香杂环化合物
N H
NO H
一 .Classification & Nomenclature:
按环的大小
Five-membered ring Six-membered ring
2、与NaNH2反应,往吡啶环上引入胺基。 将吡啶与氨基钠在N,N-二甲基苯胺溶液中加热到110℃,
吡啶环上2-位上的氢负离子被亲核性极强的氨基负离子取代, 同时有氢气放出。齐齐巴宾(Chichibabin)反应。
3、与苯基锂作用生成2-苯基吡啶,反应中间体已分离鉴 定,证明为1,2-加成产物:
五、氧化还原反应
N3 2
S 1
CH3 4 3 Br
5 O 2 Br 1
第一节 吡咯、呋喃和噻吩
它们都含有由五个原子和六个π-电子所组成的共轭体系,环 内原子上的电子云密度大于苯环。因此,是富电子的芳香杂环化 合物。如以苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物
的有效电荷分布为
一、结构
★ 分子呈平面型,氧原子为sp2杂化状态;形成两个σ键, 一对孤对电子所在p轨道与四个碳原子的p轨道平行重叠。
大学有机化学芳香烃PPT课件

HE HE
+或
+
HE
+
HE
+
.
20
σ络合物的能量比苯高,不稳定,很容易从 sp3
杂化碳原子上失去一个质子,使该碳原子恢复成
sp2 杂化状态,再形成六个 π 电子离域的闭合共轭
体系——苯环,生成取代苯。其反应机理可表示如 下:
+
+E
亲电试剂
HEsp3杂E化sp2杂化
+
E
+
+ -H
+H+
π络合物 σ络合物 取代苯
O
R C
δ
δ
R o rR X A lC l3
.
31
5.2加成反应
苯环易起取代反应而难起加成反应,但并不是绝对的,在特 定条件下,也能发生某些加成反应。
1.加氢
NP i, + 3H 2
180~250℃
2.加氯 + 3Cl2
光 50℃
H Cl
CH l
H Cl
Cl 六 六 六 H 对 人 畜 有 害 , 世 界 禁 用 ,
.
18
第五节 单环芳烃的化学性质
亲电取代反应及机理
亲电取代反应 苯环上氢的亲电取代反应:苯环上电子云密
度高,易被亲电试剂进攻,引起 C—H 键的氢被 取代,称为亲电取代反应。
.
19
5.1 亲电取代反应机理
苯与亲电试剂 E+ 作用时,生成 π 络合物,接 着亲电试剂从苯环的 π 体系中得到两个电子,生成 σ 络合物。此时,这个碳原子由 sp2 杂化变成 sp3 杂 化状态,苯环中六个碳原子形成的闭合共轭体系被 破坏,变成四个 π 电子离域在五个碳原子上。从共 振论的观点来看,σ 络合物是三个碳正离子的共振 杂化体:
有机化学7芳烃-96页PPT精品文档

H
H
C
H
C
C
C
C
H
C
H
H
这个成环的概念在有机化学结构理论上是一 重大突破。
“我坐下来写我的教科书,但工 作没有进展,我的思想开小差了。我 把椅子转向火炉,打起嗑睡来了。原 子又在我眼前跳跃起来了,这时较小 的基团谦逊地退到后面,我的思想因 这种幻觉的不断出现变得更敏锐了, 现在能分辨出多种形状的大结构;也 能分辨出有时紧密地靠近在一起的长 行分子,它们盘绕、旋转,象蛇一样 动着。看!那是什么?有一条蛇咬住 了自己的尾巴。这种形状虚幻地在我 眼前旋转着,像是电光一闪,我醒 了……。我花了这一夜的其余时间, 作出了这个设想”。先生们!让我们 学会作梦吧!或许我们将在梦中得到 真理。
O
O R-C
OO
O + CH3-C-Cl AlCl3
C-CH3
乙酰氯
苯乙酮
CH3
O
CH3
化 反 应 不 能 进 行 。
吸 电 基 时 , 付 - 克 酰 基
*
芳 烃 分 子 中 若 含 有 强
+ CH3 -C O CH3 -C
AlCl3
+ CH3COOH
O
乙酐
O= C-CH3
CH3
NO2
溴苯
甲苯
硝基苯
(2)当取代基为-NH2、-OH、-CHO、- SO3H、 -COOH等时,则把它们各看作一类化 合物。
OH
NH2
COOH SO3H CHO
苯酚
苯胺
苯甲酸 苯磺酸 苯甲醛
OH
1 2
-Cl
3 4
间氯苯酚 m-氯苯酚 3-氯苯酚
NH2 1 -NO2 2
化学竞赛题PPT课件

化学在环境保护中的作用
化学在环境保护中发挥着重要作用, 如环境监测、污水处理、空气净化等。
环境保护的意义
环境保护是可持续发展的重要组成部 分,通过采取措施减少人类活动对环 境的负面影响,保护生态系统平衡和 生物多样性。
未来展望
探讨未来环境保护的趋势和挑战,提 出加强环境保护的措施和建议,促进 可持续发展。
分子根据其电子排布和成 键情况具有特定的几何构 型,如直线、平面、四面 体等。
化学反应与能量转化
化学反应的能量守恒定律
01
化学反应中,反应物的总能量等于生成物的总能量,能量既不
会凭空产生也不会消失。
熵与自发反应
02
熵表示系统的混乱程度,自发反应总是向着熵增加的方向进行,
即向着更加无序的状态发展。
氧化还原反应
实验设计与操作
实验设计
掌握实验设计的基本原则和方法,能 够根据实验目的和要求,合理选择实 验材料、器材和试剂,设计出科学、 可行的实验方案。
实验操作
掌握基本的化学实验操作技能,如溶 解、加热、冷却、蒸馏、萃取等,能 够正确、规范地完成实验操作,确保 实验结果的准确性和可靠性。
实验数据处理与分析
数据处理
现。
采用无毒或低毒的原料和试剂,优化合成路线,减少废物产生 和能源消耗,实现高效、清洁的生产过程。
使用无毒或低毒的溶剂替代传统有机溶剂,减少对环境和人体 的危害。
介绍一些绿色化学实践案例,如绿色农药、绿色塑料等,展示 绿色化学在实践中的应用和成果。
可持续发展与环境保护
可持续发展的概念
可持续发展是指在满足当前世代需求 的同时,不损害未来世代满足自身需 求的能力。
材料科学
是一门跨学科的综合性学科,主要研究材料的组成、结构、 性质和加工工艺之间的关系,以及材料在各种环境下的行为 和性能。
化学在环境保护中发挥着重要作用, 如环境监测、污水处理、空气净化等。
环境保护的意义
环境保护是可持续发展的重要组成部 分,通过采取措施减少人类活动对环 境的负面影响,保护生态系统平衡和 生物多样性。
未来展望
探讨未来环境保护的趋势和挑战,提 出加强环境保护的措施和建议,促进 可持续发展。
分子根据其电子排布和成 键情况具有特定的几何构 型,如直线、平面、四面 体等。
化学反应与能量转化
化学反应的能量守恒定律
01
化学反应中,反应物的总能量等于生成物的总能量,能量既不
会凭空产生也不会消失。
熵与自发反应
02
熵表示系统的混乱程度,自发反应总是向着熵增加的方向进行,
即向着更加无序的状态发展。
氧化还原反应
实验设计与操作
实验设计
掌握实验设计的基本原则和方法,能 够根据实验目的和要求,合理选择实 验材料、器材和试剂,设计出科学、 可行的实验方案。
实验操作
掌握基本的化学实验操作技能,如溶 解、加热、冷却、蒸馏、萃取等,能 够正确、规范地完成实验操作,确保 实验结果的准确性和可靠性。
实验数据处理与分析
数据处理
现。
采用无毒或低毒的原料和试剂,优化合成路线,减少废物产生 和能源消耗,实现高效、清洁的生产过程。
使用无毒或低毒的溶剂替代传统有机溶剂,减少对环境和人体 的危害。
介绍一些绿色化学实践案例,如绿色农药、绿色塑料等,展示 绿色化学在实践中的应用和成果。
可持续发展与环境保护
可持续发展的概念
可持续发展是指在满足当前世代需求 的同时,不损害未来世代满足自身需 求的能力。
材料科学
是一门跨学科的综合性学科,主要研究材料的组成、结构、 性质和加工工艺之间的关系,以及材料在各种环境下的行为 和性能。
2020高中化学竞赛—精细有机合成-第八章 重氮化和重氮基的转化(共34张PPT)

ArCl
HBr,Cu2Br2 Sandmeyer反应
ArBr
KI(直接加) ArI
Na2Cu(CN)4NH3(四氰氨络铜钠盐) Na[Cu(CN)2](氰化亚铜络盐) ArCN
BF4 Schiemann反应
ArN2+ BF4
ArF
ArN2+
H3PO3(或C2H5OH)还原剂 脱氨基反应
ArH
(1)H2O (2)H2O,CuSO4催化
Ar-N2+X-
NaSO3, NaHSO3
还原
Ar-NHNH2
ArN2X- 重氮基转化 ArY Y=F, Cl, Br, I, CN, OH, H等
• 特点 (1)酸要过量
ArNH2 2HX NaNO2
ArN2+X- NaX 2H2O
理论量:n(HX):n(ArNH2)=2:1 实际比: n(HX):n(ArNH2)=2.5~4 : 1
方法:在重氮化时先把它们溶于碳酸钠或氢氧 化钠水溶液中,然后加入无机酸析出很细的沉 淀,再加入亚硝酸钠溶液,进行重氮化。
对于溶解度更小的1-氦基萘-4-磺酸,可把等 分子比的芳胺和亚硝酸钠混合物在良好搅拌下, 加到冷的稀盐酸中进行反法重氮化。
• 氨基酚类
特点:此类芳胺有邻位、对位氨基苯酚及其硝 基、氯基衍生物 。
SO3H
CH3 NO2
还原 Cl H2,Ni
CH3 NH2
NaNO2,HCl 重氮化
Cl
CH3 N2+Cl
Cu2Cl2,HCl Cl
CH3 Cl
转化
COOH NH2
H2SO4,NaNO2 10 oC以下
COOH
N2+ HSO4 K- I
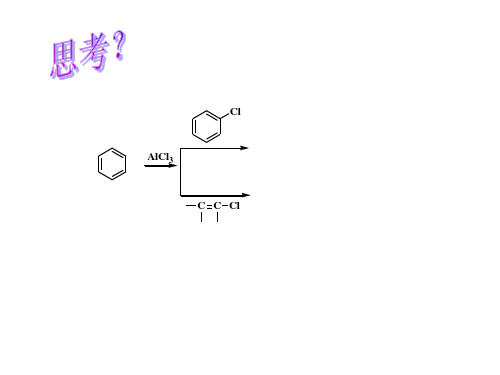
有机化学-第八章芳烃ppt课件

有机化学-第八 章芳烃1Fra bibliotek芳烃的分类和命名
第 八 章 芳 烃
当苯环上有俩不同取代基,按照下列顺序决定哪个取代基和苯 环一起作为母体:羧基-COOH > 醛基-CHO > 羟基-OH > 烯基-C=C-或炔基 > 氨基-NH2 > 烷氧基-OR > 烷基-R > 卤 素-X > 硝基-NO2 > 亚硝基-NO 当苯环上有三取代基时,先选出母体官能团,并把它编号为1 ,其他的官能团按编号最小原则顺时针或逆时针沿苯环编号, 书写官能团时依然按照取代基次序原则先后书写; 了解联苯的编号与命名; 了解萘的编号和α 位β位; 练习题 8.1 8.2
①
② •
傅克反应的局限性: 傅克反应是一个亲电取代反应,凡是苯环上连有硝基-NO2、 磺酸基-SO3H、氰基-CN或者羰基-CO-R等吸电子基团,将直 接降低苯环电子云密度而导致傅克反应不能发生; 傅克烷基化反应经过碳正离子中间体,碳正离子重排严重,常 使引入苯环的烷基不是以前的烷基; 克服碳正离子重排方法是酰化后再经克莱门森还原为烷基。
练习题 8.9 练习题 8.10
2.芳烃的化学反应
第 八 章 芳 烃
苯的加成和氧化反应 苯环相比烯烃,加成条件非常特殊。
H , N i 2 4 0 0 ~ 5 0 0 C
C l C l C l C l C l C l
C l 2 u l t r a v i o l e t
氧化反应:
O , V O 2 2 5 4 0 0 ~ 5 0 0 C
O O H S O
苯与浓硫酸或发烟硫酸(SO3与硫酸的混合物)反应,可在苯 环上引入磺酸基而生成苯磺酸。 磺化反应是可逆反应,即苯磺酸与稀酸一起加热可返回苯与硫 酸;
第 八 章 芳 烃
当苯环上有俩不同取代基,按照下列顺序决定哪个取代基和苯 环一起作为母体:羧基-COOH > 醛基-CHO > 羟基-OH > 烯基-C=C-或炔基 > 氨基-NH2 > 烷氧基-OR > 烷基-R > 卤 素-X > 硝基-NO2 > 亚硝基-NO 当苯环上有三取代基时,先选出母体官能团,并把它编号为1 ,其他的官能团按编号最小原则顺时针或逆时针沿苯环编号, 书写官能团时依然按照取代基次序原则先后书写; 了解联苯的编号与命名; 了解萘的编号和α 位β位; 练习题 8.1 8.2
①
② •
傅克反应的局限性: 傅克反应是一个亲电取代反应,凡是苯环上连有硝基-NO2、 磺酸基-SO3H、氰基-CN或者羰基-CO-R等吸电子基团,将直 接降低苯环电子云密度而导致傅克反应不能发生; 傅克烷基化反应经过碳正离子中间体,碳正离子重排严重,常 使引入苯环的烷基不是以前的烷基; 克服碳正离子重排方法是酰化后再经克莱门森还原为烷基。
练习题 8.9 练习题 8.10
2.芳烃的化学反应
第 八 章 芳 烃
苯的加成和氧化反应 苯环相比烯烃,加成条件非常特殊。
H , N i 2 4 0 0 ~ 5 0 0 C
C l C l C l C l C l C l
C l 2 u l t r a v i o l e t
氧化反应:
O , V O 2 2 5 4 0 0 ~ 5 0 0 C
O O H S O
苯与浓硫酸或发烟硫酸(SO3与硫酸的混合物)反应,可在苯 环上引入磺酸基而生成苯磺酸。 磺化反应是可逆反应,即苯磺酸与稀酸一起加热可返回苯与硫 酸;
有机化学第08章 芳香烃(共201张PPT)

再比较 4式和5式
4
催化 剂
+ H2 压 力, 溶剂
112.3KJ mol-1
5
催 化剂
+ H2
压力 ,溶 剂
按上面的计算和结论,5 式若为共轭三烯结构,当加一 分子氢时,氢化热应为-112.3-(-7.2) = -105.1 KJ mol -1。
催化剂
+ H2 压力,溶剂
(Z)
H?
(Z)
- 105.1 KJ mol -1
4 苯具有特殊的稳定性---从氢化热数据看苯的内能。
环己烯 环己二烯
环己三烯
苯
氢化热(kJ / mol) 119.5 (测定)
231.8 (测定)
119.53=358.5 208.5 (根据假设计算) (测定)
每个C=C的平均氢化热 119.5
115.9
119.5
69.5
(kJ / mol)
从整体看: 苯比环己三烯的能量低 苯比环己二烯的能量低
119.5 KJ mol-1
3
催化 剂
+ 2H2 压力,溶剂
231.8 KJ mol-1
4
催化 剂
+ H2 压力,溶剂
112.3KJ mol-1
(Z)
5.
催化剂
+ H2 压力,溶剂
H?
(Z)
6. CH2=CH-CH=CH-CH=CH2 + 3 H2 CH3(CH2)4CH3 -337 KJ mol-1
反键轨道
E 成键轨道
共振论
Ⅰ
Ⅱ
贡献大
键长,键角完全 相等的等价结构
Ⅲ
Ⅳ
Ⅴ
贡献小
键长、键角不等 的不等价结构
化学竞赛辅导ppt资料

5.欲鉴别澄清石灰水、盐酸和蒸馏水三瓶失去标
签的无色液体,提供的试剂有:①碳酸钠溶液 ②
紫色石蕊试液 ③无色酚酞试液,只用一种试剂可
将它们鉴别出来的是( ) D
A.只有①
B.只有②
C.①或②
D.①或②或③
第五页,编辑于星期五:十四点 分。
6.若按粗盐提纯的实验步骤对下列各组物质进
行分离,可以达到目的的是( )CD A.从空气中分离出氧气 B.将混入硝酸钾中少量的氯化钠除去
C.从草木灰中提取碳酸钾 D.从氯酸钾制取氧气的残渣中,回收二氧化锰和 氯化钾
第六页,编辑于星期五:十四点 分。
7.下列各组稀溶液中,利用组内物质的相互反 应,就能将各种物质鉴别出来的是( C ) A.Na2CO3、H2SO4、HCl、KNO3 B.CuSO4、KOH、NaCl、NaOH C.Na2SO4、Na2CO3、BaCl2、HNO3 D.NaNO3、MgCl2、KCl、Ba(OH)2
第七页,编辑于星期五:十四点 分。
8.下列各组物质的溶液,不另加任何试剂就能将 它们区别开来的是( )AC
A.CuSO4 HCI NaOH B.KNO3 MgCl2 NaOH
C.Na2CO3 HCl BaCl2
D.NaCl AgNO3 HCl
第八页,编辑于星期五:十四点 分。
9.除去下列物质中的杂质所用的试剂和方法不正
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
第二页,编辑于星期五:十四点 分。
2.下表是小江同学用多种方法来鉴别物质的情
况,其中完全正确的是 ( ) C 产生白色沉淀,不溶于HNO3
现有一液体推进剂以醇(含碳52%,含氢13%,含氧35%)为燃料,质量分数为90%的H2O2做氧化剂,欲使1Kg该醇燃料完全燃烧,计算 需消耗质量分数为90%的H2O2的质量。
《有机化学竞赛》课件

化学简介有机化学基础知识有机化学反应机理有机合成与分离技术有机化学竞赛题目解析
01
CHAPTER
有机化学简介
有机化学的发展经历了从天然有机化合物的认识和利用,到人工合成有机化合物的探索和实践,再到现代高分子材料和绿色合成方法的创新和应用。
总结词
有机化学的发展始于对天然有机化合物的认识和利用,如动植物体内的化合物。后来,随着科学技术的进步,人们开始探索人工合成有机化合物的方法,如塑料、合成纤维等高分子材料的发明和应用。现代有机化学则更加注重绿色合成方法的发展和创新,旨在实现可持续发展的目标。
酚在常温下与氧气反应,可以生成醌、苯甲酸等含氧有机物。
酚的氧化反应
醚在酸性催化剂作用下加热,可以发生分解反应,生成醇和烷基卤化物。
醚的分解反应
醛在常温下与氧气反应,可以生成羧酸。
醛的氧化反应
酮在常温下与氧气反应,可以生成羧酸。
酮的氧化反应
羧酸与醇在浓硫酸作用下加热,可以发生酯化反应,生成酯和水。
羧酸的酯化反应
04
CHAPTER
有机合成与分离技术
通过目标化合物的结构,分析其合成所需的原料和反应,从而设计合理的合成路线。
逆合成分析
根据目标化合物的结构特点和合成要求,选择合适的反应类型和条件,以达到最佳的合成效果。
合成策略
蒸馏法
利用不同物质沸点的差异,通过加热和冷凝的方法将它们分离。
结晶法
通过降低温度或蒸发溶剂,使目标化合物从溶液中析出。
VS
考查知识广度和深度
综合题是有机化学竞赛中难度最大的题目类型,要求学生在掌握扎实基础知识的同时,具备广泛的知识面和深入的学术探究能力。这类题目通常涉及多个有机化学知识点,并要求学生对前沿研究有所了解。
01
CHAPTER
有机化学简介
有机化学的发展经历了从天然有机化合物的认识和利用,到人工合成有机化合物的探索和实践,再到现代高分子材料和绿色合成方法的创新和应用。
总结词
有机化学的发展始于对天然有机化合物的认识和利用,如动植物体内的化合物。后来,随着科学技术的进步,人们开始探索人工合成有机化合物的方法,如塑料、合成纤维等高分子材料的发明和应用。现代有机化学则更加注重绿色合成方法的发展和创新,旨在实现可持续发展的目标。
酚在常温下与氧气反应,可以生成醌、苯甲酸等含氧有机物。
酚的氧化反应
醚在酸性催化剂作用下加热,可以发生分解反应,生成醇和烷基卤化物。
醚的分解反应
醛在常温下与氧气反应,可以生成羧酸。
醛的氧化反应
酮在常温下与氧气反应,可以生成羧酸。
酮的氧化反应
羧酸与醇在浓硫酸作用下加热,可以发生酯化反应,生成酯和水。
羧酸的酯化反应
04
CHAPTER
有机合成与分离技术
通过目标化合物的结构,分析其合成所需的原料和反应,从而设计合理的合成路线。
逆合成分析
根据目标化合物的结构特点和合成要求,选择合适的反应类型和条件,以达到最佳的合成效果。
合成策略
蒸馏法
利用不同物质沸点的差异,通过加热和冷凝的方法将它们分离。
结晶法
通过降低温度或蒸发溶剂,使目标化合物从溶液中析出。
VS
考查知识广度和深度
综合题是有机化学竞赛中难度最大的题目类型,要求学生在掌握扎实基础知识的同时,具备广泛的知识面和深入的学术探究能力。这类题目通常涉及多个有机化学知识点,并要求学生对前沿研究有所了解。
安徽高中化学竞赛有机化学第8章 芳香烃(共79页PPT)(共79张PPT)

E
+ E+
+H
+
H
E
44
B 下列反应中一般认为无重排的是( )
A. Friedel-Crafts烃化反应
B. Friedel-Crafts酰化反应
C.烯烃与HBr的加成
D. 醇与NaBr/H2SO4的反应
下列芳香烃亲电取代反应的活性顺序是( B )
10
X
取代
加成
X
氧化
11
8.2 苯衍生物的异构、命名和物理性质
1. 苯衍生物的异构、命名
异构: 侧链长短、取代基在苯环上的相对位置
命名:(1)侧链R简单:一般以苯环为母体,R作取代基 ,“某烃基苯” (2)侧链R较复杂或含有不饱和键,一般以苯环 作取代基 (3)二元取代:邻(o)、间( m )、对( p ) (4)侧链不为烃类时,要选母体
*2 反应式 :
O
+ R C Cl
催化剂
芳香化合物 酰基化试剂
O
CR + HCl
36
讨论
催 化 剂: 路易斯酸(最常用的是AlCl3) 芳香化合物: 活性低于卤代苯的芳香化合物不能发生酰基化反应。 酰基化试剂: 酰卤和酸酐(用酰卤时,催化剂用量要大于1mol。
用酸酐时,催化剂用量要大于2mol。 Why?)
醇、烯、环氧化合物可做烷基化试剂。 质子酸催化(速率快,催化量) 路易斯酸作催化剂(速率快, 大于1摩尔,Why?)
28
*3 反应机理 RCl + AlCl3
[ RCl• AlCl3] 络合物
R+ + AlCl4-
H
+ R+
+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Z
Z
Z
Z
X
X
由于Z与叁键碳原子的相对位置不同,亲核试剂进攻叁 键碳原子,将分别得到两种碳负离子中间体,相对比例取 决于取代基的性质——加成的方向主要依赖于Z的诱导效应, 亲核试剂与苯炔生成的碳负离子越稳定则越容易生成。
值得指出的是,此处只需要考虑取代基的诱导效应, 因为在苯炔与亲核试剂加成后生成的苯基碳负离子中,负
电荷处于sp2杂化轨道中,该轨道与苯环共平面,不可能 与取代基的孤对电子发生p-π共轭。p-π共轭效应不影响苯
基碳负离子的稳定性。
sp2杂化轨道
:
OCH3 -I
所以,像甲氧基、氨基等带有孤对电子的取代基,只 需考虑其电负性比碳原子的大,具有吸电子诱导效应即可。
:
邻位取代卤代苯
Z X
Z
Z
NH2
(I)
Cl
溴苯和氯苯都能与金属锂反应得到苯基锂。
Cl
Li
+ 2 Li Et2O
+ LiCl
练习:
1.
Cl
CH 3
Mg(过量)
干 Et2O
Br
DCl
Cl
CH 3 D
CH 3
CH 2CN
2.
Cl 2 hv CN
Br I
Br I
§8.11 休克尔规则和非苯系芳烃
一 休克尔规则
一百多年前凯库勒就预见到,除苯外,可能存在其他 具有芳香性的环状共轭多烯烃。自然而然,与苯相邻的两 个类似物——环丁二烯和环辛四烯就成了研究的目标。但 结果证明,环丁二烯和环辛四烯具有烯烃的典型性质(譬 如容易发生亲电加成反应),而没有芳烃的特征性质—— 芳香性。为了解决这个问题化学家们作了许多努力,但用 共价键理论没有很好的解决。
Cl Cl
O2N
NO2
H3C
CH3 Cl
+ 2 NH3
O2N
NH2 NO2 + NH4Cl
NO2
NO2 OC6H5
+
C6H5NH2
NO2 NO2
NHC6H5 +
HOC6H5
O2N
O2N
(2) 卤代芳烃与NaNH2液氨的——芳环上亲核取代反应 苯炔机理,消去—加成机理
虽然通常卤代芳烃对一般的亲核试剂表现惰性,但对既
下列化合物已被合成,并可以作为具有芳香性的二电 子体系的代表。
R
R
++
R
R
R=CH3 或 C6H5
3 环戊二烯负离子
环戊二烯本身不具有环状共轭体系,没有芳香性。如 果在环戊二烯分子中脱去一个质子,形成环戊二烯负离子, 其中有6个π电子,符合Hückel规则,具有芳香性。这使
得环戊二烯中亚甲基上的氢原子具有较高的酸性(pKa =
位阻较大
NH3 NaNH2
OCH3 NH2
2 与金属的反应
溴代芳烃与金属镁在乙醚 溶液中就能生成格氏试剂, 而氯苯与镁要在THF中进行 反应才能制得格氏试剂。
Br + Mg Et2O
Cl THF
+ Mg
MgBr MgCl
间氯溴苯在乙醚中与金属镁反应只生成苯基溴化镁:
Br
MgBr
+ Mg Et2O
Cl
(3) NO2与苯环不能有效地共轭(空阻),则NO2失去活化作用。 (4) 离去基团不仅限于卤原子,其他的一些离去基团也可以。
(5) 亲核试剂不仅限于OH-,其他亲核试剂也容易反应。 例如氨基,烷氧基。
H3C
NO2 CH3
两个甲基的空间位阻,使
H3C
NO2 CH3
NO2与苯环不能有效地共轭(空 阻),则NO2失去活化作用
I NaNH2, NH3 — HI
O
O
NH3
NH2
三蝶烯
苯炔中的三键与乙炔的不同,苯炔中的叁键碳原子仍
为sp2杂化,三键的形成基本不影响苯环中π体系,苯环的 稳定性保持不变,而新的“π键”是由两个sp2杂化轨道在
环平面内侧面交盖,重叠程度很小而形成很弱的键,非常 不稳定。
sp2杂化轨道
H H
H H
生成3,4-苯炔。
生成苯炔后,亲核试剂进攻苯炔的位置将取决于所 生成的负碳离子的稳定性。
OCH3 NaNH2, NH3(l) ?
Br
空间因素也有一定影响,如氯苯的邻位衍生物,经生 成苯炔,虽然可以生成两种产物,但是实际上只得到一种 产物,空间阻碍的影响也有一定贡献。
OCH3 Cl NaNH2
OCH3
NH2
NH2−可能作为碱进攻氯的邻位氢,先失H+,再脱Cl− 。
Cl
Cl
* H NH2
*
* NH2
NH3
NH2 * +
* NH2
苯炔或叫去氢苯是苯环亲核取代反应中的重要活性中间体。
Cl CH3
—HCl
CH3
NH3
NH2 CH3
Cl —HCl
NH
3
NH2
CH3 Cl
—HCl
NH 3 NH3
CH3 NH2
m = 6, 10…… 4n+2, p电子刚好能够填满成键轨道,体系
能量最低,最稳定,有芳香性。
提出了一个判断体系芳香性的规则,称为休克尔规则。
按照休克尔规则,单环多烯烃要有芳香性,必须同时 满足二个条件:
(1)环状闭合共轭体系(成环原子共平面或接近于平面, 平面 扭转不大于0.1nm);
(2) 环上π电子数为4n+2(n = 0、1、2、3 ∙∙∙∙∙∙)。
是很强的碱又具有亲核性的试剂则表现明显的活性。
OCH3 Br
NH3, NaNH2 -33℃
OCH3 NH2
氨基在卤素原 来的位置上
OCH3 Cl
NH3, NaNH2 -33℃
OCH3 NH2
氨基在卤素 的邻位上
OCH3
OCH3
OCH3
NH3, NaNH2 -33℃
Br
+
NH2 50%
NH2 50%
两种类型产 物的混合物
NH2
+I
NH2
NH2
(IV)
+I
NH2
Z是吸电子基时(−I效应),I比II稳定而优先生成。
Z为给电子基时(+I效应),IV相对来说比较稳定而优先生成。
当卤原子的间位有取代基时,可以生成两种不同的苯炔:
当Z是吸电子基时,其
Z
邻位氢的酸性较强,容
Z
易消去,生成2,3-苯炔
Z
Z是给电子基时,
X
有利于除去对位氢,
-2
-2
-2
反键轨道
-1
-1.414
非键轨道
2
1 2
1.414 2
成键轨道
4
6
8
图 CxHx的分子轨道能级和基态电子填充状况
m = 3, 5, 7……,奇数个p电子,总有一个未成对的电子填 充到反键轨道上。
m = 4, 8, 12……(4n),m/2-1个成键轨道,还有两个p电子 会填充到能量高的非键轨道上,各占一个轨道,自旋 平行,使体系能量升高,不稳定,没有芳香性。
N+ OO
N+ OO
分步进行:
硝基通过共轭作用,使苯 环上的负电荷分散到O上
第一步是Nu-与底物的加成,生Meisenheimer络合物;
第二步是L带着一对电子离去,完成反应。
加成—消除机理,也称SNAr。
OEt
EtO
O2N
NO2 MeOK O2N
OMe NO2
OMe
EtOK O2N
NO2
ห้องสมุดไป่ตู้NO2
N+ K+ -O O-
与乙烯型卤代烃相似,卤代芳烃由于p-π共轭,比较稳
定,不容易发生亲核取代反应。对SN1反应,C—X键不易 断裂,且生成的苯基碳正离子很不稳定,SN1反应不易发生。
苯基碳正离子的结构
对于SN2反应,除C—X键不易断裂外,亲核试剂不易从 背面进攻,因此,SN2反应也不易发生。
Cl
OH
1. NaOH, H2O, 370℃
生成的取代物都是混合物。
Cl
NH2
CH3 NH3, NaNH2
CH3 + H2N
CH3
—HCl
Cl
NH2
NH3, NaNH2 —HCl
NH2 +
CH3 Cl
NH3, NaNH2
CH3
—HCl
CH3 NH2
CH3
+ CH3
NH2
H2N
+
CH3
CH3
I
CH3
CH3
CH3
Br CH3
CH3
CH3 Br
NO2 Cl
NaHCO3溶液 130℃
NO2 ONa H+
NO2 OH
O2N
NO2
Cl NaHCO3溶液 100℃ O2N
NO2 ONa H+
O2N
NO2 OH
反应速率与底物和亲核试剂的浓度成正比,可能是双分 子反应,与SN2反应相似,但与饱和碳原子的SN2不同。
机理 L
L Nu
Nu
+ Nu-
N+ OO
NO2
Meisenheimer络合物
1902年,Meisenheimer J分理出反应的中间产 物,并经单晶结构分析和1H NMR所证实。
注意: (1) NO2能活化它的邻、对位基团,中间体负电荷与硝基存在
共轭,使负电荷分散到硝基上,中间体稳定。
(2) NO2处于L间位时,中间体负电荷与硝基不存在共轭,负 电荷不能分散到硝基上,失去活化作用,则L不易被取代。
