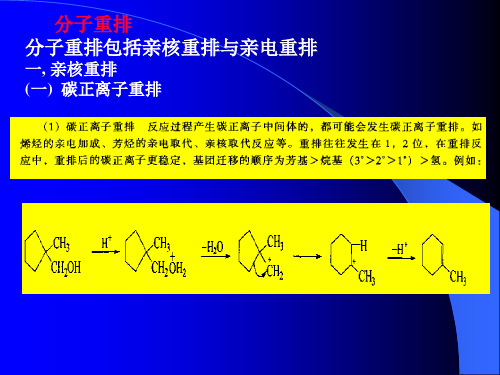
高等有机化学:第8章 分子重排
高等有机化学之重排反应

The sulfonium cation does the same
PhCOCH2 CH2Ph HOCH3
PhCOCH S CH3 CH2Ph rearrangement
Important industrial reaction for manufacturing phenol and acetone
CH3CH=CH2 anhydrous AlCl3 PhCH(CH3)2
PhCH(CH3)2
O2
Na2CO3/H2O 100℃
CH3 H+ PhOH Ph C OOH CH3
Radical rearrangement
Br
Br Cl Cl Br2 Cl C CH CH2Br Cl C CH CH2Br Cl Cl
II Nucleophilic Rearrangement
1 Wagner-Meerwein rearrangement ( Carbon cation rearrangement )
CH3 CH3 C CH2OH CH3 H
+
CH3
CH3 C CH2OH2 CH3
Cl
-
H2O
Cl C CH2CH3 CH3
CH3
CH3 C CH2 CH3
CH3
CH3 C CH2CH3 CH3
H+
CH3C=CHCH3 CH3
Cl
Cl
Cl
Cl
OH H+
+
+
CH3
CH3 CH3 C CHCH3 SN1 CH3 C CHCH3 CH3 Br CH3 CH3 C CHCH3 CH3 CH3
CH3 CH3 C C CH3 OH CH3
分子重排-亲核重排

重排反应
反应中原子或基团迁移使碳架的位置发生变化,称 为重排反应。
W A
*A-迁移起点原子
W B A B
W-迁移基团/原子
B-迁移终点原子
重排反应一般分为三步: 生成活性中间体;重排;生成消去和取代产物。
(碳正离子,碳烯,氮烯,碳负离子,自由基等)
根据反应机理中迁移终点原子上的电子多少,将重排反应分为:
O
KOBr&H2COOH
O C NH C O
KOBr + 2KOH
O COH NH2
缺电子重排(亲核重排)
-Curtius(库尔修斯)重排
缺电子重排(亲核重排)
-Schmidt重排
缺电子重排(亲核重排)
-Schmidt重排
§1.缺电子重排(亲核重排)
-Lossen重排
周环反应中的σ键迁移反应也是常见的重排反应。
环氧丙烷重排
缺电子重排(亲核重排)
机理 1.缺电子中心的创建
CH3CH2CH2CH2OH H
+
H CH3CH2CH2CH2OH2 H2O H3CH2CHC CH2
2. 迁移基团带着一对电子迁移到缺乏电子中心
H H3CH2CHC CH2 H3CH2C C CH3
3.要满足迁移始点外层8电子结构,一般与亲核试剂结合或 通过β-消除完成重排过程
H3CH2C C CH3 H
+
CH3-CH=CH-CH3
缺电子重排(亲核重排)
碳正离子重排
CH3
Cl C CH2CH3 CH3
CH3C=CHCH3 CH3
OCH3 Cl
迁移基团迁移顺序:
>
>
> R3C- > R2CH-
分子重排WORD

1 Pinacol-Pinacolone Rearrangement 重排当片呐醇类在稀H2SO4存在下加热脱水时发生特殊的分子内部的重排反应生成片呐酮。
如用盐酸、草酸、I2/CH3COOH、CH3COOH等脱水-转位剂以代替H2SO4可得相同的结局:反应机理反应的关键是生成碳正离子:反应实例2 Wagner-Meerwein 重排当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原子)时,在酸催化脱2 Wagner-Meerwein 重排当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原子)时,在酸催化脱水反应中,常常会发生重排反应,得到重排产物:反应机理反应实例3 Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4 Hofmann 重排(降解)酰胺用溴(或氯)在碱性条件下处理转变为少一个碳原子的伯胺反应机理反应实例5 Baeyer-Villiger 反应酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的机理:过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
高等有机化学:第8章 分子重排

18
19
8.1.2 碳正离子1,3-重排及其它多中心重排
R C R' CC
R R R'
R C R' CC R R R'
20
8.1.2 碳正离子1,3-重排及其它多中心重排
+
k1,2
H H
H k2,3 较难
3
6
+ 12
H
k2,3
+ H
1,3-重排
k6,2 +
k1,2 > k6,2 > k2,3
21
28
8.3 Baeyer-Villiger氧化
Mechanism
亲核 迁移
烷基迁移次序:3 > 2 > Ph > 1 > Me 29
O mCPBA Me
氧原子进入位置:
Me O
C2H5 Me O
O Me
O
Me O
30
Examples
O C CH3
PhCO3H
O O C CH3
CH2
(CH2)n
twistedohchhoendoexo18clhfsbfclftetrahedralcarbonnmr688ppmphenoniumionolahjacs19769867841920812碳正离子13重排及其它多中心重排21812碳正离子13重排及其它多中心重排13重排23较难2223813原菠烷正离子norbonylcation重排和萜类衍生物重排wagnermeerwein重排clchiral经典的双环221庚正离子chiraloacacooac5050orbitalpicturenorbonylcation25analogouslyotshoacachiral非手性chiral手性15183classicalnonclassical2682向缺电子的no的重排ohha可合成nmr可观察到位于羟基反位的基团发生迁移迁移基团立体化学保持不变2728其它向缺电子的no的重排hofmann重排hofmanndegradationcurtius重排wolffarndteistert重排schmidt重排lossen重排2983baeyervilliger氧化烷基迁移次序
《分子重排反应》课件

III. 分子重排反应的机理
• 分子重排反应的机理涉及分子内、分子间的结构变化以及化学键的重组。 • 这类反应通常包括断裂原始键、形成新的共价键、转移原子或基团等
步骤。 • 具体反应机理的理解对于控制反应路径和提高反应效率至关重要。
IV. 分子重排反应的影响因素
1 1. 温度
温度对分子重排反应速率和选择性起着重要 作用,通常较高的温度会促进分子重排反应 的进行。
II. 分子重排反应的分类
1. 根据反应类型
分子重排反应可以根据不同 的反应类型进行分类,如醇 酯互变异构、氧杂环化、羰 基互变异构等。
2. 根据反应条件
分子重排反应也可以根据不 同的反应条件进行分类,如 酸催化、碱催化、高温条件 下发生的分子重排反应等。
3. 根据反应底物
分子重排反应还可以根据不 同的反应底物进行分类,如 环状化合物的分子重排反应、 链状化合物的分子重排反应 等。
VII. 分子重排反应与有机合成的关系
分子重排反应是有机合成中的重要环节,可以用于构建复杂分子结构和控制化学反应的选择性。
2
2. 药物合成
分子重排反应在药物合成中发挥着重要作用,可用于合成药物前体和改进药物性 能。
3
3. 新型材料制备
分子重排反应可用于制备新型材料,例如高分子材料、金属配合物等。
VI. 分子重排反应的实验方法
为了研究和实施分子重排反应,可以使用各种实验方法,如核磁共振(NMR)、质谱(MS)和红外光谱(IR) 等。
2 2. 反应物浓度
反应物浓度越高,分子重排反应的速率通常 会增加。
3 3. 催化剂
催化剂可以显著提高分子重排反应的速率, 并且可以排反应的进行和产物 选择性有重要影响。
[理学]第八章 分子重排反应
![[理学]第八章 分子重排反应](https://img.taocdn.com/s3/m/3ddd9aeeda38376baf1faeda.png)
4、Schmidt重排
羧酸、醛、酮等与叠氮酸在强酸作用下重排生成伯 胺及酰胺的反应称为施密特(Schmidt)重排。
RCOOH + HN3 H2SO4 R NH2 + N2 + CO2
酮的Schmidt重排实际生成取代酰胺。
O R C R + HN3 O H2SO4 R C NH R + N2
如:
3、片呐醇(Pinacol)重排
当用无机酸及其酰氯等处理邻二叔醇时发生的重排 称为片呐醇重排,重排的产物称片呐酮。
R2 R3 R C
1
C R
4
H2SO4
R2 R1 C C R3 O R4
CH3 C6H5 C C CH3 C6H5 O
OH OH
CH3 CH3 C6H5 C C C6H5 OH OH
H2SO4
(2) 通过重排转变成稳定的中性化合物。
R 2C CR2 H 片呐醇重排 R 3C C R O
OH OH
(3)重排后减少空间张力。
CH3 CH3 C CH2 CH3
张力大
CH3
C CH2CH3 CH3
张力小
又如蒎烯重排生成菠基氯也是张力减小的过程。
Cl
HCl 蒎烯
菠基氯(氯化莰)
形成缺电子体系主要有下面四种方法: (a) 碳正离子 的形成,(b) 氮烯的生成,(c) 碳烯的形成,(d) 缺电 子氧原子的形成。其中以形成碳正离子与氮烯的两 种方法最为重要。
R NH2 + CO2
在酰胺分子中可以转移的只有一种烃基,烃基的性 质可影响转移的速度。给电子的烃基反应速度高, 吸电子的烃基反应速度低。而且具有手性碳原子的 R转移时并不消失其光学活性,保持了原构型。
分子重排

(CH3)2C C(CH3)2 + H+
O
HCN
HO
CN
H
HO
CH2NH2
NaNO2
HO
CH2
重排
+
O
5
二、重排到缺电子的氮原子 1.贝克曼重排 . 醛肟或酮肟在酸作用下重排为酰胺。 醛肟或酮肟在酸作用下重排为酰胺。
6
和羟基处于反式的集团迁移
7
2.霍夫曼重排 .
迁移集团手性保持
8
三、重排到缺电子的氧原子 1.过氧化氢烃的重排 .
分子重排
重排到C 重排到C
亲核重排
重排到O 重排到O 重排到N 重排到N
亲电重排 自由基重排 芳香胺重排 其他重排
1
一、重排到缺电子的碳原子
M C C
+
M
C
+
C
1.1-丙基阳离子的重排 . 丙基阳离子的重排
NaNO2 HCl
& CH3-CH-CH2
+
CH3-CH2-CH2 N
9
2.拜尔-维立格(Baeyer-Villiger)重排 .拜尔 维立格 维立格( )
基团亲核能力强者迁移
10
三. 连苯胺重排
11
+
N
- N2
CH3-CH-CH3
2
2.片呐醇重排 .
R2 R1 C R3 C R4
OH OH
(1)能生成更稳定的碳正离子的羟基优先离去。 )能生成更稳定的碳正离子的羟基优先离去。 (2)迁移倾向大的基团优先迁移。 )迁移倾向大的基团优先迁移。 基团的迁移倾向: 基团的迁移倾向:芳基 > 烷基
3
4
分子重排反应

Me Me Me MeOH
H2SO4
Me Me
Me Me
Me Me Me CH2Cl
AgNO3
ONO2 Me CH2CH3 + Me
Me Me
Me H
4
7.2.2 频哪醇(Pinacol)重排
Me Me H2SO4 Me C C Me OH OH Me Me C C Me Me O
O OH
OH Br Br + t-Bu AlCl3 Br
OH Br +
t-Bu
2
7.1.2 按反应历程分类 根据迁移基团的亲核、亲电或是自由基的性质可将重排反应分为 亲核重排、亲电重排和自由基重排。 亲核重排是迁移基团带着一对电子迁移到缺电子的迁移终点。 亲电重排是迁移基团不带电子向富电子的迁移终点转移。 自由基重排是带着一个电子的迁移。
O Ag+ R CHN2 H2O R
Wolff Rearrangement
O OH
O
Hofmann Rearrangement
Br2, NaOH NH2
R
RNH2
迁移基团如果是手性的,迁移前后其构型保持不变。
6
7.3 亲电重排
Favorskii 重排:α - 卤代酮在碱作用下重排得到羧酸盐或羧酸酯。
哪一个羟基质子化离去,取决于碳正离子的稳定性; 通常能提供电子,稳定正电荷较多的基团优先迁移。
Ph Ph C OH
Me Ph C OH
H H2SO4 C H OH
Me H2SO4 C Ph OH
Ph Ph C C H H O
Me Ph C C Me Ph O
分子重排
HO
CH3COO
O
+
CH3
HO O
+
HO CH3 O CH3
H
+
O O CH3
(四)碳烯的重排 (1)Wolf重排的定义 (2)应用Wolf重排如果是水解可以合成高一级羧酸;如果是醇解可以 合成高一级酯
O R C Cl + CH2N2 O R C CH
H2O
O R C CHN2 O N
+
N
N2
Ag2O
+
R C OO H
O CH3 ph
H+
C O
Ph
O
C
CH3
(3)开链酮氧化成一般酯,环酮氧化生成内酯
O O RCOOOH
HO
O
O
C R
H+
OH
HO
O
H
+
O
+
+
C O
C O
(4)基团亲核性愈大,迁移的倾向性愈大,迁移顺序为: 苯基 >叔烃基>仲烃基>伯烃基>甲基 氢过氧化物的重排 苯基 >叔烃基>仲烃基>伯烃基>甲基
二,芳环上的重排 1 联苯胺重排 联苯胺重排是指氢化偶氮苯重排为联苯胺类的反应
2 H+ +
NH
NH
NH H
+ NH H
NH H
NH H
H
2 H+
NH2
+
NH2
+
H NH2
+
H H
NH2
+
H2N
NH2
[理学]第八章 分子重排反应
![[理学]第八章 分子重排反应](https://img.taocdn.com/s3/m/3ddd9aeeda38376baf1faeda.png)
3、片呐醇(Pinacol)重排
当用无机酸及其酰氯等处理邻二叔醇时发生的重排 称为片呐醇重排,重排的产物称片呐酮。
R2 R3 R C
1
C R
4
H2SO4
R2 R1 C C R3 O R4
CH3 C6H5 C C CH3 C6H5 O
OH OH
CH3 CH3 C6H5 C C C6H5 OH OH
H2SO4
4、Schmidt重排
羧酸、醛、酮等与叠氮酸在强酸作用下重排生成伯 胺及酰胺的反应称为施密特(Schmidt)重排。
RCOOH + HN3 H2SO4 R NH2 + N2 + CO2
酮的Schmidt重排实际生成取代酰胺。
O R C R + HN3 O H2SO4 R C NH R + N2
如:
丁二酰亚胺也可以发生Hofmann重排,生成氨基丙 酸。
O CH2 CH2 C C NH O KOBr + 2KOH CH2NH2 CH2COOH
3、Curtius重排
柯提斯(Curtius)重排是指酰基叠氮化物在加热时 重排为异氰酸酯的反应。反应中失N2生成乃春中间 体。迁移基团可以为各种烃基、杂环基及含各种官 能团的,反应可以用质子酸催化,但不用催化剂, 仅加热就可以得到好产率。酰基叠氮化物一般由酰 氯与叠氮化钠作用得到。
Et n-Bu C Me H N OH O C Me Et n-Bu NH H
95% H2SO4
2、Hofmann重排( Hofmann降级) Hofmann重排指氮原子上没有取代的酰胺在碱性介 质中与卤素作用重排为异氰酸酯,后者在碱性介质 中继续水解生成伯胺和二氧化碳的反应。
分子重排

反应机理: Claisen 重排是个协同反应,中间经过一个环状过渡 态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由 酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重 排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基 占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对 位,然后经互变异构得到对位烯丙基酚。
亲核重排反应
重排过程,Z带着一对电子从原子C迁移到另一个缺 少一对电子的原子A上。 多数亲核重排是1,2-重排,即 基团的迁移发生于相邻的两个原子间。上式中,A为 C、N、O等原子,而Z为X、O、S、N、C、H等原子。 重排后的分子与反应体系的负性部分结合生成重排取代 产物或失去质子生成重排消除产物。
值得注意的是游离基重排的限度比碳正离子小 的多。在上述实例中只有50%转移。再就是这里没 有甲基转移,一般在常温情况下不发生甲基的游离基 转移.除芳基以外,乙烯基和乙酰氧基、卤素也能转 移。迁移基团的重排动力是形成更稳定的游离基,但 在常温条件下,一般不发生烷基或很少发生氢的迁 移.这是因为芳基的1,2迁移形成一个离域的桥式芳 基游离型中间体或过渡状态,他比烷基迁移通过五价 碳结构在能量上更为有利。尽管甲基迁移可产生更 为稳定的游离基.
烷基芳基酮重排时,一般是芳基进行迁移,如:
Lossen(洛森)重排
异羟肟酸或其酰基衍生物单独加热,或在SOCl2 、 P2O5 等脱水剂存在下加热,发生重排得到异氰酸酯,再经水解生 成伯胺.
反应机理(当R是手性碳原子时,重排后其构型保持不变 ):
反应实例:
Beckmann(贝克曼)重排
《有机化学重排反应》课件

THANKS
感谢观看
详细描述
重排反应通常涉及分子内部的重排,包括电子、质子和原子的重新排列,这种 重排可以发生在分子内或分子间,并伴随着键的断裂和形成。重排反应通常伴 随着键能的变化,需要一定的活化能来启动反应。
重排反应的重要性
总结词
重排反应在有机化学中具有重要的意义,它涉及到许多有机化合物的合成、转化和降解过程。
详细描述
重排反应的动力学与热力学
动力学研究
分析重排反应的动力学特征,如反应 速率常数、活化能等,以及如何影响 反应进程。
热力学研究
探讨重排反应的热力学性质,如反应 熵变、焓变等,以及与反应条件的关 系。
重排反应的历程与过渡态
历程研究
揭示重排反应的具体步骤和中间体,以及各 步骤之间的相互转化。
过渡态研究
分析重排反应过程中的过渡态结构,以及如 何影响反应活化能和产物形成。
贝克重排反应是一种有机化学反应,涉及环丙烷环系的重排过程。在反应中,环丙烷环系通过加热或 其他能量源的激发,发生重排,生成新的化合物。
沃尔夫-凯惜纳重排反应
总结词
涉及芳香族化合物的重排反应
详细描述
沃尔夫-凯惜纳重排反应是一种有机化学反应,涉及芳香族化 合物的重排过程。在反应中,芳香族化合物通过加热或其他 能量源的激发,发生重排,生成新的化合物。
计算化学的应用
利用计算化学方法预测和优化 重排反应的途径和产物,提高
反应效率。
06
参考文献
参考文献
《有机化学重排反应》第二版,作者
01
XXX,出版社:XXX。
《有机化学重排反应》第三版,作者
02
XXX,出版社:XXX。
"有机化学重排反应研究进展",作者
有机化学基础知识点整理有机分子的重排反应和空间取向

有机化学基础知识点整理有机分子的重排反应和空间取向有机分子的重排反应和空间取向在有机化学中,有机分子的结构和反应机制是学习的重要内容,其中包括了有机分子的重排反应和空间取向。
在这篇文章中,我们将对有机化学的基础知识点进行整理和探讨。
一、有机分子的重排反应有机分子的重排反应是指原子或官能团在分子内的重新排列,使得分子结构发生变化的反应。
它可以通过热力学控制以及催化剂的作用来实现。
有机分子的重排反应包括:1. 重排异构化反应;2. 化合物的重排;3. 环外迁移反应等。
1. 重排异构化反应重排异构化反应是指在分子结构中,原子或官能团的重新排列,产生异构体的反应。
例如,环庚烷和环庚烯之间的变异反应,通过热力学控制和酸催化剂的作用,可以将环庚烷转化为环庚烯。
2. 化合物的重排化合物的重排是指由于不稳定中间体的生成,导致化合物的结构变化。
此类反应常见于芳香性化合物的重排。
例如,苯与亲电试剂之间的取代反应,可能会在生成芳香性化合物的过程中发生重排反应。
3. 环外迁移反应环外迁移反应是指分子内的一个原子或官能团在分子内的迁移,从而导致分子结构的重排。
例如,烷基醇与硫酸反应生成烷基磺酸酯的过程中,烷基的迁移就是一种环外迁移反应。
二、有机分子的空间取向有机分子的空间取向是指分子在空间中的排布方式,通常由立体化学和空间位阻来确定。
有机分子中的空间位阻可以影响化学反应的速率和产物的选择性。
在有机化学中,空间位阻通常由手性分子引起。
1. 手性分子的空间取向手性分子是指分子中存在非对称碳原子或手性中心,具有左右对称关系,导致分子在空间中呈现不对称结构的分子。
手性分子的空间取向可以影响化学反应的产物选择性。
例如,在费洛环合成中,手性反应物的配置决定了产物的空间取向。
2. 空间位阻的影响空间位阻是指分子结构中的部分原子或官能团对其他原子或官能团的运动限制。
空间位阻的存在可以阻碍分子的重排反应或者催化反应。
例如,双取代苯基衍生物的取代反应中,季碳中的空间位阻可以影响置换基团的位置。
4.分子重排

二、分子重排反应历程的研究方法
• 重排反应历程的研究是很复杂的, 重排反应历程的研究是很复杂的 , 凡是 能够影响反应历程的各种因素, 能够影响反应历程的各种因素,如反应物的 性质、试剂的性质、溶剂的极性、温度、 性质、试剂的性质、溶剂的极性、温度、催 化剂等都应考虑。 化剂等都应考虑。研究上经常采用中间体的 分离及鉴定法、交叉实验法、示踪原子法、 分离及鉴定法、交叉实验法、示踪原子法、 立体化学研究及动力学研究等方法, 立体化学研究及动力学研究等方法,下面介 绍三种方法。 绍三种方法。
• 。
CH 3 H 3C C CH 2 CH 3
H 3C C CH 2CH 3 CH 3
• 又如α-蒎烯重排生成菠基氯(氯化莰)也是 又如α 蒎烯重排生成菠基氯(氯化莰) 张力减小的过程。 张力减小的过程。
HCl
Cl
• • • • • •
形成缺电子体系主要有下面四种方法: 形成缺电子体系主要有下面四种方法: 碳正离子的形成。 (a)碳正离子的形成。 氮烯的生成。 (b)氮烯的生成。 碳烯的形成。 (c)碳烯的形成。 缺电子氧原子的形成。 (d)缺电子氧原子的形成。 其中以形成碳正离子与氮烯的两种方法 最为重要。 最为重要。下面即根据生成缺电子中心的四 种方法、分别介绍碳正离子重排, 种方法、分别介绍碳正离子重排,缺电子氮 原子参加的重排、缺电子氧原子的重排、 原子参加的重排、缺电子氧原子的重排、碳 烯的重排等。 烯的重排等。
2
• (四)中间体的研究 • 重排反应中生成的中间体有的可以通过分 离、鉴定或捕捉来进行研究。 鉴定或捕捉来进行研究。 • 例如Beckmann Beckmann重排中生成的活性中间体可 例如Beckmann重排中生成的活性中间体可 加入试剂进行捕捉。 加入试剂进行捕捉。
分子重排

分子重排反应
X -X Y Y
当 R基 是 吸 引 电 子 基 时 反 应 速 度 加 快 ,
§1 反应机理及相关问题
在化学反应过程中,原子或官能
团从碳链的一个位置转移到另外一个
位置的过程称为分子重排。分子重排
前后化合物的分子结构发生了变化, 但是分子组成不一定有变化。
§1 反应机理及相关问题
4.联苯胺重排
联苯胺重排
H N H N H N H N
H
H
4.联苯胺重排
没有发现交叉产物,分子没有断裂成两 个离子,只发生分子内重排。
CH 3 NH H 3C NH H 3C H2 N CH 3 NH 2
Et NH NH
Et H2 N
Et
Et NH 2
CH 3 NH NH
Et
x
4.联苯胺重排
机理:
C C O
R
C H
OH OH
碳正离子重排机理
(1)形成碳正离子
R C OH R H C OH R
-
H C OH
H H 2O C OH 2
H C
C OH
碳正离子重排机理
(2)基团发生迁移
R C OH H C C OH H C R
碳正离子重排机理
(3)通过消除形成羰基
H C OH C R -H C O H C R
XCH 2 H -X H 2C H H H OH OH
H CH 2 X -X OH H CH 2 H H OH H
H
5.基团迁移的距离 多数情况下是1,2位迁移。 在特殊化学结构中可发生“远距离”迁移。
OT S Ph Ph
-
Ph
Ph
Ph Ph
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl
Cl
H
OH
Ph Ph
CH3 O
Ph H
CH3 AgBF4 O H Et2O
Ph
CH3
O Ph
Ph O
H
OH +
Ph > CH3 > Cl
Cl
Cl
H
OH
CH3
Ph
CH3 H
Ph AgBF4
CH3 Ph
Ph O
O H Et2O
Ph O
Ph O
H
OH +
R. Bach, J. Am. Chem. Soc. 1979, 101, 3118.
OH
OH 1,2-shift
1,3-shift OH
H O
H+
H O
OH
O
H H+
H
CHO
12
1,2-迁移的立体化学及能量需求 C-Z键及C-C键和空P轨道要共平面
Z β
R
R
+ α
The ideal relationship of the empty p orbital to the migrating group (Z) for a 1,2-shift
14
1,2-shift: stereochemistry
If X departs before Z begins to move, either retention or inversion can
occur at the migration terminus. If the lifetime of the carbocation is very short, retention will result if Z was gauche to the leaving group in the unreacted starting material and inversion will result if Z was anti
13
1,2-shift: stereochemistry
If Z begins to migrate before X has completely departed, the migration terminus C will be inverted. This is the situation most commonly encountered in solvolysis reactions that involve neighboring-group participation.
10
1,2-迁移: Tiffeneau-Demjanov rearrangement
i) HCN
O
or CH3NO2/NaOH HO
NH2
+ HO N N
ii) LAH
NaNO2 + HCl
HO + - N2
H O+
O - H+
11
Meinwald重排: 双环环氧化物经酸处理重排为醛
O H+
OH
第 8 章 分子重排
重排反应: 在反应中原子或基团迁移使分子的碳骨架发生变化
缺电子重排
缺电子碳(正碳离子)
(nucleophilic or anionotropic)
分
缺电子氮(氮烯)
类
富电子重排 (electrophilic or cationotropic)
芳香环上的重排
研究方法
化学动力学 示踪原子 交叉实验 中间体分离鉴定 立体化学等
Wagner-Meerwein Rearrangement, Pinacol Rearrangement, Friedel-Crafts Acylation and Alkylation, Bischler-Napieralski Reaction, Pictet-Spengler Reaction, Beckmann Rearrangement, Tiffaneau-Demjanov Rearrangement, Ferrier Rearrangement, Nazarov Cyclization, Pechmann Reaction, Prins Reaction, Ritter Reaction, Leuckhart-Wallach Reaction, Meyer-Schuster Rearrangement, Rupe Reaction
1
8.1 碳正离子的重排
形成碳正离子的主要途径 卤代烃与Lewis acid 作用
X + AlX3
醇的酸介质脱水
H+ OH
+ OH2
SN1反应
L
+ + AlX4-
+ + H2O
+
+ L-
双键的亲电加成
+ X+
X
2
Some named reactions which involve carbocation intermediates
3
DO YOU HAVE A CARBOCATION?
ALWAYS
STOP - LOOK - THINK
STOP
EVALUATE FOR A REARRANGEMENT
E
R
X
E
RG
ANE M
D
E
CAN YOU FORM A BETTER CARBOCATION ?
8.1.1 1,2-迁移(Wagner-Meerwein 重排)
Synthesis 2005, (15), 2562.
9
1,2-迁移: 示例
Br Br
MeLi, -70 。C
Cl
O NEt3, 120 。C
窗格烃合成
H2NNH2/KOH 160-190 。C
ห้องสมุดไป่ตู้
O
Li
PhS HO
SPh
p-TsOH.H2O
O
0 。C
C6H6, 80 。C
see JACS 1998, 120, 317-328.
基团迁移大致顺序:芳基 > 烷基 (3 > 2 >1 ) > H 5
6
1,2-迁移: 示例
Cascade of ring expansion (see Chem Ber. 1984, 117, 203; 1988, 121, 525.)
CH3 OH
Me OH
TsOH Me2C=O/H2O
R OH
8
1,2-迁移: 示例
HO R
R
O
O
O
Synthesis and Wagner–Meerwein Rearrangement of 9-(aHydroxyalkyl) xanthenes to 10-Substituted Dibenz[b,f]oxepins: Scope, Limitations and ab initio Calculations
R
SOCl2
+
Py.
RH N +
R Elimination involving five Wagner-Meerwein rearrangements
7
1,2-迁移: 示例
Total synthesis of (+)quadrone by A. B. Smith
Smith, A. B., III, Konopelski, J. P. J. Org. Chem. 1984, 49, 40944095.
