Negishi交叉偶联反应
碳碳键偶联人名反应

碳碳键偶联人名反应一、引言碳碳键偶联人名反应是有机化学中的一种重要反应,它可以将两个碳原子通过共价键连接起来。
该反应在有机合成中具有广泛的应用,可以用于构建复杂的分子结构,如天然产物和药物。
本文将介绍碳碳键偶联人名反应的基本概念、机理和实际应用。
二、基本概念碳碳键偶联人名反应是指通过催化剂促进两个烷基或芳香族基之间形成新的碳-碳键的化学反应。
这种反应可以在不同的条件下进行,如常温下或高温下,在溶液中或固体中。
常见的催化剂包括钯、铜、镍等金属催化剂,以及硼酸类和亚磷酸类配体。
三、机理1. 钯催化剂钯催化剂是最常用的催化剂之一,它可以促进烷基或芳香族基之间形成新的碳-碳键。
钯催化剂通常与亚磷酸配体或氧杂环丁烷配体一起使用,以增强其活性和选择性。
反应的机理包括以下几个步骤:(1)钯催化剂与亚磷酸配体或氧杂环丁烷配体形成活性物种;(2)活性物种与底物发生配位作用,形成中间体;(3)中间体发生还原消除,生成新的碳-碳键;(4)催化剂再次被氧化,回到起始状态。
2. 铜催化剂铜催化剂也可以促进烷基或芳香族基之间形成新的碳-碳键。
铜催化剂通常与二甲基亚磷酸钠或三甲基膦一起使用,以增强其活性和选择性。
反应的机理包括以下几个步骤:(1)铜催化剂与二甲基亚磷酸钠或三甲基膦形成活性物种;(2)活性物种与底物发生配位作用,形成中间体;(3)中间体发生还原消除,生成新的碳-碳键;(4)催化剂再次被氧化,回到起始状态。
四、实际应用碳碳键偶联人名反应在有机合成中具有广泛的应用,可以用于构建复杂的分子结构,如天然产物和药物。
以下是一些实际应用的例子:1. Suzuki偶联反应Suzuki偶联反应是一种常见的碳碳键偶联反应,它可以将芳香族卤化物与有机硼酸酯或有机硼酸盐在钯催化下发生交叉偶联反应,生成新的芳香族化合物。
该反应在药物合成中广泛应用。
2. Heck偶联反应Heck偶联反应是一种将芳香族或烷基卤化物与烯烃在钯催化下发生偶联反应的方法。
Negishi反应的研究及发展应用

Negishi反应的研究及发展应用摘要:近年来,Negishi 偶联反应已经成为有机合成化学和催化化学领域的热点,在天然产物、高分子材料、功能材料和液晶材料的合成及医药生产中得到了广泛应用。
在此,本文将综述Negishi偶联反应的研究.发展.应用。
关键词:Negishi反应研究发展应用research Progress and application in Negishi Cross-coupling ReactionsAbstract:in recent years,Negishi coupling reaction has become a hot spot in the field of organic synthesis and the catalysis。
and has been widely applied in natural products, high polymer materials, the synthesis of functional materials ,liquid crystal materials and medicine production. herein, t h e l a t e s t research o f t h e Negishi coupling reaction. development.and their applications are reviewed.Key words: Negishi coupling reaction, research, development application一.前言:Negishi 反应是2010年诺贝尔化学奖获得者日本科学家Ei-ichi Negishi(根岸英一,2010年诺贝尔奖得主)于1977年发现的,指的是钯催化下的不饱和有机锌试剂和芳基或乙基卤化物等进行的偶联反应。
如今,Negishi 反应在其本人与其他有机化学家的研究下已经广泛应用于天然产物的全合成中。
第11章-过渡金属有机配合物催化交叉偶联反应

PPh2
*
M NMe2
Br
Ph
MgCl
PPh2
* Me2N
M Br
Mg Cl-
Ph
PPh2
*
M
NMe2
C
Ph CH3
H
MgClBr
PPh2 Fe
C NMe2
H MeMຫໍສະໝຸດ BrBr+
CH3 CH
CH3
H C CH2PPh2 NMe2
Ni*
MgCl
+ Br
s-valphos NiCl2
Me H 83%ee
零价钯配合物,如Pd(PPh3)4。 后来,零价钯或二价钯与 单叔膦配体,如三叔丁基膦; 双齿叔膦配体,如dppe,dppf等; 多齿叔膦配体,如Tedicyp;
Tedicyp
P、N配体,如
水溶性P、N配体,如 氮杂环卡宾,如 甚至无配体二价钯,如Pd(OAc)2,PdCl2
催化活性物种还是零价钯
在镍、钯配合物催化下铝、锌、 锆有机化合物在Negishi 偶联反应中活性 都很低,加入ZnCl2等锌盐都可大大地缩 短反应时间,提高产率,见表11-3所示 。
表11-3 添加ZnCl2量对反应影响
RM + ZnX2
RZnX + MX
M=AlR'2; ZrCp2X
11.4.2 Negishi偶联反应底物
IV)格氏试剂以外的金属有机试剂
NC
Br + PhCH2ZnBr Ni(PPh3)4 NC
CH2Ph
MeO2C
Bu Br +
Ni(PPh3)4 MeO2C ZrCp2Cl
V)Ni 以外的金属(格氏试剂+过渡金属)
金属有机化学基础-过渡金属有机配合物催化的交叉偶联反应

Ph2P(CH2)nPPh2 n = 2, dppe; n = 3,dppp; n = 4, dppb
cis-dpen: dmpf:
13.1.2 Kumada偶联反应底物 卤代烃 R’-X:卤代芳烃 乙烯基卤代烃
R X + cat. M R' M' X = I, Br, Cl, OTf... M = Pd, Ni, Fe, Rh... M' = Mg (Kumada) B (Suzuki) Sn (Stille) Zn (Negishi) ... R R' + M'-X
交叉偶联反应的效率高、选择性好、反应条件温和,是 在过渡金属有机配合物催化下,非过渡金属有机化合物作为 有机合成试剂的典型代表,是现代有机合成新的有效手段。
1)对常规亲核取代反应惰性; 2)R’不含b-H,或难以发生b-H消除。
R'-X H X R' X
L2Ni
b-H消除
L2Ni RMgX
L2Ni L2Ni R' R
格氏试剂 RMgX:烷基格氏试剂 芳基格氏试剂
R'-R
13.1.3 Kumada偶联反应的选择性
1. 化学选择性 当使用烷基Grignard试剂进行偶联反应时,除了得到正常的偶联产物 外,还得到Grignard试剂的烷基异构化的副产物:
Pd(0)
R-R' + XSnR3
Negishi偶联反应:
R-X + aryl or vinyl halide
organozinc R'-ZnR
Pd(0)
第11章-过渡金属有机配合物催化交叉偶联反应

Cp2TiCl2 R'
O
CHOH
R'
Cp2TiCl2 H2O + (CH3)2CHMgBr
O
OH
R' CH OH
R'
(CH3)2CHOMgX
Cp2TiCl2
(CH3)2CHMgX
(CH3)2CHMgX
R'
Cp2Ti Cl
OCH R'
R' CO
R'
Cp2Ti H Cl
Cp2Ti Cl
CH3 CH
CH3
Kumada将这两个化学计量反应组合 起来并实现了催化循环
11.1.1 Kumada偶联反应催化剂 该反应的催化剂是零价镍有机配合物
11.1.2 Kumada偶联反应底物 卤代芳烃和烷基、芳基Grignard试剂是
Kumada偶联反应底物。
11.1.3 Kumada偶联反应的选择性
1. Kumada偶联反应的化学选择性
Ph L2Ni Cl +
MgCl
Ph L2Ni Cl +
MgCl
L2Ni Ph
Ph
CH2=CHCH3 H NiL2 Ph
CH2=CHCH3 + PhH
CH2CH2CH3 L2Ni Ph
PhCH2CH2CH3
2 . Kumada偶联反应中的立体化学
11.1.4 Kumada偶联反应机理
图11-1 Kumada偶联反应机理
12
Ph3Sb
13.2
5
(4-FC6H4)3P
0.60
13
dppe
0.33
6 (4-ClC6H4)3P
0.71
卤代芳烃的c-c键耦合反应

卤代芳烃的c-c键耦合反应
卤代芳烃的C-C键耦合反应是一种在有机合成中构建新的碳碳键的重要方法。
这类反应通常涉及到过渡金属催化,尤其是钯催化剂,在卤代芳烃或卤代烯烃与另一分子(如烯烃、炔烃、硼酸或有机锌试剂等)之间形成新的C-C键。
以下是几种常见的卤代芳烃C-C键耦合反应:
1. Heck反应:这是一种卤代芳烃或卤代烯烃与烯烃在碱和钯催化下生成取代烯烃的反应。
2. Suzuki偶联反应:在这个反应中,卤代芳烃与活化的硼酸在钯催化剂作用下发生偶联,生成联苯类化合物。
这个反应对水不敏感,可以容忍多种活性官能团存在,并且副产物无毒且易于除去,适合工业化生产。
3. Negishi偶联反应:这是卤代芳烃与有机锌试剂在钯催化剂作用下进行的偶联反应,适用于一些其他方法难以偶联的底物。
4. 亲电交叉偶联反应:这种反应可以在两个不同亲电试剂间发生,通常是在电化学条件下,通过阴极还原生成碳负离子,然后与另一亲电试剂发生偶联。
此外,在选择耦合反应时,需要考虑底物的活性、位阻效应以及电子效应。
一般来说,碘代和三氟甲磺酸盐的活性较高,溴代次之,氯代最低。
对于贫电子的卤代芳烃,可能需要过量使用以提高反应效果。
总的来说,这些耦合反应由于条件温和、效率高,已经成为有机合成中不可或缺的工具,广泛应用于药物合成、材料科学等领域。
交叉偶联反应

四川师范大学化学与材料科学学院
17
交叉偶联反应
The key is the choice of ligand ……
R1
P(t-Bu)3
Ar N N Ar
PR2
Adam, F. L.; Fu, G. C. Angew. Chem. Int. Ed. 2002, 41, 4176
Ph-X BDE:Cl: 96 kcal mol-1 F: 126 kcal mol-1 CN: 132 kcal mol-1
交叉偶联反应
交叉偶联反应
主讲人:向仕凯 博士、讲师
xiangsk@
四川师范大学化学与材料科学学院
1
Suzuki偶联反应高分子材料: 液晶性、导电性、 发光性等
交叉偶联反应
2007
四川师范大学化学与材料科学学院
3
交叉偶联反应
抗真菌药物、天然药物
Ambruticin (1) is a novel antifungal agent that was isolated from fermentation extracts
R R' Negishi偶联
HY R'
Sn R'
Y= N, O, S
R
Y R'
R R'
Buchwald-Hartwig偶联
Stille偶联
Si R'
R R' Hiyama偶联
Ar
I > Ar Br >> Ar Cl
Ar
X
MLn
M
Ar X
Ph-X BDE: I: 65 kcal mol-1 Br: 81 kcal mol-1 Cl: 96 kcal mol-1
11negishi交叉偶联反应(1)

Negishi, E.-i.; et al. Tetrohedron Lett. 1983, 24, 5181.
2004年,Knochel小组发展了一种新型的官能团化的二芳基锌试剂制备 方法,并运用于酰氯的Negishi偶联。
15 Kneisel, F.; Knochel, P. et al. Angew. Chem. Int. Ed. 2004, 43, 1017.
Negishi交叉偶联反应
发展历史
与Kumada偶联相比,有机锌试剂参与的Negishi偶联反应具有更好的 官能团兼容性,相比Al、Zr、B、Sn、Cu亲核试剂,活性最高,而且 大多数情况下无需其他添加剂。 有机锌试剂反应性次序:
R3ZnLi > R3ZnMgX > R2Zn > RZnX
Day)。此后,返回Teijin公司工作。1966年,成
为美国普渡大学(Purdue University)的博士后研
Prof. Ei-ichi Negishi (1935- )
究员(导师:Herbert C. Brown)。1972年成为 雪城大学(Syracuse University)助理教授,1976
1999年,Hermmann小组首次利用环钯化合物为催化剂,实现了氯苯 与苯基溴化锌的偶联。
ZnBr +
Cl palladacyle (2 mol%)
THF
88%
Herrmann, W. A.; et al.J. Organomet. Chem 1999, 576, 23.
5
Negishi交叉偶联反应
1
Negishi交叉偶联反应
反应通式
定义:指有机锌试剂与亲电试剂(通常为有机卤化物)在钯或 镍等过渡金属催化下发生的交叉偶联反应。 Negishi 交 叉 偶 联 反 应 由 美 国 普 渡 大 学 ( Purdue University ) 的 化 学 家 Ei-ichi Negishi ( 根 岸 英 一 ) 在 1977年发现的。
Negishi偶联

反应试剂
锌试剂可以通过多种方法来制备,一般是在反应过程中 原位生成使用。它对于多种官能团都是稳定的,并且反应 条件温和,选择性和产率高,唯一的不足是锌试剂对水敏 感 Zn试剂的制备有两种常用方式: ①金属Zn与X的氧化加成: ②金属交换反应:即从其他易得的金属试剂如Mg、Li、 Al 等出发,加入ZnX2而得:
反应试剂 • 根岸偶联反应(Negishi coupling): • 反应中,金属锌试剂与卤代烃在镍或钯的配合物的催化下发 生偶联,生成一根新的碳-碳键。通式如下:
• 其中: • 卤素X可以是氯、溴或碘,也可以是其它基团,如三氟甲磺 酰基或乙酰氧基,而基团R则可以是烯基、芳基、烯丙基、 炔基或炔丙基; • 卤素X'同样可以是氯、溴或碘,R'则可以是烯基、芳基、烯 丙基或者烷基; • 催化剂可以是镍或钯。
反应机理 反应中具催化活性的是零价金属(M0) 反应整体上经过了这三步: • ①卤代烃对金属的氧化加成 • ②金属转移 • ③还原消除
反应影响因素 • 卤化烃基锌与二烃基锌都可以作为反应物。 R-Zn-X':生产顺式的络合物,从而能很快地发生还原消除 后续步骤,生成产物。 R-Zn-R':生成反式的络合物,必须经过缓慢的顺反异构体 异构化过程。 • catalyst:palladium complex、Pd(0) or Pd(II) • The influence of other parameters such as the presence of copper salt, solvent, and base. • reaction temperature • reaction time
文献实例——② • 等采用PdCl2( PPh3)2 为催化剂,四氢呋喃(THF) 为溶剂, 在微波反应器中进行了Negishi 偶联反应,160 ℃下反应1 min, 得到了联苯类化合物,收率可达到90% 。 • 在环己基溴化锌参与的Negishi 偶联反应中,加入5(mol) %的 CuI,反应10 min,收率达到79 %。
交叉偶联反应的类型

交叉偶联反应的类型1.引言1.1 概述交叉偶联反应(Cross-coupling reaction)是一类重要的有机合成反应,它可以在两个或更多的有机分子之间建立键合,形成新的混合物。
在交叉偶联反应中,通常会使用过渡金属催化剂来引发反应,并使反应发生在选择性、高效的条件下。
交叉偶联反应源于20世纪70年代的发现,由于其广泛的应用领域和高度的化学选择性,成为了有机合成领域中的重要工具之一。
不仅可以构建碳-碳键,还可以构建碳-氮键、碳-氧键等重要的化学键。
它不仅可以用于药物合成、材料化学、天然产物合成等多个领域,还可以通过调整反应条件和催化剂选择,实现对底物的高度选择性修饰。
交叉偶联反应的类型繁多,常见的包括苯基-锌、叠氮-钯、硼基-钯、锡基-钯等反应类型。
每种类型的反应都有其独特的特点和应用领域,具体选择哪种类型的反应也需要根据具体的研究目的和底物结构来确定。
本文将详细介绍交叉偶联反应的各种类型,并重点阐述它们的反应机理、优缺点以及在有机合成中的应用。
通过对不同类型交叉偶联反应的比较和分析,有助于读者更好地理解和掌握这一重要的有机合成工具。
为了更好地组织内容,下文将根据各个类型的交叉偶联反应进行分类和详细介绍。
1.2 文章结构文章结构部分的内容可以按照以下方式编写:文章结构本文共分为引言、正文和结论三个部分。
引言部分概述了交叉偶联反应的背景和意义,介绍了文章的结构和目的;正文部分详细阐述了两种交叉偶联反应类型的要点;结论部分对全文进行总结,并对未来的研究方向进行展望。
正文部分按照交叉偶联反应类型分为两个小节,分别介绍了交叉偶联反应类型1和类型2。
每个小节中又分别列出了要点1和要点2,以便更好地说明交叉偶联反应的特点和应用。
通过以上结构的安排,本文能够完整而清晰地呈现交叉偶联反应的类型及其相关要点,使读者能够更好地理解和掌握这一研究领域。
目的部分的内容可以按照以下方式进行撰写:1.3 目的本文的目的是探讨交叉偶联反应的类型。
有机化学基础知识点整理偶联反应与交叉偶联反应

有机化学基础知识点整理偶联反应与交叉偶联反应有机化学基础知识点整理:偶联反应与交叉偶联反应有机化学是研究有机物结构与特性的科学,其中偶联反应和交叉偶联反应是有机合成中常用的重要手段,本文将对这两种反应进行基础知识点整理。
一、偶联反应偶联反应是指两个有机分子中的两个不同官能团在反应条件下发生连接形成新的键,从而生成一个新的有机分子。
常见的偶联反应有Heck反应、Suzuki反应、Stille反应等。
1. Heck反应Heck反应是通过钯催化下的芳香化合物与烯烃发生的偶联反应,生成具有烯烃结构的芳香化合物。
该反应需要碱性条件和适量的氧气存在。
反应机理包括反应前的氧化加成、钯催化下的反应、脱氧等步骤。
2. Suzuki反应Suzuki反应是通过钯催化下的芳香化合物与硼酸酯发生的偶联反应,生成具有芳香环和烷基或芳基基团的化合物。
该反应需有碱性条件和无氧环境。
反应机理包括反应前的亲核加成、钯催化下的反应、脱氧等步骤。
3. Stille反应Stille反应是通过钯催化下的芳香化合物与有机锡化合物发生的偶联反应,生成具有烷基或芳基基团的化合物。
该反应需有碱性条件、无氧环境和适量的溴化物存在。
反应机理包括反应前的亲核加成、钯催化下的反应、脱溴等步骤。
二、交叉偶联反应交叉偶联反应是指两个不同有机物之间的偶联反应,生成具有两个不同基团的化合物。
常见的交叉偶联反应有Negishi反应、Kumada反应、Suzuki-Miyaura反应等。
1. Negishi反应Negishi反应是通过钯催化下的有机锌化合物和卤代化物发生的交叉偶联反应,生成具有不同基团的化合物。
该反应需有碱性条件和适量的酸存在。
反应机理包括反应前的亲核加成、钯催化下的反应、脱卤等步骤。
2. Kumada反应Kumada反应是通过钯催化下的有机镁卤化物和卤代化物发生的交叉偶联反应,生成具有不同基团的化合物。
该反应需有碱性条件和无氧环境。
反应机理与Negishi反应类似。
Negishi反应Ni 催化的碳(sp2)-碳和碳(sp2)-杂交叉偶联反应

2005 年第 25 卷 第 12 期, 1508~1529
有机化学
Chinese Journal of Organic Chemistry
例如, 使用手性配体的镍催化剂时, 卤代苯和格氏 试剂 2-丁基镁合溴反应生成的产物 2-苯丁烷(Eq. 7)会偏 向两种对映异构体中的一种, 同时还生成少量的异构产 物[20]. 产物的光学纯度和优势对映体构型与溶剂、卤素 的性质、手性配体和添加剂都有关系(表 1). 当格氏试剂 与溴苯的摩尔比为 1∶3 时, 产率一般大于 80%, 产物的 光学纯度达到最大. 再增加格氏试剂的用量, 光学纯度 反而下降. 在这几种配体中, 使用 6 的产物光学纯度最 高, 但是产物的异构率也最大. 在乙醚溶剂中, 2~7 几 种配体催化得到的产物的优势对映体构型总是和手性 配体的相同, 但是在使用 2 作配体时, 甲基叔丁基醚溶 剂会使产物的构型反转. 此外, 当格氏试剂中含有 BuOMgX 时, 产物的光学纯度会变大. 有趣的是, 加入 少量的碘化镁(1%~3%), 也会使氯代格氏试剂和氯苯 偶联的产物构型反转, 同时光学纯度提高; 但是, 对于 相应的含溴反应物就不会发生构型反转.
除了上述均相催化体系, Bhanage 等发展了基于 Ni-TPPTS (TPPTS: triphenylphosphine trisulfonate sodium salt)的多相催化剂[14,15]. Ni(OAc)2 和 TPPTS 被溶解 在乙二醇中, 然后吸附在硅胶上, 再将制备好的硅胶催 化剂和反应物混合, 以甲苯作溶剂(Eq. 4). 产物的选择 性和均相催化体系相同, 也是 100%的 E 式产物; 转化 率稍低于均相体系, 但是加大硅胶催化剂的用量可以明 显地提高转化率. 乙酸钾作为无机碱和三乙胺、嘧啶等 有机碱相比, 具有易于和产品分离, 以及不会将镍从固 相中溶解出来的优点. 反应结束后, 硅胶很容易过滤出 来, 溶液中没有残留的镍, 而且过滤出的硅胶催化剂可 以重复使用多次, 产率基本不变. 其它的金属, 例如钯, 也可以在类似的条件下催化这个反应. Ni 催化剂的活性 和选择性次于钯, 而好于铑、钌、钴、铂等催化剂.
清华大学有元素机化学第七章-交叉偶联反应

(0) Grignard试剂对镍有机配合物的Ni-X键烃化, 还原消除, 生成Ni0
(1) Ni0 配合物与卤代烃发生氧化加成,生成Ni(II)
(2) Grignard试剂对新生成的Ni(II) 配合物的Ni-X键烃化
(3) 还原消除生成偶联产物与Ni0
7.2 Suzuki-Miyaura偶联反应
第七章 过渡金属有机化合物催化的交叉偶联反应 7.1 Kumada偶联反应
7.2 Suzuki偶联反应
7.3 Stille偶联反应
7.4 Negishi偶联反应 7.5 Sonogashira反应 7.6 Heck反应 7.7 其它偶联反应
交叉偶联反应定义
在过渡金属配合物的催化下,RX与非过渡金属有机化合 物R'M'形成碳-碳键(R-R')的反应。
反应环境的改进
用于吸收反应产生的卤化氢 经典反应采用有机胺
毒性大,污染环境
现常用无机离子型碱试剂(如K2CO3, Na2CO3, CsCO3等)
二价过渡金属有机化合物还原方式, 以Pd(OAc)2: * 配体还原
膦配体起还原基作用
Pd(OAc)2 + Ph 3P
配体交换
Ph 3P Pd OAc Ph 3P OAc
Normant Coupling (铜)
Stille 偶联反应机理
R1 X 2 R 2 SnBu3 PdX2 R 2 Pd R2 2 X SnBu3 Pd0 R2 R 2 R1 Pd R2 X SnBu 3 R 1 Pd X R 2 SnBu 3
7.4 Negishi偶联反应
在零价镍、钯配合物催化下,铝、锌、锆有机化合物与 卤代烃、三氟甲磺酸酯等之间的偶联反应。
Suzuki和Miyaura 1971报道 在零价钯配合物作用下,卤代烃与有机硼酸的交叉偶联反应。
钯催化的交叉偶联反应——2010年诺贝尔化学奖获奖工作介绍

2011年第31卷 有 机 化 学V ol. 31, 2011 * E-ma i l: nxwang@ma i l.iReceived December 9, 2010; revised and accepted March 10, 2011.·学术动态·钯催化的交叉偶联反应——2010年诺贝尔化学奖获奖工作介绍王乃兴(中国科学院理化技术研究所 北京 100190)摘要 钯催化的交叉偶联反应是非常实用的合成新方法. 文章给出了Heck 反应、Negishi 反应和Suzuki 反应的概念, 对其反应机理作了详细的说明, 并对其在复杂化合物和天然产物全合成中的应用作了评价. 关键词 钯催化; Heck 反应; Negishi 反应; Suzuki 反应Palladium-Catalyzed Cross-Coupling Reactions —Introduction of Nobel Prize in Chemistry in 2010Wang, Naixing(Technical Institute of Physics and Chemistry , Chinese Academy of Sciences , Beijing 100190)Abstract Palladium-catalyzed cross-coupling reactions provide chemists with a more precise and efficient new methodologies. The concepts of the Heck reaction and Negishi reaction as well as Suzuki reaction are given, the reaction mechanisms are proposed, and applications of these reactions in the total synthesis of natural products are commented.Keywords palladium-catalyzed; Heck reaction; Negishi reaction; Suzuki reaction2009年10月6日, 瑞典皇家科学院宣布, 美国科学家Richard F. Heck(理查德 赫克)、日本科学家Ei-ichi Negishi(根岸英一)和Akira Suzuki(铃木章)共同获得今年的诺贝尔化学奖. 美国教授Richard F. Heck, 1931年出生于美国的斯普林菲尔德, 1954年在美国加利福尼亚大学洛杉矶分校获得博士学位. 随后他进入瑞士苏黎世联邦工学院从事博士后研究, 后在美国特拉华大学任教, 于1989年退休. Richard F. Heck 现为特拉华大学名誉教授. Ei-ichi Negishi 教授是日本人, 1935年出生于中国长春, 1958年从东京大学毕业后进入帝人公司, 1963年在美国宾夕法尼亚大学获得博士学位, 现任美国普渡大学教授. Akira Suzuki 也是日本人, 1930年出生于日本北海道鹉川町, 1959年在北海道大学获得博士学位, 随后留校工作了一段时间. 1963年到1965年, Akira Suzuki 在美国普渡大学从事了两年的博士后研究工作. Akira Suzuki 于1973年任北海道大学工学系教授, 现在是北海道大学名誉教授.钯催化的交叉偶联反应是一种可靠而又实用的工具, 对有机合成具有长久和深远的影响力, 该反应得到了合成化学工作者的普遍应用.笔者于2004年在《有机反应——多氮化物的反应及有关理论问题(第二版)》的第4.13节中列举了5个较新的人名反应[1], 其中有Heck 反应、Negishi 反应和Suzuki 反应. 对其定义分别为: Heck 反应是钯催化下, 不饱和有机卤化物或三氟磺酸酯与烯烃进行的偶联反应. Negishi 反应是钯催化下的不饱和有机锌试剂和芳基或乙烯基卤化物等进行偶联的反应. Suzuki 反应是钯催化下不饱和有机硼试剂和芳基或乙烯基卤化物等进行偶联的反应. 这是钯催化的交叉偶联反应的基本概念. 最初的Suzuki 反应还需要在无氧无水的条件下来进行, 后来发展的一些反应条件已经无需无氧无水操作了.这几种钯催化的交叉偶联反应机理不尽相同, 对机1320有 机 化 学 V ol. 31, 2011理的说明也不止一种, 一些可能的机理对研究生也较难接受. 如Heck 反应, 即使一些已经出版的专门论述人名反应的专著也较为简略[2,3] Heck 本人最先提出的Heck 反应机理是应该接受的.1 反应机理1.1 Heck 反应机理目前关于Heck 反应机理描述较多, 但一些机理过于简单, 一些机理的描述很难让有机化学家接受. 笔者认为Jutand 等[4]最近在Heck 反应的专门著作中总结的Heck 反应机理最为贴切和容易接受(Scheme 1). 这个详细的反应过程实际上是Heck 首先建议的.Scheme 1理解各步过程并不困难. 关键是整个机理中左下角画箭头处, 表示出一个负氢迁移过程, 双键上的电子是由钯直接提供的.Heck 反应的机理主要分为四个步骤:(1)氧化加成. 上式催化循环的第一步是芳基卤和Pd(0)的氧化加成, Titton 报道的芳基卤和Pd 0(PPh 3)4的作用支持了氧化加成步骤的机理, Titton 还报道了芳基卤活性次序: ArI >ArBr >>ArCl.(2)烯烃插入. 氧化加成给出反式的σ芳基Pd(II)卤化物ArPdXL 2, 脱去一个PPh 3配体后与烯烃配位, 再经过烯的顺式插入, 得到σ烷基Pa(II)卤化物[5,6], 读者可以参照上述催化循环机理图.(3) β负氢消除. 上述催化循环机理图中的σ烷基Pa(II)卤化物有一个C —C 键内旋转, 结果使得β氢原子(与sp 3碳原子相连)和Pd 原子处于顺式位置, 接着产生了顺式的β负氢消除. 这个顺式的β负氢消除反应会是一个可逆的过程.(4)还原消除. 钯催化的偶联反应产物(与芳基直接相连的烯烃衍生物)游离产生以后, H —Pd(II)的卤化物再经过一个可逆还原消除过程, 再生出具有催化活性的Pd(0)的络合物. 碱性的辅助催化剂通过粗灭产生的卤化氢, 促使还原消除过程向Pd(0)络合物催化剂方向移动.Heck 不仅发现了这个钯催化的偶联反应, 而且对其机理做出了透彻的阐述. Heck 提出的氧化加成、烯烃插入、β负氢消除、还原消除这四个主要步骤在实验中都得到了证实. β负氢消除是一个重要过程, 钯提供了一对电子形成了双键. 最近认为β负氢消除通过一个顺式消除过程. 实际上Heck 反应不能仅看作交叉偶联反应, 它只是偶联反应一种.机理中涉及一些不同的Pd(0)和Pd(II)的中间体, 这些中间体的结构和活性依靠实验条件, 钯催化剂可以是Pd(0)的络合物, 如Pd(PPh 3)4, 可以是Pd(OAc)2等. 当Pd(OAc)2作为催化剂时, 需要加入1,3-二(二苯基膦基)丙基(dppp), 首先形成Pd(OAc)2(dppp), 再得到离子型络合物Pd 0(dppp)(OAc)- [7], Pd 0(dppp)(OAc)-分解得到Pd(0)络合物Pd(dppp). 1.2 Suzuki 反应机理笔者[8]曾研究过Suzuki 反应, 利用苯硼酸和2,2'-二溴-5,5'-二噻吩通过催化量的金属钯络合物Pd(PPh 3)4进行交叉偶联反应(Eq. 1).当时采用的反应条件还是无氧无水操作[8], 产物熔点是145 ℃, 产率为51%.笔者在文献的基础上[9~11], 提出了一个离子型的反应机理, 该论文发表在一个国外化学期刊上[8]. 该反应可能的机理由三个主要步骤完成的: (a)氧化加成; (b)硼试剂参与; (c)还原消除.(1)氧化加成. 反应过程中, Pd(0)被加到有机卤化物中间, 有机卤化物中的碳原子通过极性转换由原来荷正电变为荷负电, 钯原子被氧化为Pd(II) (Scheme 2). 氧化加成的过程是速率决定步骤, 反应中, 有机卤化物的活性按卤原子如下次序递减: I >Br >>C.N o. 8王乃兴:钯催化的交叉偶联反应——2010年诺贝尔化学奖获奖工作介绍1321Scheme 2(2)硼试剂参与. 接着, 硼试剂中的C —B 键异裂, 碳原子荷负电, 形成的芳基负离子与钯正离子结合为ArPdAr', 而游离出来的卤离子(X -)与硼正离子配位得到XB(OH)2 (Eq. 2).(3)消除反应. 最后是还原消除过程, 钯有机物分解, 形成新的C —C 键, 金属钯游离出来, 再与PPh 3络合, 再生出活性钯催化剂Pd(PPh 3)4, 完成了催化过程.Scheme 3笔者在当时研究苯硼酸和2,2'-二溴-5,5'-二噻吩通过Pd(PPh 3)4催化进行的交叉偶联反应, 发现该反应采用弱碱Ba(OH)2作为辅助催化剂比其它强碱反应快, 收率高, 甚至用碳酸钾代替Ba(OH)2也往往引起副产物增加. 笔者采用了甲醇和甲苯(V ∶V =1∶1)的混合溶剂. 就溶剂效应而言, 甲醇溶剂对反应有利. 在反应过程中的氧化加成阶段, 甲醇产生的烷氧基负离子MeO -能够置换配位在钯上的卤负离子, 容易生成ArPdOR 中间体(Scheme 4).Scheme 4RPdOMe 的形成被认为是一个重要的中间体, 曾被分离得到过[12,13]. 1.3 Negishi 反应机理笔者曾制备了有机锌试剂[8], 采用一锅反应方法, 利用溴锌苯和2,5-二溴噻吩通过催化量的金属钯络合物Pd(PPh 3)4进行交叉偶联反应(Scheme 5).Scheme 5与Suzuki 反应相比, 利用Negishi 反应合成目标化合物, 产率没有Suzuki 反应高[8,14].Negishi 反应的机理与Suzuki 反应非常类似, 也是通过氧化加成、有机锌试剂(亲核试剂)参与和还原消除的三个主要步骤进行的, 下面用离子反应历程作以描述(Eq. 3, Schemes 6, 7):(1)氧化加成Scheme 6(2)有机锌试剂参与(3)消除反应Scheme 7Pd(0)游离出来, 再与PPh 3络合再生出催化剂Pd(PPh 3)4, 完成了催化循环.另外需要说明的是, 交叉偶联反应有许多种, 一些虽然没有得到诺贝尔化学奖, 但应用价值还是比较高, 例如Songashira 反应. Sonogashira 反应是钯配合物催化的卤代芳烃或者卤代烯烃与末端炔烃的交叉偶联反应, 它是一种合成芳炔、烯炔和炔酮等化合物的有效方法. 其反应如Eq. 4.Sonogashira 反应的本质是PdCl 2与CuI 复合催化剂催化末端炔烃与碘、溴代芳或者烯烃的交叉偶联反应. 2007年发表在Chem. Rev.上的Sonogashira 反应机理, 说明了铜盐作为助催化剂的过程, 是一个容易接受的机理(Scheme 8)[15].铜盐作为助催化剂的作用一些文献也作了报道[16]. 近年来Sonogashira 反应的应用报道较多, 读者可以参考相关文献[17~19].2 结束语Heck 反应、Negishi 反应和Suzuki 反应, 代表了钯催化的交叉偶联反应的最高成就, 反应非常新颖独特,1322有机化学V ol. 31, 2011Scheme 8确实在有机合成方法学的最前沿取得了重大突破, 这些原创性的成就卓有建树, 这些新方法首先在有机合成领域得到了普遍应用, 对发展有机合成的策略和技巧产生了长久和深远的影响.人类健康对特效新药的发展不断提出更高的要求, 天然产物作为先导药, 在这方面寄托了人们的无限期望[20]. 近年来, 海洋天然产物的生物医学活性引起了人们的高度重视. 海绵、珊瑚以及海洋微生物的次生代谢的天然产物, 结构新颖而活性显著, 已经成为人们挖掘具有自主知识产权的创新先导抗肿瘤等新药的战略新领域. 人工全合成这类复杂的化合物和天然产物对人类来说是一种艰难的挑战, Heck反应、Negishi反应和Suzuki反应的新方法无疑在这方面会发挥出巨大的作用.近年来, 围绕Heck反应、Negishi反应和Suzuki反应, 化学家发展了一些新的反应方法和条件, 如Ni代替Pd进行催化的交叉偶联反应. Iyer等[21]报道了Cu催化(CuI催化剂)的Heck反应, 相对Pd和Ni催化剂更为经济. 最近, Darcel等[22]报道了Fe催化的Suzuki反应, 产率较高. Nakamura等[23]不久前报道了Fe催化的Negishi 反应, 产物收率高且有立体专一性. 反应条件已经从开始需要无氧无水操作到现在可以在水相反应体系中进行. Chao等[24]报道了在水合溶剂中进行Suzuki反应的研究结果, 产物能够获得中等以上的收率. Bach等[25]在Tetrahedron的一篇文章中(其参考文41), 对笔者关于Suzuki反应和Negishi反应的报道作了一些介绍. 相信以后还会有一些新的关于催化的交叉偶联反应的研究论文不断发表出来.Heck不仅开创了著名的Heck反应, 而且他提出的有机化学反应机理也非常之透彻和精到, 可见他的有机化学之功底和对该方法的深刻的理解. 可是, Heck在完成Heck反应研究之后, 一度连科研经费都没有, 甚至不得不离开科学界. 笔者刚在德国应用化学刊物(Angew. Chem. Int. Ed. 2010,49, 2092)看到一篇关于德国合成化学教授H. Kunz的作者介绍, H. Kunz教授列出了他的五篇文章, 其中第二篇文章发表在Tetrahedron 上, 第三篇发表在Synthesis上. 笔者在中国科学院研究生院为硕博连读生讲授“有机反应”专业课, 学生对Heck反应、Negishi反应和Suzuki反应的兴趣非常浓厚. 希望年青一代的学者, 通过研究和借鉴Heck反应、Negishi反应和Suzuki反应, 提升我国在有机合成方法学方面的整体水平.在这篇简介文章结束时, 笔者再介绍几篇关于钯催化的交叉偶联反应的代表性综述文章. 一篇是Suzuki本人1995年在Chem. Rev.上的综述[26], 希望有兴趣的读者参阅. 另外3篇对相关钯催化的交叉偶联反应最新进展作了详细综述[27~29], 希望读者特别是青年学者能够继续深入学习和掌握这一研究领域. 最近, Suzuki和Negishi[30~31]还分别发表了他们的诺贝尔化学奖获奖演说. 就在这篇文章付印之际,作者又读到了一篇最新的关于非对映选择性的Negishi反应的论文, 该方法为此类反应的立体控制开拓了又一个新生面[32]. References1 Wang,N.-X. Organic Reac tions—The Reac tion of Polyni-trogen Compounds and Some Theoretic Questions, 2nd ed., Chemical Industry Press, Beijing, 2004, pp. 165~171 (in Chinese).(王乃兴, 有机反应—多氮化物的反应及有关理论问题(第二版), 化学工业出版社, 北京, 2004, pp. 165~171.)2 Li, J. J. Name Reactions, Springer, New York, 2006, p. 285.3 Kürti, L.; Czakó, B. Strategic Applications of Named Reac-tions in Organic Synthesis, Elsevier Academic Press, 2005, p. 196.4 Jutand, A. In The Mizoroki-Hec k Reac tion, Ed.: Oestreich,M., Wiley, United Kingdom, 1999, pp. 1~5.5 Dieck, H. A.; Heck, R. F. J. Am. Chem. Soc.1974, 96, 1133.6 Ziegler, C. B.; Heck, R. F. J. Org. Chem. 1978, 43, 2941.7 Kozuch, S.; Shaik, S.; Jutand, A.; Amatore, C. Chem. Eur. J.2004, 10, 3072.8 Wang,N.-X. Synth. Commun. 2003, 33, 2119.9 Anderson, C. B.; Burreson, B. J.; Michalowski, J. T. J. Org.Chem. 1976, 41, 1990.10 Zask, A.; Helquist, P. J. Org. Chem. 1978, 43, 1619.11 Aliprantis, A. O.; Canary, J. W. J. Am. Chem. Soc. 1994,116, 6985.12 Yoshida, T.; Okano, T.; Otsuka, S. J. Chem. Soc., DaltonTrans. 1976, 993.13 Grushin, V. V.; Alper, H. Orgnometallics1993, 12, 1890.14 Wang,N.-X. Chin. . Chem. 2004, 24, 350 (in Chi-N o. 8 王乃兴:钯催化的交叉偶联反应——2010年诺贝尔化学奖获奖工作介绍1323nese).(王乃兴, 有机化学, 2004, 24, 350.)15 Chinchilla, R.; Nájera, C. Chem. Rev. 2007, 107, 874.16 Doucet, H.; Hierso, J. C. Angew. Chem., Int. Ed. 2007, 46,834.17 Gelman, D.; Buchwald, S. L. Angew. Chem., Int. Ed. 2003,42, 5993.18 Saha, D.; Dey, R.; Ranu, B. C. Eur. J. Org. Chem. 2010,6067.19 Karpov, A. S.; Merkul, E.; Rominger, F.; Müller, T. J. J.Angew. Chem., Int. Ed. 2005, 44, 6951.20 Harmata, M. Strategies and Tac tic s in Organic Synthesis,Elsevier, Oxford, 2010.21 Iyer, S.; Ramesh, C.; Sarkar, A.; Wadgaonkar, P. P. Tetrahe-dron Lett. 1997, 38, 8113.22 Bźziera, D.; Darcela, C. Adv. Synth. Catal. 2009, 351, 1732.23 Hatakeyama, T.; N akagawa, N.; N akamura, M. Org. Lett.2009, 11, 4496.24 Cho, S. Y.; Kang, S. K.; Ahn, J. H.; Ha, J. D.; Choi, J. K.Tetrahedron Lett. 2006, 47, 5237.25 Schröter, S.; Stock, C.; Bach, T. Tetrahedron2005, 61,2245.26 Norio Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457.27 Roglans, A.; Pla-Quintana, A.; Moreno-Mañas, M. Chem.Rev. 2006, 106, 4622.28 Martin, R.; Buchwald, S. L. Acc. Chem. Res. 2008, 41,1461.29 Denmark, S. E.; Regens, C. S. Acc. Chem. Res. 2008, 41,1486.30 Suzuki, A. Angew. Chem., Int. Ed.2011, 50, 6723.31Negishi, E. Angew. Chem., Int. Ed.2011, 50, 6738.32 Seel, S.; Thaler, T.; Takatsu, K.; Zhang, C.; Zipse, H.;Bernd, F.; Straub, B. F.; Mayer, P.; Knochel, P. J. Am. Chem.Soc. 2011, 133, 4774.(Y1012093 Li, L.)。
Negishi交叉偶联反应
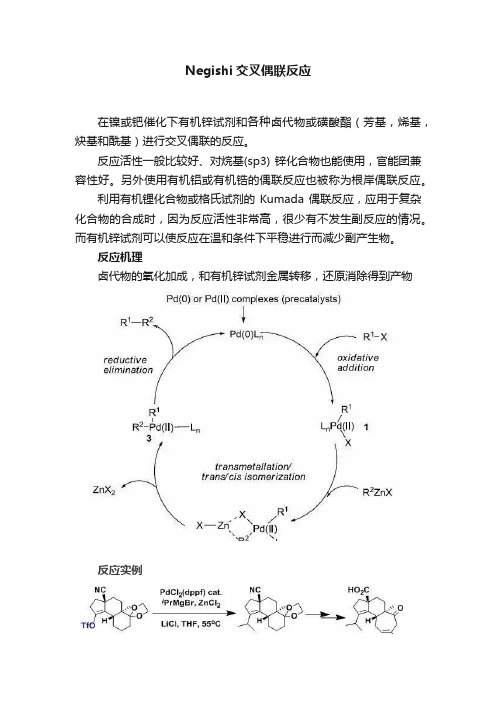
Negishi交叉偶联反应在镍或钯催化下有机锌试剂和各种卤代物或磺酸酯(芳基,烯基,炔基和酰基)进行交叉偶联的反应。
反应活性一般比较好、对烷基(sp3) 锌化合物也能使用,官能团兼容性好。
另外使用有机铝或有机锆的偶联反应也被称为根岸偶联反应。
利用有机锂化合物或格氏试剂的Kumada偶联反应,应用于复杂化合物的合成时,因为反应活性非常高,很少有不发生副反应的情况。
而有机锌试剂可以使反应在温和条件下平稳进行而减少副产生物。
反应机理卤代物的氧化加成,和有机锌试剂金属转移,还原消除得到产物反应实例【J. Am. Chem. Soc.2005, 127, 13514】【J. Heterocycl. Chem.1993, 30, 1245-1252】【Angew. Chem. Int. Ed.1993, 32, 1326-1327】【J. Org. Chem. 2004, 69, 5120-5123】【Synthesis 2007, 622-637】【J. Org. Chem.2013, 78, 3676−3687】【J. Org. Chem., 2008, 73, 7380-7382.】【Synthesis, 2016, 48, 504-511.】【Org. Lett. 2002, 4, 2385-2388.】【J. Org. Chem.1999, 64, 3000-3001】【J. Am. Chem. Soc. 1998, 120, 11198-11199.】其他文献【Org. Lett., 2005, 7, 3805-3807.】【J. Am. Chem. Soc., 2008, 130, 2756-2757.】【Org. Lett., 2003, 5, 423-425.】【J. Am. Chem. Soc., 2003, 125, 12527-12530.】【Org. Lett., 2011, 13, 1218-1221.】【Org. Lett., 2011, 13, 3822-3825.】【Org. Lett., 2010, 12, 4742-4744】【Org. Lett., 2009, 11, 4092-4095.】【Org. Lett., 2008, 10, 1521-1523.】【J. Org. Chem., 2007, 72, 9622-9629.】【J. Am. Chem. Soc., 2005, 127, 10482-10483.】【Synthesis,2002, 2681-2686.】【Org. Lett., 2008, 10, 2131-2134.】【J. Org. Chem., 2010, 75, 8330-8332.】【J. Am. Chem. Soc., 2012, 134, 9541-9544.】【Org. Lett., 2017, 19, 2490-2493】【J. Am. Chem. Soc.,2017, 139, 7741-7744】参考文献一、Name Reactions (A Collection of Detailed Reaction Mechanisms), Jie Jack Li, Negishi cross-coupling reaction,page 430-431.二、化学空间:/reactions/2014/01/%e6%a0%b9%e5%b2%b8%e5%81%b6% e8%81%94%e5%8f%8d%e5%ba%94%ef%bc%88negishi-coupling%ef%bc%89.html三、/namedreactions/negishi-coupling.shtm根岸英一(Ei-ichi Negishi),日本人,1935年7月出生于中国长春,1958年从东京大学毕业后进入帝人公司。
有机合成中钯催化下的交叉偶联反应

有机合成中钯催化下的交叉偶联反应-2010年诺贝尔化学奖简介陈明华( 兴义师范学院化学生物系,贵州兴义 562400)摘要:介绍了2010年诺贝尔化学奖的科学背景,即“有机合成中钯催化下的交叉偶联反应”的产生、发展和应用,体现了有机化学已经发展成为一门艺术形式,在这个形式下,科学家们在试管里创造性的产生出不可思议的化学物质的过程。
关键词:钯催化剂;交叉偶联反应;赫克反应;铃木反应;根岸反应Palladium-Catalyzed Cross Couplings in Organic SynthesisCHEN Ming-Hua(Department of Chemistry and Biological, Xingyi Normal College, Xingyi, Guizhou 562400)Abstract: This paper introduces scientific background of the Nobel Prize in Chemistry for 2010, it’s palladium-catalyzed cross couplings in organic synthesis.And this fack had been presents that “Organic chemistry has developed into an art form where scientists produce marvelous chemical creations in their test tubes”.Key words: palladium catalyst; cross-coupling reaction; heck reaction; suzuki reaction; negishi reaction2010年10月6日,瑞典皇家科学院决定授予美国特拉华大学(University of Delaware) 理查德-赫克(Richard F. Heck), 普渡大学(Purdue University)根岸荣一(Ei-ichi Negishi)和日本北海道大学(Hokkaido University)的铃木彰(Akira Suzuki)三位教授2010年的诺贝尔化学奖,以表彰他们在“有机合成中钯催化下的交叉偶联反应”作出的贡献[1]。
negishi反应机理

negishi反应机理
Negishi反应是一种重要的交叉偶联反应,适用于不同的有机卤化物与有机锌化合物的反应。
该反应的机理如下:
1. 有机卤化物与有机锌化合物生成中间体
有机卤化物与有机锌化合物在反应体系中相遇,通过卤原子进行亲电取代反应,生成相应化合物的中间体。
2. 中间体中的锌原子与卤原子发生交换反应
锌原子与卤原子发生交换反应,形成新的碳-碳键。
交换反应需要一定的能量,可以通过添加助溶剂或者铜盐来促进这一步反应。
3. 碳-锌键在中间体中断裂生成产物
最后,中间体中的碳-锌键断裂,生成相应的产物和锌化合物。
锌化合物可以再次参与反应循环。
总之,Negishi反应是一种重要的交叉偶联反应,可以使用有机卤化物和有机锌化合物作为反应底物,通过卤原子亲电取代反应和锌原子的交换反应形成相应的产物。
根岸偶联反应(Negishi coupling)

4.Adam P. Smith, Scott A. Savage, J. Christopher Love, and Cassandra L. Fraser (2004). "Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi cross-coupling strategy: 5-methyl-2,2'-bipyridine".Org. Synth.;Coll. Vol.10: 517.
2.Strategic Applications of Named Reactions in Organic SynthesisLaszlo Kurti, Barbara Czako Academic Press (March 4,2005)ISBN 0-12-429785-4
3.Juan A. Casares, Pablo Espinet, Beatriz Fuentes, and Gorka Salas. Insights into the Mechanism of the Negishi Reaction: ZnRX versus ZnR2 Reagents. Journal of the American Chemical Society. 2007,129: 3508.doi:10.1021/ja070235b.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Negishi交叉偶联反应
在镍或钯催化下有机锌试剂和各种卤代物或磺酸酯(芳基,烯基,炔基和酰基)进行交叉偶联的反应。
反应活性一般比较好、对烷基(sp3) 锌化合物也能使用,官能团兼容性好。
另外使用有机铝或有机锆的偶联反应也被称为根岸偶联反应。
反应机理
卤代物的氧化加成,和有机锌试剂金属转移,还原消除得到产物
反应实例
参考文献
1. (a) Negishi, E.-I.; Baba, S. J. Chem. Soc., Chem. Commun. 1976, 596 -597. (b)Negishi, E.-I.; King, A. O.; Okukado, N. J. Org. Chem. 1977, 42, 1821 -1823. (c) Negishi, E.-I. Acc. Chem. Res. 1982, 15, 340 -348. (Review). Negishi is a professor at Purdue University. He won Nobel Prize in 2010 along with Richard F. Heck and Akira Suzuki “for palladium-catalyzed cross couplings in
organic synthesis”. 【Negishi普渡大学教授。
由于在有机合成中对钯催化偶联方面的研究和Richard F. Heck , Akira Suzuki共同获得了2010年的诺贝尔化学奖。
】
2. Erdik, E. Tetrahedron 1992, 48, 9577- 9648. (Review).
3. De Vos, E.; Esmans, E. L.; Alderweireldt, F. C.; Balzarini, J.; De Clercq, E. J. Heterocycl. Chem. 1993, 30, 1245 -1252.
4. Evans, D. A.; Bach, T. Angew. Chem. Int. Ed. 1993, 32, 1326 -1327.
5. Negishi, E.-I.; Liu, F. In Metal-Catalyzed Cross-Coupling Reactions; Diederich, F.;Stang, P. J., Eds.; Wiley–VCH: Weinheim, Germany, 1998, pp 1–47. (Review).
6. Arvanitis, A. G.; Arnold, C. R.; Fitzgerald, L. W.; Frietze, W. E.; Olson, R. E.; Gilligan,P. J.; Robertson, D. W. Bioorg. Med. Chem. Lett. 2003, 13, 289- 291.
7. Ma, S.; Ren, H.; Wei, Q. J. Am. Chem. Soc. 2003, 125, 4817 -4830.
8. Corley, E. G.; Conrad, K.; Murry, J. A.; Savarin, C.; Holko, J.; Boice, G. J. Org.
Chem. 2004, 69, 5120 -5123.
9. Inoue, M.; Yokota, W.; Katoh, T. Synthesis 2007, 622- 637.
10. Yet, L. Negishi cross-coupling reaction. In Name Reactions for Homologations-Part I; Li, J. J., Ed.; Wiley: Hoboken, NJ, 2009, pp 70 99. (Review).
11. Dolliver, D. D.; Bhattarai, B. T.; et al. J. Org. Chem. 2013, 78, 3676−3687.
编译自:Name Reactions (A Collection of Detailed Reaction Mechanisms), Jie Jack Li, Negishi cross-coupling reaction,page 430-431.。
