EMEA直接接触塑料包装材料指导原则
欧盟塑料包装材料要求

欧盟塑料包装材料要求欧盟对塑料包装材料的要求那可不少呢。
一、材质方面。
1. 可回收性。
欧盟就希望塑料包装材料能容易被回收利用。
比如说,那些常见的PET塑料瓶,就得设计成方便回收的样子。
不能搞一些奇奇怪怪的形状或者和其他很难分离的材料混合在一起,不然回收的时候就像解开一团乱麻一样头疼。
就像你不能把塑料瓶和一堆金属丝缠在一起,还指望回收工人能轻松搞定。
2. 安全性。
塑料包装里可不能有那些有害健康的物质偷偷跑出来。
比如一些增塑剂,如果是对人体有害的那种,就绝对不能用在和食品、药品接触的塑料包装里。
这就好比你不能在装蛋糕的盒子里放毒药一样,必须得保证安全无毒,毕竟这些包装可是直接和我们吃的、用的东西亲密接触呢。
3. 标识清晰。
塑料包装上得清楚地标明是什么类型的塑料。
这就像给塑料包装贴上身份证一样,让大家一眼就能看出来。
像“1号PET”“2号HDPE”之类的标识得明明白白的。
这样回收的时候就可以把相同类型的塑料归到一起,就像把相同班级的学生排在一起那么整齐,方便处理。
二、环保要求方面。
1. 减少使用量。
欧盟鼓励企业能少用点塑料包装材料就少用点。
就像你不能为了包一颗小糖果就用一大张厚厚的塑料膜,那太浪费了。
如果一个产品本来只需要小小的一片塑料包装就能搞定,就别搞那种过度包装,把产品裹得像个大粽子似的全是塑料。
2. 生物降解性。
有些情况下,塑料包装最好是能生物降解的。
要是不小心被扔到自然环境里,它能自己慢慢分解,不会像普通塑料那样几百年都不消失,在土地里、海洋里变成顽固的“垃圾钉子户”。
比如说,一些一次性的塑料餐具,如果是用生物可降解塑料做的,就会在一定时间内自然分解,不会像普通塑料餐具那样对环境造成长期的污染。
FDA人用药品和生物制品包装用容器密封系统指导原则一

发布日期栏目化药药物评价>>化药质量控制标题FDA人用药品和生物制品包装用容器密封系统指导原则(一)作者高杨部门化药药学二部正文内按语:容?????美国FDA于1999年5月发布了人用药品和生物制品包装用容器密封系统指导原则(ContainerClosureSystemsforPackagingHumanDrugsandBiologics),继而于3年后再次发布了人用药品和生物制品包装用容器密封系统指导原则--问与答(ContainerClosureSystemsforPackagingHumanDrugsandBiologics--QuestionsandAnswers),该指导原则代表了FDA关于人用药品和生物制品包装用容器密封系统的现行观点,对于我国药品注册申请者和药品监管当局都具有很高的借鉴意义。
EMEA直接接触塑料包装材料指导原则的中文版已经于2011年4月在药审中心网站上以电子刊物发表。
此次将FDA的相关指导原则翻译成中文,供业界参考研究。
?????本文在翻译过程中得到了百特(中国)投资有限公司的金天明女士和龚明涛博士的大力支持,在此表示诚挚谢意。
尽管译稿经过笔者认真校核,但是由于水平有限,文中错误再所难免,恳请批评指正。
?????限于电子刊物的篇幅,将该指导原则将分为四篇连续刊出,前三篇为人用药品和生物制品包装用容器密封系统指导原则,最后一篇为人用药品和生物制品包装用容器密封系统指导原则--问与答,本文为第一篇。
指导原则人用药品和生物制品包装用容器密封系统化学,生产和质控文件美国卫生及公共服务部食品与药品管理局药品评价与研究中心(CDER)生物制品评价和研究中心(CBER)1999年5月指导原则人用药品和生物制品包装用容器密封系统化学,生产和质控文件另外的副本可以从以下地点得到:培训和交流办公室交流管理处药品信息科,HFD-210药品评价与研究中心(CDER)5600FishersLaneRockville,Maryland20857(电话)301-827-4573(网址)或交流,培训和生产商支持办公室,HFM-40生物制品评价和研究中心(CBER)1401RockvillePikeRockville,Maryland20852-1448(传真)888-CBERFAX或301-827-3844 (语音信息)800-835-4709或301-827-1800 (网址)美国卫生及公共服务部食品与药品管理局药品评价与研究中心(CDER)生物制品评价和研究中心(CBER)1999年5月目录I.引言II.背景???A.定义???B.CGMP、CPSC和USP对包装容器的要求???C.其他需要考虑的因素III.包装组件的合格性确认和质量控制???A.引言???B.一般要求???C.为支持任何药品的原始申请而应提供交的资料???D.吸入制剂???E.注射剂和眼用制剂???F.口服液体制剂、局部用制剂及其局部用给药系统???G.口服固体制剂和复溶用粉末???H.其他剂型Ⅳ.批准后的包装变更Ⅴ.Ⅲ类DMF文件???A.总体说明???B.Ⅲ类DMF中包括的信息Ⅵ.大包装容器???A.散装原料药用容器???B.散装制剂用容器附件A???法规要求附件B???与包装有关的政策指南附件C???提取物研究附件D???缩略语附件E???参考文献行业指南1人用药品和生物制品包装用容器封闭系统指导原则化学,生产和质控文件I.引言?????本指导原则为提交人用药品与生物制品2所用包装材料信息提供一般原则的指导3。
FDA人用药品和生物制品包装用容器密封系统指导原则

发布日期20110531栏目化药药物评价>>化药质量控制标题FDA人用药品和生物制品包装用容器密封系统指导原则(一)作者高杨部门化药药学二部正文内容按语:美国FDA于1999年5月发布了人用药品和生物制品包装用容器密封系统指导原则(Container Closure Systems for Packaging Human Drugs and Biologics),继而于3年后再次发布了人用药品和生物制品包装用容器密封系统指导原则--问与答(Container Closure Systems for Packaging Human Drugs and Biologics--Questions and Answers),该指导原则代表了FDA关于人用药品和生物制品包装用容器密封系统的现行观点,对于我国药品注册申请者和药品监管当局都具有很高的借鉴意义。
EMEA 直接接触塑料包装材料指导原则的中文版已经于2011年4月在药审中心网站上以电子刊物发表。
此次将FDA的相关指导原则翻译成中文,供业界参考研究。
本文在翻译过程中得到了百特(中国)投资有限公司的金天明女士和龚明涛博士的大力支持,在此表示诚挚谢意。
尽管译稿经过笔者认真校核,但是由于水平有限,文中错误再所难免,恳请批评指正。
限于电子刊物的篇幅,将该指导原则将分为四篇连续刊出,前三篇为人用药品和生物制品包装用容器密封系统指导原则,最后一篇为人用药品和生物制品包装用容器密封系统指导原则--问与答,本文为第一篇。
指导原则人用药品和生物制品包装用容器密封系统化学,生产和质控文件美国卫生及公共服务部食品与药品管理局药品评价与研究中心(CDER)生物制品评价和研究中心(CBER)1999年5月指导原则人用药品和生物制品包装用容器密封系统化学,生产和质控文件另外的副本可以从以下地点得到:培训和交流办公室交流管理处药品信息科,HFD-210药品评价与研究中心(CDER)5600 Fishers LaneRockville, Maryland 20857(电话)301-827-4573(网址)/cder/guidance/index.htm或交流,培训和生产商支持办公室,HFM-40生物制品评价和研究中心(CBER)1401 Rockville PikeRockville, Maryland 20852-1448(传真)888-CBERFAX或301-827-3844(语音信息)800-835-4709或301-827-1800(网址)/cber/guidelines.htm美国卫生及公共服务部食品与药品管理局药品评价与研究中心(CDER)生物制品评价和研究中心(CBER)1999年5月目录I.引言II.背景A.定义B.CGMP、CPSC和USP对包装容器的要求C.其他需要考虑的因素III.包装组件的合格性确认和质量控制A.引言B.一般要求C.为支持任何药品的原始申请而应提供交的资料D.吸入制剂E.注射剂和眼用制剂F.口服液体制剂、局部用制剂及其局部用给药系统G.口服固体制剂和复溶用粉末H.其他剂型Ⅳ.批准后的包装变更Ⅴ.Ⅲ类DMF文件A.总体说明B.Ⅲ类DMF中包括的信息Ⅵ.大包装容器A.散装原料药用容器B.散装制剂用容器附件A法规要求附件B与包装有关的政策指南附件C提取物研究附件D缩略语附件E参考文献行业指南1人用药品和生物制品包装用容器封闭系统指导原则化学,生产和质控文件I.引言本指导原则为提交人用药品与生物制品2所用包装材料信息提供一般原则的指导3。
直接接触的塑料包装材料指南(参考中文译文)

下文是参考中文译文,具体内容和要求以英文原文为准.欧洲药品管理局检查伦敦,2005年5月19日CPMP/QWP/4359/03EMEA/CVMP/205/04人用药品委员会(CHMP)兽用药品委员会(CVMP)直接接触的塑料包装材料指南质量工作组同意的草案2003年10月CPMP/CVMP采纳发布,用于磋商2004年2月磋商结束(征求意见截止)2004年8月31日质量工作组同意2005年2月CPMP/CVMP采纳2005年4月/5月生效日期2005年12月1日本指南取代了原“初级包装塑料材料指南”(欧盟药品管理规范3AQ10a)发布地址7 Westferry Circus, Canary Wharf, London, E14 4HB, UKTel. (44-20) 74 18 84 00 Fax (44-20) 74 18 85 95E-mail:***********.inthttp://www.emea.eu.int@EMEA 2005 如果知会EMEA,本文件的复制和/或分发仅授权用于非商业目的目录1. 介绍 (1)1.1指南目的 (1)1.2指南范围 (1)1.3基本原则 (1)2. 上市许可申请中应提供资料的位置 (2)原料药容器密封系统[3.2.S.6] (2)药剂学开发[3.2.P.2.4] (2)制剂产品容器密封系统[3.2.P.7] (2)3. 需提交的数据 (3)3.1常规信息 (3)3.2规格标准 (3)4. 萃取研究 (4)5. 相互作用研究 (4)5.1迁移性研究 (4)5.2吸附作用研究 (5)6. 毒理资料/文件 (5)7. 术语表 (5)8. 附件I:文件陈述决策树 (6)9. 附件II:塑料包材文件陈述的决策树 (7)10. 附件III:资料陈述的关联表 (8)1. 介绍1.1 指南目的本指南替代了欧盟药品管理规范3AQ10a(Rules Governing Medicinal Products 3AQ10a)中发布的初级包装塑料材料指南(Guideline on Plastic Primary Packaging Materials),并解释了提交上市许可申请的原料药和制剂所用直接包材的塑料产品的信息。
欧盟新发布关于食品接触塑料材料和物品的法规

欧盟新发布关于食品接触塑料材料和物品的法规
2019年8月9日欧盟在官方公报上发布:(EU)No.10-2011规定的聚((R)-3-羟基丁酸酯-共-(R)-3-羟基己酸酯)物质(FCM物质No.1059,CAS号147398-31-0)的授权要求所有分子量低于1000 Da的低聚物的总迁移量不超过5.0 mg/kg食品或食品模拟物。
2019年8月9日,欧盟官方公报发布指令(EU)2019/1338,修订有关与食品接触的塑料材料和物品的法规(EU)10/2011条例,该指令将于2019年8月28日开始正式生效。
在该指令在生效前,与食品接触的塑料材料及制品可于2020年8月20日之前投放市场直到售罄。
该法规直接适用于所有成员国。
欧盟食品接触塑料法规

欧盟食品接触塑料法规引言:塑料制品在我们的日常生活中无处不在,然而,塑料中的化学物质可能对我们的健康造成潜在风险。
为了确保食品的安全性,欧盟制定了食品接触塑料法规,以严格监管塑料制品在食品接触中的使用。
本文将介绍欧盟食品接触塑料法规的背景、内容和影响。
一、背景随着塑料制品的广泛应用,人们开始关注塑料对食品安全的影响。
研究发现,塑料中的某些化学物质可能渗入食品中,对人体健康产生潜在危害。
为了保护消费者的权益,欧盟制定了食品接触塑料法规,对塑料制品在食品接触中的使用进行监管。
二、法规内容欧盟食品接触塑料法规主要包括以下几个方面的内容:1. 材料限制:法规规定了塑料制品所使用的材料的限制。
例如,某些致癌物质和毒性物质的使用被严格限制,以确保食品的安全性。
2. 迁移限制:法规规定了塑料制品中化学物质的迁移限制。
即使材料本身是安全的,但在食品接触过程中,化学物质的迁移也可能对食品造成污染。
欧盟食品接触塑料法规明确规定了各种化学物质的迁移限值。
3. 标识要求:法规要求塑料制品必须进行适当的标识,以便消费者了解产品的使用范围和注意事项。
标识中应包含产品的材料成分、使用方法和相关警示信息。
4. 原材料审查:法规要求塑料制品生产商对使用的原材料进行审查,确保其符合食品安全要求。
生产商需要对原材料进行测试和评估,以确保其不会对食品造成污染。
三、影响欧盟食品接触塑料法规的实施对塑料制品行业产生了重要影响。
1. 创新推动:法规的实施促使塑料制品行业进行技术创新,开发更安全的食品接触材料。
生产商需要寻找符合法规要求的材料替代传统的塑料材料,推动材料科学的发展。
2. 企业合规:法规的出台使得塑料制品生产商需要对其产品进行合规性评估和检测,确保产品符合法规的要求。
这对于企业来说是一项挑战,但也促使企业加强质量管理和监控,提升产品质量和安全性。
3. 消费者保护:法规的实施增强了消费者对食品安全的信心。
消费者可以更加放心地购买和使用塑料制品,减少了潜在的风险。
欧盟药品评价管理局(EMEA)直接接触塑料包装材料指导原则(1)教程文件

2003年10月欧盟药品评价管理局(EMEA)起草了直接接触塑料包装材料指导原则(GUIDELINE ON PLASTICIMMEDIATE PACKAGIN GMATERIALS),并与2005年12月1日发布。
该指导原则根据风险级别,对于直接接触原料药或制剂的塑料包材应进行哪些研究,如何在申报资料中呈现,提供了指导意见。
这一指导原则对于我国直接接触药品的塑料包材研究具有很高的借鉴意义。
因此笔者进行了翻译,特此供业界参考研究。
以下为指导原则正文。
目录1 介绍1.1 目标1.2 概述1.3 一般原则2 在申请上市文件中的位置3 应提交的数据3.1 总体信息3.2 质量标准4 提取研究5 相互作用研究5.1 迁移(浸出)研究5.2 吸附研究6 毒理学资料/文献7 术语解释附件1 申报资料决策树附件2 塑料包装材料申报资料决策树附件3 提交信息对照表1 介绍1.1 目标制定本指导原则旨在替代《医药产品管理办法》3AQ10a的“直接接触塑料包装材料指导原则”,同时进一步强调在原料药和制剂申请上市时,应针对其直接接触药品的塑料包装材料提供相关信息。
本指导原则涉及人用药品和兽药所用的直接接触药品的塑料包装材料的申请。
对于人用药品,本指导原则涉及欧盟法规2003/63/EC(法规2001/83/EC的修正版)附录I第一部分第3单元的章节3.2.1.6、3.2.2.2和3.2.2.7;对于兽药,则涉及欧盟法规2001/82/EC的附录I 第二部分的章节A、C和G。
1.2 概述本指导原则囊括了对直接接触药品塑料包装材料的具体要求。
对于其他包装材料或容器密封系统的特性,如包材性能,本指导原则不会考虑为它们制定一个合适的总体要求。
本指导原则范围仅限于直接接触药品塑料包装材料,也就是与原料药或制剂发生直接接触的包装材料,它们可能只是容器密封系统中的容器、封盖或其他部件的某一部分。
弹性体、天然和人工橡胶不在本指导原则范围之内。
欧盟食品接触材料产品法规

欧盟食品接触材料产品法规1.引言1.1 概述概述欧盟食品接触材料产品法规是欧盟为保障食品安全而制定的一系列法规和标准。
食品接触材料产品是指与食品直接或间接接触的材料和制品,如食品包装、餐具及厨房用具等。
这些材料和制品可能会释放出有害物质,从而对食品安全和人体健康产生潜在影响。
欧盟一直致力于确保食品接触材料产品的安全性,并通过制定严格的法规和标准来管理和监管。
这些法规和标准旨在规范食品接触材料产品的生产、销售和使用环节,以减少有害物质的迁移和食品污染的风险。
欧盟食品接触材料产品法规的制定和实施涉及多个方面。
一方面,它要求食品接触材料产品在生产过程中必须符合特定的材料安全要求,包括合格的原料选择、生产工艺控制和标识要求等。
另一方面,它还规定了不同类别的食品接触材料产品需要进行相应的安全评估和认证,确保其在使用过程中不会对食品和人体健康造成危害。
另外,欧盟还建立了一系列的监管机构和合作机制,负责监督和管理食品接触材料产品的安全性。
这些机构不仅参与标准的制定和法规的修订,还开展风险评估和市场监测工作,确保食品接触材料产品符合相应的安全标准和法规要求。
欧盟食品接触材料产品法规的实施对于食品安全和消费者的健康至关重要。
它为企业提供了明确的规范和指引,促使食品接触材料产品的生产和使用更加安全可靠。
同时,这些法规也为消费者提供了可靠的保障,确保他们购买和使用的食品接触材料产品符合相关安全标准。
在本篇文章中,我们将重点介绍欧盟食品接触材料产品法规的概述和要点,以及它对未来的影响和建议。
通过深入了解这一领域的法规和标准,我们可以更好地理解欧盟在食品安全领域的管理体系,为企业和消费者提供更安全、更健康的食品接触材料产品。
1.2文章结构文章结构的设计是为了让读者更好地理解和掌握文章的内容。
本文将按照以下结构进行叙述:1. 引言:在引言部分,首先会对本文的主题进行概述,即欧盟食品接触材料产品法规。
接着,会介绍本文的结构,即各个章节的内容和顺序。
欧盟食品接触塑料法规

欧盟食品接触塑料法规随着人们对食品安全和环境保护意识的提高,塑料包装在食品行业中的使用受到了广泛关注。
为了保护消费者的健康和环境的可持续发展,欧盟制定了一系列食品接触塑料法规,以规范和管理塑料包装在食品领域的使用。
欧盟食品接触塑料法规的核心是确保食品包装材料的安全性。
根据法规,所有食品接触材料都必须符合一定的安全标准,以确保其中的化学物质不会对食品造成污染。
这些安全标准主要包括最大溶出限量(Migration Limit)和特定迁移物质的限制。
最大溶出限量是指食品接触材料在一定条件下所能溶出的化学物质的最大限量,而特定迁移物质的限制则是指某些特定的化学物质在食品接触材料中的使用受到限制。
欧盟食品接触塑料法规还要求食品接触材料必须符合一定的标识要求。
根据法规,食品包装上必须标明相关的信息,例如材料类型、食品接触材料的合规证明、生产日期和有效期等。
这些标识要求的目的是为了让消费者能够更好地了解食品包装的材料和安全性,从而做出更明智的购买决策。
此外,食品接触塑料法规还要求企业必须建立相应的追溯体系,以便在食品安全问题发生时,能够及时追溯并采取相应的措施。
除了安全性和标识要求,欧盟食品接触塑料法规还对食品包装材料的可持续性提出了要求。
根据法规,企业必须尽量选择可回收、可降解的材料来制造食品包装,以减少对环境的影响。
此外,法规还要求企业必须尽量减少包装材料的使用量,并鼓励采用创新技术和设计来实现包装的轻量化。
这些要求旨在推动食品包装行业向可持续发展的方向转变,为环境保护做出贡献。
为了确保法规的有效实施,欧盟设立了相应的监管机构和检验机构。
监管机构负责制定和修订相关的法规和标准,对企业进行监督和检查,并在必要时采取相应的措施。
检验机构则负责对食品包装材料进行抽样检测,以确保其符合安全标准和限制要求。
这些机构的设立为欧盟食品接触塑料法规的有效实施提供了保障。
欧盟食品接触塑料法规的出台旨在保护消费者的健康和环境的可持续发展。
直接接触塑料包装材料指导原则.doc

EMEA直接接触塑料包装材料指导原则译者:高杨校译:许真玉按语:2003年10月欧盟药品评价管理局(EMEA)起草了直接接触塑料包装材料指导原则(GUIDELINE ON PLASTIC IMMEDIATE PACKAGING MATERIALS),并与2005年12月1日发布。
该指导原则根据风险级别,对于直接接触原料药或制剂的塑料包材应进行哪些研究,如何在申报资料中呈现,提供了指导意见。
这一指导原则对于我国直接接触药品的塑料包材研究具有很高的借鉴意义。
因此笔者进行了翻译,特此供业界参考研究。
以下为指导原则正文。
目录1 介绍1.1 目标1.2 概述1.3 一般原则2 在申请上市文件中的位置3 应提交的数据3.1 总体信息3.2 质量标准4 提取研究5 相互作用研究5.1 迁移(浸出)研究5.2 吸附研究6 毒理学资料/文献7 术语解释附件1 申报资料决策树附件2 塑料包装材料申报资料决策树附件3 提交信息对照表1 介绍1.1 目标制定本指导原则旨在替代《医药产品管理办法》3AQ10a的“直接接触塑料包装材料指导原则”,同时进一步强调在原料药和制剂申请上市时,应针对其直接接触药品的塑料包装材料提供相关信息。
本指导原则涉及人用药品和兽药所用的直接接触药品的塑料包装材料的申请。
对于人用药品,本指导原则涉及欧盟法规2003/63/EC(法规2001/83/EC的修正版)附录I第一部分第3单元的章节3.2.1.6、3.2.2.2和3.2.2.7;对于兽药,则涉及欧盟法规2001/82/EC的附录I第二部分的章节A、C和G。
1.2 概述本指导原则囊括了对直接接触药品塑料包装材料的具体要求。
对于其他包装材料或容器密封系统的特性,如包材性能,本指导原则不会考虑为它们制定一个合适的总体要求。
本指导原则范围仅限于直接接触药品塑料包装材料,也就是与原料药或制剂发生直接接触的包装材料,它们可能只是容器密封系统中的容器、封盖或其他部件的某一部分。
FDA人用药品和生物制品包装用容器密封系统指导原则(二)

您现在的位置:电子刊物>> 电子刊物列表>> 电子刊物详细发布日期20110531栏目化药药物评价>>化药质量控制标题FDA人用药品和生物制品包装用容器密封系统指导原则(二)作者高杨部门化药药学二部正文内容按语:美国FDA于1999年5月发布了人用药品和生物制品包装用容器密封系统指导原则(Container Closure Systems for Packaging Human Drugs and Biologics),继而于3 年后再次发布了人用药品和生物制品包装用容器密封系统指导原则--问与答(Container Closure Systems for Packaging Human Drugsand Biologics--Questions and Answers),该指导原则代表了FDA关于人用药品和生物制品包装用容器密封系统的现行观点,对于我国药品注册申请者和药品监管当局都具有很高的借鉴意义。
EMEA 直接接触塑料包装材料指导原则的中文版已经于2011年4月在药审中心网站上以电子刊物发表。
此次将FDA的相关指导原则翻译成中文,供业界参考研究。
本文在翻译过程中得到了百特(中国)投资有限公司的金天明女士和龚明涛博士的大力支持,在此表示诚挚谢意。
尽管译稿经过笔者认真校核,但是由于水平有限,文中错误再所难免,恳请批评指正。
限于电子刊物的篇幅,将该指导原则将分为四篇连续刊出,前三篇为人用药品和生物制品包装用容器密封系统指导原则,最后一篇为人用药品和生物制品包装用容器密封系统指导原则--问与答,本文为第二篇。
C.为支持任何药品的初次申请而应提交的资料15申请资料(NDA、ANDA或BLA)CMC部分中应当提供的其他资料相关的信息和讨论请见附录E列出的指导原则。
1.说明申报资料的CMC 部分应当提供整个容器密封系统的总体说明。
此外,申请人还应提供包装系统每个组件的以下信息:a.产品名称、产品代码(如果有的话)、生产厂名称及地址、包装组件物理特征(例如型号、大小、形状和颜色)。
2011年5月1日欧盟塑料制品要求

2011年5月1日,欧盟颁布的管控塑料类食品接触材料的新法规(EU) No 10/2011正式生效,这意味着于2002年实施,前后经过7次修订的塑料食品接触材料特殊指令2002/72/EC废止。
(EU) No 10/2011是以法规形式颁布,并且在测试规则、适用范围和符合性判定规则方面进行了重大修订,可以说是近年来欧盟食品接触材料法规领域最为重大的变动,并可能直接影响到国内的生产企业。
长期以来,欧盟是我国最重要的贸易伙伴之一,是我国商品主要的输出地区,此类区域性的技术贸易壁垒会直接影响我国对外出口和经济利益。
因此,全面理解欧盟技术性法规体系和新法规的要求和变动对于规避贸易风险,提高我国产品的声誉具有极其重大的意义。
1.食品安全和食品接触材料食品接触材料,又称食品包装材料、间接食品添加剂,常见英文缩写为FCM(Food Contact Materials),是一类用于保护食品安全卫生、方便运输、促进销售,按一定的技术方法而采用的与食品直接接触的容器、材料及辅助物等的总称。
食品是人们赖以生存的必需品,食品安全自然就受到人们的高度重视。
一方面,食品包装和容器类产品可以保证食品不受外界环境污染,保持食品品质不发生劣变;另一方面,由于在食品包装和容器产品的制造加工过程中会使用到多种化学物质,其中一些有毒有害的化学物质在与食品接触的过程中会释放出来污染到食品,从而对人体健康产生危害。
因此,食品接触材料产品与人体健康和食品安全的密切关系也不言自明。
在食品安全越来越受到关注的今天,食品接触材料的安全性自然也就成为了大众和各国政府关注的焦点。
2.欧盟食品接触材料法规体系简介从欧盟第一部管控食品接触材料和制品的指令76/893/EEC发布以来,至今欧盟已有食品接触材料法规或指令三十余部,涵盖原则性的框架法规及针对具体材质和物质的专门指令,被视为目前国际上较为全面和系统的食品接触材料安全法规体系。
欧盟的食品接触材料法规体系中主要包含有法规(Regulation)和指令(Directive)两类文件。
包材指导原则--欧盟

译者:高杨校译:许真玉按语:2003年10月欧盟药品评价管理局(EMEA)起草了直接接触塑料包装材料指导原则(GUIDELINE ON PLASTIC IMMEDIATE PACKAGING MATERIALS),并与2005年12月1日发布。
该指导原则根据风险级别,对于直接接触原料药或制剂的塑料包材应进行哪些研究,如何在申报资料中呈现,提供了指导意见。
这一指导原则对于我国直接接触药品的塑料包材研究具有很高的借鉴意义。
因此笔者进行了翻译,特此供业界参考研究。
以下为指导原则正文。
目录1 介绍1.1 目标1.2 概述1.3 一般原则2 在申请上市文件中的位置3 应提交的数据3.1 总体信息3.2 质量标准4 提取研究5 相互作用研究5.1 迁移(浸出)研究5.2 吸附研究6 毒理学资料/文献7 术语解释附件1 申报资料决策树附件2 塑料包装材料申报资料决策树附件3 提交信息对照表1 介绍1.1 目标制定本指导原则旨在替代《医药产品管理办法》3AQ10a的“直接接触塑料包装材料指导原则”,同时进一步强调在原料药和制剂申请上市时,应针对其直接接触药品的塑料包装材料提供相关信息。
本指导原则涉及人用药品和兽药所用的直接接触药品的塑料包装材料的申请。
对于人用药品,本指导原则涉及欧盟法规2003/63/EC(法规2001/83/EC的修正版)附录I第一部分第3单元的章节3.2.1.6、3.2.2.2和3.2.2.7;对于兽药,则涉及欧盟法规2001/82/EC的附录I第二部分的章节A、C和G。
1.2 概述本指导原则囊括了对直接接触药品塑料包装材料的具体要求。
对于其他包装材料或容器密封系统的特性,如包材性能,本指导原则不会考虑为它们制定一个合适的总体要求。
本指导原则范围仅限于直接接触药品塑料包装材料,也就是与原料药或制剂发生直接接触的包装材料,它们可能只是容器密封系统中的容器、封盖或其他部件的某一部分。
弹性体、天然和人工橡胶不在本指导原则范围之内。
直接接触塑料包装材料指导原则资料

EMEA直接接触塑料包装材料指导原则译者:高杨校译:许真玉按语:2003年10月欧盟药品评价管理局(EMEA)起草了直接接触塑料包装材料指导原则(GUIDELINE ON PLASTIC IMMEDIATE PACKAGING MATERIALS),并与2005年12月1日发布。
该指导原则根据风险级别,对于直接接触原料药或制剂的塑料包材应进行哪些研究,如何在申报资料中呈现,提供了指导意见。
这一指导原则对于我国直接接触药品的塑料包材研究具有很高的借鉴意义。
因此笔者进行了翻译,特此供业界参考研究。
以下为指导原则正文。
目录1 介绍1.1 目标1.2 概述1.3 一般原则2 在申请上市文件中的位置3 应提交的数据3.1 总体信息3.2 质量标准4 提取研究5 相互作用研究5.1 迁移(浸出)研究5.2 吸附研究6 毒理学资料/文献7 术语解释附件1 申报资料决策树附件2 塑料包装材料申报资料决策树附件3 提交信息对照表1 介绍1.1 目标制定本指导原则旨在替代《医药产品管理办法》3AQ10a的“直接接触塑料包装材料指导原则”,同时进一步强调在原料药和制剂申请上市时,应针对其直接接触药品的塑料包装材料提供相关信息。
本指导原则涉及人用药品和兽药所用的直接接触药品的塑料包装材料的申请。
对于人用药品,本指导原则涉及欧盟法规2003/63/EC(法规2001/83/EC的修正版)附录I第一部分第3单元的章节3.2.1.6、3.2.2.2和3.2.2.7;对于兽药,则涉及欧盟法规2001/82/EC的附录I第二部分的章节A、C和G。
1.2 概述本指导原则囊括了对直接接触药品塑料包装材料的具体要求。
对于其他包装材料或容器密封系统的特性,如包材性能,本指导原则不会考虑为它们制定一个合适的总体要求。
本指导原则范围仅限于直接接触药品塑料包装材料,也就是与原料药或制剂发生直接接触的包装材料,它们可能只是容器密封系统中的容器、封盖或其他部件的某一部分。
美国FDA关于食品接触材料的塑料制品法规要求
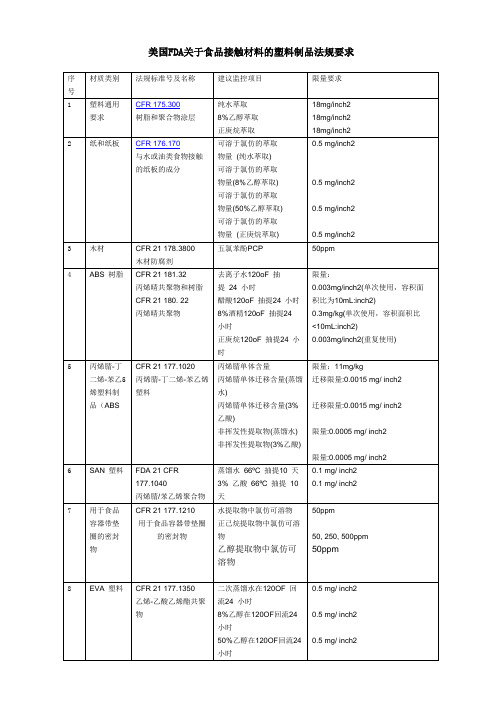
7
用于食品容器带垫圈的密封
物
CFR 21 177.1210
用于食品容器带垫圈的密封物
水提取物中氯仿可溶物
正己烷提取物中氯仿可溶物
乙醇提取物中氯仿可溶物
50ppm
50, 250, 500ppm
50ppm
8
EVA塑料
CFR 21 177.1350
乙烯-乙酸乙烯酯共聚物
二次蒸馏水在120OF回流24小时
总提取物(初回流7hours后蒸馏水再回流2 hours)
≤20 mg/inch2
≤1 mg/inch2
17b
橡胶制品(重复使用并接触脂类食品)
CFR 177.2600
总提取物(正己烷回流7 hours)
总提取物(初回流7hours后正己烷再回流2 hours)
≤175 mg/inch2
≤4 mg/inch2
乙酸乙酯中最大萃取物含量, W/W%
苯中最大萃取物含量, W/W%
NylonNylonNylon 610
6661.075-1.105
1.135-1.1251.075-1.105
1.165-1.15
5
392-44675-495405-425
1小1小1小时
时内时内后不
溶解溶解溶解
1.01.51.0
2.01.52.0
0.850-1.000
最大值53%
12c
PE与食品接触的表面涂层中的聚乙烯
(聚乙烯重量≤50%)
CFR 177.1520
二甲苯提取物(25℃)
密度(23ºC)
最大值75%
0.850-1.000
13
PC塑料
CFR 177.1580
包材指导原则 欧盟

译者:高杨校译:许真玉按语:2003年10月欧盟药品评价管理局(EMEA)起草了直接接触塑料包装材料指导原则(GUIDELINE ON PLASTIC IMMEDIATE PACKAGING MATERIALS),并与2005年12月1日发布。
该指导原则根据风险级别,对于直接接触原料药或制剂的塑料包材应进行哪些研究,如何在申报资料中呈现,提供了指导意见。
这一指导原则对于我国直接接触药品的塑料包材研究具有很高的借鉴意义。
因此笔者进行了翻译,特此供业界参考研究。
以下为指导原则正文。
目录1 介绍1.1 目标1.2 概述1.3 一般原则2 在申请上市文件中的位置3 应提交的数据3.1 总体信息3.2 质量标准4 提取研究5 相互作用研究5.1 迁移(浸出)研究5.2 吸附研究6 毒理学资料/文献7 术语解释附件1 申报资料决策树附件2 塑料包装材料申报资料决策树附件3 提交信息对照表1 介绍1.1 目标制定本指导原则旨在替代《医药产品管理办法》3AQ10a的“直接接触塑料包装材料指导原则”,同时进一步强调在原料药和制剂申请上市时,应针对其直接接触药品的塑料包装材料提供相关信息。
本指导原则涉及人用药品和兽药所用的直接接触药品的塑料包装材料的申请。
对于人用药品,本指导原则涉及欧盟法规2003/63/EC (法规2001/83/EC的修正版)附录I第一部分第3单元的章节3.2.1.6、3.2.2.2和3.2.2.7;对于兽药,则涉及欧盟法规2001/82/EC的附录I第二部分的章节A、C和G。
1.2 概述本指导原则囊括了对直接接触药品塑料包装材料的具体要求。
对于其他包装材料或容器密封系统的特性,如包材性能,本指导原则不会考虑为它们制定一个合适的总体要求。
本指导原则范围仅限于直接接触药品塑料包装材料,也就是与原料药或制剂发生直接接触的包装材料,它们可能只是容器密封系统中的容器、封盖或其他部件的某一部分。
弹性体、天然和人工橡胶不在本指导原则范围之内。
FDA人用药品和生物制品包装用容器密封系统指导原则(一)

发布日期20110531栏目化药药物评价>>化药质量控制标题FDA人用药品和生物制品包装用容器密封系统指导原则(一)作者高杨部门化药药学二部正文内容按语:美国FDA于1999年5月发布了人用药品和生物制品包装用容器密封系统指导原则(Container Closure Systems for Packaging Human Drugs andBiologics),继而于3年后再次发布了人用药品和生物制品包装用容器密封系统指导原则--问与答(Container Closure Systems for Packaging Human Drugsand Biologics--Questions and Answers),该指导原则代表了FDA关于人用药品和生物制品包装用容器密封系统的现行观点,对于我国药品注册申请者和药品监管当局都具有很高的借鉴意义。
EMEA 直接接触塑料包装材料指导原则的中文版已经于2011年4月在药审中心网站上以电子刊物发表。
此次将FDA的相关指导原则翻译成中文,供业界参考研究。
本文在翻译过程中得到了百特(中国)投资有限公司的金天明女士和龚明涛博士的大力支持,在此表示诚挚谢意。
尽管译稿经过笔者认真校核,但是由于水平有限,文中错误再所难免,恳请批评指正。
限于电子刊物的篇幅,将该指导原则将分为四篇连续刊出,前三篇为人用药品和生物制品包装用容器密封系统指导原则,最后一篇为人用药品和生物制品包装用容器密封系统指导原则--问与答,本文为第一篇。
指导原则人用药品和生物制品包装用容器密封系统化学,生产和质控文件美国卫生及公共服务部食品与药品管理局药品评价与研究中心(CDER)生物制品评价和研究中心(CBER)1999年5月指导原则人用药品和生物制品包装用容器密封系统化学,生产和质控文件另外的副本可以从以下地点得到:培训和交流办公室交流管理处药品信息科,HFD-210药品评价与研究中心(CDER)5600 Fishers LaneRockville, Maryland 20857(电话)301-827-4573(网址)/cder/guidance/index.htm 或交流,培训和生产商支持办公室,HFM-40生物制品评价和研究中心(CBER)1401 Rockville PikeRockville, Maryland 20852-1448(传真)888-CBERFAX或301-827-3844(语音信息)800-835-4709或301-827-1800(网址)/cber/guidelines.htm美国卫生及公共服务部食品与药品管理局药品评价与研究中心(CDER)生物制品评价和研究中心(CBER)1999年5月目录I.引言II.背景A.定义B.CGMP、CPSC和USP对包装容器的要求C.其他需要考虑的因素III.包装组件的合格性确认和质量控制A.引言B.一般要求C.为支持任何药品的原始申请而应提供交的资料D.吸入制剂E.注射剂和眼用制剂F.口服液体制剂、局部用制剂及其局部用给药系统G.口服固体制剂和复溶用粉末H.其他剂型Ⅳ.批准后的包装变更Ⅴ.Ⅲ类DMF文件A.总体说明B.Ⅲ类DMF中包括的信息Ⅵ.大包装容器A.散装原料药用容器B.散装制剂用容器附件A法规要求附件B与包装有关的政策指南附件C提取物研究附件D缩略语附件E参考文献行业指南1人用药品和生物制品包装用容器封闭系统指导原则化学,生产和质控文件I.引言本指导原则为提交人用药品与生物制品2所用包装材料信息提供一般原则的指导3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EMEA直接接触塑料包装材料指导原则化药药学二部译者:高杨校译:许真玉20110412按语:2003年10月欧盟药品评价管理局(EMEA)起草了直接接触塑料包装材料指导原则(GUIDELINE ON PLASTIC IMMEDIATE PACKAGING MATERIALS),并与2005年12月1日发布。
该指导原则根据风险级别,对于直接接触原料药或制剂的塑料包材应进行哪些研究,如何在申报资料中呈现,提供了指导意见。
这一指导原则对于我国直接接触药品的塑料包材研究具有很高的借鉴意义。
因此笔者进行了翻译,特此供业界参考研究。
以下为指导原则正文。
1 介绍1.1 目标制定本指导原则旨在替代《医药产品管理办法》3AQ10a的“直接接触塑料包装材料指导原则”,同时进一步强调在原料药和制剂申请上市时,应针对其直接接触药品的塑料包装材料提供相关信息。
本指导原则涉及人用药品和兽药所用的直接接触药品的塑料包装材料的申请。
对于人用药品,本指导原则涉及欧盟法规2003/63/EC(法规2001/83/EC的修正版)附录I第一部分第3单元的章节3.2.1.6、3.2.2.2和3.2.2.7;对于兽药,则涉及欧盟法规2001/82/EC的附录I第二部分的章节A、C和G。
1.2 概述本指导原则囊括了对直接接触药品塑料包装材料的具体要求。
对于其他包装材料或容器密封系统的特性,如包材性能,本指导原则不会考虑为它们制定一个合适的总体要求。
本指导原则范围仅限于直接接触药品塑料包装材料,也就是与原料药或制剂发生直接接触的包装材料,它们可能只是容器密封系统中的容器、封盖或其他部件的某一部分。
弹性体、天然和人工橡胶不在本指导原则范围之内。
本指导原则不适用于对采用已批准包材的上市药品进行回顾性研究。
但是,对于新注册申请,或者引入新直接接触药品塑料包材的变更申请,无论该包装材料是首次应用,还是已经用于原料药或制剂,都必须符合本指导原则的要求。
1.3 一般原则为塑料包装材料提供什么样的数据由具体情况而定,对于原料药,取决于其物理状态(具体见附件I的决策树),对于制剂,则取决于剂型和给药途径(具体见附件II的决策树)。
以什么样的格式提供数据呢?对于人用药品,应根据欧盟《医药产品管理办法》2B卷《注册通知》中的CTD 第3单元的章节3.2.S.6、3.2.P.2.4和3.2.P.7规定的标准格式提供数据;对于兽药,则应根据欧盟《医药产品管理办法》6B卷《注册通知》中第二部分的章节A、C和G规定的标准格式提供数据。
附件III的对照表比较了欧盟CTD格式与较早版本的人用药品(《注册通知》2B卷,1998年版)的数据要求及当前版本的兽药(《注册通知》6B卷,2004年版)的数据要求。
本指导原则的理解和掌握需要与一些其他方面的指导原则同步进行。
对于人用药品,这些指导原则包括:药物制剂研发指导原则(CPMP/QWP/155/96)、稳定性试验:新原料药和新制剂的稳定性试验指导原则(CPMP/ICH/2736/99)--CPMP/ICH/380/95的修订版、稳定性试验:已上市原料药及其制剂的稳定性试验指导原则(CPMP/QWP/122/02)。
对于兽药,这些指导原则包括:药物制剂研发指导原则(CVMP/315/98)、新原料药和新制剂稳定性试验指导原则(CVMP/VICH/899/99)、已上市原料药及其制剂的稳定性试验指导原则(CVMP/846/99)。
同时,对于欧盟关于接触食品的塑料材料及制品的立法规定(特别是关于接触食品的塑料材料及制品的委员会法令2002/22/EC),当出现在本指导原则中时,应予以充分考虑。
2 在申请上市文件中的位置为便于阅读,人用药品的CTD规定了申请上市文件的格式和内容,本指导原则仅提供CTD格式下相关研究内容的放置位置。
对于兽药,相关信息的放置位置参考附件III的对照表。
原料药的容器密封系统[3.2.S.6]这份资料需提供原料药的容器密封系统所用的塑料材料的信息,包括:●章节3.1中的材料类型和性质的总体信息;●塑料材料的质量标准(见章节3.2)●根据情况需要,提供提取研究和相互作用研究结果(见章节4和章节5),和/或毒理学资料(见章节6);药物制剂研发[3.2.P.2.4]应提供制剂研发过程中的相关研究数据,以证明所选择的塑料材料支持药品的稳定性、质量一致性和相容性,并与给药方法相适应,如果生产过程中有灭菌步骤,还应与灭菌工艺相适应。
具体研究数据应包括:●根据需要,提供提取研究和相互作用研究(见章节4和章节5),和/或毒理学资料(见章节6),以证明塑料材料与药品的相容性。
●应对塑料材料的光敏感性进行研究,以判断材料因光照产生的降解产物是否对包材与药品的相容性产生显著影响。
●根据情况,提供塑料材料受药品生产工艺的影响,如灭菌条件。
药物制剂的容器密封系统[3.2.P.7]在CTD第3单元所需提供的信息应包括如下内容:●描述所采用的容器密封系统,明确所有的塑料组件。
●提供所选择的塑料材料的概括说明,例如按本指导原则章节3.1所述。
●每一个塑料材料的质量标准,例如章节3.2所述。
3 应提交的数据3.1 总体信息与原料药或制剂直接接触的包装中所有的塑料材料,都应提供以下信息:●材料的化学名称。
●所有单体的化学名称。
除此之外,对于与非固体原料药或非固体制剂直接接触的塑料材料,还应提供以下信息:用于非固体原料药包装的塑料材料:●如果包材未被欧洲药典或其成员国药典收载,并且供应商也无法证明包材符合相关食品法规,那么就需要提供塑料材料中所有的定性组成,包括各种添加剂,例如抗氧剂、稳定性、增塑剂、润滑剂、溶剂和/或干燥剂。
用于非固体制剂包装的塑料材料:●当制剂属于吸入制剂、注射剂或眼用制剂时,应提供包装材料的供应商。
●当制剂属于吸入制剂、注射剂或眼用制剂时,如果包材未被欧洲药典或其成员国药典收载,并且即便所用添加剂由药典专论中批准中的添加中选取且用量在其规定限度之内,都应提供塑料材料中所有的定性组成,如上所述,包括各种添加剂,例如抗氧剂、稳定性、增塑剂、润滑剂、溶剂和/或干燥剂。
如果非固体制剂用于口服或局部给药(不包括眼用),当采用非药典收载的包装材料时,如果供应商无法证明包材符合相关食品法规,那么也需要提供材料的定性组成。
3.2 质量标准对于直接接触原料药或制剂的塑料包装材料,当为其制定质量标准时,应参照欧洲药典或其成员国药典的相关专论。
当参照药典专论制定质量标准时,应证明其方法的适用性。
如果所用塑料材料未被欧洲药典或其成员国药典收载,那么应考虑采用药典收载的一般方法,按照下列要求为其制定一份内部专论:●材料描述。
●材料鉴别。
●特性说明,如力学参数、物理参数等。
对于直接接触非固体原料药或非固体制剂的塑料包装材料,其内部专论需要在上述基础上进一步丰富,例如增加以下信息:●主要添加剂的鉴别,特别是容易迁移入内容物的添加剂,例如抗氧剂、增塑剂、催化剂、引发剂等。
●着色剂鉴别。
●基于提取研究(见章节4)的结果,说明可提取物的性质和数量。
当非固体制剂用于口服或局部给药(不包括眼用),或者非固体原料药的材料供应商可以证明其包材符合相关食品法规时,那么上述信息可不列入内部质量标准。
为证明材料是否符合其内部质量标准,应提供一批具有代表性的样品的检验报告。
4 提取研究提取研究的目的为确定哪些添加剂可以通过与制剂或原料药的接触而被从材料中提取出来。
对于容器密封系统中的塑料材料,当直接接触物为非固体原料药或口服及局部(不包括眼用)给药的非固体制剂时,如果该塑料材料未被欧洲药典及其成员国药典收载,或材料供应商无法证明其符合相关食品法规,则应进行提取研究。
但是,当直接接触的非固体制剂为吸入、注射或眼用给药途径时,即便该材料被证明可用于食品包装,也需要进行提取研究。
提取研究的一般方法为将材料样品置于一种合适的溶剂系统中,在苛刻条件下进行加速提取。
提取研究中所用溶剂的性质应尽量与实际盛装的原料药或制剂相同或相似。
对于制剂而言,优先选择制剂本身或不含药空白制剂。
在包材质量标准中应列出提取物的性质和数量。
5 相互作用研究为了评价所选择包材多大程度上适合于其用途,一项重要的研究内容就是揭示包材与原料药或制剂的相容性。
相容性研究的实验材料可能会是塑料材料本身,或者是塑料部件,也可能是包装容器本身。
研究材料与原料药或制剂的相互作用时,研究程度和方法视原料药或制剂的物理形态而区分,具体如下:对于固体原料药和固体制剂:药物与包材发生相互作用的风险较低,一般情况下无需进行相互作用研究。
但是,对于吸入给药或注射给药的固体制剂,例如冻干制剂,建议根据情况研究包装材料与制剂处方组分的相互作用。
对于非固体原料药和非固体制剂:相互作用的风险较大,对于每一种原料药或制剂,都应当进行有针对性的、全面充分的相互作用研究。
研究应着重于评价包装容器/给药系统的关键功能属性,并且应保证没有发生导致原料药或制剂质量下降的重大变化。
相互作用研究一般由迁移研究和/或吸附研究组成。
迁移研究用于监测从塑料材料中浸出并进入原料药或制剂之中的物质。
吸附研究用于评价由吸附或吸附作用可能引发的药物质量下降的情况。
5.1 迁移研究在药物的研发阶段就应当对原料药或制剂早期处方进行迁移研究,以期为原料药或制剂选择一种合适的包装材料。
当提取研究结果显示有一个或多个可提取物时(见章节4),就有必要在研发阶段进行迁移研究。
在这种情况下,应当证明在反映包装材料拟定用途的条件下,浸出物数量不会改变原料药或制剂的有效性和稳定性,并且不至于产生毒性风险。
应至少选择一批原料药或制剂进行此项研究。
采用其他介质(例如食品)进行的模拟研究仅被认为是一种预实验,不能代替采用原料药或制剂本身的研究。
研究所用的分析方法应考虑采用药典所列常规方法,并在文件中详细描述。
非药典收载的分析方法需进行方法学验证。
建议对浸出物制定含量上限。
仅当基于提取研究的结果,原料药或制剂中可能出现的每一种浸出物的最大量被证明是安全时,迁移研究才可以豁免。
如果认为迁移研究没必要并且因此未进行研究,那么应该证明其合理性。
当塑料包材是由多层不同的塑料材料组成时,应该根据其特点和拟定用途,评价处于外表面的几层材料发生迁移的可能性。
并且,还应当证明用于容器/密封系统表面的墨水或添加剂不会迁移进入药品之中。
在某些情况下,药品研发阶段没有进行过迁移研究,那么就应该在药品正式稳定性研究中,在长期试验和加速试验条件下进行浸出物监测。
5.2 吸附研究建议在药品研发阶段进行包材与制剂处方的相互作用研究,以考察是否发生主药吸附或某种辅料吸附于包装材料,从而导致制剂质量改变。
当在药品稳定性研究过程中观察到制剂稳定性发生变化,并且原因可能是主药吸附或辅料吸附于包装材料时,应进行吸附研究。
