阳极基础知识
电化学基础知识点(大全)
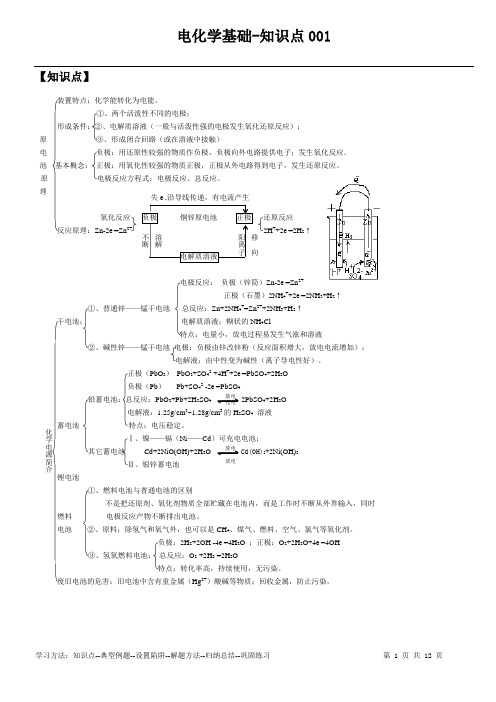
【知识点】装置特点:化学能转化为电能。
①、两个活泼性不同的电极;形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触)电 负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。
池 基本概念: 正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。
原 电极反应方程式:电极反应、总反应。
理氧化反应 负极 铜锌原电池 正极 还原反应反应原理:Zn-2e -=Zn 2+ 2H ++2e -=2H 2↑电解质溶液电极反应: 负极(锌筒)Zn-2e -=Zn 2+正极(石墨)2NH 4++2e -=2NH 3+H 2↑①、普通锌——锰干电池 总反应:Zn+2NH 4+=Zn 2++2NH 3+H 2↑干电池: 电解质溶液:糊状的NH 4Cl特点:电量小,放电过程易发生气涨和溶液②、碱性锌——锰干电池 电极:负极由锌改锌粉(反应面积增大,放电电流增加);电解液:由中性变为碱性(离子导电性好)。
正极(PbO 2) PbO 2+SO 42-+4H ++2e -=PbSO 4+2H 2O 负极(Pb ) Pb+SO 42--2e -=PbSO 4铅蓄电池:总反应:PbO 2+Pb+2H 2SO 4 2PbSO 4+2H 2O电解液:1.25g/cm 3~1.28g/cm 3的H 2SO 4 溶液蓄电池 特点:电压稳定。
Ⅰ、镍——镉(Ni ——Cd )可充电电池;其它蓄电池 Cd+2NiO(OH)+2H 2O Cd(OH)2+2Ni(OH)2Ⅱ、银锌蓄电池锂电池①、燃料电池与普通电池的区别不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断从外界输入,同时燃料 电极反应产物不断排出电池。
电池 ②、原料:除氢气和氧气外,也可以是CH 4、煤气、燃料、空气、氯气等氧化剂。
负极:2H 2+2OH --4e -=4H 2O ;正极:O 2+2H 2O+4e -=4OH -③、氢氧燃料电池: 总反应:O 2 +2H 2 =2H 2O特点:转化率高,持续使用,无污染。
电化学基础知识讲解及总结

电化学基础知识讲解及总结电化学是研究电与化学之间相互作用的学科,主要研究电能转化为化学能或者化学能转化为电能的过程。
以下是电化学的基础知识讲解及总结:1. 电化学基本概念:电化学研究的主要对象是电解质溶液中的化学反应,其中电解质溶液中的离子起到重要的作用。
电池是电化学的主要应用之一,它是将化学能转化为电能的装置。
2. 电化学反应:电化学反应可以分为两类,即氧化还原反应和非氧化还原反应。
氧化还原反应是指物质失去电子的过程称为氧化,物质获得电子的过程称为还原。
非氧化还原反应是指不涉及电子转移的反应,如酸碱中的中和反应。
3. 电解和电解质:电解是指在电场作用下,电解质溶液中的离子被电解的过程。
电解质是指能在溶液中形成离子的化合物,如盐、酸、碱等。
4. 电解质溶液的导电性:电解质溶液的导电性与其中的离子浓度有关,离子浓度越高,导电性越强。
电解质溶液的导电性也受温度和溶质的物质性质影响。
5. 电极和电位:在电化学反应中,电极是电子转移的场所。
电极可以分为阳极和阴极,阳极是氧化反应发生的地方,阴极是还原反应发生的地方。
电位是指电极上的电势差,它与电化学反应的进行有关。
6. 电池和电动势:电池是将化学能转化为电能的装置,它由两个或多个电解质溶液和电极组成。
电动势是指电池中电势差的大小,它与电化学反应的进行有关。
7. 法拉第定律:法拉第定律是描述电化学反应速率的定律,它表明电流的大小与反应物的浓度和电化学当量之间存在关系。
8. 电解质溶液的pH值:pH值是衡量溶液酸碱性的指标,它与溶液中的氢离子浓度有关。
pH值越低,溶液越酸性;pH值越高,溶液越碱性。
总结:电化学是研究电与化学之间相互作用的学科,主要研究电能转化为化学能或者化学能转化为电能的过程。
其中包括电化学反应、电解和电解质、电极和电位、电池和电动势等基本概念。
掌握电化学的基础知识对于理解电化学反应和电池的工作原理具有重要意义。
人教版选修四第四章、电化学基础 期末基础知识复习及训练(含答案)

人教版高二化学必修四第四章、电化学基础期末基础知识复习及训练(含答案)基础知识点整理一、原电池基本概念理解。
1、原电池的概念:把化学能直接转化为电能的装置叫做原电池。
2、化学电池的分类:常见的原电池可以分为三类:(1)一次电池:常见一次电池:碱性锌锰电池、锌银电池、锂电池等;(2)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池;(3)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池。
3、原电池的电极反应:以锌铜原电池为例:负极:氧化反应:Zn-2e=Zn2+(较活泼金属)正极:还原反应:2H++2e=H2↑(较不活泼金属)总反应式:Zn+2H+=Zn2++H2↑4、常见原电池的电极反应总结。
⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e-=2NH3+H2NH3和H2被Zn2+、MnO2吸收:MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A.放电反应负极: Pb-2e-+ SO42- = PbSO4正极: PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2OB.充电反应:阴极:PbSO4 +2e-= Pb+ SO42-阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-===总反应式:Pb + PbO 2 + 2H2SO4放电充电2PbSO4 + 2H2O5、典型例题分析。
例题1、原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。
下列说法中正确的是( )A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.(3)中Fe作负极,电极反应式为Fe-2e-===Fe2+D.(4)中Cu作正极,电极反应式为2H++2e-===H2↑答案:B解析:(1)中Mg作负极;(2)中Al作负极;(3)中铜作负极;(4)是铁的吸氧腐蚀,Fe作负极。
电子管基础知识最适合初学者

电子管基础知识最适合初学者电子管基础知识最适合初学者在科技日新月异的今天,电子技术不断地发展和进步,而电子管在电子技术的发展中有着不可或缺的地位。
虽然如今电子器件的使用范畴越来越广泛,但是对于初学电子的小白们来说,学习电子管基础知识仍然是非常有必要的。
在本文中,我们将为大家介绍电子管的基础知识并帮助你了解它的工作原理。
1.电子管的基本构成一个电子管由若干个电子器件组成,最基本的电子器件是电子三极管(又称晶体三极管),其他的电子器件如激光管、热电子发射管、阴极射线管等。
一个普通的电子管大致由五个部分组成:阴极、阳极、栅极、灯丝(热丝)和玻璃球。
其中,阴极是负极,阳极是正极,栅极则可以控制电流的大小,灯丝则通过发热产生电子,通过管内真空减少与其它器件的电磁干扰,并且有助于电子从阴极发射出来。
2.电子管工作原理电子管的工作原理是利用真空(或气体)导体管道中的热力电子注以及管内不同电极之间所产生的电场分布来对电子进行加速或制动,从而达到一定的放大、阻止和调制信号的目的。
每个电子管的工作原理都是相似的,由接口(Cathode)作为电子的起点,向阳极(Anode)运输,通过控制栅极(Grid)电压大小和极性来控制阳极上的电子通量大小和方向,来实现电导管道的控制。
虽然不同的电子管作用和电路结构有所不同,但是这些不同类型的电子管都有一个共同点,它们都在其他器件还没有发明出来之前就发挥了非常重要的作用。
3.电子管的分类根据其功能和特性的不同,电子管可以分为很多类,如放大器管、移相管、磁电显示管、X射线管、微波管、发光管等。
其中,放大器管是最为常见的一种电子管,用于放大信号,而微波管则主要用于高频、微波信号的放大和调制。
此外,发光管是一种能够将电信号转换为光信号的器件,用于发光显示和通讯传输等。
4.学习电子管的实际应用学习电子管的基础知识对于将来从事电子工程相关的职业是非常重要的。
电子管是很多电子设备的核心部件,如电视机、收音机、射频信号放大器等,同时,在某些特定的领域,如军事、通讯、医疗等也广泛应用电子管,这些领域的工作者需要了解电子管的基础知识。
电子管基础知识最适合初学者

电子管基础知识最适合初学者电子管是一种早期的电子元件,用于控制和放大电信号。
它由一个或多个真空管构成,其内部包含阴极、阳极、栅极和加速极等部件。
虽然现在电子管已经被晶体管和集成电路所取代,但是学习电子管的基础知识仍然是掌握电子学基础的重点。
本文将简单介绍电子管基础知识,特别适合初学者。
一、电子管的工作原理电子管的工作原理是利用真空管内部的电场控制电子的流动。
阴极是真空管内的电子源,会释放出大量的自由电子,这些电子被阳极吸引并流向阳极。
通过栅极的正、负电压来控制电子的流动,从而控制阳极电流大小。
当栅极施加的负电压足够大时,电子将被栅极吸引而无法流向阳极,从而实现电子管的关闭。
二、电子管的组成电子管包括阴极、阳极、栅极和加速极等组成部分。
其中,阴极是电子源,可以是热阴极或者冷阴极;阳极是电子管的输出端,也称为屏蔽极;栅极是控制电子流动的部分,可以是网格栅或者螺旋状的加速电极;加速极是用来改变电子流动速度的电极。
三、电子管的分类根据电子管的不同使用情况和电路要求,电子管可以分为各种类型,如三极管、四极管、光电管等。
其中,三极管是最常用的一种电子管,它由三个电极:阴极、阳极和控制极组成。
它的输出电流由控制极所施加的电压决定。
四、电子管的优点和缺点电子管的优点是:工作温度宽,能承受高电压,动态范围大,能够完成高功率放大等任务。
而电子管的缺点是:占用空间大,功耗高,使用寿命短等。
五、电子管的使用电子管通过控制和放大电信号,在无线电、电视、电视监督、音响、电话和计算机等各种领域中得到广泛应用。
六、电子管的维护和保养电子管应该放置在干燥、防尘的环境中,并定期进行清洗和保养。
清洗时,应该小心处理慢器和引线,避免损坏电子管的内部部件。
总之,电子管基础知识尤其适合初学者,它是理解电子学根本原理的重要组成部分。
通过对电子管的学习,学生能够更好地理解和应用电子学的基础知识,为以后更复杂的电路设计打下坚实的基础。
电子行业电子管基础知识

电子行业电子管基础知识什么是电子管?电子管,也被称为真空管,是一种用于控制电流的电子设备。
它由一个或多个电子极和一个真空腔组成,极内有阴极、阳极和控制极。
与半导体设备相比,电子管具有更高的功率和更好的线性特性。
电子管的结构和工作原理结构电子管的基本结构由以下几个主要部分组成:1.阴极(Cathode):阴极是电子管内的一个金属电极,它发射电子并用于提供电子到其他极的流动。
2.阳极(Anode):阳极是电子管内的另一个电极,它用于吸收来自阴极的电子流并产生输出信号。
3.控制极(Grid):控制极用于控制电子流的大小和方向,以调整阴极和阳极之间的电流。
4.真空腔(Vacuum chamber):真空腔包围着阴极、阳极和控制极,提供高真空环境以防止电子的散射和损失。
工作原理电子管是通过控制极上的外部电压来控制电子的流动。
当控制极施加正电压时,它排斥阴极上的电子,从而减少电子流到阳极的数量。
反之,当控制极施加负电压时,它吸引阴极上的电子,增加电子流的数量。
通过调整控制极的电压,可以精确地控制电子管的输出。
常见的电子管类型三极管三极管是一种最常见的电子管类型之一。
它由三个电极:阴极、阳极和控制极组成。
三极管通常用于放大信号和控制电流。
其中最常见的三极管类型是晶体管,它使用半导体材料构建。
二极管二极管是另一种常见的电子管类型。
它只有两个电极,即阴极和阳极。
二极管通常用于整流电流,将交流信号转换为直流信号。
它也常常用于保护电路免受反向电压的损害。
五极管五极管是一种包含五个电极的特殊电子管类型。
它们通常用于复杂的电路应用,可以实现更复杂的功能。
电子管的优缺点优点1.较高的功率:电子管可以处理高功率电流,适用于需要放大信号的应用。
2.良好的线性特性:电子管在放大信号时具有较好的线性特性,能够保持输入信号的准确度。
3.耐压能力强:电子管可以处理较高的电压,对电压变化较为稳定。
缺点1.较大尺寸:相比半导体器件,电子管的体积较大,需要更多空间进行安装。
电化学基础知识

电化学基础知识整理1.原电池原电池是将化学能转化为电能的装置原电池原理①、原电池:将化学能转变成电能的装置②、形成条件:①活动性不同的两电极连接;②电解质溶液插入其中并与电极自发反应;③电极形成闭合电路④能自发的发生氧化还原反应③、电极名称:负极:较活泼的金属电子流出的一极正极:较不活泼的金属或能导电的非金属电子流入的一极④、电极反应:负极:氧化反应,金属失电子正极:还原反应,溶液中的阴离子得电子或氧气得电子吸氧腐蚀⑤、电子流向:由负极沿导线流向正极锌-铜电池,负极-Zn,正极-Cu;负极:Zn-2e=Zn2+,电解质溶液——稀硫酸;正极:2H++2e=H2↑总反应:2H++Zn=H2↑+Zn2+注意:如果在铜锌的导线中加一个电流计,电流计指针会发生偏转;随时间的延续,电流计指针的偏转角度逐渐减小;盐桥的作用:盐桥起到了使整个装置构成通路的作用例如:铜锌原电池中用到了盐桥现象:⑴、检流计指针偏转,说明有电流通过;从检流计指针偏转的方向可以知道电流的方向是Cu极→Zn极;根据电流是从正极流向负极,因此,Zn极为负极,Cu极为正极;而电子流动的方向却相反,从Zn极→Cu极;电子流出的一极为负极,发生氧化反应;电子流入的一极为正极,发生还原反应;一般说来,由两种金属所构成的原电池中,较活泼的金属是负极,较不活泼的金属是正极;其原理正是置换反应,负极金属逐渐溶解为离子进入溶液;反应一段时间后,称重表明,Zn棒减轻,Cu棒增重;⑵、取出盐桥,检流计指针归零,重新放入盐桥,指针又发生偏转,说明盐桥起到了使整个装置构成通路的作用;盐桥是装有饱和KCl琼脂溶胶的U形管,溶液不致流出来,但离子则可以在其中自由移动;盐桥是怎样构成原电池中的电池通路呢Zn棒失去电子成为Zn2+进入溶液中,使ZnSO4溶液中Zn2+过多,带正电荷;Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO42-过多,溶液带负电荷;当溶液不能保持电中性,将阻止放电作用的继续进行;盐桥的存在,其中Cl-向ZnSO4 溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶在两个烧杯中分别放入锌片和锌盐溶液、铜片和铜盐溶液,将两个烧杯中的溶液用一个装满电解质溶液的盐桥如充满KCl饱和溶液和琼脂制成的胶冻连接起来,再用导线将锌片和铜片联接,并在导线中串联一个电流表,就可以观察到下面的现象:1电流表指针发生偏转,根据指针偏转方向,可以判断出锌片为负极、铜片为正极.2铜片上有铜析出,锌片则被溶解.3取出盐桥,指针回到零点,说明盐桥起了沟通电路的作用.2.化学电源化学电源又称电池,是一种能将化学能直接转变成电能的装置,它通过化学反应,消耗某种化学物质,输出电能;它包括一次电池、二次电池和燃料电池等几大类;判断一种电池的优劣或是否符合某种需要,主要看这种电池单位质量或单位体积所能输出电能的多少比能量,单位是W·h/kg, W·h/L,或者输出功率的大小比功率,W/kg,W/L以及电池的可储存时间的长短;除特殊情况外,质量轻、体积小而输出点能多、功率大、可储存时间长的电池,更适合使用者的需要;一一次电池一次电池的活性物质发生氧化还原反应的物质消耗到一定程度,就不能使用了;一次电池中电解质溶液制成胶状,不流动,也叫干电池;常用的有普通的锌锰干电池、碱性锌锰电池、锌汞电池、镁锰干电池等;例如;碱性锌锰干电池负极:Zn +2OH——2e—=ZnOH2正极:2MnO2+2H2O +2e—=2MnOOH +2OH—总反应:Zn +2MnO2+2H2O=2MnOOH +ZnOH2补充:银一锌电池电子手表、液晶显示的计算器或一个小型的助听器等所需电流是微安或毫安级的,它们所用的电池体积很小,有“纽扣”电池之称;它们的电极材料是Ag2O和Zn,所以叫银一锌电池;电极反应和电池反应是:负极:Zn+2OH-—2e—=ZnOH2正极:Ag2O+H2O+2e—=2Ag+2OH-总反应:Zn+Ag2O+H2O=ZnOH2+2Ag利用上述化学反应也可以制作大电流的电池,它具有质量轻、体积小等优点;这类电池已用于宇航、火箭、潜艇等方面;锂-二氧化锰非水电解质电池以锂为负极的非水电解质电池有几十种,其中性能最好、最有发展前途的是锂一二氧化锰非水电解质电池,这种电池以片状金属及为负极,电解活性MnO2作正极,高氯酸及溶于碳酸丙烯酯和二甲氧基乙烷的混合有机溶剂作为电解质溶液,以聚丙烯为隔膜,电极反应为:负极反应:Li=Li++e正极反应:MnO2+Li++e=LiMnO2总反应:Li+MnO2=LiMnO2该种电池的电动势为,重量轻、体积小、电压高、比能量大,充电1000次后仍能维持其能力的90%,贮存性能好,已广泛用于电子计算机、手机、无线电设备等;二二次电池二次电池又称充电电池或蓄电池,放电后可以再充电使活性物质获得再生;这类电池可以多次重复使用;铅蓄电池是最常见的二次电池,它由两组栅状极板交替排列而成,正极板上覆盖有PbO2,负极板上覆盖有Pb,电介质是H2SO4.铅蓄电池放电的电极反应如下:负极:Pbs+SO42-aq-2e-=PbSO4s氧化反应正极:PbO2s+SO42-aq十4H+aq+2e-=PbSO4s+2H2O l还原反应总反应:Pbs+PbO2s+2H2SO4aq=2PbSO4s十2H2O l铅蓄电池充电的反应是上述反应的逆过程:阴极:PbSO4s+2e-=Pbs+SO42-aq还原反应阳极:PbSO4s+2H2O l -2e-=PbO2s+SO42-aq十4H+aq氧化反应总反应:2PbSO4s十2H2O l =Pbs+PbO2s+2H2SO4aq可以把上述反应写成一个可逆反应方程式:Pbs+PbO2s+2H2SO4aq 2PbSO4s十2H2O l三燃料电池燃料电池是一种连续的将燃料和氧化剂的化学能直接转换成电能的化学电池;燃料电池的电极本身不包含活性物质,只是一个催化转化元件;它工作时,燃料和氧化剂连续的由外部供给,在电极上不断的进行反应,生成物不断地被排除,于是电池就连续不断的提供电能;⑴氢氧燃料电池以氢气为燃料,氧气为氧化剂,铂做电极,使用酸性电解质;它的的工作原理:负极:2H2 -4e-=4H+正极:O2十4H+aq+4e-=2H2O总反应:2H2十O2=2H2O⑵以碱性氢氧燃料电池为例,它的燃料极常用多孔性金属镍,用它来吸附氢气;空气极常用多孔性金属银,用它吸附空气;电解质则由浸有KOH溶液的多孔性塑料制成,其电极反应为:负极反应:2H2+4OH-=4H2O+4e -正极反应:O2+2H2O+4e -=4OH-总反应:2H2+O2=2H2O除氢气以外,烃、肼、甲醇、氨等液体或气体,均可作燃料电池的燃料;除纯氧外,空气中的氧气也可以做氧化剂;3甲烷燃料电池KOH做电解质用金属铂片插入KOH溶液作电极,又在两极上分别通甲烷燃料和氧气氧化剂;电极反应式为:负极:CH4+10OH--8e=CO32-+7H2O;正极:4H2O+2O2+8e=8OH;电池总反应式为:CH4+2O2+2KOH=K2CO3+3H2O知识拓展:海洋电池1991年,我国首创以铝-空气-海水为能源的新型电池,称之为海洋电池;它是一种无污染、长效、稳定可靠的电源;海洋电池彻底改变了以往海上航标灯两种供电方式:一是一次性电池,如锌锰电池、锌银电池、锌空气电池等;这些电池体积大,电能低,价格高;二是先充电后给电的二次性电源,如铅蓄电池,镍镉电池等;这种电池要定期充电,工作量大,费用高;海洋电池,是以铝合金为电池负极,金属Pt、Fe网为正极,用取之不尽的海水为电解质溶液,它靠海水中的溶解氧与铝反应产生电能的;我们知道,海水中只含有%的溶解氧,为获得这部分氧,科学家把正极制成仿鱼鳃的网状结构,以增大表面积,吸收海水中的微量溶解氧;这些氧在海水电解液作用下与铝反应,源源不断地产生电能;两极反应为:负极:Al:4Al-12e-=4Al3+正极:Pt或Fe等:3O2+6H2O十12e-=12OH-总反应式:4Al+3O2十6H2O=4AlOH3↓海洋电池本身不含电解质溶液和正极活性物质,不放入海洋时,铝电极就不会在空气中被氧化,可以长期储存;用时,把电池放入海水中,便可供电,其能量比干电池高20~50倍;电池设计使用周期可长达一年以上,避免经常交换电池的麻烦;即使更换,也只是换一块铝板,铝板的大小,可根据实际需要而定;海洋电池没有怕压部件,在海洋下任何深度都可以正常了作;海洋电池,以海水为电解质溶液,不存在污染,是海洋用电设施的能源新秀;3. 电解池一电解原理⑴.电解质溶液的导电我们知道,金属导电时,是金属内部的自由电子发生的定向移动,而电解质溶液的导电与金属导电不同;通电前电解质溶液中阴、阳离子在溶液中自由地移动;通电后在电场的作用下,这些自由移动的离子改作定向移动,带负电荷的阴离子由于静电作用向阳极移动,带正电荷的阳离子则向阴极移动;电极名称:电解池中与直流电源负极相连的电极叫阴极,与直流电源正极相连的电极叫阳极;物质能否导电是由其内部能否形成定向移动的自由电荷所决定的,对金属就是自由电子,而对电解质溶液就是自由移动的阴阳离子;⑵.电解①概念:使电流流过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫电解;②电子流动的方向:电子从外接直流电源的负极流出,经导线到达电解池的阴极,电解池溶液中的阳离子移向阴极,并在阴极获得电子而被还原,发生还原反应;与此同时,电解池溶液中的阴离子移向阳极,并在阳极上失去电子也可能是阳极很活泼而本身失去电子而被氧化,发生氧化反应;这样,电子又从电解池的阳极流出,沿导线而流回外接直流电源的正极;③电极反应的类型:阳极反应为氧化反应,阴极反应为还原反应,故而阴极处于被保护的状态,而阳极则有可能被腐蚀;⑶.电解池与原电池的联系与区别能量转变化学能转变为电解电能转变为化学能反应自发能自发进行的氧化还原反应反应一般不能够自发进行,需电解条件性举例Zn+CuSO4=Cu+ZnSO4CuClCu+Cl2↑2装置特点无外接直流电源有外接直流电源相似之处均能发生氧化还原反应,且同一装置中两个电极在反应过程中转移电子总数相等;重点出击:原电池与电解池的判断⑴判断下图是原电池、电解池还是电镀池,为什么2延伸有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏的能源;它依靠人体内含有一定浓度的溶解氧进行工作,下列各种叙述中错误的是A: Pt是正极B: 负极反应:C: 正极反应:D 正极反应:小结与反思:原电池、电解池、电镀池判定规律:若无外接电源,可能是原电池,然后依据原电池的形成条件分析判定;若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池;当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其余情况为电解池;4.实验分析:电解CuCl2溶液1电极材料阴极可用惰性电极,甚至较活泼的金属,但阳极需使用惰性电极,否则会发生氧化反应而溶解;2惰性电极一般指金、铂、石墨电极,银、铜等均是活性电极;3实验现象:通电后,电流表指针发生偏转,阴极石墨棒上析出一层红色固体,阳极表面有气泡放出,可闻到刺激性气味;4淀粉碘化钾试纸的作用:检验阳极产物是否为Cl2;使用时应先润湿并缠于玻棒端或用镊子夹持,作用时间不宜太久,否则变蓝后会被Cl2漂白;二、电解的应用I.电解饱和食盐水反应原理1.实验分析:电解饱和食盐水在U型管里装入饱和食盐水,滴入几滴酚酞试液,用碳棒作阳极、铁棒作阴极,将湿润的碘化钾淀粉试纸放在阳极附近,接通电源,观察管内发生的现象及试纸颜色的变化;注意:铁棒不可作阳极,否则发生Fe-2e-=Fe2+;碘化钾淀粉试纸需事先用水润湿;现象:阴、阳两极均有气体放出,阳极气体有刺激性气味,能使湿润的碘化钾淀粉试纸变蓝;阴极区域溶液变红;说明阴极区域生成物为碱性物质与H2,阳极产物是Cl2;2.电解饱和食盐水反应原理饱和食盐水成分:溶液存在Na+、Cl-、H+、OH-四种离子;电极反应式:阴极:2H++2e-=H2↑还原反应;阳极:2Cl--2e-=Cl2↑氧化反应;实验现象解释:1阴极区域变红原因:由于H+被消耗,使得阴极区域OH-离子浓度增大实际上是破坏了附近水的电离平衡,由于K W为定值,cH+因电极反应而降低,导致cOH-增大,使酚酞试液变红;2湿润的碘化钾淀粉试纸变蓝原因:氯气可以置换出碘化钾中的碘,Cl2+2KI=2KCl+I2,I2使淀粉变蓝;注意:如果试纸被熏蒸的太久,蓝色会因为湿氯气的漂白作用而褪去;电解饱和食盐水的总反应式:该电解反应属于放氢生碱型,电解质与水均参与电解反应,类似的还有K2S、MgBr2等;II、铜的电解精炼1.原理:电解时,用粗铜板作阳极,与直流电源的正极相连;用纯铜板作阴极,与电源的负极相连,用CuSO4溶液加入一定量的硫酸作电解液;CuSO4溶液中主要有Cu2+、、H+、OH-,通电后H+和Cu2+移向阴极,并在阴极发生Cu2++2e-=Cu,OH-和移向阳极,但阳极因为是活性电极故而阴离子并不放电,主要为阳极活泼及较活泼金属发生氧化反应而溶解,阳极反应:Cu-2e-=Cu2+;电解过程中,比铜活泼的Zn、Fe、Ni等金属杂质,在铜溶解的同时也会失电子形成金属阳离子而溶解,此时阴极仍发生Cu2++2e-=Cu,这会导致电解液浓度不发生变化;Ag、Au不如Cu易失电子,Cu溶解时它们以阳极泥沉积下来可供提炼Au、Ag等贵金属;该过程实现了提纯铜的目的;离子在电极上得失电子的能力与离子的性质、溶液的浓度、电流的大小、电极的材料等都有关系;中学阶段我们一般只讨论电极材料的性质、离子的氧化性强弱和还原性强弱对它们得失电子能力的影响2.电极反应中得失电子的规律1阳极上失电子的规律应首先看电极材料是惰性电极,还是活性电极,如是惰性电极,则由溶液中的阴离子失去电子,阴离子的还原性越强越易失电子,阴离子的放电顺序为:S2->I->Br->Cl->OH->含氧酸根离子;如是活性电极,则这些金属首先失去电子进入溶液,此时溶液中其他离子不再失电子;2阴极上得电子的规律阴极上只能由溶液中阳离子获得电子,阳离子氧化性越强越易得电子,阳离子放电顺序一般为:Ag+>Hg2+>Fe3+>Cu2+>H+酸>Fe2+>Zn2+>H+盐溶液3变价的金属Fe在作阳极发生氧化反应时电极反应为:Fe-2e-=Fe2+III、电解冶炼铝工业上,用纯净的氧化铝为原料,采用电解的方法制取铝;纯净的氧化铝熔点很高2045℃,很难熔化,现在都用熔化的冰晶石Na3AlF6作熔剂,使氧化铝在1000℃左右溶解在液态的冰晶石里,成为冰晶石和氧化铝的熔融体,然后进行电解;电极反应式:阴极:4Al3++12e-=4Al阳极:6O2-+12e-=3O2↑总反应式:2Al2O34Al+3O2↑只能电解Al2O3,不能是AlCl3在冶炼铝时,阳极产生氧气,石墨阳极在如此高温条件下,将不断被氧气氧化而消耗,因而需不断补充石墨阳极;三、电镀铜1.原理:电镀时,一般都是用含镀层金属离子的电解质溶液为电镀液;把待镀金属制成品浸入电镀液中与直流电源的负极相连,作为阴极,而用镀层金属为阳极,阳极金属溶解在溶液中成为阳离子,移向阴极,并在阴极上被还原成金属析出;电镀铜规律可概括为“阳极溶解,阴极沉积,电解液不变”;工业上电镀常使用有毒电镀液,因此电镀废水应回收有用物质、降低有害物质含量后,达标排放,以防污染环境;2.实验分析:电镀铜实验1待镀件需酸洗去除表面的锈;2电镀液CuSO4中加氨水制成铜氨溶液以降低Cu2+浓度使镀层光亮;四、电解质溶液电解时均为惰性电极,pH变化情况,电解液复原所需加入物质及电解类型;1、1分解水型:含氧酸、强碱、活泼金属的含氧酸盐如NaOH、H2SO4、K2SO4等的电解;阴极:4H++4e-=2H2↑阳极:4OH--4e-=O2↑+2H2O总反应:2H2O 2H2↑+O2↑阴极产物:H2;阳极产物:O2;电解质溶液复原加入物质:H2O;pH变化情况:原来酸性的溶液pH变小,原来碱性的溶液pH变大,强酸含氧酸强碱的正盐溶液pH 不变;2分解电解型:无氧酸除HF外、不活泼金属的无氧酸盐氟化物除外的电解,如HCl、CuCl2等;阴极:Cu2++2e-=Cu阳极:2Cl--2e-=Cl2↑总反应:CuCl2 Cu+Cl2↑阴极产物:酸为H2,盐为金属;阳极产物:卤素等非金属单质;电解液复原加入物质为原溶质,如电解CuCl2溶液,需加CuCl2;pH变化情况:如电解无氧酸溶液pH变大但不会超过7;如为盐溶液的电解则视无氧酸根的情况而定;3放氢生碱型:活泼金属的无氧酸盐氟化物除外溶液的电解,如NaCl、MgBr2等;阴极:2H++2e-=H2↑阳极:2Cl--2e-=Cl2↑总反应:2NaCl+2H2O2NaOH+H2↑+Cl2↑阴极产物:碱和H2;阳极产物:卤素等非金属单质;电解饱和食盐水的产物分别为NaOH和H2以及Cl2;电解液复原加入物质为卤化氢;电解饱和食盐水,要使电解质溶液复原需加入HCl;pH变化情况:电解液pH显着变大4放氧生酸型:不活泼金属的含氧酸盐溶液的电解,如CuSO4、AgNO3等;阴极:2Cu2++4e-=Cu阳极:4OH--4e-=O2↑+2H2O总反应:2CuSO4+2H2O2Cu+O2↑+2H2SO4阴极产物:析出不活泼金属单质;阳极产物是该盐对应的含氧酸和氧气,本例中分别是Cu以及H2SO4、O2.电解液复原加入物质为不活泼金属的氧化物金属价态与原盐中相同;如电解CuSO4溶液,复原需加入CuO;pH变化情况:溶液pH显着变小;规律变化液复原法解反应类型电解质类型解水氧酸质电解水-- > H2 + O2解稀H2SO4低H2O碱溶液质电解水-- > H2 + O2解NaOH溶液高H2O泼金属含氧酸盐质电解水-- > H2 + O2解Na2SO4溶液变H2O练习:电解液中含有K+、Cl —、SO42—、OH —少量、Cu2+、H+少量,用两个石墨棒作电极,电解时,阳极上析出_______,电极反应式是______________;阴极析出_______,电极反应式是______________;改用两个铜棒作电极,则阳极变化是______________________,电极反应式是______________;阴极上析出_______,电极反应式是______________;小结与反思:关键是放电顺序:阳极:活性电极>S2- >I- >Br- >Cl->OH - >含氧酸根>F-阴极:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+> Fe2+> Zn2+ > Al3+> Mg2+> Na+> Ca2+> K+4、金属的电化学腐蚀与防护一、金属腐蚀的类型:1、化学腐蚀:金属与接触到的物质直接发生化学反应而引起的腐蚀;例如铁丝在氧气中燃烧、铜在氯气中燃烧等;2、电化学腐蚀:不纯金属与电解质溶液接触时比较活泼的金属失电子而被氧化的腐蚀;二、金属的电化学腐蚀:金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程;不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀;钢铁在潮湿的空气中所发生的腐蚀是电化学腐蚀最突出的例子;金属腐蚀的本质:2金属腐蚀的本质:M—ne—=Mn+三、钢铁的电化学腐蚀1析氢腐蚀钢铁表面吸附水膜酸性较强时阳极Fe:Fe-2e-=Fe2+Fe2++2H2O=FeOH2+2H+阴极杂质:2H++2e-=H2电池反应:Fe+2H2O=FeOH2+H2↑由于有氢气放出,所以称之为析氢腐蚀;2吸氧腐蚀钢铁表面吸附水膜酸性较弱时阳极Fe:Fe—2e-=Fe2+阴极:O2+2H2O+4e-=4OH-总反应:2Fe+O2+2H2O=2FeOH2由于吸收氧气,所以也叫吸氧腐蚀;析氢腐蚀与吸氧腐蚀生成的FeOH2被氧所氧化,生成FeOH3脱水生成Fe2O3 铁锈;钢铁制品在大气中的腐蚀主要是吸氧腐蚀;Fe+2H2O=FeOH2+H2↑ O2+2H2O+4e-→4OH-2Fe+O2+2H2O=2FeOH2 2H++2e-→H2析氢腐蚀主要发生在强酸性环境中,而吸氧腐蚀发生在弱酸性或中性环境中;化学腐蚀和电化学腐蚀的区别和联系:相互联系化学腐蚀和电化学腐蚀往往同时发生四、金属的防护1、牺牲阳极的阴极保护法正极:要保护的金属负极:比要保护金属活泼的金属2、外加电流的阴极保护法比组成原电池防护更好阴极:被保护的金属阳极:惰性电极两者均存在于电解质溶液中接上外接直流电源;3、覆盖保护膜及其他保护方法覆盖保护膜涂油漆,电镀,钝化等改变金属的内部结构钢→不锈钢,在钢中加入镍和铬习题指导1 解题步骤方法①判断两池原电池还是电解池—②标注电极名称—③写出电极反应式—根据电极产物、溶液成分变化—④描述或解释现象或进行有关计算;练1-01 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中如图所示平面图,经过一段时间后,首先观察到溶液变红的区域是 BA、Ⅰ和Ⅲ附近B、Ⅰ和Ⅳ附近C、Ⅱ和Ⅲ附近D、Ⅱ和Ⅳ附近解析①判两池:通常有外接电源的装置是电解池,故左图为电解池,根据右图为两个活性不同金属浸在电解质溶液中可判断为原电池;②标电极名:左图由外接电源极性可知I为阴极,II为阳极;右图因Zn比Fe活泼,故III为负极,IV为正极;③写电极反应:左图中,阳极II:金属Fe优先氧化Fe-2e-=Fe2+;阴极I:水中氢放电:2H++2e-=H2;④现象及解释:因I区OH-增生,碱性,使酚酞变红;又右图,正极IV上电极反应:O2+4e-+2H2O = 4OH- 吸氧腐蚀,该区域呈碱性使酚酞变红,B入选;1-02 如图甲乙两池分别以碳棒、铂条、铝条、镁条为电极,并用导线相连接,以NaCl、NaOH溶液为电解溶液,有关该装置的描述正确的是 DA.乙池中,Mg极的电极反应是 Mg-2e-=Mg2+B.甲池中,Pt极的电极反应是 2Cl—2e-=Cl2↑C.随着反应的进行.乙池中 nNaOH保持不变D.反应过程中,甲池中两极附近溶液 PH C <PHPt解析先判两池,乙为原电池,甲为电解池;乙池中,因为在NaOH溶液中Al比Mg易失电子,故Al为原电池的负极,其电极反应式为:Al-3e-+4OH-= =AlO2-+2H2O ;Mg为正极,其电极反应式为:3H2O+3e-=↑+3OH- ;甲池中,Pt电极为阴极: 2H+ +2e- =H2↑, 碳棒C电极为阳极2Cl- -2e- =Cl2↑,电解后溶液为NaOH 溶液;练1-03如图A、B为两个串联的电解池,已知B池中c为铁,d为石墨,电解质溶液为NaCl溶液;试回答:1若A池为用电解原理精练铜装置,则a电极名称为阴极,电极材料是精铜,电极反应式为Cu2++2e-=Cu ,电解质溶液可以是 CuSO4溶液;2B池中c极Fe电极反应式为 2H++2e-=H2↑ 2H2O+2e-=H2 +2OH- ,若在B池中加入少量酚酞试液,开始电解一段时间,铁极附近呈红色;3若A池a极增重12.8g,则B池d极石墨上放出气体在标况下的体积为 4.48L ;电解后,若B池余下的溶液为 400ml,则溶液的PH值是 14 ;练4-04 金属镍有广泛的的用途;粗镍中含有少量的 Fe、Zn、Cu、Pt等金属杂质,可电解法制备高纯度原镍已知:氧化性:Fe2+<Ni2+<Cu2+, 下列叙述正确的是 DA.阳极发生还原反应,其电极反应式是Ni2+ + 2e- = Nix y a b乙溶液B .电解过程中,阳极质量的减少与阴极质量的增加相等C .电解后,溶液中存在的阳离子只有 Fe 2+ 、Zn 2+D .电解后,电解模底部阳极泥中中存在 Cu 、Pt解析 这是电解的过程,阳极发生的是氧化反应,A 错;阳极:Zn-2e - = Zn 2+ Fe-2e - = Fe 2+ Ni-2e -=Ni 2+ ,Pt 为惰性金属,不会放电,而Cu 要在金属Ni 全部氧化为Ni 2+后才能放电,但此时Cu 已没有了支撑物了,结果和Pt 一起落下,形成阳极泥,故 D 正确; 阴极:因氧化性Ni 2+>Fe 2+>Zn 2+ ,所以只有 Ni 2++2e -=Ni ,可见,阳极质量减少的是“溶解”下的Zn 、Fe 、Ni,而阴极质量增加的只是析出的镍,两者质量是不相等的,故 B 错;;电解后,溶液中除留下 Fe 2+、Zn 2+ 外,还有 Ni 2+ ,C 也错; 练1-05 铅蓄电池是典型的可充型电池,它的正负极格板是惰性 材料,电池总反应式为: Pb+PbO 2+4H ++2SO2-42PbSO 4+2H 2O请回答下列问题不考虑氢、氧的氧化还原: 1 放电时:正极的电极反应式是______________;电解液中H 2SO 4的浓度将变________;当外电路通过1 mol 电子时,理论上负极板的质量增加________g;2 在完全放电耗尽PbO 2和Pb 时,若按题27图连接,电解一段时间后,则在A 电极上生成__________、B 电极上生成________,此时铅蓄电池的正负极的极性将________________________;解析:铅蓄电池的负极是铅Pb,正极是二氧化铅PbO 2;放电时电极反应: 正极 A-PbO 2 PbO 2 + 2e - + 2H ++ SO 42- == PbSO 4+ H 2O 与常见电池不同,铅蓄电池放电时正极材料PbO 2本身参与了电极反应 负极 B-Pb Pb - 2e - + 2H ++ SO 42- == PbSO 4+ H 2O可见,当通过2mole -时,负极1molPb 变为1mol PbSO 4沉积在负极板上,既净增加1molSO 4,所以当外电路通过1 mol 电子时,理论上负极板的质量增加 49g;因放电时要消耗H 2SO 4,故;电解液中H 2SO 4的浓度将变小; 完全放电后两极材料都有变为硫酸铅PbSO 4,外接电源时,发生电解过程,电极反应如下: 阴极A-PbSO 4 PbSO 4 + 2e -+ = Pb + SO 42- ,A 电极上生成 Pb 阳极B-PbSO 4 PbSO 4 - 2e -+ 2H 2O = PbO 2 + + 4H ++ SO 42-,B 电极上生成 PbO 2 此时铅蓄电池的正负极的极性将 对换; 2、电极名称判断法根据两极金属相对活性判定原电池的电极名称,根据X 极所连接在的外接电源极性“+”或“-”判定电解池的电极名称;根据电子或电流流向或测电极电势高低等电学原理判断电极名称;此外根据X 极发生氧化还是还原,移向X 极的离子是阳离子还是阴离子,X 极增重还是减重,X 极区PH 值是升高还是降低等判定X 电极的名称;但要注意X 极指的是在原电池还是电解池;说明:化学上规定,凡发生氧化变化的电极均为阳极,而发生还原的电极均为阴极;据此,从发生的化学变化角度看,原电池中的负极-又叫阳极,正极+又叫阴极;练1-06 x,y 分别为直流电源的两极,通电后,发现a 极质量加,b 极处有无色无味气体放出,符合此情况的是: A备选项a 电极 B 电极 x 电极 溶液 A 锌Zn 石墨C 负 CuSO 4 B石墨C石墨C负NaOH。
阳极培训课件

阳极培训课件阳极培训课件阳极培训课件是一种用于培训和教育的工具,旨在向人们介绍阳极的概念、用途和操作方法。
阳极作为一种重要的电化学工具,在许多领域中都有广泛的应用,包括金属腐蚀防护、水处理、电池制造等。
阳极培训课件的目的是帮助学习者理解阳极的原理和应用,并提供相关的操作指南和安全注意事项。
一、阳极的概念和原理阳极是电化学中的一个重要概念,它是电流从电源流向电解质中的电极。
在阳极上发生氧化反应,释放电子和阳离子。
阳极的反应可以是金属的氧化、水的电解等。
阳极的反应过程是电流通过的地方,因此阳极在电化学中起到了重要的作用。
阳极的原理可以通过电化学平衡来解释。
在电化学平衡中,阳极上的氧化反应和阴极上的还原反应达到了平衡。
阳极上的氧化反应产生的阳离子通过电解质传递到阴极,参与阴极上的还原反应。
这种平衡状态使得电流能够稳定地通过电解质,实现电化学反应。
二、阳极的应用领域阳极在许多领域中都有广泛的应用。
其中最常见的应用之一是金属腐蚀防护。
在金属结构中,阳极可以被用作保护层,吸收腐蚀过程中产生的电流,从而延缓金属的腐蚀速度。
此外,阳极还可以应用于水处理领域。
在水处理过程中,阳极可以用来去除水中的有害物质,如重金属离子和有机物。
此外,阳极还可以应用于电池制造、电镀、电解制氧等领域。
三、阳极的操作方法在使用阳极之前,必须了解正确的操作方法,并严格遵守相关的安全注意事项。
首先,必须确保阳极与电源的连接正确无误。
阳极通常与正极连接,而阴极与负极连接。
其次,必须选择适当的电解质。
不同的反应需要不同的电解质,因此在使用阳极之前必须选择合适的电解质。
此外,还需要控制电流的大小和方向,以确保阳极的正常运行。
四、阳极的安全注意事项在使用阳极时,必须注意安全。
首先,必须戴好防护眼镜和手套,以防止溅射物伤害眼睛和皮肤。
其次,必须确保工作环境通风良好,以防止有害气体的积聚。
此外,还需要定期检查阳极的状态,以确保其正常运行。
如果发现阳极出现损坏或故障,必须及时更换或修理。
电子管基础知识大全

电子管的基本参数:1.灯丝电压:V;2.灯丝电流:mA;3.阳极电压:V;4.阳极电流:mA;5.栅极电压:V;6.栅极电流:mA;7.阴极接入电阻:Ω;8.输出功率:W;9.跨导:mA/v; 10.内阻: kΩ。
几个常用值的计算:放大因数μ=阳极电压Uak/栅极电压Ugk表示在维持阳极电流不变的情况下,阳极电压与栅极电压的比值。
跨导 S=阳极电流Ia/栅极电压Ugk表示在维持阳极电压不变的情况下,栅极电压若有一个单位(如mV)的电压变化时将引起阳极电流有多少个单位的变化。
内阻 Ri=栅极电压Uak/阳极电流Ia表示在维持栅极电压不变的情况下,阳极电流若有一个单位(如mA)的电压变化时将引起阳极电压有多少个单位的变化。
上面的几个值也可以表述为放大因数μ=跨导S乘以内阻Ri先说这些,各位要是觉得可以瞧下去,下回再说几种常见的管型和结构工作原理等等等等。
这回就先说电子管的构造和工作原理吧。
照顾一下咱的老习惯,以后所涉及的管型和单元电路均以国产管为例,在最后我会结合自己的使用体会简要说说部分常见的国产管和进口管的各自特点以及代换。
在讨论之前咱们先得把讨论的范围作一界定,即仅限于真空式电子管。
不管是二极,三极还是更多电极的真空式电子管,它们都具有一个共同结构就是由抽成几近真空的玻璃(或金属,陶瓷)外壳及封装在壳里的灯丝,阴极和阳极组成。
直热式电子管的灯丝就是阴极,三极以上的多极管还有各种栅极。
先说二极管:考虑一块被加热的金属板,当它的温度达到摄氏800度以上时,会形成电子的加速运动,以至能够摆脱金属板本身对它们的吸引而逃逸到金属表面以外的空间。
若在这一空间加上一个十几至几万伏的正向电压(踏雪留痕在上面说到的显象管,阳极上就加有7000--27000伏的高压),这些电子就会被吸引飞向正向电压极,流经电源而形成回路电流。
把金属板(阴极),加热源(灯丝),正向电压极板(阳极)封装在一个适当的壳里,即上面说的玻璃(或金属,陶瓷)封装壳,再抽成几近真空,就是电子二极管。
高中化学选择性必修一第4章第2节 电解池 基础知识讲义

第二节电解池一、电解池(一)电解的定义:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(二)电解池的定义:将电能转变为化学能的装置,也称电解槽(三)构成条件:两极一液一电源,氧化还原是条件注:电解法是一种强氧化还原手段,可以完成一个不自发的氧化还原反应1、两极(1)阴极——负极——阳离子——还原反应(2)阳极——正极——阴离子——氧化反应注:阳极分为两种:(1)活性电极:电极自身放电即电极自身发生氧化反应,如:Fe、Cu、Ag(2)惰性电极:电极自身不反应,由电解质中的阴离子发生氧化反应。
如:Au、Pt、C2、电解质溶液3、外接电源4、能发生氧化还原反应:可以是自发的反应,也可以是非自发的反应(四)工作原理(以电解CuCl2溶液为例)电极名称阴极阳极电极材料石墨石墨电极反应Cu2++2e-=Cu 2Cl-—2e-=Cl2↑反应类型还原反应氧化反应总反应CuCl2Cu+ Cl2↑反应现象有红色物质产生有刺激性气味的气体,使湿润的淀粉KI试剂变蓝电子流向负极→阴极,阳极→正极电流流向正极→阳极,阴极→负极离子走向阳离子→阴极,阴离子→阳极注:放电:离子得失电子发生氧化还原反应的过程(五)电极的放电顺序1、阳极:(1)活性电极:Fe、Cu、Ag。
反应方式:M-ne-=M n+Fe-2e- =Fe2+、Cu-2e- =Cu2+、Ag-e- =Ag+(2)惰性电极:Au、Pt、C。
溶液中的阴离子放电常见放电顺序:活性电极>S2- >I- >Br- >Cl- >OH- >含氧酸根>F-2I-2e-=I2 2Br-2e-=Br22Cl-2e-=Cl22H2O—4e-=4H++O2↑2、阴极:常见阳离子放电顺序:金属活动性顺序的倒序Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+ 最常见的阴极产物有Ag、Cu、H2Ag++e-= Ag Cu2++2e-=Cu 2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-注:在电镀时,通过控制条件,Fe2+和Zn2+的得电子能力会强于酸中的H+,即浓度越大,得电子能力越强(六)电解方程式的书写看电极→找离子→分阴阳→排顺序→写反应注:1、必须在总反应方程式的“==”上标明“通电”或“电解”2、只是电解质被电解,电解化学方程式中只写电解质及电解产物,无关的不写注:常考的电解池反应式:惰性电极的情况下,电解强碱、含氧酸、活泼金属含氧酸盐(KNO3、Na2SO4)、HCl、CuCl2、NaCl、MgCl2、CuSO4、AgNO31、惰性电极的情况下,电解强碱、含氧酸、活泼金属含氧酸盐(KNO3、Na2SO4):阴极:2H2O+2e-=H2↑+2OH- 阳极:2H2O—4e-=4H++O2↑总反应:2H2O电解2H2↑+O2↑2、惰性电极的情况下,电解HCl:阴极:2H++2e-=H2↑阳极:2Cl--2e-=Cl2↑总反应:2HCl电解H2↑+Cl2↑3、惰性电极的情况下,电解CuCl2溶液:阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑总反应:CuCl2电解Cu+ Cl2↑4、惰性电极的情况下,电解NaCl溶液:阴极:2H2O+2e-=H2↑+2OH- 阳极:2Cl--2e-=Cl2↑总反应:2H2O+2Cl-电解Cl2↑+H2↑+2OH-5、惰性电极的情况下,电解MgCl2溶液:阴极:2H2O+2e-=H2↑+2OH- 阳极:2Cl--2e-=Cl2↑总反应:Mg2++2H2O+2Cl-电解Cl2↑+H2↑+ Mg (OH)26、惰性电极的情况下,电解CuSO4溶液:阴极:Cu2++2e-=Cu 阳极:2H2O—4e-=4H++O2↑总反应:2Cu2++2H2O电解2Cu+4H++O2↑7、惰性电极的情况下,电解AgNO3溶液:阴极:Ag++e-= Ag 阳极:2H2O—4e-=4H++O2↑总反应:4Ag++2H2O电解4Ag +4H++O2↑(八)电解池与原电池的比较原电池电解池能量转化化学能→电能电能→化学能反应能否自发进行自发进行的氧化还原反应非自发进行的氧化还原反应构成装置两极、电解质、导线两极、电解质、电源电极名称负极正极阴极(与负极相连)阳极(与正极相连)电极反应失电子—氧化反应得电子—还原反应得电子—还原反应失电子—氧化反应电子流向负极→外电路→正极负极→阴极,阳极→正极电流流向正极→外电路→负极正极→阳极,阴极→负极离子流向阳离子→正极,阴离子→负极阳离子→阴极,阴离子→阳极小结:原电池与电解池的电极反应:负阳氧,正阴还原电池的离子走向:正向正,负向负;电解池的离子走向:阴阳相吸二、电解原理的应用(一)氯碱工业——电解饱和食盐水制烧碱和氯气1、原理:阴极:2H2O+2e-=H2↑+2OH-阳极:2Cl-—2e-=Cl2↑总反应:2Cl―+2H2O电解2OH―+Cl2↑+H2↑2、现象及检验:阴极:有无色、无味气泡产生,滴加酚酞——变红阳极:有黄绿色、刺激性气味的气体产生,使湿润的淀粉KI试纸变蓝3、阳离子交换膜的作用(1)将电解池隔成阳极室和阴极室,只允许阳离子(Na+、H+)通过,而阻止阴离子(Cl-、OH-)和气体通过(2)既能防止阴极产生的H2和阳极产生的Cl2相混合,而引起爆炸,又能避免Cl2和NaOH 作用生成NaClO而影响烧碱的质量(二)电镀1、定义:利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺2、目的:使金属增强抗腐蚀能力,增加美观和表面硬度3、电镀池的构成:阴极:待镀金属——镀件阳极:镀层金属(通常是一些在空气或溶液里不易起变化的金属(如Cr、Ni、Ag和合金(如黄铜)))电解质溶液:含有镀层金属阳离子的电解质溶液——电镀液4、实例:铁上镀铜5、特点:一多一少一不变一多:阴极上有镀层金属沉积一少:阳极上镀层金属溶解一不变:电解质溶液浓度不变(三)电解精炼铜1、装置:如图2、原理:阳极:Cu—2e-=Cu2+(Zn—2e-=Zn2+、Fe—2e-=Fe2+、Ni—2e-=Ni2+)阳极泥成分:Au、Ag阴极:Cu2++2e-=Cu(电解质溶液浓度减小,因为m Cu(溶解)< m Cu(析出))(四)电冶金1、金属冶炼:使矿石中的金属离子获得电子变成金属单质的过程。
阳极培训课件

通过测量阳极材料在交流电场下的阻抗响应,了解其内部电荷转移 和物质传输过程。
实际应用效果评估
电池组装与测试
将阳极材料组装成实际电池,进 行充放电循环测试,以评估其在
实际应用中的性能表现。
安全性评估
对含有阳极材料的电池进行安全 性测试,如过充、过放、高温等 条件下的性能表现,以确保其在
预处理
破碎、筛分、干燥等
压制成型技术
压制方式
干压、湿压、等静压等
成型模具设计
形状、尺寸、精度等
压制参数
压力、时间、温度等
烧结工艺及参数控制
烧结方式
01
无压烧结、热压烧结等
烧结温度曲线
02
升温速率、保温时间、降温速率等
气氛控制
03
真空度、气氛类型、气氛压力等
设备结构与维护保养
设备结构
主机、液压系统、电气控制系统 等
金属基复合材料研究进展
01
02
03
铝基复合材料
通过向铝基体中加入增强 相,如陶瓷颗粒、碳纤维 等,提高阳极的力学性能 和耐腐蚀性。
镁基复合材料
利用镁的轻质特性,结合 增强相的强化作用,制备 出高性能的阳极材料。
钛基复合材料
钛具有优异的耐腐蚀性和 生物相容性,通过复合其 他材料可进一步提高阳极 性能。
在高温或长时间使用过程中,阳极材料的 尺寸稳定性对于电池性能至关重要,需要 通过专业设备进行测量。
化学性能测试
成分分析
通过光谱、能谱等方法对阳极材料进 行成分分析,了解其化学组成和元素 含量。
pH值测试
耐腐蚀性测试
阳极材料需要具有良好的耐腐蚀性以 应对电池内部复杂的化学环境,可以 通过浸泡试验或电化学腐蚀试验进行 评估。
应用电化学-1-1-基础知识

9
离子迁移方向:
阴离子迁向阳极
A n io n A n o d e
阳离子迁向阴极
C a tio n C a th o d e
2021/8/2
10
原电池(galvanic cell)
Zn电极:
Zn(S)→Zn2++2e发生氧化作用,是阳极。电 子由Zn极流向Cu极,Zn极电 势低,是负极。
2021/8/2
⒈ 是电化学上最早的定量的基本定律,揭示了 通入的电量与析出物质之间的定量关系。 ⒉ 该定律在任何温度、任何压力下均可以使用。 ⒊ 该定律的使用没有什么限制条件。
= 1 7 6 3 C
(2 )t Q I 0 1 .7 0 6 2 3 5 C A 7 .0 5 1 0 4s
(3) n(O2)1 4n(1 3Au) =1 4197.01g .20 m g ol1/34.57103m ol
2021/8/2
18
荷电粒子基本单元的选取
解法二
取基本粒子荷3个基本电荷:即
解质溶液、熔融电解质等。
A.正、负离子作反向移动而导电 B.导电过程中有化学反应发生
C.温度升高,电阻下降 D.导电总量分别由正、负离子分担
*固体电解质,如 AgBr、PbI2等,也属于离子导体,但 它导电的机理比较复杂,导电能力不高,一般以讨论电
解质水溶液为主。
2021/8/2
7
正极、负极
正极: 电势高的极称为正极,电流从正极
⑴ 通入电量 Q ;
⑵ 通电时间 t ;
⑶ 阳极上放出氧气的物质的量。
2021/8/2
17
荷电粒子基本单元的选取
解法一
取基本粒子荷单位电荷:即
碳素生产基础知识

1.铝电解用阳极炭块的主要作用是什么?答:炭块在电解槽上起到导电和参与电化学反应的作用。
2.炭素阳极制品的特点有哪些?答:(1)耐高温,导电、导热性好(2)较低的热膨胀系数(3)化学性能稳定。
3.什么叫煅烧?答:炭素材料在基本隔绝空气的条件下进行高温热处理的过程称为煅烧。
4.石油焦煅烧的目的是什么?答:(1)排除原料中的水份和挥发份(2)提高原料的密度和机械强度(3)改善原料的导电性能(4)提高原料的抗氧化性能5. 回转窑内三个温度带是什么?答:预热带、煅烧带、冷却带6. 石油焦的挥发份在煅烧过程中的挥发机理如何?答:在500℃~600℃的时候就开始少量排出;800℃时是排出的高峰;1150~1250℃基本排完。
7.正常生产中,回转窑几个关键温度应控制在什么范围内?答:窑头:<900℃。
窑尾及沉灰室出口:介于900~1100℃之间煅烧带:介于1150℃~1250℃之间8.回转窑的特点?答:优点:产能大,结构简单,对原料适应性好,便于实现自动化控制。
缺点:碳质烧损较大一般在8~11%。
9.回转窑二、三次风的作用是什么?答:它的作用是给窑内补充空气,助燃达到充分燃烧。
10. 炭素分公司回转窑的规格和产能是多少?答:规格ф2.6/2.14×50m煅后焦产能:9t/h11. 煅烧的工艺流程?答:煅前仓→回转窑→冷却窑→煅后仓12. 回转窑烟气走向?答:回转窑→沉灰室→余热锅炉→除尘器→引风机→烟囱13. 煅前给料的粒度要求?答:原料进入回转窑以前先要预碎到50±20mm的粒度。
14. 冷却窑加直接冷却水的目的是什么?答:使物料急剧冷却,防止氧化,减少烧损。
15. 石油焦原料的设计标准是什么?答:应符合SH/T0527-1992中2号A级焦质量标准16. 煅烧回转窑密封采用何种形式的密封?答:窑头密封采用重锤压环式密封,窑尾密封采用迷宫式密封环17.双齿辊破碎机主要由哪些部件组成?答:该机主要由机架,辊轴,传动部分,罩壳等组成。
放射医学技士基础知识模拟试卷37(题后含答案及解析)

放射医学技士基础知识模拟试卷37(题后含答案及解析) 题型有:1. A1型题1.基本呼吸节律产生于A.延髓B.脊髓C.小脑D.间脑E.大脑皮质正确答案:A2.X线管靶面物质原子内沿一定轨道绕原子核旋转的是A.质子B.中子C.光子D.电子E.介子正确答案:D3.口咽与喉咽分界的标志为A.软腭平面B.第6颈椎C.会厌上缘D.环状软骨E.咽峡正确答案:C4.在X线摄影中,光电效应的主要负面影响是A.产生散射B.产生灰雾C.增加X线对比度D.患者接受照射量多E.产生辐射剂量正确答案:D5.下列器官中可分为底、体、颈三部分的是A.胃B.胰C.肝D.膀胱E.胆囊正确答案:E6.下列肌肉的组织结构属平滑肌的是A.心肌B.胸大肌C.咀嚼肌D.瞳孔括约肌E.表情肌正确答案:D7.影响X线衰减的因素不包括A.X线的能量B.照射方式C.原子序数D.物质密度E.吸收物质的每克电子数正确答案:B8.有关小腿骨的叙述,错误的是A.胫骨位于小腿的内侧B.腓骨下端膨大形成内踝C.腓骨上端膨大称腓骨头D.胫骨上端前方的隆起称为胫骨粗隆E.胫骨上端两侧突出形成内、外侧髁正确答案:B9.放射工作条件在年有效剂量当量很少超过5mSv/年时,定为A.甲种工作条件B.乙种工作条件C.丙种工作条件D.丁种工作条件E.戊种工作条件正确答案:C10.一般诊断X线摄影时,使用的滤过板是A.铝板B.铁板C.木板D.铜板E.铅板正确答案:A11.最明显而固定的直肠横襞距肛门约A.4cmB.5cmC.6cmD.7cmE.8cm正确答案:D12.在诊断能量范围内,X线与物质作用时,不发生的效应是A.光电效应B.康普顿效应C.相干散射D.康普顿散射E.电子对效应正确答案:E13.男性生殖腺是A.前列腺B.睾丸C.输精管D.精囊E.附睾正确答案:B14.副交感神经兴奋可使A.瞳孔扩大B.心脏活动抑制C.胃肠运动减弱D.支气管舒张E.汗腺分泌增多正确答案:B15.属于上消化道的是A.结肠B.盲肠C.十二指肠D.回肠E.直肠正确答案:C16.下列关于X线的叙述,正确的是A.管电压越高,特征辐射的波长越短B.连续辐射的波长仅与管电压有关C.管电压升高时连续辐射所占比例增加D.管电压的高低与特征辐射无关E.特征辐射是一组连续混合射线正确答案:B17.有关连续X线最短波长的叙述,正确的是A.与管电流成正比B.与管电压成反比C.与靶面物质有关D.与管电压成正比E.与X线管真空度有关正确答案:B18.排便反射的感受器分布于A.盲肠B.结肠C.直肠D.肛管E.肛门正确答案:C19.发现X线的科学家是A.牛顿B.居里C.伦琴D.达芬奇E.伽利略正确答案:C20.下列有关解剖学姿势的描述,错误的是A.身体直立B.两眼平视C.上肢下垂D.手掌向前E.两足分开正确答案:E21.对光反射的中枢位于A.脊髓B.延髓C.脑桥D.中脑E.下丘脑正确答案:D22.照射量的测量依据是利用A.X线的热作用B.X线的穿透作用C.X线的生物特性D.X线的电离作用E.X线的感光作用正确答案:D23.其运动是呼吸的重要部分,约占肺活量60%的肌是A.膈肌B.腹肌C.胸大肌D.肋间内肌E.肋间外肌正确答案:A24.下列不属于X线波动性的现象是A.反射现象B.干涉现象C.衍射现象D.折射现象E.荧光现象正确答案:E25.同一原子中,原子核对壳层电子的吸引力最小的是A.K壳层电子B.L壳层电子C.M壳层电子D.N壳层电子E.O壳层电子正确答案:E26.可露出于肝下缘,与腹前壁的内面相接触的是A.胆囊全部B.胆囊体C.胆囊颈D.胆囊管E.胆囊底正确答案:E27.对脂肪和蛋白质的消化,作用最强的消化液是A.唾液B.胃液C.胰液D.小肠液E.胆汁正确答案:C28.关于外照射防护基本方法的叙述,正确的是A.防护的最优化B.个人剂量限值C.实践的正当化D.建立剂量限制体系E.缩短受照时间、增大与放射源的距离、屏蔽防护正确答案:E29.分泌胃蛋白酶原的细胞是A.胃上皮细胞B.壁细胞C.主细胞D.胃黏液细胞E.内分泌细胞正确答案:C30.影响X线产生的因素不包括A.靶物质B.管电压C.管电流D.高压波形E.辅助装置正确答案:E31.戈瑞(Gy)和拉德(rad)的换算关系是A.1rad=10GyB.1rad=10-3GyC.1rad=10-5GyD.1rad=10-2GyE.1rad=10-4Gy正确答案:D32.半值层是指入射X线强度衰减到初始值的多少时,所需标准吸收物质的厚度A.1/3B.1/2C.1/4D.1/8E.1/16正确答案:B33.不得参与放射工作的年龄限制是A.未满16岁B.未满18岁C.未满20岁D.未满22岁E.未满25岁正确答案:A34.下列组织对X线的衰减由小到大的正确排序是A.空气、肌肉、脂肪、骨骼B.空气、脂肪、肌肉、骨骼C.骨骼、肌肉、脂肪、空气D.骨骼、空气、肌肉、脂肪E.空气、骨骼、脂肪、肌肉正确答案:B35.激活糜蛋白酶原的物质是A.HClB.肠致活酶C.胰蛋白酶D.糜蛋白酶E.组织液正确答案:B36.肝外形呈A.长梨形B.蚕豆形C.狭长形D.圆锥形E.不规则的楔形正确答案:E37.人体内最大的腺体是A.肝B.脾C.胰D.腮腺E.甲状腺正确答案:A38.位于心脏最后方的结构是A.左心房B.右心房C.左心室D.右心室E.左心耳正确答案:A39.下列关于标识辐射的叙述,错误的是A.波长为一个固定的数值B.与韧致辐射共同构成X线谱C.随着管电压的升高百分比增加D.管电压过低时不会产生标识辐射E.是高速电子与外层电子作用的结果正确答案:E40.关于射线防护综合原则的叙述,正确的是A.无特殊情况,应尽量少地接受X线的照射B.不影响诊断的情况下,尽量远离放射源进行照射C.实践的正当化,防护水平最优化,个人剂量限值D.不影响诊断的情况下,尽量缩短X线的照射时间E.X线检查时,非受照部位应尽量采用屏蔽防护正确答案:C41.关于X线管阳极的描述,错误的是A.选用高熔点的物质B.保持较高的真空度C.阻止高速电子流的运动D.选用原子序数较高的物质E.用来完成高压电路的回路正确答案:B42.对X线感受性最低的是A.胎儿B.生殖腺C.造血组织D.结缔组织E.淋巴组织正确答案:D43.脑神经中不属于运动神经的是A.动眼神经B.视神经C.三叉神经D.面神经E.舌咽神经正确答案:B44.分泌生长素的腺体是A.甲状腺B.垂体C.肾上腺D.松果体E.甲状旁腺正确答案:B45.右心房的入口和出口分别有A.3个、1个B.3个、2个C.4个、1个D.4个、2个E.1个、1个正确答案:A46.胆汁中起消化和吸收作用的主要成分是A.胆色素B.脂肪酸C.卵磷脂D.胆固醇E.胆盐正确答案:E47.红细胞的血红蛋白可以携带A.氧和葡萄糖B.氧和二氧化碳C.氧和氨基酸D.尿素和二氧化碳E.二氧化碳和氨基酸正确答案:B48.下列生殖腺和附属腺中,不成对的是A.精囊B.尿道球腺C.卵巢D.睾丸E.前列腺正确答案:E49.在定义照射量时X射线照射的物质是A.水B.空气C.氧气D.金属E.任何物质正确答案:B50.颈神经有A.5对B.6对C.7对D.8对E.12对正确答案:D51.椎间盘位于A.相邻椎体之间B.相邻椎弓根之间C.相邻椎弓板之间D.相邻上、下关节突之间E.相邻棘突之间正确答案:A52.机体的内环境是指A.细胞外液B.细胞内液C.血液D.体液E.组织液正确答案:A53.骨盆的构成中,不包括A.左侧髋骨B.右侧髋骨C.骶骨D.腰椎E.尾骨正确答案:D54.下列关于连续辐射的叙述,错误的是A.高速电子与内层轨道电子作用产生B.能量取决于电子接近核的情况C.与标识辐射共同构成X线谱D.其能量取决于电子能量大小E.能量与核电荷的大小有关正确答案:A55.原子的最外层电子数量最多不超过A.8个B.2个C.16个D.32个E.4个正确答案:A56.神经纤维在中枢内聚集的部位称A.白质B.灰质C.神经核D.神经节E.网状结构正确答案:A57.在诊断能量范围内,相干散射的产生概率所占比例约是A.0.05%B.0.5%C.5%D.55%E.85%正确答案:C58.X线诊断机房的副防护应达到的铅当量是A.0.1mmPbB.0.2mmPbC.0.5mmPbD.1.0mmPbE.2.0mmPb正确答案:D59.关于咽鼓管的描述,正确的是A.外侧份为软骨部,内侧份为骨部B.连通鼓室与咽部C.主要功能是传递声波D.内有三块听小骨E.听觉感受器位于此正确答案:B60.L壳层最多可容纳的电子数是A.2个B.4个C.8个D.12个E.18个正确答案:C61.骨性外耳道位于A.蝶骨B.颞骨C.筛骨D.枕骨E.下颌骨正确答案:B62.影响测量半值层的因素,不包括A.管电压B.总过滤C.电压波形D.滤过板厚度E.曝光时间正确答案:E63.属于眼球壁外膜结构的是A.巩膜B.虹膜C.睫状体D.脉络膜E.视网膜正确答案:A64.胰尾邻接A.贲门B.幽门C.脾门D.肝门E.肾门正确答案:C65.体液约占体重的比例是A.60%B.50%C.40%D.30%E.20%正确答案:A66.体循环始于A.左心房B.右心房C.左心室D.右心室E.冠状窦正确答案:C67.关于光电效应的产物,正确的是A.韧致辐射、光电子和正离子B.特征放射、光电子和负离子C.特征放射、正电子和正离子D.特征放射、光电子和正离子E.韧致辐射、负电子和负离子正确答案:D68.呼吸是指A.环境和肺泡之间的气体交换B.环境和机体之间的气体交换C.肺泡和机体之间的气体交换D.肺泡和血液之间的气体交换E.血液和组织液之间的气体交换正确答案:B69.脑的动脉供应主要来自A.颈外动脉和椎动脉B.颈内动脉和椎动脉C.颈外、颈内动脉D.两侧锁骨下动脉E.两侧颈总动脉正确答案:B70.X线不具有A.生物效应B.导电作用C.穿透作用D.荧光作用E.感光作用正确答案:B71.原子处于能量最低状态称为A.激发态B.基态C.电离态D.跃迁态E.辐射态正确答案:B72.下列组织对X线照射感受性最高的是A.结缔组织B.骨C.脂肪组织D.血管E.造血组织正确答案:E73.腕骨、跗骨分别有A.7块、7块B.8块、8块C.7块、8块D.8块、7块E.9块、6块正确答案:D74.下列有关肺的描述,正确的是A.左肺分三叶B.左肺有斜裂和水平裂C.肺位于纵隔的两侧D.肺尖不超过锁骨上方E.外侧面凹陷称肺门正确答案:C75.蛛网膜下腔位于A.硬脊膜与椎管之间B.硬脊膜与蛛网膜之间C.硬脑膜与颅骨内膜之间D.蛛网膜与软脑膜之间E.软膜与脑(脊髓)之间正确答案:D76.属于脑干的是A.间脑B.小脑C.端脑D.大脑E.中脑正确答案:E77.在诊断X线能量范围内,X线与物质能发生的主要作用有A.光电效应和相干散射B.光核反应和相干散射C.相干散射和康普顿效应D.光核反应和康普顿效应E.光电效应和康普顿效应正确答案:E78.不属于副鼻窦的结构是A.额窦B.蝶窦C.筛窦D.矢状窦E.上额窦正确答案:D79.在间脑中间有一矢状裂隙为A.蛛网膜下隙B.第四脑室C.第三脑室D.侧脑室E.内囊正确答案:C80.垂体位于A.颅前窝B.颅中窝C.颅后窝D.翼点深面E.颞骨岩部正确答案:B81.区分心房和心室的标志是A.前室间沟B.冠状沟C.胸肋面D.后室间沟E.心底正确答案:B82.伦琴发现X线在A.1905年B.1901年C.1895年D.1898年E.1908年正确答案:C83.下列关于骨构造的叙述,错误的是A.由骨质、骨膜、骨髓构成B.骨质分骨密质、骨松质两种C.骨膜对骨有营养、再生和感觉作用D.红骨髓具有造血功能E.成人骨干骨髓腔内的骨髓终生具有造血功能正确答案:E84.肾门向肾内凹陷形成一较大的腔称为A.肾皮质B.肾髓质C.肾大盏D.肾窦E.肾盂正确答案:D85.有关前臂骨的叙述,错误的是A.桡骨位于外侧B.桡骨上端粗大C.桡骨属于长骨D.尺骨下端细小E.鹰嘴属尺骨结构正确答案:B86.下列有关输胆管道的叙述,错误的是A.胆汁由肝细胞产生B.胆囊形状呈长梨形C.胆囊管与肝总管汇合成胆总管D.胆囊为储存和浓缩胆汁的器官E.由左肝管、右肝管合成胆囊管正确答案:E87.放射工作人员全身均匀照射时,防止随机性效应的年剂量当量限值是A.1rem/年B.2rem/年C.3rem/年D.4rem/年E.5rem/年正确答案:E88.下列有关肺的叙述,正确的是A.肺底又称肋面B.右肺仅有斜裂C.左肺共分3叶D.右肺共分3叶E.位于胸膜腔内正确答案:D89.卵受精的部位多在A.输卵管子宫部B.输卵管漏斗部C.输卵管峡部D.输卵管壶腹部E.输卵管伞部正确答案:D90.下列有关胰的叙述,错误的是A.胰由外分泌和内分泌两部分组成B.外分泌部分分泌的胰液是最重要的消化液C.内分泌部主要分泌胰岛素D.分头、体、尾三部E.其主胰管单独开口于十二指肠正确答案:E91.不属于内分泌腺的是A.肾上腺B.甲状腺C.垂体D.舌下腺E.松果体正确答案:D92.有肠脂垂的肠管是A.十二指肠B.空肠C.回肠D.结肠E.直肠正确答案:D93.光电效应是指X线与物质原子的什么作用发生的A.中子B.质子C.光电子D.自由电子E.内壳层电子正确答案:E94.标识X线的放射方式又称为A.受激辐射B.特征辐射C.自发辐射D.韧致辐射E.热辐射正确答案:B95.同一原子中,电子结合能最大的壳层是A.O壳层B.N壳层C.K壳层D.L壳层E.M壳层正确答案:C96.在X线摄影中,光电效应的负面影响是A.产生散射B.产生灰雾C.增加X线对比度D.患者接受照射量多E.产生辐射剂量正确答案:D97.食管的第3处狭窄在A.食管起始处B.食管穿膈处C.与胃相接处D.胸廓上口处E.与左主支气管交叉处正确答案:B98.十二指肠乳头位于十二指肠的A.上部B.降部C.水平部D.升部E.十二指肠球部正确答案:B99.心脏的正常起搏点是A.房室结B.房室束C.窦房结D.左束支E.右束支正确答案:C100.管理面部感觉的脑神经主要是A.副神经B.面神经C.舌咽神经D.迷走神经E.三叉神经正确答案:E。
碳素生产基础知识

1.铝电解用阳极炭块的主要作用是什么?答:炭块在电解槽上起到导电和参与电化学反应的作用。
2.炭素阳极制品的特点有哪些?答:(1)耐高温,导电、导热性好(2)较低的热膨胀系数(3)化学性能稳定。
3.什么叫煅烧?答:炭素材料在基本隔绝空气的条件下进行高温热处理的过程称为煅烧。
4.石油焦煅烧的目的是什么?答:(1)排除原料中的水份和挥发份(2)提高原料的密度和机械强度(3)改善原料的导电性能(4)提高原料的抗氧化性能5. 回转窑内三个温度带是什么?答:预热带、煅烧带、冷却带6. 石油焦的挥发份在煅烧过程中的挥发机理如何?答:在500℃~600℃的时候就开始少量排出;800℃时是排出的高峰;1150~1250℃基本排完。
7.正常生产中,回转窑几个关键温度应控制在什么范围内?答:窑头:<900℃。
窑尾及沉灰室出口:介于900~1100℃之间煅烧带:介于1150℃~1250℃之间8.回转窑的特点?答:优点:产能大,结构简单,对原料适应性好,便于实现自动化控制。
缺点:碳质烧损较大一般在8~11%。
9.回转窑二、三次风的作用是什么?答:它的作用是给窑内补充空气,助燃达到充分燃烧。
10. 炭素分公司回转窑的规格和产能是多少?答:规格ф2.6/2.14×50m煅后焦产能:9t/h11. 煅烧的工艺流程?答:煅前仓→回转窑→冷却窑→煅后仓12. 回转窑烟气走向?答:回转窑→沉灰室→余热锅炉→除尘器→引风机→烟囱13. 煅前给料的粒度要求?答:原料进入回转窑以前先要预碎到50±20mm的粒度。
14. 冷却窑加直接冷却水的目的是什么?答:使物料急剧冷却,防止氧化,减少烧损。
15. 石油焦原料的设计标准是什么?答:应符合SH/T0527-1992中2号A级焦质量标准16. 煅烧回转窑密封采用何种形式的密封?答:窑头密封采用重锤压环式密封,窑尾密封采用迷宫式密封环17.双齿辊破碎机主要由哪些部件组成?答:该机主要由机架,辊轴,传动部分,罩壳等组成。
钛阳极基础知识及应用

钛阳极基础知识及应用一、钛阳极详解什么是钛阳极?钛阳极全称叫钛基金属氧化物涂层钛阳极(MMO)。
也叫KSA阳极。
(尺寸形状稳定型阳极)。
它以钛为基板,在钛基板上刷涂贵金属涂层,使其具有良好的电催化活性及导电性。
钛阳极分类:按照在电化学反应中阳极析出气体来区分,析出氯气的称析氯阳极,如钌系涂层钛电极:析出氧化的称为析氧阳极,如铱系涂层钛电极和铂钛网/板。
析氯阳极(钌系涂层钛极):电解液中氯离子含量高:一般在盐酸环境及电解海水,电解食盐水环境。
如钌铱钛阳极,钌铱锡钛阳极。
析氧阳极(铱系涂层钛电极):电解液一般为硫酸环境。
对应我公司产品为铱钽阳极,铱钽锡阳极,高铱阳极。
镀铂阳极(白金钛网/白金钛板):钛为基材。
表面镀上贵金属铂,镀层厚度一般为1-5um(微米)。
白金钛网网孔规格一般为12.7*4.5mm或6*3.5mm.二、钛阳极优点现阶段国内钛阳极主要以刷涂为主。
这样的电极有很非常广泛的应用,钛阳极以其轻巧灵活的制作工艺,又被称为DSA阳极,比起同类阳极钛阳极优越性能有以下几点;1.阳极尺寸稳定,电解过程中电极间距离不变化,可保证电解操作在槽电压稳定的情况下进行。
2.工作电压低,电能消耗小,直流电耗可降低10-20%。
3.钛阳极工作寿命长,耐腐蚀性强。
4.可克服石墨阳极和铅阳极的溶解问题,避免对电解液和阴极产物的污染,因而可提高金属产品纯度。
5.电流密度高,过电位小,电极催化活性高,可有效捉高生产效率。
6.可避免铅阳极变形后的短路问题,提高电流效率。
7.形状制作容易,可高精度化。
8.钛基体可重复使用。
9.较低的过电位特性,电极间表面及电极的气泡容易排除,可有效降低电解槽电压。
电积提取金属是将经浸出、净化处理的电解液中的待提取金属离子在阴极还原,制得纯金属的一种方法由Ti基体和被覆其上的贵金属和(或)贵金属氧化物电化学活性层组成。
在电解冶金中,可以替代常规的铅合金阳极,在相同的条件下,可以降低电压,节约电能消耗。
对电极 阳极

对电极阳极
对电极和阳极在电化学反应中起着至关重要的作用。
电极是电池或电化学设备的核心部分,它们参与并促进电化学反应,从而使设备能够产生电流或实现某种功能。
首先,让我们了解一下对电极和阳极的基本概念。
对电极通常是指与阳极相对的另一电极,它与阳极共同构成电池或电化学设备的两极。
而阳极则是电池或电化学设备中发生氧化反应的电极,也就是说,阳极是失去电子的电极。
对于电极的要求,我们可以从以下几个方面进行探讨:
1. 电导率:电极需要有高的电导率,以确保电流能够顺畅地通过。
这样可以减少电阻,提高设备的效率。
2. 稳定性:电极需要在电化学反应过程中保持稳定,防止因反应而发生分解或腐蚀。
这有助于确保设备的长期性能和可靠性。
3. 活性:电极需要具有一定的活性,能够参与电化学反应。
这样可以提高设备的反应效率,从而提升设备的性能。
4. 结构与设计:电极的结构和设计也需要考虑,以适应不同的应用需求。
例如,在某些设备中,可能需要特殊的电极形状或尺寸以满足特定要求。
5. 环境友好性:电极材料应选择环保、无毒、无害的物质,以确保设备在使用过程中不会对环境造成危害。
此外,对电极和阳极的选择还需考虑具体的电化学反应原理和应用场景。
针对不同的反应类型和设备用途,我们需要选择最合适的电极材
料和结构,以确保设备的性能和稳定性。
总的来说,对电极和阳极在电化学反应中具有重要地位,它们的质量和性能将直接影响设备的性能和稳定性。
因此,在选择和应用电极时,我们必须综合考虑多个因素,确保电极能够满足实际需求并发挥最佳性能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产品的性能/环保 外观检查和测试 产品的性能 环保/外观检查和测试 环保
同一批次的阳极产品外观颜色必须保持一致; 具体阳极产品的检验依照《进料检验程序》 执行,并保留必要的记录和结果,如填写 《ROHS及镀层厚度测试记录表》。 涉及到阳极产品颜色不一致,需要重新返电 的时候,必须移动产品的挂点 挂点位置,确保再 挂点 次阳极电镀时导电良好。
阳极处理基础知识
一般原理:以铝或铝合金制品为阳极置于电解质 溶液中,利用电解作用,使其表面形成氧化铝薄膜的 过程,称为铝及铝合金的阳极氧化处理。铝阳极氧 化的原理实质上就是水电解的原理。
阳极工艺流程
准备工件(Parts) 工件上挂具(Rack):针对于不同的产品选择合 适的挂具,通常由阳极厂的有经验的人员确认; 此过程也是耗时间最多的时间;为了确保阳极电 镀时导电接触良好,需要确认挂具的导电性能 (如是否松动);确认挂具是否能够牢固可靠。 脱脂去污(前处理):首先将挂具上的工件放入到酸 性去污槽,通常是HNO3,H2SO4,H3PO4按照 一定的比例的混合酸,去污时间10-13S,然后清 洗30S,再将挂具上的工件放入到高温碱进行去 油污(80-95℃,时间10-13S),再清洗30S
过程关键控制点
工件上挂具,接触点尽可能的在孔位置或者在非外观面; 去污后的水洗必须彻底,确保清洗干净; 阳极电镀时间,电压设定(通常是时间长,电压低比较 好); 染色时间不可太短,根据实际产品情况决定染色时间。 封闭/封孔时间最低限度必须大于10分钟; 烘烤时间不可太短; 卸工件的工具不可伤害产品的外观; 包装必须要轻拿轻放,不可有碰伤;
产品的性能/环保 外观检查和测试 产品的性能 环保/外观检查和测试 环保
阳光照射试验:将产品暴露在自然光中照射120小 时(0-35℃),其照射面与不照射面进行对比, 颜色无差异或无褪色的则判定为OK, 环保测试:每批每款取1件送环保测试室,使用 EDX-3000进行测试 外观检查:无明显色差,划伤,刻痕,表面无光 泽,或者光泽度不均衡,阳极不完全。 产品外观检验注意砂眼不可接受,(砂眼通常由 ห้องสมุดไป่ตู้料材质不良引起,如材质含铁Fe含量过高);
膜厚检测:采用交频涡流厚度测试仪进行检测, 测试前后必须进行凋零和标准,同一面的测试次 数不少于3次,取其算术平均值。 膜厚标准:一般情况,金色、绿色、黑色膜厚为 10um以上, 本色为6至8um, 若客户有文件特别 要求,则依据客户要求生产。 耐磨测试:长度大于或等于38mm的产品使用单 重500g砝码包上白色棉布,粘酒精在试样表面来 回自重擦拭5次,检查棉布变色为NG,若棉布基 本上不粘色为OK,长度小于38mm的产品,使用 棉签蘸一滴酒精在试样表面来回擦拭10次,检查 棉签变色为NG,若棉签基本不粘色为OK
阳极工艺流程
阳极电镀:将清洗干净的挂具上的工件放置到阳极槽进行阳极 电镀,此过程大概需要45分钟,通常情况,阳极槽设置的电 压为12V,电解液为H2SO4。 染色/配色:此过程需要15分钟,对于黑色颜色来说,目前比 较常见,其他颜色的配色也是目前所有阳极处理厂商技术难度 最大的地方,同时也是最难控制的地方。一定要确保染色缸未 受到任何的污染,阳极氧化铝染色与染料的浓度,PH值,染色 时间,染色的温度有关(不同的颜色,不同的染料染色时间不 同)。
阳极工艺流程
热水清洗:此过程需要1分钟, 烘干/干燥:烘烤温度100-150℃,烘烤时间 2-5分钟,通常以产品烤干为准。 目视检查外观:检查产品的光泽度以及和样品 的颜色进行比对。 卸工件:将挂具上的工件卸下,注意产品划伤 或夹伤。 包装:根据客户的要求做适当的防护。
产品的性能/环保 外观检查和测试 产品的性能 环保/外观检查和测试 环保
阳极处理返工注意事项
通常情况下阳极产品不得进行二次处理,因 为产品阳极过程再处理时,产品受到酸、碱 的腐蚀,一些关键尺寸会产生变异,例如说 螺丝孔内径变大,通孔尺寸变大、总体尺寸 变小, 凸点尺寸变小,圆内径增大,外径 减小,产品表面材质被腐蚀破坏等原因。如 果经过确认为特殊原因,条件认可的情况下, 产品可以接受二次处理,但是产品必须做好 必要的防护措施,如已经攻丝的螺纹必须使 用塑胶螺丝密封,防止螺纹受损。
阳极工艺流程
封闭/封孔:将清洗干净的挂具上的工件放入封闭槽中固化颜 色,本色产品的封闭时间通常阳极厂设置为4-5分钟,黑色及 其他颜色的产品封闭时间通常设置为10-15分钟;具体的封闭 时间依据产品确定。温度控制一般有三种,高温封闭/封孔 (温度一般为80±10℃),低温封闭/封孔(温度一般为 35±15℃)和常温封闭/封孔(温度一般为25±10℃),具 体的封闭温度依据所选择的封孔剂而确定;例如说:阳极产品 阳极产品 可能经常暴露在空气或阳光中, 可能经常暴露在空气或阳光中,需要选择高温封孔剂在高温的 条件下执行封闭,如果出现阳极产品阳光照射试验失败,则可 条件下执行封闭 能与封孔剂的选择不匹配有关。因此封闭/封孔过程直接决定 耐磨测试、封孔测试和阳光照射测试是否通过。注意,一定要 确保封闭槽中所使用的水是净化水。(封闭/封孔工序为阳极 产品最为关键的工序之一,决定着最终成品的性能和外观,需 要特别关注)
