胡波化学竞赛题库-不饱和键的氧化
胡波元素

第八题(15 分)过氧乙酸的制备、性质与测定 过氧乙酸是一种广谱消毒剂,是抗“非典”中一种重要消毒剂。 (1)过氧乙酸的制备如下:将 58.0mL(1mol)冰乙酸倒入四口瓶中,加入 5.0mL 浓硫酸, 缓慢滴加 206.0mL(约 2mol)30%双氧水,温度保持在 30~35℃,搅拌 3h 后停止反应,减压 蒸馏,得到过氧乙酸的水溶液。 (2) 过氧乙酸含量的分析方法如下: 准确称取 0.5027g 过氧乙酸试样, 置于预先盛有 40mL H2O、5mL 3mol/L H2SO4 溶液和 2~3 滴 1mol/L MnSO4 溶液并已冷却至 5℃的碘量瓶中,摇匀, 用 0.02366mol/L KMnO4 标准溶液滴定至溶液呈浅粉色(30s 不退色) ,消耗了 12.49mL;随即 加入 10mL 20% KI 溶液和 2~3 滴(NH4)2MoO4 溶液(起催化作用并减轻溶液的颜色) ,轻轻摇 匀, 加塞, 在暗处放置 5~10min, 用 0.1018mol/L Na2S2O3 标准溶液滴定, 接近终点时加入 3mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持 30s 不重新显色,为终点,消耗了 Na2S2O3 23.61mL。 1.写出过氧乙酸的结构简式和制备过氧乙酸的化学反应方程式,并预测过氧乙酸的水溶 性和稳定性,简述其原因。
6.已知氢元素有 1H、2H、3H 三种同位素,氧元素也有 16O、17O、18O 二种同位素。计算 如果 H2O2 的结构如①或②所示时,它们之间形成 H2O2 的种类。
第五题(8 分) H2O2 是一种绿色氧化剂,应用十分广泛。1979 年化学家将 H2O2 慢慢加入到 SbF5 的 HF 溶 液中得一白色固体 A,A 是一种盐类,其阴离子呈八面体结构。 1.确定 A 的结构简式;写出生成 A 的化学反应方程式;
胡波化学竞赛题库_氧化还原

中学化学竞赛试题资源库——氧化还原A组1.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。
服用维生素C 可缓解亚硝酸盐的中毒,这说明维生素C具有A 酸性B 碱性C 氧化性D 还原性2.苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。
若榨汁时加入维生素C,可有效防止这种现象发生。
这说明维生素C 具有A 氧化牲B 还原性C 碱性D 酸性3.以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是A KMnO4B NaNO2C FeCl3D HNO34.元素从化合物中被置换成单质时,该元素A 一定被氧化B 一定被还原C 可能被氧化,也可能被还原D 既不被氧化,也不被还原5.下列物质转化需要加入还原剂才能实现的是A SO32-→SO2B HCl→Cl2C Na→Na+D SO2→S6.下列反应所生成的气体中,含有被还原的元素是A 炭粉和二氧化硅均匀混和后强热B 石英和纯碱均匀混和后强热C 铜片放入浓硫酸中加热D 铝粉放入氢氧化钾溶液中振荡7.下列微粒既具有氧化性又具有还原性的是①Al3+②Cl-③N2④MnO4-⑤CO2⑥H2O2⑦H2O ⑧MnO42-A ①④⑤⑦B ③⑥⑦⑧C ④⑤⑥⑧D ①②③⑥8.R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。
这四种离子被还原成0价时表现的氧化性大小符合A R2+>X2+>Z2+>Y2+B X2+>R2+>Y2+>Z2+C Y2+>Z2+>R2+>X2+D Z2+>X2+>R2+>Y2+9.已知下列三个反应:2Fe2++Cl2=2Fe3++2Cl- 2Fe3++Cu=2Fe2++Cu2+ Fe+Cu2+=Fe2++Cu试推断结论:具有还原性物质的还原性强弱:①Fe>Cu>Fe2+>Cl-②Cl->Fe2+>Fe>Cu具有氧化性物质的氧化性强弱:③Fe3+>Cl2>Fe2+>Cu2+④Cl2>Fe3+>Cu2+>Fe2+其中结论正确的是A ①③B ②③C ①④D ②④10.根据反应:2H2S+O2=2S↓+2H2O,4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,Na2S +I2=2NaI+S↓,判断下列物质的氧化性强弱,正确的是:A O2>I2>SB H2S>NaI>H2OC S>I2>O2D H2O>NaI>H2S11.从下面的变化过程,推断氧化性从强到弱的顺序是①2H2S+SO2=3S↓+2H2O ②2KI+Cl2=2KCl+I2③2FeCl2+Cl2=2FeCl3④2FeCl3+2HI=2FeCl2+I2+2HCl ⑤I2+SO2+2H2O=H2SO4+2HIA Cl2>Fe3+>I2>SO2B Cl2>I2>Fe3+>SO2C Cl2>Fe3+>SO2>I2D Fe3+>I2>Cl2>SO212.已知:①2BrO3—+Cl2=Br2+2ClO3—②5Cl2+I2+6H2O=2HIO3+10HCl③ClO—3+5Cl—+6H+=3Cl2+3H2O下列粒子氧化性强弱顺序正确的是A ClO3—>BrO3—>IO3—>Cl2B IO3—<ClO3—<BrO3—<Cl2C IO3—<BrO3—<Cl2<ClO3—D BrO3—>ClO3—>Cl2>IO3—13.根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是①向FeC13溶液中滴加KI溶液,再加入CC14振荡,CCl4层呈紫红色②向FeC12溶液中加入氯水,再加入KSCN溶液,呈红色③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去A I2>C12>Fe3+>MnO4-B MnO4->C12>Fe3+>I2C.Cl2>I2>Fe3+>MnO4- D Fe3+>MnO4->Cl2>I214.已知:2Fe+3Br2=2FeBr3 2Fe3++2I—=2Fe2++I2,现将Fe(NO3)2溶液分别滴入到以下溶液中:①H2SO4②HNO3③溴水④碘水,其中能使Fe2+转变成Fe3+的是A 只有②③B ①②③C ②③④D 全部15.下列反应中有一种物质既是氧化剂又是还原剂的是A 2KI+Br2=2KBr+I2B 2AgNO32Ag+2NO2↑+O2↑C Cu(OH)2CO32CuO+CO2↑+H2OD 2Na2O2+2H2O=4NaOH+O2↑16.下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是A 2Na2O2+2H2O=4NaOH+O2↑B C+H2O CO+H2C Cl2+H2O=HCl+HClOD 2F2+2H2O=4HF+O217.下列反应中气体只作氧化剂的是A Cl2通入水中B Cl2通入Na2SO3溶波中C SO2通入氢硫酸溶液中D NO2通人水中18.久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的物质是A 过氧化钠固体B 亚硫酸钠固体C 硫酸亚铁晶体D 苯酚晶体19.下列物质在空气中久置变质,在变质过程中既有氧化还原反应发生,又有非氧化还原反应发生的是A 溴水B 绿矾C 电石D 漂白粉20.单质X和Y反应生成的化合物X2+Y2-,现有下列叙述:①X被氧化②X是氧化剂③X具有氧化性④XY既是氧化产物又是还原产物⑤XY中的Y元素具有还原性⑥XY中的X 元素具有氧化性⑦Y的氧化性比X2+强⑧Y2-的还原性比X的还原性强,上述说法中,都正确的组合是A ①④⑤⑥B ②③④⑤C ②④⑥⑧D ⑤⑥⑦⑧21.有甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在;丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应。
2008高中化学竞赛初赛模拟试卷(胡波竞赛卷)(26)

2008高中化学竞赛初赛模拟试卷(26)第一题(11分)图为不饱和烃uSat与氢卤酸HX反应的自由能线图,TSi表示反应步骤的过渡态。
某实验室经过测定知8.56g uSat液体在室温下与足量HX反应,测得吸收HX气体2.27mL,反应产率接近99%。
uSat是Diels-Alder反应的亲二烯体,与1,3-丁二烯反应的产物中无内外型(endo &exo)异构体出现。
1.由图可以判断uSat是烯烃还是炔烃?2.图中哪一步是速率决定步骤,ΔG‡表示什么含义。
3.用立体结构式表示,写出反应的立体化学过程并单独描绘出TS的立体结构。
第二题(12分)开关性系统一直是超分子化学所研究目标,美国加州大学圣地歌分校的研究人员曾经发现1,2-二芳基取代的尿素与苯的硝基取代产物(A和B)可以形成可逆性还原反应。
以1,2-二苯基尿素(简写为DPU,1,2-D i p henyl u rea)为例,在溶剂DMF中,A与DPU未观察到任何相互作用,但当A被还原为自由基离子后却与DPU有强的作用(K=105 M-1,DMF)。
B在被还原后同样与DPU有强的相互作用,这一点已经被循环伏安法所证实。
A的HNMR显示有三种不同化学环境的H,B则只有一种。
1.请问DMF属于哪类溶剂,为何本实验选用此类溶剂?2.以结构式表示,写出A、B与DPU相互作用的原因。
3.请写出A、B两还原电对的Nernst方程表达式。
4.写出K的表达式。
第三题(7分)某碘取代连苯M在Cu2O的存在下可以得到N,虽然产量不高,但却不失为一种合成B的方法,B可以简单认为没有芳香性。
取0.387g M反应后得到0.094g N,产率约为65%。
请写出最合理的M得到N的结构式,并给出推理过程。
第四题(13分)10年前,有研究员为了解富勒烯的形成机理,曾在做过一个有趣的实验。
在一个500mL的三颈烧瓶中存有300mL纯氯仿(已除去污染物),接着不断通入纯净的氮气以维持惰性的化学环境;装配并浸入两铜电极(相距约1mm),然后进行高压高频电弧放电,此过程中有大量酸性气体M产生;5h放电后得到深红褐溶液,该溶液经真空蒸发后收集到3~4g的残渣。
中学化学竞赛试题资源库-胡波环境化学

中学化学竞赛试题资源库——环境化学A组1.科技文献中经常出现的下列词汇,其中与相关物质的颜色无联系的是A 赤色海潮B 绿色食品C 白色污染D 棕色烟气2.下列有关环境问题都是由化学物质引起的,在下列组合中对应的化合物不正确的是A 温室效应:二氧化碳B 光化学污染:二氧化氮C 酸雨:二氧化碳D 臭氧层破坏:氟氯烃3.下列三组内容中,三种地理现象之间存在着逐级因果联系的是A 火山喷发、海啸、厄尔尼诺B 汽车尾气排放、酸雨、二恶英C 氯氟烃排放、光化学烟雾、大气臭氧洞D 沿海地区污水排放、赤潮、近海渔业减产4.环境污染已成为人类社会面临的重大威胁,各种污染数不胜数。
下列名词与环境污染无关的是①温室效应②赤潮③酸雨④光化学污染⑤臭氧空洞⑥潮汐⑦大脖子病⑧富营养化A ②⑥B ⑥⑦C ①③⑤D ④⑤⑧5.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及A SO2B NO2C CO2D 可吸入颗粒物6.二氧化硫是大气污染的主要有害物质之一,也是形成“酸雨”的主要成分,其来源主要有A 大量矿石的开采B 生态环境的破坏C 工业上生产硫酸排放的尾气D 工业上大量含硫物质的燃烧7.上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。
其中塑料袋、废纸、旧橡胶制品等属于A 无机物B 有机物C 盐类D 非金属单质8.室内空气污染的主要来源之一是现代生活中所使用的化工产品,如泡沫绝缘材料的办公桌、化纤地毯及书报、油漆等会不同程度地释放出来某种气体,该气体可能是A 甲醛B 氮气C 二氧化碳D 甲烷9.室内空气污染的主要来源之一是现代人的生活中使用的化工产品。
如泡沫绝缘材料的办公用品、化纤地毯及书报、油漆等不同程度释放出的气体。
该气体可能是A 甲醛B 甲烷C 一氧化碳D 二氧化碳10.某些不合格的建筑装饰材料,会缓慢释放出浓度过高、影响健康的气体,这些气体最常见的是A 二氧化氮B 二氧化硫C 一氧化碳D 甲苯等有机物蒸气和甲醛11.室内装潢和家具挥发出来的甲醛是室内空气的主要污染物,甲醛易溶于水,常温下有强烈刺激性气味,当温度超过20℃时,挥发速度加快,根据甲醛的这些性质,下列做法错误的是A 入住前房间内保持一定温度并通风B 装修尽可能选择在温度较高的季节C 请环境监测部门检测室内甲醛含量低于国家标准后入住D 紧闭门窗一段时间后入住12.汽车尾气中污染空气主要的是A COB CO2C 氮氧化合物D 铅的化合物13.汽车尾气易造成铅污染,其原因是汽油中溶有含铅物质(防爆剂),该防爆剂的化学式为A PbSB Pb(NO3)2C Pb(C2H5)4D (CH3COO)2Pb14.汽车尾气(含有烃类、CO、NO x、SO2等)是城市空气的主要污染源。
胡波化学竞赛题库-化学动力学-

胡波化学竞赛题库-化学动力学-中学化学竞赛试题资源库——化学动力学A组1.在下列过程中,需要加快化学反应速率的是A 塑料老化B 合成氨C 钢铁腐蚀D 食物腐败 2.下列情况,反应速率不加快的是A 在空气中燃着的木条插入盛有纯氧的瓶中B 用煤粉代替煤块燃烧C 锌粉和碘粉的混合物中滴入水D 用0.01mol/L的盐酸代替1mol/L的盐酸与铁反应制取氢气 3.对于反应N2+O22NO在密闭容器中进行,下列条件中哪些能加快该反应的化学反应速率A 缩小体积使压强增大B 体积不变充入氮气使压强增大C 体积不变充入氦气使压强增大D 使体积增大到原来的2倍 4.催化剂能加快化学反应速率的原因是 A 能降低反应所需要的能量B 加快分子运动的速度,增加分子碰撞的机会C 催化剂并没有参与反应,所以能改变化学反应速率D 以上说法均不对5.升高温度能加快反应速率的主要原因是A 加快分子运动的速度,增加分子碰撞的机会B 降低反应物分子的能量 C 增大活化分子的百分数D 以上说法均对6.某温度下,反应2N2O5=4NO2+O2开始进行时,c(N2O5)=0.0408mol/L。
经1min后,c(N2O5)=0.030mol/L。
则该反应的反应速率是------A v(N2O5)=1.8×104mol·L1·s1B v(N2O5)=1.8×102mol·L1·s1------C v(NO2)=1.8×104mol·L1·s1D v(O2)=1.8×104mol·L1·s17.在密闭容器中进行可逆反应,A跟B反应生成C,反应速率v(A)、v(B)、v(C)之间存在以下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应可以表示为A A+BCB 2A+2B3C C 3A+B2CD A+3B2C8.已知:4NH3+5O2=4NO+6H2O,若反应速率分别用?NH3、?O2、?NO、?H2O(mol/L·min)表示,则正确的关系是4524A ?NH3=?O2 B ?O2=?H2O C ?NH3=?H2OD ?O2=?NO53569.合成氨反应为:3H2+N2表示,则正确的关系式是A ?H2=?N2=?NH3B ?N2=?H2C ?NH3=3?H2 D ?H2=3?N2 2?N2、?NH3(mol/L)2NH3,其反应速率可以分别用?H2、10.在2A+B3C+4D反应中,表示该反应速度最快的是A vA=0.5mol/(L·s)B vB=0.5mol/(L·s)中学综合学科网第 1 页共 18 页://zhxk.C vC=0.8mo l/(L·s)D vD=1mol/(L·s)--11.反应2A=B+3C,在20℃进行时其VA=5mol·L1·s1。
2005年全国化学竞赛初赛模拟试卷31

2005年全国化学竞赛(jìngsài)初赛模拟试卷(71)(时间(shíjiān):3小时满分:100分)第一题(4分)1.锝在自然界不存在,是用人工方法制备的第一个元素(yuán sù),锝的希腊文的原意是“人工(réngōng)制造”的意思。
1937年美国加利福尼亚洲立大学(dàxué)的意大利教授B. Segere和C. Perrier,用能量约500万电子伏特的氘核轰击质量数为96的Mo而制得。
请写出核反应方程式。
2.放射性Uub的一个原子经过6次衰变(每次衰变都放出一个相同粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的核素。
请写出核反应方程式。
第二题(6分)把适量Cl2通入Na2S2O3溶液中,总是先出现白色浑浊,继而白色浑浊消失呈无色溶液。
1.写出上述反应方程式;2.如何检验反应中新生成的离子?第三题(8分)某人买了两瓶消毒液,不小心将两种液体混在一起,结果剧烈反应,产生大量有色气体而使人中毒。
收集产生的气体,通入NaOH溶液中,气体仅部分吸收,剩余无色气体。
用pH试纸测量2瓶消毒液:甲瓶中消毒液pH=12,乙瓶中消毒液pH=2,且都能很快使pH 试纸变白。
1.写出2瓶消毒液的主要成分;2.写出制备这2种消毒液的化学方程式;3.写出这2种消毒液间反应的化学方程式。
第四题(6分)α-硫辛酸(LA)被誉为“万能(wànnéng)抗氧剂”,是已知天然抗氧剂中效果最强的一种,其结构(jiégòu)简式如右图。
动植物组织中LA通常(tōngcháng)与蛋白质分子中赖氨酸(C6H14N2O2)结合(jiéhé)。
LA含量最高的植物是菠菜;在动物体内肝脏和肾脏(shènzàng)组织中LA含量最高。
LA是代谢性抗氧剂,在生物体内可以转化为(DHLA)。
胡波化学竞赛题库-离子反应

中学化学竞赛试题资源库——离子反应A组1.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是A Mg2+B Ca2+C Na+D Fe3+2.某化合物M在固态时不导电,但熔化或溶于水中能完全电离。
下列关于M的说法中正确的是A M为非电解质B M是强电解质C M是离子晶体D M为弱电解质3.下列物质的水溶液能导电,但属于非电解质的是A CH3CH2COOHB Cl2C NH4HCO3D SO24.对某物质进行试验:①能与碱反应生成盐和水②该物质的水溶液能与铁反应生成氢气③该物质的水溶液中阳离子只有H+,据你学过的酸的概念,下列判断正确的是A ①②③均能说明该物质是酸B ①②③均不能说明该物质是酸C 只有③能说明该物质是酸D ②③能说明该物质是酸5.下列哪一事实可以肯定某物质是碱A 能与酸反应,生成盐和水B 其水溶液中,有金属阳离子和OH-离子C 其水溶液能使酚酞溶液变成红色D 其水溶液中的阴离子只有OH-离子6.只能在水溶液中导电的电解质是A NaNO2B Cl2C KHCO3D NaOH7.下列各组离子中,能在水溶液中大量共存的是A Fe3+Cu2+NO3-SO42-B Fe3+Fe2+NO3-SO42-C S2-CO32-OH-SO42-D PO43-H2PO4-NH4+NO3-8.下列各组中,离子能大量共存的是A NH4+、Na+、SO42-、OH-B NH4+、H+、Cl-、CO32-C K+、NH4+、NO3-、Cl-D Fe2+、NH4+、NO3-、H+9.在强酸性溶液中能大量共存,并且溶液为无色透明的是A NH4+Fe2+SO42-NO3-B K+Na+S2-NO3-C K+NH4+Br-SO42-D Na+K+NO3-HCO3-10.下列各组离子能在呈酸性的无色溶液中大量共存的是A Ba2+、Na+、NO3-、MnO4-B Mg2+、Cl-、Al3+、SO42-C K+、Cl-、HCO3-、NO3-D Ca2+、Na+、Fe3+、SO32-11.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是A Cl-、Mg2+、H+、Zn2+、SO42-B MnO4-、K+、Cl-、Mn2+C Na+、Ba2+、NO3-、HCO3-、SO42-D K+、NO3-、SO42-、OH-、Na+12.无色透明的强碱性溶液中,能大量共存的离子组是A CO32-、Br-、K+、Na+B NH4+、SO42-、Cl-、NO3-C K+、Na+、AlO2-、Cl-D K+、SO42-、HCO3-、S2-13.在pH=1的无色溶液中能大量共存的离子组是A NH4+、Mg2+、SO42-、Cl-B Ba2+、K+、OH-、NO3-C Al3+、Cu2+、SO42-、Cl-D Na+、Ca2+、Cl-、AlO2-14.下列离子在溶液中因发生氧化还原反应而不能大量共存的是A H3O+、NO3-、Fe2+、Na+B Ag+、NO3-、Cl-、K+C K+、Ba2+、OH-、SO42-D Cu2+、NH4+、Br-、OH-15.能大量共存于同一溶液中,在该溶液中加入过量的NaOH液或适量稀硫酸,都可能产生白色沉淀的离子组是A Ba2+Mg2+NO3-Ca2+B NH4+Ba2+Fe3+Cl-C H+Ba2+Al3+Cl-D K+Ca2+Cl-HCO3-16.在溶液中能共存,且加入OH-有沉淀析出,加入H+能放出气体的一组离子是A Na+,SO42-,Cu2+,Cl-B SO32-,Ba2+,K+,NO3-C HCO3-,Cl-,Na+,Ca2+D CO32-,S2-,Na+,K+17.下列各组离子,在强碱溶液中可以大量共存的是A I-AlO2-Cl-CO32-B Na+K+NH4+Ba2+C Br-S2-Cl-CO32-D SO32-NO3-SO42-HCO3-18.经实验测得某一溶液由Mg2+、Al3+、NO3-、SO42-四种离子组成,其中Mg2+、Al3+、SO42-离子的个数比可能为A 3︰1︰10B 3︰5︰1C 3︰10︰1D 3︰1︰519.测得某溶液中仅含Cu2+、K+、SO42-、Cl-四种离子,且阳离子的个数比为Cu2+︰K+=3︰4,则SO42-和Cl-的个数比可能是A 3︰2B 1︰3C 1︰8D 任意比20.在Na2SO4、NaCl、NaOH的混和溶液中,含有Na+、SO42-、OH-、Cl-,其中Na+、SO42-、OH-的个数比为8︰1︰2。
胡波化学竞赛题库-配位异构、平衡、滴定

中学化学竞赛试题资源库——配位异构、平衡、滴定A组1.已知[Co(NH3)6]3+呈正八面体结构:各NH3分子间距相等,Co3+位于正八面的中心。
若其中二个NH3分子被Cl-取代,所形成的[Co(NH3)4Cl2]+的同分异构体的种数有A 2种B 3种C 4种D 5种2.Co(NH3)63+离子是正八面体而非三棱柱或平面六边形构型的理由是A 其一氯取代物不存在同分异构体B 它是非极性分子C 它的键长与键角都相等D 其二氯取代物只存在两种同分异构体3.CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H 2O)4]2+(蓝色)+4Cl-[CuCl4]2-(黄色)+4H2O现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法:①,②。
4PbCl2于1.00mol/L HCl溶解度最小,请说出可能原因。
5.(1)写出Fe(Ⅲ)和I-在溶液中的反应现象和反应方程式。
(2)有足量F-时,Fe(Ⅲ)不和I-反应。
请说出原因。
(3)往(1)的溶液中加足量F-,有什么现象?原因何在。
(4)在足量2mol/dm3HCl溶液中加Fe(Ⅲ)、I-、F-。
请说出反应现象,它可能和实验(2)的现象有何不同?6.水的硬度常用一种规定的标准来衡量。
通常把1L水中含有10mg CaO(或相当于10mgCaO)称为1°。
Ca2+、Mg2+的硬度之和称为总硬度。
用配位滴定法分析某水样的硬度时,取50.00mL水样放入250mL锥形瓶中,加入稀盐酸数滴,煮沸,冷却,加入2mL 1︰1的三乙醇胺溶液和10mL NH3·H2O-NH4Cl缓冲溶液(pH=10),及3滴酸性铬蓝K-素酚绿B混合指示剂。
用0.01000mol/L EDTA溶液滴定至由红色到蓝色即终点,消耗EDTA溶液12.5mL。
另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的,NaOH溶液使pH>12,用0.01000mol/L EDTA溶液滴定至终点,消耗EDTA溶液7.50mL。
化学竞赛题库(26)0_NoRestriction

2008 年高三化学竞赛训练试卷(26)(时间:3 小时 满分:100 分)题 号 1 2 3 4 5 6 7 8 9 10 11满 分 6 7 7 10 10 11 10 8 10 11 10H 1.008相对原子质量He 4.003Li BeB C N O F Ne6.941 9.01210.81 12.01 14.01 16.00 19.00 20.18Na MgAl Si P S Cl Ar22.99 24.3126.98 28.09 30.97 32.07 35.45 39.95K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3Cs Ba La- Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn132.9 137.3 Lu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222]Fr Ra Ac- [223] [226] LrRfDbSgBhHsMtDsRg第一题(6 分) C-Cl 键的形成对生命的衍化具有重要意义。
其中 H3CCl 的形成不排除是这个“重要意义” 的重要成分。
胡波化学竞赛题库

胡波化学竞赛题库中学化学竞赛试题资源库——苯酚A组1.下列反应式表示苯酚的-OH+H2O-O-+H3O+ A 水解 B 水化C 电解 D 电离2.下列关于苯酚的叙述正确的是 A 苯酚和己醇是同系物 B 苯酚在常温下能跟水以任意比混溶 C 苯酚分子中所有原子可能共平面 D 苯酚不易溶于乙醇等有机溶剂3.下列物质沸点的比较,错误的是 A 1-丙醇>乙醇 B 甲醛>甲醇 C 苯酚>苯 D 1-氯丙烷>丙烷4.下列有机物不能与HCl直接反应的是 A 苯 B 乙烯 C 丙醇 D 苯酚钠5.下列物质久置于空气中因被氧化而变质且颜色发生改变的是 A NaOH B FeSO4·7H2O C CaO D 苯酚6.除去苯中所含的苯酚,可采用的适宜方法是 A 加70℃以上的热水,分液 B 加适量浓溴水,过滤 C 加足量NaOH溶液,分液 D 加适量FeCl3溶液,过滤7.实验室为除去苯中含有的少量苯酚,通常采用的方法是 A 加氢氧化钠溶液,用分液漏斗分离 B 加乙醇,用分液漏斗分离C 加热蒸馏,用分馏法分离 D 加浓溴水,用过滤法分离8.甲苯中混有少量苯酚,除去苯酚的最佳方法是A 加入足量的NaOH溶液充分振荡后,用分液漏斗分液弃除下层溶液 B 加入溴水,生成三溴苯酚,再过滤除去 C 加水,加热超过70 ℃(苯酚在热水中溶解度很大),然后用分液漏斗振荡分液后,弃除下层溶液 D 将混合物蒸馏,可先蒸出甲苯9.下列各组物质中,只用溴水一种试剂不能加以区别的是 A 苯己烷甲苯 B 硫化氢二氧化硫二氧化碳 C 苯苯酚乙醇D 乙烷乙烯乙炔10.有五种无色试剂:C2H5OH、NaOH、KSCN、C6H5OH、AgNO3,可将它们一一鉴别出来的试剂是: A 溴水 B 盐酸 C 氯化铝溶液 D 氯化铁溶液11.化学式为C7H8O,分子中含有苯环和羟基,其同分异构体可能有A 2种 B 3种 C 4种D 5种12.在苯和苯酚组成的混和物中,碳元素的质量分数为90%,则混和物的氧元素的质量分数是A % B 5% C % D % 13.以苯、硫酸、氢氧化钠、亚硫酸钠为原料,合成苯酚的方法可简单表示为:??苯酚??苯酚钠(盐+水)??苯????苯磺酸?????苯磺酸钠??????中学综合学科网第 1 页共15 页磺化亚硫酸钠固体烧碱,300pC熔融SO2根据上述的反应,判断苯磺酸、苯酚、亚硫酸三种物质的酸性强弱顺序是 A 苯磺酸>苯酚>亚硫酸 B 苯磺酸>亚硫酸>苯酚 C 亚硫酸>苯酚>苯磺酸 D 亚硫酸>苯磺酸>苯酚14.丁香油酚的结构简式如右图所示,它不具有的化学性质是 A 燃烧 B 使酸性高锰酸钾溶液褪色 C 与溴加成 D 与NaHCO3溶液反应放出二氧化碳15.扑热息痛是一种优良的解热镇痛药,其结构为:,它可能具有的化学性质是 A 不与氢氧化钠溶液反应 B 能与浓溴水发生取代反应 C 不能被氧化 D 遇三氯化铁溶液呈现紫色16.针对右面的分子结构式:下列说法正确的是 A 所有的碳原子有可能处在同一平面上 B 所有的碳原子不可能处在同一平面上 C 所有的氧原子有可能同时处在苯环平面上 D 所有的氢原子有可能同时处在苯环平面上17.酚酞的结构如右图,则下列说法中正确的是 A 分子式是C20H12O4 B 能与NaOH稀溶液反应,溶液显红色 C 能与溴水反应,产生白色沉淀 D 能与羧酸发生酯化反应18.以下实验能获得成功的是 A 用含结晶水的醋酸钠和碱石灰共热制甲烷气体 B 将铁屑、溴水、苯混合制溴苯 C 在苯酚溶液中滴入少量稀溴水出现白色沉淀 D 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色19.在苯酚的浑浊液中逐滴加入氢氧化钠溶液,浑浊液会变得,这是因为。
不饱和烃试题及答案

不饱和烃试题及答案1. 请列举至少三种不饱和烃,并说明它们各自的不饱和度。
答案:不饱和烃是指含有一个或多个碳-碳双键或三键的烃类化合物。
以下是三种不饱和烃的例子及其不饱和度:- 乙烯(C2H4): 不饱和度为1,因为它含有一个碳-碳双键。
- 乙炔(C2H2): 不饱和度为2,因为它含有一个碳-碳三键。
- 苯(C6H6): 不饱和度为4,尽管它没有明显的双键或三键,但苯环的六个碳原子都参与了环状共轭系统,因此具有高度不饱和性。
2. 写出以下不饱和烃的分子式:- 丙烯- 1,3-丁二烯- 环己烯答案:- 丙烯的分子式为C3H6。
- 1,3-丁二烯的分子式为C4H6。
- 环己烯的分子式为C6H10。
3. 描述加成反应和取代反应在不饱和烃中的区别。
答案:加成反应和取代反应是两种不同的化学反应类型,它们在不饱和烃中的表现如下:- 加成反应:在不饱和烃中,加成反应是指一个或多个原子或原子团加到不饱和键上,使得双键或三键变成单键。
例如,乙烯(C2H4)可以与氢气发生加成反应生成乙烷(C2H6)。
- 取代反应:取代反应是指不饱和烃中的一个原子或原子团被另一个原子或原子团所取代。
例如,氯乙烯(C2H3Cl)可以与氢氧化钠发生取代反应生成乙醇(C2H5OH)和氯化钠。
4. 请解释什么是共轭系统,并给出一个例子。
答案:共轭系统是指在有机分子中,两个或多个交替的单键和双键的碳原子组成的系统,这些键的电子可以在整个系统中自由移动,从而增加了分子的稳定性和反应活性。
一个典型的例子是1,3-丁二烯,它具有一个共轭的双键系统,使得整个分子具有较高的反应活性。
5. 写出一个不饱和烃的氧化反应的例子,并解释其过程。
答案:一个典型的不饱和烃氧化反应的例子是乙烯(C2H4)的氧化反应。
在这个反应中,乙烯与氧气反应生成环氧乙烷(C2H4O)。
过程如下:- 乙烯分子中的碳-碳双键被氧气分子中的氧原子攻击,形成环氧乙烷的环状结构。
- 这个反应是一个氧化反应,因为乙烯中的碳原子与氧原子结合,增加了分子的氧含量。
2005年全国化学竞赛初赛模拟试卷22

2005年全国化学(huàxué)竞赛初赛模拟试卷(54)(时间:3小时(xiǎoshí) 满分:100分)题号 1 2 3 4 5 6 7 8 9 10 11满分 3 7 7 5 5 10 5 12 11 16 18H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-LaRf Db Sg Bh Hs Mt Ds第一题(3分)2004年7月以来(yǐlái),由“塑料(sùliào)王”制造的不粘锅的安全(ānquán)问题受到质疑,在全球(特别是中国)引起了轩然大波。
“塑料王”的化学成分是(化学式表达),“塑料王”又被ISO(国际标准组织)称为“萤石纤维”,可能原因是。
化学竞赛胡波题

2005年全国化学竞赛初赛模拟试卷(06)(时间:3小时满分:100分)第一题(4分)1976年6月里,美国科学家们参加在加拿大魁北克召开的一次物理学会议上,提出一份报告,讲到发现一块含钍的独居石矿石,上面有一环状“大洞”,直径80~100微米,显然是被矿石内含有的超重元素放射性放出的射线破坏的,经X射线探测,证明116号、124号和126号元素存在。
1.116、124、126在元素周期表中位于哪族?2.用氪-86照射铅-208,可获得293118,293118发生α衰变可得116元素,写出核反应方程式。
第二题(4分)EDTA的二氢钙盐可以用做铅中毒的解药。
试解释其原因,并说明为什么用其钙盐而不直接用酸本身?第三题(6分)请仔细观察表中数据,计算上述6个离子的离子半径(上述8个化合物晶体类型相同)。
在-20℃时,将SO3加到无水乙醚中,再将与SO3等物质的量的H2S气体通入到上述体系中,发现有无色晶体A出现。
进一步测定发现,A中含有24.44%的硫元素。
1.写出A的化学式(结构简式);2.写出生成A的化学方程式;3.简述乙醚在制备A过程中的作用。
第五题(13分)苛性碱是重要的化工原料,在化学发展史上有多种制备方法:1.苛性碱的制备最早记载在我国晋朝炼丹家葛洪编著的《肘后备急》中:“取白炭灰,荻灰等分,煎令如膏。
……”请写出化学反应方程式。
2.1882年德国化学家将干燥的碳酸钠和氧化铁混合后熔融,所得产物溶于水可得苛性钠,写出反应方程式。
3.用电解NaCl水溶液的方法制备苛性钠是无机工业中最重要的反应。
19世纪初末开始,隔膜法得到广泛使用;到20世纪60年代被离子交换膜法所替代。
离子交换膜和隔膜的最大区别是什么?离子交换膜的最大优点是什么?4.1892年,一位居住在英国的美国化学技术人员卡斯特勒提出,利用水银作为阴极,电解食盐水以制取氢氧化钠,并取得专利。
该方法是继隔膜法之后实现工业化的第二种电解制备苛性钠的方法。
国初章节强化1-化学键(胡波题库)

全国高中学生化学竞赛考点强化训练1化学键(胡波题库)(省预赛前使用)A组1.由IIIA族元素A和VI族元素B组成的阴离子结构如下图,所带电荷数x、y、z依次为A 2 3 4B 2 3 2C 5 6 4D 4 3 22.2000年1月底,罗马尼亚一金矿污水处理池因降暴雨而发生裂口,10万升含氰化物和铅、汞等重金属的污水流入蒂萨河(多瑙河支流),造成该河90%以上的动植物死亡。
这是继切尔诺贝利核泄漏以来,欧洲最严重的环境污染事件。
氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是A 氰分子中四原子共直线,是非极性分子B 氰分子中C≡N键长大于C≡C键长C 氰气能与强碱溶液反应得到氰化物和次氰酸盐D 氰化氢在一定条件下能与烯烃发生加成反应3.1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。
C60分子结构酷似足球,由12个五边形与20个六边形构成,碳—碳键长介于单键与双键之间。
在此基础上人们又发现了棒碳(链式炔烃)是由300~500个碳原子组成的新物质,其分子中只含有交替连接的单键和叁键。
请对以下三个问题进行选择:(1)以下说法中不正确的是A 棒碳是直线型结构B 棒碳在一定条件下可以转化成金刚石C 棒碳是原子晶体D 棒碳中所有的化学键都是非极性共价键(2)有关C60的说法不正确的是A C60是分子晶体B C60能发生加成反应C C60摩尔质量是720D C60在一定条件下能与CuO发生置换反应(3)有关金刚石、石墨、C60、棒碳的说法不正确的是A 都是碳的同素异形体B 棒碳化学性质最活泼C 它们的物理性质不同D 它们与氧气反应唯一产物是二氧化碳B组4.以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为8-N个,N为该非金属元素的族序数,这一现象化学家称为8-N规则。
某非金属单质结构如图所示,构成该单质的元素位于:A ⅢAB ⅣA CⅤA D ⅥA5.据权威刊物报道,1996年科学家在宇宙中发现H3分子。
(整理)高中化学竞赛题--不饱和键的氧化

中学化学竞赛试题资源库——不饱和键的氧化A 组1.含有C =C 的有机物与O 3作用形成不稳定的臭氧化物,臭氧化物在还原剂存在下,与水作用分解为羰基化合物,总反应为: −−−−−→−O H Zn O 23/)21) +(R 1、R 2、R 3、R 4为H 或烷基)。
以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是A (CH 3)2C =C(CH 3)2BC D(环锌四烯)2.烯烃被酸性高锰酸钾溶液氧化的规律是烯烃中双键断裂,双键两端的基团=CH 2变成CO 2;=CHR 变成RCOOH ;=CRR ’变成R ’RC =O 。
现有某溴代烷A ,分子式为C 4H 9Br ,在NaOH 醇溶液中加热得到有机物B ,B 被酸性KMnO 4溶液氧化后不可能得到的产物是A CH 3COOHB CO 2和CH 3COCH 3C CO 2和CH 3CH 2COOHD HCOOH 和CH 3CH 2COOH3.人们已进入网络时代常观看显示屏的人,会感到眼睛疲劳,甚至会对眼睛有一定的伤害。
人眼中的视色素里含有视黄醛(见a )作为辅基的蛋白质,而与视黄难相似结构的维生素A (见b )常作为保健药物。
写出视黄酸的分子式 ;从结构上看,维生素A 与视黄醛的关系是 ;A .同分异构体B .同系物C .维生素A 是视黄醛的还原产物D .维生素A 是视黄醛的氧化产物β-胡萝卜素是一种多烯烃,分子具有对称性。
当正中间的双键被氧化断裂时,恰好生成两个视黄醛,推测卜胡萝卜素的分子式为。
4.已知: C C H H R 1R 2R 1 C O + O C H H R 2②3①Zn ,H 2O(1)该反应的生成物中含有的官能团的名称是_________,该物质在一定条件下能发生_________(填序号);①银镜反应 ②酯化反应 ③还原反应(2)已知HCHO 分子中所有原子都在同一平面内。
若要使R 1CHO 分子中所有原子都在同一平面内,R 1可以是__________(填序号);① —CH 3 ②—③-CH =CH 2 (3)某氯代烃A 的分子式为C 6H 11Cl ,它可以发生如下转化:H 2结构分析表明E 分子中含有两个甲基且没有支链。
胡波化学竞赛题库无机框图综合题
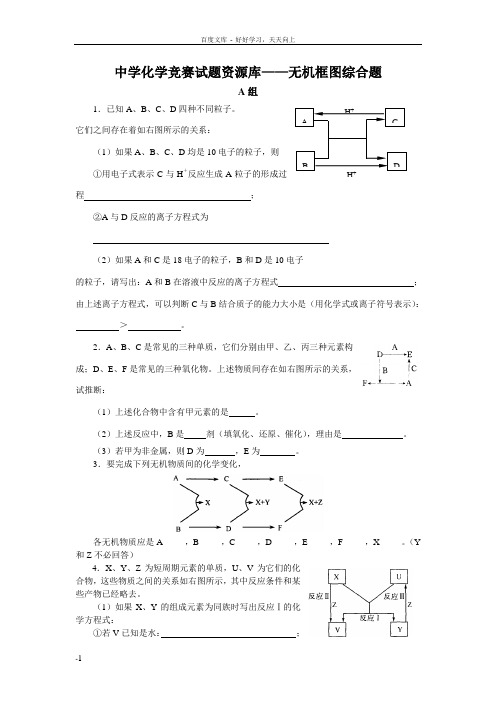
中学化学竞赛试题资源库——无机框图综合题A组1.已知A、B、C、D四种不同粒子。
它们之间存在着如右图所示的关系:(1)如果A、B、C、D均是10电子的粒子,则①用电子式表示C与H+反应生成A粒子的形成过程;②A与D反应的离子方程式为(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:A和B在溶液中反应的离子方程式;由上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):>。
2.A、B、C是常见的三种单质,它们分别由甲、乙、丙三种元素构成;D、E、F是常见的三种氧化物。
上述物质间存在如右图所示的关系,试推断:(1)上述化合物中含有甲元素的是。
(2)上述反应中,B是剂(填氧化、还原、催化),理由是。
(3)若甲为非金属,则D为,E为。
3.要完成下列无机物质间的化学变化,各无机物质应是A_____,B_____,C_____,D_____,E_____,F_____,X_____。
(Y 和Z不必回答)4.X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如右图所示,其中反应条件和某些产物已经略去。
(1)如果X、Y的组成元素为同族时写出反应Ⅰ的化学方程式:①若V已知是水:;DH+CBA②若U、V均为氧化物。
(2)如果X、Y的组成元素不同族时,按下列要求写出X、Y、Z的分子式:①X组成元素是地壳中含量最多的金属元素时,则X为;Y为;Z为。
②若Y组成元素在自然界中形成的化合物种类最多时,则X为;Y为;Z 为。
③若Z是密度最小的物质,则X为;Y为;Z为。
5.甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体。
A和B以物质的量2︰1通入水中,得到C溶液。
请根据下图的转化关系回答:(1)按要求写出下列物质:乙分子的电子式A分子的结构式白色沉淀E、F的化学式、(2)写出溶液C中加氯水的离子方程式:(3)在催化剂和加热条件下,A可与丙反应,化学方程式为:6.如图所示。
胡波化学竞赛题库-生物化学

中学化学竞赛试题资源库——生物化学A组1.大豆含有大量的蛋白质和脂肪,由大豆配制出来的莱肴很多,它是人体营养中最重要的补品,我们每天都要饮食大量的豆制品。
请回答下列问题:(1)我们所吃的豆腐是一种A凝胶 B 蛋白质 C 脂肪 D 淀粉(2)点豆腐所采用的凝聚剂是A石膏 B 硫酸钾 C 氯化钡 D 六水氯化镁(3)我们食用的大豆,最终补充给人体的主要成分是A氨基酸 B 蛋白质 C 多肽 D 糖类(4)蛋白质水解的最终产物是。
请以甘氨酸为例,写出与盐酸反应的化学方程式。
(5)大豆是绿色植物,需要大量的氮、磷、钾等营养元素,请问这个观点是否正确?为什么?(6)大豆中同时还含有一定量的酯类,它是由高级脂肪酸和发生酯化反应形成的,常温下呈液态,请举出一例,写出该物质的结构简式。
(7)豆油不能保存较长时间的原因主要是。
所以必须进行硬化,油脂的硬化就是指。
人造脂肪指的是。
2.在测定血液的密度时不能用密度计,因为那样做需要的太大。
巧妙的方法是:在准备好的几支试管里分别装入浓度不同的色硫酸铜溶液,其分子式为。
然后将被测血液分别滴入每支试管里,可以观察到、和三种现象。
如果血液是悬浮在硫酸铜溶液中,则说明血液的相同。
作出这样判断的根据是。
血液能在硫酸铜溶液中悬浮而不溶化是因为血液中的与重金属离子发生了反应。
3.如图为RNA的结构单体的核苷酸的主要部分——核苷中的一种腺嘌呤核苷,RNA与生命物质DNA同属核酸,对遗传和蛋白质合成具有重要意义。
(1)图中右上角部分是碱基部分,试列举DNA和RNA由哪三部分构成,并列举其碱基的种类及符号。
(2)写出上图腺嘌呤核苷的分子式,并计算0.lmol此物质燃烧完全后,把生成物中CO2通入足量Na2O2中,能得到标准状况下多少体积的O2。
4.将一株根系发育完善的新鲜水稻苗放入10℃,339克饱和的硝酸钠溶液中,3个小时后取出溶液进行测定:(1)滴入酚酞,发现溶液变红,原因是(2)测定溶液离子和水含量的变化,如果NO3-比Na+大量减少,它的原因是;(3)20克NaNO3缓慢升温至25℃(设水无损失),仍有5克NaNO3未溶,另一份蒸发掉12克水后恢复到10℃恰好饱和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学竞赛试题资源库——不饱和键的氧化A 组1.含有C =C 的有机物与O 3作用形成不稳定的臭氧化物,臭氧化物在还原剂存在下,与水作用分解为羰基化合物,总反应为: −−−−−→−O H Zn O 23/)21) +(R 1、R 2、R 3、R 4为H 或烷基)。
以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是A (CH 3)2C =C(CH 3)2BCD (环锌四烯)2.人们已进入网络时代常观看显示屏的人,会感到眼睛疲劳,甚至会对眼睛有一定的伤害。
人眼中的视色素里含有视黄醛(见a )作为辅基的蛋白质,而与视黄难相似结构的维生素A (见b )常作为保健药物。
写出视黄酸的分子式 ;从结构上看,维生素A 与视黄醛的关系是 ;A .同分异构体B .同系物C .维生素A 是视黄醛的还原产物D .维生素A 是视黄醛的氧化产物β-胡萝卜素是一种多烯烃,分子具有对称性。
当正中间的双键被氧化断裂时,恰好生成两个视黄醛,推测卜胡萝卜素的分子式为。
3.已知有机物在一定条件下氧化,碳链断裂,断裂处的两个碳原子被氧化成为羧基,例如:-CH =CH -−−→−氧化-COOH +HOOC -根据题意在方框内填入相应的有机物的结构简式其中F 与等物质的量的溴反应,生成两种互为同分异构体的产物,而G 与等物质量的溴反应时,只生成一种产物。
4.已知有机物分子中的烯键可发生臭氧分解反应,例如:R -CH =CH -CH 2OH −−−−→−+OH Zn O 23/R -CH =O +O =CH -CH 2OH 有机物A 的分子式是C 20H 26O 6,它可以在一定条件下发生缩聚反应合成一种感光性高分子B ,B 在微电子工业上用作光刻胶。
A 的部分性质如下图所示:试根据上述信息结合化学知识,回答:(1)化合物(A )、(C )、(E )中,具有酯的结构的是 ;(2)写出指定化合物的结构简式:C ;D ;E ;B 。
(3)写出反应类型:反应II ,反应III 。
B 组5.聚1,3—异戊二烯是天然橡胶的主要成分,它经臭氧氧化,再在锌粉和稀硫酸作用下水解,水解产物能发生碘仿反应。
写出水解产物的结构简式和发生碘仿反应的方程式。
6.化合物C 6H 10在催化剂存在下能与一分子氢反应,经臭氧还原水解得到醛、酮化合物C 6H 10O 2,推断化合物可能的结构。
7.当使1mol 的2-甲基-1,4-二氯丁烷和含2mol 的KOH 水溶液进行反应,得到物质A 。
在Al 2O 3存在下,加热A 使转化为B ,B 能结合1mol H 2形成数种同分异构体产物,其中异构体C 占优势和其余异构体相比较是热力学最稳定的。
C 在KMnO 4溶液作用下转变为具有如下性质的化合物D ,在30% H 2SO 4作用下脱水重排成化合物E ,在四乙酸铅的作用下,分解成两种物质F 和G ,后二者都是大量生产的有机合成产品,物质F 能发生银镜反应,而物质G 不能,但它们都能与D 反应,形成相应的环状化合物H 和I 。
写出A ~I 各物质的结构简式。
8.CH 3COCH 3−−−−−→−-)(3加成MgBr C H (CH 3)3COMgBr −−−→−+O H H 2/(CH 3)3COH −−−→−Mg HBr )2)1(CH 3)3CMgBr −−−−→−)(3加成CHO CH A −−−→−+O H H 2/B −−−−−−→−∆(消去)43%85PO H C +D C −−−−→−O H Zn O 23/)2)1 E D −−−−→−OH Zn O 23/)2)1F +G以丙酮等常见有机物为原料,由上述反应能合成醇B ,B 能消去1分子水得到三种烯烃C 、D 、H ,其中占C 占80%,D 占20%,H 因含量极低而未列出,C 的臭氧化物E 不能发生银镜,D 的臭氧化物F 能发生银镜,其中1g F 最多可得金属银14.4g ,G 与Cl 2在光照下反应时,可得三种酮的一氯取代物。
(1)写出下列物质的结构简式:A B E G(2)用一个方程式表示B 转化为C 、D 的反应。
9.不饱和烃可发生催化氧化反应:其中/C 5H 10(1为 。
(210CH 3II 得到B 和 回答下列问题:(1)B 的相对分子质量是 ;C →F 的反应类型为;D 中含有官能团的名称 。
(2)D +F →G 的化学方程式是: 。
(3)A 的结构简式为 。
(4)化合物A 的某种同分异构体通过臭氧化并经锌和水处理只得到一种产物,符合该条件的异构体的结构简式有 种。
11.在有机化学分析中,根据反应的性质和反应产物,即可确定烯烃的组成和结构(双键及支链的位置),例如:+(1)据以上线索和下列反应事实,确定C 7H 14的结构和名称:C 7H 14CH 3CHO +该烃的结构简式是 ,名称是 ;(2)把某混和气体,用上述方法进行氧化,生成0.5mol 酮、1.5mol 醛,其中含甲醛0.7mol ,且1mol 该混和气体进行加氢反应,生成1mol 饱和烃的混和气体。
又知:该混和气体由A 、B 、C 三种不饱和烃组成,分别取A 、B 、C 各1mol 分别充分燃烧,均可得到4mol 二氧化碳和72g 水,试通过计算和分析回答下列问题:①上述混和气体经臭氧氧化后可生成哪些物质(写结构简式) ; ②混和气体中各组分物质的量之比为 ;③用于氧化的混和气体,在标准状况下的体积是 L ;④加氢反应后,生成了 mol 异丁烷。
12.从月桂树油中分离得到一个烃类化合物A ,分子式为C 10H 16,它能吸收3mol H 2生成C 10H 22,化合物A 经臭氧化,水解后生成如下三种产物:CH 2O 、CH 3COCH 3、OHCCH 2CH 2COCHO 。
试推测A 可能的结构。
13.图为测定有机物的分子结构,常使待测有机物与臭氧反应,生成的臭氧化物再与水、金属锌反应,结果是有机物分子中的C =C 键断裂,生成两个C =O 键,即生成醛或酮。
例如:CH 3CH =C(CH)3CH 3CHO +CH 3COCH 3玫瑰花中有一种香料成分经此处理后得到相对分子质量较小的有机物A 和B ,A 的分子式是C 3H 6O ,且不能发生银镜反应;B 经充分加红后产物的结构简式为CH(OH)CH 2CH 2CH(OH)CH 3。
试推测此香料成分可能的结构简式。
14.蚂蚁等群居性昆虫,在找到食物后的归巢途中,用一种自身分泌物涂在土地上,为其他蚂蚁觅食引路,这种分泌物叫做跟踪剂,是信息素的一种。
所谓信息素,是指同种生物个体间用来传递信息的化学物质。
上述蚂蚁跟踪信息素叫做栊牛儿醇,又称香叶醇,是一种液态的不饱和醇,可用作香料和昆虫引诱剂。
其元素分析结果为:C 77.86%,H 11.76%,O 10.37%;相对分子质量为 154.24。
用此信息素先与臭氧反应,生成臭氧化物,再与水和金属锌反应,发生水解(在此信息素分子的双键位置上断裂,生成醛和酮),按1︰1︰1的物质的量之比得到下列3种水解产物:CH 3--CH 3 H --(CH 2)2--CH 3 H --CH 2-OH(1)写出此信息素的分子式。
(2)写出此信息素的结构式。
(3)给出此信息素的系统命名名称。
15.某烃A ,分子式为C 7H 10,经催化氢化生成化合物B (C 7H 14)。
A 在HgSO 4催化下与水反应生成醇,但不能生成烯醇式结构(该结构可进一步转化为酮)。
A 与KMnO 4剧烈反应生成化合物C ,结构式如右图所示。
试画出A 的可能结构的简式。
16.由本题所给有关信息,结合已学知识,回答问题。
有机物中的烯键可与臭氧(O 3)发生反应,再在Zn 粉的存在下水解,即可将原有烯HO O CCH 2CH 2CCH 2CO O H O键断裂,断裂处两端各结合一个氧原子成为醛基或酮基。
两步反应合在一起称为“烯烃的臭氧分解”,例如:(CH3)2C=CHCH3(CH3)2C=O+CH3CHO(1)异戊二烯臭氧分解的各种产物的结构简式为:_________________,其物质的量之比为:。
(2)写出由环己醇制备已二醛的各步反应。
(3)某烃A,化学式是C10H16。
A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和,A经催化加氢得B,分子式是C10H20,分析数据表明,分子内含有六元碳环。
请写出A和B的结构简式。
17.化合物A、B分子式均为C8H12O2。
A与浓硫酸共热后主要生成C,但伴有少量D。
C与热酸性高锰酸钾溶液反应后生成2mol酮和1mol二元酸。
D在同样条件下反应时可看到有气泡放出,并得到一个直链二元酮。
而B与浓硫酸共热后却只得到D。
请写出A、B、C、D的结构简式,并用化学方程式表示D氧化时气泡产生的过程(不必配平)。
18.化合物A(C8H17Br)经NaOH-ROH溶液处理后生成两种烯烃B1和B2,B2(C8H16)经臭氧氧化后在Zn存在下水解,只生成一种化合物C,C经催化氢化吸收1mol氢气生成醇D(C4H10O),用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8),请给出A、B2、C、D、E的结构简式。
19.完成反应式????20.测结构,式中(+)表示反应,(-)表示不反应求(A)→(G)各化合物的可能结构21.在某天然产物中得到一种有机物比分子式为H,分子式C10H12,经酸性高锰酸钾氧化后得到有机物A和B。
A经高碘酸氧化后得到分子式为C2H4O2的某酸C和CO2。
而B可由环戊二烯和乙烯经双烯加成的产物以酸性高锰酸钾氧化得到。
请给出化合物A、B和H结构简式(可用键线式表示)。
附:已知高碘酸可使邻二羰基氧化断裂:+HIO4+H2O→RCOOH+R’COOH+HIO3 22.烯烃经臭氧氧化后,在锌粉存在下水解,双键断裂,在原双键两端碳原子上各结合一个氧原子生成羰基化合物。
如:烯烃的臭氧氧化和水解,也叫烯烃的臭氧分解,它是研究烯烃分子结构的一个重要反应。
萜是一类具有异戊二烯结构单元的有机物,它广泛存在于橙花、柠檬等天然香精油中。
今有某萜烃A,元素分析得知,它含C:88.23%,H:11.77%,对氢气的相对密度为68,该烃经臭氧氧化水解,得到等物质的量的甲醛和萜。
求:(1)烃A的分子式;(2)又知烃A具有六元环结构,试写出它的结构简式。
23.苎烯(C10H16)是存在于橘子等水果中的一种化合物,它可以吸收两分子H2形成对烷(C 10H20)。
KMnO4可使苎烯氧化成。
(1)苎烯分子中有一个环,试根据氧化产物推断苎烯可能的结构;(2)苎烯属于环萜类天然有机化合物,此类物质可看做是由两个或两个以上的异戊二烯分子按照一定方式连接形成的。
试推断苎烯可能的结构。
(3)酸性条件下苎烯分子加一分子水就形成一元醇。
