1、空气各成分的用途
2.1 空气的成分(第1课时 空气的成分及用途)2024-2025学年化学科粤版(2024)上册

难
题 烧生成二氧化碳气体,导致集气瓶内压强变化不大,水不能
型 进入集气瓶内,因此实验所用的红磷不能用木炭代替;装置
突
破 右边量筒中的水的作用是进入集气瓶,显示空气中氧气的含
量;(3)由题图可知,导管在水面以下,形成了液封,装
置内气体不会逸出,因此无需使用止水夹;(4)实验过程
中,红磷燃烧放出热量,装置内气体受热膨胀,压强增大,
题
型 塞(或白磷要足量等合理即可)
____________________________(写一点即可)。
突
破
第 1 课时 空气的成分及用途
解题通法
测定空气中氧气含量的装置有多种,但原
重
难
题 理一致,都是利用物质消耗氧气使密闭容器内的压强减小,
型 都需要冷却至室温后才能读数。
突
破
第 1 课时 空气的成分及用途
液面下降,待完全反应后,逐渐冷却至室温,由于消耗了氧
气,装置内压强减小,量筒中的水进入集气瓶,液面上升,
故液面的变化情况是先下降后上升。
第 1 课时 空气的成分及用途
点燃
重
[答案] (1) 红磷+氧气
五氧化二磷
难
题 (2) 不能 进入集气瓶,显示空气中氧气的含量
型
突 (3)没有
破
(4)先下降后上升
对点典例剖析
考
点
典例1 如图装置常用来测定空气中氧气的含量。下列对
清
单
)
解 该实验的认识中正确的是 (
读
A.红磷燃烧产生大量的白色烟雾
B.实验的过程中瓶内的气压一直在减小
C.反应停止后,待集气瓶冷却至室温,
松开止水夹
我们周围的空气2

9.下列物质中,属于混合物的是 ①⑤⑥ (用序号 填空,下同),属于单质的是 ④⑦ ,属于化合物的 是 ②③ ,属于氧化物的是: 。 ② ①生铁 ②冰水混合物 ③纯碱 ④金刚石Fra bibliotek⑤医用酒精
⑥加碘盐
⑦液氧
10.氧化物与X的关系可用右下图表示,则X是 ( C ) A.混合物 B.金属氧化物
C.化合物
D.单质
2、实验条件: ⑴反应物必须易与空气中的氧气反应,且反应 没有气体生成。(Fe 、C、S、Mg不行)
铁不能在空气中燃烧,碳、硫在氧气中燃烧生成气体, 镁与氮气也反应。
⑶反应物必须过量,且容器的气密性良好。
3、实验设计:
水压装置:
白 磷
金 属 梯
图3测定空气里氧气的含量
气压装置
4、误差分析
液面上升不足1/5:
11、测定空气中氧气的体积分数可以采用下图甲乙两
种装置,甲装置实验过程中,红磷燃烧产生大量白烟, 当温度降到室温,打开止水夹,会观察到 水进入到A瓶 ,约占A瓶容积的1/5 现象。乙装置可视 为甲的改进装置,乙装置与甲装置相比较,优点在于 测量更为精确或减少污染 (任答一点)。
12.某学习小组将“从空气中制取氮气”作为研究课题, 以下是他们的实验方案:
3、保护措施:
加强大气质量监测,改善环境状况,使用清洁 能源(太阳能、风能),工业废气回收处理、 达标排放,积极植树造林、种草等。
4、空气质量报告
计入项目: SO2 CO NO2 可吸入颗粒物和臭氧
不同地区首要污染物不同;
级别越高,污染越严重。
PM2.5(可入肺颗粒物)
四、纯净物与混合物
纯净物 定义 由一种物质组成 由分子构成的纯净物中, 只有一种分子,由原子构 成的纯净物中只有一种原 子 混合物 由两种或两种以上物质组成 由分子构成的混合物中,有 2种或2种以上分子,由原子 构成的混合物中有2种或2种 以上原子
中考化学第一轮复习 专题7《空气(一)》课件 新人教版

【解析】本题考查 O2 的实验室制取。A 装置属于常温固液型,可用于 H2O2 分解制氧气 和制 CO2,长颈漏斗底端必须插入液面以下是为了防止产生的气体通过长颈漏斗逸到空气 中。加热固体药品制 O2 一般使用排水法收集。氧气的密度大于空气密度,故应正放。
答案:A
2.(2010·重庆)“森林重庆”的实施,有助于减少空气中哪种成分的含量( )
A.氧气
B.二氧化碳
C.氮气
D.稀有气体
解析:“森林重庆”的实施,会使植物的光合作用增强,能消耗空气中大量的二氧化碳, 因此能减少空气中的二氧化碳的含量。
答案:B
3.(2010·苏州)为了经久耐用,在灯泡中可填充的气体是( )
【答案】(1)10 (2)使注射器内的氧气充分与红磷反应 4P+5O2==点=燃==2P2O5 (3)装置气密性不好等合理即可
科学课上做“用红磷燃烧测定空气中氧气的体积分数”的实验时,由于红磷燃烧生成的 P2O5 对人体有一定危害,小明改用氢气燃烧来测定空气中氧气的体积分数,设计的实验装 置如下图所示,实验时用夹子 B 夹住橡胶管,打开夹子 A,点燃纯净的氢气并迅速插入甲 瓶中,使氢气在甲瓶中燃烧。
6.注意事项 (1)药品按要求选择,一定要足量。 (2)装置的气密性要良好。 (3)反应完成后要待冷却至室温再读数。
考点三
保护空气
7.空气污染来源:主要来自于化石燃料的燃烧和汽车尾气的排放。 8.目前计入空气污染指数的主要污染物有一氧化碳、二氧化硫、氮的氧化物、可吸入 颗粒物,其中二氧化硫、氮的氧化物会导致酸雨的形成。 9.防治污染的措施:制定环境保护法律;控制污染源,减少废气的排放;提倡使用无 污染能源;植树造林等。
苏教版科学空气的组成

苏教版科学空气的组成
苏教版科学中关于空气的组成的知识点主要包括以下几个方面:
空气的成分:
氧气:约占空气体积的21%。
二氧化碳:约占空气体积的0.03%。
氮气:约占空气体积的78%。
稀有气体:约占空气体积的0.94%。
其他气体和杂质:约占空气体积的0.03%。
空气的重要性和作用:
维持生命:人类和其他动物呼吸需要氧气,植物生长也需要二氧化碳。
使火燃烧:氧气是燃烧的必要条件。
带走水蒸气:空气能够使水蒸气凝结成水滴,从而形成降雨,滋润大地。
实验活动:通过观察烧烛实验、呼吸实验、水蒸气实验等活动,了解空气的性质和作用。
空气的混合物:空气是由多种气体组成的混合物,其中氧气、氮气、二氧化碳等是主要的成分。
二氧化碳的性质:二氧化碳是一种无色、无味的气体,能够使澄清石灰水变浑浊,是一种温室气体。
证明空气中有水蒸气的方法:在杯子中放入冰块,盖上盖子,过
一段时间后,杯子外壁上会出现小水珠,这是因为空气中含有水蒸气。
以上是苏教版科学中关于空气的组成的主要知识点。
通过学习这些知识点,学生可以了解空气的基本组成和性质,以及空气在自然界和人类生活中的重要作用。
同时,通过实验活动和观察实验现象,学生可以培养观察、分析和实验操作能力,加深对科学知识的理解和掌握。
2023中考化学一轮复习教材考点复习第二单元 我们周围的空气(课件70页)

液滴
检验氢气纯度
⑥氢气燃烧
考点六氧气的制取
1.实验室制法(详见实验突破)
2工业制法:分离液态空气原理:利用液氮和液氧的_______ 不同制得,属于_______ 变化。(填“物理”或“化学”)方法:
沸点
物理
3催化剂和催化作用(1)催化剂(又叫触媒):在化学反应中,能_______其他物质的化学反应速率,而本身的_______和___________ 在化学反应前后都没有变化的物质。(2)催化作用:催化剂在化学反应中所起的作用。
2023年中考化学一轮复习
教材考点复习
考点突破
考点梳理
知识归纳
第二单元 我们周围的空气
备考集训
考 点 梳 理
考点一 空气的成分及用途
1.空气的成分(按体积分数计算)
2.空气主要成分的性质及用途
主要成分
用途(性质)
氮气
.可作保护气,用于食品防腐、灯泡填充(化学性质不活泼) .液氮用于制造低温环境,医疗上用作冷冻麻醉剂 .制造氮肥和硝酸的重要原料
改变
质量
化学性质
特别提醒
1.催化剂只改变化学反应速率,即加快或减慢反应速率,并不影响生成物的质量,生成物的质量由反应物的质量决定。
2.催化剂的化学性质在化学反应前后不变,但物理性质可能改变。
考点七化合反应和分解反应
1.化合反应和分解反应
化合反应
分解反应
概念
由_____________________生成_____________的反应
剧烈燃烧,火星四射,生成黑色固体,放出热量
防止生成的高温熔融物溅落炸裂集气瓶底
②铁丝燃烧
③硫燃烧
a.现象:在空气中,发出_____________ 色火焰,生成有刺激性气味气体;在氧气中,发出_____________ 色火焰,生成有刺激性气味气体;b.化学方程式:_ _______________;c.注意事项:集气瓶底部放少量___________________ ,目的是___________________________________ 。
空气的主要成分、用途

一、 空气的成分空气成分 氮气 氧气 体积分数78%21%二、 空气的用途气体氧气化学性质:物理性质:密度稍大于空氮气无色、无味化学性质不活在一定条件下稀有气体无色、无味不同颜色的光典例1 中国对大深度载人挺进深蓝的宏伟目标,A .O 2和H 2O 的含量 空气的成分、用途稀有气体(包括氦、氖、氩、氪、氙、氡)二氧化碳 其他气0.94%0.03%性质主要用途:供给呼吸、支持燃烧:无色、无味、不易溶于水,大于空气潜水、登山、医疗救护焊、宇航、化工生产等无味、难溶于水,熔沸点低医疗上在液氮冷冻麻醉术;超导材料在液氮的能显示超导性能质不活泼用作食物和焊接金属时条件下可以发生化学反应用于制造含氮化合物药、硝酸、炸药无味、难溶于水,通电时发出色的光,化学性质不活泼用作保护气、灯泡的填各种颜色的霓虹灯度载人潜水器“蛟龙号”的研制取得了世界瞩目的成绩,乘蛟龙号下潜的科研人员,他们的呼吸环境必须注B .O 2和N 2的含量其他气体和杂质0.03%要用途疗救护、炼钢、气生产等冻麻醉条件下做手液氮的低温环境下金属时的保护气 合物,如化肥、农泡的填充气,制作的成绩,实现了我国必须注意调节的是C.O2和H2的含量D.O2和CO2的含量【解析】人类呼吸呼入氧气,氧气的浓度过高或过低都对人不利;呼出二氧化碳,若空气中二氧化碳浓度过高,会使人窒息,所以要调节氧气和二氧化碳的含量,故选D。
【答案】D变式拓展1.下列关于空气成分的说法错误的是()A. 氧气约占空气总体积4/5B. 稀有气体可制成多种用途的电光源如霓虹灯C. 氮气充入食品包装中以防腐D. 二氧化碳在大气中含量不断上升,从而导致温室效应增强2.空气是一种宝贵的资源,下列生产生活中用到的气体不是..来自空气的是()A.作为燃料电池燃料的H2B.用于生产氮肥的N2C.用于医疗急救的O2D.用于飞艇的He3.空气是一种宝贵的自然资源,由多种物质组成。
下列说法错误..的是()A.氦气可用来填充探空气球B.氮气充入食品包装袋防腐C.二氧化碳是植物光合作用的基本原料D.氧气可用作火箭发射的燃料典例2我国主办2019“世界环境日”活动,其主题聚焦“空气污染”。
空气中各成分的用途

空气中各成分地用途级班薛笑然一.概念空气是构成地球周围大气地气体.无色,无味,主要成分是氮气和氧气,还有极少量地氡、氦、氖、氩、氪、氙等稀有气体和水蒸气、二氧化碳和尘埃等.b5E2R。
二.成分氮气:氧气:稀有气体:二氧化碳:其他物质:.空气是多种气体地混合物.它地恒定组成部分为氧气、氮气、氩和氖等稀有气体,可变组成部分为二氧化碳和水蒸气,它们在空气中地含量随地球上地位置和温度不同在很小限度地范围内会微有变动.至于空气中地不定组成部分,则随不同地区变化而有不同,例如,靠近冶金工厂地地方会含有二氧化硫,靠近氯碱工厂地地方会含有氯等等.此外空气中还有微量地氢、臭氧、氧化二氮、甲烷以及或多或少地尘埃.p1Ean。
三.各成分地用途Ⅰ氮气.化工合成氮主要用于合成氨,反应式为(条件为高压,高温、和催化剂.反应为可逆反应)还是合成纤维(锦纶、腈纶)、合成树脂、合成橡胶等地重要原料. 氮是一种营养元素,还可以用来制作化肥,例如:碳酸氢铵,氯化铵,硝酸铵等等.DXDiT。
.汽车轮胎.提高轮胎行驶地稳定性和舒适性氮气几乎为惰性地双原子气体,化学性质极不活泼,气体分子比氧分子大,不易热胀冷缩,变形幅度小,其渗透轮胎胎壁地速度比空气慢约~,能保持稳定胎压,提高轮胎行驶地稳定性,保证驾驶地舒适性;氮气地音频传导性低,仅为普通空气地,使用氮气能有效减少轮胎地噪音,提高行驶地宁静度.RTCrp。
.防止爆胎和缺气碾行汽车行驶时,轮胎温度会因与地面磨擦而升高,尤其在高速行驶及紧急刹车时,胎内气温急速上升,胎压骤增.或高温导致轮胎橡胶老化,疲劳强度下降,胎面磨损剧烈,导致爆胎.而与一般高压空气相比,高纯度氮气因为无氧且几乎不含水份不含油,其热膨胀系数低,热传导性低,升温慢,降低了轮胎聚热地速度,不可燃也不助燃等特性,所以可大大地减少爆胎地几率.5PCzV。
.延长轮胎使用寿命使用氮气后,胎压稳定体积变化小,大大降低了轮胎不规则磨擦地可能性,如冠磨、胎肩磨、偏磨,提高了轮胎地使用寿命;橡胶地老化是受空气中地氧分子氧化所致,老化后其强度及弹性下降,且会有龟裂现象,这时造成轮胎使用寿命缩短地原因之一.氮气分离装置能极大限度地排除空气中地氧气、硫、油、水和其它杂质,有效降低了轮胎内衬层地氧化程度和橡胶被腐蚀地现象,不会腐蚀金属轮辋,延长了轮胎地使用寿命,也极大程度减少轮辋生锈地状况.jLBHr。
探索无处不在的空气

探索无处不在的空气空气是地球上最普遍的物质之一,它无处不在,我们每天都在呼吸着它。
然而,我们对空气的了解却很有限。
本文将探索无处不在的空气,从它的组成、作用到我们对它的利用等方面展开讨论。
一、空气的组成空气主要由氮气、氧气、水蒸气和少量的其他气体组成。
其中,氮气占空气的78%,氧气占21%,水蒸气的含量则因地区和季节的不同而有所变化。
此外,空气中还含有二氧化碳、氩气、氦气等气体,以及微量的氮氧化物、臭氧等。
二、空气的作用1. 呼吸作用:空气中的氧气是人类和动物生存所必需的,它通过呼吸进入我们的肺部,与血液中的红细胞结合,供给身体所需的能量。
2. 气候调节:空气中的水蒸气和其他气体参与了地球的气候调节过程。
水蒸气的凝结形成云和降水,调节了地球的温度和湿度。
3. 保护层:地球的大气层起到了保护地球的作用,它能够吸收和散射太阳辐射,减轻地球表面的紫外线辐射,维持适宜的生物环境。
4. 传播声音:空气是声音传播的媒介,声波通过空气的震动传播到我们的耳朵,使我们能够听到声音。
5. 氧化作用:空气中的氧气参与了许多氧化反应,如燃烧、腐蚀等。
这些反应在工业生产和能源利用中起到了重要的作用。
三、空气的利用1. 氧气的应用:氧气广泛应用于医疗、工业、冶金等领域。
在医疗方面,氧气被用于治疗呼吸系统疾病和提供急救。
在工业方面,氧气被用于燃烧、氧化和氧化还原反应等。
在冶金方面,氧气被用于炼钢和炼铁等过程。
2. 空气净化:由于空气中存在着各种污染物,如颗粒物、有害气体等,空气净化变得越来越重要。
通过空气净化设备,可以去除空气中的污染物,提高室内空气质量。
3. 空气动力学:空气动力学是研究空气对物体运动的影响的学科。
它在航空、汽车、建筑等领域有着广泛的应用,可以帮助设计更高效、更安全的交通工具和建筑结构。
4. 空气能利用:空气能是一种可再生能源,通过空气能热泵等设备,可以将空气中的热能转化为供暖、制冷和热水等能源。
总结:空气是我们生活中不可或缺的一部分,它的组成和作用对我们的生活和环境有着重要的影响。
人教版化学九年级上册 第二单元我们周围的空气知识点精讲

第二单元:《我们周围的空气》知识汇总精讲【知识构造】【知识梳理】一、空气成分及其用途1、法国化学家拉瓦锡用定量的方法研究空气成分,得出结论:空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。
2、空气的成分及其体积分数(大约)空气成分氮气氧气稀有气体二氧化碳水蒸气和其它成分体积分数78% 21% 0.934% 0.034% 0.02%3、空气各成分的用途:(1)别离液态空气制取各成分降温加热氧气该过程是物理变化空气液态空气氮气(石油蒸馏同这里的原理一样)加压原理:各成分沸点不同稀有气体(2)用途:氮气工业生产硝酸和氮肥,食品防腐,液态氮气用作制冷剂; O2供应呼吸,支持燃烧,钢铁冶炼,金属焊接;稀有气体用作保护气,制作多用途电光源;4、空气质量:(1)空气中的有害物:SO2、CO、NO2、O3和可吸入颗粒物、总悬浮颗粒物;(2)空气污染指数越高,污染越严重;(3)CO2不属于空气污染物,但含量增多会引起温室效应。
典例1 【2021.北京】空气成分中,体积分数最大的是()A.氧气 B.氮气 C.稀有气体 D.二氧化碳【答案】B【解析】空气成分中,体积分数:氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%和其他气体0.03%。
应选B。
典例2【2021.重庆A卷】某些袋装食品需要充气防腐,以下最宜作充入气体的是( )A.氮气B.氧气C.甲烷D.一氧化碳【答案】A【解析】氮气化学性质较稳定,无毒且来源广,可以作袋装食品保护气。
应选A。
典例3【2021湖南衡阳】有关空气的表达中,正确的选项是()A.空气中的氧气具有可燃性,可用作火箭燃料B.化工厂废气及汽车尾气,不会造成空气污染C.稀有气体有广泛的用途,可制成多种用途的电光源D.空气中的氮气与氧气体积比约为5:1【答案】C【解析】A、氧气能支持燃烧,但不具有可燃性,不能用作火箭燃料,应选项说法错误。
B、化工厂废气及汽车尾气,会造成空气污染,应选项说法错误。
五年级科学上册第一课空气的成分

空气是我们生活中必不可少的东西,它是地球上所有生物体的共同呼吸之源。
空气的成分对人类和其他生物的生存和发展至关重要。
在五年级科学上册中,第一课就是关于空气的成分,通过本文,我们将详细介绍空气的成分以及对生物体的重要性。
一、空气的成分1. 氮气氮气是空气中最主要的成分之一,约占空气的78,它对植物的生长和动物的呼吸起着重要的作用。
氮气还能稳定大气的温度,并参与了大气层的氮循环。
2. 氧气氧气在空气中约占21,它是人类和其他生物维持生命所必需的气体,是呼吸作用的重要原料。
氧气还参与了大气的氧循环,是地球大气层中的重要组成部分。
3. 二氧化碳二氧化碳是空气中的另一重要组成部分,约占0.03。
它是植物进行光合作用的必需气体,也是地球大气中的温室气体之一,对地球气候起着重要的调节作用。
4. 稀有气体空气中还含有少量的稀有气体,如氩气、氦气、氖气等,它们虽然含量较低,但也对大气层的稳定和温度的控制有着重要的作用。
二、空气的重要性1. 对人类的重要性空气是人类维持生命所必需的,每天人们通过呼吸来摄取氧气,将二氧化碳排出体外。
正常的空气中的成分比例和质量对人类的健康和生存至关重要,而且还能减少各种疾病的发生。
2. 对动植物的重要性空气中的氮气和二氧化碳是动植物生长发育不可缺少的重要元素,没有它们的存在,植物无法进行光合作用,人类和其他动物也无法进行正常的呼吸作用。
空气的成分对于动植物的生存和发展至关重要。
3. 对地球的重要性空气中的成分对地球的气候和环境稳定起着重要的调节作用,它们可以维持地球的温度和大气层的稳定,保障了地球生物的生存和发展。
总结:空气的成分对人类、动植物以及地球的重要性不言而喻,它们是地球上生物体共同呼吸之源,维持了地球生态系统的平衡。
我们要珍惜和保护好地球上的空气,保持空气的质量和成分,才能够保障我们自己和后代的生存和发展。
通过本文对五年级科学上册第一课空气的成分的介绍,相信读者对空气的重要性有了更深入的了解,也希望大家能够从自身做起,保护好我们生存的地球。
沪科版九年级化学第一学期同步精品课堂第二章浩瀚的大气(知识梳理)(原卷版+解析)

第1节 第二章 浩瀚的大气一、空气成分 空气成分氮气 氧气 稀有气体 二氧化碳 体积分数 二、空气各成分用途1、氧气的用途:供给 ,支持燃烧, 冶炼,金属焊接等。
2、氮气的性质:物理性质:无色、无味的气体,密度比空气 , 溶于水。
化学性质不支持 ,化学性质 。
用途:氮气 工业生产 和氮肥,食品 ,液态氮气用作制冷剂;3、稀有气体,化学性质很不活泼,用作 ;制作多用途电光源;氦可用于制造低温环境。
三、空气中氧气体积分数的测定1、反应原理: (化学方程式)。
2、现象:集气瓶中有大量的 生成,并放出热量;打开止水夹,烧杯中的水倒流到集气瓶中,并上升到约 处。
3、结论:空气中的氧气含量大约是空气总体积 ;4、实验反思:在实验中,进入集气瓶内的水的体积常小于集气瓶容积的1/5,可能是什么原因呢?四、空气污染1、空气中的有害物:细颗粒物、 、CO 、NO2、 和可吸入颗粒物;2、空气污染指数越高,污染越严重;3、CO 2不属于空气污染物,但含量增多会引起 。
五、微粒定义及性质(一)定义1、分子定义:分子是保持物质 的一种微粒。
在化学反应中,分子 , 不可分。
2、原子定义:原子是 中的最小微粒;第2节(二)微粒性质1、微粒(体积和质量)。
2、微粒在。
3、微粒间;气体物质微粒间的空隙比液体、固体物质微粒间的空隙大,容易压缩。
4、构成微粒相同,则物质的性质;构成微粒不同,则物质的性质。
六、相对原子质量:(Ar)相对原子质量是指一种原子质量对一种碳原子质量的1/12(1.6605×10-27 kg)的比值。
式量:化学式中的总和。
一、氧气的物理性质1、无色、的气体,溶于水;密度比空气。
2、氧气的液体状态是。
固体状态是。
二、氧气的化学性质1、氧气可以使带火星的木条。
用途:如何检验这是一瓶氧气?把带火星的木条伸入集气瓶中,带火星的木条,证明这是一瓶氧气。
2、木炭的燃烧实验现象在空气中在氧气中化学方程式3、硫的燃烧实验现象在空气中在氧气中表达式4、铁丝的燃烧实验现象在空气中在氧气中表达式三、化学反应1、物质与生的反应,叫做氧化反应。
浙江省2013年初中科学毕业生学业考试复习 专题32 空气(无答案)

2013年浙江省初中毕业生学业考试复习初中科学专题32 空气考点知识梳理考点一空气的成分与用途1.主要成分:空气中各成分的体积分数是相对稳定的。
在空气中,Array各成分保持着各自的化学性质。
2.各成分的用途(1)N2:工业上生产硝酸和氮肥的重要原料;液态氮气常用作;因为N2的性质,所以可用于食品防腐、保鲜,也可用于延长灯泡的使用寿命。
(2)O2:供给的重要物质;可作剂,用于钢铁冶炼、金属焊接等。
(3)稀有气体(包括、、、氪、氙、氡):因为化学性质稳定,常用作;通电时能发出不同颜色的光,故可用作各种用途的。
(4)CO2:作用的原料;固态CO2(俗称 )可作制冷剂,用于冷藏、等;在工业上可用于制碱、尿素、汽水等;还可用于灭火。
CO2在空气中的含量少,故不采用分离空气的方法制取。
考点二测定空气中氧气的含量1.实验原理:完全消耗一定体积的空气中的,导致气体的压强变,恢复原状态后减少的体积即为的体积。
2.药品的选择:所选药品只能与空气中的反应,不能和其他气体成分反应,且反应不能生成,另外药品的量要。
常用药品是、等。
3.常用实验装置反应原理: (填写化学方程式,下同)。
反应原理:4.注意事项(1)药品按要求选择,一定要足量。
(2)装置的气密性要。
(3)反应完成后要待再读数。
考点三臭氧层和温室效应1.大气中臭氧层的作用大气臭氧层主要有两个作用:其一是。
臭氧层能够吸收太阳光中的紫外线,保护地球上的人类和动植物免遭紫外线辐射的伤害;其二为。
臭氧层吸收太阳光中的紫外线并将其转换为热能加热大气。
2.温室效应(1)原因:由于现代化工业社会过多使用、和等矿物燃料,使大气中的二氧化碳浓度剧增。
(2)利弊:适度的温室效应能保证地球上的气温平衡,适于动植物的生存。
在一定程度上导致全球气候变暖,并引起一系列恶果,如①地球上的病虫害增加;②海平面上升;③气候反常,海洋风暴增多;④土地干旱,沙漠化面积增大。
(3)措施:控制二氧化碳含量增加;控制人口增长,科学使用燃料;加强植树造林,绿化大地,尽量减少温室效应给全球带来的巨大灾害。
空气的成份性质及用途

一、空氣的成份、性質及用途1.氮:約占空氣總體積的78﹪A.無色、無臭、無味的氣體;不可燃亦不助燃。
B.在高溫時可與部分金屬及非金屬產生作用,可製造植物所需的氮肥,和工業用的氨C.將食品包裝中的空氣抽出,充入氮氣,可以保鮮。
2.氧:約占空氣總體積的21﹪A. 無色、無臭、無味的氣體;不可燃但可助燃。
B.可供動、植物呼吸之用。
3.惰性氣體:在高溫及常溫下都極不易發生反應的氣體。
包括氦、氖、氬、氪、氙、氡等。
(1)氦:密度僅大於氫,可填充汽球。
(2)氖:燈管填入氖會發出紅光,可做為信號燈或霓虹燈。
(3)氬:體積占空氣的0.9﹪(第三位),可用於焊接金屬,防止金屬氧化,可裝入白熾燈泡。
4.空氣中還有水蒸氣、二氧化碳、臭氧等氣體。
所占比例因地點、氣候不同而異。
【練習題】1.空氣的成分中包含(甲)氮(乙)氧(丙)氦(丁)氖(戊)氬(己)二氧化碳(庚)水蒸氣等,請以代號回答下列問題:(1)會使火柴餘燼復燃的是_________(2)會使燃燒的火柴熄滅的是____________(3)可用來製造氨與肥料的是_______(4)在空氣中的含量因地點、氣候不同而改變的是_______(5)常充入包裝的食品中,保持食物新鮮的是_________(6)通電時會發出紅光的是______(7)常溫時不可燃、不助燃,性質安定的是______2.當深深地吸一口氣時,請問這一口氣中,含量最多的氣體是_____;吐出的氣體中含量最多的是_____3.玻璃管內放潮濕的鋼絲絨,並套上滴管橡皮頭套,黏貼在燒杯內壁。
試問:(1)三天後,鋼絲絨有_______生成(2)這段期間,玻璃管內的空氣成分會______(增加、減少或不變),所以水面會________(上升、下降或不變)(3)上述與鋼絲絨發生反應的空氣成分是_____,玻璃管內殘餘不會發生反應的氣體成分是______二、氧1.氧的製備:2.氧的性質:無色、無味、無臭的活潑氣體,有______性3.物質燃燒的產物:(1)燃燒:物質與氧化合(氧化反應),同時發光、發熱的化學變化,為______反應。
中考化学一轮复习考点精细梳理---第二单元我们周围的空气
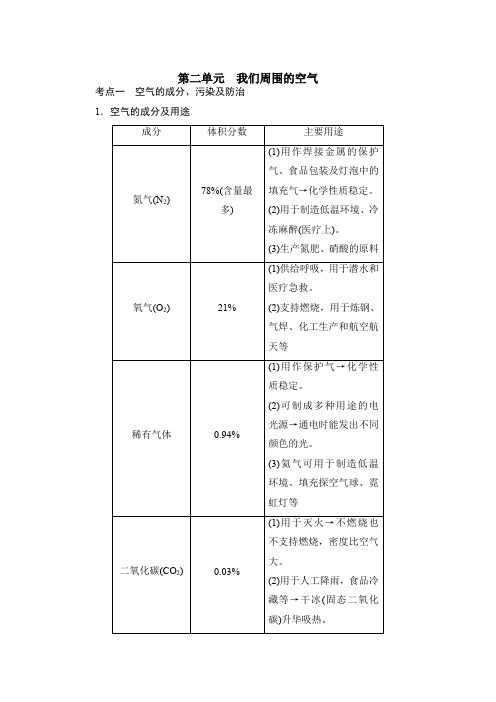
第二单元我们周围的空气考点一空气的成分、污染及防治1.空气的成分及用途2.法国化学家拉瓦锡用定量的方法研究了空气的成分。
空气中氧气含量的测定利用红磷的燃烧,把集气瓶中的氧气消耗掉,使集气瓶内的压强减小,在大气压的作用下水进入集气瓶内,进入的水的体积即为氧气的体积。
反应的化学方程式为4P +5O 2=====点燃2P 2O 5 (1)红磷燃烧,有大量白烟生成。
图1图2图3图4(1)实验原理的改进图1用铁在空气中生锈的原理设计实验,铁的缓慢氧化使集气瓶中氧气消耗更彻底,使实验结果更准确。
(2)点燃方式的改进图2、3通过电、热、光能等方式使温度达到实验药品的着火点,或将红磷换为着火点低的白磷,既能提高测量的准确度,又能减少对空气的污染。
(3)测量方式的改进图4利用注射器代替烧杯,使读数更精确3.空气的污染及防治1.物理性质标准状况下(0 ℃, 1.01×105 Pa),氧气为无色、无味、密度比空气大、不易溶于水的气体。
三态变化:气体(无色) ――→-183 ℃ 液体(淡蓝色) ――→-218 ℃ 固体(淡蓝色雪花状) 2.化学性质 (1)与金属单质反应铁丝(Fe)⎩⎪⎨⎪⎧现象⎩⎨⎧空气中:不能燃烧,红热氧气中:剧烈燃烧,火星四射,放出大量的热,生成黑色固体化学方程式:3Fe +2O 2=====点燃Fe 3O4注意⎩⎨⎧a.将铁丝绕成螺旋状,目的是增大铁丝与氧气的接触面积b.在集气瓶瓶底铺一层细沙或放少量的水,目的是防止生成 的熔融物溅落,炸裂瓶底镁条(Mg)⎩⎪⎨⎪⎧现象⎩⎨⎧空气中:发出耀眼的白光,放出热量,生成白色固体氧气中:燃烧比在空气中更剧烈化学方程式:2Mg +O 2=====点燃2MgO 注意:实验前用砂纸打磨,目的是除去表面的氧化镁薄膜或污物(2)与非金属单质反应木炭(C)⎩⎪⎨⎪⎧现象⎩⎨⎧不同点⎩⎨⎧空气中:木炭红热,无烟、无焰氧气中:剧烈燃烧,发出白光相同点:放热,生成能使澄清石灰水变浑浊的气体化学方程式⎩⎪⎨⎪⎧C +O 2=====点燃CO 2(完全燃烧)2C +O 2=====点燃2CO (不完全燃烧)硫(S)⎩⎪⎨⎪⎧现象⎩⎨⎧不同点⎩⎨⎧空气中:产生微弱的淡蓝色火焰氧气中:产生明亮的蓝紫色火焰相同点:放热,生成刺激性气味的气体化学方程式:S +O 2=====点燃SO 2注意:反应前在集气瓶中加氢氧化钠溶液,目的是吸收SO 2,防止其污染空气,化学方程式:2NaOH +SO 2===Na 2SO 3+H 2O磷(P)⎩⎪⎨⎪⎧现象:放出热量,产生大量白烟,生成白色固体化学方程式:4P +5O 2=====点燃2P 2O 5氢气(H 2)⎩⎪⎨⎪⎧现象:发出淡蓝色火焰,在火焰上方罩一干冷烧杯,内壁出现水珠化学方程式:2H 2+O 2=====点燃2H 2O(3)与化合物反应考点三 氧气的制取1.工业制法——分离液态空气法(1)原理:利用空气中液态氧和液态氮的沸点不同,采用低温蒸发的方法,该法属于物理变化。
中考化学一轮复习专题一 空气 氧气详细知识考点

①供给呼吸:如用于急救、潜水等
②支持燃烧:如用于炼钢、气焊等(助燃性) 3. 稀有气体(氦、氖、氩、氪、氙的总称)
【物理性质】没有颜色,没有气味的气体,难溶于水。通电时能发出不同颜色的光。
【化学性质】化学性质很不活泼。所以稀有气体又叫做惰性气体。 【用途】① 用作保护气(焊接金属时作保护气、灯泡中充入稀有气体使灯泡耐用); ② 用作光源(如航标灯、强照明灯、闪光灯、霓虹灯等); ③ 用于激光技术;④ 氦气可作冷却剂;⑤ 氙气可作麻醉剂。 4. 二氧化碳 ①用于灭火(不燃烧也不支持燃烧) ②干冰(固态二氧化碳)作制冷剂,可用于人工降雨 ③气体肥料,光合作用的原料
被倒吸入热的试管中,使试管炸裂。 选择装置时,要选择带有橡皮塞的弯管。 固液混合在常温下反应制备气体的装置(见上图②) 反应物和反应条件的特征:反应物中有固体和液体,反应不需要加热。 装置气密性的检查方法:在导管出口处套上橡皮塞,用弹簧夹夹紧橡皮塞,从
漏斗中加水。如果液面稳定后水面不下降,则表明装置气密性良好。 要根据实际情况选择(a)(b)(c)(d)四种装置。
的试管中,使试管炸裂。 ◆ 加热高锰酸钾时,试管口要放一团棉花,防止高锰酸钾被吹入导管,使导管堵塞。 ◆ 棉花不要离高锰酸钾太近,否则会导致发生装置爆炸。
2. 分解过氧化氢溶液制取氧气
反应原理:2H2O2
2H2O+O2↑(催化剂可换成硫酸铜溶液)
铝在空气中与氧气反应,表面形成致密的氧化膜
4Al+3O2
2Al2O3
4Al+3O2=2Al2O3
镁 镁在空气中燃烧,发出耀眼的白光、放热、生成白色粉末 2Mg+O2
2MgO
铜 红色的固体逐渐变成黑色
2Cu+O2
空气的成分 知识点(1)

第一节空气的成分一、空气的组成1、干燥洁净空气的组成:(下列数据是各成分的体积分数)纯净的空气是混合物,其中氮气、氧气、氩气、二氧化碳的化学式为N2、O2、Ar、CO2。
空气中含量最多的元素是N(或氮元素)。
二、测定空气中氧气的含量1、测定原理:利用空气中氧气与其它气体性质的差异,利用化学反应,只使密闭容器中的氧气反应掉,且不生成新的气体。
这样,容器中减少的气体即为氧气。
容器中气体减少从而气压减小,使得活塞内移(或水进入)。
2、药品选择依据:(1)只与空气中的氧气反应且不生成新的气体。
思考:测定空气中氧气的含量能不能选择木炭、蜡烛、镁条?不能,木炭、蜡烛和氧气反应产生气体二氧化碳,镁除了能与空气中的氧气反应,还能与氮气反应。
实验室常用:铜粉、红磷或白磷3、铜粉加热实验(1)实验装置①小气球的作用:缓冲气压②小气球在尾部比在上侧好:便于空气的流通,能使氧气与铜粉充分反应(2)反应原理:铜+氧气加热氧化铜(3)实验步骤:①测定反应前密闭容器中的空气的总体积空气的总体积=注射器示数+硬质玻璃管容积②在玻璃管铜粉部位加热注意事项:a.铜粉的量必须充足b.c.加热温度和时间要足够氮气氧气稀有气体(主要为氩气)二氧化碳其他气体78%21%0.934% 0.034% 0.002%③测定反应后剩余气体的体积。
注意事项:a.等装置冷却至室温再读数(原因:由于气体热胀冷缩,会使剩余气体体积偏大,则氧气的体积偏小,导致实验结果偏小)b.读数前将小球气球中的气体全部挤出(4)实验现象:铜粉表面由红色变为黑色,注射器。
(5)氧气含量的计算:=注射器中气体减少体积/(原注射器中气体体积+硬质玻璃管内气体体积)×100%(6)实验结论:氧气约占空气总体积的五分之一(7)实验误差分析:①实验结果偏小:装置漏气、未等装置冷却到室温读数、铜粉量不足、反应时间不够、加热温度达不到反应温度、加热过程没有推拉注射器②实验结果偏大:小气球内气体未完全挤出4、红磷燃烧实验(1)实验装置(2)反应原理:磷+氧气点燃五氧化二磷(3)实验步骤:①将集气瓶容积五等分,并做好标记;②夹紧止水夹,点燃燃烧匙内的红磷,立即伸入集气瓶中并塞紧瓶塞③待到燃烧停止并冷却到室温后打开止水夹,观察进入水的体积实验现象:①产生大量白烟;②烧杯中的水倒流入集气瓶中,体积约为集气瓶容积的1/5(5)实验结论:氧气约占空气总体积的五分之一(6)实验误差分析:①实验结果偏小:装置漏气、红磷的量不足、温度没冷却到室温就打开止水夹②实验结果偏大:实验前没有将弹簧夹夹紧、点燃红磷伸入集气瓶中时,没有立即塞紧瓶塞(7)实验改进:改进后的优点:装置始终密闭,实验结果准确;防止白烟污染空气三、空气是一种重要的资源1、分离液态空气法:工业上将空气通过降温加压使空气液化 ,然后加热升温液态的空气,利用空气中各成分沸点不同,使他们分别汽化,逐一分离出来.最先分离出来的是氮气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人工固氮的主要途径是用氮气合成氨。
大豆的根瘤与根瘤菌
• 生物固氮
• 生产化肥、炸药、 染料等
• 保
物质的燃烧
动植物的腐烂
钢铁的锈蚀 、、、、、、
氦气—粉红色 氖气---红色 氩气---紫色 氙气---强光
从古至今,空气中的成分是以极慢的速度变化着, 原始大气是以二氧化碳、一氧化碳、甲烷和氨为主。
空气的成分
• 氧气 • 氮气 • 二氧化碳 • 水蒸气 • 灰尘 • 稀有气体----氦气、氖气、氩气、氪气、
氙气等气体
植物生长需要氮元素。氮元素的来源就是 空气中的氮气。
天然固氮主要是靠闪电将氮气氧化成亚硝 酸和硝酸。进入土壤中转变为亚硝酸盐和硝 酸盐。通过这种途径,每年可以从大气中固 定约4000万吨的氮
