SO2(二氧化硫)理化特性
二氧化硫 (2)

二氧化硫(SO2)二氧化硫是一种化学物质,化学式为SO2。
它是由硫和氧元素组成的化合物,具有刺激性气味和有毒性。
在自然界中,二氧化硫主要来源于火山喷发、煤炭燃烧和工业生产过程。
本文将介绍二氧化硫的性质、来源、影响以及防止和减少二氧化硫污染的方法。
1. 二氧化硫的性质•化学性质:二氧化硫是一种无色气体,在标准大气压下很容易液化成为无色液体。
它具有刺激性气味,并且可溶于水形成二氧化硫溶液。
•物理性质:二氧化硫具有较高的溶解度和较低的沸点。
它的密度比空气大,且可被火焰燃烧产生三氧化硫(SO3)。
2. 二氧化硫的来源2.1 自然来源•火山喷发:火山喷发是最主要的自然源之一,火山口喷发会释放大量的二氧化硫和其它有害气体进入大气中。
•海洋生物活动:某些海洋生物,如海藻和珊瑚,可以释放二氧化硫。
•大气中的硫化物:大气中的硫化物,如硫化氢和二硫化碳,在一系列化学反应中会转化为二氧化硫。
2.2 人为活动•燃煤和工业生产:燃煤和工业生产过程是二氧化硫的主要人为来源。
在这些过程中,煤和矿石中的硫会在燃烧或冶炼过程中产生二氧化硫。
•交通运输:汽车、火车和船只的尾气中也含有二氧化硫,特别是使用含硫燃料的交通工具。
•家庭和商业活动:家庭和商业用途中的燃烧活动,如烧煤、燃天然气和燃油,也会排放二氧化硫。
3. 二氧化硫的污染和影响3.1 大气污染二氧化硫是大气污染物之一,它与其他废气(如氮氧化物和颗粒物)一起形成雾霾和酸雨。
当大气中的二氧化硫经过氧化反应形成硫酸,与水蒸气结合形成酸雨。
酸雨对于植物、动物和人类的健康都有危害,会导致土壤酸化、水源污染和呼吸道疾病。
3.2 健康影响•呼吸系统问题:长期暴露在高浓度的二氧化硫中会导致呼吸道疾病,如支气管炎和哮喘。
•眼睛和皮肤刺激:高浓度的二氧化硫会刺激眼睛和皮肤,引起眼红、烧灼感和皮肤过敏。
•心血管疾病:二氧化硫与氮氧化物反应产生酸性颗粒物,对心血管系统造成不良影响,增加心血管疾病的风险。
二氧化硫(SO2)PPT课件

(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40).
(二) SO2的化学性质:
1:具有酸性氧化物的通性
⑴与H2O反应: SO2+H2O H2SO3(亚硫酸)
⑵与碱反应 SO2+2NaOH=Na2SO3+H2O
3、强氧化性。
现象:有气体产生,产生气体使品红褪色: 反应后试管中液体溶于水溶液呈蓝色
Cu+2H2SO4(浓)== CuSO4+SO2↑+2H2O 思考:1、为何对SO2进行尾气吸收?
吸收试剂用什么?
再如: C+2H2SO4(浓)== CO2 ↑+2SO2 ↑+2H2O
常温下,浓硫酸可使铁、铝表面形成一层致 密氧化物的保护膜而钝化
❖ _______SO_2_+C_a_O_==_=C_高a_S温O_3_______________,
高温
❖ _____O2_+_2C_a_SO_3_==_=_2C_aS_O_4_______________。
❖ 练习:
❖ 1.现有雨水样品1份,每隔一段时间测定该雨水 样品的pH,所得数据如下表:
2SO3
SO3+H2O=H2SO4
原理二:
SO2 + H2O H2SO3
2H2SO3+O2=2H2SO4
回忆:氮氧化物形成酸雨的原理?
汽车尾气等产生NO、NO2 等氮氧化物。 形成酸雨的原理可简单表述为: 2NO+O2=NO2 3NO2+H2O=2HNO3+NO
2.酸雨的防治
❖ 例题:为防治酸雨降低煤燃烧时向大气排放 的二氧化硫,工业上将生石灰和含硫煤混合 后使用。请写出燃烧时有关“固硫”(不使 硫化合物进入大气)反应的化学方程式
(Ⅱ)二氧化硫、硫酸、硫酸盐、硫酸的工业...

SO2 某些有机色素 △
无色的物质
经SO2漂白的物质长时间光照或受热后, 会恢复原来的颜色,因此,其漂白作用不持久。 漂白本质:SO2与有色物质的化合作用。 浸有浓溴水的滤纸悬在SO2的集气瓶中,滤纸 的红棕色褪去,SO2表现_____性。 还原 SO2通入蓝色石蕊溶液的现象: ___________________________。 蓝色溶液变紫色后又变红色
化学性质
1、具有酸的通性(强酸) H2SO4=2H++SO42Cu(OH)2 CuO ZnO BaCl2 CuSO4 +2H2O CuSO4 +H2O ZnSO4 +H2↑ BaSO4+2HCl
H2SO4
FeS+H2SO4 =FeSO4+H2S↑
紫色石蕊试液 变红
2、难挥发性 实验室制HCl(HF)、HNO3利用了硫酸的难挥发性。 ∆ 2NaCl+H2SO4(浓)==Na2SO4+2HCl↑ 微热 NaNO3+H2SO4(浓)=====NaHSO4+HNO3↑
二氧化硫的性质及应用

二氧化硫的性质及应用二氧化硫,化学式为SO2,是一种无色、有刺激性气味的气体。
它广泛存在于自然界中,并在许多工业和商业应用中发挥着关键作用。
然而,由于其具有某些有害特性,二氧化硫的排放也引起了环境和健康问题。
一、二氧化硫的性质二氧化硫是由硫和氧组成的化合物,化学式为SO2。
它是一种无色、有刺激性的气体,在常温下易溶于水。
二氧化硫的分子结构使其具有多种化学性质,包括氧化性、还原性和酸性。
二、二氧化硫的应用1、工业用途二氧化硫在工业中应用广泛。
首先,它被广泛用于纸浆和纸张的漂白。
其次,二氧化硫也是制造硫酸和其他化学物质的重要原料。
此外,二氧化硫还用于制造肥料、橡胶制品和食品加工。
2、食品添加剂在食品工业中,二氧化硫被用作防腐剂和抗氧化剂,以延长食品的保质期。
它还被用于制作一些特定的食品,如葡萄酒和啤酒,以保持其口感和质量。
3、生物医学应用在生物医学领域,二氧化硫也被用于多种应用。
例如,它被用于制作一些药物和生物试剂,以及用于治疗某些疾病。
此外,二氧化硫也被用于消毒和清洁医疗设备。
三、二氧化硫的排放和环境影响尽管二氧化硫在某些应用中具有重要作用,但其排放也带来了环境和健康问题。
二氧化硫的排放主要来自燃煤和石油燃烧,以及一些工业过程。
这些排放可能导致酸雨和其他环境问题。
因此,许多国家和地区都实施了严格的环保法规,以限制二氧化硫的排放。
四、结论二氧化硫是一种具有重要应用的有害气体。
尽管其应用广泛,但其排放也带来了环境和健康问题。
因此,我们需要继续研究和开发更环保的替代品和技术,以减少二氧化硫的排放和对环境的影响。
对于现有的二氧化硫应用,我们也需要采取适当的措施来减少其对环境和人类健康的影响。
“二氧化硫的性质”教学设计一、教材分析二氧化硫是高中化学硫及其化合物的性质一节中安排的重要内容之一,是高中化学重要的基本概念和理论的重要组成部分,也是高考必考的重要内容之一。
本节课不仅具有很强的基础性,而且其理论性和实用性都很强,对于强化学生的环境保护意识,加强对大气污染的防治有着重要的意义。
优质课_二氧化硫的性质和作用

品红溶液 征反应,常被
用来鉴别或检 验SO2。
现象:品红溶液褪色 现象:加热后溶液变回红色
漂白原理:SO2+品红 △ 不稳定的无色物质
自学思考
1. 硫酸型酸雨如何形成? 2.酸雨有哪些危害?二氧化硫来源? 3.如何防治?
当降水的PH低于5.6时,降水 即称为酸雨。
1.二氧化硫溶于水是像蔗糖溶于水一样 是个物理变化还是像氯气溶于水一样 发生了化学反应了呢?可不可以通过 实验来证明?
2.从物质分类角度看,二氧化硫属 于什么类型氧化物?
二、SO2的化学性质: 1.与水反应
SO2 + H2O
H2SO3 (可逆反应)
2.具有酸性氧化 物的通性
(类比CO2)
①与碱反应 ②与碱性氧化物反应
设计实验证明SO2具有还原性
可选用的药品
KMnO4溶液,3%H2O2水溶液, BaCl2溶液,稀盐酸,SO2气体
“黄”银耳是怎样“变”成“雪白雪白”的
“空中死神”——酸 雨
1.SO2主要来源有哪些? 2.酸雨的危害有哪些? 3.如何防治酸雨?
SO2 + SHO22O + H2OH2SO3 H2SO3 2H2SO32+HO22S=O23H+2OS2O=42H2SO4 来自于空气里烟尘中
①②①③
品红
酸性高锰酸钾
澄清石灰水
①
②
③
作业
复习本节内容,完成课本P95第9题
•
9、有时候读书是一种巧妙地避开思考 的方法 。2021/8/52021/8/5T hursday, August 05, 2021
•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/8/52021/8/52021/8/58/5/2021 5:03:31 AM
二氧化硫

二氧化硫1 编号ICSC编号:CAS号:RTECS号:SY-UN编号:EC编号:IMDG规则页码:危险货物编号:2 名称中文名称:二氧化硫;亚硫酐;无水亚硫酐英文名称:Sukfyr duixude;Sulfurous anhydride3 理化特性化学式:SO2分子量:64.07性状:常温下无色气体,具辛辣和窒息气味,在常温时压力(4~5Kg/cm2)下压缩为无色、流动的液体。
沸点:-10.1℃熔点:-75.5℃相对密度:2.3蒸气压:挥发性:溶解度:水中8.5%(25℃);易于与水混合并氧化成亚硫酸;易溶于甲醇、乙醇;溶于硫酸、醋酸、氯仿和乙醚。
闪点:自燃温度:爆炸极限:油水分配系数:4 危险性与接触机会用于制造硫酸、亚硫酸、硫酸盐、冶炼镁、精炼石油、有机化合物合成、硫化橡胶及漂白、制冷、熏蒸、消毒杀虫等;在烧制硫磺、燃烧含硫的镁、石油等燃料熔炼硫化矿石、还原物质作用于硫酸都可产生,是大气污染源之一。
常因管道等设备泄漏、破裂等而危及职工及公众。
5 毒理属中等毒类,系刺激性气体;高浓度吸入,引起喉头痉挛、水肿而窒息。
人的嗅觉阈值0.0015-0.003mg/L、刺激阈值0.01mg/L;0.03mg/L浓度时只能耐受1分钟,过久则引起呼吸困难、青紫、呕吐甚至意识障碍;大量吸入时,由于SO2窒息作用和细胞毒作用而致死。
5.1 急性毒性30-50mg/m3可立即引起眼、鼻、粘膜刺激症状和支气管痉挛及窒息感,1000mg/m3以上即时生命危险,5000mg/m3以上,立即产生喉头痉挛、喉头水肿而窒息。
SO2易被粘膜的湿润表面而吸收生成亚硫酸,一部分进而氧化成硫酸。
因此对呼吸道及眼有强烈刺激作用,大量吸入可引起肺水肿、喉水肿、声带痉挛而致窒息。
5.2 慢性毒性动物实验显示小鼠吸入5.24mg/m3低浓度,经半年出现免疫反应受抑制。
长期吸入平均浓度50mg/m3的接触者,可引起慢性鼻炎和嗅觉迟钝、牙酸蚀症、肺通气功能下降、免疫功能受损等表现。
二氧化硫

燃爆危险 皮肤接触 眼睛接触 吸入 食入 灭火方法 操作注意事项
储存注意事项
Page
18
二氧化硫
沸点(bp) : -10℃ 英文缩写:
爆炸上限【%(V/V) 】 :无意义 溶解性: 主要用途:
爆炸下限【%(V/V) 】 :无意义 溶于水、乙醇 用于制造硫酸和保险粉等
第二部分
稳定性 禁忌物 危险性类别 侵入途径 健康危害
稳定性和反应性及危险性和防护措施
稳定 强还原剂、强氧化剂、易燃或可燃物 有毒气体 吸入 易被润的年末表面吸收生成亚硫酸、硫酸。对眼及呼吸道粘膜有 强烈的刺激作用。大量吸如可引起肺水肿、喉水肿、声带痉挛而制 窒息。长期低浓度接触,可有头痛、头晕、乏力等全身症状以及慢 性鼻炎、咽喉炎、嗅觉及味觉减退等。 不燃,无特殊燃爆特性 立即脱去污染的衣着,用大量流动清水冲洗,有不适感,就医 提起眼脸,用流动清水或者生理盐水冲洗,如不适,及时就医 迅速脱离现场至空气新鲜处,保持呼吸道通畅,如呼吸困难,给吸 氧,就医 不会通过该途径接触 本品不燃,根据着火原因选择适当灭火剂灭火。 严加密闭,提供充分的局部排风和全面通风。操作人员必须经过专 门培训,严格遵守操作规程。佩戴自吸过滤式防毒面具(全面罩) , 穿聚乙烯防毒服,戴橡胶手套。 储存于阴凉通风良好的有毒气体专用库房内,远离火种、热源。库 温不宜超过 30℃,应与易(可)燃物、氧化剂、还原剂、食用化学 品分开存放,切忌混储。储区应备有泄露应急处理设备。
常用物料 MSDS
第一部分
化学品中文名: 二氧化硫;亚硫酸酐 分子式:SO2 相对密度 (水=1) :1.4 (-10℃)
化学品及理化特性
外观和性状:无色气 体,有刺激气味 熔点(mp) : -75.5℃ 闪点(℃) :无意义
二氧化硫

二氧化硫百科名片中文名称:二氧化硫化学式:SO2 相对分子质量:64.06 化学品类别:酸性气体是否管制:否目录展开编辑本段化学品简介管制信息本品不受管制名称中文名称:二氧化硫中文别名:亚硫酸酐英文别名: Sulfur Dioxide编码信息技术说明书编码: 41CAS No.: 7446-09-5EINECS号: 231-195-2InChI: InChI=1/O2S/c1-3-2编辑本段结构SO2是一个弯曲的分子,其对称点群为C2v。
硫原子的氧化态为+4,形式电荷为0,被5个电子对包围着,因此可以描述为超价分子。
从分子轨道理论的观点来看,可以认为这些价电子大部分都参与形成S-O键。
二氧化硫的三种共振结构色态常温下为无色有刺激性气味的有毒气体熔点-72.4℃(200.75K)沸点-10℃(263K)物理性质无色,常温下为无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(约为1:40)化学性质二氧化硫可以在硫磺燃烧的条件下生成S(s) +O2(g) =点燃= SO2(g)硫化氢可以燃烧生成二氧化硫2H2S(g) + 3O2(g) ==点燃= 2H2O(g) + 2SO2(g)加热硫铁矿,闪锌矿,硫化汞,可以生成二氧化硫二氧化硫漂白品红溶液4FeS2(s) + 11O2(g) === 2Fe2O3(s) + 8SO2(g)2ZnS(s) + 3O2(g) === 2ZnO(s) + 2SO2(g)HgS(s) + O2(g) === Hg(g) + SO2(g)应用:用于生产硫以及作为杀虫剂、杀菌剂、漂白剂和还原剂。
在大气中,二氧化硫会氧化而成硫酸雾或硫酸盐气溶胶,是环境酸化的重要前驱物。
大气中二氧化硫浓度在0.5ppm以上对人体已有潜在影响;在1~3ppm 时多数人开始感到刺激;在400~500ppm时人会出现溃疡和肺水肿直至窒息死亡。
二氧化硫与大气实验步骤中的烟尘有协同作用。
当大气中二氧化硫浓度为0.21ppm,烟尘浓度大于0.3mg/lL,可使呼吸道疾病发病率增高,慢性病患者的病情迅速恶化。
最新二氧化硫的理化性质及危险有害特性表

包装类别:O52
包装方法:钢质气瓶;安瓿瓶外普通木箱。
储存注意事项
储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。应与易(可)燃物、氧化剂、还原剂、食用化学品分开存放,切忌混储。储区应备有泄漏应急处理设备。
运输注意事项
本品铁路运输时限使用耐压液化气企业自备罐车装运,装运前需报有关部门批准。铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。采用刚瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物、氧化剂、还原剂、食用化学品等混装混运。夏季应早晚运输,防止日光曝晒。公路运输时要按规定路线行驶,禁止在居民区和人口稠密区停留。铁路运输时要禁止溜放。
毒性及健康危害
侵入途径
吸入
急性毒性
LD50:无资料
LC50:6600mg/m3,1小时(大鼠吸入)
健康危害
易被湿润的粘膜表面吸收生成亚硫酸、硫酸。对眼及呼吸道粘膜有强烈的刺激作用。大量吸入可引起肺水肿、喉水肿、声带痉挛而致窒息。 急性中毒:轻度中毒时,发生流泪、畏光、咳嗽,咽、喉灼痛等;严重中毒可在数小时内发生肺水肿;极高浓度吸入可引起反射性声门痉挛而致窒息。皮肤或眼接触发生炎症或灼伤。 慢性影响:长期低浓度接触,可有头痛、头昏、乏力等全身症状以及慢性鼻炎、咽喉炎、支气管炎、嗅觉及味觉减退等。少数工人有牙齿酸蚀症。
旁站监理记录表
GD220240□□
单位(子单位)工程名称:
旁站日期:年 月 日
旁站气候:晴、雨、阴
旁站监理的部位或工序:xxx施工升降机安装.
旁站监理开始时间:年 月 日 时旁站监理结束时:年 月 日 时
二氧化硫的理化性质及危险有害特性表
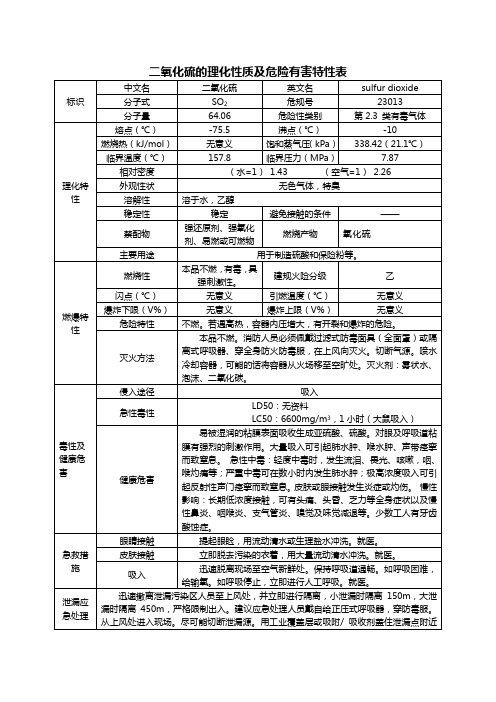
标识
中文名
二氧化硫
英文名
sulfur dioxide
分子式
SO2
危规号
23013
分子量
64.06
危险性类别
第2.3 类有毒气体
理化特性
熔点(℃)
-75.5
沸点(℃)
-10
燃烧热(kJ/mol)
无意义
饱和蒸气压(kPa)
338.42(21.1℃)
临界温度(℃)
157.8
毒性及健康危害
侵入途径
吸入
急性毒性
LD50:无资料
LC50:6600mg/m3,1小时(大鼠吸入)
健康危害
易被湿润的粘膜表面吸收生成亚硫酸、硫酸。对眼及呼吸道粘膜有强烈的刺激作用。大量吸入可引起肺水肿、喉水肿、声带痉挛而致窒息。 急性中毒:轻度中毒时,发生流泪、畏光、咳嗽,咽、喉灼痛等;严重中毒可在数小时内发生肺水肿;极高浓度吸入可引起反射性声门痉挛而致窒息。皮肤或眼接触发生炎症或灼伤。 慢性影响:长期低浓度接触,可有头痛、头昏、乏力等全身症状以及慢性鼻炎、咽喉炎、支气管炎、嗅觉及味觉减退等。少数工人有牙齿酸蚀症。
引燃温度(℃)
无意义
爆炸下限(V%)
无意义
爆炸上限(V%)
无意义
危险特性
不燃。若遇高热,容器内压增大,有开裂和爆炸的危险。
灭火方法
本品不燃。消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风向灭火。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷处。灭火剂:雾状水、泡沫、二氧化碳。
操作注意事项
严加密闭,提供充分的局部排风和全面通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(全面罩),穿聚乙烯防毒服,戴橡胶手套。远离易燃、可燃物。防止气体泄漏到工作场所空气中。避免与氧化剂、还原剂接触。搬运时轻装轻卸,防止钢瓶及附件破损。配备泄漏应急处理设备。
SO2

关于大气污染对人类的危害性
空气与人类的生存是息息相关的,它直接参与人体的气体代 谢、物质代谢和体温调节等过程。一个人每天呼吸的空气约为1 万多升,折合质量约为12.9 kg,约为每天所需食物和饮水量的 10倍。随着现代工业和交通的迅猛发展,烟尘和汽车尾气等的 排放,超越了大气的自净界限,接踵而至的却是一个十分严峻 的问题——大气污染。 对大气污染影响较大的污染物有:硫氧化物、氮氧化物、 碳氢化合物、碳氧化合物、粉尘等。 硫氧化物是酸性物质,来自含硫燃料(石油、煤)的燃烧 ,主要是指二氧化硫和三氧化硫。它们在一定条件下能形成对 人类极为有害的气溶胶和酸雨。硫的氧化物不仅污染环境,而 且严重地危害人的健康,能刺激人呼吸道,使内径变窄,阻力 增大,造成对细菌感染的抵抗能力下降,损伤骨髓、脾等造血 器官,破坏体内新陈代谢。1952年12月5日至8日发生在英国
[问题] NO2在什么情况下能全部转化为HNO3? 4NO2+O2+2H2O == 4HNO3 4NO+3O2+2H2O==4HNO3
4、在NO2被水吸收的反应中,发生氧化反应 、 被水吸收的反应中, 和发生还原反应的物质的质量之比 ( D )
A、3:1 、 : C、1:2 、 :
B、1:3 、 : D、2:1 、 :
震惊世界的“伦敦烟雾事件”就属这一类空气污染惨例,在短短 的四天里,支气管炎、肺炎、哮喘、冠心病骤然激增,葬送了 4000多人的性命,即便在毒雾过后的两个月内还有人厄运难逃, 陆续有8000余人罹难。 氮氧化物和碳氢化合物主要是由汽车排放出的废气,经太阳光 紫外线照射而发生一系列复杂的光化学反应,形成光化学烟雾, 这是一以臭氧、氮氧化物、醛、酮类、过氧乙酰硝酸酯及其气溶 胶的氧化性污染物。 碳氧化物包括一氧化碳和二氧化碳,主要由矿物燃料的燃烧 释放。二氧化碳气体能强烈吸收太阳的红外线,使地球表面气温 升高,造成“温室效应”,改变并破坏了生态平衡。一氧化碳无 色无味,它与血红蛋白的亲合力为氧气与血红蛋白亲合力的210倍 ,使血红蛋白丧失输氧的能力而引起组织缺氧,导致头痛,神经 麻痹,甚至生命危险。
二氧化硫的理化性质及危险 有害特性表
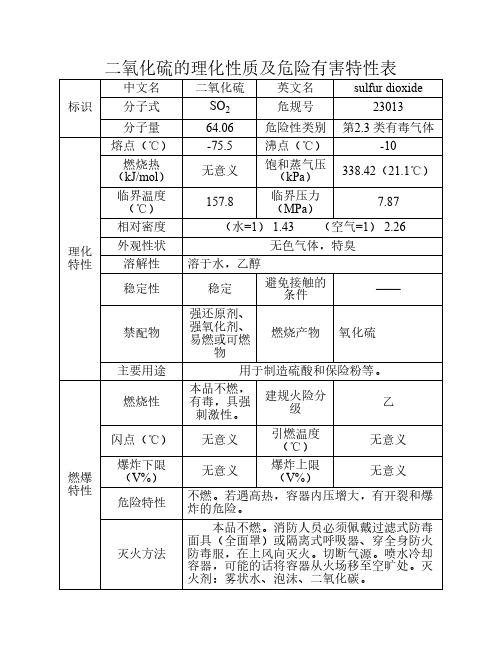
呼吸系统防护:空气中浓度超标时,佩戴自吸过滤式防毒 面具(全面罩)。紧急事态抢救或撤离时,建议佩戴正压自给 式呼吸器。眼睛防护:呼吸系统防护中已作防护。
身体防护:穿聚乙烯防毒服。 手防护:戴橡胶手套。 其他防护:工作现场禁止吸烟、进食和饮水。工作完毕, 淋浴更衣。保持良好的卫生习惯。
严加密闭,提供充分的局部排风和全面通风。操作人员必 须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸 过滤式防毒面具(全面罩),穿聚乙烯防毒服,戴橡胶手套。 远离易燃、可燃物。防止气体泄漏到工作场所空气中。避免与 氧化剂、还原剂接触。搬运时轻装轻卸,防止钢瓶及附件破 损。配备泄漏应急处理设备。
临界压力 (MPa)
7.87
相对密度
(水=1) 1.43 (空气=1) 2.26
理化 特性
外观性状
无色气体,特臭
溶解性 溶于水,乙醇
稳定性
稳定
避免接触的 条件
——
禁配物
强还原剂、 强氧化剂、 易燃或可燃
物
燃烧产物 氧化硫
主要用途
用于制造硫酸和保险粉等。
燃烧性
本品不燃, 有毒,具强 刺激性。
建规火险分 级
皮肤接触
立即脱去污染的衣着,用大量流动清水冲 洗。就医。
眼睛接触
提起眼睑,用流动清水或生理盐水冲洗。 就医。
吸入
迅速脱离现场至空气新鲜处。保持呼吸道 通畅。如呼吸困难,给输氧。如呼吸停止,立 即进行人工呼吸。就医。
迅速撤离泄漏污染区人员至上风处,并立即进行隔离,小 泄漏时隔离150m,大泄漏时隔离450m,严格限制出入。建议 应急处理人员戴自给正压式呼吸器,穿防毒服。从上风处进入 现场。尽可能切断泄漏源。用工业覆盖层或吸附/ 吸收剂盖住 泄漏点附近的下水道等地方,防止气体进入。合理通风,加速 扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生的大量 废水。如有可能,用一捉捕器使气体通过次氯酸钠溶液。漏气 容器要妥善处理,修复、检验后再用。
二氧化硫

二氧化硫二氧化硫又称亚硫酸酐,是最常见的硫氧化物,为硫酸原料气的主要成分,是大气主要污染物之一。
无色气体,有强烈刺激性气味。
火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。
由于煤和石油通常都含有硫化合物,因此燃烧时会生成二氧化硫。
当二氧化硫溶于水中,会形成亚硫酸(酸雨的主要成分)。
若把SO2进一步氧化,通常在催化剂如二氧化氮的存在下,便会生成硫酸。
中文名:二氧化硫别名:亚硫酸酐英文名:Sulfur dioxide 化学式:SO2CAS号:7446-09-5 RTECS:WS4550000摩尔质量:64.054 g·mol−1 外观:无色气体密度:0.002551 g/L 熔点:-72.4℃沸点:-10℃溶解度(水):9.4 g/100 mL (25 °C)警示术语:R:23-34 安全术语:S:1/2-9-26-36/37/39-45主要危害:大气主要污染物之一二氧化硫-分子结构二氧化硫,是一个弯曲的分子,其对称点群为C2v。
硫原子的氧化态为+4,形式电荷为0,被5个电子对包围着,因此可以描述为超价分子。
从分子轨道理论的观点来看,可以认为这些价电子大部分都参与形成S—O键。
SO2中的S—O键长(143.1 pm)要比一氧化硫中的S—O键长(148.1 pm)短,而O3中的O—O键长(127.8 pm)则比氧气O2中的O—O键长(120.7 pm)长。
SO2的平均键能(548 kJ/mol)要大于SO的平均键能(524 kJ/mol),而O3的平均键长键能(297 kJ/mol)则小于O2的平均键能(490 kJ/mol)。
这些证据使化学家得出结论:二氧化硫中的S—O 键的键级至少为2,与臭氧中的O-O键不同,臭氧中的O—O键的键级为1.5。
分子结构与极性:V形分子,极性分子。
二氧化硫-物理性质二氧化硫是无色有刺激性气味的气体。
溶于丙酮、乙醇、甲酸等多种有机溶剂,溶于水(0℃时溶解度22.8g/l00ml,90℃时溶解度0.58g/100ml)。
二氧化硫(SO2)课件

工业管理
加强工业企业的环境监管和排 放控制,采用清洁生产技术, 减少二氧化硫(SO2)的排放量。
技术手段
引进脱硫技术、电除尘技术等, 对二氧化硫(SO2)进行处理和净 化。
环境监测
建立监测体系,定期监测二氧 化硫(SO2)浓度,及时采取治理 和应对措施。
二氧化硫(SO2)的应用
工业生产
二氧化硫(SO2)可用于制造硫 酸、二氧化硫(SO2)气体干燥 剂等工业产品。
化学试剂
二氧化硫(SO2)作为还原剂用 于有机合成、化学分析等领 域。
食品添加剂
二氧化硫(SO2)可用作食品的 防腐剂、漂白剂和酸化剂。
结论
总结二氧化硫(SO2)的重要性和危害,强调对二氧化硫(SO2)的治理和管理的重要性,并展望二氧化硫(SO2)在未 来的应用前景。
二氧化硫(SO2)PPT课件
二氧化硫(SO2)PPT课件简介
什么是二氧化硫(SO2)
二氧化硫(SO2)是一种无色气体,具有刺激性的气味。它由硫和氧元素组成,化学式为SO2。其分子结构为S-OO。二氧化硫(SO2)具有很高的反应活性和溶解性。
二氧化硫(SO2)的物理性质和化学性质
物理性质
二氧化硫(SO2)是一种无色气体,具有刺激性气味。 它可溶于水,形成亚硫酸。在高温下,二氧化硫 (SO2)会分解为硫和氧。
二氧化硫(SO2)的危害
1
空气污染
二氧化硫(SO2)是主要的空气污染物之一,会导致酸雨和雾霾,对环境和人类健 康造成危害。
2
环境污染
高浓度的二氧化硫(SO2)可导致植被受损,影响地球生态系统的平衡。
3
人体健康影响
呼吸高浓度的二氧化硫(SO2)会刺激呼吸道,引发气喘、支气管炎等疾病。
二氧化硫的性质与作用

二氧化硫的性质与作用二氧化硫是一种无色、刺激性气体,化学式为SO2、它在自然界中由于火山活动、工业排放和生物代谢等过程中释放出来。
以下将详细介绍二氧化硫的性质和作用。
1.物理性质:-二氧化硫是一种无色气体,具有刺激性气味。
-它有较高的沸点和较低的熔点,沸点为-10°C,熔点为-75°C。
-在室温下,二氧化硫是不可燃的,但可以作为氧化剂。
-它比空气重,能够聚集在低洼区域。
-二氧化硫具有较高的溶解度,可以溶解在水中形成亚硫酸(H2SO3)。
2.化学性质:-二氧化硫经常作为还原剂参与化学反应。
它可以与氧、卤素、酸等进行反应。
-它可以与水反应生成亚硫酸。
当二氧化硫溶解在水中时,会产生亚硫酸,这种酸性溶液有一定的强酸性。
-它可以与氧气反应生成三氧化硫(SO3),形成硫酸。
-二氧化硫可以被氧化成为二氧化硫酸(H2SO4),这是一种极强的酸。
3.生态效应:-二氧化硫是大气污染物之一,具有一定的毒性。
当大量的二氧化硫排放到大气中时,会导致可见光透过能力降低,产生雾霾,并对人体呼吸系统造成刺激和危害。
-二氧化硫溶解在水中形成亚硫酸,减少了水中的溶解氧,对水生生物有害。
-二氧化硫对植被也有一定的危害作用。
它会破坏植物叶片的叶绿素,干扰光合作用,影响植物的生长和养分吸收。
4.工业应用:-二氧化硫是制取硫酸的重要原料。
通过将二氧化硫气体通入水中,制取亚硫酸,再经氧化得到硫酸。
-它被用作漂白剂和消毒剂,因为它可以与细菌和真菌融合,破坏其细胞结构。
-二氧化硫被广泛用于食品工业。
它可以用来保鲜、防止腐败、抗氧化和改善食物的质量。
-二氧化硫还被添加到葡萄酒中作为抗菌剂和抗氧化剂,防止酒在贮存和酿造过程中发生氧化反应。
总结起来,二氧化硫是一种具有刺激性气味的无色气体,具有较高的溶解度。
其化学性质活泼,在很多化学反应中扮演着重要的角色。
然而,二氧化硫也是一种有害气体,对人类、植被和水生生物有一定的危害。
在工业方面,二氧化硫被广泛应用于制取硫酸、食品保鲜和葡萄酒加工等领域。
二氧化硫

二氧化硫
1、理化特性
无色气体,特臭;熔点为-75.5℃;沸点为-10℃;相对密度为1.43;相对密度为2.26;溶于水、乙醇;主要用途:用于制造硫酸和保险粉等。
2、危险特性
秒燃。
若遇高热,容器内压增大,有开裂和爆炸的危险。
3、健康危害
易被湿润的粘膜表面吸收生成亚硫酸、硫酸。
对眼及呼吸道粘膜有强烈的刺激作用。
大量吸入可起肺水肿、喉水肿、声带痉挛而致窒息。
急性中毒:轻度中毒时,发生流泪、畏光、咳嗽,咽、喉灼痛等;严重中毒可在数小时内发生水肿;极高浓度吸入可引起反射性声门冯挛而致窒息。
皮肤或眼接触民生炎症或灼伤。
慢性影响:长期低浓度接触,可有头痛、头昏、乏力等全身症状以及慢性鼻炎、咽喉炎、支气管炎、嗅觉及味觉减退等。
少数工人有牙齿酸蚀症。
4、应急行动
迅速撤离泄漏污染区人员至上风处,并立即进行隔离,小泄漏时隔离150m,大泄漏时隔离450m,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
从上风处进入现场。
尽可能切断漏源。
用工业覆盖层或吸附/吸收剂盖住泄漏附近的下水道等地方,防止气体进入。
合理通风,加速扩散。
喷雾状水稀释、溶解。
构筑围堤或挖坑收容产生的大量废水。
如有可能,有一捉捕器使气体通过次氯酸钠溶液。
漏气容器要妥善处理,修复、检验后再用。
二氧化硫安全技术说明书

化学品安全技术说明书(二氧化硫)第一部分化学品及企业标识化学品中文名:二氧化硫化学品英文名:Sulfur Dioxide企业名称:企业地址:邮编:传真:联系电话:电子邮件地址:企业应急电话:SDS编码:产品推荐及限制用途:用于制造漂白剂、防腐剂、硫酸等。
第二部分危险性概述紧急情况概述:有毒,具强刺激性。
气体对上呼吸道和肺有强烈刺激性。
如长时间暴露,甚至可引起死亡。
GHS危险性类别:加压气体-压缩气体,皮肤腐蚀/刺激-1B,严重眼睛损伤/眼睛刺激性-1,急性毒性-吸入-3。
标签要素:象形图:警示词:危险危险信息:含压力下气体,如受热可爆炸;引起严重的皮肤灼伤和眼睛损伤;引起严重眼睛损伤; 吸入会中毒。
防范说明:预防措施:避免吸入烟气、气体;仅在室外或通风良好处操作;操作后彻底清洗,工作场所不得进食、饮水或吸烟;戴防护眼镜、防护面罩。
事故响应:吸入:将患者转移到空气新鲜处,休息,保持利于呼吸的体位,呼叫中毒控制中心或就医;眼睛接触:用水细心冲洗数分钟,如带隐形眼镜并可方便地取出,则取出隐形眼镜,继续冲洗;如果眼睛刺激持续:就医。
安全储存:在通风良好处储存;与强还原剂、强氧化剂、易燃或可燃物等分开储存;保持容器/管道密闭;上锁保管。
废弃处置:把废气通入碱液中中和,然后用水冲入废水处理系统。
物理化学危险:本品不燃,有毒,具强刺激性。
健康危害:易被湿润的粘膜表面吸收生成亚硫酸、硫酸。
对眼及呼吸道粘膜有强烈的刺激作用。
大量吸入可引起肺水肿、喉水肿、声带痉挛而致窒息。
环境危害:对大气可造成严重污染。
第三部分成分/组成信息物质混合物√危险成分浓度CAS No.二氧化硫≥12%7446-09-5第四部分急救措施皮肤接触:用大量肥皂水和水清洗。
眼睛接触:用水细心冲洗数分钟。
吸入:将患者转移到空气新鲜处,休息,保持利于呼吸的体位。
呼叫中毒控制中心或就医。
食入:无资料第五部分消防措施特别危险性:本品不燃,有毒,具有强刺激性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化硫
二氧化硫(化学式:SO2)是最常见的硫氧化物。
无色气体,有强烈刺激性气味。
大气主要污染物之一。
火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。
由于煤和石油通常都含有硫化合物,因此燃烧时会生成二氧化硫。
当二氧化硫溶于水中,会形成亚硫酸(酸雨的主要成分)。
若把SO2进一步氧化,通常在催化剂如二氧化氮的存在下,便会生成硫酸。
这就是对使用这些燃料作为能源的环境效果的担心的原因之一。
名称
中文名称:二氧化硫
中文别名:亚硫酸酐
英文别名:Sulfur Dioxide sulfur dioxide cyl. with 5 L (net ~6 kg); sulfur dioxide pressure tin with 100 ml (net ~128 G); sulphur dioxide
物理性质
无色,常温下为无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(约为1:40)密度2.551g/L。
(气体,20摄氏度下)
熔点:-72.4℃(200.75K)
沸点:-10℃(263K)
溶解度:
理化特性
主要成分:含量:工业级一级≥99.9%;二级≥99.0%。
外观与性状:无色气体,有刺激性气味。
pH:2/3的二氧化硫溶于水生成亚硫酸(H2SO3),溶液的pH值变成2或3 方程式:SO2+H2O ←→ H2SO3
熔点(℃):-75.5
沸点(℃):-10
相对密度(水=1):1.43
相对蒸气密度(空气=1):2.26
饱和蒸气压(kPa):338.42(21.1℃)
燃烧热(kJ/mol):无意义
临界温度(℃):157.8
临界压力(MPa):7.87
闪点(℃):无意义
引燃温度(℃):无意义
爆炸上限%(V/V):无意义
爆炸下限%(V/V):无意义
溶解性:溶于水、乙醇。
溶解度:1:40 (溶于水)
主要用途:用于制造硫酸和保险粉等。
