史上最全高考化学方程式
高考常用的化学方程式

高考常用的化学方程式一1将亚硫酸氢铵与过量氢氧化钠在稀溶液中混合:NH4++hso3-+2OH-==SO32-+H2O+nh3h2o2铜片插入硝酸银溶液中:cu+2ag+=cu2++2ag3cl2注入NaOH溶液:Cl2+2OH-==Cl-+ClO-+H2O4氯化铁和铜反应::2fe3++cu=2fe2++cu2+向5fecl2溶液中加入Cl2::2fe2++Cl2=2fe3++2Cl-6溴化亚铁溶液中通入过量氯气::2fe2++4br-+3cl2==2fe3++2br2+6cl-7.向溴化亚铁溶液中注入少量氯:2fe2++Cl2=2fe3++2Cl-8在碘化亚铁溶液中通入足量氯气:2fe2++4i-+3cl2==2fe3++2i2+6cl-9向碘化铁溶液中加入少量氯2fe2++Cl2=2fe3++2Cl-10实验室用mno2和浓盐酸制取cl2::mno2+4h++2cl-mn2++cl2↑+2h2o11.向饱和碳酸钠溶液中加入足量的CO2:CO2+2Na++CO32-+H2O=2nahco3↓12少量的co2通入澄清石灰水中::co2+ca2++2oh-=caco3↓+h2o13.向澄清石灰水中加入足量的CO2:CO2+OH-=2hco3-14少量的so2通入澄清石灰水中::so2+ca2++2oh-=caso3↓+h2o15.向澄清石灰水中引入足够的SO2:SO2+OH-=2hso3-16agno3溶液中滴入过量氨水::ag++2nh3h2o=agnh32++2h2o17向三氯化铁溶液中加入铁粉:2fe3++Fe=3fe2+18钠和冷水反应:2na+2h2o=2na++2oh-+h2↑19铁粉和稀硫酸:Fe+2H+==Fe2++H2↑10feso4酸性溶液中加过量双氧水:2fe2++h2o2+2h+=2fe3++2h2o二氧化硅与氢氧化钠溶液的反应:SiO2+2OH-=sio32-+H2O22na与cuso4溶液反应:2na+2h2o+cu2+=2na++cuoh2↓+h2↑23Na与FeCl3溶液的反应:6na+6H2O+2fe3+=6na++2feoh3↓ + 3h2↑ 24o与h2o反应:na2o+2h2o=2na++2oh-25na 2O 2与H 2O的反应:2Na 2O 2+2H 2O=4na++4OH-+O2↑26al2o3与盐酸反应:al2o3+6h+==2al3++3h2o27al2o3与NaOH溶液的反应:al2o3+2OH-==2alo2-+h2o28aloh3与hcl反应:aloh3+3h+==al3++3h2o29aloh 3与NaOH溶液的反应:aloh 3+OH-=alo 2-+2H 2O30na2sio3溶液与稀盐酸反应:sio32-+2h+h2sio3↓二1、4na+o2══2na2o2、 2na+o2na2o23、2na+cl22nacl4、 2na+sna2s5、2na+2h2o══2naoh+h2↑6、 na2o+h2o==2naoh7、2na2o+o22na2o28、na2o+co2══碳酸钠9、na2o+2hcl══2nacl+h2o10、2na2o2+2h2o══4naoh+o2↑11、2na2o2+2co2══2na2co3+o212、2na2o2+2h2so4══2na2so4+o2↑+2h2o13、2nahco3na2co3+co2+h2o14、nahco3+naoh══na2co3+h2o15、na2co3+co2+h2o══2nahco316、 si+o2sio217、si+2cl2sicl418、si+2f2══sif419、si+4hf══sif4↑+2h2↑20、si+2naoh+h2o══na2sio3+2h2↑6、sio2+2csi+2co↑21、sio2+2naoh══na2sio3+h2o22、sio2+4hf══sif4↑+2h2o9、h2sio3sio2+h2o23、na2sio3+2hcl══h2sio3↓+2nacl24、na2sio3+2hcl+h2o══h4sio4↓+2nacl25、na2sio3+co2+h2o══h2sio3↓+na2co3226、nh3+hcl══氯化铵27、2no2红棕色n2o4无色28.4hno3浓缩4no2↑ + 氧气↑ + 2H2O29、cu+4hno3浓==cuno32+2no2↑+2h2o30.3cu+8hno3稀释==3cuno32+2No↑ + 4h2o12,C+4hno3浓CO2↑ + 4no2↑ + 2H2O三向1NA 2SiO 3溶液中注入少量CO 2气体:SiO 32-+CO 2+H 2O H 2SiO 3↓ + CO 32-2si与naoh溶液反应:si+2oh-+2h2osio32-+2h2↑当向氯水中加入3So 2时,氯水会褪色:SO 2+Cl 2+2H 2O 2H++SO 42-+2Cl-4so2通入溴水中‘溴水褪色’:so2+br2+2h2o2h++so42-+2br-5向氨中滴加稀盐酸:nh3h2o+H+==NH4++H2O6向na2co3溶液中滴入几滴稀盐酸少量:h++co32-=hco3一7将多余的稀盐酸滴入Na2CO3溶液:2h++CO32-=CO2↑ + H2O8向na2so3溶液中滴入几滴稀盐酸少量:h++so32-=hso3一9将多余的稀盐酸滴入Na2SO3溶液:2h++SO32-=SO2↑ + H2O10向naalo2溶液中滴入几滴稀盐酸少量:alo2-+h2o+h+=aloh3↓11将多余的稀盐酸滴入NaAlO2溶液:4H++AlO2-=Al3++2H2O12cahco32与硝酸反应:h++hco3-=co2↑+h2o13铝与盐酸的反应:2Al+6h+=Al3++3h2↑14银与稀硝酸反应:3ag+4h++no3-=3ag++no↑+2h2o银与浓硝酸的反应:Ag+2H++NO3-=Ag++NO2↑ + H2O16alcl3水解显酸性:al3++3h2o=aloh3+3h+17na2co3水解呈碱性:CO32-+H2O=HCO3-+Oh-18nh42so4水解显酸性:nh4++h2o=nh3h2o+h+19alcl 3与NaAlO 2溶液的反应:Al 3++3alo 2-+6h 2O=4aloh 3↓ 20al2so43与nahco3溶液反应:al3++3hco3-=aloh3↓+3co2↑21feno33与NaHCO3溶液的反应:Fe3++3hco3-=feoh3↓ + 3co2↑22氯气与水反应:cl2+h2o=cl-+h++hclo次氯酸23nahco 3与盐酸的反应:H++HCO 3-=CO 2↑ + h2o24氨水与醋酸反应:nh3h2o+ch3cooh=nh4++ch3coo-+h2o25水与少量CO2反应:CO2+H2O=HCO3-+H+26fe2o3与hi碘化氢,碘酸溶液反应:fe2o3+6h++2i-=2fe2++i2+3h2o 27feoh3与hi溶液2feoh3+6h++2i-2fe2++I2+6H2O的反应28电解饱和食盐水2cl-+2h2o=cl2↑+h2↑+2oh-29电解硫酸铜溶液2Cu 2++2H 2O=2Cu+O2+4H+30明矾溶液加氢氧化钡至so42-完全反应al3++2so42-+2ba2++4oh-=2baso4↓+alo2-+2h2o。
史上最全高考化学方程式

中学化学方程式大全一、非金属单质(F2、Cl2、 O2、S、N2、P、C、Si)(1)、氧化性F2 + H2= 2HF (冷暗处爆炸)F2 +Xe(过量)=XeF2(产物为白色)2F2(过量)+Xe=XeF4(产物为白色)nF2 +2M=2MFn (表示大部分金属)2F2 +2H2O=4HF+O2F2 +2NaX=2NaX+Cl2(熔融,不能是溶液)Cl2 +H2=2HCl (光照或点燃)3Cl2 +2P 点燃2PCl3Cl2 +PCl3△PCl5Cl2 +2Na 点燃2NaCl3Cl2 +2Fe 点燃2FeCl3Cl2 +2FeCl2=2FeCl3Cl2+Cu 点燃CuCl22Cl2+2NaBr=2NaCl+Br2Cl2 +2NaI =2NaCl+I2* 5Cl2+I2+6H2O=2HIO3+10HCl Cl2 +Na2S=2NaCl+S↓Cl2 +H2S=2HCl+S↓Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2 +H2O2=2HCl+O22O2 +3Fe 点燃Fe3O4O2+K △KO2S+H2△H2S2S+C △CS2S+Fe △FeSS+2Cu △Cu2S3S+2Al △Al2S3S+Zn △ZnSN2+3H2催化剂高温高压2NH3N2+3Mg △Mg3N2N2+6Na=2Na3NP4+6H2△4PH3(2)、还原性S+O2点燃SO2S+6HNO3(浓)=H2SO4+6NO2↑+2H2O3S+4 HNO3(稀)=3SO2↑+4NO↑+2H2O N2+O2=2NO(放电)4P+5O2点燃P4O10(常写成P2O5)2P+3X2=2PX3 (X表示F2、Cl2、Br2) PX3+X2=PX5P4+20HNO3(浓)=4H3PO4+20NO2+4H2O C+2F2=CF4C+2Cl2=CCl42C+O2(少量)点燃2COC+O2(足量)点燃CO2C+CO2△2COC+H2O高温CO+H2(生成水煤气)2C+SiO2△Si+2CO(制得粗硅)Si(粗)+2Cl2△SiCl4(SiCl4+2H2△Si(纯)+4HCl)Si(粉)+O2△SiO2Si+C△SiC(金刚砂)Si+2NaOH+H2O=Na2SiO3+2H2↑(3)、歧化Cl2+H2O=HCl+HClO(加酸抑制歧化、加碱或光照促进歧化)Cl2+2NaOH=NaCl+NaClO+H2O3Cl2+6NaOH=5NaCl+NaClO3+3H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2O3S+6NaOH△2Na2S+Na2SO3+3H2O* 4P+3KOH(浓)+3H2O=PH3+3KH2PO2* 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO43C+CaO电炉CaC2+CO↑3C+SiO2电炉SiC+2CO↑二、金属单质(Na、Mg、Al、Fe)(1)、还原性2Na+H2=2NaH4Na+O2=2Na2O2Na2O+O2△2Na2O22Na+O2=Na2O22Na+S=Na2S(爆炸)2Na+2H2O=2NaOH+H2↑2Na+2NH3=2NaNH2+H24Na+TiCl4(熔融)=4NaCl+TiMg+Cl2=MgCl2Mg+Br2=MgBr22Mg+O2点燃2MgOMg+S=MgSMg+2H2O=Mg(OH)2+H2↑2Mg+TiCl4(熔融)=Ti+2MgCl2Mg+2RbCl(熔融)=MgCl2+2Rb2Mg+CO2点燃2MgO+C2Mg+SiO2点燃2MgO+SiMg+H2S=MgS+H2Mg+H2SO4=MgSO4+H2↑2Al+3Cl2△2AlCl34Al+3O2点燃2Al2O3(钝化)* 4Al(Hg)+3O2+2xH2O=2(Al2O3.xH2O)+4Hg4Al+3MnO2高温2Al2O3+3Mn2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe2Al+3FeO△Al2O3+3Fe2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O(Al、Fe、C在冷、浓的H2SO4、HNO3中钝化)Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Fe+3Br2=2FeBr3Fe+I2△FeI2Fe+S△FeS3Fe+4H2O(g)高温Fe3O4+4H2Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+CuFe+SnCl4=FeCl2+SnCl2(铁在酸性环境下、不能把四氯化锡完全还原为单质锡 Fe+SnCl2=FeCl2+Sn)三、非金属氢化物(HF、HCl、H2O、H2S、NH3)(1)、还原性4HCl(浓)+MnO2△MnCl2+Cl2+2H2O4HCl(g)+O2△2Cl2+2H2O16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O* 14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2=4HF+O22H2S+3O2(足量)=2SO2+2H2O2H2S+O2(少量)=2S+2H2O2H2S+SO2=3S+2H2OH2S+H2SO4(浓)=S↓+SO2+2H2O3H2S+2HNO3(稀)=3S↓+2NO+4H2O5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O* 3H2S+K2Cr2O7+4H2SO4=Cr2(SO4)3+K2SO4+3S+7H2O* H2S+4Na2O2+2H2O=Na2SO4+6NaOH2NH3+3CuO△3Cu+N2+3H2O2NH3+3Cl2=N2+6HCl 8NH3+3Cl2=N2+6NH4Cl4NH3+3O2(纯氧)点燃2N2+6H2O4NH3+5O2催化剂△4NO+6H2O4NH3+6NO催化剂△5N2+6HO(用氨清除NO) NaH+H2O=NaOH+H2* 4NaH+TiCl4=Ti+4NaCl+2H2CaH2+2H2O=Ca(OH)2+2H2↑(2)、酸性4HF+SiO2=SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2=CaF2↓+2HClH2S+Fe=FeS+H2↑H2S+CuCl2=CuS↓+2HClH2S+2AgNO3=Ag2S↓+2HNO3H2S+HgCl2=HgS↓+2HClH2S+Pb(NO3)2=PbS↓+2HNO3H2S+FeCl2=不反应2NH3+2Na=2NaNH2+H2(NaNH2+H2O=NaOH+NH3)(3)、碱性NH3+HCl=NH4Cl(白烟)NH3+HNO3=NH4NO3(白烟)2NH3+H2SO4=(NH4)2SO4NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯氏制碱法)(此反应用于工业制备小苏打、苏打) (4)、不稳定性2HI △H2+I22H2O 电解2H2↑+O2↑2H2O2=2H2O+O2↑H2S △H2+S四、非金属氧化物(1)、低价态的还原性2SO2+O2△2SO32SO2+O2+2H2O=2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HI* SO2+NO2=SO3+NO2NO+O2=2NO2NO+NO2+2NaOH=2NaNO2+H2O(用于制硝酸工业中吸收尾气中的NO和NO2) 2CO+O2点燃2CO2CO+CuO△Cu+CO23CO+Fe2O3△2Fe+3CO2CO+H2O催化剂△CO2+H2(2)、氧化性SO2+2H2S=3S+2H2O* SO3+2KI=K2SO3+I2NO2+2KI+H2O=NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)* 4NO2+H2S=4NO+SO3+H2O2Mg + CO2点燃2MgO+C(CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾)* SiO2+2H2△Si+2H2O* SiO2+2Mg△2MgO+Si(3)、与水的作用SO2+H2O=H2SO3SO3+H2O=H2SO43NO2+H2O=2HNO3+NON2O5+H2O=2HNO3P2O5+H2O(冷)=2HPO3P2O5+3H2O(热)=2H3PO4(P2O5极易吸水、可作气体干燥剂* P2O5+3H2SO4(浓)=2H3PO4+3SO3CO2+H2O=H2CO3(4)、与碱性物质的作用SO2+2NH3+H2O=(NH4)2SO3SO2+ (NH4)2SO3+H2O=2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理 2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑生成的硫酸铵作化肥、SO2循环作原料气)SO2+Ca(OH)2=CaSO3↓+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO=MgSO4SO3+Ca(OH)2=CaSO4+H2OCO2+2NaOH(过量)=Na2CO3+H2OCO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3↓+H2O2CO2(过量)+Ca(OH)2=Ca(HCO3)2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+C6H5ONa+H2O=C6H5OH+NaHCO3SiO2+CaO高温CaSiO3SiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑五、金属氧化物(1)、低价态的还原性6FeO+O2△2Fe3O4FeO+4HNO3=Fe(NO3)3+NO2↑+2H2O(2)、氧化性Na2O2+2Na=2Na2O(此反应用于制备Na2O)MgO、Al2O3几乎没有氧化性、很难被还原为Mg、Al.一般通过电解熔融态的MgCl2和Al2O3制Mg和Al.Fe2O3+3H2=2Fe+3H2O (制还原铁粉)Fe3O4+4H2△3Fe+4H2O(3)、与水的作用Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑(此反应分两步Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2↑. H2O2的制备可利用类似的反应BaO2+H2SO4(稀)=BaSO4+H2O2)MgO+H2O=Mg(OH)2 (缓慢反应)(4)、与酸性物质的作用Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O2Na2O2+2CO2=2Na2CO3+O2Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2MgO+SO3=MgSO4MgO+H2SO4=MgSO4+H2OAl2O3+3H2SO4=Al2(SO4)3+3H2O(Al2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2O)FeO+2HCl=FeCl2+3H2OFe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl(浓)△FeCl2+2FeCl3+4H2O六、含氧酸(1)、氧化性* 4HClO3+3H2S=3H2SO4+4HCl* HClO3+HI=HIO3+HCl* 3HClO+HI=HIO3+3HClHClO+H2SO3=H2SO4+HClHClO+H2O2=HCl+H2O+O2↑(氧化性HClO>HClO2>HClO3>HClO4、但浓、热的HClO4氧化性很强)2H2SO4(浓)+C△CO2↑ +2SO2↑+2H2O2H2SO4(浓)+S=3SO2↑+2H2OH2SO4(浓)、 HNO3(浓)+Fe(Al) 室温或冷的条件下钝化6H2SO4(浓)+2Fe=Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu △CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr △SO2+Br2+2H2OH2SO4(浓)+2HI △SO2+I2+2H2OH2SO4(稀)+Fe=FeSO4+H2↑2H2SO3+2H2S=3S↓+2H2O4HNO3(浓)+C △CO2↑+4NO2↑+2H2O* 6HNO3(浓)+S=H2SO4+6NO2↑+2H2O* 5HNO3(浓)+P=H3PO4+5NO2↑+H2O6HNO3+Fe=Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe=Fe(NO3)3+NO↑+2H2O30HNO3+8Fe=8Fe(NO3)3+3N2O↑+15H2O36HNO3+10Fe=10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe=8Fe(NO3)3+3NH4NO3+9H2O (2)、还原性H2SO3+X2+H2O=H2SO4+2HX (X表示Cl2、Br2、I2)2H2SO3+O2=2H2SO4H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2O H2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl (3)、酸性H2SO4(浓) +CaF2=CaSO4+2HF↑H2SO4(浓)+NaCl △NaHSO4+HCl↑H2SO4(浓) +2NaCl Na2SO4+2HClH2SO4(浓)+NaNO3△NaHSO4+HNO3↑(微热)3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2=2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4=H3PO4+3AgNO32HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2)等还原性气体)4H3PO4+Ca3(PO4)2=3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr=NaH2PO4+HBrH3PO4(浓)+NaI=NaH2PO4+HI(4)、不稳定性2HClO=2HCl+O2↑(见光或受热分解)4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)H2SO3=H2O+SO2 H2CO3=H2O+CO2H4SiO4=H2SiO3+H2O 七、碱(1)、低价态的还原性4Fe(OH)2+O2+2H2O=4Fe(OH)3(2)、与酸性物质的作用2NaOH+SO2(少量)=Na2SO3+H2ONaOH+SO2(足量)=NaHSO32NaOH+SiO2=Na2SiO3+H2O2NaOH+Al2O3=2NaAlO2+H2O2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2ONaOH+H2S(足量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=A l(O H)3↓+3NaClNaOH+Al(OH)3=NaAlO2+2H2ONaOH+NH4Cl△NaCl+NH3↑+H2OMg(OH)2+2NH4Cl=MgCl2+2NH3+H2OAl(OH)3+NH4Cl 不溶解(3)、不稳定性Mg(OH)2△MgO+H2O2Al(OH)3△Al2O3+3H2O2Fe(OH)3△Fe2O3+3H2OCu(OH)2△CuO+H2O八、盐(1)、氧化性2FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn=2FeCl2+ZnCl2Fe2(SO4)3+2Ag=FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2FeCl2+Mg=Fe+MgCl2(2)、还原性2FeCl2+Cl2=2FeCl33Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O2Na2SO3+O2=2Na2SO4(3)、与碱性物质的作用MgCl2+2NH3〃H2O=Mg(OH)2↓+NH4ClAlCl3+3NH3〃H2O=Al(OH)3↓+3NH4ClFeCl3+3NH3〃H2O=Fe(OH)3↓+3NH4Cl(4)、与酸性物质的作用Na3PO4+HCl=Na2HPO4+NaClNa2HPO4+HCl=NaH2PO4+NaClNaH2PO4+HCl=H3PO4+NaClNa2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl3Na2CO3+2FeCl3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O=2Al(OH)3↓+3H2S↑3NaAlO2+AlCl3+6H2O=4Al(OH)3↓(5)、不稳定性Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2ONH4Cl=NH3+HClNH4HCO3=NH3+H2O+CO22KNO3=2KNO2+O22Cu(NO3)2△2CuO+4NO2↑+O2↑2KMnO4△K2MnO4+MnO2+O2↑2KClO3△2KCl+3O2↑2NaHCO3△Na2CO3+H2O+CO2↑Ca(HCO3)2△CaCO3+H2O+CO2↑CaCO3高温CaO+CO2↑MgCO3高温MgO+CO2↑九、其他方程式1、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O2、Al4C3+12H2O=4Al(OH)3↓+3CH4↑(碳化物氮化物的水解)3、3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO34、AgNO3+NaCl=AgCl↓+NaNO32AgCl=2Ag+Cl2↑(见光或受热)5、2Br2+3Na2CO3+H2O=2NaHCO3+2NaBrO+2NaBr+CO2↑Br2+NaHCO3=NaBr+HBrO+CO2↑6、2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HClBaCl2+H2SO4=BaSO4↓+2HCl7、Ca(H2PO4)2+2Ca(OH)2=Ca3(PO4)2↓+4H2O8、4KO2+2CO2=2K2CO3+3O29、SOCl2+H2O=2HCl+SO2↑10、HIO+HCl=ICl+H2OHIO+NaOH=NaIO+H2O11、NH2Cl+H2O=NH3+HClO强热12、Cu2(OH)2CO3+4CH3COOH=2(CH3COO)2Cu+CO2↑+3H2O(CH3COO)2Cu+Fe=Cu+(CH3COO )2Fe13、6NO+4NH3催化剂△5N2+6H2O14、3BrF3+5H2O=9HF+HBrO3+O2↑+Br215、As2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O16、3As2S3+28HNO3+4H2O=6H3AsO4+9H2SO4 +28NO↑17、Na2SO3+SO2+H2O=2NaHSO32NaHSO3△Na2SO3+SO2↑+H2O18、P2O5+2NaOH=2NaPO3+H2OP2O5+6NaOH=2Na3PO3+3H2O19、3Na2S+As2S5=2Na3AsS4Na2S+SnS2=Na2SnS320、(CN)2+2H2S→21、(SCN)2+2NaOH=NaSCN+NaSCNO+H2O22、HCl+KOH=KCl+H2O2HI+PbO=PbI2+H2O23、P4(固)+5O2(气)=P4O10(固)+4Q kJ24、S(固)+O2(气)=SO2(气)+296kJ25、2H2(气)+O2(气)=2H2O(液)+511.9kJ26、C2H6O(液)+3O2(气)=2CO2+3H2O(液)+ 2Q27、4Al(固)+3O2(气)=2Al2O3(固)+3349 .3kJ28、3Fe2++NO3―+4H+=3Fe3++NO ↑+2H2O29、2S2―+SO32―+6H+=3S↓+3H2O30、SiO32―+2NH4+=H2SiO3↓+2NH331、3H2O2+2CrO2―+2OH―=2CrO42―+4H2O32、Al3++2SO42―+2Ba2++4OH―=2BaSO4 ↓+AlO2―+2H2O33、Fe2O3+6H++2I―=2Fe2++I2+3H2O34、Al3++3HCO3―=Al(OH)3↓+3CO2↑35、2H++[Ag(NH3)2]+=Ag++2NH4+36、HS―+OH―=S2―+H2O37、AsO43―+2I―+2H+=AsO33―+I2+H2O38、Cr2O72―+6Fe2++14H+=2Cr3++6Fe3++7H2O39、2I―+Cl2=2Cl―+I2I2+SO2+2H2O=SO42―+2I―+4H+SO42―+Ba2+=BaSO4↓40、2I―+2ClO―+4H+=I2+Cl2↑+2H2OI2+SO32―+H2O=SO42―+2H++2I―41、2Fe2++4Br―+3Cl2=2Fe3++2Br2+6Cl―42、2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑43、3S2―+16BrO3―+24OH―=15SO42―+16Br―+12H2O44、3Ca2++6H2PO4―+12OH―=Ca3(PO4)2↓+12H2O+4PO43―45、4H++NO3―+3Fe2+=3Fe3++NO↑+2H2OFe3++SCN―=[Fe(SCN)]2+46、2Na+2H2O=2Na++2OH―+H2↑Fe2++2OH―=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)347、S2O32―+2H+=S↓+SO2+H2O48、KAl(SO4)2==K++Al3++2SO42―49、NaHSO4=Na++HSO4―50、NH4HS=NH4++HS―51、对KCl溶液,阳极:2Cl-2e=Cl2↑阴极:2H+2e=H2↑对CuSO4溶液,阳极:4OH-4e=2H2O+O2↑阴极:2Cu2++4e=2Cu52、负极:2H2–4e=4H+正极:O2+2H2O+4e=4OH―53、负极:2Zn–4e=2Zn2+正极:O2+2H2O+4e=4OH―4OH―+4H+=H2O54、负极:Zn–2e=Zn2+正极:Ag2O+H2O+2e=2Ag+2OH―2NaCl + 2H2O电解2NaOH + H2↑+Cl2↑2NO + O2 = 2NO22H2O2 2H2O + O2↑有机化学反应方程式:1、甲烷的主要化学性质(1)氧化反应 CH4(g)+2O2(g)−−→−点燃CO2(g)+2H2O(l)(2)取代反应2、乙烯的乙烯的主要化学性质(1)氧化反应:C2H4+3O2−−→−点燃2CO2+2H2O(2)加成反应乙烯还可以和氢气、氯化氢、水等发生加成反应。
高中化学方程式大全(绝对全)

高考总复习之高中化学方程式总结化学 第一册一章 卤素 氯气节2Na Cl 2 点燃2 NaClCu Cl 2 点燃CuCl 22Fe 3Cl 2 点燃2FeCl 3H 2Cl 2点燃(光照)2HCl2P 3Cl 2 点燃 点燃2PCl 3PCl 3 Cl 2 PCl 5Cl 2 H 2O HCl HClO2Ca( OH )2 2Cl 2 Ca (ClO )2 CaCl 2 2H 2O Ca (ClO )2 CO 2 H 2O CaCO 3 2HClO 2NaOH Cl 2 NaClO NaCl H2O1、 2、 3、 4、 5、 6、 7、 8、 9、 10、 第第 12、 2KMnO 4 16HCl (浓) 2MnCl 2 2KCl 5Cl 28H 2O13、 2HClO 见光2HCl O 2 第二 节 氯化氢14、NaCl H 2SO (4 浓) NaHSO 4 HCl15、 NaHSO 4 NaClNa 2SO 4 HCl16、 2NaCl H 2SO (4 浓) Na 2SO 4 2HCl( 14、 15 结合)17HCl AgNO 3 AgCl HNO 311、 4HCl MnO 2 MnCl 2 2H 2O Cl 230、 H 2 Br 2 2HBr 31、 H 2 I 2 2HI 32、 2NaBr Cl 22NaCl Br 233、 2KI Cl 2 2KCl I 2 34、 2KI Br 2 2KBr I 2 35、 NaBr AgNO 3 AgBr NaNO 3 36、 KI AgNO 3 AgI KNO 3 37、 2AgBr 光照2Ag Br 2 第二 章 摩尔 反应热第节 摩尔18、 NaCl AgNO 3 AgCl NaNO 3 19、 KCl AgNO 3 AgCl KNO 3 20、 2HCl CaCO 3 CaCl 2 H 2O CO 2 第三节 氧化还原反应 21、 CuO H 2 Cu H 2O 22、 C 4HNO 3 CO 2 4NO 2 2H 2O 23、 4Zn 10HNO (3 极稀)4Zn ( NO 3)2 NH 4NO 3 3H 2O24、 11P 15CuSO 4 24H 2O 5Cu 3P 6H 3PO 4 15H 2SO 4 25、 KClO 3 6HCl (浓) 3Cl 2 KCl 3H 2O 26、 4Mg 10HNO (3 极稀)4Mg ( NO 3)2 NH 4NO 3 3H 2O27、 K 2Cr 2O 7 6Fe 3O 4 31H 2SO 4 Cr (2 SO 4)3 9Fe (2 SO 4)3 K 2SO 4 28、 2KNO 3 3C S K 2S N 2 3CO 2 第四节 卤族元素 29、 H 2 F 2 2HF 31H 2O38、 CO 2 CO 2239、 Mg 2 HCl MgCl 40、 Z n 2HCl ZnCl 2 H 2第三节 物质的量浓度41、 2NaOH H 2SO 4 Na 2SO 4 2H 2O第四节 反应热42、 C( 固) O (2 气) 点燃 CO (2气) 393.5kJ 43、 2H (2 气) O (2气)2H 2O (气) 483.6kJ 44、 2H (2 气) O (2气)2H 2O (液) 571.6kJ45、 C ( 固) H 2O (气) CO (气) H (2 气)第三 章 硫 硫酸第一 节 硫46、 2Cu S Cu 2S47、 F eS FeS48、 S H 2 H 2S49、 S C 高温CS 250、 SO 2点燃SO 251、 3S 6 KOH 2K2S K 2SO 4 3H2O第二节 气体摩尔体积 131.3k J第二节52、H 2S H 2 S53、 2H 2S 3O 2(足)点燃2H 2O 2SO 54、 2H 2S O 2(不足) 点燃2H 2O 2S55、 2H 2S SO2 点燃2H 2O 3S56、 H 2S Br 2 S2HBr硫的氢化物和氧77、 4FeS 2 11O 2 高温2Fe 2O 3 8SO 257、 FeS 2HCl FeCl 2 H 2S 58、 CuSO 4 H 2S CuS H 2SO 4 59、 PbAc 2 H 2S PbS 2HAc 60、 H 2S NaOHNaHS H 2O61、 NaHS NaOH Na 2S H 2O 62、 H 2S 2NaOH Na 2S 2H 2O (60、61 结合) 63、 H 2S 2FeCl 3 S 2FeCl 2 2HCl 64、 H 2SO (4 稀) FeS FeSO 4 H 2S 65、 SO 2 H 2OH 2SO 366、2SO 2O 2 V2O52SO 367、 SO 3 H 2O H 2SO 4 68、 Na 2SO 3 H 2SO 4 Na 2SO 4 H 2O SO 2 69、 SO 2 2NaOH Na 2SO 3 H 2O 70、 SO 2 CaO CaSO 371、 SO 2 2Ca ( OH )2 CaSO 3H 2O 72、 SO 2 CaSO 3 H 2O Ca ( HSO 3)2 73、 SO 2 2H 2S 3S 2H 2O 74、 SO 2 Cl 2 2H 2O 2HCl H 2SO 475、 SO 2 Br 2 2H 2O 2HBr H 2SO 4 76、 5SO 2 2H 2O 2KMnO 4 MnSO 4 K 2SO 4 2H 2SO 4第三节 硫酸的工业制法 78、 2SO 2 O 2V 2O 52SO 394、 2Fe 6H 2SO (4 浓)Fe (2 SO 4)3 3SO 2 6H 2O95、 2NaBr 2H 2SO (4 浓) Br 2 SO 2 Na 2SO 4 H 2O 96、 2NaCl H 2SO (4 浓) Na 2SO 4 2HCl 97、C 11H 22O 浓H 2SO412C11H 2O第四章 碱金属第一节 钠98、 4Na O 2 2Na 2O第四节 硫酸 硫酸盐 80、 C 2H 2 SO (4浓) CO 2 2SO 2 2H 2O81、 S 2H 2SO (4 浓) 3SO 2 2H 2O82、P H 2SO (4 浓) H 3PO 4SO 2 2H 2O83、 H 2S H 2SO (4 浓)S SO22H 2O84、 Cu 2H 2 SO (4 浓)CuSO 4 SO 22H 2O85、 BaCl 2 H 2SO 4 BaSO 4 2HCl86、 BaCl 2 Na 2 SO 4 BaSO 4 2NaCl87、 BaCl 2 Na 2 CO 3 BaCO 32NaCl88、 BaCO 3 2HClBaCl 2 H 2 O CO 289、 BaCO 32 HNO3 Ba (NO3) 2 H 2OCO 290、 Na 2CO 3 H 2SO 3Na 2S H 2 O CO 291、2H 2SO 3 O 2 2H 2SO 492、 2Na 2SO 3 O 22Na 2SO 493、2CaSO 3 O 2 2CaSO 479、 H 2O SO 3H 2SO 499、2 Na O 2Na 2O 2100、2Na Cl2 点燃2 NaCl101、2Na S 研磨Na2S102、2Na 2H 2O 2NaOHH2103、2Na 2H 2O CuSO 4Cu( OH )2 Na 2SO4 H第二节钠的氧化物104、Na 2 O H 2 O 2 NaOH105、2Na2O2 2H 2O 4NaOH O2106、Na 2O CO2 Na 2CO3107、2Na2O2 2CO2 2Na 2CO3 O2108、Na 2O 2HCl 2NaCl H 2O109、Na2O2 4HCl 4NaCl 2H 2O O2110、Na2CO 3 2HCl 2NaCl CO2 H 2O111、NaHCO 3 HCl NaCl CO2 H 2O112、2NaHCO 3 Na2CO3 CO2 H 2O113、NaHCO 3 NaOH Na2CO3 H 2O114、2NaHCO 3 Ca(OH)(2 少量) CaCO3 Na2CO3 2H2O 115、NaHCO 3 Ca( OH )(2 足量) CaCO3 NaOH H 2O116、Na 2CO 3 BaCl 2 BaCO3 2NaCl117、Na 2CO 3 CaCl 2 CaCO 3 2NaCl118、Ca (HCO 3)22HClCaCl2 2CO2 2H2O119、Ca(HCO 3)2 2NaOH CaCO3 Na2CO3 2H2O 120、NaHSO 3 HCl NaCl SO2 H 2O第三节碱金属元素140、 NH 3 HCl NH 4Cl物质结构 元素周期律 性质特殊,所有化学反应方程式均融在其他章节中。
高考重点必背化学方程式(精选)

高考重点必背化学方程式(精选)高考重点必背化学方程式(精选)你知道,高中有哪些化学方程式吗?包括有了非金属单质、电解方程式、电离方程式、酸碱盐化学方程式,以及金属单质等,下面小编给大家整理了关于高考重点必背化学方程式的内容,欢迎阅读,内容仅供参考!高考重点必背化学方程式常见气体的制取和检验⑴氧气制取原理——含氧化合物自身分解制取方程式——2KClO32KCl+3O2↑装置——略微向下倾斜的大试管,加热检验——带火星木条,复燃收集——排水法或向上排气法⑵氢气制取原理——活泼金属与弱氧化性酸的置换制取方程式——Zn+H2SO4===H2SO4+H2↑装置——启普发生器检验——点燃,淡蓝色火焰,在容器壁上有水珠收集——排水法或向下排气法⑶氯气制取原理——强氧化剂氧化含氧化合物制取方程式——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O装置——分液漏斗,圆底烧瓶,加热检验——能使湿润的蓝色石蕊试纸先变红后褪色;除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气) 收集——排饱和食盐水法或向上排气法尾气回收——Cl2+2NaOH===NaCl+NaClO+H2O⑷硫化氢①制取原理——强酸与强碱的复分解反应②制取方程式——FeS+2HCl===FeCl2+H2S↑③装置——启普发生器④检验——能使湿润的醋酸铅试纸变黑⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)⑥收集——向上排气法⑦尾气回收——H2S+2NaOH===Na2S+H2O或H2S+NaOH===NaHS+H2O⑸二氧化硫①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——Na2SO3+H2SO4===Na2SO4+SO2↑+H2O③装置——分液漏斗,圆底烧瓶④检验——先通入品红试液,褪色,后加热又恢复原红色;⑤除杂质——通入浓H2SO4(除水蒸气)⑥收集——向上排气法⑦尾气回收——SO2+2NaOH===Na2SO3+H2O⑹二氧化碳①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——CaCO3+2HClCaCl2+CO2↑+H2O③装置——启普发生器④检验——通入澄清石灰水,变浑浊⑤除杂质——通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)⑥收集——排水法或向上排气法⑺氨气①制取原理——固体铵盐与固体强碱的复分解②制取方程式——Ca(OH)2+2NH4ClCaCl2+NH3↑+2H2O③装置——略微向下倾斜的大试管,加热④检验——湿润的红色石蕊试纸,变蓝⑤除杂质——通入碱石灰(除水蒸气)收集——向下排气法⑻氯化氢①制取原理——高沸点酸与金属氯化物的复分解②制取方程式——NaCl+H2SO4Na2SO4+2HCl↑③装置——分液漏斗,圆底烧瓶,加热④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——向上排气法⑼二氧化氮①制取原理——不活泼金属与浓硝酸的氧化—还原;②制取方程式——Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成⑤收集——向上排气法⑥尾气处理——3NO2+H2O===2HNO3+NONO+NO2+2NaOH===2NaNO2+H2O⑩一氧化氮①制取原理——不活泼金属与稀硝酸的氧化—还原;②制取方程式——Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,暴露于空气中立即变红棕色⑤收集——排水法⑾一氧化碳①制取原理——浓硫酸对有机物的脱水作用②制取方程式——HCOOHCO↑+H2O③装置——分液漏斗,圆底烧瓶④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——排水法⑿甲烷①制取方程式——CH3COONa+NaOHCH4↑+Na2CO3②装置——略微向下倾斜的大试管,加热③收集——排水法或向下排空气法⒀乙烯①制取原理——浓硫酸对有机物的脱水作用②制取方程式——CH3CH2OHCH2=CH2↑+H2O③装置——分液漏斗,圆底烧瓶,加热④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气)收集——排水法⒁乙炔①制取原理——电石强烈吸水作用②制取方程式——CaC2+2H2OCa(OH)2+CHCH↑③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)收集——排水法或向下排气法高中常用化学方程式整理一、物质与氧气的反应(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二、几个分解反应13.水在直流电的作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO+H2O+CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3====2KCl+3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H2CO3===H2O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三、几个氧化还原反应19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑21.焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+Fe3O4高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO加热Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+Fe3O4高温3Fe+4CO2四、单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸---盐+氢气(置换反应)26.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑27.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑28.镁和稀硫酸M g+H2SO4=MgSO4+H2↑29.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑30.锌和稀盐酸Zn+2HCl===ZnCl2+H2↑31.铁和稀盐酸Fe+2HCl===FeCl2+H2↑32.镁和稀盐酸Mg+2HCl===MgCl2+H2↑33.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑(2)金属单质+盐(溶液)---另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu35.锌和硫酸铜溶液反应:Zn+CuSO4===ZnSO4+Cu36.铜和硝酸汞溶液反应:Cu+Hg(NO3)2===Cu(NO3)2+Hg(3)碱性氧化物+酸---盐+水37.氧化铁和稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O38.氧化铁和稀硫酸反应:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O39.氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O40.氧化铜和稀硫酸反应:CuO+H2SO4====CuSO4+H2O41.氧化镁和稀硫酸反应:MgO+H2SO4====MgSO4+H2O42.氧化钙和稀盐酸反应:CaO+2HCl====CaCl2+H2O(4)酸性氧化物+碱---盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2====Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH+SO2====Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+SO3====Na2SO4+H2O46.消石灰放在空气中变质:Ca(OH)2+CO2====CaCO3↓+H2O47.消石灰吸收二氧化硫:Ca(OH)2+SO2====CaSO3↓+H2O(5)酸+碱---盐+水48.盐酸和烧碱起反应:HCl+NaOH====NaCl+H2O49.盐酸和氢氧化钾反应:HCl+KOH====KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2====CuCl2+2H2O51.盐酸和氢氧化钙反应:2HCl+Ca(OH)2====CaCl2+2H2O52.盐酸和氢氧化铁反应:3HCl+Fe(OH)3====FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3====AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH====Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH====K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2====CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3====Fe2(SO4)3+6H2O58.硝酸和烧碱反应:HNO3+NaOH====NaNO3+H2O(6)酸+盐---另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl===CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应:Na2CO3+2HCl===2N aCl+H2O+CO2↑61.碳酸镁与稀盐酸反应:MgCO3+2HCl===MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3===AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2====BaSO4↓+2HCl(7)碱+盐---另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4====Cu(OH)2↓+Na2SO466.氢氧化钠与氯化铁:3NaOH+FeCl3====Fe(OH)3↓+3NaCl67.氢氧化钠与氯化镁:2NaOH+MgCl2====Mg(OH)2↓+2NaCl68.氢氧化钠与氯化铜:2NaOH+CuCl2====Cu(OH)2↓+2NaCl69.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3===CaCO3↓+2NaOH(8)盐+盐---两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3====AgCl↓+NaNO371.硫酸钠和氯化钡:Na2SO4+BaCl2====BaSO4↓+2NaCl五、其它反应72.二氧化碳溶解于水:CO2+H2O===H2CO373.生石灰溶于水:CaO+H2O===Ca(OH)274.氧化钠溶于水:Na2O+H2O====2NaOH75.三氧化硫溶于水:SO3+H2O====H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O加热CuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO4·5H2O化学选择题考试技巧大家都知道高考化学选择题分值很高(一般是6分),所以要想取得高分,选择题必须做好。
高三化学方程式大全

高三化学方程式大全
1、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4。
2、硝酸银与盐酸及可溶性盐酸盐溶液反应:Ag++Cl-=AgCl↓。
3、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑。
4、甲烷在空气中燃烧:CH4+2O2=CO2+2H2O。
5、酒精在空气中燃烧:C2H5OH+3O2=2CO2+3H2O。
6、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑。
7、一氧化碳还原氧化铜:CO+CuO=Cu+CO2。
5、一氧化碳还原氧化铁:3CO+Fe2O3=2Fe+3CO2。
7、氢氧化钙与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓。
8、氯化钠溶液和硝酸银溶液反应:NaCl+AgNO3=AgCl↓+NaNO3。
9、二氧化碳通过澄清石灰水:Ca(OH)2+CO2=CaCO3↓+H2O。
10、氢氧化钠和二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
11、碳酸氢钙和氢氧化钠反应:Ca2++HCO3-+OH-=CaCO3↓+H2O。
12、硫酸钠和氯化钡反应:Na2SO4+BaCl2=BaSO4↓+2NaCl。
13、石灰石与稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑。
14、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O。
15、碳酸钠与浓盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑。
高考常见化学方程式

高考常见化学方程式化学方程式是所有化学考试的重要组成部分。
下面是店铺为您带来的高考常见化学方程式,希望对大家有所帮助。
高考常见化学方程式(一)1. 铜与浓硝酸反应:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O2. 铜与稀硝酸反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O3. 碳与浓硝酸反应:C+4HNO3=CO2↑+4NO2↑+2H2O4. 氯化铵受热分解:NH4Cl NH3↑+HCl↑5. 铁与硫蒸气反应:Fe+S△==FeS6. 铜与硫蒸气反应:2Cu+S△==Cu2S7. 硫与浓硫酸反应:S+2H2SO4(浓)△==3SO2↑+2H2O8. 二氧化硫与硫化氢反应:SO2+2H2S=3S↓+2H2O9. 铜与浓硫酸反应:Cu+2H2SO4△==CuSO4+SO2↑+2H2O10. 二氧化硫的催化氧化:2SO2+O2 2SO311. 二氧化硫与氯水的反应:SO2+Cl2+2H2O=H2SO4+2HCl12. 二氧化硫与氢氧化钠反应:SO2+2NaOH=Na2SO3+H2O13. 硫化氢在充足的氧气中燃烧:2H2S+3O2点燃===2SO2+2H2O14. 硫化氢在不充足的氧气中燃烧:2H2S+O2点燃===2S+2H2O15. 在空气中点燃镁条:2Mg+O2点燃===2MgO16. 在氮气中点燃镁条:3Mg+N2点燃===Mg3N217. 在二氧化碳中点燃镁条:2Mg+CO2点燃===2MgO+C18. 在氯气中点燃镁条:Mg+Cl2点燃===MgCl219. 海水中提取镁涉及反应:① 贝壳煅烧制取熟石灰:CaCO3高温===CaO+CO2↑ CaO+H2O=Ca(OH)2② 产生氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓③ 氢氧化镁转化为氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O④ 电解熔融氯化镁:MgCl2通电===Mg+Cl2↑20.制造玻璃主要反应:SiO2+CaCO3高温===CaSiO3+CO2↑ SiO2+Na2CO3高温===Na2SiO3+CO2↑高考常见化学方程式(二)1.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO42.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO43.浓硫酸与铜的反应2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O4.浓硫酸与碳的反应2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿5.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O36.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O7.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O8.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS9.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O 硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O10.硫化氢与氯气的反应H2S+Cl2==== 2HCl+S↓11.硫化氢与浓硫酸的反应H2S+H2SO4(浓)==== S↓+SO2↑+2H2O12.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑13.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑14.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑15.海水制镁(1) CaCO3==== CaO+CO2(2) CaO+H2O==== Ca(OH)2(3) Mg2++2OH2-==== Mg(OH)2↓(4) Mg(OH)2+2HCl==== MgCl2+2H2O(5) MgCl2==== Mg+Cl2↑16.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C17.镁与氯气的反应Mg+Cl2==== MgCl218.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑19.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑20.镁与氢离子的反应Mg+2H+==== Mg2++H2↑高考常见化学方程式(三)1 偏铝酸钠溶液与少量的盐酸反应: NaAlO2+HCl(少量)+H2O= NaCl + Al(OH)32 偏铝酸钠溶液与足量的盐酸反应: NaAlO2+4HCl(过量)=NaCl+AlCl3+2H2O3 硫酸铝与氨水:Al2(SO4)3+6NH3.H2O=2Al(OH)3沉淀+3(NH4)2SO44 氯化铝与氢氧化钠:AlCl3+3NaOH=Al(OH)3沉淀+3NaCl5 氯化铝与氨水:AlCl3+3NH3·H2O==Al(OH)3↓+3NH4Cl(反应到此为止不再继续)6 氯化铝与氢氧化钠:AlCl3+4NaOH=NaAlO2+2H2O7 氢氧化钡溶液与稀H2SO4 反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OBa(OH)2 + H2SO4 == BaSO4 + 2H2O8 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OH2SO4+Ba(OH)2=BaSO4+2H2O9 硫酸氢钠溶液中加入氢氧化钡溶液至硫酸根沉淀完全:H++SO42-+Ba2++2OH-=BaSO4↓+2H2ONaHSO4+ B a(OH)2=BaSO4↓+NaOH+H2O10 碳酸氢钠溶液和氢氧化钠溶液混合HCO3-+OHˉ=CO32-+H2ONaHCO3+ NaOH=Na2CO3+H2O11 氢氧化钠溶液中加入过量碳酸氢钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2ONaOH+CaHCO3=CaCO3↓+ Na2CO3+H2O12 氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+H2O+ CO32-NaOH+CaHCO3=CaCO3↓+Na2CO3+H2O13 向AlCl3溶液中加入少量的NaOH溶液:Al3+ + 3OH- = Al(OH)3↓AlCl3+3NaOH=Al(OH)3+3NaCl14 向AlCl3溶液中加入过量的NaOH溶液:Al3+ +4OH- =AlO2-+2H2OAlCl3+3NaOH=Al(OH)3+3NaClNaAlO4+3NaCl15 氯化铁溶液中加过量氨水:Fe 3++3NH3•H2O= Fe (OH)3↓+3NH4+FeCl3+3NH3•H2O= Fe (OH)3↓+3NH4Cl16 氯化铝溶液中加入过量的氨水A13++3NH3•H2O= Al(OH)3↓+3NH4+A1Cl3+3NH3•H2O= Al(OH)3↓+3NH4Cl17 氯化铝溶液中加入少量的氨水(同上) A13++3NH3•H2O= Al(OH)3↓+3NH4+A1Cl3+3NH3•H2O= Al(OH)3↓+3NH4Cl18 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-= CaCO3↓+H2OCa(OH)2+NaHCO3-= CaCO3↓+NaOH+H2O19 澄清石灰水与过量小苏打溶液混合:Ca2++2OH-+2HCO3-= CaCO3↓+2H2O+ CO32-Ca(OH)2+NaHCO3= CaCO3↓+NaOH+H2O NaOH+NaHCO3= Na2CO3↓+ H2OCa(OH)2+2NaHCO3= CaCO3↓+2H2O+ NA2CO320 铝片溶于苛性钠溶液:2Al+2OH-+2H2O =2AlO2-+3H2↑2Al+2NaOH=2NaAlO2+3H2↑。
高考化学方程式大全

高考化学方程式大全临近高考,化学怎么准备考试?化学方程式怎么记下来?下面是小编为大家整理的关于高考化学方程式大全,希望对您有所帮助。
欢迎大家阅读参考学习!高考化学方程式大全1.铁/铜在氯气中燃烧(方程式及现象)2Fe+3Cl22FeCl3(产生棕黄色的烟,加水振荡,溶液呈黄色)Cu+Cl2CuCl2(产生棕色的烟,加水振荡,溶液呈蓝绿色)2. 漂白x在空气中变质 / 在工业上应用Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO (在空气中变质)Ca(ClO)2+2HCl==CaCl2+2HClO (工业上应用)3.实验室制氢氟酸 / 氢氟酸腐蚀玻璃NaF+H2SO4==Na2SO4+2HF↑ (反应须在铅皿或塑料制品中进行)4HF+SiO2==SiF4↑+2H2O4. 铜粉/铁粉与硫粉共热2Cu+SCu2S(黑色)(S的氧化性不强,只能将变价金属氧化成低价态)Fe+SFeS(黑色)5.将硫粉/碳粉/铜粉与浓硫酸/硝酸共热S+2H2SO4(浓)△3SO2↑+2H2OC+2H2SO4(浓)△ CO2↑+2SO2↑+2H2OCu+2H2SO4(浓)△ CuSO4+SO2↑+2H2OS+6HNO3(浓)△ H2SO4+6NO2↑+2H2OC+4HNO3(浓)△ CO2↑+4NO2↑+2H2OCu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(浓H2SO4、浓HNO3与非金属反应只作氧化剂; 与金属反应既作氧化剂又作酸。
)6. H2S/HI通入浓硫酸中H2S+H2SO4(浓)==SO2↑+S↓+2H2O2H2S+H2SO4(浓)==3S↓+4H2O2HI+H2SO4(浓)==SO2↑+I2+H2O7.工业上用接触法制硫酸4FeS2+11O22Fe2O3+8SO2 (沸腾炉) 2SO2+O2 2SO3 (接触室) SO3+H2O==H2SO4 (98.3%的浓硫酸吸收塔)8.工业上生产NH3/HNO3/H3PO4(1)N2+ 3H22NH3(2)HNO3:4NH3+5O24NO+6H2O(氧化炉)2NO+O2==2NO2 3NO2+H2O==2HNO3+NO(吸收塔)(3)制磷酸:Ca3(PO4)2+H2SO4(浓)△CaSO4+H3PO49.侯氏制碱法制取纯碱第一步:CO2+NH3+NaCl+H2O==NaHCO3↓+NH4Cl (NH3必须先通入到溶液中,然后再通入CO2。
高考化学方程式大全

高中化学方程式总结第一部分金属1.钠Na4Na+O2=2Na2O2Na+O2Na2O2Cl2+2Na 2NaCl2Na+S=Na2S(爆炸)2Na+2H2O=2NaOH+H2↑2Na+H22NaH2Na+2NH3=2NaNH2+H24Na+TiCl4(熔融)=4NaCl+TiNa2O Na2O+H2O=2NaOH2Na2O2Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2ONa2O2+2Na=2Na2O(此反应用于制备Na2O)2Na2O2+2H2O =4NaOH+O2↑( 此反应分两步Na2O2+2H2O =2NaOH+H2O2;2H2O2=2H2O+O2↑。
H2O2的制备可利用类似的反应)2Na2O2+2CO2=2Na2CO3+O2Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2NaHNaH+H2O=NaOH+H2↑NaOH2NaOH+Si+H2O=Na2SiO3+2H2↑6NaOH+3S2Na2S+Na2SO3+3H2O2NaOH+2Al+2H2O=2NaAlO2+3H2↑2NaOH(过量)+CO2=Na2CO3+H2ONaOH+CO2(过量)=NaHCO32NaOH+SiO2=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)2NaOH+Al2O3=2NaAlO2+H2O2NaOH+Cl2=NaCl+NaClO+H2O一、碱金属NaOH+HCl=NaCl+H2ONaOH+H2S(足量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=Al(OH)3↓+3NaCl NaOH+Al(OH)3=NaAlO2+2H2ONaOH+NH4Cl NaCl+NH3↑+H2O2NaOH+P2O5=2NaPO3+H2O6NaOH+P2O5=2Na3PO3+3H2ONaAlO22NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO33NaAlO2+AlCl3+6H2O=4Al(OH)3↓NaCl、NaClO、NaBr、NaINaCl+H2SO4(浓NaHSO4+HCl↑H2SO4( 浓Na2SO4+2HCl2NaI+Cl2=2NaCl+I2NaBr+H3PO4(浓)=NaH2PO4+HBrNaI+H3PO4(浓)=NaH2PO4+HINa2CO3、NaHCO3Na2CO3+SiO2Na2SiO3+CO2 Na2CO3+HCl=NaHCO3+NaCl NaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl 3Na2CO3+2FeCl3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl 3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑NaHCO3+HCl=NaCl+CO2↑+H2ONa2CO3+CO2↑+H2O3Na2CO3+2Br2+H2O =2NaHCO3+2NaBrO+2NaBr+CO2↑NaHCO3+Br2=NaBr+HBrO+CO2↑NaNO3、NaNO22NaNO32NaNO2+O2↑H2SO4(浓NaHSO4+HNO3↑KClO3+6HCl=KCl+3Cl2↑+3H2ONaNO2+NH4Cl=NaCl+N2↑+2H2ONa3PO4、NaH2PO4、Na2HPO4Na3PO4+HCl=Na2HPO4+NaClNa2HPO4+HCl=NaH2PO4+NaClNaH2PO4+HCl=H3PO4+NaClNa2S、NaHSNa2S+Cl2=2NaCl+S↓3Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O 3Na2S+Al2(SO4)3+6H2O=2Al(OH)3↓+3H2S↑Na2SO4、Na2SO3、Na2S2O33Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O 2Na2SO3+O2=2Na2SO4Na2S2O3+H2SO4=Na2SO4+S+SO2+H2ONa2SO3+SO2+H2O=2NaHSO32NaHSO3Na2SO3+SO2↑+H2ONa2SiO3Na2SiO3+2HCl=H2SiO3↓+2NaClC6H5ONa C6H5ONa+CO2+H2O=C6H5OH+NaHCO32.钾KK+O2KO22K+2H2O=2KOH+H2↑K2O、K2O2K2O+H2O=2KOHK2O+CO2=K2CO32K2O2+2CO2=K2CO3+O22K2O2+2H2O=4KOH+O2KOH2KOH+CO2=K2CO3+H2OKOH+CO2=KHCO3K2CO3K2CO3+2HCl=2KCl+CO2↑+H2OK2CO3+CaCl2=CaCO3↓+2KC1.镁Mg2Mg+O22MgO Mg+2H2O=2Mg(OH)2↓+H2↑K2CO3+2AgNO3=Ag2CO3↓+2KNO3KHCO3KHCO3+HCl=KCl+CO2↑+H2OK2CO3+CO2↑+H2OKClO32KClO32KCl+3O2↑KClO3+6HCl=KCl+3Cl2↑+3H2O KClO3+5KCl+3H2SO4=3Cl2↑+3K2SO4+3H2OKI2KI+Cl2=2KCl+I2KI+AgNO3=AgI↓+KNO3KAl(SO4)22KAl(SO4)2+6NaOH=K2SO4+3Na2SO4+2Al(OH)3↓2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓KSCN 3KSCN+FeCl3=Fe(SCN)3+3KCl KHKH+H2O=KOH+H2↑3.锂LiLi+O2Li2O2Li+2H2O=2LiOH+H2↑Li2OLi2O+CO2=Li2CO3Li2O+H2O=2LiOHLiOH2LiOH+CO2=Li2CO3↓+H2OLiOH+CO2=LiHCO3Li2CO3Li2CO3+2HCl=2LiCl+CO2↑+H2OLiHCO3LiHCO3+HCl=LiCl+CO2↑+H2OLi2CO3+CO2↑+H2O二、常见金属Mg+Cl2MgCl22Mg+CO22MgO+CMg+S=MgSMg+Br2=MgBr23Mg+N2=Mg3N2Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑2Mg+TiCl4(熔融)=Ti+2MgCl2Mg+2RbCl(熔融)=MgCl2+2RbMgO MgO+2HCl=MgCl2+H2O MgO+H2O=Mg(OH)2↓Mg(OH)2Mg(OH)2+2HCl=MgCl2+2H2OMgCO3MgCO3+2HCl=2MgCl2+CO2↑+H2OMg(OH)2↓+CO2↑MgCO3CO2↑+MgOMg(HCO3)2Mg(HCO3)2+2HCl=MgCl2+2CO2↑+2H2O Mg(OH)2↓+CO2↑+H2O MgSO4MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓MgSO4+2NaOH=Mg(OH)2↓+Na2SO4↓Mg3N2Mg3N2+8H2O=3Mg(OH)2+2NH3·H2O2.铝AlAl+3O22Al2O32Al+3S Al2S32Al+3Cl22AlCl34Al+3MnO22Al2O3+3Mn2Al+Cr2O3Al2O3+2Cr2Al+Fe2O3Al2O3+2Fe(铝热反应)2Al+3FeO Al2O3+3Fe2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6H2SO4(浓Al2(SO4)3+3SO2↑+6H2OAl+4HNO3(稀)=Al(NO3)3+NO↑+2H2O(Al、Fe 在冷、浓的H2SO4 、HNO3中钝化)2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3、Al(OH)3Al2O3+3H2SO4=Al2(SO4)3+3H2O(Al2O3是两性氧化物)Al2O3+2NaOH=2NaAlO2+H2O2Al(OH)3Al2O3+3H2OAl(OH)3+3HCl=AlCl3+3H2O2Al(OH)3+3H2SO4=Al2(SO4)3+6H2OAl(OH)3+NaOH=NaAlO2+2H2O铝盐AlCl3+3NaOH=Al(OH)3↓+3NaCl AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl2AlCl3+3Na2CO3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl AlCl3+3NaHCO3=Al(OH)3↓+3CO2↑AlCl3+3NaAlO2+6H2O=4Al(OH)3↓Al2(SO4)3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑Al4C3+12H2O=4Al(OH)3↓+3CH4↑3.铁Fe2Fe+3Cl22FeCl33Fe+2O2Fe3O4Fe+S FeS2Fe+3Br2=2FeBr3Fe+I2FeI2Fe+S FeS 3Fe+4H2O(g)Fe3O4+4H2Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+CuFe+SnCl4=FeCl2+SnCl2Fe+H2S=FeS+H2↑2Fe+6H2SO4(浓)=Fe2(SO4)3+3SO2↑+6H2OFe+H2SO4( 稀)=FeSO4+H2↑Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O Fe+4HNO3=Fe(NO3)3+NO↑+2H2O 8Fe+30HNO3=8Fe(NO3)3+3N2O↑+15H2O10Fe+36HNO3=10Fe(NO3)3+3N2↑+18H2O8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2OFe+(CH3COO)2Cu=Cu+(CH3COO)2FeFeO3FeO+2Al Al2O3+3Fe6FeO+O22Fe3O4 FeO+4HNO3=Fe(NO3)3+NO2↑+2H2O Fe2O3Fe2O3+2Al Al2O3+2FeFe2O3+3CO 2Fe+3CO2Fe2O3+3H2=2Fe+3H2O(制还原铁粉)Fe2O3+6HCl=2FeCl3+3H2OFe3O4Fe3O4+4H23Fe+4H2OFe3O4+8HCl(浓) FeCl2+2FeCl3+4H2OFe(OH)2、Fe(OH)34Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3Fe2O3+3H2OFeCl22FeCl2+Cl2=2FeCl3 FeCl2+Mg=Fe+MgCl2FeCl32FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2(用于雕刻印刷电路板)2FeCl3+H2SO3+H2O=H2SO4+2FeCl2+2HCl1.锰KMnO42KMnO4K2MnO4+MnO2+O2↑2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O2KMnO4+5H2O2+6HCl=2KCl+2MnCl2+5O2↑+8H2O 2KMnO4+5KNO3+3H2SO4=2MnSO4+K2SO4+5KNO3+ 2H2PMnO2MnO2+4HCl(浓MnCl2+Cl2↑+2H2O2.铜Cu2Cu+O22CuO2Cu+S Cu2SCu+Cl2CuCl2 CH4+4CuO=4Cu+CO2+2H2O 2FeCl3+Zn=2FeCl2+ZnCl22FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2 FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl 2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl FeCl3+3NaHCO3=Fe(OH)3↓+3CO2↑2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HClBaCl2+H2SO4=BaSO4↓+2HClFeCl3+3KSCN=Fe(SCN)3+3KClFeS FeS+2HCl=FeCl2+H2S↑ FeS+H2SO4=FeSO4+H2S↑ 4FeS2+11O2=2Fe2O2+8SO2H2FeO44H2FeO4+2H2O=4Fe(OH)3+3O2↑4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O Fe2O3+3Na2O2=2Na2FeO4+Na2O其它Fe 化合物Fe2(SO4)3+2Ag=FeSO4+Ag2SO4(较难反应)Fe3C+22HNO3=3Fe(NO3)3+CO2+13NO2+11H2O三、其他金属3CuO+2NH33Cu+N2+3H2OCuO+2HCl=CuCl2+H2O CuO+H2SO4=CuSO4+H2O Cu(OH)2+2HCl=CuCl2+2H2OCu(OH)2+H2SO4=CuSO4+2H2OCuO+H2OCuCl2+H2S=CuS↓+2HClCuCl2+2NaOH=Cu(OH)2↓+2NaClCuSO4+H2S=CuS↓+H2SO4CuSO4+2NaOH=Cu(OH)2↓+Na2SO4CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓3.钙CaCaO+H2O=Ca(OH)2 CaO+SiO2CaSiO3 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2OCa(OH)2+SO3=CaSO4+H2OCaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S、HI、HBr、SO2等还原性气体)CaCO3+SiO2CaSiO3+CO2↑CaF2+H2SO4(浓)=CaSO4+2HF↑Ca3(PO4)2+3H2SO4(浓)=3CaSO4+2H3PO4Ca3(PO4)2+2H2SO4(浓)=2CaSO4+Ca(H2PO4)2Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2(重钙)CaH2+2H2O=Ca(OH)2+2H2↑4.钡BaBa(OH)2+CO2=BaCO3↓+H2OBa(OH)2+2CO2(过量)=Ba(HCO3)2Ba(OH)2+H2SO4=BaSO4↓+2H2O3Ba(OH)2+2H3PO3=Ba3(PO4)2↓+6H2OBaCl2+H2SO4=BaSO4↓+2HClBaCl2+Na2SO4=BaSO4↓+2NaClBaCO3+2HCl=BaCl2+CO2↑+H2OBaCO3+2HNO3=Ba(NO3)2+CO2↑+H2OBaO2+H2SO4(稀)=BaSO4↓+H2O2)5.铅Pb、PbO2Pb+2HCl=PbCl2+H2↑PbO2+4HCl(浓PbCl2+Cl2↑+2H2O铅盐Pb(NO3)2+H2S=PbS↓+2HNO3(CH3COO)2Pb+H2S=PbS↓+CH3COOH第二部分卤族元素、氮族元素1.氟F2F2+H2=2HF 2F2+2H2O=4HF+O2HF4HF+SiO2=SiF4+2H2O2.氯Cl2Cl2+H2=2HCl(光照或点燃)2NaCl3Cl2+2P2PCl36.锌ZnZn+S ZnSZn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑Zn+2NaOH=Na2ZnO2+H2↑Zn+2FeCl3=2FeCl2+ZnCl2As2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O ZnOZnO+2HCl=ZnCl2+H2OZnO+2NaOH=Na2ZnO2+H2OZn(OH)2Zn(OH)2+2HCl=ZnCl2+2H2OZn(OH)2+2NaOH=Na2ZnO2+2H2OZn(OH)2+4NH3·H2O=Zn(NH3)4(OH)2+4H2O Zn(OH)2ZnO+H2O7.铍BeBe+2HCl=BaCl2+H2↑Be+2NaOH=Na2BO2+H2↑BeCl2+2NaOH=Be(OH)2↓+2H2OBe(OH)2+2HCl=BeCl2+2H2OBe(OH)2+2NaOH=Na2BO2+2H2O8.汞Hg3Hg+8HNO3(稀)=3Hg(NO3)2+2NO2↑+4H2O Hg+4HNO3(浓)=Hg(NO3)2+2NO2↑+2H2一、卤族元素Cl2+PCl3PCl53Cl2+2Fe2FeCl3Cl2+Cu CuCl2 Cl2+2FeCl2=2FeCl3 2Cl2+2NaBr=2NaCl+Br2 Cl2+2KI=2KCl+I25Cl2+I2+6H2O=2HIO3+10HClCl2+Na2S=2NaCl+S↓Cl2+H2S=2HCl+S↓Cl2+SO2+2H2O=H2SO4+2HClCl2+H2SO3+H2O=H2SO4+2HClCl2+H2O=HCl+HClO Cl2+H2O2=2HCl+O2Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2OHCl6HCl+2Al=2AlCl3+3H2↑2HCl+Fe=FeCl2+H2↑4HCl(浓)+MnO2MnCl2+Cl2+2H2O4HCl(g)+O22Cl2+2H2O16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2OHCl+NH3=NH4Cl(白烟)2HCl+FeO=FeCl2+3H2O6HCl+Fe2O3=2FeCl3+3H2O8HCl( 浓FeCl2+2FeCl3+4H2O HCl+Na3PO4=Na2HPO4+NaClHCl+Na2HPO4=NaH2PO4+NaClHCl+NaH2PO4=H3PO4+NaClHCl+Na2CO3=NaHCO3+NaClHCl+NaHCO3=NaCl+H2O+CO2HClOHClO=HCl+O2↑1.氮N2N2+3H23N2+O22NO N2+3MgMg3N2N2+6Na=2Na3NNO、NO2、N2O52NO+O2=2NO2NO+NO2+2NaOH=2NaNO2(用于制硝酸工业中吸收尾气中的NO 和NO2)6NO+4NH35N2+6H2ONO2+2KI+H2O=NO+I2+2KOH(不能用淀粉KI 溶液鉴3.溴Br2Br2+H22HBrBr2+Fe=FeBr3Br2+2FeBr2=2FeBr3Br2+NaI=NaBr+I2Br2+HI=HBr+I2Br2+H2O=HBr+HBrOBr2+NaOH=NaBr+NaBrO+H2OBr2+SO2+2H2O=H2SO4+2HBrBr2+H2S=S↓+2HBr 2Br2+3Na2CO3+H2O=2NaHCO3+2NaBrO+2NaBr+CO2↑HBr HBr+NaOH=NaBr+H2O 2HBr+Cl2=2HCl+Br24.碘I2I2+H22HII2+Fe FeI2 I2+2NaOH=NaI+NaIO+H2OHI2HI H2+I22HI+Cl2=2HCl+I2HI+NaOH=NaI+H2O二、氮族元素别溴蒸气和NO2)4NO2+H2S=4NO+SO3+H2ONO2+SO2=SO3+NO3NO2+H2O=2HNO3+NON2O5+H2O=2HNO3HNO33HNO3+Ag3PO4=H3PO4+3AgNO3Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O3As2S3+28HNO3+4H2O=6H3AsO4+9H2SO4+28NO↑4HNO3(浓CO2↑+4NO2↑+2H2O2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑6HNO3+Fe=Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe=Fe(NO3)3+NO↑+2H2O30HNO3+8Fe=8Fe(NO3)3+3N2O↑+15H2O36HNO3+10Fe=10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe=8Fe(NO3)3+3NH4NO3+9H2OFeO+4HNO3=Fe(NO3)3+NO2↑+2H2O3H2S+2HNO3(稀) 3S↓+2NO+4H2O4HNO3=4NO2+O2+2H2O(见光或受热分解)NH3+HNO3=NH4NO3(白烟)(用HNO3和浓H2SO4不能制备H2S、HI、HBr、SO2)3Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O3Cu2S+22HNO3=6Cu(NO3)2+10NO↑+3H2SO4+8H2O 5HNO3(浓)+P=H3PO4+5NO2↑+H2OP4+20HNO3(浓)=4H3PO4+20NO2+4H2OS+6HNO3(浓)=H2SO4+6NO2↑+2H2O3S+4HNO3(稀)=3SO2↑+4NO↑+2H2OS+6HNO3(浓)=H2SO4+6NO2↑+2H2O3As2S3+28HNO3( 稀)+4H2O =6H3AsO4+9H2SO4+28NO ↑As2S3+28HNO3( 浓) =2H3AsO4+3H2SO4+28NO2↑+8H2ONH32NH3+3CuO3Cu+N2+3H2O2NH3+3Cl2=N2+6HCl8NH3+3Cl2=N2+6NH4Cl4NH3+3O2(纯氧2N2+6H2O4NH3+5O24NO+6H2O4NH3+6NO5N2+6HO(用氨清除NO)NH3+HCl=NH4Cl(白烟)NH3+HNO3=NH4NO3(白烟)2NH3+H2SO4=(NH4)2SO4NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯氏制碱法)2NH3+SO2+H2O=(NH4)2SO3NH3·H2O NH3↑+H2ONH3+H2O NH3·H2O NH4++OH-NH4HCO3、(NH4)2CO3NH4HCO3=NH3+H2O+CO2(NH4)2CO3=2NH3↑+H2O+CO2↑NH4ClNH4Cl=NH3+HCl2NH4Cl+Ca(OH)2CaCl2+NH3↑+H2ONH4Cl+NaOH NaCl+NH3↑+H2ONH4Cl+NaOH=NaCl+NH3·H2ONH4NO3NH4NO3+NaOH==NaNO3+NH3·H2ONH4NO3+NaOH NaNO3+NH3↑+H2O5NH4NO32HNO3+4N2↑+9H2O(NH4)2SO3、(NH4)2SO4(NH4)2SO3+SO2+H2O=2NH4HSO3(NH4)2SO4+2NaOH=Na2SO4+2NH3·H2ONa2SO4+2NH3↑+2H2O2.磷P2P+3Cl22PCl3PCl3+Cl2PCl5P4+6H24PH34P+5O2P4O10(常写成P2O5)P4+20HNO3(浓)=4H3PO4+20NO2+4H2O11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 PH3+2O2=H3PO4P2O3、P2O5、P4S3P2O5+H2O(冷)=2HPO3P2O5+3H2O(热)=2H3PO4(P2O5极易吸水、可作气体干燥剂)P2O5+3H2SO4(浓)=2H3PO4+3SO3P2O5+2NaOH=2NaPO3+H2O P2O5+6NaOH=2Na3PO3+3H2OP4S3+38HNO3+8H2O=9H2SO4+12H3PO4+38NO↑H3PO44H3PO4+Ca3(PO4)2=3Ca(H2PO4)2H3PO4(浓)+NaBr=NaH2PO4+HBrH3PO4(浓)+NaI=NaH2PO4+HI第三部分碳族元素、氧族元素一、碳族元素1.碳2CO2(过量)+Ca(OH)2=Ca(HCO3)2C CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 C+2F2=CF4CO2+C6H5ONa+H2O=C6H5OH+NaHCO3C+2Cl2=CCl4CO2+Na2O=Na2CO32C+O2(少量)2CO 2CO2+2Na2O2=2Na2CO3+O2C+O2(足量) CO2C+CO22COC+H2O CO+H2(生成水煤气)2C+SiO2Si+2CO(制得粗硅)C+Si SiC(金刚砂)C+2S CS23C+CaO CaC2+CO↑3C+SiO2SiC+2CO↑C+2H2SO4(浓) CO2↑+2SO2↑+2H2O C+4HNO3(浓) CO2↑+4NO2↑+2H2O CO2CO+O22CO2CO+CuO Cu+CO23CO+Fe2O32Fe+3CO2CO+H2O CO2+H2CO2CO2+2Mg2MgO+CCO2+H2O=H2CO3CO2+2NaOH(过量)=Na2CO3+H2OCO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3↓+H2O1.氧O2O2+2H22H2OO2+K KO22O2+3Fe Fe3O4O2+S SO2O2+N22NO2O34P+5O22P2O5CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl(侯氏制碱法)H2CO3H2CO3=CO2↑+H2O2.硅SiSi(粗)+2Cl2SiCl4SiCl4+2H2Si(纯)+4HClSi(粉)+O2SiO2Si+C SiC(金刚砂)Si+2NaOH+H2O=Na2SiO3+2H2SiO22C+SiO2Si+2CO3C+SiO2SiC+2CO↑2Mg+SiO22MgO+Si4HF+SiO2=SiF4+2H2OSiO2+2H2Si+2H2OSiO2+2Mg 2MgO+SiSiO2+CaO CaSiO3SiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3Na2SiO3+CO2SiO2+CaCO3CaSiO3+CO22NaOH+SiO2=Na2SiO3+H2O二、氧族元素C+O2(足量) CO2Si+O2SiO24Na+O2=2Na2O2Na2O+O22Na2O22Na+O2=Na2O22Mg+O22MgO4Al+3O22Al2O34NH3+5O24NO+6H2O2SO2+O22SO32CO+O 2 2CO 26FeO+O 2 2Fe 3O 4 2H 2SO 3+O 2=2H 2SO 44Fe(OH)2+O 2+2H 2O =4Fe(OH)3 2Na 2SO 3+O 2=2Na 2SO 4 O 32O 3=3O 2 O 3+2HI ==I 2+O 2+H 2O H 2O 2F 2+2H 2O =4HF+O 2 Cl 2+H 2O =HCl+HClO2Na+2H 2O =2NaOH+H 2↑ Mg+2H 2O =Mg(OH)2+H 2↑ 3Fe+4H 2O(g) Fe 3O 4+4H 22H 2O2H 2↑+O 2SO 2+H 2O =H 2SO 3 SO 3+H 2O =H 2SO 4 3NO 2+H 2O =2HNO 3+NO N 2O 5+H 2O =2HNO 3 P 2O 5+H 2O(冷)=2HPO 3 P 2O 5+3H 2O(热)=2H 3PO 4 CO 2+H 2O =H 2CO 3 H 2O 2 2H 2O 2=2H 2O+O 2↑ H 2O 2+Cl 2=2HCl+O 2S+2Na =Na 2S(爆炸) S+Mg =MgS S+FeFeSS+2H 2SO 4(浓)=3SO 2↑+2H 2O SO 2SO 2+2H 2S =3S+2H 2O △2SO 2+O 2 2SO 32SO 2+O 2+2H 2O =2H 2SO 4 SO 2+Cl 2+2H 2O =H 2SO 4+2HCl SO 2+Br 2+2H 2O =H 2SO 4+2HBr SO 2+I 2+2H 2O =H 2SO 4+2HI SO 2+NO 2=SO 3+NO SO 2+2H 2S =3S+2H 2O SO 2+H 2O =H 2SO 3 SO 2+2NH 3+H 2O =(NH 4)2SO 3 SO 2+(NH 4)2SO 3+H 2O =2NH 4HSO 3 SO 2+Ca(OH)2=CaSO 3↓+H 2O(不能用澄清石灰水鉴别 SO 2 和 CO 2.可用品红鉴别) 2NaOH+SO 2(少量)=Na 2SO 3+H 2O NaOH+SO 2(足量)=NaHSO 3 Cl 2+SO 2+2H 2O =H 2SO 4+2HCl SO 3SO 3+H 2O =H 2SO 4 SO 3+MgO =MgSO 4 SO 3+Ca(OH)2=CaSO 4+H 2O SO 3+Na 2O =Na 2SO 4 5H 2O 2+2 2.硫 SS+H 2 KMnO 4+6HCl =2MnCl 2+2KClH 2S +5O 2↑+8H 2O SO 3+2KI =K 2SO 3+I 2 H 2S H 2S+Cl 2=2HCl+S ↓ H 2S+Mg =MgS+H 22S+C CS 2 2H 2S+3O 2(足量)=2SO 2+2H 2O S+Fe FeS 2H 2S+O 2(少量)=2S+2H 2O S+2Cu Cu 2S 2H 2S+SO 2=3S+2H 2O3S+2Al Al 2S 3 H 2S+H 2SO 4(浓)=S ↓+SO 2+2H 2O S+ZnZnSH 2S H 2+SS+O 2 SO 2S+6HNO 3(浓)=H 2SO 4+6NO 2↑+2H 2O 3S+4HNO 3(稀)=3SO 2↑+4NO ↑+2H 2O 3S+6NaOH2Na 2S+Na 2SO 3+3H 2O3H 2S+2HNO 3(稀)=3S ↓+2NO+4H 2O5H 2S+2KMnO 4+3H 2SO 4=2MnSO 4+K 2SO 4+5S+8H 2O 3H 2S+K 2Cr 2O 7+4H 2SO 4=Cr 2(SO 4)3+K 2SO 4+3S+7H 2O H 2S+4Na 2O 2+2H 2O =Na 2SO 4+6NaOHH2S+Fe=FeS+H2↑H2S+CuCl2=CuS↓+2HClH2S+2AgNO3=Ag2S↓+2HNO3H2S+HgCl2=HgS↓+2HClH2S+Pb(NO3)2=PbS↓+2HNO3H2S+4NO2=4NO+SO3+H2OH2SO3H2SO3+X2+H2O=H2SO4+2HX(X 表示Cl2、Br2、I2)2H2SO3+O2=2H2SO4H2SO3+H2O2=H2SO4+H2O 5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl H2SO3=H2O+SO2↑2H2SO3+2H2S=3S↓+2H2OH2SO4Zn+H2SO4=ZnSO4+H2↑Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6H2SO4(浓Al2(SO4)3+3SO2↑+6H2O2NH3+H2SO4=(NH4)2SO42Al+6H2SO4(浓) Al2(SO4)3+3SO2↑+6H2O H2S+H2SO4(浓)=S↓+SO2+2H2OP2O5+3H2SO4(浓)=2H3PO4+3SO3BaO2+H2SO4(稀)=BaSO4+H2O2)Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2MgO+H2SO4=MgSO4+H2OAl2O3+3H2SO4=Al2(SO4)3+3H2O2H2SO4(浓CO2↑+2SO2↑+2H2O2H2SO4(浓)+S=3SO2↑+2H2O6H2SO4(浓)+2Fe=Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr SO2+Br2+2H2OH2SO4(浓)+2HI SO2+I2+2H2OH2SO4(浓)+CaF2=CaSO4+2HF↑H2SO4(浓)+NaCl NaHSO4+HCl↑H2SO4(浓)+2NaCl Na2SO4+2HClH2SO4(浓)+NaNO3NaHSO4+HNO3↑3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2=2CaSO4+C a (H2PO4)2第四部分有机反应一、烃1.甲烷CaO甲烷的制取:CH3COONa+NaOH Na2CO3+CH4↑△烷烃通式:C n H2n-2(1)氧化反应点燃甲烷的燃烧:CH4+2O2CO2+2H2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(完整版)高考化学方程式汇总
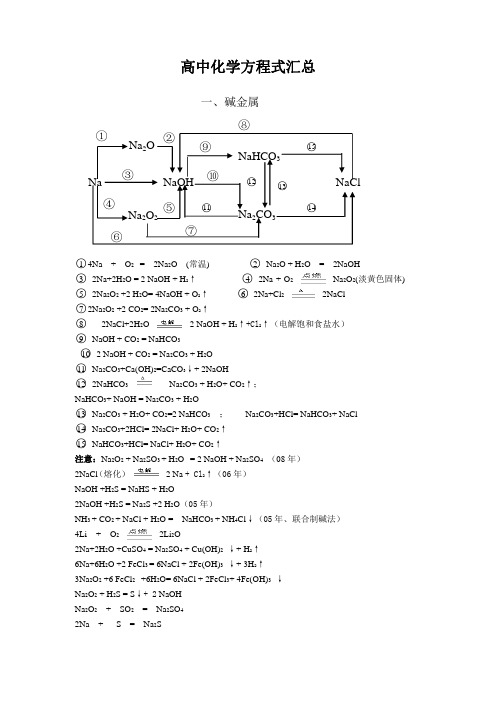
Na NaOH NaClNa 2O Na 2O 2Na 2CO 3NaHCO 3①②③ ④⑤⑥⑦⑧⑨⑩ ○11 ○12 ○13 ○14 ○15 高中化学方程式汇总○14Na + O 2 = 2Na 2O (常温) ○2 Na 2O + H 2O = 2NaOH ○3 2Na+2H 2O = 2 NaOH + H 2↑ ○4 2Na + O 2Na 2O 2(淡黄色固体) ○5 2Na 2O 2 +2 H 2O= 4NaOH + O 2↑ ○62Na+Cl 22NaCl ○72Na 2O 2 +2 CO 2= 2Na 2CO 3 + O 2↑ ○82NaCl+2H 2O 2 NaOH + H 2↑+Cl 2↑(电解饱和食盐水) ○9 NaOH + CO 2 = NaHCO 3 ○10 2 NaOH + CO 2 = Na 2CO 3 + H 2O ○11 Na 2CO 3+Ca(OH)2=CaCO 3↓+ 2NaOH ○12 2NaHCO 3 Na 2CO 3 + H 2O+ CO 2↑; NaHCO 3+ NaOH = Na 2CO 3 + H 2O○13 Na 2CO 3 + H 2O+ CO 2=2 NaHCO 3 ; Na 2CO 3+HCl= NaHCO 3+ NaCl ○14 Na 2CO 3+2HCl= 2NaCl+ H 2O+ CO 2↑ ○15 NaHCO 3+HCl= NaCl+ H 2O+ CO 2↑ 注意:Na 2O 2 + Na 2SO 3 + H 2O = 2 NaOH + Na 2SO 4 (08年) 2NaCl (熔化)2 Na + Cl 2↑(06年)NaOH +H 2S = NaHS + H 2O2NaOH +H 2S = Na 2S +2 H 2O (05年)NH 3 + CO 2 + NaCl + H 2O = NaHCO 3 + NH 4Cl ↓(05年、联合制碱法) 4Li + O 22Li 2O2Na+2H 2O +CuSO 4 = Na 2SO 4 + Cu(OH)2 ↓+ H 2↑ 6Na+6H 2O +2 FeCl 3 = 6NaCl + 2Fe(OH)3 ↓+ 3H 2↑ 3Na 2O 2 +6 FeCl 2 +6H 2O= 6NaCl + 2FeCl 3+ 4Fe(OH)3 ↓ Na 2O 2 + H 2S = S ↓+ 2 NaOH Na 2O 2 + SO 2 = Na 2SO 4 2Na + S = Na 2S一、碱金属Cl 2NaClOHClNH 4ClO 2HClOCa(ClO)2NaClAgClPCl 3 PCl 5CuCl 2FeCl 3FeCl 2①○2 ○3 ○4 ○5 ○7○9 ○10 ○11 ○12 ○13 ○16 ○14○15 ○17 ○18 ○19 ○20 ○21 ○22 ○23 ○24 ○25 ○26二、卤素○1Cl 2 +H 2 2HCl②4HCl(浓)+MnO 2MnCl 2+Cl 2↑+2H 2O (氯气的实验室制法)○3 Cl 2 + 2Na 2NaCl ○42NaCl 2Na +Cl 2↑ ○5 Cl 2 +2NaOH=NaClO+ NaCl+H 2O (氯气的尾气处理) ⑥ NaClO + 2HCl(浓) = Cl 2↑ + NaCl + H 2O○7NaClO+H 2O HClO+NaOH ○9 Cl 2 + H 2O = HCl + HClO ○10 2Cl 2 +2Ca(OH)2=CaCl 2+Ca(ClO)2+ H 2O (漂白粉的工业制取) ○11 Ca(ClO)2 + H 2O+ CO 2= CaCO 3↓+2 HClO ○122 HClO 2HCl + O 2↑ ○13 HCl +NaOH = NaCl + H 2O ○14 2NaCl +H 2SO 4(浓) Na 2SO 4 +2HCl ↑( HCl 的实验室制法 ) ○15 NaCl + AgNO 3 = AgCl ↓ + NaNO 3 ○16 HCl + AgNO 3 = AgCl ↓ + HNO 3 ○17 HCl +NH 3 = NH 4Cl (白烟) ○18Fe + 2HCl = FeCl 2 + H 2↑ ○19 2Fe +3Cl 2 2 FeCl 3 (棕色的烟、黄色溶液) ○20Cu +Cl 2 CuCl 2 (棕黄色的烟、蓝绿色溶液) ○21 2P +5Cl 2 2PCl 5 ○222P +3 Cl 2 2PCl 3 ○23 PCl 3+ Cl 2 = PCl 5 注意:2F 2+2 H 2O = 4HF + O 2 Cl 2 + 2NaBr = 2 NaCl + Br 2 Cl 2 + 2NaI = 2 NaCl +I 2 Br 2 + 2NaI = 2 Na Br +I 2 NaBr + AgNO 3 = AgBr ↓(浅黄色)+ NaNO 3 NaI + AgNO 3 = AgI ↓(黄色) + NaNO 3 5 Cl 2 + I 2 + 6H 2O = 2HIO 3 + 10 HCl HClO + SO 2 + H 2O = H 2SO 4 + 2 HClS SO 2 SO 3 Na 2SO 4BaSO 4CuSH 2SH 2SO 3H 2SO 4Cu 2S FeSFeS 2①○3 ○2 ○4 ○5 ○6 ○7 ○8 ○9 ○10 ○11 ○12 ○13 ○14 ○15 ○16 ○17 CuSO 4○18 ○19 ○20 ○21 ○22 三、氧族元素○1 Fe+S FeS ○22 Cu+S Cu 2S ○3 H 2 + S H 2S FeS + 2 HCl = H 2S ↑ + FeCl 2 ○4 H 2S H 2 + S ;2H 2S +O 2 =2 H 2O +2 S ↓ ○5 H 2S +CuSO 4= H 2SO 4+CuS ↓ ○62H 2S + 3O 2 2 H 2O + 2SO 2(完全燃烧) ○7 S +O 2 2SO 2 ○8 2H 2S + SO 2=2 H 2O +3 S ↓ ○94FeS + 7O 2 2 Fe 2O 3 + 4SO 2 ○104FeS 2 + 11O 2 2 Fe 2O 3 + 8SO 2 (工业制取SO 2) ○11 SO 2 + H 2O = H 2SO 3 ○12 Na 2O 2+ SO 2= Na 2SO 4 ○13 ○14 2 SO 2 + O 2 2SO 3 ○15 SO 3+ H 2O= H 2SO 4 ○16 SO 2 + 2 H 2O + X 2 = H 2SO 4 + 2HX (X=Cl ,Br ,I ) ○172H 2SO 4 + Cu Cu SO 4 + SO 2↑+ 2H 2O Na 2SO 3 + H 2SO 4(浓)=N a 2 SO 4 + SO 2↑+ 2H 2O 2H 2SO 4 + CCO 2 ↑+ 2SO 2↑+ 2H 2O○18 H 2SO 3 +Cl 2 + H 2O = H 2SO 4+ 2HCl ○19 H 2SO 4+Cu(OH)2= Cu SO 4+ 2H 2O ○20 H 2SO 4+ 2NaOH = Na 2SO 4 + 2H 2O ○21 H 2SO 4+BaCl 2= BaSO 4↓+ 2HCl ○22 Na 2SO 4 + Ba(OH)2 = BaSO 4↓+ 2NaOH 注意:SO 2 + 2 H 2O +Br 2 = H 2SO 4 + 2H BrSO 2 +Ca(OH) 2 = CaSO 3 ↓ + H 2O (SO 2不足) 2SO 2 +Ca(OH) 2 = Ca(HSO 3)2 (SO 2过量)2 FeCl 3+ H 2S = S ↓+ 2 FeCl 2 + 2HCl H 2SO 4(浓)+2HBr===SO 2↑+Br 2↑+2H 2O 2 FeCl3 + SO 2 + 2H 2O = 2 FeCl 2 + H 2SO4 + 2HClSO 2 + 2NaOH = Na 2SO 3 + H 2O (SO 2不足 、吸收SO 2) 2Na 2SO 3 + O 2 = 2 Na 2SO 4 3O 2 O 32H 2O 22H 2O+ O 2↑ H 2SO 3+H 2O 2===H 2SO 4+H 2OO 3 + 2KI + H 2O = 2KOH +I 2+ O 2(使湿润的淀粉KI 试纸变蓝) Cu SO 4·5H 2OCu SO 4 + 5H 2O。
最新高考必背化学方程式大全

最新高考必背化学方程式大全化学是一门以实验为基础的自然科学。
小编预备了高考必背化学方程式,期望你喜爱。
一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H)1、氧化性:F2+H2===2HF (阴暗处爆炸)F2+Xe(过量)==XeF22F2(过量)+Xe==XeF4 (XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属)2F2+2H2O===4HF+O2 (水是还原剂)2F2+2NaOH===2NaF+OF2+H2OF2+2NaCl===2NaF+Cl2F2+2NaBr===2NaF+Br2F2+2NaI===2NaF+I27F2(过量)+I2===2IF7F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 )Cl2+H2 2HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)3Cl2+2P 2PCl3 Cl2+PCl3 PCl5 Cl2+2Na 2NaCl3Cl2+2Fe 2FeCl3 Cl2+Cu CuCl2Cl2+2FeCl2===2FeCl3 (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl )Cl2+2NaBr===2NaCl+Br2 Cl2+2Br =2Cl +Br2Cl2+2KI===2KCl+I2 Cl2+2I =2Cl +I23Cl2(过量)+2KI+3H2O===6HCl+KIO33Cl2+I–+3H2O=6H++6Cl–+IO3–5Cl2+I2+6H2O===2HIO3+10HCl5Cl2+I2+6H2O=10Cl–+IO3–+12H+Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓Cl2+H2S===2HCl+S↓(水溶液中:Cl2+H2S=2H++2Cl–+S↓Cl2+SO2+2H2O===H2SO4+2HClCl2+SO2+2H2O=4H++SO42–+2Cl–Cl2+H2O2===2HCl+O2 Cl2+H2O2=2H++Cl–+O2 2O2+3Fe Fe3O4? O2+K===KO2S+H2 H2S 2S+C CS2 S+Zn ZnSS+Fe FeS (既能由单质制取,又能由离子制取)S+2Cu Cu2S (只能由单质制取,不能由离子制取) 3S+2Al Al2S3 (只能由单质制取,不能由离子制取) N2+3H2 2NH3? N2+3Mg Mg3N2 N2+3Ca Ca3N2 N2+3Ba Ba3N2 N2+6Na 2Na3N N2+6K 2K3NN2+6Rb 2Rb3N N2+2Al 2AlNP4+6H2 4PH3 P+3Na Na3P 2P+3Zn Zn3P2H2+2Li 2LiH2、还原性S+O2 SO2S+H2SO4(浓) 3SO2↑+2H2OS+6HNO3(浓) H2SO4+6NO2↑+2H2OS+4H++6==6NO2↑+2H2O+3S+4HNO3(稀) 3SO2+4NO↑+2H2O3S+4H++4 3SO2+4NO↑+2H2ON2+O2 2NO4P+5O2 P4O10(常写成P2O5)2P+3X2 2PX3(X表示F2,Cl2,Br2)PX3+X2 PX5P4+20HNO3(浓) 4H3PO4+20NO2↑+4H2OC+2F2 CF4C+2Cl2 CCl4C+O2(足量) CO22C+O2(少量) 2COC+CO2 2COC+H2O CO+H2(生成水煤气)2C+SiO2 Si+2CO(制得粗硅)Si(粗)+2Cl2 SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2 SiO2Si+C SiC(金刚砂)Si+2NaOH+H2O==Na2SiO3+2H2↑(Si+2OH +H2O= +2H2↑)3、歧化反应Cl2+H2O==HCl+HClO(加碱或光照促进歧化:(Cl2+H2O H++Cl–+H ClO)Cl2+2NaOH==NaCl+NaClO+H2O? (Cl2+2OH–=Cl–+ClO–+H2O)Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H 2O)3Cl2+6KOH(浓) 5KCl+KClO3+3H2O (3Cl2+6OH–5Cl–+ClO3–+3 H2O)3S+6NaOH 2Na2S+Na2SO3+3H2O? (3S+6OH–2S2–+SO32–+3H2 O)4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2 (4P+3OH–+3H2O==PH3↑+3H2PO2–)11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO43C+CaO CaC2+CO↑3C+SiO2 SiC+2CO↑二.金属单质(Na,Mg,Al,Fe,Cu)的还原性2Na+H2 2NaH 4Na+O2==2Na2O 2Na2O+O2 2Na2O22Na+O2 Na2O2 2Na+S==Na2S(爆炸)2Na+2H2O==2NaOH+H2↑2Na+2H2O=2Na++2OH―+H2↑2Na+2NH3==2NaNH2+H2↑2Na+2NH3=2Na++2NH2―+H2↑4Na+TiCl4 4NaCl+Ti Mg+Cl2 MgCl2 Mg+Br2 MgBr22Mg+O2 2MgO Mg+S MgS2Cu+S Cu2S (Cu2S只能由单质制备)Mg+2H2O Mg(OH)2+H2↑2Mg+TiCl4 Ti+2MgCl2 Mg+2RbCl MgCl2+2Rb2Mg+CO2 2MgO+C 2Mg+SiO2 2MgO+SiMg+H2S==MgS+H2Mg+H2SO4==MgSO4+H2↑(Mg+2H+=Mg2++H2↑)2Al+3Cl2 2AlCl34Al+3O2===2Al2O3 (常温生成致密氧化膜而钝化,在氧气中燃烧)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg(铝汞齐)4Al+3MnO2 2Al2O3+3Mn 2Al+Cr2O3 Al2O3+2Cr (铝热反应)2Al+Fe2O3 Al2O3+2Fe 2Al+3FeO Al2O3+3Fe2Al+6HCl===2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H+=2Al3++3H2↑2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4, HNO3中钝化)Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O Al+4H++NO3–=Al3++NO ↑+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H2↑2Al+2OH–+2H2O=2AlO2–+3H2↑2Fe+3Br2===2FeBr3 3Fe+2O2 Fe3O4 2Fe+O2 2FeO (炼钢过程)Fe+I2 FeI2Fe+S FeS (FeS既能由单质制备,又能由离子制备)3Fe+4H2O(g) Fe3O4+4H2↑Fe+2HCl===FeCl2+H2↑Fe+2H+=Fe2++H2↑Fe+CuCl2===FeCl2+Cu Fe+Cu2+=Fe2++Cu↓Fe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn↓Fe+Sn2+=Fe2++Sn↓三.非金属氢化物(HF,HCl,H2O,H2S,NH3) 金属氢化物(NaH)1、还原性:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O4H++2Cl–+MnO2 Mn2++Cl2↑+2H2O4HCl(浓)+PbO2 PbCl2+Cl2↑+2H2O4H++2Cl–+PbO2 Pb2++Cl2↑+2H2O4HCl(g)+O2 2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O16 H++10Cl-+2MnO4–=2Mn2++5Cl2↑+8H2O6HCl+KClO3==KCl+3Cl2↑+3H2O6H++5Cl–+ClO3–=3Cl2↑+3H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2↑+7H2O14H++6Cl–+Cr2O72–=2Cr3++5Cl2↑+7H2O2H2O+2F2===4HF+O22HCl+F2=2HF+Cl2 (F2气与HCl、HBr、HI、H2S、NH3气体不能共存)2HBr+Cl2=2HCl+Br2 (Cl2气与HBr、HI、H2S、NH3气体不能共存) 2H2S+3O2(足量) 2SO2+2H2O 2H2S+O2(少量) 2S↓+2H2O2H2S+SO2===3S↓+2H2O H2S+H2SO4(浓)===S↓+SO2↑+2H2O3H2S+2HNO3(稀)===3S↓+2NO↑+4H2O3H2S+2H++2NO3–=3S↓+2NO↑+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S↓+8H2O5H2S+2MnO4–+6H+=2Mn2++5S↓+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S↓+7H2O3H2S+Cr2O72–+8H+===2Cr3++3S↓+7H2OH2S+4Na2O2+2H2O===Na2SO4+6NaOHH2S+4Na2O2+2H2O=8Na++ +2NH3+3CuO 3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl 8NH3+3Cl2===N2+6NH4ClNH3+NaNO2+HCl==NaCl+N2↑+2H2ONH3+NO2–+H+=N2↑+2H2O4NH3+3O2(纯氧) 2N2+6H2O 4NH3+5O2 4NO+6H2O4NH3+6NO===5N2+6H2O (用氨清除NO)NaH+H2O===NaOH+H2↑(生氢剂)NaH+H2O=Na++OH–+H2↑4NaH+TiCl4 Ti+4NaCl+2H2↑CaH2+2H2O=Ca(OH)2↓+2H2↑2、酸性:4HF+SiO2===SiF4+2H2O(可测定矿样或钢样中SiO2的含量,玻璃雕刻)4HF+Si===SiF4+2H2↑2HF+CaCl2===CaF2+2HCl H2S+Fe===FeS↓+H2↑H2S+CuCl2===CuS↓+2HCl (弱酸制强酸的典型反应)H2S+Cu2+=CuS↓+2H+H2S+2AgNO3===Ag2S↓+2HNO3H2S+2Ag+=Ag2S↓+2H+H2S+HgCl2===HgS↓+2HClH2S+Hg2+=HgS↓+2H+H2S+Pb(NO3)2===PbS↓+2HNO3 (铅试纸检验空气中H2S)H2S+Pb2+=PbS↓+2H+H2S+2Ag===Ag2S+H2↑(银器在空气中变黑的缘故)2NH3(液)+2Na==2NaNH2+H2↑(NaNH2+H2O===NaOH+NH3↑)3、NH3的碱性:NH3+HX===NH4X (X:F、Cl、Br、I、S)NH3+HNO3===NH4NO3 NH3+H+=NH4+2NH3+H2SO4===(NH4)2SO4 NH3+H+=NH4+NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(侯德榜制碱:用于工业制备小苏打,苏打)NH3+H2S==NH4HS NH3+H2S=NH4++HS-4、不稳固性:2HF H2+F2 2HCl H2+Cl2 2H2O 2H2+O22H2O2===2H2O+O2 H2S H2+S 2NH3 N2+3H22HI H2+I2四.非金属氧化物(SO3、SO2、N2O、NO、N2O3、NO2、N2O4、N2O5、CO、CO2、Si O2、P2O3、P2O5、Cl2O、Cl2O3、Cl2O5、Cl2O7、ClO2)1、低价态的还原性:(SO2、CO、NO)2SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)2SO2+O2 2SO3 SO2+NO2===SO3+NOSO2+Cl2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl –SO2+Br2+2H2O===H2SO4+2HBr Br2+SO2+2H2O=4H++SO42–+2Br –SO2+I2+2H2O===H2SO4+2HI I2+SO2+2H2O=4H++SO42–+2I–2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸取尾气中的NO和NO2)NO+NO2+2OH–=2NO2–2CO+O2 2CO2 CO+CuO Cu+CO23CO+Fe2O3 2Fe+3CO2 CO+H2O CO2+H22、氧化性:SO2+2H2S===3S+2H2OSO3+2KI K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和N O2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu 4CuO+N2 N2O+Zn ZnO+N2CO2+2Mg 2MgO+C (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2 Si+2H2O SiO2+2Mg 2MgO+Si3、与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO4 SO3+H2O=2H++SO42–3NO2+H2O===2HNO3+NO (NO2不是硝酸的酸酐)N2O5+H2O===2HNO3 N2O5+H2O=2H++2NO3–P2O5+H2O(冷水)===2HPO3P2O5+3H2O(热水)===2H3PO4 (P2O5极易吸水,可作气体干燥剂)P2O5+3H2SO4(浓)===2H3PO4+3SO3CO2+H2O===H2CO3Cl2O+H2O==2HClOCl2O7+H2O==2HClO4 Cl2O7+H2O=2H++2ClO4–4、与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO32NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑(硫酸工业尾气处理)SO2+Ca(OH)2===CaSO3↓+H2O (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4↓+H2OCO2+NH3+H2O===NH4HCO3CO2+2NH3(过量)+H2O===(NH4)2CO3 (NH4)2CO3 (NH2)2CO+2H2O CO2+2NH3 (NH2)2CO+H2O (工业制取尿素)CO2+2NaOH(过量)==Na2CO3+H2O 2OH-+CO2=CO32–+H2OCO2(过量)+NaOH==NaHCO3 OH-+CO2=HCO3–CO2+Ca(OH)2(过量)==CaCO3+H2O Ca2++2 +CO2=CaCO3↓+H2O2CO2(过量)+Ca(OH)2==Ca(HCO3)2 OH―+CO2=HCO3–CO2+CaCO3+H2O==Ca(HCO3)2 CO2+CaCO3+H2O=Ca2++2HCO3–CO2(不足)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3CO2+3H2O+AlO2–=Al(OH)3↓+CO32–CO2(足)+NaAlO2+2H2O===Al(OH)3↓+NaHCO3CO2+2H2O+AlO2–=Al(OH)3↓+HCO3–CO2+C6H5ONa+H2O===C6H5OH↓+NaHCO3CO2+C6H5O―+H2O=C6H5OH↓+HCO3–SiO2+CaO CaSiO3 (炼钢造渣)SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3 Na2SiO3+CO2 (制取玻璃)SiO2+CaCO3 CaSiO3+CO2 (制取玻璃)2NO2+2NaOH==NaNO2+NaNO3+H2O2NO2+2OH―=NO3–+NO2―+H2ONO+NO2+2NaOH==2NaNO2+H2O (制取硝酸工业尾气吸取)NO+NO2+2OH―=2NO3–+H2O五.金属氧化物1、低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2OFeO+4H++NO3―=Fe3++NO2↑+2H2O2、氧化性:Na2O2+2Na 2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,专门难被还原为Mg,Al.一样通过电解制Mg和Al.Fe2O3+3H2 2Fe+3H2O(制还原铁粉)Fe3O4+4H2 3Fe+4H2O CuO+H2 Cu+H2O2Fe3O4+16HI==6FeI2+8H2O+2I22Fe3O4+16H++4I―=6Fe2++8H2O+2I2Fe2O3+Fe 3FeO (炼钢过程中加入废钢作氧化剂)FeO+C Fe+CO (高温炼钢调剂C含量)2FeO+Si 2Fe+SiO2 (高温炼钢调剂Si含量)3、与水的作用:Na2O+H2O==2NaOHNa2O+H2O=2Na++2OH–2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2H2O=4Na++4OH–+O2↑(此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2 H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)===BaSO4+H2O2) MgO+H2O===Mg(OH)2(缓慢反应)4、与酸性物质的作用:Na2O+SO3==Na2SO4 Na2O+CO2==Na2CO3 MgO+SO3===MgSO4 Na2O+2HCl==2NaCl+H2ONa2O+2H+=2Na++H2O2Na2O2+2CO2==2Na2CO3+O2↑Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+H2SO4===MgSO4+H2OMgO+2H+=Mg2++H2OAl2O3+3H2SO4===Al2(SO4)3+3H2OAl2O3+6H+=2Al3++3H2OAl2O3+2NaOH===2NaAlO2+H2O (Al2O3两性氧化物)Al2O3+2OH―=2AlO2―+H2OFeO+2HCl===FeCl2+H2OFeO+2H+=Fe2++H2OFe2O3+6HCl===2FeCl3+3H2OFe?2O3+6H+=2Fe3++3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2OFe?3O4+8H+=2Fe3++Fe2++4H2O六.含氧酸1、氧化性:4HClO3+3H2S===3H2SO4+4HClClO3–+3H2S=6H++SO42–+Cl–HClO3+HI===HIO3+HClClO3–+I–=IO3–+Cl–3HClO+HI===HIO3+3HCl3HClO+I-=IO3–+3H++Cl–HClO+H2SO3===H2SO4+HClHClO+H2SO3=3H++SO42–+Cl–HClO+H2O2===HCl+H2O+O2↑HClO+H2O2=H++Cl–+H2O+O2↑(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性专门强) 2H2SO4(浓)+C CO2↑+2SO2↑+2H2O2H2SO4(浓)+S 3SO2↑+2H2OH2SO4+Fe(Al)室温下钝化6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2 O2H2SO4(浓)+Cu CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr===SO2↑+Br2+2H2O (不能用浓硫酸与NaBr制取H Br)H2SO4(浓)+2HI===SO2↑+I2+2H2O (不能用浓硫酸与NaI制取HI)H2SO4(稀)+Fe===FeSO4+H2↑2H++Fe=Fe2++H2↑H2SO3+2H2S===3S↓+3H2O4HNO3(浓)+C CO2↑+4NO2↑+2H2O6HNO3(浓)+S H2SO4+6NO2↑+2H2O5HNO3(浓)+P H3PO4+5NO2↑+H2O5HNO3(稀)+3P+2H2O 3H3PO4+5NO↑5H++5NO3-+3P+2H2O 3H3PO4+5NO↑6HNO3(浓足)+Fe===Fe(NO3)3+3NO2↑+3H2O4HNO3(浓)+Fe(足)===Fe(NO3)2+NO2↑+2H2O(先得Fe3+,在Fe过量时再生成Fe2+的盐)4HNO3(稀足)+Fe===Fe(NO3)3+NO↑+2H2O4H++NO3-+Fe=Fe3++NO↑+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O↑+15H2O30 H++6NO3–+8Fe=8Fe3++3N2O↑+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2↑+18H2O36H++6NO3–+10Fe=8Fe3++3N2↑+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O30 H++3NO3–+8Fe=8Fe3++3NH4++9H2O4Zn+10HNO3(稀)==4Zn(NO3)2+N2O↑+5H2O4Zn+10H++2NO3–=4Zn2++N2O↑+5H2O4Zn+10HNO3(稀)==4Zn(NO3)2+NH4NO3+3H2O4Zn+10H++NO3–=4Zn2++NH4++5H2O2、还原性:H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2)H2SO3+X2+H2O=4H++SO42-+X–2H2SO3+O2==2H2SO42H2SO3+O2=4H++SO42-H2SO3+H2O2===H2SO4+H2OH2SO3+H2O2=2H++SO42–+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O5H2SO3+2MnO4–=2Mn2++4H++3SO42–+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HClH2SO3+2Fe3++H2O=4H++2Fe2+ +SO42–3、酸性:H2SO4(浓)+CaF2 CaSO4+2HF↑(不挥发性酸制取挥发性酸)H2SO4(浓)+NaCl NaHSO4+HCl↑(不挥发性酸制取挥发性酸)H2SO4(浓)+2NaCl Na2SO4+2HCl↑(不挥发性酸制取挥发性酸)H2SO4(浓)+NaNO3 NaHSO4+HNO3↑(不挥发性酸制取挥发性酸)3H2SO4(浓)+Ca3(PO4)2 3CaSO4+2H3PO4 (强酸制弱酸酸)2H2SO4(浓)+Ca3(PO4)2 2CaSO4+Ca(H2PO4)2 (工业制磷肥)3HNO3+Ag3PO4==H3PO4+3AgNO33H++Ag3PO4=H3PO4+3Ag+2HNO3+CaCO3==Ca(NO3)2+H2O+CO2↑2H++CaCO3=Ca2++H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S,HI,HBr,SO2等还原性气体) 4H3PO4+Ca3(PO4)2 3Ca(H2PO4)2 (重钙)H3PO4(浓)+NaBr NaH2PO4+HBr↑(不挥发性酸制取挥发性酸,磷酸是非氧化性酸)H3PO4(浓)+NaI NaH2PO4+HI↑4、不稳固性:2HClO 2HCl+O2↑(储存在棕色瓶中)4HNO3 4NO2↑+O2↑+2H2O (储存在棕色瓶中)H2SO3 H2O+SO2↑(在加热或酸性条件下分解)H2CO3 H2O+CO2↑(在加热或酸性条件下分解)H4SiO4 H2SiO3+H2O H2SiO3 SiO2↓+H2OH2S2O3 H2O+S↓+SO2↑(在加热或酸性条件下分解)七.碱1、低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32、与酸性物质的作用:2NaOH+SO2(少量)==Na2SO3+H2OOH–+SO2=SO32–+H2ONaOH+SO2(足)==NaHSO3OH-+SO2(足)=HSO3–2NaOH+SiO2==Na2SiO3+H2OOH-+SiO2=SiO32–+H2O2NaOH+Al2O3==2NaAlO2+H2O2OH-+Al2O3=2AlO2–+H2O2KOH+Cl2==KCl+KClO+H2OCl2+2OH–=Cl–+ClO–+H2ONaOH+HCl==NaCl+H2OH++OH =H2ONaOH+H2S(足)==NaHS+H2OOH–+H2S=HS–+H2O2NaOH+H2S(少量)==Na2S+2H2O2OH–+H2S=S2–+2H2O3NaOH+AlCl3==Al(OH)3↓+3NaCl3OH–+Al3+=Al(OH)3↓NaOH+Al(OH)3==NaAlO2+2H2O (AlCl3和Al(OH)3哪个酸性强?)OH–+Al(OH)3=AlO2–+2H2OCa(OH)2+2NH4Cl 2CaCl2+2NH3↑+2H2O (实验室制NH3)NaOH+NH4Cl NaCl+NH3↑+H2OMg(OH)2+2NH4Cl==MgCl2+2NH3?H2O (Al(OH)3+NH4Cl不溶解)Ba(OH)2+H2SO4==BaSO4↓+2H2O2H++2OH–+Ba2++SO42–=BaSO4↓2H2O3、不稳固性:Mg(OH)2 MgO+H2O 2Al(OH)3 Al2O3+3H2O2Fe(OH)3 Fe2O3+3H2O Cu(OH)2 CuO+H2O 2AgOH==Ag2O+H2O 八.盐1、氧化性:(在水溶液中)2FeCl3+Fe==3FeCl2 2Fe3++Fe=3Fe2+2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版) 2Fe3++Cu=2Fe2++ Cu2+2FeCl3+Zn(少量)===2FeCl2+ZnCl2 2Fe3++Zn=2Fe2++Zn2+FeCl3+Ag===FeCl2+AgCl↓2Fe3++Cl-+2Ag=2Fe2++2AgCl↓Fe2(SO4)3+2Ag===FeSO4+Ag2SO4↓(较难反应) Fe(NO3)3+Ag不反应2FeCl3+H2S===2FeCl2+2HCl+S↓2Fe3++H2S=2Fe2++2H++S↓2FeCl3+2KI===2FeCl2+2KCl+I2 2Fe3++2I-=2Fe2++I2FeCl2+Mg===Fe+MgCl2 Fe2++Mg=Fe+Mg2+NaNO2+NH4Cl==NaCl+N2↑+2H2O (实验室制氮气) NH4++NO2-=N 2↑+2H2O2、还原性:2FeCl2+3Cl2===2FeCl3 (在水溶液中不需加热)2Fe2++3Cl2=2Fe3++6Cl-3Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S+4H2O3S2-+8H++2NO3-=2NO↑+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O2Na2SO3+O2===2Na2SO4 (Na2SO3在空气中易变质)Na2SO3+S Na2S2O3Na2S+Cl2==2NaCl+S↓(在水溶液中) S2-+Cl2=2Cl-+S↓3、与碱性物质的作用:Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO4↓(波尔多液)MgCl2+2NH3?H2O===Mg(OH)2↓+2NH4ClMg2++2NH3?H2O=Mg(OH)2↓+2NH4+AlCl3+3NH3?H2O===Al(OH)3↓+3NH4ClAl3++3NH3?H2O=Al(OH)2↓+3NH4+FeCl3+3NH3?H2O===Fe(OH)3↓+3NH4ClFe3++3NH3?H2O=Fe(OH)3↓+3NH4+CuSO4+2NH3?H2O(不足)==Cu(OH)2↓+(NH4)2SO4Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+Cu(OH)2+4NH3?H2O=Cu(NH3)4(OH)2+4H2OCu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O 铜氨溶液CuSO4+4NH3?H2O(足)==Cu(NH3)4SO4+4H2O 总方程式Cu2++4NH3?H2O=[Cu(NH3)4]2++4H2O 铜氨溶液AgNO3+NH3?H2O==AgOH↓+NH4NO3 2AgOH=Ag2O(灰黑色)+H2O Ag2O+4NH3?H2O=2[Ag(NH3)2]++2OH-+3H2O 银氨溶液AgNO3+2NH3?H2O==Ag(NH3)2NO3+2H2OAg++2NH3?H2O=[Ag(NH3)2]++2H2O 总方程式ZnSO4+2NH3?H2O(不足)==Zn(OH)2↓+(NH4)2SO4Zn2++2NH3?H2O=Zn(OH)2↓+2NH4+Zn(OH)2+4NH3?H2O=Zn(NH3)4(OH)2+4H2OZnSO4+4NH3?H2O(足)==Zn(NH3)4SO4+4H2OZn2++4NH3?H2O=[Zn(NH3)4]2++4H2O 总方程式4、与酸性物质的作用:强酸制弱酸,或不挥发性酸制挥发性酸Na3PO4+2HCl===Na2HPO4+2NaCl PO43-+2H+=H2PO4-Na2HPO4+HCl===NaH2PO4+NaCl HPO42-+H+=H2PO4-NaH2PO4+HCl===H3PO4+NaCl H2PO4-+H+=H3PO4Na2CO3+HCl===NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl===NaCl+H2O+CO2↑HCO3-+H+=CO2↑+H2O3Na2CO3+2AlCl3+3H2O==2Al(OH)3↓+3CO2↑+6NaCl (物质之间的双水解反应)3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+3CO2+6NaCl (物质之间的双水解反应)3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑3NaHCO3+AlCl3===Al(OH)3↓+3CO2↑(物质之间的双水解反应)3HCO3-+Al3+=2Al(OH)3↓+3CO2↑3NaHCO3+FeCl3===Fe(OH)3↓+3CO2↑(物质之间的双水解反应)3HCO3-+Fe3+=2Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O===2Al(OH)3↓+3H2S↑(物质之间的双水解反应)3S2-+2Al3++3H2O=2Al(OH)3↓+3H2S↑3NaAlO2+AlCl3+6H2O==4Al(OH)3↓+3NaCl (物质之间的双水解反应)3AlO2-+Al3++6H2O=4Al(OH)3↓3NaAlO2+FeCl3+6H2O==3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓NaAlO2+NH4Cl+2H2O==Al(OH)3↓+NH3?H2O+NaClAlO2-+NH4++2H2O=Al(OH)3↓+NH3?H2ONa2CO3+H2O+CO2===2NaHCO3CO32-+H2O+CO2=2HCO3-Na2CO3+H2O+2SO2==2NaHSO3+CO2↑(1:2)CO32-+H2O+2SO2=2HSO3-+CO2↑2Na2CO3(足)+H2O+SO2==Na2SO3+2NaHCO3 (CO2中的SO2不能用Na2CO3洗气)2CO32-+H2O+SO2=SO32-+2HCO3- (2:1)Na2CO3+SO2==Na2SO3+CO2 (1:1)CO32-+SO2=SO32-+CO2NaHCO3+SO2===NaHSO3+CO2 (CO2中的SO2可能用NaHCO3洗气) 2HCO3-+SO2=2HSO3-+CO22NaHCO3+SO2==Na2SO3+2CO2+H2O2HCO3-+SO2=SO32-+2CO2+H2ONa2SiO3+2HCl===H2SiO3↓+NaCl 或Na2SiO3+2HCl+H2O===H4SiO 4↓+2NaClSiO32-+2H+=H2SiO3↓或SiO32-+2H++H2O=H4SiO4↓Na2SiO3+CO2+2H2O===H2SiO3↓+Na2CO3SiO32-+CO2+2H2O=H4SiO4↓+CO32-5、盐与盐复分解反应Na2SO4+BaCl2==BaSO4↓+2NaCl(沉淀不溶于盐酸、硝酸)SO32-+Ba2+=BaSO4↓Na2SO3+BaCl2==BaSO3↓+2NaCl (沉淀溶于盐酸,在硝酸中生成新的沉淀,沉淀不消逝)SO32-+Ba2+=BaSO3↓Na2CO3+BaCl2==BaCO3↓+2NaCl(沉淀溶于盐酸、沉淀消逝)CO32-+Ba2+=BaCO3↓Na2CO3+CaCl2==CaCO3↓+2NaCl (NaHCO3不反应)CO32-+Ca2+=CaCO3↓AgNO3+NaCl==AgCl↓+NaNO3 Ag++Cl-=AgCl↓AgNO3+NaBr==AgBr↓+NaNO3 Ag++Br-=AgBr↓AgNO3+KI==AgCl↓+KNO3 Ag++I-=AgI↓3AgNO3+Na3PO4==Ag3PO4↓+3NaNO3 3Ag++PO43-=Ag3PO4↓CuSO4+Na2S==CuS↓+Na2SO4 Cu2++S2-=CuS↓FeCl3+3KSCN==Fe(SCN)3+3KClFe3++3SCN-=Fe(SCN)3 (血红色,用于Fe3+的特性检验)6、不稳固性:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2OS2O32-+2H+=S↓+SO2↑+H2ONH4Cl NH3↑+HCl↑NH4I NH3↑+HI↑2HI H2+I2NH4I NH3↑+H2↑+I2↑NH4HCO3 NH3↑+H2O+CO2↑2KNO3 2KNO2+O2↑2Cu(NO3)3 2CuO+4NO2↑+O2↑2AgNO3 2Ag+2NO2↑+O2↑(储存在棕色瓶中)5NH4NO3 4N2↑+2HNO3+9H2O10NH4NO3 8N2↑+4NO2↑+O2↑+20H2O↑(硝酸铵爆炸反应)2KMnO4 K2MnO4+MnO2+O2↑2KClO3 2KCl+3O2↑2NaHCO3 Na2CO3+H2O+CO2↑Ca(HCO3)2 CaCO3+H2O+CO2↑CaCO3 CaO+CO2↑MgCO3 MgO+CO2↑九、电离方程式1、酸的电离(H2SO4、HNO3、HCl、HBr、HI、H3PO4、HF、H2SO3、CH3COOH、H2CO3、H2S、HNO2、C6H5OH、HCN、HClO)H2SO4==2H++SO42- 或:H2SO4+2H2O==2H3O++SO42-HNO3==H++NO3- 或:HNO3+H2O==H3O++NO3- (以下雷同)HCl==H++ClHBr==H++BrHI==H++IH3PO4 H++H2PO H2PO H++HPO HPO H++POHF H++FH2SO3 H++HSO HSO H++SOCH3COOH H++CH3COOH2CO3 H++ H++H2S H++ H++HNO2 H++NO C6H5OH H++C6H5O- (苯酚不是酸,显酸性)HCN H++CNHClO H++ClOH2O H++OH2H2O H3O++OH2、碱的电离(NaOH、KOH、Ba(OH)2、Mg(OH)2、Al(OH)3、NH3?H2O)NaOH==Na++OH KOH==K++OH Ba(OH)2==Ba2++2OHMg(OH)2 Mg2++2OHAl(OH)3 Al3++3OH 酸式电离:Al(OH)3 H++ +H2ONH3?H2O +2OHCa(OH)2==Ca2++2OH (澄清石灰水)Ca(OH)2 Ca2++2OH (石灰悬浊液)3、盐的电离(NaCl、Na2SO4、NaHSO4、Na2SO3、NaHSO3、MgSO4、CaSO4、A l2(SO4)3、CuSO4、AlCl3、AgNO3、CH3COONa、NH4NO3、FeCl3、Na2 CO3、NaHCO3、Na2S、NaHS、NaH2PO4、Na2HPO4、Na3PO4、KI、Na Br、NaClO、AgCl、CaCO3)NaCl==Na++ClNa2SO4==2Na++NaHSO4==H++Na++Na2SO3==2Na++NaHSO3==Na++HSO3- (错误书写:NaHSO3==Na++H++SO42-)MgSO4==Mg2++Al2(SO4)3==2Al3++3CuSO4==Cu2++AlCl3==Al3++3ClAgNO3==Ag++NO3CH3COONa==CH3COO +Na+NH4NO3==NH4++NO3-FeCl3==Fe3++3ClNa2CO3==2Na++NaHCO3==Na++ (错误书写:NaHCO3==Na++H++ )Na2S==2Na++NaHS==Na++HS (错误书写:NaHS==Na++H+ )NaH2PO4==Na++H2PONa2HPO4==2Na++HPO (错误书写:Na2HPO4==2Na++H++PO )Na3PO4==3Na++POKI==K++I―NaBr==Na++Br―NaClO==Na++ClO―AgCl Ag++ (难溶、微溶物质在水中发生柔弱电离)CaCO3 Ca2++ (错误书写:CaCO3==Ca2++CO )CaSO4 Ca2++SO (错误书写:CaSO4==Ca2++SO )3、熔融电离NaCl Na++ MgCl2 Mg2++2Na2O 2Na++O2―Al2O3 2Al3++3O2―十、水解反应1、单水解---可逆水解NH4Cl+H2O NH3?H2O+HCl NH4++H2O H++NH3?H2OFeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+AlCl3+3H2O Al(OH)3+3HCl Al3++3H2O Al(OH)3+3H+CuSO4+2H2O Cu(OH)2+H2SO4 (金属活动顺序表中Mg2+以后的阳离子均水解)NaHCO3+H2O H2CO3+NaOH (NaHSO4不水解,NaHSO3电离大于水解)Na2CO3+H2O NaHCO3+NaOH CO32-+H2O HCO3-+OH–NaHCO3+H2O H2CO3+NaOH(第一步远远大于第二步,二步不能叠加) Na2SO3+H2O NaHSO3+NaOH SO32-+H2O HSO3-+OH–NaHSO3+H2O H2SO3+NaOH(第一步远远大于第二步,二步不能叠加) HSO3-+H2O H2SO3+OH-Na2S+H2O NaHS+NaOH S2-+H2O HS-+OH–NaHS+H2O H2S+NaOH(第一步远远大于第二步,二步不能叠加)HS-+H2O H2S+OH-Na3PO4+H2O Na2HPO4+NaOH PO43-+H2O HPO42-+OH–Na2HPO4+H2O NaH2PO4+NaOH HPO42-+H2O H2PO4-+OH–NaH2PO4+H2O H3PO4+NaOH H2PO4-+H2O H3PO4+OH–CH3COONa+H2O CH3COOH+NaOH CH3COO-+H2O CH3COOH+O H–C6H5ONa+H2O C6H5OH+NaOH C6H5O-+H2O C6H5OH+OH–2、双水解CH3COONH4+H2O CH3COOH+NH3?H2ONH4F+H2O HF+NH3?H2OAl2S3+6H2O==Al(OH)3↓+H2S↑(隔绝空气,密封储存)Mg3N2+6H2O==Mg(OH)2↓+NH3↑(隔绝空气,密封储存)Na3P+3H2O==3NaOH+PH3↑(隔绝空气,密封储存)Zn3P2+6H2O==Zn(OH)2↓+PH3↑(Zn3P2一种老鼠药,PH3剧毒神经毒剂)CaC2+2H2O==Ca(OH)3↓+C2H2↑(隔绝空气,密封储存)C2H5ONa+H2O==C2H5OH+NaOH十一、电解及电极方程式1、电解质溶液在惰性电极条件下,或阴极是较爽朗金属电极,阳极是惰性电极条件下的电解2NaCl+2H2O 2NaOH+H2↑+Cl2↑(-)2H2O+2e-==H2↑+2OH- 或2H++2e-==H2↑(+)2Cl --2e-==Cl2↑2Cl-+2H2O 2OH-+H2↑+Cl2↑CuCl2 Cu+Cl2↑(-)Cu2++2e-==Cu↓(+)2Cl- -2e-==Cl2↑Cu2++2Cl- Cu↓+Cl2↑2CuSO4+2H2O 2Cu↓+O2↑+2H2SO4(-)2Cu2+ + 4e-==2Cu↓(+)2H2O - 4e-==O2↑+4H+ 或:4OH- -4e-==O2↑+2H2O 4H2O 4H+ +4OH-2Cu2++2H2O 2Cu↓+O2↑+4H+2H2O 2H2↑+O2↑(-) 4H++4e-==2H2↑(+)4OH- -4e-==O2↑+2H2O中性电解4H2O 4H++4OH-2H2O H2↑+O2↑酸性水解:(-) 4H++4e-==2H2↑(+)2H2O-4e-==O2↑+4H+ 4OH- -4e-==O2↑+2H2O2H2O H2↑+O2↑碱性水解:(-) 4H2O+4e-==2H2↑+4OH- 或:4H++4e-==2H2↑(+)4OH--4e-==O2↑+2H2O2H2O H2↑+O2↑2、电镀:镀件作阴极,被镀金属作阳极,被镀金属的含氧酸盐作电解质溶液镀铜:CuSO4电镀液镀件(-) Cu2++2e-==Cu↓纯铜(+) Cu–2e-==Cu2+镀锌:ZnSO4电镀液镀件(-) Zn2++2e-==Zn↓纯锌(+) Zn–2e-==Zn2+镀银:AgNO3电镀液镀件(-) Ag++e-==Ag↓纯银(+) Ag–e-==Ag+镀镍:NiSO4电镀液镀件(-) Ni2++2e-==Ni↓纯镍(+) Ni–2e-==Ni2+3、熔融状态下的电解:2NaCl(熔融) 2Na+Cl2↑(-)2Na++2e-==2Na(+)2Cl--4e-==Cl2↑2Na++2Cl-(熔融) 2Na+Cl2↑2Al2O3(熔融) 4Al+2O2↑(-)4Al3++12e–==4Al(+)6O2- -12e-==3O2↑4Al3+ +6O2- 4Al+3O2↑NaHF2(熔融) H2↑+F2↑(-)2H++2e–==H2↑(+)2F- -2e-==F2↑2HF H2↑+F2↑高考必背化学方程式就为大伙儿介绍到那个地点,期望对你有所关心。
高中化学重点化学方程式大全

高中化学重点化学方程式大全以下是高中化学重点化学方程式大全,按照不同的化学反应类型进行划分:1. 酸碱反应方程式:(1)强酸和强碱反应:HCl + NaOH → NaCl + H2OH2SO4 + 2NaOH → Na2SO4 + 2H2O(2)弱酸和强碱反应:CH3COOH + NaOH → CH3COONa + H2OH2CO3 + 2NaOH → Na2CO3 + 2H2O(3)酸性氧化物和碱性氧化物反应:SO2 + 2NaOH → Na2SO3 + H2OCO2 + 2NaOH → Na2CO3 + H2O2. 氧化还原反应方程式:(1)金属和非金属反应:2Na + Cl2 → 2NaCl2Mg + O2 → 2MgO(2)金属和酸反应:Zn + 2HCl → ZnCl2 + H2↑Mg + 2HNO3 → Mg(NO3)2 + H2↑(3)金属和过氧化氢反应:2K + H2O2 → 2KOH + H2↑2Na + H2O2 → 2NaOH + H2↑(4)非金属和过氧化氢反应:SO2 + H2O2 → H2SO4NO + O3 → NO2 + O23. 离子反应方程式:(1)沉淀反应:AgNO3 + NaCl → AgCl↓ + NaNO3 BaCl2 + K2SO4 → BaSO4↓ + 2KCl(2)酸碱反应:H2SO4 + 2NaOH → Na2SO4 + 2H2OHNO3 + NaOH → NaNO3 + H2O(3)双置换反应:AgNO3 + NaCl → AgCl↓ + NaNO3FeSO4 + CuSO4 → FeSO4 + CuSO4↓以上是高中化学重点化学方程式大全,掌握这些化学方程式对于化学知识的理解有很大帮助。
高中化学方程式大全(最最最完整版)

〔以下无机反应箭头改等号〕1. 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光2. 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)〔14、15结合〕 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 23. 氧化复原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+4. 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+5. 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆50、22SO O S −−→−+点燃51、O H 3SO K S K 2KOH 6S 32422++−→−+∆6. 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+〔60、61结合〕 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+ 64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++7. 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温或22SO O S −−→−+点燃 78、3OV 22SO 2O SO 252∆−−→←+〔改为可逆号〕 79、4232SO H SO O H →+8. 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+86、NaCl 2BaSO SO Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na 91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 9. 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨 102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(10. 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na 110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+ 112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))(115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+11. 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃 M 表示碱金属元素,124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2 12. 氮气126、232N Mg N Mg 3−−→−+点燃127、322NH 2H N 催化剂高温高压−−−→←+〔改可逆号〕 128、NO 2O N 22−−→−+放电129、22NO 2O NO 2→+130、422O N NO 2⇔131、NO HNO 2O H NO 3322+→+132、322HNO 4O H 2O 3NO 4→++133、3222HNO 4O H 2O NO 4→++13. 氨 铵盐134、Cl NH HCl NH 43→+135、3433NO NH HNO NH →+136、O H 6NO 4O 5NH 4223+−−→−+∆催化剂137、O H N O NH 2223+−−→−+点燃(纯)〔系数4326〕 138、O H 2CaCl NH 2OH Ca Cl NH 22324++↑−→−+∆)( 139、↑+↑−→−∆HCl NH Cl NH 34(固) 140、Cl NH HCl NH 43→+ 141、↑++↑−→−∆22334CO O H NH HCO NH 142、O H 2SO Na NH 2NaOH 2SO NH 2423424++↑−→−+∆)( 14. 硝酸143、O H 2O NO 4HNO 42223++↑−−→−光或热 144、O H 2NO 2NO Cu HNO 4Cu 22233+↑+→+)((浓)145、O H 4NO 2NO Cu 3HNO 8Cu 32233+↑+→+)((稀)145、O H 2NO 4CO HNO 4C 2223+↑+↑→+146、↑+−→−+∆34423HNO NaHSO SO H NaNO (浓) 147、4NH3+5O2=4NO+6H2O148、2NO+O2=2NO2149、3NO2+H2O=2HNO3+NO150、O H NaNO 2NaOH 2NO NO 222+→++15. 磷 磷酸(内容为了解)151、32PCl 2Cl 3P 2−−→−+点燃152、52PCl 2Cl 5P 2−−→−+点燃153、3252HPO O H O P −−→−+冷水154、43252PO H 2O H 3O P −−→−+热水 155、↓+−→−+∆44342243CaSO 3PO H 2SO H 3PO Ca (浓))( 156、↓+−→−+∆424242243CaSO 2PO H Ca SO H 2PO Ca )((浓))( 157、24243243PO H Ca 3PO H 4PO Ca )((浓))(→+16. 硅及其重要的化合物158、22SiO O Si −→−+∆159、↑+→++2322H 2SiO Na O H NaOH 2Si 160、↑+−−→−+CO 2Si C 2SiO 2高温161、32CaSiO CaO SiO −−→−+高温162、O H SiO Na NaOH 2SiO 2322+→+163、O H 2SiF HF 4SiO 242+→+164、NaCl 2SiO H O H HCl 2SiO Na 44232+↓→++ 165、O H SiO H SiO H 23244+−−−→−干燥空气166、32322232CO Na SiO H O H CO SiO Na +↓→++17. 制玻璃167、↑+−−→−+232232CO SiO Na SiO CO Na 高温 168、↑+−−→−+2323CO CaSiO SiO CaCO 高温 18. 镁和铝的性质169、MgO 2O Mg 22−−→−+点燃170、322O Al 2O 3Al 4−→−+∆171、↑+→++222H 3NaAlO 2O H 2NaOH 2Al 2 172、22MgCl Cl Mg −−→−+点燃173、32AlCl 2Cl 3Al 2−−→−+点燃174、232N Mg N Mg 3−−→−+点燃175、32S Al S 3Al 2−−→−+点燃176、Cu MgSO CuSO Mg 44+→+ 177、Hg 3NO Al 2NO Hg 3Al 23323+→+)()(178、↑+−−→−+222H OH Mg O H 2Mg )(沸水179、↑+−−→−+∆232H 3OH Al 2O H 6Al 2)(沸水180、C MgO 2CO Mg 22+−−→−+点燃181、Fe 2O Al O Fe Al 23232+−−→−+高温182、V 6O Al 5O V 3Al 103252+−−→−+高温183、W O Al WO Al 2323+−−→−+高温184、Cr 2O Al O Cr Al 23232+−−→−+高温19. 镁和铝的重要化合物185、↑+−−→−23CO MgO MgCO 煅烧 186、O H MgO OH Mg 22+−→−∆)( 189、↓+→+2222OH Mg CaCl OH Ca MgCl )()( 190、↑+−−→−22Cl Mg MgCl 熔融电解191、↑+−−→−232O 3Al 4O Al 电解冰晶石192、O H 3AlCl 2HCl 6O Al 2332+→+193、O H 3SO Al SO H 3O Al 23424232+→+)(194、O H NaAlO 2NaOH 2O Al 2232+→+195、424323342SO NH 3OH Al 2O H NH 6SO Al )()()(+↓→⋅+196、O H 3O Al OH Al 22323+−→−∆)( 197、O H 3AlCl HCl 3OH Al 233+→+)( 198、O H 6SO Al SO H 3OH Al 22342423+→+)()(199、O H 2NaAlO NaOH OH Al 223+→+)(20. 硬水及其软化200、23223HCO Ca O H CO CaCO )(→++201、O H CO CaCO HCO Ca 22323+↑+↓−→−∆)( 202、O H CO MgCO HCO Mg 22323+↑+↓−→−∆)( Mgco3+H2O=Mg(OH)2+CO2(加热条件) 203、O H 2CaCO 2OH Ca HCO Ca 23223+↓→+)()(204、O H 2OH Mg CaCO 2OH Ca 2HCO Mg 223223+↓+↓→+)()()(205、4224CaSO OH Mg OH Ca MgSO +↓→+)()( 206、423324SO Na CaCO CO Na CaSO +↓→+ 21. 铁和铁的化合物207、432O Fe O 2Fe 3−−→−+点燃208、FeS S Fe −→−+∆209、32FeCl 2Cl 3Fe 2−→−+∆ 210、2432H 4O Fe O H 4Fe 3+−−→−+高温(气) 211、↑+→+22H FeCl HCl 2Fe 212、Cu SO Fe SO Cu Fe 2424+→+)()(213、O H FeCl HCl 2FeO 22+→+214、O H 3FeCl 2HCl 6O Fe 2332+→+215、4224SO Na OH Fe NaOH 2FeSO +→+)( 216、NaCl 3OH Fe NaOH 3FeCl 33+↓→+)( 217、3222OH Fe 4O H 2O OH Fe 4)()(→++218、O H FeO OH Fe 22+−→−∆)( 219、O H 3O Fe OH Fe 22323+−→−∆)( 220、O H 2FeCl HCl 2OH Fe 222+→+)(221、O H 3FeCl HCl 3OH Fe 233+→+)(222、O H Fe H FeO 22+→+ 223、O H 3Fe 2H 3O Fe 2232+→+ 224、O H 4Fe 3H 4O Fe 2243+→+225、O H 2NO NO Fe HNO 4Fe 2333+↑+→+)((稀)22. 炼铁和炼钢226、232CO 3Fe 2CO 3O Fe +−−→−+高温 227、↑+−−→−23CO CaO CaCO 高温228、FeO 2O Fe 22−−→−+高温229、2SiO Fe 2FeO 2Si +−−→−+高温230、MnO Fe FeO Mn +−−→−+高温231、CO Fe FeO C +−−→−+高温232、32O Al Fe 3FeO 3Al 2+−−→−+高温233、243PO Ca Fe 5CaO 3FeO 5P 2)(高温+−−→−++23. 甲烷234、↑+−−→−+∆432CaO3CH CO Na NaOH COONa CH 235、O H 2CO O 2CH 2224+−−→−+点燃236、HCl Cl CH Cl CH 324+−→−+光237、HCl Cl CH Cl Cl CH 2223+−→−+光 238、HCl CHCl Cl Cl CH 3222+−→−+光 239、HCl CCl Cl CHCl 423+−→−+光240、24H 2C CH +−−→−高温24. 乙烯241、O H CH CH OH CH CH 222C17023+↑=−−→−--。
高中化学方程式大全(最最完整版)

优质解答1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3•H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2¬:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2F e2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液: Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应: 2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸: Zn+2H+=Z n2++H2↑63、锌与醋酸: Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、氯化铁溶液加入碘化钾溶液: 2Fe3++2I-=2Fe2++I266、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸: Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸: Fe2O3+6H+=2Fe3++3H2O70、氧化铁溶于氢碘酸溶液: Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、向溴化亚铁溶液通入少量氯气: 2Fe2++Cl2=2Fe3++2Cl-74、向碘化亚铁溶液通入足量氯气: 2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、向碘化亚铁溶液通入少量氯气: 2I-+Cl2=I2+2Cl-76、碘化钾溶液中加入氯水: 2I-+Cl2=I2+2Cl-77、碘化钾溶液中加入过量氯水: I-+3Cl2+3H2O=6H++IO3-+6Cl-78、溴化钠溶液中加入氯水: 2Br-+Cl2=Br2+2Cl-79、亚硫酸溶液中加入氯水: H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、亚硫酸溶液中加入氯化铁: H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、亚硫酸溶液中加入双氧水: H2SO3++H2O2=2H++H2O+SO42-82、氯气通入水中: Cl2+H2O=H++Cl-+HClO83、氯气通入碳酸氢钠溶液中: Cl2+HCO3=Cl-+CO2+HClO84、亚硫酸钠溶液中加入溴水: SO32-+H2O+Br2=SO42-+Br-+2H+85、亚硫酸钠溶液中加入双氧水: SO32-+H2O2=SO42-+2H2O86、二氧化硫通入溴水中: SO2+Br2+2H2O=4H++2Br-+SO42-87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、单质铜与稀硝酸反应: 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、单质铜与浓硝酸反应: Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、铜片插入硝酸银溶液: 2Ag++Cu=2Ag+Cu2+92、用氨水吸收少量SO2: SO2+2NH3+H2O=2NH4++SO32-93、用氨水吸收过量的SO¬2 : SO2+NH3+H2O=NH4++HSO3-94、稀硝酸中通入SO2: 3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、浓硝酸中通入SO2: SO2+2NO3-=SO42-+2NO2↑96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- NH3↑+H2O97、向次氯酸钙溶液中通入SO2: Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、用碳酸钠溶液吸收过量SO2: CO32-+H2O+2SO2=CO2↑+2HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、电解饱和食盐水: 2Cl-+2H2O 2OH-+H2↑+Cl2↑102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+103、电解氯化铜溶液: Cu2++2Cl- Cu↓+Cl2↑104、电解熔融氯化钠: 2Na++2Cl-(熔融) 2Na+Cl2↑105、电解熔融氧化铝: 4Al3+ +6O2- 4Al+3O2↑106、二氧化锰与浓盐酸共热: MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3-110、次氯酸钠溶液中加入浓盐酸: ClO-+Cl-+2H+=Cl2↑+H2O111、氯酸钾与浓盐酸: ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O113、NO2溶于水: 3NO2+H2O=2H++NO3-+NO↑114、NO2通入亚硫酸钠溶液: SO32-+NO2=SO42-+NO↑115、硫化钠的第一步水 S2-+H2O HSO3-+OH-116、碳酸钠的第一步水 CO32-+H2O HCO3-+OH-117、氯化钡溶液与硫酸反应: Ba2++SO42-=BaSO4↓118、硫溶于热的氢氧化钠溶液: 3S+6OH-=2S2-+SO32-+3H2O119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、醋酸与氢氧化钾溶液反应: CH3COOH+OH-=CH3COO-+H2O121、醋酸与氨水反应:CH3COOH+NH3•H2O=CH3COO-+NH4++2H2O122、苯酚溶于氢氧化钠溶液: C6H5OH+OH-=C6H5O-+H2O123、苯酚与氯化铁溶液反应: 6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+ 124、苯酚钠溶于醋酸溶液: C6H5O-+CH3COOH=C6H5OH+CH3COO-125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-128、甲酸钠跟盐酸反应: HCOO-+H+=HCOOH129、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-130、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O131、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O 132、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O133、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ 134、乙烯通入酸性高锰酸钾溶液生成CO2:5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O135、乙酸乙酯与氢氧化钠溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3 136、硬脂酸甘油酯与氢氧化钠溶液:(C17H35COO)3(C3H5O3)+3OH-=3C17H35COO-+CH2(OH)CH(OH)CH2OH 137、氯乙烷在氢氧化钠溶液中水CH3CH2Cl+OH-=CH3CH2OH+Cl-138、硝酸银溶液中滴入少量氨水:Ag++NH3•H2O=AgOH↓+NH4+139、硝酸银溶液中滴加氨水至过量:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O 140、葡萄糖发生银镜反应:CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-=CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O+2Ag↓141、硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-=Cu(OH)2↓142、硫酸铜溶液中加入少量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+143、硫酸铜溶液中加入过量氨水:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O 144、硫酸锌溶液中加入少量氨水:Zn2++2NH3•H2O=Zn(OH)2↓+2NH4+145、硫酸锌溶液中加入过量氨水:Zn2++4NH3•H2O=[Zn(NH3)4]2++4H2O第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓)82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+ 86、NaCl 2BaSO SO Na BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+ 88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na 91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃 101、S Na S Na 22−−→−+研磨 102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2 106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+ 108、O H NaCl 2HCl 2O Na 22+→+ 109、↑++→+2222O O H 2NaCl 4HCl 4O Na 110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCO CaCl CO Na 3232+↓→+ 118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)( 119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃 122、22KO O K −−→−+点燃 123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
完整版)高中化学方程式大全(最最完整版)

完整版)高中化学方程式大全(最最完整版) 高中化学方程式总结第一章:卤素第一节:氯气1、2Na + Cl2 → 2NaCl2、Cu + Cl2 → CuCl23、2Fe + 3Cl2 → 2FeCl34、H2 + Cl2 → 2HCl5、2P + 3Cl2 → 2PCl36、PCl3 + Cl2 → PCl57、Cl2 + H2O → HCl + HClO8、2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9、Ca(ClO)2 + CO2 + H2O → CaCO3 ↓ + 2HClO10、2NaOH + Cl2 → NaClO + NaCl + H2O (光照)11、4HCl + MnO2 → MnCl2 + 2H2O + Cl2 ↑12、2KMnO4 + 16HCl (浓) → 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O13、2HClO → 2HCl + O2第二节:氯化氢14、NaHSO4 + HCl ↑ → NaCl + H2SO415、NaCl + H2SO4 (浓) → Na2SO4 + HCl ↑14、15结合)16、2NaCl + H2SO4 (浓)17、HCl + AgNO3 → AgCl ↓ + HNO318、NaCl + AgNO3 → AgCl ↓ + NaNO319、KCl + AgNO3 → AgCl ↓ + KNO320、2HCl + CaCO3 → CaCl2 + H2O + CO2 ↑第三节:氧化还原反应21、CuO + H2 → Cu + H2O22、C + 4HNO3 → CO2 ↑ + 4NO2 ↑ + 2H2O23、4Zn(NO3)2 → 4Zn + 10NO2 ↑ + NH4NO3 + 3H2O24、11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 + 15H2SO425、KClO3 + 6HCl (浓) → 3Cl2 ↑ + KCl + 3H2O26、4Mg(NO3)2 → 4Mg + 10NO2 ↑ + N2H4(NO3)222HBr S(固)27、化学方程式:K2Cr2O76Fe3O431H2SO4Cr(2SO439Fe(2SO43K2SO431H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学方程式大全一、非金属单质(F2、Cl2、O2、S、N2、P、C、Si)(1)、氧化性F2 + H2=2HF (冷暗处爆炸)2F2 +2H2O=4HF+O2Cl2 +H2=2HCl (光照或点燃)Cl2 +2Na点燃2NaCl3Cl2 +2Fe点燃2FeCl3Cl2 +2FeCl2=2FeCl3Cl2+Cu点燃CuCl22Cl2+2NaBr=2NaCl+Br2Cl2 +2NaI =2NaCl+I2Cl2 +Na2S=2NaCl+S↓Cl2 +H2S=2HCl+S↓Cl2+SO2 +2H2O=H2SO4 +2HCl(比较重要,包含其离子反应)2O2 +3Fe点燃Fe3O4S+H2△H2SS+Fe△FeSS+2Cu△Cu2S3S+2Al△Al2S3N2+3H2催化剂高温高压2NH3N2+3Mg △Mg3N2(2)、还原性S+O2点燃SO2S+6HNO3(浓)=H2SO4+6NO2↑+2H2O N2+O2=2NO(放电)2C+O2(少量)点燃2COC+O2(足量)点燃CO2C+CO2△2CO C+H2O高温CO+H2(生成水煤气)2C+SiO2△Si+2CO(制得粗硅)Si(粗)+2Cl2△SiCl4(SiCl4+2H2△Si(纯)+4HCl)Si(粉)+O2△SiO2Si+2NaOH+H2O=Na2SiO3+2H2↑(3)、歧化Cl2+H2O=HCl+HClO(加酸抑制歧化、加碱或光照促进歧化) Cl2+2NaOH=NaCl+NaClO+H2O3Cl2+6NaOH=5NaCl+NaClO3+3H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 3S+6NaOH△2Na2S+Na2SO3+3H2O3C+SiO2电炉SiC+2CO↑二、金属单质(Na、Mg、Al、Fe)(1)、还原性4Na+O2=2Na2O2Na2O+O2△2Na2O22Na+O2=Na2O22Na+S=Na2S(爆炸)2Na+2H2O=2NaOH+H2↑Mg+Cl2=MgCl2Mg+Br2=MgBr22Mg+O2点燃2MgOMg+2H2O=Mg(OH)2+H2↑2Mg+CO2点燃2MgO+C2Mg+SiO2点燃2MgO+SiMg+H2SO4=MgSO4+H2↑2Al+3Cl2△2AlCl34Al+3O2点燃2Al2O3(钝化)4Al+3MnO2高温2Al2O3+3Mn2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe2Al+3FeO△Al2O3+3Fe2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑(Al、Fe、C在冷、浓的H2SO4、HNO3中钝化)Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O2Al+2NaOH+6H2O=2Na[(AlOH)4]+3H2↑2Fe+3Br2=2FeBr3Fe+I2△FeI2Fe+S△FeS3Fe+4H2O(g)高温Fe3O4+4H2Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+CuFe+SnCl4=FeCl2+SnCl2(铁在酸性环境下、不能把四氯化锡完全还原为单质锡Fe+SnCl2=FeCl2+Sn)三、非金属氢化物(HF、HCl、H2O、H2S、NH3)(1)、还原性4HCl(浓)+MnO2△MnCl2+Cl2+2H2O4HCl(g)+O2△2Cl2+2H2O16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O* 14HCl+K2Cr2O7=2H2O+2F2=4HF+O22H2S+3O2(足量)=2SO2+2H2O2H2S+O2(少量)=2S+2H2O2H2S+SO2=3S+2H2OH2S+H2SO4(浓)=S↓+SO2+2H2O3H2S+2HNO3(稀)=3S↓+2NO+4H2O5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O* 3H2S+K2Cr2O7+4H2SO4=Cr2(SO4)3+K2SO4+3S+7H2O* H2S+4Na2O2+2H2O=Na2SO4+6NaOH2NH3+3CuO△3Cu+N2+3H2O 2NH3+3Cl2=N2+6HCl8NH3+3Cl2=N2+6NH4Cl4NH3+3O2(纯氧)点燃2N2+6H2O4NH3+5O2催化剂△4NO+6H2O4NH3+6NO催化剂△5N2+6HO(用氨清除NO) NaH+H2O=NaOH+H2* 4NaH+TiCl4=Ti+4NaCl+2H2CaH2+2H2O=Ca(OH)2+2H2↑(2)、酸性4HF+SiO2=SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2=CaF2↓+2HClH2S+Fe=FeS+H2↑H2S+CuCl2=CuS↓+2HClH2S+2AgNO3=Ag2S↓+2HNO3H2S+HgCl2=HgS↓+2HClH2S+Pb(NO3)2=PbS↓+2HNO3H2S+FeCl2=不反应2NH3+2Na=2NaNH2+H2(NaNH2+H2O=NaOH+NH3)(3)、碱性NH3+HCl=NH4Cl(白烟)NH3+HNO3=NH4NO3(白烟)2NH3+H2SO4=(NH4)2SO4NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl (侯氏制碱法)(此反应用于工业制备小苏打、苏打) (4)、不稳定性2HI△H2+I22H2O电解2H2↑+O2↑2H2O2=2H2O+O2↑H2S△H2+S四、非金属氧化物(1)、低价态的还原性2SO2+O2△2SO32SO2+O2+2H2O=2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HI* SO2+NO2=SO3+NO2NO+O2=2NO2NO+NO2+2NaOH=2NaNO2+H2O(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2点燃2CO2CO+CuO△Cu+CO23CO+Fe2O3△2Fe+3CO2CO+H2O催化剂△CO2+H2(2)、氧化性SO2+2H2S=3S+2H2O* SO3+2KI=K2SO3+I2NO2+2KI+H2O=NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)* 4NO2+H2S=4NO+SO3+H2O2Mg + CO2点燃2MgO+C(CO2不能用于扑灭由Mg、Ca、Ba、Na、K 等燃烧的火灾)* SiO2+2H2△Si+2H2O* SiO2+2Mg△2MgO+Si(3)、与水的作用SO2+H2O=H2SO3SO3+H2O=H2SO43NO2+H2O=2HNO3+NON2O5+H2O=2HNO3P2O5+H2O(冷)=2HPO3P2O5+3H2O(热)=2H3PO4(P2O5极易吸水、可作气体干燥剂* P2O5+3H2SO4(浓)=2H3PO4+3SO3CO2+H2O=H2CO3(4)、与碱性物质的作用SO2+2NH3+H2O=(NH4)2SO3SO2+ (NH4)2SO3+H2O=2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑生成的硫酸铵作化肥、SO2循环作原料气) SO2+Ca(OH)2=CaSO3↓+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO=MgSO4SO3+Ca(OH)2=CaSO4+H2OCO2+2NaOH(过量)=Na2CO3+H2OCO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3↓+H2O2CO2(过量)+Ca(OH)2=Ca(HCO3)2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 CO2+C6H5ONa+H2O=C6H5OH+NaHCO3 SiO2+CaO高温CaSiO3SiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑五、金属氧化物(1)、低价态的还原性6FeO+O2△2Fe3O4FeO+4HNO3=Fe(NO3)3+NO2↑+2H2O (2)、氧化性Na2O2+2Na=2Na2O(此反应用于制备Na2O)MgO、Al2O3几乎没有氧化性、很难被还原为Mg、Al.一般通过电解熔融态的MgCl2和Al2O3制Mg和Al.Fe2O3+3H2=2Fe+3H2O (制还原铁粉)Fe3O4+4H2△3Fe+4H2O(3)、与水的作用Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑(此反应分两步Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2↑. H2O2的制备可利用类似的反应BaO2+H2SO4(稀)=BaSO4+H2O2)MgO+H2O=Mg(OH)2 (缓慢反应)(4)、与酸性物质的作用Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O2Na2O2+2CO2=2Na2CO3+O2Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2 MgO+SO3=MgSO4MgO+H2SO4=MgSO4+H2OAl2O3+3H2SO4=Al2(SO4)3+3H2O(Al2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2O)FeO+2HCl=FeCl2+3H2OFe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl(浓)△FeCl2+2FeCl3+4H2O六、含氧酸(1)、氧化性* 4HClO3+3H2S=3H2SO4+4HCl* HClO3+HI=HIO3+HCl* 3HClO+HI=HIO3+3HClHClO+H2SO3=H2SO4+HClHClO+H2O2=HCl+H2O+O2↑(氧化性HClO>HClO2>HClO3>HClO4、但浓、热的HClO4氧化性很强)2H2SO4(浓)+C△CO2↑ +2SO2↑+2H2O2H2SO4(浓)+S=3SO2↑+2H2OH2SO4(浓)、HNO3(浓)+Fe(Al) 室温或冷的条件下钝化6H2SO4(浓)+2Fe=Fe2(SO4)3+3SO2↑+6H2O 2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr△SO2+Br2+2H2O H2SO4(浓)+2HI△SO2+I2+2H2OH2SO4(稀)+Fe=FeSO4+H2↑2H2SO3+2H2S=3S↓+2H2O4HNO3(浓)+C△CO2↑+4NO2↑+2H2O* 6HNO3(浓)+S=H2SO4+6NO2↑+2H2O* 5HNO3(浓)+P=H3PO4+5NO2↑+H2O6HNO3+Fe=Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe=Fe(NO3)3+NO↑+2H2O30HNO3+8Fe=8Fe(NO3)3+3N2O↑+15H2O36HNO3+10Fe=10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe=8Fe(NO3)3+3NH4NO3+9H2O (2)、还原性H2SO3+X2+H2O=H2SO4+2HX (X表示Cl2、Br2、I2)2H2SO3+O2=2H2SO4H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl (3)、酸性H2SO4(浓) +CaF2=CaSO4+2HF↑H2SO4(浓)+NaCl△NaHSO4+HCl↑H2SO4(浓) +2NaCl Na2SO4+2HClH2SO4(浓)+NaNO3△NaHSO4+HNO3↑(微热)3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2=2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4=H3PO4+3AgNO32HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2) 等还原性气体)4H3PO4+Ca3(PO4)2=3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr=NaH2PO4+HBrH3PO4(浓)+NaI=NaH2PO4+HI(4)、不稳定性2HClO=2HCl+O2↑(见光或受热分解)4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)H2SO3=H2O+SO2H2CO3=H2O+CO2强热H4SiO4=H2SiO3+H2O七、碱(1)、低价态的还原性4Fe(OH)2+O2+2H2O=4Fe(OH)3(2)、与酸性物质的作用2NaOH+SO2(少量)=Na2SO3+H2ONaOH+SO2(足量)=NaHSO32NaOH+SiO2=Na2SiO3+H2O2NaOH+Al2O3=2NaAlO2+H2O2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2ONaOH+H2S(足量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=A l(O H)3↓+3NaClNaOH+Al(OH)3=NaAlO2+2H2ONaOH+NH4Cl△NaCl+NH3↑+H2OMg(OH)2+2NH4Cl=MgCl2+2NH3+H2OAl(OH)3+NH4Cl 不溶解(3)、不稳定性Mg(OH)2△MgO+H2O2Al(OH)3△Al2O3+3H2O2Fe(OH)3△Fe2O3+3H2OCu(OH)2△CuO+H2O八、盐(1)、氧化性2FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn=2FeCl2+ZnCl2Fe2(SO4)3+2Ag=FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2FeCl2+Mg=Fe+MgCl2(2)、还原性2FeCl2+Cl2=2FeCl33Na2S+8HNO3(稀)=6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O2Na2SO3+O2=2Na2SO4(3)、与碱性物质的作用MgCl2+2NH3·H2O=Mg(OH)2↓+NH4Cl AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl (4)、与酸性物质的作用Na3PO4+HCl=Na2HPO4+NaClNa2HPO4+HCl=NaH2PO4+NaClNaH2PO4+HCl=H3PO4+NaClNa2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl3Na2CO3+2FeCl3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O=2Al(OH)3↓+3H2S↑3NaAlO2+AlCl3+6H2O=4Al(OH)3↓(5)、不稳定性Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O NH4Cl=NH3+HClNH4HCO3=NH3+H2O+CO22KNO3=2KNO2+O22Cu(NO3)2△2CuO+4NO2↑+O2↑2KMnO4△K2MnO4+MnO2+O2↑2KClO3△2KCl+3O2↑2NaHCO3△Na2CO3+H2O+CO2↑Ca(HCO3)2△CaCO3+H2O+CO2↑CaCO3高温CaO+CO2↑MgCO3高温MgO+CO2↑九、其他方程式1、A lCl3 + 4NaOH = NaAlO2 + 3NaCl +2H2O2、Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑(碳化物氮化物的水解)3、3K2MnO4 + 2CO2= 2KMnO4 + MnO2↓+ 2K2CO34、AgNO3 + NaCl =AgCl↓ + NaNO32AgCl=2Ag + Cl2↑(见光或受热)5、2Br2 + 3Na2CO3 + H2O = 2NaHCO3+ 2NaBrO + 2NaBr + CO2↑Br2 + NaHCO3= NaBr + HBrO + CO2↑6、2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2 HClBaCl2 + H2SO4= BaSO4↓ + 2HCl7、Ca(H2PO4)2 + 2Ca(OH)2= Ca3(PO4)2↓ + 4H 2O8、4KO2 + 2CO2= 2K2CO3 + 3O29、SOCl2 + H2O = 2HCl + SO2↑10、HIO + HCl = ICl + H2OHIO + NaOH = NaIO + H2O11、NH2Cl + H2O = NH3 + HClO12、Cu2(OH)2CO3 + 4CH3COOH =2(CH3COO)2Cu + CO2↑+ 3H2O(CH3COO)2Cu + Fe = Cu + (CH3COO) 2Fe13、6NO + 4NH3催化剂△5N2 + 6H2O 14、3BrF3 + 5H2O = 9HF + HBrO3 + O2↑+ Br2 15、As2O3 + 6Zn + 12HCl = 2AsH3 ↑ + 6ZnCl2 + 3H2O16、3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO↑17、Na2SO3 + SO2 + H2O = 2NaHSO32NaHSO3△Na2SO3 + SO2↑ + H2O18、P2O5 + 2NaOH = 2NaPO3 + H2OP2O5 + 6NaOH = 2Na3PO3 + 3H2O19、3Na2S + As2S5= 2Na3AsS4Na2S + SnS2= Na2SnS320、(CN)2 + 2H2S →21、(SCN)2 + 2NaOH = NaSCN + NaSCNO + H2O 22、HCl + KOH = KCl + H2O2HI + PbO = PbI2 + H2O23、P4(固) + 5O2(气) = P4O10(固) + 4Q kJ24、S(固) + O2(气) = SO2(气) + 296 kJ25、2H2(气) + O2(气) = 2H2O(液) + 511.9 kJ26、C2H6O(液) + 3O2(气) = 2CO2 + 3H2O(液) + 2Q27、4Al(固) + 3O2(气) = 2Al2O3(固) + 3349.3 kJ28、3Fe2+ + NO3― + 4H+= 3Fe3+ + NO↑ + 2H2O29、2S2― + SO32― +6H+=3S↓ + 3H2O30、SiO32― + 2NH4+= H2SiO3↓ + 2NH331、3H2O2 + 2CrO2― + 2OH―= 2CrO42― + 4H2O 32、Al3+ + 2SO42― + 2Ba2+ + 4OH―=2BaSO4 ↓ + AlO2― + 2H2O33、Fe2O3 + 6H+ +2I―= 2Fe2+ + I2 + 3H2O34、Al3+ + 3HCO3―= Al(OH)3↓+ 3CO2↑35、2H+ + [Ag(NH3)2]+= Ag+ + 2NH4+36、HS― + OH―= S2― + H2O37、AsO43― + 2I― + 2H+= AsO33― + I2 + H2O38、Cr2O72― + 6Fe2+ + 14H+= 2Cr3+ + 6Fe3+ + 7H2O39、2I ― + Cl 2 = 2Cl ― + I 2I 2 + SO 2 + 2H 2O = SO 42― + 2I ― + 4H+SO 42― + Ba 2+ = BaSO 4↓ 40、2I ― + 2ClO ― + 4H + = I 2 + Cl 2↑ + 2H 2OI 2 + SO 32― + H 2O = SO 42― + 2H + + 2I―41、2Fe 2+ + 4Br ― + 3Cl 2 = 2Fe 3+ + 2Br 2 + 6Cl―42、2MnO 4― + 5H 2O 2 + 6H + = 2Mn 2+ + 8H 2O + 5O 2↑43、3S 2― + 16BrO 3― + 24OH ― =15SO 42― + 16Br ― + 12H 2O44、3Ca 2+ + 6H 2PO 4― + 12OH ― =Ca 3(PO 4)2↓ + 12H 2O + 4PO 43― 45、4H + + NO 3― + 3Fe 2+ = 3Fe 3+ + NO↑ + 2H 2OFe 3+ + SCN ― = [Fe(SCN)]2+ 46、2Na + 2H 2O = 2Na + + 2OH ― + H 2↑Fe 2+ + 2OH ― = Fe(OH)2↓ 4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3 47、S 2O 32― + 2H + = S↓ + SO 2 + H 2O 48、KAl(SO 4)2 == K + + Al 3+ + 2SO 42― 49、NaHSO 4 = Na + + HSO 4― 50、NH 4HS = NH 4+ + HS ―51、对KCl 溶液,阳极:2Cl - 2e = Cl 2↑阴极:2H + 2e = H 2↑ 对CuSO 4溶液,阳极:4OH - 4e = 2H 2O + O 2↑阴极:2Cu 2++ 4e = 2Cu 52、负极:2H 2 – 4e = 4H + 正极:O 2 + 2H 2O + 4e = 4OH ― 53、负极:2Zn – 4e = 2Zn 2+正极:O 2 + 2H 2O + 4e = 4OH ― 4OH ― + 4H + = H 2O54、负极:Zn – 2e = Zn 2+正极:Ag 2O + H 2O + 2e = 2Ag + 2OH ―2NaCl + 2H 2O电解2NaOH + H 2↑+ Cl 2↑2NO + O 2 = 2NO 22H 2O 22H 2O + O 2↑有机化学反应方程式:1、甲烷的主要化学性质(1)氧化反应 CH 4(g)+2O 2(g)−−→−点燃CO 2(g)+2H 2O(l)(2)取代反应2、乙烯的乙烯的主要化学性质(1)氧化反应:C 2H 4+3O 2 −−→−点燃2CO 2+2H 2O (2)加成反应乙烯还可以和氢气、氯化氢、水等发生加成反应。
