高中化学常用计算公式
高中化学常用计算公式

高中化学常用计算公式高中化学中常用的计算公式主要包括摩尔质量计算、溶解度计算、浓度计算、反应路线计算、酸碱滴定计算、氧化还原反应计算等等。
一、摩尔质量计算:1.摩尔质量(M)=相对分子质量(Mr)/摩尔量(n)2.摩尔量(n)=质量(m)/摩尔质量(M)例如:H2SO4的Mr为98 g/mol,如果有2 g的H2SO4,求其摩尔量。
解:摩尔量(n)=质量(m)/摩尔质量(M)=2 g/98 g/mol≈0.020 mo二、溶解度计算:1.溶解度(S)=溶质在溶剂中的质量(m)/溶剂的质量(M)例如:已知60g的氯化钠溶解于200g的水中,求氯化钠的溶解度。
解:溶解度(S)=溶质在溶剂中的质量(m)/溶剂的质量(M)=60g/(60g+200g)≈0.23三、浓度计算:1.质量浓度(C)=溶质的质量(m)/溶液的体积(V)例如:已知溶液中含有10g的氯化钠,溶液的体积为100mL,求氯化钠的质量浓度。
解:质量浓度(C)=溶质的质量(m)/溶液的体积(V)=10g/100mL=100g/L四、反应路线计算:1.反应物的量与生成物的量之间的关系可以根据化学方程式得到。
例如,对于A+B→C+D,如果已知A的量,则可以根据化学方程式计算出B 的量、C的量和D的量。
例如:已知反应1 mol的甲烷与氧气反应生成水和二氧化碳,求生成物水和二氧化碳的摩尔量。
解:根据化学方程式CH4 + 2O2 → CO2 + 2H2O,可知1 mol的甲烷生成1 mol的二氧化碳和2 mol的水。
五、酸碱滴定计算:1. 氢离子浓度(pH)= -log[H+],其中[H+]为氢离子的浓度。
2.酸碱滴定中可以根据已知溶液的体积和浓度,计算出另一种溶液的体积和浓度。
例如:已知0.1 mol/L的盐酸滴定到了100 mL的0.05 mol/L的碳酸钠溶液中,求中和点的体积和酸溶液的浓度。
解:根据盐酸和碳酸钠的化学方程式,Na2CO3 + 2HCl → 2NaCl + CO2 + H2O,可以推算出滴定的摩尔比例为1:2、根据摩尔比例和已知的碳酸钠溶液体积和浓度,可以计算出滴定的中和点体积为100 mL,酸溶液的浓度为0.2 mol/L。
高中化学常用计算公式

高中化学常用计算公式高中化学中常用的计算公式是在化学实验和计算中经常使用的数学公式,用于求解各种化学性质和反应等问题。
这些公式包括质量计算、摩尔计算以及浓度计算等。
一、质量计算公式1. 质量计算公式是在计算物质的质量时使用的公式。
质量计算公式的基本形式为:质量=密度×体积。
其中,密度是物质的质量和体积的比值。
例如,当我们想计算某物质的质量时,首先需要测量物质的体积,然后根据密度公式计算得出其质量。
这个公式在实验室中经常使用,用于确定所需物质的质量。
2. 溶液质量计算公式:溶液质量=溶质质量+溶剂质量。
这个公式用于计算溶液的质量,其中溶液的质量由溶质质量和溶剂质量组成。
二、摩尔计算公式摩尔计算是高中化学中最常用的计算方法之一。
摩尔计算是以摩尔为单位进行计算的方法,用于计算物质的摩尔质量、摩尔浓度以及反应中物质的摩尔比等。
1. 摩尔质量计算公式:摩尔质量=质量/摩尔数。
这个公式用于计算物质的摩尔质量,其中质量是物质的质量,摩尔数是物质的摩尔数。
摩尔质量是物质相对分子质量或相对原子质量的摩尔比。
例如,当我们想计算某个物质的摩尔质量时,首先需要知道该物质的质量和摩尔数,然后根据公式计算得出摩尔质量。
摩尔质量在计算化学反应中经常用到。
2. 摩尔浓度计算公式:摩尔浓度=摩尔数/体积。
这个公式用于计算溶液的摩尔浓度,其中摩尔数是溶质的摩尔数,体积是溶液的体积。
例如,当我们想计算某溶液的摩尔浓度时,首先需要知道溶质的摩尔数和溶液的体积,然后根据公式计算得出摩尔浓度。
摩尔浓度在溶液的配制和化学反应的计算中经常使用。
三、浓度计算公式1. 质量浓度计算公式:质量浓度=溶质质量/溶液体积。
这个公式用于计算溶液的质量浓度,其中溶质质量是溶质的质量,溶液体积是溶液的体积。
例如,当我们想计算某溶液的质量浓度时,首先需要知道溶质的质量和溶液的体积,然后根据公式计算得出质量浓度。
质量浓度在化学实验和溶液的配制中经常使用。
高中化学常用公式

高中化学常用公式1. 有关物质的量(mol )的计算公式 (1)物质的量(mol )()=物质的质量物质的摩尔质量()g g mol / 即n=MmM 数值上等于该物质的相对分子(或原子)质量(2)物质的量(mol )=)(个微粒数(个)mol /1002.623⨯ 即n=A N NN A 为常数6.02×1023,应谨记(3)气体物质的量(mol )=标准状况下气体的体积().(/)L L mol 224 即n=mgV V 标,V m 为常数22.4L 〃mol -1,应谨记(4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )即n B =C B V aq(5)物质的量(mol )=)反应热的绝对值()量(反应中放出或吸收的热mol KJ KJ / 即n=HQ∆2. 有关溶液的计算公式(1)基本公式①溶液密度(g/mL )=溶液质量溶液体积()()g mL 即ρ =aqV m 液②溶质的质量分数=%100) g g ⨯+溶剂质量)((溶质质量)溶质质量(=))g g 溶液质量(溶质质量(×100% 即w=100%⨯液质m m =剂质质m m m +×100%③物质的量浓度(mol/L )=溶质物质的量溶液体积()()mol L 即C B=aqBV n(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系: ①溶质的质量分数100%(g/m L)1000(m L)(g/m ol)1(L)(m ol/L)⨯⨯⨯⨯=溶液密度溶质的摩尔质量物质的量浓度②物质的量浓度=⨯⨯⨯1000(mL)(g /mL)(g /mol)1(L)溶液密度溶质的质量分数溶质摩尔质量即C B =BM ρω1000 ρ单位:g/ml(3)溶液的稀释与浓缩(各种物理量的单位必须一致):原则:稀释或浓缩前后溶质的质量或物质的量不变!①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数 即浓m 稀稀浓ωωm =②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度 即c (浓)〃V (浓)=c (稀)〃V (稀)(4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)(5)物料守恒:电解质溶液中,由于某些离子能够水解,离子种类增多,但某些关键性的原子总是守恒的。
(完整word)高中化学常用计算公式

1. 有关物质的量(mol )的计算公式 (1)物质的量(mol )()=物质的质量物质的摩尔质量()g g mol / 即n=Mm;M 数值上等于该物质的相对分子(或原子)质量 (2)物质的量(mol )=)(个微粒数(个)mol /1002.623⨯ 即n=AN NN A 为常数6.02×1023,应谨记 (3)气体物质的量(mol )=标准状况下气体的体积().(/)L L mol 224 即n=mgV V 标, V m 为常数22.4L ·mol -1,应谨记 (4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )即n B =C B V aq (5)物质的量(mol )=)反应热的绝对值()量(反应中放出或吸收的热mol KJ KJ / 即n=HQ∆2. 有关溶液的计算公式(1)基本公式 ①溶液密度(g/mL )=溶液质量溶液体积()()g mL 即ρ =aqV m 液②溶质的质量分数=%100) g g ⨯+溶剂质量)((溶质质量)溶质质量(=))g g 溶液质量(溶质质量(×100%即w=100%⨯液质m m =剂质质m m m +×100% ③物质的量浓度(mol/L )=溶质物质的量溶液体积()()mol L 即C B=aqBV n(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:①溶质的质量分数100%(g/mL)1000(mL)(g/mol)1(L)(mol/L)⨯⨯⨯⨯=溶液密度溶质的摩尔质量物质的量浓度②物质的量浓度=⨯⨯⨯1000(mL)(g /mL)(g /mol)1(L)溶液密度溶质的质量分数溶质摩尔质量 即C B =BM ρω1000 ρ单位:g/ml(3)溶液的稀释与浓缩(各种物理量的单位必须一致): 原则:稀释或浓缩前后溶质的质量或物质的量不变!①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数 即浓m 稀稀浓ωωm =②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度 即c (浓)·V (浓)=c (稀)·V (稀)(4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性) (5)物料守恒:电解质溶液中,由于某些离子能够水解,离子种类增多,但某些关键性的原子总是守恒的。
关于高中化学常用计算公式有哪些

关于高中化学常用计算公式有哪些在每年的化学考试中,计算题的分值大约占15%,但高中化学计算题的得分率却不高,高中化学计算类型比较多,其中有些计算经常考查,如能用好方法,掌握技巧,就一定能节约时间,提高计算的正确率。
下面小编为大家带来高中化学常用计算公式有哪些,希望对您有所帮助!高中化学常用计算公式有哪些1. 有关物质的量(mol)的计算公式⑴ 物质的量(n)质量(m)摩尔质量(M)和物质所含微粒数(N)之间的换算关系物质的量(mol)=物质的质量(g)÷物质的摩尔质量(g/mol)n=m÷M或M=m÷n或m=n×M⑵ 物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间有换算关系物质的量(mol)=微粒数(个)÷6.02×10∧23(个/mol)n=N÷NA或N=n×NA或NA=N÷n⑶ 在标准状况下,气体的物质的量(n)、气体体积(V)、气体摩尔体积(Vm)的换算关系气体物质的量(mol)=标准状况下气体的体积(L)÷22.4(L/mol)n=V÷22.4或V=n×22.4⑷ 物质的量浓度C(B),溶质的物质的量n(B),与溶液体积(V)的换算关系:溶质的物质的量(mol)=物质的量浓度(mol/L)×溶液体积(L)n(B)=C(B)×V或C(B)=n(B)÷V或V=n(B)÷C(B)⒉ 标准状况下气体的密度ρ(g/L)=气体的摩尔质量(g/mol)÷气体摩尔体积(L/mol)=M/22.4mmol/Lρ(g/L)=M÷22.4mmol/L标准状况下气体的摩尔质量M=22.4ρmol/L⒊ 平均摩尔质量或平均式量的计算公式⑴ 已知混合物的总质量m(混)和总物质的量n(混):M=m(混)÷n(混)说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。
高中化学常用计算公式

高中化学常用计算公式1.有关物质的量(mol)的计算公式(1)物质的量(mol)=(g)(g/mol)物质的质量物质的摩尔质量(2)物质的量(mol)=()(/mol)⨯23微粒数个6.0210个(3)气体物质的量(mol)=(L)22.4(L/mol)标准状况下气体的体积(4)溶质的物质的量(mol)=物质的量浓度(mol/L)×溶液体积(L)2.有关溶液的计算公式(1)基本公式①溶液密度(g/mL)=(g)(mL)溶液质量溶液体积②溶质的质量分数=(g)100% ()(g)⨯+溶质质量溶质质量溶剂质量③物质的量浓度(mol/L)=(mol)(L)溶质物质的量溶液体积(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:①溶质的质量分数=(mol/L)1L (g /mol)(mL)(g /mL)⨯⨯⨯物质的量浓度溶质的摩尔质量1000溶液密度②物质的量浓度=mL (g /mL)(g /mol)1L ⨯⨯⨯1000溶液密度溶质的质量分数溶质摩尔质量3.平均摩尔质量或平均式量的计算公式(1)已知混合物的总质量m (混)和总物质的量n (混):m()n()M =混混 说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。
(2)已知标准状况下,混合气体的密度ρ(混):22.4()M ρ=g 混 注意:该方法只适用于处于标准状况下(0℃,1.01×105Pa )的混合气体。
4.化学平衡计算公式对于可逆反应:mA(g)nB(g)pC(g)qD(g)++ƒ(1)各物质的变化量之比=方程式中相应系数比(2)反应物的平衡量=起始量-消耗量生成物的平衡量=起始量+增加量表示为(设反应正向进行):mA(g)nB(g)pC(g)qD(g)(mol) a b c dnxpxqx(mol) x() () () ()m m m nxpx(mol) a-x b- c+ d m m ++ƒ起始量变化量耗耗增增平衡量qx+m(3)阿伏加德罗定律及阿伏加德罗定律的三个重要推论。
高中化学常用公式

高中化学常用公式1.化学反应速率公式化学反应速率是指在一定时间内反应物质消失或生成的数量。
反应速率公式可以用来描述反应物质浓度与时间之间的关系,其中最常见的反应速率公式是:v=ΔC/Δt或v=-Δ[A]/Δt=-Δ[B]/Δt其中v表示反应速率,ΔC表示反应物质的浓度变化,Δt表示时间的变化。
这个公式表示了当反应物质浓度变化时,反应速率的变化情况。
2.酸碱中和反应公式酸碱中和反应是指酸和碱反应生成盐和水的化学过程。
酸碱反应的常见公式包括:酸+碱→盐+水例如:HCl+NaOH→NaCl+H2O其中HCl是酸,NaOH是碱,NaCl是盐,H2O是水。
3.氧化还原反应公式氧化还原反应是指物质的氧化态和还原态之间的转化过程。
氧化还原反应的常见公式是:氧化剂+还原剂→氧化物+还原物例如:2Fe2O3+3C→4Fe+3CO2其中Fe2O3是氧化剂,C是还原剂,Fe是还原物,CO2是氧化物。
4.摩尔浓度计算公式摩尔浓度是指溶液中溶质的摩尔数与溶液体积之比,常用的摩尔浓度计算公式是:C=n/V其中C是摩尔浓度,n是溶质的摩尔数,V是溶液的体积。
5.溶液配制公式溶液配制是指调配指定体积的浓度溶液。
常见的溶液配制公式有:C1V1=C2V2其中C1和V1表示初始溶液的浓度和体积,C2和V2表示目标溶液的浓度和体积。
这个公式用来计算从初始溶液中取出一定体积配制为目标浓度的溶液所需的初始溶液体积。
6.燃烧热计算公式燃烧热是指物质燃烧过程中释放的热量。
在化学实验中,可以通过测量温度的变化来计算燃烧热。
常见的燃烧热计算公式是:ΔH=m×c×ΔT其中ΔH表示燃烧热,m表示物质的质量,c表示物质的比热容,ΔT 表示温度的变化。
以上是高中化学中常用的一些公式,掌握这些公式可以帮助我们更好地理解化学知识,解决化学问题。
在学习时,可以通过做题、实验和课堂讨论等方式加深对这些公式的理解。
高中化学常用计算公式

1. 有关物质的量(mol)的计算公式(1)物质的量(mol)g物质的质量物质的摩尔质量()g / mol即n=mM;M数值上等于该物质的相对分子(或原子)质量(2)物质的量(mol)=微粒数(个)23 即n=6.02 10 (个/ mol)N NNAA为常数6.02 ×1023,应谨记23,应谨记(3)气体物质的量(mol)标准状况下气体的体积( )L22.4( L / mol )V标,即n=Vmg -1V m为常数22.4L〃mol,应谨记(4)溶质的物质的量(mol)=物质的量浓度(mol/L )×溶液体积(L)即n B=C B V aq反应中放出或吸收的热反应热的绝对值((5)物质的量(mol)= KJ量(KJ/ mol))即n=QH2. 有关溶液的计算公式(1)基本公式①溶液密度(g/mL)溶液质量溶液体积(g)( m L)即=m液Vaq溶质质量(g)②溶质的质量分数= 100%(溶质质量溶剂质量)(g) =溶质质量(溶液质量(gg))×100%m质即w= 100%m液=m质m质m剂×100% ③物质的量浓度(mol/L)溶质物质的量溶液体积(mol )(L)即C B=n BVaq(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:物质的量浓度(g/m o l)(mol/L) 1(L)溶质的摩尔质量①溶质的质量分数100%1000(m L) 溶液密度(g/mL)②物质的量浓度1000(mL) (g / mL)溶液密度溶质的质量分数溶质摩尔质量(g / mol) 1(L)即C B=1000MBρ单位:g/ml(3)溶液的稀释与浓缩(各种物理量的单位必须一致):原则:稀释或浓缩前后溶质的质量或物质的量不变!①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数即m浓浓m 稀稀②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度即c(浓)〃V(浓)=c(稀)〃V(稀)(4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)(5)物料守恒:电解质溶液中,由于某些离子能够水解,离子种类增多,但某些关键性的原子总是守恒的。
高中化学常用计算公式汇总

高中化学常用计算公式汇总高中化学常用计算公式汇总:在高中化学学习过程中,计算是不可避免的一部分。
掌握一些常用的计算公式能够帮助我们更好地理解化学知识,解决化学问题。
下面将为大家总结一些高中化学中常用的计算公式。
1. 摩尔浓度计算公式:摩尔浓度(C)= 物质的物质量(m)/ 物质的摩尔质量(M)例如,NaCl溶液中NaCl的摩尔浓度为0.1mol/L,求其质量分数。
NaCl的摩尔质量为58.5,所以NaCl的质量分数为0.1*58.5=5.85%2. 反应物质量计算公式:根据平衡化学方程式计算反应物质量的问题通常使用此公式。
已知A+2B→C+3D,所需的反应物质量,A的质量50g,求B的质量。
根据平衡方程式,A=2B,所以B的质量为25g。
3. 溶液稀释公式:浓度1×体积1=浓度2×体积2例如,已知硫酸溶液的浓度为2mol/L,所需制备500mL浓度为0.5mol/L的溶液,求稀释的体积和浓度。
代入公式,2×V = 0.5×500,解得V=125mL,所以需要添加125mL 的水到硫酸溶液中。
4. 气体摩尔体积计算公式:气体摩尔体积(V)= 气体的物质量(m)×标准摩尔体积例如,已知一气体的质量为0.02g,求其摩尔体积。
该气体为氢气,标准摩尔体积为22.4L/mol,代入公式得V=0.02/2=0.01L。
5. 气体状态方程计算公式:PV=nRT其中,P为压强,V为体积,n为摩尔数,R为气体常数,T为温度(开尔文)。
根据这个方程式可以解决气体在不同条件下的性质和相关问题。
通过掌握以上几种常用的化学计算公式,我们可以更加高效地完成化学问题的求解和实验操作。
化学计算是化学学习中重要的一环,希最大家能够认真学习和掌握这些计算公式,提高化学学习的效率和成绩。
愿大家在化学学习的道路上不断进步,取得优异的成绩。
高中化学常用计算公式(114)

(2)主族元素的最高价=主族序数=主族元素的最外层电子数。
9、烃的分子式的确定方法 (1)先求烃的最简式和相对分子质量,再依(最简式相对分子质量)n=相
对分子质量,求得分子式。 (2)商余法: 烃的相对分子质量 → 商为 C 原子数,余数为 H 原子数。
12
注意:一个 C 原子的质量=12 个 H 原子的质量
(4)溶质的物质的量(mol)=物质的量浓度(mol/L)×溶液体积(L)
2、有关溶液的计算公式
(1)基本公式
①溶液密度(g/mL) = 溶液质量(g)
溶液体积(mL)
②溶质的质量分数 =
溶质质量 ( g )
× 100%
(溶质质量 + 溶剂质量)(g)
③物质的量浓度(mol/L) = 溶质物质的量(mol)
溶液体积( L)
(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数 = 物质的量浓度(mol / L) × 1(L) × 溶质的摩尔质量(g / mol) × 100%
1000(mL) × 溶液密度(g / mL)
②物质的量浓度 = 1000(mL) × 溶液密度(g / mL) × 溶质的质量分数
溶质摩尔质量(g / mol) × 1(L)
(3)溶液的稀释与浓缩(各种物理量的单位必须一致):
①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的
质量分数(即溶质的质量不变) ②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量
浓度[即 c(浓)·V(浓)=c(稀)·V(稀)] (4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负
高中化学常用计算公式
1、有关物质的量(mol)的计算公式
高中化学必用公式

高中化学必用公式在高中化学学习中,掌握各种重要的化学公式是至关重要的。
这些公式涵盖了化学反应、物质质量与量的关系、物质的结构与性质等多个方面。
下面将列举一些高中化学中必须掌握的公式,以便同学们在学习和实验中能够准确应用。
**1. 摩尔浓度公式**摩尔浓度(M)是溶液中溶质的摩尔数和溶液的体积的比值。
其计算公式为:$$ M = \frac{n}{V} $$其中,n为溶质的物质的量(单位为摩尔),V为溶液的体积(单位为升)。
摩尔浓度是描述溶液浓度的重要参数,通常用来计算反应物的用量以及实验操作中的稀释问题。
**2. 摩尔质量公式**物质的相对分子质量(Mr)是该物质相对于碳-12的原子质量的多少倍。
其计算公式为:$$ Mr = m/n $$其中,m为该物质的质量(单位为克),n为该物质的物质的量(单位为摩尔)。
摩尔质量通常用来计算反应过程中的物质质量变化以及计算化学实验中的反应物质用量。
**3. 摩尔气体体积公式**理想气体状态方程描述了气体在不同条件下的状态之间的关系。
在标准状况下,1摩尔气体的体积为22.4升。
根据理想气体状态方程,摩尔气体的体积(V)与气体的摩尔数(n)之间满足以下公式:$$ V = n \times 22.4 $$这个公式在计算气体的体积、温度和压强之间的关系时非常有用。
**4. 离子平衡常数公式**在化学平衡反应中,离子平衡常数(K)描述了反应物和生成物之间的浓度关系。
对于一般的反应:$$ aA + bB \rightleftharpoons cC + dD $$其离子平衡常数的计算公式为:$$ K = \left( \frac{[C]^c \times [D]^d}{[A]^a \times [B]^b} \right)$$其中,[A]、[B]、[C]、[D]分别表示反应物A、B和生成物C、D的摩尔浓度。
离子平衡常数公式帮助我们了解反应的方向和平衡位置。
**5. 溶解度积公式**溶解度积(Ksp)描述了固体物质在水中的溶解程度。
高中化学计算公式
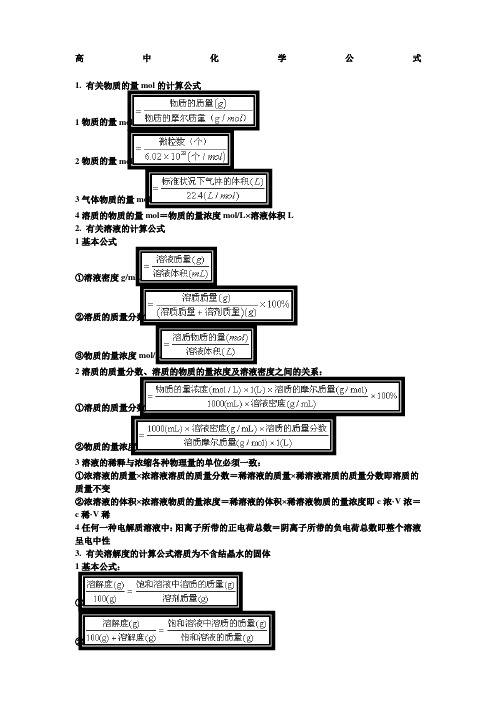
高中化学公式1. 有关物质的量mol的计算公式1物质的量mol2物质的量mol3气体物质的量mol4溶质的物质的量mol=物质的量浓度mol/L×溶液体积L2. 有关溶液的计算公式1基本公式①溶液密度g/mL②溶质的质量分数③物质的量浓度mol/L2溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:①溶质的质量分数②物质的量浓度3溶液的稀释与浓缩各种物理量的单位必须一致:①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数即溶质的质量不变②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度即c浓·V浓=c稀·V稀4任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数即整个溶液呈电中性3. 有关溶解度的计算公式溶质为不含结晶水的固体1基本公式:①②2相同温度下,溶解度S与饱和溶液中溶质的质量分数w%的关系:3温度不变,蒸发饱和溶液中的溶剂水,析出晶体的质量m的计算:4降低热饱和溶液的温度,析出晶体的质量m的计算:4. 平均摩尔质量或平均式量的计算公式1已知混合物的总质量m混和总物质的量n混:说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用; 2已知标准状况下,混合气体的密度混:混注意:该方法只适用于处于标准状况下0℃,的混合气体;3已知同温、同压下,混合气体的密度与另一气体A的密度之比D通常称作相对密度:则5. 化学反应速率的计算公式1某物质X的化学反应速率:2对于下列反应:有或6.对于可逆反应:1各物质的变化量之比=方程式中相应系数比2反应物的平衡量=起始量-消耗量生成物的平衡量=起始量+增加量表示为设反应正向进行:起始量mol a b c d变化量mol x耗耗增增平衡量mol3反应达平衡时,反应物A或B的平衡转化率%说明:计算式中反应物各个量的单位可以是mol/L、mol,对于气体来说还可以是L或mL,但必须注意保持分子、分母中单位的一致性;4阿伏加德罗定律及阿伏加德罗定律的三个重要推论;①恒温、恒容时:,即任何时刻反应混合气体的总压强与其总物质的量成正比;②恒温、恒压时:,即任何时刻反应混合气体的总体积与其总物质的量成正比;③恒温、恒容时:,即任何时刻反应混合气体的密度与其反应混合气体的平均相对分子质量成正比;5混合气体的密度6混合气体的平均相对分子质量的计算;①其中MA、MB……分别是气体A、B……的相对分子质量;a%、b%……分别是气体A、B……的体积或摩尔分数;②7. 溶液的pH值计算公式1若,则若,则2任何水溶液中,由水电离产生的与总是相等的,即:3常温25℃时:4n元强酸溶液中;n元强碱溶液中8. 有关物质结构,元素周期律的计算公式8.1 原子核电荷数、核内质子数及核外电子数的关系核电荷数=核内质子数=原子核外电子数注意:阴离子:核外电子数=质子数+所带的电荷数阳离子:核外电子数=质子数-所带的电荷数8.2 质量数A、质子数Z、中子数N的关系8.3 元素化合价与元素在周期表中的位置关系1对于非金属元素:最高正价+|最低负价|=8对于氢元素,负价为-1,正价为+1;2主族元素的最高价=主族序数=主族元素的最外层电子数;9. 烃的分子式的确定方法1先求烃的最简式和相对分子质量,再依最简式相对分子质量n=相对分子质量,求得分子式;2商余法:商为C原子数,余数为H原子数;注意:一个C原子的质量=12个H原子的质量10. 依含氧衍生物的相对分子质量求算其分子式的方法,所得的商为x,余数为y;注意:1个原子团的式量=1个O原子的相对原子质量=16。
高中化学公式大全

高中化学常用公式总结1. 有关物质的量(mol )的计算公式 (1)物质的量(mol )()=物质的质量物质的摩尔质量()g g mol /(2)物质的量(mol )()=⨯微粒数(个)个6021023./mol(3)气体物质的量(mol )=标准状况下气体的体积().(/)L L mol 224(4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )2. 有关溶液的计算公式 (1)基本公式 ①溶液密度(g/mL )=溶液质量溶液体积()()g mL②溶质的质量分数()=⨯+溶质质量溶质质量溶剂质量(g g )()100%③物质的量浓度(mol/L )=溶质物质的量溶液体积()()mol L(2)溶质的质量分数、溶质的物质的量浓度与溶液密度之间的关系: ①溶质的质量分数=⨯⨯⨯⨯物质的量浓度溶质的摩尔质量溶液密度(mol /L)1(L)(g /mol)1000(mL)(g /mL)100%②物质的量浓度=⨯⨯⨯1000(mL)(g /mL)(g /mol)1(L)溶液密度溶质的质量分数溶质摩尔质量(3)溶液的稀释与浓缩(各种物理量的单位必须一致):①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不变)②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c (浓)·V (浓)=c (稀)·V (稀)](4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)3. 有关溶解度的计算公式(溶质为不含结晶水的固体) (1)基本公式: ①溶解度饱和溶液中溶质的质量溶剂质量(g)100(g)(g)(g)=②溶解度溶解度饱和溶液中溶质的质量饱和溶液的质量(g)100(g)(g)(g)(g)+=(2)相同温度下,溶解度(S )与饱和溶液中溶质的质量分数(w%)的关系:S g w g w g g ()()()()()=-⨯100100w S g S g %()()()=+⨯100100%(3)温度不变,蒸发饱和溶液中的溶剂(水),析出晶体的质量m 的计算:m g g g =⨯溶解度蒸发溶剂(水)的质量()()()100(4)降低热饱和溶液的温度,析出晶体的质量m 的计算:()()m g g =+⨯-高温溶解度低温溶解度高温溶解度高温原溶液质量100()()4. 平均摩尔质量或平均式量的计算公式(1)已知混合物的总质量m (混)和总物质的量n (混):M m n =()()混混 说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。
高中化学必备公式大全

高中化学必备公式大全一、阿伏加德罗定律1、阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同的数目的粒子。
2、阿伏加德罗常数:1mol任何粒子的粒子数叫阿伏加德罗常数,N A =6.02×10 23个/mol,不过也要记住:1mol任何粒子的粒子数叫阿伏加德罗常数。
3、适用条件:一定温度和压强下。
二、物质的量计算公式1、物质的量计算公式:n = N / N A = m / M = V / V m = c × V2、物质的量基本单位——摩尔(mol)3、物质的量是国际单位制中七个基本物理量之一。
三、气体摩尔体积、气体体积计算公式1、气体摩尔体积计算公式:V m = 22.4L/mol2、在标准状况下,任何气体的摩尔体积都是22.4L/mol。
3、在标准状况下,任何气体的体积都是22.4L/mol。
4、非标准状况下,气体摩尔体积的数值可以不是22.4L/mol。
5、气体体积 =气体质量×气体摩尔体积。
6、气体摩尔质量=气体摩尔体积×物质质量。
7、物质质量=物质粒子数目×每个粒子质量。
8、原子间结合方式:共价键、离子键、金属键等。
9、原子间相互作用力:静电力、分子间作用力。
中考必备:中考数学公式大全一、什么是数学公式?数学公式是解决数学问题的关键工具。
它是数学概念、定理和定律的组合,可以帮助我们更好地理解和解决各种数学问题。
掌握数学公式不仅有助于提高数学成绩,还能增强我们的逻辑思维和解决问题的能力。
二、中考数学公式的重要性中考数学是学生们普遍的重要科目。
在中考数学中,数学公式的作用不可忽视。
准确理解和应用数学公式,能够使问题解决过程更加简洁、准确,有效提高解题速度。
因此,对于即将参加中考的学生们来说,掌握数学公式是必备的技能。
三、中考数学公式大全以下是一些重要的中考数学公式,供大家参考:1、平方差公式:(a+b)(a-b)=a²-b²2、完全平方公式:a²±2ab+b²=(a±b)²3、立方和(差)公式:a³±b³= (a±b)(a²±ab+b²)4、幂的乘方: (a^m)^n = a^(mn)5、积的乘方: (ab)^n = a^n b^n6、同底数幂的乘法:a^m a^n = a^(m+n) (m,n都是正数)7、同底数幂的除法:a^m/a^n = a^(m-n) (a ≠ 0, m,n都是正整数,且 m大于 n)8、平方差公式:a²-b²=(a+b)(a-b)9、完全平方公式:a²±2ab+b²=(a±b)²10、立方和(差)公式:a³±b³= (a±b)(a²±ab+b²)11、圆的周长公式:C=2πr12、圆的面积公式:S=πr²13、扇形面积公式:S扇形=πr²/360°×n°14、弧长公式:L=πr/180°×n°15、圆柱体积公式:V=πr²h16、圆锥体积公式:V=1/3πr²h四、如何记忆和应用数学公式?记忆和应用数学公式需要一定的技巧和方法。
高中化学常用计算公式

1. 有关物质的量(mol )的计算公式(1)物质的量(mol 即n=Mm;M 数值上等于该物质的相对分子(或原子)质量 (2)物质的量(mol )=)(个微粒数(个)mol /1002.623⨯ 即n=AN NN A 为常数6.02×1023,应谨记(3)气体物质的量(mol 即n=mgV V 标, V m 为常数22.4L ·mol -1,应谨记 (4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )即n B =C B V aq (5)物质的量(mol )=)反应热的绝对值()量(反应中放出或吸收的热mol KJ KJ / 即n=HQ∆2. 有关溶液的计算公式(1)基本公式 ①溶液密度(g/mL 即ρ =aqV m 液②溶质的质量分数=%100) g g ⨯+溶剂质量)((溶质质量)溶质质量(=))g g 溶液质量(溶质质量(×100%即w=100%⨯液质m m =剂质质m m m +×100% ③物质的量浓度(mol/L 即C B=aqBV n(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:①溶质的质量分数100%(g/mL)1000(mL)(g/mol)1(L)(mol/L)⨯⨯⨯⨯=溶液密度溶质的摩尔质量物质的量浓度即C B =BM ρω1000 ρ单位:g/ml(3)溶液的稀释与浓缩(各种物理量的单位必须一致): 原则:稀释或浓缩前后溶质的质量或物质的量不变!①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数 即浓m 稀稀浓ωωm =②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度 即c (浓)·V (浓)=c (稀)·V (稀)(4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性) (5)物料守恒:电解质溶液中,由于某些离子能够水解,离子种类增多,但某些关键性的原子总是守恒的。
高中化学常用计算公式大全

高中化学常用计算公式大全在高中化学学习中,常常会涉及到各种计算问题。
掌握化学计算公式是非常重要的,它可以帮助我们更好地理解化学理论知识,解决化学实验中的问题,提高化学学习效率。
下面就为大家整理了一些高中化学常用计算公式大全,希望对大家的学习有所帮助。
1. 摩尔浓度计算公式:$$ C = n/V $$其中,C表示摩尔浓度,单位为mol/L;n表示物质的量,单位为mol;V表示溶液的体积,单位为L。
2. 溶质的质量分数计算公式:$$ w = m_{\text{溶质}} / m_{\text{溶液}} \times 100\% $$其中,w表示质量分数,单位为%;m_{\text{溶质}}表示溶质的质量,单位为g;m_{\text{溶液}}表示溶液的质量,单位为g。
3. 摩尔质量计算公式:$$ M = m / n$$其中,M表示摩尔质量,单位为g/mol;m表示物质的质量,单位为g;n表示物质的量,单位为mol。
4. 摩尔体积计算公式:$$ V_m = V / n $$其中,V_m表示摩尔体积,单位为L/mol;V表示气体的体积,单位为L;n表示气体的物质的量,单位为mol。
5. 气体在STP条件下的摩尔体积计算公式:$$ V_{m,\text{STP}} = 22.4\,\text{L/mol} $$在标准温度(0°C)和标准压力(1 atm)下,气体的摩尔体积为22.4L/mol。
6. 气体的比容计算公式:$$ \beta = 1/V_m$$其中,β表示气体的比容,单位为mol/L;V_m表示气体的摩尔体积,单位为L/mol。
7. 气体的密度计算公式:$$ d = PM / RT$$其中,d表示气体的密度,单位为g/L;P表示气体的压强,单位为atm;M表示气体的摩尔质量,单位为g/mol;R表示气体常数,单位为atm·L/(mol·K);T表示气体的温度,单位为K。
高中化学公式

高中化学公式
高中化学常用的公式包括:
1. 摩尔质量公式:M = m/n
其中,M表示物质的摩尔质量,m表示质量,n表示物质的摩尔数。
2. 摩尔浓度公式:c = n/V
其中,c表示摩尔浓度,n表示物质的摩尔数,V表示溶液的体积。
3. 物质的量公式:n = m/M
其中,n表示物质的摩尔数,m表示质量,M表示物质的摩尔质量。
4. 摩尔比公式:aA + bB → cC + dD
其中,a、b、c、d分别表示反应物和产物的摩尔系数。
5. 摩尔利用率公式:运用摩尔比公式计算得到的摩尔量比
值与理论摩尔比值之间的比值。
6. 理想气体状态方程:PV = nRT
其中,P表示物质的压强,V表示物质的体积,n表示物质的摩尔数,R为气体常数,T表示物质的温度。
7. 化学反应速率公式:r = k[A]^m[B]^n
其中,r表示反应速率,k表示速率常数,[A]、[B]表示
反应物的浓度,m、n表示反应物的反应级数。
8. 相对原子质量计算公式:Ar = (m/M) × 12g/mol
其中,Ar表示元素的相对原子质量,m表示元素的质量,M表示元素的摩尔质量。
这些公式是高中化学学习中常用的公式,可以帮助我们计
算化学问题中的各种数量关系和化学反应速率等相关问题。
高中化学计算公式大全

高中化学计算公式大全高中化学计算是化学学科中最基础和最重要的部分之一,其中最重要的就是化学计算公式。
以下是高中化学计算公式大全:一、化学计量法1. 摩尔分数计算公式:X(A) = n(A) / n(All)2. 化学反应物质的摩尔质量计算公式:M = m / n3. 化学反应物质之间的摩尔量比计算公式:a / b = n(A) / n(B)4. 化学反应物质之间的物质量比计算公式:a / b = M(A) / M(B)5. 化学反应之后的生成物质的摩尔量和分数计算公式:n = V x c;X(A) = n(A) / n(All)二、气体化学计算公式1. 摩尔气体定律计算公式:PV = nRT2. 摩尔质量计算公式:M = mRT / PV3. 气体密度计算公式:d = PM / RT4. 气体混合比计算公式:P(A) = n(A)RT / V5. 部分压力计算公式:P(A) = X(A)P(All)三、化学平衡计算公式1. 反应的平衡常数计算公式:Kc = [C]^c [D]^d / [A]^a [B]^b2. 平衡常数与热力学平衡常数的关系:ΔG = -RT ln K3. 平衡浓度计算公式:C(A) = n(A) / V4. 平衡浓度和摩尔分数的关系:X(A) = C(A) / (C(A) + C(B))5. 配位化学稳定常数计算公式:Kf = [MLn] / [M][L]^n四、酸碱计算公式1. 酸碱中和反应计算公式:n(A)M(A)V(A) = n(B)M(B)V(B)2. 强酸和强碱的溶液浓度计算公式:pH = -log[H+];pOH = -log[OH-]3. 标准溶液浓度计算公式:C = n / V4. 酸碱反应h反应热计算公式:ΔH = mCΔT五、电化学计算公式1. 电积分计算公式:Q = It2. 离子电极位移计算公式:E = E° + RT / nF ln (oxi / red)3. 某种离子在电解质溶液中的活度计算公式:a± = γ±[±] / γ±°[±]4. 阴极与阳极反应的计算公式:ΔG = -nFE5. 摩尔电导率计算公式:Λm = k / c以上就是高中化学计算公式大全,通过巩固和掌握这些公式,可以有效提高化学计算的能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学常用计算公式
1.有关物质的量(mol )的计算公式
(1)物质的量(mol )=(g)
(g /mol)物质的质量物质的摩尔质量
(2)物质的量(mol )=
()
(/mol)
23微粒数个6.0210个(3)气体物质的量(mol )=(L)22.4(L /mol)
标准状况下气体的体积
(4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )
2.有关溶液的计算公式
(1)基本公式
①溶液密度(g/mL )=(g)
(mL)
溶液质量溶液体积②溶质的质量分数=(g)
100%
()(g)溶质质量溶质质量溶剂质量③物质的量浓度(mol/L )=(mol)
(L)
溶质物质的量溶液体积(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数=(mol/L)
1L (g /mol)(mL)(g /mL)
物质的量浓度溶质的摩尔质量1000溶液密度②物质的量浓度=mL (g /mL)(g /mol)
1L 1000溶液密度溶质的质量分数
溶质摩尔质量3.平均摩尔质量或平均式量的计算公式
(1)已知混合物的总质量m (混)和总物质的量n (混):m()
n()M
混混说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。
(2)已知标准状况下,混合气体的密度ρ(混):22.4()
M 混
注意:该方法只适用于处于标准状况下(0℃,×105
Pa )的混合气体。
4.化学平衡计算公式
对于可逆反应:mA(g)nB(g)pC(g)qD(g)
(1)各物质的变化量之比=方程式中相应系数比
(2)反应物的平衡量=起始量-消耗量
生成物的平衡量=起始量+增加量
表示为(设反应正向进行):
mA(g)nB(g)pC(g)qD(g)
(mol) a b c d
nx
px
qx
(mol) x() () () ()
m m m nx
px
(mol) a-x b- c+ d m m 起始量变化量耗耗增增平衡量qx
+m
(3)阿伏加德罗定律及阿伏加德罗定律的三个重要推论。
①恒温、恒容时:1
12
2p n p n ,即任何时刻反应混合气体的总压强与其总物质的量成正比。
②恒温、恒压时:1
12
2V n V n ,即任何时刻反应混合气体的总体积与其总物质的量成正比。
③恒温、恒容时:1
122Mr Mr ,即任何时刻反应混合气体的密度与其反应混合气体的平均相对分子质量成
正比。
5.溶液的pH 值计算公式
(1)pH=-lg[c(H
+)]若c(H +)=10-n mol/L ,则pH=n
若c(H +)=m ×10-n mol/L ,则pH=n-lgm
(2)任何水溶液中,由水电离产生的
c(H +)与c(OH -)总是相等的,即:c 水(H +)=c 水(OH -)(3)常温(25℃)时:c(H +)·c(OH -)=1×10
-14(4)n 元强酸溶液中c(H +)=n ·c 酸;n 元强碱溶液中c(OH -
)=n ·c 碱
6.元素化合价与元素在周期表中的位置关系
(1)对于非金属元素:最高正价+|最低负价|=8(对于氢元素,负价为-1,正价为+1)。
(2)主族元素的最高价=主族序数=主族元素的最外层电子数。
7.烃的分子式的确定方法
(1)先求烃的最简式和相对分子质量,再依(最简式相对分子质量)
n =相对分子质量,求得分子式。
(2)商余法:12
烃的相对分子质量商为C 原子数,余数为H 原子数。
注意:一个C 原子的质量=12个H 原子的质量。
