氨基酸及其结构
氨基酸的组成与结构

氨基酸的组成与结构氨基酸是构成蛋白质的基本单元,它们的组成与结构对于蛋白质的功能和性质起着重要的影响。
本文将详细介绍氨基酸的组成与结构。
一、氨基酸的组成氨基酸由氨基(NH2)、羧基(COOH)、氢原子(H)和一个特定的侧链组成。
其中,氨基和羧基是所有氨基酸共有的基本结构,而侧链则是氨基酸之间区别的关键。
二、氨基酸的结构氨基酸的结构可以分为三个部分:氨基(氨基酸的氮原子与两个氢原子的结合)、羧基(酸性基团)和侧链(区分不同氨基酸的基团)。
氨基和羧基通过碳原子相连,形成了氨基酸的骨架结构。
侧链是氨基酸结构的关键部分,它的不同决定了氨基酸的性质和功能。
氨基酸的侧链可以是碳链、环状结构或含有其他元素的结构。
侧链的特性可以影响氨基酸的溶解性、电荷性质以及与其他分子的相互作用。
根据侧链的特性,氨基酸可以分为极性氨基酸和非极性氨基酸。
极性氨基酸的侧链含有带电荷的官能团,使得它们具有亲水性。
非极性氨基酸的侧链则主要是碳氢化合物,使得它们具有疏水性。
极性氨基酸中的一类是带有酸性侧链的氨基酸,如天冬酰胺酸和谷氨酰胺酸。
它们的侧链中含有羧基,具有酸性性质。
另一类是带有碱性侧链的氨基酸,如赖氨酸和精氨酸。
它们的侧链中含有氨基,具有碱性性质。
非极性氨基酸中的一类是含有疏水性侧链的氨基酸,如丙氨酸和苏氨酸。
它们的侧链主要由碳氢链组成,不带电荷,具有疏水性。
另一类是含有芳香环的氨基酸,如酪氨酸和酪酸。
它们的侧链中含有苯环,具有特殊的化学性质。
三、氨基酸的分类根据氨基酸在生物体内的合成能力,可以将氨基酸分为必需氨基酸和非必需氨基酸。
必需氨基酸是指人体无法自身合成,需要通过食物摄入的氨基酸,如赖氨酸、色氨酸和苏氨酸等。
非必需氨基酸是指人体可以自身合成的氨基酸,如丙氨酸、谷氨酸和天冬氨酸等。
四、氨基酸的功能氨基酸是蛋白质的构成单元,蛋白质在生物体内具有多种功能。
氨基酸的种类和顺序决定了蛋白质的结构和功能。
一些氨基酸可以参与酶的催化作用,调节代谢过程;一些氨基酸可以参与信号传导,调节细胞功能;一些氨基酸可以参与免疫反应,维护机体健康。
氨基酸的结构与命名

氨基酸的结构与命名氨基酸是构成蛋白质的基本组成单元,它通过肽键的形成相互连接在一起。
在生物体内,氨基酸承担着重要的生理功能,因此了解氨基酸的结构和命名对于理解蛋白质的合成与功能具有重要意义。
一、氨基酸的结构氨基酸的结构主要由两个部分构成:氨基(-NH2)和羧基(-COOH),它们与一个中心碳原子(称为α碳)连接在一起。
此外,氨基酸还有一个侧链(R基团),它的结构和化学性质决定了不同氨基酸之间的差异性。
具体来说,氨基酸的结构可以用以下示意图表示:H|N|H3N+-C-COO-|R其中,H3N+表示氨基,C表示中心碳原子,COO-表示羧基,R表示氨基酸的侧链。
每个氨基酸都有不同的侧链结构,决定了其特定的物理性质和化学性质。
二、氨基酸的命名氨基酸的命名通常按照IUPAC(国际纯粹和应用化学联合会)的命名规则进行,一般是由以下几个部分组成:1. 基本名称:根据氨基酸的化学性质和结构特点,通常以拉丁字母的缩写来表示,比如甘氨酸(Gly)表示甘氨酸基本名称为“Gly”。
2. 位点号码:位点号码用来标识氨基酸侧链上的特定原子或基团,通常用阿拉伯数字表示。
例如,对甘氨酸来说,如果侧链上的氢原子被替换为羟基(-OH),那么甘氨酸的命名就是“Ser”(基本名称)加上位点号码“16”表示羟基的位置。
3. 修饰物:在氨基酸命名中,有时会加上一些修饰物来表示某些特定功能的氨基酸。
例如,磷酸化的丝氨酸可以被命名为“pSer”或“Ser(P)”,其中“p”表示磷酸化。
综上所述,按照IUPAC的命名规则,氨基酸的命名可以通过基本名称、位点号码和修饰物等部分组成,以准确地描述氨基酸的结构和特性。
结论氨基酸作为构成蛋白质的基本组成单元,具有多样的结构和命名规则。
了解氨基酸的结构和命名对于深入理解蛋白质的合成和功能至关重要。
通过掌握氨基酸的结构与命名,我们能够更好地理解生物体内蛋白质的组成和相关生理功能,为进一步的研究提供有力支持。
氨基酸总结
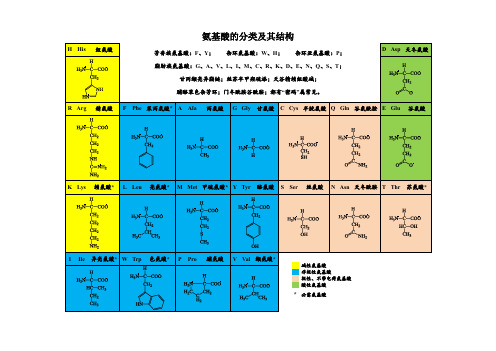
氨基酸的分类及其结构甘氨酸:无手性C颉氨酸、亮氨酸、异亮氨酸、甲硫氨酸:大脂肪侧链脯氨酸:唯一成环氨基酸,氨基酸的侧链既与α-碳原子结合又与α-氨基N-原子结合,缺少H-bond donor,无法形成α螺旋结构苯丙氨酸:侧链有芳香环,疏水氨基酸络氨酸:酪氨酸的芳香环有一个羟基。
与其他氨基酸侧链呈化学惰性相比,酪氨酸的羟基有化学反应性,疏水性弱。
色氨酸:吲哚基团替代丙氨酸侧链的氢原子。
吲哚基团有的两个环融合在一起,一个环有NH基团。
有NH故疏水性弱。
丝氨酸:侧链有极性但不带电荷。
侧链有羟基与脂肪链相连。
亲水,其反应活性比丙氨酸和颉氨酸大得多。
苏氨酸:侧链有极性但不带电荷。
侧链有羟基与脂肪链相连。
亲水,其反应活性比丙氨酸和颉氨酸大得多。
有第二个不对称碳原子,但蛋白质的苏氨酸只有一种构型。
天冬酰胺、谷氨酰胺:极性但不带电荷。
含酰胺的极性氨基酸半胱氨酸:极性不带电。
结构上类似苏氨酸,但是用巯基替代了羟基。
巯基比羟基活泼。
一对巯基靠近可以形成二硫键,稳定蛋白质的结构。
赖氨酸:带电荷的氨基酸,高度亲水,侧链长,末端是氨基,在中性pH时侧链末端带正电荷。
精氨酸:带电荷,高度亲水,侧链长,末端是胍基,在中性pH时侧链末端带正电荷。
组氨酸:带电荷,高度亲水,侧链含有咪唑基,咪唑基是芳香环,也能被质子化后带正电荷。
咪唑的pKa值接近于6,在中性pH附近的溶液中咪唑基既可以质子化也可以不带电荷,实际情况取决于咪唑基团所在的局部环境。
组氨酸常在酶的活性中心。
在酶促反应中咪唑环既可以结合质子,有可以释放质子。
天冬氨酸:酸性氨酸。
常被称为天冬氨酸盐,主要是强调在生理pH溶液中侧链基团解离,因此带负电荷。
在有些蛋白质中这两种氨基酸的作用是接受质子,对蛋白质功能起重要作用。
谷氨酸:酸性氨酸。
常被称为谷氨酸盐,主要是强调在生理pH溶液中侧链基团解离,因此带负电荷。
在有些蛋白质中这两种氨基酸的作用是接受质子,对蛋白质功能起重要作用。
氨基酸的结构通式

氨基酸的结构通式
氨基酸(Amino acids)是构成蛋白质的基本组成单位。
它们由一个氨基(-NH2)和一个羧基(-COOH)以及一个与其它原子或基团结合的侧链组成。
氨基酸分为20种常见的自然氨基酸,每种都具有不同的侧链结构。
H-N-C-COOH
H
氨基基团(-NH2)是氨基酸中的氮原子和两个氢原子组成的基团。
它是氨基酸的氨基官能团,是氨基酸的碱性部分。
酸基团(-COOH)是氨基酸中的碳原子和两个氧原子组成的基团。
它是氨基酸的羧基官能团,是氨基酸的酸性部分。
氢原子(H)是氨基酸中的单个氢原子,连接在α碳原子上。
它是氨基酸的中心碳原子上的一个取代基。
侧链(R)是氨基酸中与其他原子或基团结合的部分。
它是氨基酸的特定部分,决定了氨基酸的特性和功能。
氨基酸的侧链结构可以是非极性的、极性的或带电的。
非极性氨基酸的侧链通常由碳和氢原子组成,如丙氨酸、天冬酰胺酸等。
极性氨基酸的侧链含有带电的氨基或酸基官能团,如赖氨酸、谷氨酰胺酸等。
带电氨基酸的侧链含有正电荷或负电荷,如赖氨酸、谷氨酸等。
可见,氨基酸的结构通式显示了其在化学组成上的基本特征,其中包括氨基、羧基、氢原子和侧链。
这些特征结构决定了氨基酸在蛋白质中的位置和功能,并对蛋白质的结构和功能产生重要影响。
二十种氨基酸结构式

*作品编号:DG13485201600078972981*创作者:玫霸*20种常见氨基酸的名称和结构式中文缩英文缩写结构式名称写非极性氨基酸甘氨酸(α-氨基乙酸)甘Gly GGlycine丙氨酸(α-氨基丙酸)丙Ala AAlanine亮氨酸(γ-甲基-α-氨基戊酸)*亮Leu LLeucine异亮氨酸(β-甲基-α-氨基戊酸)*异亮Ile IIsoleucine缬氨酸(β-甲基-α-氨基丁酸)*缬Val VValine脯氨酸(α-四氢吡咯甲酸)脯Pro PProline苯丙氨酸(β-苯基-α-氨基丙酸)*苯丙Phe F Phenylalanine蛋(甲硫)氨酸(α-氨基-γ-甲硫基戊酸) *蛋Met M Methionine色氨酸[α-氨基-β-(3-吲哚基)丙酸]*色Trp W Tryptophan非电离的极性氨基酸丝氨酸(α-氨基-β-羟基丙酸)丝Ser S Serine谷氨酰胺(α-氨基戊酰胺酸)谷胺Gln Q Glutamine苏氨酸(α-氨基-β-羟基丁酸)*苏Thr T Threonine半胱氨酸(α-氨基-β-巯基丙酸)半胱Cys C Cysteine天冬酰胺(α-氨基丁酰胺酸)天胺Asn N Asparagine酪氨酸(α-氨基-β-对羟苯基丙酸)酪Tyr Y Tyrosine酸性氨基酸天冬氨酸(α-氨基丁二酸)天Asp D Aspartic acid谷氨酸(α-氨基戊二酸)谷Glu E Glutamic acid碱性氨基酸赖氨酸(α,ω-二氨基己酸)*赖Lys K Lysine精氨酸(α-氨基-δ-胍基戊酸)精Arg R Arginine组氨酸[α-氨基-β-(4-咪唑基)丙酸]组His H Histidine作品编号:DG13485201600078972981创作者:玫霸*。
二十种氨基酸结构式

缬
Val
V
脯氨酸(-四氢吡咯甲酸)
Proline
脯
Pro
P
苯丙氨酸(-苯基--氨基丙酸)*
Phenylalanine
苯丙
Phe
F
蛋(甲硫)氨酸(-氨基--甲硫基戊酸) *
Methionine
蛋
Met
M
色氨酸[-氨基--(3-吲哚基)丙酸]*
Tryptophan
色
Trp
W
非电离的极性氨基酸
Histidine
组
His
H
丝氨酸(-氨基--羟基丙酸)
Serine
丝
Ser
S
谷氨酰胺(-氨基戊酰胺酸)
Glutamine
谷胺
Gln
Q
苏氨酸(-氨基--羟基丁酸)*
Threonine
苏
Thr
T
半胱氨酸(-氨基--巯基丙酸)
Cysteine
半胱
Cys
C
天冬酰胺(-氨基丁酰胺酸)
Asparagine
天胺
Asn
N
酪氨酸(-氨基--对羟苯基丙酸)
Tyrosine
酪
Tyr
Y
酸性氨基酸
天冬氨酸(-氨基丁二酸)
Aspartic acid
天
Asp
D
谷氨酸(-氨基戊二酸)
Glutamic acid
谷
Glu
E
碱性氨基酸
赖氨酸(,-二氨基己酸)*
Lysine
赖
Lys
K
精氨酸(-氨基--胍基戊酸)
Arginine
精
Arg
R
组氨酸[-氨基--(4-咪唑基)丙酸]
氨基酸的结构与性质

四、核酸
1、核酸是一类含磷的生物高分子化合物,相对分 子量可达十几万至几百万。
2、核酸在生物体的生长、繁殖、遗传、变异等 生命现象中起着决定性的作用。
3、具有酸性
4、分类:(1)脱氧核糖核酸(DNA):生物遗 传信息的载体;还指挥着蛋白质的合成、细胞的分 裂和制造新的细胞,大量存在于细胞核中。 (2)核糖核酸(RNA):根据DNA提供的信息 控制体内蛋白质的合成,主要存在于细胞质中。
化而分解。它们能溶于强酸或强碱溶液中,除少数外一般 都能溶于水,而难溶于酒精和乙醚。
谷
甘
氨
氨
酸
酸
不同的氨基酸形成内盐的pH值各不相同
名称 甘氨酸 丙氨酸 缬氨酸 亮氨酸 异亮氨酸 苯丙氨酸 半胱氨酸
内盐pH 6.06 6.11 6.00 6.01 6.05 5.49 5.05
名称 苏氨酸 谷氨酸 天冬氨酸 赖氨酸 组氨酸 精氨酸 酪氨酸
A.蛋白质的盐析 B.酯的水解 C.蛋白质白变性 D.氯化铁的水解
2、欲将蛋白质从水中析出而又不改变它的性
质应加入( C)
A.甲醛溶液
B.CuSO4溶液
C.饱和Na2SO4溶液 D.浓硫酸
3.关于蛋白质的叙述错误的是( B )
A.浓HNO3溅在皮肤上,使皮肤呈黄色, 是由于浓HNO3和蛋白质发生了颜色反应
A. 2种 C. 4种
B. 3种 D. 5种
氨基酸可以与同碳数的硝基化合物为同分异构体
第四章 生命中的基础有机化学物质 第二课时蛋白质 酶 核酸
蛋白质的结构与性质 1. 组成: 蛋白质构成元素有:C、H、O、N、S 等 官能团为:肽键(酰胺键) 相对分子质量可达几万到几千万,为有机高分 子化合物。 人体内所具有的蛋白质种类达到了10万种以上。
二十种氨基酸结构式

二十种氨基酸结构式氨基酸是构成蛋白质的基本单位,共有20种标准氨基酸。
每种氨基酸都具有不同的结构和特性。
以下是二十种氨基酸的结构式及其相关信息。
1. 丙氨酸(Alanine, Ala, A):H3N^+-C(H)(H)-C(H)(H)-COO^-2. 天冬氨酸(Aspartic Acid, Asp, D):H2N-CH2-COO^-,C(O)-O^-3. 谷氨酸(Glutamic Acid, Glu, E):H2N-CH2-CH2-COO^-,C(O)-O^-4. 亮氨酸(Leucine, Leu, L):H3N^+-C(H)(CH3)-CH2-CH(CH3)-CH2-CH3-COO^-5. 苏氨酸(Glycine, Gly, G):H3N^+-CH2-COO^-6. 缬氨酸(Isoleucine, Ile, I):H3N^+-C(H)(CH3)-CH(CH3)-CH2-CH3-COO^-7. 苏胺酸(Threonine, Thr, T):H3N^+-C(H)(CH3)-CH(OH)-CH3-COO^-8. 赖氨酸(Lysine, Lys, K):H3N^+-C(H)(H)-CH2-CH2-CH2-CH2-CH2-CH2-NH3^+-COO^-9. 苏氨酸(Valine, Val, V):H3N^+-C(H)(CH3)-CH(CH3)-CH3-COO^-10. 苏胺酸(Asparagine, Asn, N):H2N-CH2-C(O)-NH-C(O)-CH311. 苏脯氨酸(Proline, Pro, P):H2N-CH2-CH2-CH2-CO^-12. 同型胱氨酸(Cysteine, Cys, C):H3N^+-CH2-CH(SH)-COO^-13. 苏酪氨酸(Tryptophan, Trp, W):H3N^+-CH2-C(C=C-C6H4-NH2)-COO^-14. 存氨酸(Serine, Ser, S):H3N^+-CH2-OH-COO^-15. 苏酮氨酸(Phenylalanine, Phe, F):H3N^+-CH2-C(C6H5)-COO^-16. 苏蛋氨酸(Methionine, Met, M):H3N^+-CH2-CH2-S-CH3-COO^-17. 同型精氨酸(Arginine, Arg, R):H2N-CH2-CH2-CH2-CH2-NH-C(NH2)(NH3^+)-COO^-18. 苏脯氨酸(Histidine, His, H):H3N^+-CH2-C3H2N(C3H3N2)-COO^-19. 苏蛋氨酸(Threonine, Thr, T):H2N-CH(CH3)-CH(NH2)(COOH)-COO^-20. 苏缬氨酸(Tyrosine, Tyr, Y):H3N^+-CH2-C(C6H4-OH)-COO^-这是20种标准氨基酸的结构式。
20种常见氨基酸的分类和结构

20种常见氨基酸的分类和结构氨基酸是构成蛋白质的基本单位,根据其侧链的不同化学性质,可以将氨基酸分为不同的分类。
下面将介绍20种常见氨基酸的分类和结构。
1.非极性氨基酸:- 甘氨酸 (Gly):侧链仅有一个氢原子。
- 丙氨酸 (Ala):侧链为一个甲基基团。
- 缬氨酸 (Val):侧链为一个异丁基基团。
- 亮氨酸 (Leu):侧链为一个异戊基基团。
- 异亮氨酸 (Ile):侧链为一个异戊基基团和甲基基团。
2.非极性芳香氨基酸:- 苯丙氨酸 (Phe):侧链为苯甲基。
- 色氨酸 (Trp):侧链包含类似吲哚的环结构。
- 酪氨酸 (Tyr):侧链为苯酪基。
3.极性非电荷氨基酸:-非极性的侧链:- 蛋氨酸 (Met):侧链为甲硫基。
- 赖氨酸 (Lys):侧链为五碳鏈帶一原子氮的氨基。
-极性的侧链:- 缬氨酸 (Val):侧链为羟基。
- 嘧啶丙氨酸 (Asn):侧链包含一个酰胺基团。
- 谷氨酸 (Gln):侧链为二酰胺基团。
4.极性带正电氨基酸:- 精氨酸 (Arg):侧链带有三个氨基。
- 肌氨酸 (Lys):侧链带有一个氨基。
- 组氨酸 (His):侧链带有一个咪唑环。
5.极性带负电氨基酸:- 谷氨酸 (Glu):侧链呈羧基酸态。
- 天冬氨酸 (Asp):侧链呈羧基酸态。
- 异亮氨酸 (Ile):侧链包含羧乙基。
以上就是20种常见氨基酸的分类和结构。
每种氨基酸都具有不同的化学结构和性质,它们的组合形成了多样的蛋白质结构和功能。
这些氨基酸的分类对于理解蛋白质的结构和功能以及生物学过程的研究非常重要。
氨基酸简写

氨基酸简写概述氨基酸是构成蛋白质的基本组成单位,分为20种常见的氨基酸。
为了简化氨基酸的表示和书写,在国际上制定了使用简写的约定。
每种氨基酸都有一个特定的简写标识,方便科学家在文献中进行描述和书写。
本文将介绍氨基酸的简写以及其对应的化学结构和功能。
氨基酸简写表下表列出了20种常见的氨基酸及其对应的简写标识。
序号氨基酸简写标识1丙氨酸Ala2谷氨酸Arg3天冬氨酸Asn 4马来酸Asp 5胱氨酸Cys 6谷氨酸Gln 7谷氨酸Glu 8赖氨酸Gly 9组氨酸His 10异亮氨酸Ile 11亮氨酸Leu12赖氨酸Lys 13甲硫氨酸Met 14苯丙氨酸Phe 15脯氨酸Pro 16色氨酸Ser 17环胺酸Thr 18缬氨酸Trp 19酪氨酸Tyr 20缬氨酸Val氨基酸结构和功能1. 丙氨酸 (Alanine)•简写标识:Ala•结构式:CH3-CH(NH2)-COOH•功能:丙氨酸是一种非极性氨基酸,常参与蛋白质的结构稳定性维持。
2. 谷氨酸 (Arginine)•简写标识:Arg•结构式:H2N-C(NH)-NH-(CH2)3-CH(NH2)-COOH•功能:谷氨酸是一种碱性氨基酸,通常与酸性氨基酸组合形成盐桥,参与蛋白质的相互作用。
3. 天冬氨酸 (Asparagine)•简写标识:Asn•结构式:H2N-CO(CH2)-CH(NH2)-COOH•功能:天冬氨酸是一种极性氨基酸,通过氢键与其他氨基酸相互作用,参与蛋白质的折叠和稳定。
4. 马来酸 (Aspartic acid)•简写标识:Asp•结构式:HOOC-CH2-CH(NH2)-COOH•功能:马来酸是一种亲酸氨基酸,在蛋白质的结构和功能中起到重要的作用。
5. 胱氨酸 (Cysteine)•简写标识:Cys•结构式:HS-CH2-CH(NH2)-COOH•功能:胱氨酸含有硫原子,可以和其他胱氨酸形成二硫键,参与蛋白质的折叠和稳定。
6. 谷氨酸 (Glutamine)•简写标识:Gln•结构式:H2N-C(O)-(CH2)2-CH(NH2)-COOH•功能:谷氨酸是一种极性氨基酸,通过氢键与其他氨基酸相互作用,参与蛋白质的折叠和稳定。
氨基酸的结构与分类

① 具有非极性或疏水R基团的氨基酸 ② 具有极性不带电荷R基团的氨基酸 ③ R基团带负电荷的氨基酸(酸性氨基酸) ④ R基团带正电荷的氨基酸(碱性氨基酸)
丙氨酸
缬氨酸
亮氨酸
异亮氨酸
苯丙氨酸
色氨酸
吲哚环
脯氨酸
吡咯环
甲硫氨酸
① 具有非极性或疏水R基团的氨基酸 ② 具有极性不带电荷R基团的氨基酸 ③ R基团带负电荷的氨基酸(酸性氨基酸) ④ R基团带正电荷的氨基酸(碱性氨基酸)
中文名称
甘氨酸 丙氨酸 缬氨酸 亮氨酸 异亮氨酸 甲硫氨酸 脯氨酸 苯丙氨酸 色氨酸 丝氨酸
英文名称
三字母 单字母 中文名称
符号 符号
英文名称
三字母 单字母 符号 符号
Glycine
Gly
G 苏氨酸 Threonine Thr
T
Alanine
Ala
A 天冬酰胺 Asparagine Asn
N
Valine
F
组氨酸 Histidine
His
H
Tryptophan Trp W 天冬氨酸 Asparitic acid Asp
D
Serine
Ser
S 谷氨酸 Glutamic acid Glu
E
氨基酸的分类
1.按 R 基团的极性分类
① 具有非极性或疏水R基团的氨基酸 ② 具有极性不带电荷R基团的氨基酸 ③ R基团带负电荷的氨基酸(酸性氨基酸) ④ R基团带正电荷的氨基酸(碱性氨基酸)
在生理条件下,侧链基团既可以作为质子供体, 也可以作为质子受体的常见氨基酸是什么?
质子化的组氨酸
去质子化的组氨酸
含有硫原子的氨基酸有哪些?
甲硫氨酸
氨基酸的结构与性质

氨基酸的结构与性质氨基酸是生命中的基本分子之一,它是构成生物体内蛋白质的组成单元,同时还在许多代谢反应中发挥重要作用。
氨基酸的结构与性质涉及到它的化学组成、空间结构以及在生物体内的功能。
以下将详细介绍氨基酸的结构与性质。
一、氨基酸的化学结构:氨基酸由中心碳原子(α-C)和与之相连的四个基团组成:氨基(-NH2)、羧基(-COOH)、一个氢原子(-H)和一个侧链基团(R)。
1.氨基:-NH2,和一个氢原子连接,是氨基酸的一个常见特点。
2.羧基:-COOH,和一个氢原子连接,为氨基酸的另一个特点。
3.氢原子:-H,连接在中心碳原子上,可以与侧链基团相互作用。
4.侧链基团:R是氨基酸的特异性标志,不同的R导致了不同的氨基酸种类。
二、氨基酸的分类:氨基酸可以根据其侧链基团的性质被分为极性、非极性、酸性和碱性氨基酸。
1.极性氨基酸:侧链中含有氢键供体或受体,可以与其他极性物质相互作用。
酪氨酸、赖氨酸、组氨酸等就是极性氨基酸的代表。
2.非极性氨基酸:侧链中没有明显的极性基团,通常是脂溶性的。
丙氨酸、丝氨酸、亮氨酸等都属于非极性氨基酸。
3.酸性氨基酸:侧链中含有羧基,可以失去质子。
谷氨酸、门冬氨酸是常见的酸性氨基酸。
4.碱性氨基酸:侧链中含有氨基,在适当的条件下可以接受质子。
赖氨酸、精氨酸等属于碱性氨基酸。
三、氨基酸的空间结构:氨基酸通常以L型存在,这是由于侧链基团的位置而决定的。
在L型氨基酸中,羧基位于左侧,而氨基位于右侧。
D型氨基酸存在于一些细菌细胞壁中,而在自然界中D型氨基酸几乎不见。
氨基酸的侧链基团的位置和性质决定了氨基酸的生物功能和化学反应。
侧链基团的大小、电荷、极性、亲水性等属性对蛋白质的结构和功能起着重要的影响。
四、氨基酸的性质:1.酸碱性:氨基酸可以通过羧基中的羟基(-OH),羟基的质子(H+),以及氨基中的氨基质子(NH3+)与其他分子发生酸碱反应。
2.缔合特性:在生物体内,通过形成酯、肽和烷基缔合等化学反应,氨基酸可以与其他分子形成化学连接。
20种常见氨基酸的名称、结构及分类

20种常见氨基酸的名称和结构式名称中文英文缩写结构式等电点非极性氨基酸丙氨酸(α-氨基丙酸) Alanine 丙Ala ACH COONH3CH3 6.02缬氨酸(β-甲基-α-氨基丁酸)*Valine 缬Val VCHCOONH3(CH3)2CH 5.97亮氨酸(γ-甲基-α-氨基戊酸)*Leucine 亮Leu LCHCOONH3(CH3)2CHCH2 5.98异亮氨酸(β-甲基-α-氨基戊酸) *Isoleucine 异亮Ile ICHCOONH3CH3CH2CHCH36.02苯丙氨酸(β-苯基-α-氨基丙酸) *Phenylalanine 苯丙Phe FCHCOONH3CH2 5.48色氨酸[α-氨基-β-(3-吲哚基)丙色Trp W NCH2CH COONH3H5.89酸]*Tryptophan 蛋(甲硫)氨酸(α-氨基-γ-甲硫基戊酸) *Methionine蛋(甲硫)Met MCHCOONH3CH3SCH2CH2 5.75脯氨酸(α-四氢吡咯甲酸)Proline 脯Pro PCOONH H6.30非电离的极性氨基酸甘氨酸(α-氨基乙酸) Glycine 甘Gly GCH2COONH35.97丝氨酸(α-氨基-β-羟基丙酸)Serine 丝Ser SCHCOONH3HOCH2 5.68苏氨酸(α-氨基-β-羟基丁酸) *Threonine 苏Thr TCHCOONH3CH3CHOH6.53半胱氨酸(α-氨基-β-巯基丙酸)Cysteine 半胱Cys CCHCOONH3HSCH2 5.02酪氨酸(α-氨基-β-对羟苯基丙酸)Tyrosine 酪Tyr YCHCOONH3CH2HO 5.66天冬酰胺(α-氨基丁酰胺酸) Asparagine 天胺Asn NCH2CHCOONH3H2N CO5.41谷氨酰胺(α-氨基戊酰胺酸) Glutamine 谷胺Gln QCH2CH2CHCOONH3H2N CO5.65碱性氨基酸组氨酸[α-氨基-β-(4-咪唑基)丙酸] Histidine 组His HNCH2CH COONH3HN7.59赖氨酸(α,ω-二氨基己酸)*Lysine 赖Lys KCHCOONH2CH2CH2CH2CH2NH39.74精氨酸(α-氨基-δ-胍基戊酸)Arginine 精Arg RH2N C CHCOONH2NHCH2CH2CH2NH210.76酸性氨基酸天冬氨酸(α-氨基丁二酸) Aspartic acid 天冬Asp DNH3HOOCCH2CHCOO 2.97谷氨酸(α-氨基戊二酸) Glutamic acid 谷Glu ECHCOONH3HOOCCH2CH2 3.22带“*”为必需氨基酸THANKS致力为企业和个人提供合同协议,策划案计划书,学习课件等等打造全网一站式需求欢迎您的下载,资料仅供参考。
氨基酸的结构及性质

主要内容
氨基酸的分析 蛋白质的分析 核酸的分析 两个实验
第一章、氨基酸的结构及性质 —— 组成蛋白质的基本单位
存在自然界中的氨基酸有300余种,但组 成人体蛋白质的氨基酸仅有20种,且均属 L氨基酸〔甘氨酸除外〕.
第一节 氨基酸的分类
一、氨基酸的结构通式
氨基酸是蛋白质水解的最终产物,是组成蛋白质的基本单位.从蛋白质水解物中分 离出来的氨基酸有二十种,除脯氨酸和羟脯氨酸外,这些天然氨基酸在结构上的共 同特点为:
脯氨酸
饼干写亮一本谱 proline Pro P
6.30
4. 极性中性氨基酸
色氨酸 tryptophan Trp W 5.89
丝氨酸 serine
Ser S 5.68
酪氨酸 tyrosine Tyr Y 5.66 半胱氨酸 cysteine Cys C 5.07
蛋氨酸 methionine Met M 5.74
〔1〕按R基团的酸碱性分
中性AA 酸性AA 碱性AA
〔2〕按R基团的电性质分
疏水性R基团AA 电荷极性R基团的AA 带电荷R基团的AA
〔3〕按R基团的化学结构分 芳香族AA 杂环族AA
〔一〕按R基的化学结构分类 可分为三类:脂肪族、芳香族和杂环族
1、脂肪族氨基酸
● 含一氨基一羧基的中性氨基酸
甘氨酸 Gly, G
+NH3
-HH
+NH3
-O O C -C H -C H 2-SS-C H 2-C H -C O O -
+ N H 3
+ N H 3
二硫键
胱氨酸
人体所需的八种必需氨基酸 赖氨酸<Lys> 缬氨酸<Val> 蛋氨酸<Met> 色氨酸<Trp > 亮氨酸<Leu> 异亮氨酸<Ile> 苏氨酸<Thr> 苯丙氨酸<Phe>
二十种氨基酸结构式

20种罕见氨基酸的名称和结构式宇文皓月名称中文缩写英文缩写结构式非极性氨基酸甘氨酸(α-氨基乙酸)Glycine甘Gly G丙氨酸(α-氨基丙酸)Alanine丙Ala A亮氨酸(γ-甲基-α-氨基戊酸)*Leucine亮Leu L异亮氨酸(β-甲基-α-氨基戊酸)*Isoleucine异亮Ile I缬氨酸(β-甲基-α-氨基丁酸)*Valine缬Val V脯氨酸(α-四氢吡咯甲酸)Proline脯Pro P苯丙氨酸(β-苯基-α-氨基丙酸)*Phenylalanine苯丙Phe F蛋(甲硫)氨酸(α-氨基-γ-甲硫基戊酸) *Methionine蛋Met M色氨酸[α-氨基-β-(3-吲哚基)丙酸]*色Trp W Tryptophan非电离的极性氨基酸丝氨酸(α-氨基-β-羟基丙酸)丝Ser S Serine谷氨酰胺(α-氨基戊酰胺酸)谷胺Gln Q Glutamine苏氨酸(α-氨基-β-羟基丁酸)*苏Thr T Threonine半胱氨酸(α-氨基-β-巯基丙酸)半胱Cys C Cysteine天冬酰胺(α-氨基丁酰胺酸)天胺Asn N Asparagine酪氨酸(α-氨基-β-对羟苯基丙酸)酪Tyr Y Tyrosine酸性氨基酸天冬氨酸(α-氨基丁二酸)天Asp D Aspartic acid谷氨酸(α-氨基戊二酸)谷Glu E Glutamic acid碱性氨基酸赖氨酸(α,ω-二氨基己酸)*赖Lys K Lysine精氨酸(α-氨基-δ-胍基戊酸)精Arg R Arginine组氨酸[α-氨基-β-(4-咪唑基)丙酸]组His H Histidine。
十种氨基酸结构式

十种氨基酸结构式氨基酸是构成蛋白质的基本组成单元,它们由一种中心碳原子(α碳)连接到一个氨基基团(—NH2)、一个羧基基团(—COOH)、一个氢原子以及一个侧链(R基团)。
以下是十种常见的氨基酸及其结构式:1. 甘氨酸(Glycine,简称Gly)甘氨酸是最简单的氨基酸,其侧链为一个氢原子。
结构式:H2N—CH2—COOH2. 丙氨酸(Alanine,简称Ala)丙氨酸的侧链为一个甲基基团(—CH3)。
结构式:H3C—CH(NH2)—COOH3. 缬氨酸(Valine,简称Val)缬氨酸的侧链为一个异丙基基团(—CH(CH3)2)。
结构式:H3C—CH(CH3)—CH(NH2)—COOH4. 亮氨酸(Leucine,简称Leu)亮氨酸的侧链为一个异戊基基团(—CH2CH(CH3)2)。
结构式:(C2H5)2CH—CH(NH2)—COOH5. 异亮氨酸(Isoleucine,简称Ile)异亮氨酸的侧链为一个三甲基基团(—CH(CH3)CH2CH3)。
结构式:(CH3)2CH—CH(CH3)—CH(NH2)—COOH6. 苏氨酸(Serine,简称Ser)苏氨酸的侧链为一个羟基基团(—OH)。
结构式:HO—CH2—CH(NH2)—COOH7. 苯丙氨酸(Phenylalanine,简称Phe)苯丙氨酸的侧链为一个苯基基团(—C6H5)。
结构式:C6H5—CH2—CH(NH2)—COOH8. 组氨酸(Histidine,简称His)组氨酸的侧链为一个咪唑环(—CH=N—CH=CH—NH2),其中含有一个带负电荷的氮原子。
结构式:N—CH=N—CH=CH—CH(NH2)—COOH9. 赖氨酸(Lysine,简称Lys)赖氨酸的侧链为一个五碳烃基链(—CH2CH2CH2CH2NH2),其中含有一个带正电荷的氮原子。
结构式:H2N—(CH2)4—CH(NH2)—COOH10. 酪氨酸(Tyrosine,简称Tyr)酪氨酸的侧链为一个苯基羟基基团(—C6H4OH)。
氨基酸的化学结构

氨基酸的化学结构
氨基酸是构成蛋白质的基本单位,其化学结构是由一个氨基(-NH2)、一个羧基(-COOH)和一个侧链组成的。
氨基和羧基相互作用形成了肽键(-CO-NH-),将氨基酸分子连成了线性的多肽链。
侧链则决定了不同氨基酸之间在空间结构上的不同排列方式,从而决定了蛋白质的不同功能和性质。
目前已经发现了20种常见的氨基酸,它们的侧链结构不同,因此各自具有不同的生物学功能。
其中,8种必需氨基酸人体无法合成,必须通过食物摄入。
氨基酸在生命体中发挥着重要的作用,不仅是蛋白质的构成单元,还能参与代谢、信号传导等生命活动。
- 1 -。
氨基酸空间结构

氨基酸空间结构氨基酸是构成蛋白质的基本组成单位,它们具有独特的空间结构。
这些结构对于蛋白质的功能至关重要。
本文将介绍几种常见氨基酸的空间结构及其在生物体内的重要作用。
一、甘氨酸(Glycine)甘氨酸是最简单的氨基酸,它的空间结构非常特殊。
甘氨酸的侧链只有一个氢原子,因此它的侧链非常小。
这使得甘氨酸在蛋白质中能够处于很多不同的位置,从而增加了蛋白质的灵活性。
甘氨酸在蛋白质折叠和稳定性中起到重要作用。
二、丝氨酸(Serine)丝氨酸具有一个羟基(-OH)的侧链。
这个羟基使得丝氨酸具有一定的亲水性。
丝氨酸在蛋白质中常常参与磷酸化反应,从而调控蛋白质的功能。
此外,丝氨酸还可以通过与其他氨基酸的侧链形成氢键相互作用,从而影响蛋白质的折叠结构。
三、赖氨酸(Lysine)赖氨酸具有一个长链的侧链,其中包含一个胺基(-NH2)。
赖氨酸在蛋白质的结构和功能中起着重要的作用。
它的侧链可以与其他氨基酸的侧链形成离子键,从而稳定蛋白质的立体结构。
此外,赖氨酸还参与DNA的结合和修复过程,对细胞的正常功能具有重要影响。
四、谷氨酸(Glutamic acid)谷氨酸具有一个羧基(-COOH)的侧链。
这个羧基使得谷氨酸具有一定的酸性。
谷氨酸在蛋白质中常常作为酸性残基存在,与碱性氨基酸如赖氨酸和精氨酸形成盐桥,稳定蛋白质的结构。
此外,谷氨酸还参与神经递质的合成和释放,对神经系统的正常功能至关重要。
五、半胱氨酸(Cysteine)半胱氨酸具有一个硫氢基(-SH)的侧链。
这个硫氢基在蛋白质中常常形成二硫键,从而稳定蛋白质的结构。
半胱氨酸还参与细胞的氧化还原反应,调节细胞内的氧化状态。
六、苏氨酸(Threonine)苏氨酸具有一个羟基(-OH)和一个甲基(-CH3)的侧链。
这个羟基使得苏氨酸具有一定的亲水性。
苏氨酸在蛋白质中常常作为磷酸化位点存在,参与蛋白质的调控和信号传导。
以上只是几种常见氨基酸的空间结构及其作用的简要介绍。
实际上,氨基酸的种类很多,它们的空间结构和功能也各不相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O C OH
羧基
C
R
侧链基团 2.元素组成: C H O N 3.化学式: C2 H 4O2 N1 R
1、下列哪项不是构成蛋白质的氨基酸? NH2 CH A、 COOH CH3 B、 SH NH2 D、 CH NH CH COOH CH2 COOH COOH
CH2 NH2 COOH
NH2 CH C、
CH CH3 CH3
氨基酸通式的特点
H H2N C COOH
侧链基团
氨基酸分子的结构通式
R
H H2N C H H H2N C
缬 氨 酸
H COOH
甘氨酸
H2N C CH3 H
COOH
丙氨酸
COOH
H2N C
亮 氨 酸
COOH
CH CH3 CH3
CH2 CH CH3 CH3
氨 基 酸 通 式 的 特 点
CH2 CH2 COOH
2、甲硫氨酸的R基是-CH2-CH2-S-CH3,它的分 子式是 A. C5H11O2NS C. C4H11O2S B. C3H7S D. C5H10O2N
组成蛋白质的氨基酸约有20种;
组氨酸
有8种氨基酸是人体细胞不能合成的 , (婴儿有9种) 必须从外界环境中直接获取,这些氨基酸叫做必需氨基酸。 〔甲硫 (蛋)氨酸、缬氨酸、赖氨酸、异亮氨酸、苯丙氨酸、 携 来 一 本 甲 亮氨酸、色氨酸、苏氨酸;〕【甲携来一本亮色书】 亮 色 书
为什么蛋白质具有如此多的功能呢? 这与它的结构是分不开的。
比较下列两种物质的相对分子质量: H2O(水) C3032H4816O872N280S8Fe4(血红蛋白)
结论:蛋白质的相对分子质量很大,是一种 高分子化合物,为生物大分子。蛋白质主 要由C、H、O、N四种,也含有P、S及一些 微量元素。占细胞干重的50%以上。 回忆蛋白质的消化过程
1、每种氨基酸分子 都有一个氨基(—NH2) 一个氢原子(—H)和一 个羧基(—COOH)连接 在同一个碳原子上。 2、R基不同,氨基酸的种类不同。
H H2N C COOH
侧链基团
R
氨基酸分子的结构通式
H H NH2 C COOH NH2 C CH2 C NH2 天冬氨酸 天门冬酰胺 O COOH
细胞分泌胰岛素
5、免疫作用:
抗体
一、蛋白质的功能多样性
1、构成细胞和生物体的重要物质 如人和动物的肌肉的主要成分
2、调节细胞和生物体的新陈代谢作用的重要物 质 催化作用 酶 运输作用 血红蛋白 载体 调节作用 胰岛素 生长激素 免疫作用 抗体
一切生命活动都离不开蛋白质,蛋白质是生命活动 的主要承担者,是生命活动的体现者
讨论:他们都是健康的孩子吗?
蛋白质对生命活 动有重要作用。
第二节、生命活动的主要承担者--蛋白质
氨基酸及其种类
说出你所知道的富含蛋白质的食物:
大豆制品:如豆 浆、豆 腐、腐 竹、豆 饼、豆 渣等。 奶类制品:如奶粉、酸奶、袋装奶、 豆 奶等。 肉蛋类食品:如牛肉、烤肉、肉肠、 鸡蛋等。
图2-7阅读课本P23页,了解生物 体内的常见蛋白质的功能,并将 常见蛋白质的功能总结出来
CH2
COOH
氨 基 酸 通 式 的 特 点
1、每种氨基酸分子 至少 都含有一个氨基(— NH2)、一 个羧基(—COOH)和一个氨基连接在 同一个碳原子上。 2、R基不同,氨基酸分子不同的。
H H2N C COOH
侧链基团
R
氨基酸分子的结构通式
氨基酸分子结构通式
组成生物体蛋白质氨基酸的
H
1.结构通式: H2N 氨基
另外12种氨基酸是人体细胞能够合成的,叫做非必需氨基酸。
COOH
COOH
CH CH3 CH3
CH2 CH CH3 CH3
H O H N C C OH H H
氨基 羧基
甘氨酸
这四种氨基酸在结构上有什么相同之处? 有什么不同之处?
H H2N C H H H2N C
缬 氨 酸
H COOH
甘氨酸
H2N C CH3 H
COOH
丙氨酸
COOH
H2N C
亮 氨 酸
H H2N C H H H2N C
缬 氨 酸
H COOOOH
丙氨酸
COOH
H2N C
亮 氨 酸
COOH
CH CH3 CH3
CH2 CH CH3 CH3
H H2N C H H H2N C COOH COOH
H H2N C CH3 H H2N C CH2 CH CH3 CH3 COOH COOH
蛋 白 质 可 以 被 人体 直 接 吸 收 利 用 吗?
蛋白质
胃蛋白酶
肽酶
氨基酸
氨基酸是组成蛋白质的基本单位。
这四种氨基酸由几种元素组成?它们分别是什么
H H2N C H H H2N C
缬 氨 酸
H COOH
甘氨酸 中 心 碳 原 子
H2N C CH3 H H2N C
亮 氨 酸
COOH
丙氨酸
COOH
CH CH3 CH3
CH2 CH CH3 CH3
这四种氨基酸在结构上有什么相同之处? 有什么不同之处?
H H2N C H H H2N C
缬 氨 酸
H COOH
甘氨酸
H2N C CH3 H
COOH
丙氨酸
COOH
H2N C
亮 氨 酸
COOH
CH CH3 CH3
CH2 CH CH3 CH3
这四种氨基酸在结构上有什么相同之处? 有什么不同之处?
许多蛋白质是构成细胞和生物体结构的重要物质。 如羽毛、肌肉、头发、蛛丝等的成分主要是蛋白 质。
2、催化作用:细胞
内的化学反应离不开
酶的催化。绝大多数
酶都是蛋白质
胃蛋白质酶结晶
3、运输作用:有 些蛋白质具有运输 载体的功能。如血 红蛋白、载体蛋白。
血红蛋白
4、调节生命活动:有 些蛋白质起信息传递 的作用,能够调节机 体的生命活动,如胰 岛素、生长激素。
