南昌大学无机化学题库
无机化学试题及答案

无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种元素是地壳中含量最多的元素?A. 氧B. 硅C. 铝D. 铁2. 根据元素周期表,以下哪个元素属于第ⅥA族?A. 碳B. 硫C. 氧D. 氮3. 以下哪种化合物属于共价化合物?A. NaClB. CaOC. H2OD. Fe3O44. 氧化还原反应中,失去电子的物质被称为:A. 还原剂B. 氧化剂C. 被还原物D. 被氧化物5. 以下哪种金属的活泼性最强?A. 锂B. 钠C. 钾D. 钙二、填空题(每空2分,共20分)6. 元素周期表中,第______周期的元素最多。
7. 离子键是由______和______之间的电荷吸引力形成的。
8. 原子半径从左到右在周期表中通常______,从上到下通常______。
9. 酸碱中和反应的实质是______。
10. 根据鲍林规则,一个原子周围可以有______个最邻近的原子。
三、简答题(每题10分,共30分)11. 简述什么是路易斯酸碱理论。
12. 描述一下什么是配位化合物,并给出一个例子。
13. 解释什么是氧化数,并给出一个具体的例子。
四、计算题(每题15分,共30分)14. 已知反应:2H2 + O2 → 2H2O,如果 1.2摩尔的氢气与氧气反应,计算生成水的摩尔数。
15. 计算硫酸铜(CuSO4)的摩尔质量,并根据题目给出的硫酸铜的质量,计算其摩尔数。
答案一、选择题1. A2. B3. C4. A5. C二、填空题6. 六7. 正离子,负离子8. 减小,增大9. 氢离子(H+)与氢氧根离子(OH-)结合生成水10. 4三、简答题11. 路易斯酸碱理论认为,酸是能够接受电子对的物质,碱是能够提供电子对的物质。
12. 配位化合物是由一个中心金属原子或离子与若干个配体通过配位键结合形成的化合物。
例如,[Cu(NH3)4]SO4,其中铜离子是中心金属离子,氨分子是配体。
13. 氧化数是指在化合物中,原子的电荷状态,通常用正负数表示。
无机化学下试题库及答案

无机化学下试题库及答案一、选择题1. 下列元素中,属于碱金属元素的是:A. NaB. MgC. AlD. Si答案:A2. 以下化合物中,属于共价化合物的是:A. NaClB. H2OC. MgOD. NaOH答案:B3. 根据周期表,下列元素中原子半径最大的是:A. LiB. BeC. CD. N答案:A二、填空题1. 请写出下列化合物的化学式:- 水:H2O- 硫酸:H2SO4- 碳酸钙:CaCO32. 请填写下列元素的电子排布:- 钠(Na):1s² 2s² 2p⁶ 3s¹- 氧(O):1s² 2s² 2p⁴- 铁(Fe):[Ar] 3d⁶ 4s²三、简答题1. 什么是离子键?请举例说明。
离子键是由正离子和负离子之间的静电吸引力形成的化学键。
例如,NaCl中的钠离子(Na⁺)和氯离子(Cl⁻)之间就形成了离子键。
2. 什么是共价键?请举例说明。
共价键是由两个原子共享一对电子形成的化学键。
例如,H2O中的氢原子(H)和氧原子(O)之间就形成了共价键。
四、计算题1. 计算1摩尔H2O的摩尔质量。
水的摩尔质量为18.015 g/mol,因此1摩尔H2O的质量为18.015克。
2. 计算1摩尔NaCl中Na⁺和Cl⁻离子的摩尔数。
由于NaCl是一个离子化合物,1摩尔NaCl中包含1摩尔Na⁺离子和1摩尔Cl⁻离子。
五、实验题1. 描述如何通过实验确定溶液的酸碱性。
可以通过使用pH试纸或pH计来确定溶液的酸碱性。
将试纸浸入溶液中,然后与标准色卡比较,或者使用pH计直接测量溶液的pH值。
2. 描述如何制备硫酸铜晶体。
将硫酸铜溶液加热至饱和状态,然后冷却溶液至室温,硫酸铜晶体会逐渐析出。
大学《无机化学》期末复习题库及答案

第1章气体一、单选题1、某气体AB,在高温下建立下列平衡∶AB(g)==A(g)+B(g).若把1.00mol此气体在T=300K,P=101 kPa下放在某密闭容器中,加热到600K时,有25.0%解离。
此时体系的内部压力(kPa)为( )A.253 B.101 C.50.5 D.1262、一敞口烧瓶在7℃时盛满某种气体,欲使1/3 的气体逸出烧瓶,需加热到()A.100℃B.693 ℃C.420 ℃D.147 ℃3、实际气体和理想气体更接近的条件是( )A.高温高压 B. 低温高压 C. 高温低压 D. 低温低压4、A,B两种气体在容器中混合,容器体积为V,在温度T下测得压力为P,V A ,V B 分别为两气体的分体积,P A ,P B 为两气体的分压,下列算式中不正确的一个是( )A. PV A = n A RTB. P A V A =n A RTC. P A V= n A RVD. P A (V A+V B )= n A RT,在一定温度下发生反应:5、某容器中加入相同物质的量的NO和Cl2NOCl(g)。
平衡时,各物种分压的结论肯定错误的是NO(g)+1/2Cl2()) B. P(NO)=P(NOCl)A. P(NO)=P(Cl2) D. P(NO)>P(NOCl)C. P(NO)<P(Cl26、The height of a column of liquid supported by atmospheric pressure is inversely proportional to the density of the liquid. Mercury has a density of 13.6 g/mL. How high a column of water (density = 1.00g/mL) would be supported by an atmospheric pressure of 0.876 atm? ( )A. 9.05×103 mmB. 1.03×104 mmC. 49.0 mm7、If you purchase a balloon filled with helium and take it outside on a cold day, you will notice that it shrinks and becomes less buoyant. What gas law explains this observation? ( )A. Boyle'sB. Charles'sC. Avogadro'sD. Graham's8、A sample of gas occupies 10.0 L at 50°C. Assuming that pressure is constant, what volume will the gas occupy at 100°C?( )A. 10.0 LB. 20.0 LC. 11.5 LD. 5.0 L9、What is the Charles's law constant (in L/K) for 200 mg of carbon dioxide at 600 mm pressure? ( )A. 4.73 10–4 L/KB. 5.64 10–3 L/KC. 42.0 L/KD. 2.11 103 L/K10、At a given temperature and pressure, which gas occupies the smallest volume per unit mass? ( )A O2B. ArC. CO2D. Xe11、At what temperature (in °C) will 25.0 g of carbon dioxide (at1.00 atm) occupy. ( )A. 188°CC. –263°CD. –270°C12、What is the molar mass of a gas that has a density of 3.11 g/L at 100°C and 1.50 atm pressure? ( )A. 0.152 g/molB. 95.2 g/molC. 17.0 g/molD. 63.5 g/mol13、What volume of Ngas would be produced by the decomposition of2solid? (Assume that the gas is produced at 1.00 atm35.0 g NaN3pressure and 150°C.)( )A 28.0 LB. 9.95 LC. 18.7 LD. 56.1 L14、At what temperature would CO2 gas have the same average molecular speed as O2 gas has at 400 K? ( )A. 250 KB. 550 KC. 400 KD. 600K15、How much faster does nitrogen escape from the balloon than oxygen? ( )A. 1.07 times fasterB. 1.14 times fasterC. 0.875 times as fastD. 0.935 times as fast二、判断题(判断下列各项叙述是否正确,对,打“√”;错,打“×”。
《无机化学》考研复习题库(五套)-各校通用

D. pA = nRT/VA
12.气相反应 A(g)=B(g),某温度时 GA = GB ,则相应温度下该反应的平衡常数( )。
A. K = 0
B. K = 1 C. K = 10
D.无法确定
13.反应 PCl5(g) =PCl3(g)+ Cl2(g)平衡时 PCl5 分解率为 50%,平衡后体系总压力为 p,
A. 恒温下,增加反应物浓度;
B. 升高温度;
C. 恒温下,加催化剂;
D. 恒温下,改变总压力
4. H2 (g)+Br2 (g) 是:( )
2HBr(g) 在 800K 时 Kθ=3.8×105,1000K 时 Kθ=1.8×103,则此反应
A. 吸热反应; B. 放热反应;C. 无热效应的反应; D. 无法确定是吸热反应还是放热反 应
A. ClO2﹣、 PCl3、SO2 C. NO3﹣ 、 CO32﹣、 BCl3
B. NO3﹣、SO3、CO32﹣ D. CO2、H2O、NH3
9.Cu2+ CuCl 0.137 Cu
Cu2+ 0.158 Cu+ 0.522 Cu
Cu(OH)2 -0.080 Cu2O –0.358 Cu
A.①②③⑤B.①②③④C Nhomakorabea②③④⑥
D.③④⑤⑥
7. 依照酸碱电子理论,反应 Ag++2NH3=Ag(NH3)2+中(
)。
A.Ag+是酸,NH3 是碱
B. Ag(NH3)2+是酸碱配合物
C.Ag+是盐,NH3 是配位体
D. Ag(NH3)2+是盐
8. 下列各组分子或离子,中心原子都为 sp2 杂化的是( )
无机化学考试题库及答案

无机化学考试题库及答案一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数是2?A. 氢B. 氦C. 锂D. 铍答案:B2. 元素周期表中,第IA族元素的共同特征是什么?A. 最外层电子数为1B. 最外层电子数为2C. 最外层电子数为3D. 最外层电子数为4答案:A3. 哪种化合物的化学式是H2O?A. 氢气B. 氧气C. 水D. 过氧化氢答案:C4. 以下哪种元素属于过渡金属?A. 钠B. 铁C. 氧D. 氩5. 哪种化合物是共价化合物?A. NaClB. MgOC. HClD. Fe2O3答案:C6. 以下哪种元素的电子排布是1s2 2s2 2p6 3s2 3p6?A. 碳B. 氧C. 镁D. 硫答案:C7. 哪种元素的原子半径在所有元素中最大?A. 氢B. 铯C. 氧D. 氦答案:B8. 哪种化合物的化学式是CO2?A. 一氧化碳B. 二氧化碳C. 一氧化氮D. 二氧化氮答案:B9. 以下哪种元素的电负性最高?B. 氧C. 氮D. 碳答案:A10. 哪种化合物是离子化合物?A. H2B. O2C. NaClD. CH4答案:C二、填空题(每题2分,共20分)1. 元素周期表中,第______周期的元素数量最多。
答案:六2. 元素的原子序数决定了其在周期表中的______。
答案:位置3. 元素周期表中,第VIII族元素被称为______。
答案:铁系元素4. 元素的电子排布遵循______原理。
答案:泡利不相容5. 元素周期表中,第VA族元素的最外层电子数为______。
答案:56. 元素的电负性是指______对电子的吸引力。
答案:原子核7. 元素周期表中,第IA族元素被称为______。
答案:碱金属8. 元素的原子半径随着周期数的增加而______。
答案:减小9. 元素周期表中,第IB族元素被称为______。
答案:铜系元素10. 元素的电负性随着周期数的增加而______。
答案:增加三、简答题(每题10分,共20分)1. 描述元素周期表的结构和元素的排列规律。
无机化学试题库及答案

无机化学试题库及答案一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 钾答案:A2. 氢氧化钠的化学式是:A. NaOHB. NaClC. H2OD. Na2O答案:A3. 以下化合物中,哪一个是酸性氧化物?A. CO2B. Na2OC. CaOD. H2O答案:A4. 以下哪种元素属于卤素?A. 氧B. 氮C. 氟D. 碳答案:C5. 以下化合物中,哪一个是共价化合物?A. NaClB. H2OC. NaOHD. MgO答案:B6. 以下哪种金属的密度大于水?A. 钠B. 钾C. 铝D. 铜答案:C7. 以下哪种化合物是离子化合物?A. CO2B. H2OC. NaClD. CH4答案:C8. 以下哪种元素的原子序数为26?A. 铁B. 钴C. 镍D. 锌答案:A9. 以下哪种化合物是碱性氧化物?A. CO2B. Na2OC. CaOD. H2O答案:B10. 以下哪种元素的原子序数为30?A. 锌B. 镓C. 锗D. 砷答案:C二、填空题(每题2分,共20分)1. 元素周期表中,第____周期的元素数量最多。
答案:六2. 元素周期表中,第____族的元素都是金属元素。
答案:三3. 化合物H2SO4的俗名是____。
答案:硫酸4. 化合物NaCl的俗名是____。
答案:食盐5. 元素周期表中,第____族的元素都是非金属元素。
答案:七6. 化合物NH3的俗名是____。
答案:氨7. 元素周期表中,第____周期的元素数量最少。
答案:一8. 化合物H2O的俗名是____。
答案:水9. 元素周期表中,第____族的元素都是稀有气体。
答案:零10. 化合物CO2的俗名是____。
答案:二氧化碳三、简答题(每题10分,共40分)1. 请简述什么是离子键,并举例说明。
答案:离子键是由正负离子之间的静电吸引力形成的化学键。
例如,NaCl中的钠离子(Na+)和氯离子(Cl-)之间就是通过离子键结合在一起的。
南昌大学无机化学06年无机真题

南昌大学2006年攻读硕士学位研究生入学考试试题报考专业:____ 化学___考试科目:_______无机化学______ ( A )一、选择题1.水的三相点是-------------------------------------------------------------------------------( )(A)冰、水和水蒸气三相平衡时的温度(B)水的蒸气压和冰的蒸气压相等时的温度(C)标准压力下水和冰的平衡温度(D)水的冰点2.体积为V2的绝热器,由A、B两部分组成,A的体积为V1,装有温度为T1的1 mol的理想气体,B为真空,打开中间阀门形成新的平衡。
下列不正确的是----()(A) T I= T2 (B) ΔU = 0 (C) ΔS= Rln(V1/V2) (D) ΔS=03.下列反应中释放能量最大的是………………………………………………()(A) CH4(l) + 2O2(g)CO2(g) + 2H2O(g)(B) CH4(g) + 2O2(g)CO2(g) + 2H2O(g)(C) CH4(g) + 2O2(g)CO2(g) + 2H2O(l)(D) CH4(g) +O2(g)CO(g) + 2H2O(l)4.某反应的标准摩尔Gibbs函数变化在773 K时为1.00 kJ·mol-1,在此温度下反应的标准平衡常数是…………………………………………………………()(A) 0.856 (B) 1.17 (C) 1.00 (D) 1.275.用Nernst方程式计算Br2/Br-电对的电极电势,下列叙述中正确的是………()(A) Br2的浓度增大,增大(B) Br-的浓度增大,减小(C) H+浓度增大,减小(D)温度升高对无影响6.在[Co(en)(C2O4)2]配离子中,中心离子的配位数为………………………()(A) 3 (B) 4 (C) 5 (D) 67.从锰在酸性溶液中的元素电势图MnO─── MnO─── MnO2─── Mn3+─── Mn2+──── Mn可以看出,在酸性介质中会发生歧化反应的物质是…………………………()(A) MnO(B) MnO(C) MnO2(D) Mn2+8.方程式Zn + HNO3Zn(NO3)2+ NH4NO3+H2O配平后,HNO3的计量数是()(A) 4 (B) 7 (C) 10 (D) 129.按照质子理论,下列物种中没有共轭碱的是…………………………………()(A) SO42-(B) HSO4-(C) H2SO4(D) H3SO4+10. La2(C2O4)3的饱和溶液的溶解度为1.1⨯ 10-6mol·L-1,其溶度积为…………()(A) 1.2⨯ 10-12(B) 1.7⨯ 10-28(C) 1.6⨯ 10-3 (D) 1.7⨯ 10-1411.在300 K时,反应(1)的K p值为2.46,则反应(2)的K p值为………………………()(1) NO2(g)N2O4(g)(2) 2NO2(g)N2O4(g)(A) 6.05 (B) 4.92 (C) 2.46 (D) 1.5712.苯的熔化热为10.67 kJ·mol-1,其熔点为5.0℃,则苯熔化过程的约为()(A) 2.09 J·mol-1·K-1(B) 10.88 J·mol-1·K-1(C) 38.38 J·mol-1·K-1(D) 54.39 J·mol-1·K-113.可逆反应PCl5(g)PCl3(g) + Cl2(g)在密闭容器中进行,放热反应.当达到平衡时,下列说法正确的是---------------------------------------------------------------()(A)温度不变,加入催化剂,使平衡向右移动(B)保持体积不变,加入氮气使压力增加1倍,平衡向右移动(C)不论条件如何变化,平衡不移动(D)降低温度,平衡向右移动14. 下列各混合溶液中,具有缓冲作用的是………………………………………()(A) HCl (1 mol·L-1) + NaAc (2 mol·L-1)(B) NaOH (1 mol·L-1) + NH3 (1 mol·L-1)(C) HCl (1 mol·L-1) + NaCl (1 mol·L-1)(D) NaOH (1 mol·L-1) + NaCl (1 mol·L-1)15.下列反应的平衡常数可以用K p= 1/表示的是……………………………()(A) H2(g) + S(g)H2S(g) (B) H2(g) + S(s)H2S(g)(C) H2(g) + S(s)H2S(l) (D) H2(l) + S(s)H2S(s)二、填空题1.在下表变化方向栏内用箭头指示变化方向:序号可逆反应操作变化方向(1) 2SO2(g) + O2(g)2SO3(g) <0 加热( )(2) C(s) + H2O(g)CO(g) + H2(g) >0 冷却( )(3) NH4Cl(s)NH3(g) + HCl(g) >0 加压( )(4) N2O4(g)2NO2(g) <0 减压( )2. Pt│Fe2+(1 mol·L-1), Fe3+(1 mol·L-1)‖Ce4+(1 mol·L-1), Ce3+(1 mol·L-1)│Pt,该原电池正极发生电极反应式__________;负极发生电极反应式__________;电池反应__________.3.用AgNO3和KI溶液制备AgI溶胶, KI过量时,胶核带_________电荷,胶团表示为________________________。
大一无机化学试题及答案

大一无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,属于金属元素的是:A. 碳B. 氧C. 铁D. 硫答案:C2. 原子的化学符号为Hg,其原子序数是:A. 80B. 81C. 82D. 83答案:C3. 以下化合物中,属于共价化合物的是:A. NaClB. H2OC. NaOHD. MgO答案:B4. 元素周期表中,第IA族元素的价电子数为:A. 1B. 2C. 3D. 4答案:A5. 根据元素周期律,下列元素中,原子半径最大的是:A. NaB. MgC. AlD. Si答案:A6. 化合物Na2O2中,氧元素的化合价是:A. -1B. -2C. +1D. +2答案:C7. 以下化合物中,属于离子化合物的是:A. CO2B. H2OC. NaClD. N2答案:C8. 元素周期表中,第VIIA族元素的价电子数为:A. 7B. 6C. 5D. 4答案:A9. 下列化合物中,属于酸的是:A. H2SO4B. NaClC. NaOHD. H2O答案:A10. 根据元素周期律,下列元素中,电负性最大的是:A. FB. ClC. BrD. I答案:A二、填空题(每题2分,共20分)1. 元素周期表中,第IIA族元素的价电子数为______。
答案:22. 化合物H2SO4中,硫元素的化合价为______。
答案:+63. 元素周期表中,第VIII族元素的价电子数为______。
答案:84. 化合物NaCl中,钠离子的符号为______。
答案:Na+5. 元素周期表中,第VIA族元素的价电子数为______。
答案:66. 化合物H2O中,氧元素的化合价为______。
答案:-27. 元素周期表中,第IIIB族元素的价电子数为______。
答案:38. 化合物Mg(OH)2中,镁离子的符号为______。
答案:Mg2+9. 元素周期表中,第IVA族元素的价电子数为______。
答案:410. 化合物NH4Cl中,铵根离子的符号为______。
南昌大学《无机化学》期末试卷

南昌大学《无机化学》期末试卷2018年南昌大学无机化学期末试卷(专题型版)(一)一.是非题:1.化学变化有新物质产生,而物理变化无新物质产生.2.化学变化是由于构成分子的原子外层电子运动状态的改变而引起的、原子核不变的一类变化3.元素的变化为物理变化而非化学变化.4.化学变化的特点是原子核不变分子组成或原子间结合方式发生变化.5.化学反应常伴有发光现象,但并非所有的发光现象都属于化学反应.二.选择题:1.化学研究的对象是具有宏观实体的物质,它不包括A.希有气体B:混合物C.电子流或γ──射线D.地球外的物质2.纯的无机物不包括A.碳元素B.碳化合物C.二者都对D.二者都错3.下列哪一过程不存在化学变化A.氨溶于水B.蔗糖溶在水中C.电解质溶液导电D.照相底片感光(二)一.是非题1.电子在原子核外运动的能量越高,它与原子核的距离就越远.任何时候,1s电子总比2s电子更靠近原子核,因为E2s>E1s.2.原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道.3.氢原子中,2s与2p轨道是简并轨道,其简并度为4;在钪原子中,2s 与2p轨道不是简并轨道,2p x,2p y,2p z为简并轨道,简并度为3.4.从原子轨道能级图上可知,任何原子在相同主量子数的轨道上,能量高低的顺序总是f>d>p>s;在不同主量子数的轨道上,总是(n-1)p>(n-2)f>(n-1)d>ns.5.在元素周期表中,每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数.6.所有非金属元素(H,He除外)都在p区,但p区所有元素并非都是非金属元素.7.就热效应而言,电离能一定是吸热的,电子亲和能一定是放热的.8.铬原子的电子排布为Cr[Ar]4s13d5,由此得出:洪特规则在与能量最低原理出现矛盾时,首先应服从洪特规则.9.s区元素原子丢失最外层的s电子得到相应的离子,d区元素的原子丢失处于最高能级的d电子而得到相应的离子.10.在原子核里因质子数和中子数不同,就组成了不同的核素;同样在原子核里因质子数和中子数不等,就构成了同位素.可见,核素也就是同位素.二.选择题1.玻尔在他的原子理论中A.证明了电子在核外圆形轨道上运动;B.推导出原子半径与量子数平方成反比;C.应用了量子力学的概念和方法;D.解决了氢原子光谱和电子能量之间的关系问题.2.波函数和原子轨道二者之间的关系是A.波函数是函数式,原子轨道是电子轨迹;B.波函数和原子轨道是同义词;C.只有轨道波函数与原子轨道才是同义的;D.以上三种说法都不对.3.多电子原子的原子轨道能级顺序随着原子序数的增加A.轨道能量逐渐降低,但能级顺序不变;B.轨道能量基本不变,但能级顺序改变;C.轨道能量逐渐增加,能级顺序不变;D.轨道能量逐渐降低,能级顺序也会改变.4.周期表中各周期元素数目是由什么决定的A.2n2(n为主量子数);B.相应能级组中所含轨道总数;C.相应能级组中所含电子总数D.n+0.7规则5.下列电子构型中,电离能最低的是A.ns2np3B.ns2np4C.ns2np5D.ns2np66.下列元素中,第一电离能最大的是A.BB.CC.AlD.Si7.原子光谱中存在着不连续的线谱,证明了A.在原子中仅有某些电子能够被激发B.一个原子中的电子只可能有某些特定的能量状态C.原子发射的光,在性质上不同于普通的白光D.白光是由许许多多单色光组成.8.原子轨道中"填充"电子时必须遵循能量最低原理,这里的能量主要是指A.亲合能B.电能C.势能D.动能9.下列哪一原子的原子轨道能量与角量子数无关?A.NaB.NeC.FD.H10.下列哪一种元素性质的周期规律最不明显A.电子亲合能B.电负性C.电离能D.原子体积11.用来表示核外某电子运动状态的下列各组量子数(n l m ms)中哪一组是合理的?A.(2,1,-1,-1/2)B.(0,0,0,+1/2)C.(3,1,2,+1/2)D.(2,1,0,0)12.元素和单质相比较时,正确的说法是A.元素由单质构成;B.元素可分解为单质;C.元素的质量比单质的质量重;D.单质是元素存在的一种形式.13.核素和同位素的相同点是A.它们中的质子数均大于中子数;B.它们中的质子数均小于中子数;C.它们中的质子数和中子数相等;D.它们各自含有相同的质子数.14.关于核素的正确说法是A.具有一定数目的核电荷的一种原子;B.具有一定数目的质子的一种原子;C.具有一定数目的中子的一种原子;D.具有一定数目的中子和一定数目的质子的一种原子.15.测定原子量最直接的方法是A.质谱法B.化合量法C.气体密度法D.α─粒子散射法三.填空题:1.宏观物体的运动可用方程F=ma描述,但微观物体的运动要用量子力学中的()描述.它是一个偏微分方程式.2主量子数为4的一个电子,它的角量子数的可能取值有()种,它的磁量子数的可能取值有()种.3.在氢原子中,4s和3d轨道的能量高低为(),而在19号元素K和26号元素Fe 中,4s和34轨道的能量高低顺序分别为()和().4.填上合理的量子数:n=2,l=(),m=(),ms=+1/2.5.+3价离子的电子层结构与S2-离子相同的元素是().6.微观粒子运动与宏观物质相比具有两大特征,它们是()和(),说明微观粒子运动特点的两个重要实验是().7.ψn,l,m是(),当n,l,m,一定时,处于ψn,l,m状态的一个电子的(),(),()可以确定.n,l,m可以确定一个().8.氢原子的电子能级由()决定,而钠原子的电子能级由()决定.9.Mn原子的价电子构型为(),用四个量子数分别表示每个价电子的一定状态,是().10.在电子构型a.1s22s2,b.1s22s22p54s1,c.1s22s12p13d13s1,d.1s22s22p63s13d 1,e.1s22p2,f.1s22s32p1,g.1s12s22p13d1中,属于原子基态的是(),属于原子激发态的是(),纯属错误的是().11.用元素符号填空:(均以天然存在为准)原子半径最大的元素是(),第一电离能最大的元素是(),原子中3d半充满的元素是(),原子中4p半充满的元素是(),电负性差最大的两个元素是(),化学性质最不活泼的元素是().四.简答题1.第114号元素属于第几周期?第几族?2.为什么碳(6C)的外围电子构型是2s22p2,而不是2s12p3,而铜(29Cu)的外围电子构型是3d104s1,而不是3d94s2?3、气体常数R是否只在气体中使用?五.综合题1.某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答:(1).该元素的原子序数,符号,所处周期和族;(2).写出表示全部价电子运动状态的四个量子数;(3).该元素最高价氧化物水合物的分子式及酸碱性.2.某元素原子序数为33,试问:(1).此元素原子的电子总数是多少?有多少个未成对电子?(2).它有多少个电子层?多少个能级?最高能级组中的电子数是多少?(3).它的价电子数是多少?它属于第几周期?第几族?是金属还是非金属?最高化合价是几?3.写出原子序数为24的元素的名称,符号及其基态原子的电子排布式,并用四个量子数分别表示每个价电子的运动状态.(三)一.是非题:1、两原子间可以形成多重键,但两个以上的原子间不可能形成多重键。
无机化学下试题库及答案

无机化学下试题库及答案一、选择题(每题2分,共20分)1. 下列元素中,属于碱金属的是:A. 锂B. 钠C. 钾D. 钙答案:A2. 以下化合物中,不属于共价化合物的是:A. 氯化钠B. 氯化氢C. 硝酸D. 硫酸答案:A3. 金属元素的原子半径通常随着原子序数的增加而:A. 增加B. 减少C. 先增加后减少D. 先减少后增加答案:A4. 以下哪种物质是强酸:A. 醋酸B. 碳酸C. 硫酸D. 硼酸答案:C5. 根据元素周期表,下列元素中属于第VIII族的是:A. 铁B. 镍C. 钴D. 铜答案:B6. 以下哪种元素的氧化物不是碱性氧化物:A. 钠B. 镁C. 铝D. 锌答案:D7. 以下化合物中,属于离子晶体的是:A. 二氧化碳B. 氯化钠C. 氮气D. 甲烷答案:B8. 以下哪种元素的原子最外层电子数为8:A. 氦B. 氖C. 氩D. 氪答案:B9. 以下哪种化合物是两性化合物:A. 碳酸钠B. 氧化铝C. 硫酸钠D. 氯化钠答案:B10. 以下哪种元素的原子半径最大:A. 氢B. 锂C. 钠D. 钾答案:D二、填空题(每空1分,共20分)1. 元素周期表中,第IA族元素的原子最外层电子数为________。
答案:12. 根据元素周期律,同一主族元素的原子半径随着原子序数的增加而________。
答案:增加3. 金属元素通常具有________价。
答案:正4. 非金属元素通常具有________价。
答案:负5. 金属与非金属元素之间形成的化合物通常属于________化合物。
答案:离子6. 元素的氧化态是指元素在化合物中的________。
答案:电荷状态7. 元素周期表中,第VIIA族元素的原子最外层电子数为________。
答案:78. 元素周期表中,第VIII族元素的原子最外层电子数为________。
答案:89. 元素的电负性是指元素吸引________的能力。
答案:电子10. 元素周期表中,第IVA族元素的原子最外层电子数为________。
大学无机化学练习题

大学无机化学练习题一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 硅2. 根据周期表,下列元素中属于第ⅦA族的元素是:A. 氟B. 氯C. 溴D. 碘3. 原子半径最大的元素是:A. 氢B. 氦C. 氖D. 氩4. 以下化合物中,属于共价化合物的是:A. NaClB. MgOC. H2OD. NaOH5. 根据鲍林规则,下列分子中具有平面三角形结构的是:A. CO2C. SO3D. CO3^2-6. 以下离子中,具有+2价的是:A. K+B. Ca2+C. Fe2+D. Cu2+7. 根据路易斯理论,下列分子中具有孤对电子的是:A. N2B. O2C. F2D. Cl28. 以下化合物中,属于离子晶体的是:A. 金刚石B. 石墨C. NaClD. 干冰9. 根据电负性,下列元素中电负性最大的是:A. 氟B. 氧C. 氮D. 碳10. 以下元素中,属于过渡金属的是:A. 钠B. 铁D. 锌二、填空题(每空2分,共20分)11. 根据原子核外电子的排布规律,氦原子的电子排布式为________。
12. 元素周期表中,第ⅥA族元素的通式为________。
13. 根据离子半径的比较规则,具有相同电子层结构的离子中,核电荷数越大,离子半径越________。
14. 根据鲍林的共振理论,苯分子的共振式为________。
15. 根据酸碱质子理论,酸是能够________的物质,碱是能够________的物质。
16. 根据配位化学中的命名规则,[Cu(NH3)4]2+的名称为________。
17. 根据氧化还原反应的定义,氧化剂是能够________的物质,还原剂是能够________的物质。
18. 根据晶体学中的点阵类型,NaCl晶体属于________点阵。
19. 根据化学动力学,反应速率常数k与反应物浓度的关系为________。
20. 根据热化学方程式,焓变ΔH与反应物和生成物的热力学性质有关,其表达式为________。
大学无机化学试题及答案(DOC)

无机化学试题一、选择题1.对于H2O2和N2H4,下列叙述正确的是…………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2.下列含氧酸中属于三元酸的是…………………………………………………()(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43.下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34.铝在空气中燃烧时,生成…………………………………………………………()(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5.下列含氧酸根中,属于环状结构的是…………………………………………()(A) (B) (C) (D)6.下列化合物与水反应放出HCl 的是……………………………………………()(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. InCl2为逆磁性化合物,其中In的化合价为……………………………………()(A) +1 (B) +2 (C) +3 (D) +1和+38.鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9.下列各组化合物中,都有颜色的一组化合物是………………………………()(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS10.将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11.将NCl3通入碱性溶液,其水解产物是…………………………………………()(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12.PCl3和水反应的产物是…………………………………………………………()(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13.下列各对物质,水解能力对比,正确的是………………………………………()(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314.二氧化氮溶解在NaOH溶液中可得到:(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15.下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题16.N2O3很容易分解为和。
《无机化学》试题库

《无机化学》试题库试题一一、填空(每小题2分,共20分)1、相同质量的同一种物质的不同聚集状态所具有的能量,以气态最高,次之,______ 最低;2、ImolH 2SO4中含氧原子数=个;3、当正反应的活化能小于逆反应的活化能时,反应(吸热或放热);4、对于可逆反应N2+ 3H2 == 2NH3,其实验平衡常数表达式为K C=;5、酸碱质子理论定义:凡是的物质都是酸;6、BaSO4的溶度积K SP与溶解度S (mol • L-1)之间的换算关系为K SP=;7、共价键具有饱和性与性;8、一个H2O分子与一个HF分子之间存在四种分子间力,即:、取向力、诱导力;9、借助氧化还原反应产生电流的装置称为 ;10、举出常见的可作配位体的分子与离子各两种:。
二、单项选择(每小题2分,共20分)1、气体标准状况的定义中,温度与压力分别为 ;A、T=273K , P=10000PaB、T=298K , P=101325PaC、T=273K , P=101325PaD、T=298K , P=10000Pa2、对于气相平衡2SO2+ O2 == 2SO3 + Q ("+ Q”代表放热),为了提高SO2的转化率, 可以在其它条件不变的情况下, ;B、升温C、加入一些SO2D、加入一些O23、下列各组物质中,不是共轲关系的是一A、H2SO4〜SO42-B、H2O〜OH-4、原子核、外M电子层最多可容纳的电子数为A、2B、185、在H2S、HCl、N2、CI2分子中,既有b键,A、H2sB、HCl6、在Na2s2。
3中,S的氧化数=;A、+4B、+2.57、关于Li、Na、K的性质,下列表述中错误的是—A、Na、K在空气中燃烧,分别生成Na2。
、K2O C、H F 〜F-D、NH3- -NH4+___C、8D、32又有旺键的是 _ ——;C、N2D、C12C、-2D、+2 A、加压并升温B、Na、K通常保存于煤油中C、Li、Na、K可浮于水面D、Na、K在空气中燃烧,不能生成Na2。
《无机化学》考研复习题库-各校通用

《无机化学》考研复习题库-各校通用《无机化学》考研复习题库各校通用无机化学是化学学科的一个重要分支,对于考研的同学来说,掌握好这门课程至关重要。
为了帮助大家更好地复习,以下为大家整理了一份通用的《无机化学》考研复习题库。
一、原子结构与元素周期律1、下列关于氢原子光谱的说法,正确的是()A 氢原子光谱是连续光谱B 氢原子光谱是线状光谱C 氢原子光谱的频率是固定不变的D 氢原子光谱的波长是固定不变的答案:B解析:氢原子光谱是线状光谱,其频率和波长不是固定不变的,而是随着能级的跃迁而变化。
2、下列关于原子轨道的说法,错误的是()A 原子轨道是电子在核外空间出现的概率密度分布的形象化描述B 原子轨道的形状由主量子数和角量子数决定C 原子轨道的能量由主量子数和角量子数决定D 同一原子中,不同电子层的相同类型的原子轨道能量相同答案:D解析:同一原子中,不同电子层的相同类型的原子轨道能量不同,电子层序数越大,能量越高。
3、下列元素中,第一电离能最大的是()A BB CC ND O答案:C解析:同一周期从左到右,元素的第一电离能呈增大趋势,但ⅡA 族和ⅤA 族元素的第一电离能大于相邻元素,所以 N 的第一电离能大于 O。
4、元素的电负性是指()A 原子在分子中吸引电子的能力B 原子形成化学键的能力C 原子失去电子的能力D 原子获得电子的能力答案:A解析:元素的电负性是原子在分子中吸引电子的能力,电负性越大,原子吸引电子的能力越强。
5、下列元素中,原子半径最大的是()A LiB BeC BD C答案:A解析:同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大。
二、化学键与分子结构1、下列物质中,含有离子键的是()A HClB H₂OC NaClD CO₂答案:C解析:NaCl 是由钠离子和氯离子通过离子键结合而成的。
2、下列关于共价键的说法,正确的是()A 共价键是由两个原子共用电子对形成的B 共价键一定是极性键C 共价键一定是非极性键D 共价键可以存在于离子化合物中答案:A解析:共价键是由两个原子共用电子对形成的,共价键可以是极性键也可以是非极性键,离子化合物中也可能存在共价键,如 NaOH 中氢氧根内存在共价键。
《无机化学》期末考试试卷及参考答案
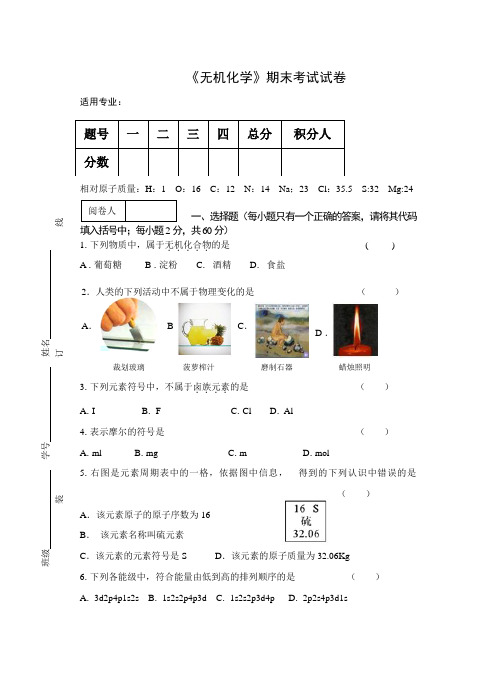
《无机化学》期末考试试卷适用专业:相对原子质量:H :1 O :16 C :12 N :14 Na ;23 Cl :35.5 S:32 Mg:24一、选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题2分,共60分) 1.下列物质中,属于无机化合物.....的是 ( ) A .葡萄糖 B .淀粉 C . 酒精 D . 食盐3.下列元素符号中,不属于卤族元素....的是 ( ) A .I B . F C .Cl D . Al4.表示摩尔的符号是 ( ) A .ml B .mg C .m D .mol5.右图是元素周期表中的一格,依据图中信息, 得到的下列认识中错误的是( )A .该元素原子的原子序数为16B . 该元素名称叫硫元素C .该元素的元素符号是SD .该元素的原子质量为32.06Kg 6.下列各能级中,符合能量由低到高的排列顺序的是 ( ) A . 3d2p4p1s2s B . 1s2s2p4p3d C . 1s2s2p3d4p D . 2p2s4p3d1s题号 一 二 三 四 总分 积分人 分数裁划玻璃A .B 菠萝榨汁C .磨制石器D .蜡烛照明2.人类的下列活动中不属于物理变化的是 ( ) 阅卷人班级 学号 姓名 - -------------------------------------装--------------------------------------------订---------------------------------------线-------------------------------------7. 5.5 mol 水的质量是 ( ) A . 18g B . 9g C . 99g D . 108g( )9.在标准状况下,任何气体的标准摩尔体积都是 ( ) A . 2.24L B . 11.2L C . 22.4L D . 224L10.下列物质的分子中属于极性分子的是 ( ) A . CO 2 B . O 2 C . HCl D . I 211.NaOH 的摩尔质量是 ( ) A . 4g B . 40 g/mol C . 40 Kg D . 28 mol12.在0.0001 mol/L 的NaOH 溶液中H +浓度为 ( ) A .10-4 mol/L B .10-10 mol/L C . 10-14 mol/L D .10-7mol/L14. 196g H 2SO 4的物质的量是 ( ) A .1mol B .2mol C .3mol D . 0.2mol 15. 浓度为0.01 mol/L 的稀盐酸的pH 是 ( ) A . 7 B . 2 C . 4 D . 816. 在标准状况下44.8L N 2气体的物质的量是 ( ) A .2mol B .1mol C .0.5mol D . 0.2mol17.配制250mL0.1mol/L 的NaOH 溶液需要NaOH 的质量是 ( ) A . 1g B . 10g C . 0.1g D .4gA . 试管B .烧瓶 D . 锥形C .容量瓶8.配制一定物质的量的浓度的溶液应选用的主要仪器是13.下列图像中不是..p 亚层电子云的是 ( ) A.C .B.D.19.配制250mL0.1mol/L 的NaCl 溶液应该选用的容量瓶的规格是 ( ) A . 250 mL B .200mL C . 100mL D . 500mL 20. 0.5mol 的水中含有的水分子个数是 ( ) A .3.01×1023B .6.02×1023C . 1.8×1023D .6.02×102221.标准状况下,与6.4gO 2的分子数目相同的CO 2气体的体积是 ( ) A . 22.4L B .11.2L C .4.48L D .2.24L22.在纯水中pH=7的原因是纯水 ( ) A . [H +]﹥[OH -] B . [H +]﹤[OH -] C . [H +]=[OH -] D .只有[H +] 无[OH -] 23.阿伏伽德罗常数是 A .5×1026B . 3.01×1022C . 6.02×1023D .3.01×1022.24.食盐属于 ( ) A .分子晶体 B .原子晶体 C . 离子晶体 D . 金属晶体 25.物质的量的国际单位是 ( ) A .千克 B .克 C .摩尔 D . 米27.非极性分子与非极性分子之间的作用力主要是 ( ) A .取向力 B .诱导力 C .色散力 D . 氢键28.在通常情况下,水的离子积常数.....是 ( ) A . 1×10-8B .1×10-7C .1×10-14D .1×10-1018.下图是元素周期表中某元素的原子结构示意图, ( ) 依据图中信息所得的结论错误的是 A .该元素的原子很容易得到电子 B .C. 该元素在第一主族 D . 该元素是碱金属元素v26.如图表示某可逆反应的化学平衡建立过程,下 列对于图像中的意义分析有错误的是A . 正反应速率在不断的减小B . 逆反应速率不断增大C .达到平衡时正反应和逆反应都停止,速率都为零D .达化学平衡时正、逆反应速率相等,29.某可逆反应的逆反应的平衡常数K 逆为4,则正反应的平衡常数K 正为( ) A .0.25 B .10 C .2 D .530. 金属铝属于 ( ) A . 原子晶体 B . 分子晶体 C .金属晶体 D .离子晶体 二、判断题(正确的打“√”,错误的打“×”;每小题1分,共10分)31.元素周期表中同一周期的元素随着原子序数的递增原子的半径由大变小 ( ) 32.元素周期表中同一主族的元素原子的最外层电子数一定相等 ( ) 33.分子是否有极性取决于整个分子中正负电荷的重心是否重合 ( ) 34.氧化还原反应的特征是有元素化合价的升降 ( ) 35. 强酸弱碱盐水解,溶液呈酸性 p H ﹤7 ( ) 36. 原电池是一种将电能转变为化学能的装置 ( ) 37. 物质的量就是指物质的质量 ( )38. 酸性溶液中[OH -]﹥[H +]﹥1×10-7mol/L ( ) 39.电子云图中的一个小黑点就代表一个电子. ( )40. 在NaAc-HAc 组成的缓冲溶液 中抗酸成分是HAc ( ) 三、填空题(每空1分,共10分)41. 硫酸四氨合铜(Ⅱ)的化学式是 。
无机化学(上)_南昌大学中国大学mooc课后章节答案期末考试题库2023年

无机化学(上)_南昌大学中国大学mooc课后章节答案期末考试题库2023年1.已知 2PbS(s) + 3O2(g) = 2PbO(s) + 2SO2(g) 【图片】= -843.4 kJ·mol-1则该反应的QV值是…………………………………………………()参考答案:-840.92.ClO3F分子的几何构型属于………………………………………………………… ( )参考答案:四面体形3.由图可知下述描述正确的是………………………………………………………… ()参考答案:反应的焓变为 -y4.H2(g) +O2(g)H2O(l) 的Qp与QV之差(kJ·【图片】)是………………………()参考答案:-3.75.极化能力最强的离子应具有的特性是……………………………………………… ()参考答案:离子电荷高、离子半径小6.下列分子中含有两个不同键长的是………………………………………………… ()参考答案:SF47.如果体系经过一系列变化,最后又变到初始状态,则体系的………………………()参考答案:Q = W ΔU = Q - W ΔH = 08.某白色固体易溶于水,加入BaCl2有白色沉淀产生,用HCl酸化,沉淀完全溶解,再加入过量NaOH至强碱性,并加热,有刺激性气体逸出。
此白色固体是…………………()参考答案:(NH4)2CO39.在常压下的饱和二氧化碳水溶液中,含碳化合物的浓度最高的是…………………()参考答案:CO210.向含有0.010 mol·dm-3 的【图片】溶液中逐滴加入AgNO3溶液,要求只生成Ag2C2O4沉淀,而又不会生成Ag2O沉淀,则溶液的pH应是……………………………………()参考答案:< 10.411.某溶液中含有KCl、KBr和K2CrO4其浓度均为0.010 mol·dm-3,向该溶液中逐滴加入0.010 mol·dm-3的AgNO3溶液时,最先和最后沉淀的是………………………………()(已知:Ksp(AgCl)= 1.56 ´ 10【图片】,Ksp(AgBr) = 7.7 ´ 10【图片】, Ksp(Ag2CrO4)= 9.0 ´ 10【图片】)参考答案:AgBr和Ag2CrO412.pH为9.40的溶液中氢氧根离子浓度为………………………………………………()参考答案:2.5 ´ 10^-5 mol·dm-313.20cm【图片】0.10 mol·dm-3 HCl和20 cm【图片】0.20 mol·dm【图片】NH3·H2O混合,其pH为(NH3·H2O:Kb = 1.76 ´ 10【图片】)………………………………………………… ()参考答案:9.2514.一定温度下 SO2(g) + NO2(g)【图片】SO3(g) + NO(g) Kc= 0.240 NO2(g)【图片】NO(g) +O2(g) Kc= 0.012则SO3(g)【图片】SO2(g) +O2(g) 的KC为………………………………………………()参考答案:0.05015.某反应的标准摩尔Gibbs自由能变化在773 K时为1.00 kJ·mol-1,在此温度下反应的平衡常数是……………………………………………………………………………()参考答案:0.85616.气体反应 P + Q【图片】R + S 【图片】= -20 kJ·mol-1,若由等物质的量的P、Q开始反应,该温度时平衡混合物中为…………………………()参考答案:P、Q物质的量浓度较小17.下列说法中,正确的是……………………………………………………………… ()参考答案:py和dxy的线性组合形成p 成键轨道和p*反键轨道18.下列化合物中不存在的是…………………………………………………………… ()参考答案:OF619.下列分子或离子中,呈反磁性的是……………………………………………………()参考答案:CO20.CO2是非极性分子,SO2是_________分子,BF3是__________分子,NF3是_________分子,PF5是_________分子。
南昌大学《无机化学》复习重点题库

℃,101.3 kPa 时
等于多少?
2. 3.
4. 5.
6.
试卷
一、单项选择题 1.下列几种溶液中,蒸气压最低的是( )
(A) 1 mol·kg-1 NaCl (C) 1 mol·kg-1 H2SO4
(B) 1 mol·kg-1 HAc (D) 1 mol·kg-1 CO(NH2)2
(A) -67.7
(B) -43.5
(C) 43.5
(D) 99.1
(A)
(B)
(C)
(D)
2.如果体系经过一系列变化,最后又变到初始状态,则体系的( )
(A) Q = 0 (B) Q 0 (C) Q = W
(D) Q W
W = 0 ΔU = 0
W0
ΔU = 0
ΔU = Q - W
ΔU = Q - W
3.已知在 57.0℃,水的蒸气压为 17.3 kPa,将空气通过 57.0℃ 的水,用 排水集气法在 101.3 kPa 下收集 1.0 dm3 气体. (1)若将此气体加压至 202.6 kPa(温度不变),求气体总体积; (2)若将此气体降温至 10 ℃,求气体总体积. (10 ℃ 饱和水蒸气压 为 1226 Pa)
ΔH = 0 ΔH = Q ΔH = 0
ΔH = 0
(A)
(B)
(C)
(D)
3.
(A)
(B)
(C)
(D)
4.
(A)
(B)
(C)
(D)
5.
(A)
(B)
(C)
(D)
6.
(A)
(B)
(C)
(D)
7.
(A)
(B)
(C)
无机化学期末试题题库(130道)

无机化学期末试题1、无机化学研究内容不包括的是()——[单选题]A 物质组成B 结构C 性质D 合成正确答案:D2、某元素处在周期表中的第三周期,该元素原子的电子层数为——[单选题]A 1B 3C 2D 4正确答案:B3、据报道,1995年我国科研人员在兰州首次合成了新核素镤-239,其原子核内有148个中子,则该元素的原子序数为——[单选题]A 148B 239C 91D 108正确答案:C4、不是共轭酸碱对的一组物质是——[单选题]A NH3, NH4+B NaOH, Na+C HS-, S2-D H2O, OH-正确答案:B5、生理盐水的质量浓度为——[单选题]A 4g/LB 9g/LC 15g/LD 50g/L正确答案:B6、2mol MgCl2 和1mol AlCl3中,Cl-的物质的量之比为——[单选题]A 3:2B 2:3C 4:3D 3:4正确答案:C7、物质的量浓度的单位是——[单选题]A mol/LB g/LC 1D g/mol正确答案:A8、下列溶液中渗透压最大的是——[单选题]A 0.1mol·L-1AlCl3B 0.1mol·L-1CaCl2C 0.1mol·L-1葡萄糖(C6H12O6)D 0.1mol·L-1NaCl正确答案:A9、下列说法正确的是——[单选题]A NaCl的质量浓度是0.1mol/LB 水的摩尔质量是18C 1mol H2的质量是2gD 1mol O的质量是32g正确答案:C10、正常人血浆(37˚C时)渗透浓度范围是——[单选题]A 210~280mmol/LB 280~320mmol/LC 280~320mol/LD 380~410mmol/L正确答案:B11、一个电对中,氧化态的氧化能力越强,则其共轭还原态的还原能力——[单选题]A 无法确定B 越强C 越弱D 影响不大正确答案:C12、将12.5g葡萄糖溶于水,配成250mL溶液,该溶液的质量浓度为——[单选题]A 25 g/LB 5.0 g/LC 50 g/LD 0.025 g/L正确答案:C13、决定多电子原子轨道能量的量子数是——[单选题]A n,lB nC lD n,l,m正确答案:A14、正常人血浆(37˚C时)渗透压范围是——[单选题]A 210~280kPaB 720~800kPaC 440~600kPaD 500~1000kPa /L正确答案:B15、下列说法正确的是——[单选题]A p轨道之间以“肩并肩”方式重叠形成σ键B p轨道之间以“头碰头”方式重叠形成π键C p轨道之间以“头碰头”方式重叠形成σ键D s轨道之间以“头碰头”方式重叠形成π键正确答案:C16、基态的电子组态是——[单选题]A [Ar]4s23d4B [Kr]4s23d4C [Ar] 3d54s1D [Xe] 3d54s1正确答案:C17、在氧化还原反应中失去电子的物质是——[单选题]A 氧化剂B 还原剂C 氧化产物D 还原产物正确答案:B18、如果将氮原子的价层电子的运动状态写成为:2,1,0,+1/2; 2, 1,0,-1/2; 2,1,1,+1/2。
大学无机化学试题及答案

大学无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,属于碱金属的是:A. NaB. MgC. AlD. Si答案:A2. 氧化还原反应中,氧化剂和还原剂之间的关系是:A. 氧化剂被还原B. 还原剂被氧化C. 氧化剂被氧化D. 还原剂被还原答案:B3. 根据周期表,下列元素中,原子半径最大的是:A. LiB. NaC. KD. Rb答案:D4. 以下化合物中,属于共价化合物的是:A. NaClB. MgOC. H2OD. NaOH答案:C5. 元素周期表中,元素的电子排布遵循:A. 泡利不相容原理B. 洪特规则C. 能量最低原理D. 所有上述原理答案:D6. 下列反应中,属于酸碱中和反应的是:A. HCl + NaOH → NaCl + H2OB. 2H2 + O2 → 2H2OC. 2Na + Cl2 → 2NaClD. Fe + CuSO4 → FeSO4 + Cu答案:A7. 根据路易斯酸碱理论,下列物质中,属于酸的是:A. H2OB. NH3C. NaOHD. HCl答案:D8. 根据化学计量学,1摩尔任何物质的质量等于:A. 它的相对分子质量B. 阿伏伽德罗常数C. 它的摩尔质量D. 它的原子量答案:C9. 以下化合物中,属于离子化合物的是:A. CO2B. NaClC. CH4D. SO2答案:B10. 根据化学键理论,下列化合物中,属于离子键的是:A. H2B. NaClC. O2D. H2O答案:B二、填空题(每题2分,共20分)1. 元素周期表中,周期数等于电子层数,而族数等于最外层电子数。
2. 氧化还原反应中,失去电子的物质被称为还原剂,而获得电子的物质被称为氧化剂。
3. 元素的电负性是指元素的原子吸引电子对的能力。
4. 金属晶体中,原子通过金属键结合在一起。
5. 路易斯酸碱理论中,酸是能够接受电子对的物质,而碱是能够提供电子对的物质。
6. 根据阿伏伽德罗定律,1摩尔任何气体在标准状态下的体积是22.4升。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
南昌大学研究生院教学档案(专题型题库)课程名称:无机化学参考教材:无机化学(上、下册),武汉大学,高等教育出版社第一专题气体、液体和溶液的性质1. 敞口烧瓶在7℃所盛的气体,必须加热到什么温度,才能使1/3气体逸出烧瓶?2. 已知一气筒在27℃,30.0atm时,含480g的氧气。
若此筒被加热到100℃,然后启开阀门(温度保持在100℃),一直到气体压力降到1.00atm时,共放出多少克氧气?3. 在30℃时,把8.0gCO2、6.0gO2和未知量的N2放入10dm3的容器中,总压力达800 mmHg。
试求:(1) 容器中气体的总摩尔数为多少?(2) 每种气体的摩尔分数为多少?(3) 每种气体的分压为多少?(4) 容器中氮气为多少克?4. CO和CO2的混合密度为1.82g⋅dm-3(在STP下)。
问CO的重量百分数为多少?5. 已知某混合气体组成为:20份氦气,20份氮气,50份一氧化氮,50份二氧化氮。
问:在0℃,760mmHg下200dm3此混合气体中,氮气为多少克?6. S2F10的沸点为29℃,问:在此温度和1atm下,该气体的密度为多少?7. 体积为8.2dm3的长颈瓶中,含有4.0g氢气,0.50mol氧气和分压为2atm 的氩气。
这时的温度为127℃。
问:(1) 此长颈瓶中混合气体的混合密度为多少?(2) 此长颈瓶内的总压多大?(3) 氢的摩尔分数为多少?(4) 假设在长颈瓶中点火花,使之发生如下反应,直到反应完全:2H2(g) + O2(g) =2H2O(g)当温度仍然保持在127℃时,此长颈瓶中的总压又为多大?8. 在通常的条件下,二氧化氮实际上是二氧化氮和四氧化二氮的两种混合气体。
在45℃,总压为1atm时,混合气体的密度为2.56g⋅dm-3。
计算:(1) 这两种气体的分压。
(2) 这两种气体的重量百分比。
9. 在1.00atm和100℃时,混合300cm3H2和100 cm3O2,并使之反应。
反应后温度和压力回到原来的状态。
问此时混合气体的体积为多少毫升?若反应完成后把温度降低到27℃,压力仍为1.00atm,则混合气体的体积为多少毫升?(已知27℃时水的饱和蒸汽压为26.7mmHg)10. 当0.75mol的“A4”固体与2mol的气态O2在一密闭的容器中加热,若反应物完全消耗仅能生成一种化合物,已知当温度降回到初温时,容器内所施的压力等于原来的一半,从这些数据,你对反应生成物如何下结论?11. 有两个容器A和B,各装有氧气和氮气。
在25℃时:容器A:O2 体积500 cm3,压力1atm。
容器B:N2 体积500 cm3,压力0.5atm。
现将A和B容器相连,让气体互相混合,计算:(1) 混合后的总压。
(2) 每一种气体的分压。
(3) 在此混合物中氧气所占的摩尔分数。
12. 在1dm3的玻璃瓶中,装有100 cm3含HCl 10%的盐酸溶液(1.19g⋅cm-3),在温度为27℃时,加入0.327g锌(原子量为65.4)并立即用塞子塞紧。
反应完全后,如瓶内温度和反应前相同,问:瓶中的压力是多少?(假设反应前瓶中的压力为1atm,包括空气、水蒸气和氯化氢三种气体的分压,并假设反应前后此三种分压相同。
)13. 将未知量的氩气和氦气相混合,其混合物的重量为5.00g,并且知道此混合气体在25℃,1atm时占有10dm3体积,求此混合气体各组分的重量百分组成?14. 现有5.00gFeCl3(固体),放入事先抽空的1dm3容器中气化成在427℃时,该气体的压力为0.89atm。
试证明气体的分子组成是Fe2Cl6,而不是FeCl3。
15. 一气态化合物的分子式为C x H y Cl z,它与足量的氧气完全燃烧,燃烧8体积该化合物,产生16体积的CO2,16体积的H2O蒸汽和8体积的Cl2(反应前后都在相同的温度和压力下)。
问:此化合物的分子式如何?16. 100cm3的O2加入50cm3的CO和C2H6的混合气体中,点燃后,CO和C2H6完全变成CO2和H2O,然后再回到原来的温度和压力(此时水已不算体积了)。
剩下的气体体积为85cm3,求原来混合物中,CO和C2H6的体积百分数。
17. 在臭氧的分析中,把2.0⨯104dm3的空气(在STP下)通入NaI的溶液中,发生如下反应:O3 + 2I-+ H2O =O2 + I2 + 2OH-生成的I2用0.0106mol⋅dm-3的硫代硫酸钠溶液滴定,反应如下:I2 + 2Na2S2O3 =2NaI + Na2S4O6为了使所有的I2和Na2S2O3完全反应,必须用此硫代硫酸钠溶液4.2dm3,试计算:(1) 与Na2S2O3完全反应的I2的摩尔数?(2) 在20000dm3空气中,含有多少摩尔O3?(3) 在STP下,这些O3占多大体积?(4) 空气中O3占的体积为空气的百分之几?18. 某两种气态混合烃,在常温下体积为20cm3,与足量的氧气反应,产生的气体被浓硫酸吸收后,体积减少了30 cm3;被石灰水吸收后,体积减少了40 cm3(这些体积都已换算成与初始状态在相同的温度和压力下)。
问此混合物有几种?每种可能情况下,各烃的体积百分数为多少?19. 有一种未知气体,测得它的扩散速度是NH3扩散速度的2.92倍,求这种未知气体的近似分子量?20. 在第二次世界大战期间,发明了分离铀同位素的方法。
把六氟化铀(UF6,分子量为352)通过几千层多孔的障碍,利用扩散速度的不同来分离。
试比较氟甲烷(氘碳-14甲基) (CD3F,分子量为39)和UF6的扩散速率比。
21. 在50atm和50℃时,10.0gCO2的体积为85cm3。
试求:此实际气体与理想气体定律的体积百分偏差为多少?22. 在18℃和760mmHg气压下,将含饱和水蒸汽的空气2.70dm3通过CaCl2干燥管。
吸去水汽后,称重得3.21g,求:18℃时饱和水蒸汽压。
(已知空气的平均分子量为29.0)。
23. 在16℃和747mmHg气压力下,在水面上收集1dm3CO2气体,经干燥后,还有多少立方分米CO2?重多少克?24. 液体A和B形成理想溶液。
纯A和纯B的蒸汽压(在100℃时)分别为300mmHg和100mmHg。
假设100℃时此溶液是由1molA和1molB组成。
收集此液体上方的蒸汽,然后冷凝,再把此冷凝液体加热到100℃,然后再使此冷凝液体上方的蒸汽冷凝,形成液体X,问在液体X中,A的摩尔分数为多少?25. 在80℃时苯的蒸汽压为753mmHg,甲苯的蒸汽压为290mmHg。
若有1/3 mol的苯和2/3mol的甲苯混合溶液,问:(1) 此溶液的蒸汽压为多少?(2) 溶液上面蒸汽的组成如何?(假设此溶液中的两个成分都服从拉乌尔定律)26. 在25℃时,某液体上方的氧气体积为4dm3,压强为750mmHg。
用适当的方法除去氧气中的某液体蒸汽。
再测量氧气的体积(在STP下)为3dm3,计算此液体的蒸汽压。
(假设开始时氧气的液态蒸汽是饱和的)。
27. 4g某物质溶于156g的苯中,苯的蒸汽压从200mmHg减到196.4mmHg。
计算:(1) 此物质的摩尔分数。
(2) 此物质的分子量。
28. 在25℃时3%的阿拉伯胶水溶液(最简单的化学式为C6H10O5)的渗透压为0.0272atm。
求此阿拉伯胶的分子量和聚合度?29. 在30℃时,在水面上收集N2,此温度下水的蒸汽压为32mmHg。
水上方气体的总压力为656mmHg,体积为606cm3。
问:此混合气体中,氮气的摩尔数为多少?30. 某酚的正常沸点为455.1K,蒸发热为48.139kJ⋅mol-1。
欲使沸点为400K,问真空度应为多少kPa?31. 三氯甲烷在40℃时蒸汽压为370mmHg,在此温度和740mmHg气压下,有4.00dm3干燥空气缓缓通过三氯甲烷(即每个气泡都为三氯甲烷所饱和),求:(1) 空气和三氯甲烷混合气体的体积是多少?(2) 被空气带走的三氯甲烷质量是多少克?32. 在青藏高原某山地,测得水的沸点为93℃,估计该地大气压是多少?(∆H evap=43kJ⋅mol-1)33. 向某液态有机物(分子量为148.4)缓慢通人5dm3,1atmN2。
当温度为110℃时,失重32g,140℃时失重1215g。
试求此有机物在110℃及140℃的饱和蒸汽压、摩尔汽化热和正常沸点。
34. 10g非挥发性未知样品溶解在100g苯中,然后将空气在此溶液内鼓泡,流出的空气被苯的蒸汽所饱和,这时溶液重量损失了1.205g(溶液的浓度在此过程中假定为不变);在同样的温度下,空气通过纯苯鼓泡,流出的气体体积与前者相同时,苯的蒸汽也达到了饱和,引起的重量损失为1.273g,求未知样品的分子量。
35. 在25℃时,固体碘的蒸汽压为0.31mmHg,氯仿(液态)的蒸汽压为199.1mmHg,碘的氯仿饱和溶液中碘的摩尔分数为0.0147,计算:(1) 在这样的饱和溶液中,平衡时碘的分压,(2) 此溶液的蒸汽压(假定服从拉乌尔定律)。
36. 在0℃时, 1大气压下,水溶解纯N2为23.54cm3⋅dm-3,溶解O2为48.89cm3⋅dm-3,空气中含N279%和O2 21%(体积百分数),问溶解空气时,水中空气的N2和O2的体积百分数为多少?37. 当20℃、氮气的压力为730mmHg时,1000g水中可溶解9.3cm3氮气,试求氮气的亨利常数?38. 氧在1atm下,20℃时的溶解度是3.1cm3/100cm3水,问100dm3雨水中最多含多少溶解了的氧气?39. 由0.550g樟脑和0.045g有机溶质所组成的溶液的凝固点为157.0℃。
若溶质中含93.46%的碳及6.54%的氢(重量百分比),试求溶质的分子式。
(已知樟脑的熔点为178.4℃)40. 现有25mg的未知有机物溶在1.00g的樟脑中,樟脑的熔点下降2.0K,问此未知有机物的分子量为多少?(樟脑C10H16O的K f =40)41. 今有两种溶液:一种为1.5g尿素溶在200g水内,另一种为42.72g未知物溶在1000g 水内。
这两种溶液在同一温度时结冰。
问这个未知物的分子量为多少?42. 某6g溶质,溶解于100g水中,冰点降低了1.02K,计算此溶质的分子量。
43. 用0.244g的苯甲酸溶在20g苯中,冰点为5.232℃,纯苯的冰点为5.478℃,计算在此溶液中苯甲酸的分子量。
写出在此溶液中苯甲酸的分子式。
44. 在0℃时,1大气压的氮气在水中的溶解度为23.54cm3⋅dm-3,1大气压的氧气在水中的溶解度为48.89cm3⋅dm-3,空气中的水和无空气水的冰点差为多少?45. 在100cm3含有2.30g甘油,这时冰点为-0.465℃。
