非金属及其化合物关系图及方程式上课讲义
第11讲 常见非金属及其重要化合物(课件)-2023届高考化学二轮复习(全国通用)

化学
2023
二轮精准复习45讲
第11讲
常见非金属及其重要化合物
有关非金属元素单质及其化合物的性质和用途的思维途径
1.硅及其化合物
(1)硅及其化合物的“价类二维”转化。
理清知识主线:
-
H4
-
H4
+
O
+
+
O2
+
O2(H2 O3)
(2)重要反应的方程式。
ClO-+Cl-+2H+═Cl2↑+H2O
⑦将SO2和Cl2混合,漂白性减弱的原因(用离子方程式表示)。
SO2+Cl2+2H2O
+
4H +S +2Cl
(3)扫除易忘知识盲点。
①液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。
②酸性KMnO4溶液应用硫酸酸化。
酸化KMnO4溶液不能用盐酸,也不能用硝酸
③ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与
-、Fe2+均不能大量共存。
、I
SO23
④当Fe与Cl2在加热条件下反应时,不论Fe过量还是不足,由于Cl2的强氧化
性,产物一定是FeCl3。
⑤“84”消毒液的有效成分为NaClO,漂粉精的有效成分为Ca(ClO)2。“84”消
3S↓+3H2O
④书写下列反应的化学方程式。
a.将 SO2 通入 H2S 溶液中。
2H2S+SO2
3S↓+2H2O
b.Cu 与浓硫酸混合加热。
Cu+2H2SO4(浓)
必修一第四章《非金属及其化合物》知识框架图

第四章非金属元素及其化合物一、非金属元素的主角――硅二、富集海水中的元素-氯1. 物理性质:黄绿色,有刺激性气味的气体,有毒,易液化,可溶于水(溶解度1:2)①2Na+Cl22NaCl (白烟)A. 与金属反应②Cu+Cl2CuCl2 (棕黄色烟,与变价金属反应生成高价金属)③2Fe+3Cl22FeCl3(产生棕色的烟,常温下不与干燥氯气反应)①H2+Cl22HCl 白雾,发生爆炸H2+Cl22HCl(苍白色火焰,HCl工业制法)1.氯气的 B.与非金属反应:②2P+3Cl22PCl3 (白烟) 白色烟雾化学性质2P+5Cl22PCl5(白雾)C.与水反应:Cl2+H2O HCl+HClO 氯气的水溶液叫氯水4. 化学性质:①Cl2+2NaOH = NaCl+NaClO+H2O (制漂白液,制氯气尾气处理)D.与碱反应②2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O(工业制漂白粉制法)①2FeCl2+Cl2 = 2FeCl3(溶液由浅绿色变为黄色)②2KI+Cl2 = 2KCl + I2湿润的淀粉KI试纸变蓝,用于氯气的检验E.氧化性:③SO2+Cl2+2H2O = 2HCl + H2SO4 (除废水中的氯)①反应原理:MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑注意:MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
5.氯气的 A.实验室制法:②装置组成:发生装置---收集装置---吸收装置制法:③实验步骤:检密—装药—固定—加热—收集④收集方法:向上排空气法(或排饱和食盐水法)⑤检验方法: 用湿润的KI淀粉试纸置于瓶瓶口观察是否变蓝。
⑥净化装置:用饱和食盐水除去HCl,用浓硫酸干燥⑦尾气处理:用碱液(NaOH)吸收B. 工业制法:(氯碱工业) 2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑6.用途:1.氯水(氯气的水溶液)Cl 2+H 2O ====== HCl+HClO (可逆)新制 A.分子:Cl 2、H 2O 、HClO2.氯水的成分: B.离子:H +、Cl -、ClO -(少量) 、OH -(少量) 2HClO ======= 2HCl + O 2久置: 久制的氯水主要成份为H 2O 、HCl 。
非金属及其化合物8 人教课标版精选教学PPT课件

非金属及其化合物
•教学内容概述 •本章内容在整个模块的作用 •本章的总体教学目标分析 •本章的重点和难点分析 •教学方法和建议 •课时建议
•本章教学内容概述
第一节 第二节 第三节 第四节
无机非金属材料的主角——硅 富集在海水中的元素——氯 硫和氮的氧化物 氨 硝酸 硫酸
•本章教学内容概述
氯气泄漏事故 中消防战士正在调制碱水喷洒液
国道319线武隆大溪河段,一辆罐装货车从武隆向涪 陵方向行驶。几块巨石从公路上方5米处崖壁上滑落, 货车头被砸中,两前车胎爆裂。钢罐一端已现裂缝, 浓硫酸正泄漏。
随着人们生活水平的日益 提高,城市工业化步伐的大步 前进,环境污染已经成为全世 界最为关注的问题之一,某些 工厂排出的废气不经过处理直 接排放到空气中,严重造成了 大气污染,使得某些地区雨水 酸性严重超标,形成酸雨。
旧教材
新教材:突出典型元素
卤族元素
Cl
碳族元素 四章
Si
氧族元素
S
氮族元素
N
•本章教学内容概述
第一节 无机非金属材料的主角——硅
二氧化硅、硅酸,硅酸盐,硅单质
第二节 富集在海水中的元素——氯 氯气,氯离子检验
硅和氯:纵向写法 硅及其化合物:存在和用途十分广泛,突出硅
的材料特性 氯及其化合物:典型的代表性的非金属元素,
突出氯的典型非金属特征
第三节 第四节
硫和氮的氧化物
二氧化硫 二氧化氮和一氧化氮 二氧化氮和一氧化氮对大气的污染
氨 硝酸 硫酸
浓硫酸和硝酸的氧化性 氨
硫和氮:横向写法
硫、氮与当代环境问题相关(氧化物),突出环 境问题,注重科学精神和人文精神融合
用途广泛的两种酸——硫酸和硝酸(氧化性), 突出特点、重点,加强联系和比较
人教版高中化学必修1:第四章非金属及其化合物_归纳与整理_课件5(2)

④在空气中迅速由无色变为红棕色的气体为 NO; ⑤能与 SO2 等气体或其水溶液反应析出浅黄色固体的气体 为 H2S; ⑥在一定条件下能漂白有色物质的淡黄色固体为 Na2O2、 无色液体为 H2O2、有色液体为氯水、无色刺激性气体为 SO2、 有色刺激性气体为 Cl2; ⑦在空气中能自燃的固体物质为白磷; ⑧可溶于氢氟酸的酸性氧化物只有 SiO2;
③ 有 色 固体 : ①红 色 : Cu、 Cu2O、 Fe2O3 ; ②红 褐 色 : Fe(OH)3; ③绿色: Cu2(OH)2CO3、 FeSO4·7H2O ;④蓝色 : Cu(OH)2、CuSO4·5H2O;⑤黑色:CuO、FeO、FeS、Fe3O4、 CuS、MnO2、C;⑥浅黄色:S、Na2O2、AgBr;⑦黄色:AgI、 FeS2;⑧白色:Mg(OH)2、Fe(OH)2、Al(OH)3、CaCO3、BaSO4、 AgCl、BaSO3、H2SiO3。
【解析】 根据乙和丙两种单质反应生成的化合物 C 能使 品红溶液褪色,可知 C 为 SO2;B 的焰色反应为黄色,所以 B 中含有 Na 元素,又因为 B 是由甲和丙两种单质在点燃条件下 反应生成的,可推知 B 为 Na2O2,同时可确定甲、乙、丙分别 为 Na、S、O2;根据 B(Na2O2)分别与 H2O、CO2 的反应产物, 可知 E 为 NaOH,F 为 Na2CO3;F 可由 E 与 G(焰色反应为黄 色)反应得到,所以 G 为 NaHCO3;C 与丙(O2)在一定条件下反 应得 H,则 H 为 SO3,H(SO3)与 E(NaOH)反应生成 D,D 为 Na2SO4。
【答案】 (1)碳酸铵或碳酸氢铵 NaOH Na2CO3 SiO2 (2)3Cu+8H++2NO- 3 ===3Cu2++2NO↑+4H2O (3)O3 具有氧化性 (4)N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1 (5)2
高二化学非金属及其化合物.ppt

下列氯化物既可以由金属与氯
气直接化合得到,又可以由金属与 盐酸反应而制得的是( D )
A、CuCl2 C、FeCl3
B、FeCl2 D、AlCl3
三、硫及其化合物
1、硫 点燃
S + O2 === SO2 Fe+S== FeS
Cu+S== Cu2S H2 + S== H2S
三、硫的化合物 1、二氧化硫 物理性质:无色、有刺激性气味、有毒
四、氮及其化合物 1、N2 2NO+O2==2NO2 红棕色、有毒、 易溶于水、易液化
性 质
放电 N2+O2===2NO 无色、有毒、不溶于水
3NO2+H2O==2HNO3+NO 形成酸雨、制硝酸
2、氨 物性:无色、有刺激性、极易溶于水、易液化
NH3+H2O NH3·H2O
化 性
NH3+HCl==NH4Cl
பைடு நூலகம்
一、硅及其化合物 1、硅
原子结构: +14 2 8 4 存在形式:主要以氧化物和硅酸盐形式存在
主要性质:灰黑色、熔点高、硬度大、 半导体、性质不活泼
主要用途:半导体材料、太阳能电池
2、二氧化硅 存在形式:硅石、水晶、石英、玛瑙
SiO2+4HF==SiF4↑+2H2O
高温
主要性质: SiO2+CaO===CaSiO3 SiO2+2NaOH==Na2SiO3+H2O
4、硅酸盐
概念:由硅、氧和金属组成的化合物的总称 陶瓷:以黏土为原料
产品 水泥:以黏土和石灰石为原料
玻璃:以纯碱、石灰石、石英为原料 水溶液俗称水玻璃,在空气中易
非金属金属及化合物转换关系图和化学方程式与离子方程式的归纳与整理
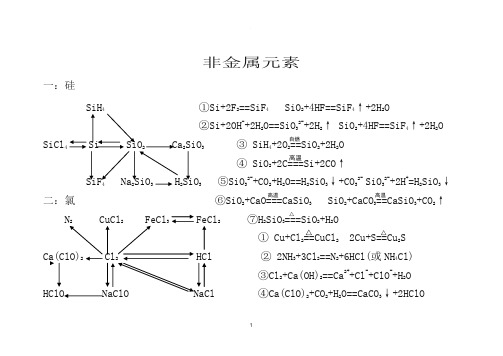
非金属元素一:硅SiH 4 ①Si+2F 2==SiF 4 SiO 2+4HF==SiF 4↑+2H 2O②Si+2OH -+2H 2O==SiO 32-+2H 2↑ SiO 2+4HF==SiF 4↑+2H 2OSiCl 4 Si SiO 2 Ca 2SiO 3 ③ SiH 4+2O 2==SiO 2+2H 2O ④ SiO 2+2C===Si+2CO ↑SiF 4 Na 2SiO 3 H 2SiO 3 ⑤SiO 32-+CO 2+H 2O==H 2SiO 3↓+CO 32- SiO 32-+2H +=H 2SiO 3↓ 二:氯 ⑥SiO 2+CaO===CaSiO 3 SiO 2+CaCO 3==CaSiO 3+CO 2↑N 2 CuCl 2 FeCl 3 FeCl 2 ⑦H 2SiO 3===SiO 2+H 2O① Cu+Cl 2==CuCl 2 2Cu+S==Cu 2S Ca(ClO)2 Cl 2 HCl ② 2NH 3+3Cl 2==N 2+6HCl(或NH 4Cl) ③Cl 2+Ca(OH)2==Ca 2++Cl -+ClO -+H 2O HClO NaClO NaCl ④Ca(ClO)2+CO 2+H 2O==CaCO 3↓+2HClO高温高温高温 △△ △自燃Ca(ClO)2+2HCl==CaCl 2+2HClO ICl+ H 2O==HIO+HCl ⑤2NaOH+Cl 2==NaCl+NaClO+H 2OFe 2O 3+ 6HI==2FeI 2+I 2+3H 2O ⑥Cl -+ ClO -+2H +==Cl 2↑+H 2O2NaCl+MnO 2+2H 2SO 4(浓)== ⑦ClO -+CO 2+H 2O==HClO+HCO 3- ClO -+SO 2+H 2O==Cl -+SO 42-+2H +Na 2SO 4+MnSO 4+Cl 2↑+2H 2O ⑧ MnO 2+4HCl(浓)— 2MnO 4-+10Cl -+16H +==2Mn 2++5Cl 2↑+4H 2O⑨2NaCl+2H 2O===2NaOH+Cl 2↑+H 2↑ ⑩NaCl+H 2SO 4(浓)==NaHSO 4+ HCl ↑ 三:硫 ⑴ 2Al+3S==Al 2S 3 Al 2S 3+6H 2O==2Al(OH)3↓+3H 2S ↑ CuS Cu ⑵Fe+S==FeS FeS+2H +==Fe 2++H 2S ↑ ⑶ Cu 2++ H 2S==CuS ↓+2H +H 2S S SO 2 SO 3 ⑷2H 2S+O 2==3S+2H 2O 2H 2S+3O 2==2SO 2+2H 2O ⑸ 2H 2S+SO 2==3S+2H 2O H 2S+2Fe 3+==2Fe 2++S ↓+2H +FeS Al 2S 3 H 2SO 4 ⑹ 2SO 2+ O 2 2SO 3 Na 2SO 3 Na 2SO 4 ⑺2H 2SO 4(浓)+Cu===CuSO 4+SO 2↑+2H 2O△△电解 点燃 点燃△V 2O 5450℃ △△△四:氮⑴ N 2+3H 2 2NH 3 NH 4Cl NH 3 N 2 NO NO 2 HNO 3 ⑵ 8NH 3+3Cl 2==N 2+6NH 4Cl ⑶ N 2+O 2==2NONH 3·H 2O Mg 3N 2 NaNO 2 NaNO 3 ⑷4NH 3+6NO==5N 2+6H 2O ⑸2NH 4Cl+Ca(OH)2==CaCl 2+2NH 3↑+2H 2O ⑹NH 4++OH -==NH 3·H 2O NH 4++OH -==NH 3↑+H 2O⑺NH 3·H 2O(浓)===NH 3↑+H 2O ⑻ 3NO 2+H 2O==2HNO 3+NO ⑼NO+ NO 2+2OH -==2NO 2-+H 2O 2NO 2+2OH -==NO 2-+NO 3-+H 2O⑽4NH 3+5O 2===4NO+6H 2O ⑾Cu+4HNO 3(浓)==Cu(NO 3)2+2NO 2↑+2H 2O 3Cu+8HNO 3(稀)==3Cu(NO 3)2+2NO ↑+4H 2O△⑾CaO或碱石灰△高温、高压催化剂 催化剂△催化剂△ 放电欢迎您的下载,资料仅供参考!致力为企业和个人提供合同协议,策划案计划书,学习资料等等打造全网一站式需求。
非金属及其化合物知识点框架图

1.碳、硅及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
①Si 和NaOH 溶液的反应 Si +2OH -+2H 2O===SiO 32-+2H 2↑②SiO 2和NaOH 溶液的反应SiO 2+2OH -===SiO 32-+H 2O ③SiO 2和C 的反应SiO 2+2C=====高温Si +2CO ↑④向Na 2SiO 3溶液中通入过量CO 2气体 SiO 32-+2CO 2+2H 2O===H 2SiO 3↓+2HCO 3- ⑤Si 和氢氟酸的反应Si +4HF===SiF 4↑+2H 2↑⑥Mg 在CO 2中燃烧2Mg +CO 2=====点燃2MgO +C⑦向苯酚钠溶液中通入少量CO 2气体⑧向澄清石灰水中通入少量CO 2气体Ca 2++2OH -+CO 2===CaCO 3↓+H 2O⑨向澄清石灰水中通入过量CO 2气体OH -+CO 2===HCO 3-⑩除去CO 2中的COCO +CuO=====△CO 2+Cu?Na 2CO 3和SiO 2的反应 Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑?CaO 和MgCl 2溶液的反应CaO +Mg 2++H 2O===Mg(OH)2+Ca 2+2.氯气及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式: ①Cl 2和H 2O 的反应Cl 2+H 2O H ++Cl -+HClO②Cl 2和NaOH 的反应 Cl 2+2OH -===Cl -+ClO -+H 2O③Cl 2和石灰乳的反应 2Cl 2+2Ca(OH)2===2Ca 2++2Cl -+2ClO -+2H 2O ④把Cl 2通入到Na 2SO 3溶液中 Cl 2+SO 32-+H 2O===SO 42-+2H ++2Cl -⑤将Cl 2和SO 2混合通入H 2OSO 2+Cl 2+2H 2O===4H ++2Cl -+SO 42-⑥将Cl 2通入到氢硫酸溶液中Cl 2+H 2S===S ↓+2H ++2Cl -⑦将浓盐酸和MnO 2混合加热 MnO 2+4H ++2Cl -=====△Mn 2++Cl 2↑+2H 2O⑧电解饱和食盐水2Cl -+2H 2O=====电解Cl 2↑+H 2↑+2OH - ⑨将浓盐酸与漂白液混合Cl -+ClO -+2H +===Cl 2↑+H 2O⑩将浓盐酸与KClO 3溶液混合6H ++5Cl -+ClO 3-===3Cl 2↑+3H 2O?向KMnO 4固体滴加浓盐酸2MnO 4-+16H ++10Cl -===2Mn 2++5Cl 2↑+8H 2O ?向漂白粉溶液中通入少量CO 2气体Ca 2++2ClO -+CO 2+H 2O===CaCO 3↓+2HClO ?向漂白粉溶液中通入少量SO 2气体Ca 2++3ClO -+SO 2+H 2O===CaSO 4↓+Cl -+2HClO?向漂白粉溶液中通入过量SO 2气体 Ca 2++2ClO -+2SO 2+2H 2O===CaSO 4↓+2Cl -+SO 42-+4H +3.硫及其化合物(1)知识网络构建(2)重要反应必练 写出下列反应的方程式,是离子反应的写离子方程式。
2021年人教课标版_必修1_第四章 非金属及其化合物 _ 归纳与整理 (1)(共13张PPT)

A.9.0 L差量法
化学反应中因反应物和生成物的状态变化(或不相同)而 产生物质的量差量、质量差量、气体体积差量、气体压 强差量等,差量法就是利用这些差量来列出比例式,从而简 化计算步骤,达到快速解题的目的,其中最常用的是质量差 法和体积差法。
呈无色。下列关于该溶液的判断正确的是( C )
A.肯定不含I C.肯定含有SO 3 2-
B.不能确定是否含SO4 2D.肯定含有NH 4 +
• 9、春去春又回,新桃换旧符。在那桃花盛开的地方,在这醉人芬芳的季节,愿你生活像春天一样阳光,心情像桃花一样美丽,日子像桃子一样甜蜜。 2021/2/52021/2/5Friday, February 05, 2021
4.关系式法
关系式是将多个连续反应转化为一步计算。建立关系式 的依据有两种,一是依据连续反应的化学方程式的化学计 量数建立,二是依据化学反应中原子数目守恒建立 。
例4
黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时, 取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量 Fe2 (SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7 标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL. 已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
例3
16ml由NO与NH3组成的混合气体在催化剂作用下于400℃左右可 发生反应,6NO+4NH3 ⇌ 5N2+6H2O(g)达到化学平衡时在相同 条件下气体体积变为17.5ml,则原混合气体中NO与NH3的物质的量
之比有四种情况:①5:3 ②3:2 ③4:3 ④9:7 正确的有( C )
《非金属及其化合物》课件

非金属元素在周期表中的位置主要在碳族、氮族、氧族、卤素等族中,它们通 常具有较低的电负性和较高的电子亲和力,容易形成共价键和分子晶体。
非金属元素的分类
01
02
03
惰性气体
氦、氖、氩、氪、氙等。
非金属元素
氢、硼、碳、氮、氧、磷、硫 等。
卤素
氟、氯、溴、碘等。
04
准金属元素
砷、硒、锑、铋等。
非金属元素在地壳中的分布
分布情况
非金属元素在地壳中的分布非常广泛 ,其中氧、硅、铝、铁等是地壳中含 量最高的元素,而其他非金属元素在 地壳中的含量相对较低。
影响因素
非金属元素的分布受到多种因素的影 响,如元素的电负性、原子半径、离 子半径等,这些因素决定了元素在地 球各圈层中的分布和迁移。
02
非金属单质的物理性质
总结词
不稳定性
有些非金属单质在特定条件下不稳定,容易发生化学反应, 如氟气、氯气等在强光照射下易分解。
04
非金属化合物的性质
非金属氧化物的性质
总结词
非金属氧化物大多为酸性氧化物,除个别如CO、N2O等外,大多数不与水反应。
详细描述
非金属氧化物大多数是酸性氧化物,这是因为非金属氧化物中的非金属元素通常具有较高的电负性,容易获得电 子而形成负离子。这些负离子可以与水分子结合形成含氧酸或酸酐。例如,二氧化碳(CO2)是一种典型的酸性 氧化物,它可以与水反应生成碳酸(H2CO3)。
总结词
非金属单质的溶解性是影响其应用的重要物理性质之 一。
详细描述
不同非金属单质的溶解性差异很大,如碘易溶于汽油、硫难溶 于水等。了解非金属单质的溶解性有助于对其制备、分离和提 纯等操作进行指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
非金属及其化合物关系图及方程式一、氯及氯的化合物Cl 2⑴金属Na/Fe/Cu不活泼的非金属H 2/P⑵非金属阴离子X -/S 2-/NH 3⑶SO 2/SO 32-/Fe 2+/FeI 2/FeBr 2HClH 2SO 4AgCl MnO (△)/KMnO /KClO HClO-KClO 3KClHCl/MnO 2(△)Ca(ClO)221, 氧化性: nF 2 +2M=== F 2 + H 2 === F 2 +Xe(过量)=== 2H 2O+2F 2===4HF+O 22F 2 +2NaOH===Cl 2 +2Na 点燃2NaCl(黄色火焰,冒白烟)3Cl 2 +2Fe 点燃2FeCl 3(红棕色烟,溶于水显黄色)Cl 2+Cu 点燃CuCl 2(棕黄色烟,溶于水浓绿色,稀蓝色)Cl 2 +H 2 光或点燃2HCl(点燃,苍白色火焰,瓶口冒白雾。
光照爆炸) Si(粗)+2Cl 2高温SiCl 4 3Cl 2 +2P 点燃2PCl 3(白雾) Cl 2 +PCl 3 点燃PCl 5(白烟)2Cl 2+2NaBr===2NaCl+Br 2(无色变黄色,加CCl 4橙红色) Cl 2 +2NaI ===2NaCl+I 2(无色变棕黄色,加CCl 4紫红色)5Cl 2+I 2+6H 2O===2HIO 3+10HCl(碘化钾淀粉溶液中滴加氯水直至过量,先变蓝色后蓝色消失)[NaCl + AgNO 3 === AgCl ↓(白色) + NaNO 3 NaBr + AgNO 3 = AgBr ↓(淡黄色)+ NaNO 3 NaI + AgNO 3 = AgI ↓(黄色) + NaNO 3] Cl 2 +Na 2S===2NaCl+S(黄色浑浊) Cl 2 +H 2S===2HCl+S(黄色浑浊) Cl 2 +2FeCl 2 ===2FeCl 3(绿色变黄色)X 2+SO 2 +2H 2O===H 2SO 4 +2HX(X=Cl/Br/I ,氯气与二氧化硫等体积混合后无漂白性)H 2SO 3+X 2+H 2O===H 2SO 4+2HX Cl 2 +H 2O 2 ===2HCl+O 2还原性:SO 32->I ->Fe 2+>Br - 2(水或碱中)歧化Cl 2+H 2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化) Cl 2+2NaOH===NaCl+NaClO+H 2O(尾气吸收)2Cl 2+2Ca (OH )2==CaCl 2+Ca (ClO )2+2H 2O(制漂白粉) 3Cl 2+6KOH (浓)@5KCl+KClO 3+3H 2OCa(ClO)2 + CO 2 + H 2O =CaCO 3↓ + 2HClO(漂白原理) 2HClO 光2HCl+O 2(漂白粉失效) 3.氯气的制法 工业制法电解氯化钠溶液 2NaCl +2 H 2O 2NaOH + H 2↑ + Cl 2↑(氯碱工业) 电解熔融氯化钠 2NaCl 2Na + Cl 2↑实验室制法 MnO 2 + 4HCl(浓)MnCl 2 +Cl 2↑+ 2H 2O16HCl+2KMnO 4==2KCl+2MnCl 2+5 Cl 2↑+8H 2O 14HCl+K 2Cr 2O 7===2KCl+2CrCl 3+3 Cl 2↑+7H 2O 6HCl+KClO 3=3 Cl 2↑+KCl+3H 2O Cl -+ClO -+2H +=Cl 2↑+H 2OMnO 2+HCl---(地康法)4HCl+O 2催化剂、加热2Cl 2+2H 2O 4、HX 的制法H 2SO 4(浓) +CaF 2@CaSO 4+2HF ↑ H 2SO 4(浓)+NaCl 微热NaHSO 4+HCl ↑ H 2SO 4(浓) +2NaCl 强热Na 2SO 4+2HCl ↑ H 3PO 4(浓)+NaBr @NaH 2PO 4+HBr ↑ H 3PO 4(浓)+NaI @NaH 2PO 4+HI ↑ 5.HClO 的氧化性 3HClO+HI===HIO 3+3HCl HClO+H 2SO 3===H 2SO 4+HCl HClO+H 2O 2===HCl+H 2O+O 2通电 通电(氧化性:HClO>HClO 2>HClO 3>HClO 4,但浓,热的HClO 4氧化性很强) 2KClO 3二氧化锰加热2KCl+3O 2↑二、氧及氧的化合物(1)O 2⑴金属Na/Fe/Cu不活泼的非金属S/P/C/Si/H 2⑵非金属阴离子X -/S 2-/NH 3⑶SO 2/SO 32-/Fe 2+/NO/CO/CS 2/CH 4O 2-KClO 3F 2/电解F 2(低温)OF 2O 3PbSKI(Cl/NO )放电紫外光H 2O 2KMnO 4(H +)I -/Fe 2+/SO 32-MnO 2Na 2O 2Ba 2O 2Na(点燃)H 2SO 4MnO 2(△)1、O 22Na + O 2=== Na 2O(钠放置在空气中变暗) 2Na + O 2Na 2O 2(黄色的火焰,生成淡黄色固体)4Al + 3O 2点燃2Al 2O 3 铝箔在氧气中剧烈燃烧 3Fe +2O 2 点燃Fe 3O 44FeS 2+11O 2煅烧2 Fe 2O 3+8SO 2 N 2 + O 2 放电 2NO S+O 2===SO 2 4P+5O 2点燃P 4O 10(常写成P 2O 5,冒白烟)2C+O 2(少量)点燃2COC+O 2(足量)点燃CO 2Si + O 2SiO 2(硅粉在氧气中燃烧 )4NH 3 +5O 2(空气)4NO + 6H 2O4NH 3+3O 2(纯)点燃2N 2+6H 2O2H 2S+3O 2点燃2H 2O+2SO 2 2NO + O 2 2NO 22SO 2+O 2催化剂 加热2SO 32CaSO 3+O 2=== 2CaSO 4 P 4S 3+8O 2点燃3SO 2+2P 2P 5SiH 4+2O 2=SiO 2+2H 2O 2.O 32 O3 NO Cl 或 3 O 2(氮氧化物或氟里昂破坏臭氧层) PbS+2 O 3=PbSO 4+O 22KI+ O 3+ H 2O=I 2+2KOH+O 2(湿KI-淀粉试剂检验空气中的臭氧含量) 3O 2 放电或紫外光 2O 3(雷电、复印机、高压电机) 3、H 2O 2 不稳定性:2H 2O 22MnO 2H 2O+O 2↑弱酸性:BaO 2+H 2SO 4=BaSO 4↓+H 2O 2 氧化性:H 2O 2+2KI+H 2SO 4=K 2SO 4+I 2+2H 2O Cu+H 2O 2+2H +=Cu 2++2H 2OSO 2+H 2O 2=H 2SO 4还原性:2MnO 4-+5H 2O 2+6H +=2Mn 2++8H 2O+5O 2 ↑二、硫及硫的化合物(2)⑴金属Na/Fe/Cu/Hg H S S 2 SO SO 32-PbSPb(CH 3(FeS)SO 3O 22O 5/400-5000C )4Cu(△)C (△)S (△)241. S氧化性:3S+2Al△Al 2S 3 S+Fe @FeS S+2Cu△2SS+Hg=HgS(除去洒落地上的水银) 2S+C△CS 2 S+H 2△H 2S还原性:S+O 2 点燃SO 2S+H 2SO 4(浓)△3SO 2↑+2H 2O S+6HNO 3(浓) △2SO 4+6NO 2↑+2H 2O3S+6NaOH △2Na 2S+Na 2SO 3+3H 2O2. H 2S不稳定性:H 2S△H 2+S还原性:Cl 2+H 2S=2HCl+S ↓ 2H 2S+O 2(少量)===2S ↓+2H 2O 2H 2S+SO 2===3S ↓+2H 2OH 2S+H 2SO 4(浓)===S ↓+SO 2↑+2H 2O 3H 2S+2HNO 3(稀)===3S ↓+2NO ↑+4H 2O5H 2S+2KMnO 4+3H 2SO 4===2MnSO 4+K 2SO 4+5S ↓+8H 2O 3H 2S+K 2Cr 2O 7+4H 2SO 4===Cr 2(SO 4)3+K 2SO 4+3S ↓+7H 2O H 2S+4Na 2O 2+2H 2O===Na 2SO 4+6NaOH 酸性:H 2S+Fe===FeS+H 2↑ H 2S+CuCl 2===CuS ↓+2HClH 2S+Pb(CH 3COO)2===PbS ↓+2CH 3COOH H 2S+FeCl 2===不反应H 2S+2AgNO 3===Ag 2S ↓+2HNO 33.SO 2与SO 3 酸性氧化物的通性:SO 2+H 2O===H 2SO 3SO 3+H 2O===H 2SO 4(要形成酸雾,常用98.3%的浓硫酸吸收三氧化硫) SO 2+2NH 3+H 2O===(NH 4)2SO 3(这是硫酸厂回收SO 2的反应.先用氨水吸收SO 2,2NH 4HSO 3+H 2SO 4===(NH 4)2SO 4+2H 2O+2SO 2(生成的硫酸铵作化肥,SO 2循环作原料气)SO 2+Ca(OH)2===CaSO 3+H 2O(不能用澄清石灰水鉴别SO 2和CO 2.可用品红鉴别) SO 3+Ca(OH)2===CaSO 4+H 2O还原性:2SO 2+O 2250V O 450C垐垐?噲垐?2SO 3 2SO 2+O 2+2H 2O===2H 2SO 4(这是SO 2在大气中缓慢发生的环境化学反应) SO 2+X 2+2H 2O===H 2SO 4+2HX(X=Cl/Br/I) SO 2+NO 2===SO 3+NO氧化性:SO 2+2H 2S===3S+2H 2O SO 3+2KI===K 2SO 3+I 2 4、亚硫酸不稳定性:H 2SO 3===H 2O+SO 2↑ 氧化性:2H 2SO 3+2H 2S===3S+2H 2O还原性:H 2SO 3+X 2+H 2O===H 2SO 4+2HX(X 表示Cl 2,Br 2,I 2) 2H 2SO 3+O 2===2H 2SO 4 H 2SO 3+H 2O 2===H 2SO 4+H 2O5H 2SO 3+2KMnO 4===2MnSO 4+K 2SO 4+2H 2SO 4+3H 2O H 2SO 3+2FeCl 3+H 2O===H 2SO 4+2FeCl 2+2HCl3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O5.硫酸H2SO4(稀)+Fe===FeSO4+H2浓硫酸的氧化性:H2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe△Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2O2H2SO4(浓)+C△CO2+2SO2↑+2H2O2H2SO4(浓)+S△3SO2↑+2H2OH2SO4(浓)+2HBr△SO2↑+Br2+2H2OH2SO4(浓)+2HI△SO2↑+I2+2H2OI2 + 2Na2S2O3 ===2NaI + Na2S4O6S2O32- + 2H+ === SO2↑+ S↓+H2O三、氮及氮的化合物(△3(NH化肥H2NHCa(OH)23(△)3存在化合态土壤NH4+/NO3-生物体中蛋白质NH4++OHA.N21.性质:由于N≡N键很牢固,通常状况下性质稳定,在高温、高压、放电等条件下,能与一些物质反应。
