缺血-再灌注损伤的发生机制
肾脏缺血再灌注损伤机制

肾脏缺血再灌注损伤机制一、前言肾脏是人体重要的器官之一,其主要功能为排泄代谢产物、维持电解质平衡和调节血压等。
然而,由于多种原因,如心血管疾病、肾脏疾病等,肾脏缺血再灌注损伤(ischemia-reperfusion injury, IRI)已成为临床常见的问题之一。
本文将从机制方面对肾脏缺血再灌注损伤进行详细探讨。
二、缺血再灌注损伤的定义缺血再灌注损伤是指在组织或器官发生缺血后再次供氧供血时所引起的一系列不可逆性或可逆性的生理和生化反应过程。
在临床上,IRI通常出现在器官移植、冠心病介入治疗、心脏手术等情况下。
三、IRI发生机制1. 缺氧引起能量代谢紊乱当组织或器官发生缺氧时,由于ATP生成减少,导致能量代谢紊乱。
此时,细胞内ATP水平降低会导致Na+/K+-ATP酶活性下降,细胞内钠离子增加,钙离子内流,从而引起细胞肿胀和膜损伤。
此外,缺氧还会导致线粒体功能障碍和ROS生成增加。
2. 再灌注引起氧化应激反应再灌注时,组织或器官会受到一系列的氧化应激反应影响。
再灌注后,由于氧供应恢复,线粒体内的呼吸链会被激活,从而产生一系列自由基(ROS)和活性氮(RNS)。
这些自由基和RNS可造成脂质过氧化、蛋白质氧化、DNA损伤等。
3. 炎症反应IRI也会导致炎症反应的发生。
在缺血时,组织或器官受到严重的缺血和低氧环境的影响,导致细胞死亡和坏死。
当再灌注时,坏死细胞释放出许多危险信号分子(DAMPs),如高迁移率族蛋白-1(HMGB-1)、热休克蛋白(HSPs)等,这些信号分子会激活免疫系统,从而引起炎症反应。
4. 凋亡和坏死IRI还会导致细胞凋亡和坏死。
在缺血时,细胞内ATP水平下降,导致凋亡抑制因子(IAPs)失活,从而导致凋亡的发生。
同时,在再灌注时,由于氧化应激和炎症反应的作用,细胞也会发生坏死。
四、IRI的影响因素1. 缺血时间缺血时间是影响IRI严重程度的重要因素。
一般来说,缺血时间越长,IRI越严重。
骨骼肌缺血再灌注损伤机制

骨骼肌缺血再灌注损伤机制骨骼肌缺血再灌注损伤(ischemia-reperfusion injury, IRI)是指骨骼肌组织在缺血一段时间后重新灌注血液时发生的损伤现象。
缺血再灌注损伤机制复杂,涉及多种生物学过程。
缺血阶段:1. 血流供应不足:由于血管堵塞或狭窄等原因,骨骼肌组织无法得到足够的血流供应,导致氧气和营养物质供应不足。
2. 细胞能量缺乏:缺血导致ATP生成减少,细胞无法维持正常的代谢活动和功能,进而引发细胞死亡。
再灌注阶段:1. 缺血-再灌注诱导的氧化应激:当血流重新供应到缺血骨骼肌组织时,氧气重新进入细胞,导致氧化应激反应,产生大量的活性氧(reactive oxygen species, ROS),如超氧阴离子、过氧化氢和羟基自由基等。
这些ROS能够引发氧化损伤,导致细胞膜的脂质过氧化、细胞骨架的蛋白质氧化、DNA断裂等。
2. 炎症反应的激活:缺血再灌注损伤能够激活炎症反应,包括细胞黏附分子和细胞因子的表达,引起炎性细胞浸润和炎性介质的释放。
炎症反应进一步加剧细胞损伤和细胞死亡。
3. 钙离子失衡:缺血再灌注损伤会破坏细胞内外的钙离子平衡,导致细胞内钙浓度增加。
高浓度的细胞内钙离子可以引发线粒体膜通透性转变、肌纤维收缩的持续性、激活酶和信号通路等,从而对细胞产生损伤。
4. 肌纤维溶解和细胞凋亡:缺血再灌注损伤可导致骨骼肌肌纤维的破裂和溶解,损害肌细胞的结构和功能。
同时,缺血再灌注损伤还能够激活细胞凋亡,进一步加剧细胞死亡。
总的来说,骨骼肌缺血再灌注损伤机制是一个复杂的过程,涉及氧化应激、炎症反应、钙离子失衡、肌纤维溶解和细胞凋亡等多个方面,这些因素相互作用,共同促使骨骼肌细胞发生损伤和死亡。
了解这些机制,有助于针对性地预防和治疗骨骼肌缺血再灌注损伤。
心肌缺血-再灌注损伤的发病机制概述

心肌缺血-再灌注损伤的发病机制概述心肌缺血-再灌注损伤是一种常见的心脏疾病,可以导致心肌死亡、心力衰竭等严重后果。
其发病机制十分复杂,包括氧化应激反应、炎症反应、细胞凋亡等多种生理和分子机制。
本文将对其主要发病机制进行概述。
1. 氧化应激反应:缺血导致心肌细胞缺氧,使得细胞无法正常进行氧化磷酸化反应,从而降低ATP的合成,导致细胞能量代谢失衡。
同时,缺血还可引起一系列氧自由基及其他活性氧的释放和生成,继而形成氧化应激反应。
氧化应激反应会引发一系列信号传递通路的改变,如c-Jun N-末端激酶、p38-MAPK等信号通路的激活,从而导致心肌细胞的损伤。
2. 炎症反应:缺血再灌注过程中,炎症细胞及其激活因子的释放是重要的病理生理过程。
再灌注会刺激各种炎性细胞的激活,特别是中性粒细胞激活,产生一系列炎症介质。
这些炎症介质一方面可以直接破坏心肌细胞,另一方面也能诱导心肌细胞和免疫细胞分泌炎性介质,形成炎症反应。
炎症反应可引起心肌细胞凋亡、坏死和细胞外基质降解等病理变化。
3. 细胞凋亡:缺血再灌注损伤引起心肌细胞凋亡的机制可能与缺血引起线粒体功能障碍和细胞内Ca2+过载有关。
缺血冲击过程中线粒体内膜通透性的增加可导致细胞死亡,而Ca2+的过载也是细胞死亡的重要因素。
Bcl-2家族的蛋白激活是载线粒体膜通透性和细胞凋亡的重要因素;P53对心肌细胞凋亡发挥着重要作用。
心肌细胞凋亡的细胞死亡类型表明其可通过积极调控诱导凋亡途径减轻心肌损伤。
针对心肌缺血-再灌注损伤的发病机制,目前已有不少针对性的治疗策略。
例如,抗氧化剂、抗炎药物和ATP敏感性钾通道开放剂等可用于减轻氧化应激和炎症反应;缩短再灌注时间、预处理干细胞等可用于减轻心肌细胞凋亡等。
尽管这些治疗策略在临床上有着一定的成效,但其对病因机制的理解和干预仍有待进一步探讨。
缺血-再灌注损伤

机制:
内皮素 (ET) ↑ 一氧化氮(NO)↓
血栓素A2(TXA2)↑
前列环素(PGI2)↓
后果:
有助于无复流现象的发生,加重组织损伤
(3)微血管通透性增高
机制:可能与白细胞释放的某些炎性介质有关
后果:①引发组织水肿
②导致血液浓缩,有助于形成无复流现象
③有利于中性粒细胞从血管内游走到细胞间隙,
直接释放细胞因子造成组织细胞的损伤
(三)心肌超微结构变化
肌原纤维结构破坏 (出现严重收缩带、肌丝断裂、溶解) 线粒体损伤 (极度肿胀、嵴断裂、溶解,空泡形成、 基质内致密物增多)
台湾野柳公园蘑菇石
二、脑缺血-再灌注损伤的变化 (一)脑能量代谢变化
ATP等均在短时间内减少 cAMP含量增加
cGMP含量下降
(二)脑氨基酸代谢变化
诊断: 心肌梗塞 问题:
1、为什么在溶栓后出现严重的心律失常?
2、如何防治?
台湾阿里山
3、核酸及染色体破坏 染色体畸变
核酸碱基改变
DNA断裂
(四)判断指标
O2-、OH· 1O2、H2O2 、
XO
MDA ( LPO )
SOD、CAT、GSH-PX VitC、VitE、 VitA
台东八仙台
二、钙超载
(一)钙超载的概念
钙超负荷
calcium overload CO
各种原因引起的细胞内钙含量异常增多 并导致细胞结构损伤和功能代谢障碍的现象
膜磷脂降解→线粒体膜受损→ATP生成↓→细胞膜、 肌浆网Ca2+ 泵功能障碍→胞浆Ca2+↑
(三)钙超载引起缺血-再灌注损伤的机制
1、激活XO→OFR生成↑ 2、激活ATP酶→加重细胞内酸中毒 3、激活PL→膜磷脂降解→直接造成生物膜受损
急性心肌梗死缺血再灌注损伤的机制及其药物防治进展

三、药物防治进展
1、抗氧化损伤药物
抗氧化损伤药物是一类能够清除氧自由基、抑制氧化应激反应的药物,如维 生素C、维生素E、硫辛酸等。这些药物可减轻IRI引起的氧化应激反应,保护心 肌细胞。
2、血管扩张药物
血管扩张药物可以扩张冠状动脉,增加心肌血流量,减轻心肌缺血。其中, 硝酸酯类药物是常用的血管扩张药物,可减轻IRI,保护心脏功能。
背景
心肌缺血再灌注损伤的发病机制涉及多个方面,其中自由基损伤、钙离子超 载、炎症反应和细胞凋亡等是关键因素。在心肌缺血期间,能量代谢障碍导致自 由基大量产生,当血液重新流经缺血心肌时,自由基引发氧化应激反应,进而导 致心肌细胞损伤和凋亡。此外,钙离子超载也在心肌缺血再灌注损伤中起到重要 作用,细胞内钙离子浓度异常升高,导致心肌细胞收缩功能障碍,最终引发心肌 损伤。
参考内容
引言
心肌缺血再灌注损伤是指心肌在短暂缺血后重新获得血液供应时所导致的进 一步损伤。这种损伤往往比单纯缺血所造成的损伤更加严重,因此对其发病机制 和防治策略进行深入探讨具有重要意义。本次演示将详细阐述心肌缺血再灌注损 伤的发病机制、症状及危害、实验研究、药物治疗以及其他防治策略,以期为临 床提供有力参考。
1、自由基清除剂:如维生素C、E等,可清除体内自由基,减轻氧化应激反 应,保护心肌细胞。
2、钙离子通道阻滞剂:如硝苯地平、维拉帕米等,可抑制钙离子内流,减 轻钙离子超载引起的细胞损伤。
3、抗炎药物:如阿司匹林、氯吡格雷等,可抑制炎症反应,减轻心肌细胞 的进一步损伤。
4、细胞凋亡抑制剂:如某些抗肿瘤药物,可抑制心肌细胞凋亡,延长细胞 生命。
急性心肌梗死缺血再灌注损伤的机 制及其药物防治进展
目录
01 一、缺血再灌注损伤 机制
缺血再灌注损伤机制

缺血再灌注损伤机制缺血再灌注损伤(ischemia-reperfusion injury)是一种普遍存在的生理现象,常见于心血管外科手术、心肌梗死、脑中风等各种临床情况中。
本文将以缺血再灌注损伤机制为主题,从深度和广度两个方面探讨该主题的各个方面,以帮助读者更全面地理解这一现象。
一、缺血再灌注损伤的基本概念缺血再灌注损伤指的是当组织或器官遭受缺血(血液供应中断)一段时间后,再次供血恢复时所引发的损伤反应。
尽管再灌注的目的是恢复局部供血,但却可能对组织或器官造成更严重的伤害,导致细胞坏死、炎症反应和功能丧失等不良后果。
二、缺血再灌注损伤的机制1. 氧化应激和自由基产生在缺血时,组织或器官缺乏氧气和能量供应,导致线粒体功能障碍和ATP合成降低。
当再灌注发生时,由于血液中大量的氧气重新供应,导致活化的线粒体释放更多反应性氧种和自由基,从而引发氧化应激反应,破坏细胞膜和细胞器功能。
2. 炎症反应激活缺血再灌注损伤可引发炎症反应,释放细胞因子、趋化因子和炎症介质,进一步导致炎症细胞浸润、血管扩张和血小板聚集等炎症反应。
这些炎症反应激活了免疫细胞和炎性细胞,进一步加剧了组织损伤。
3. 钙离子紊乱缺血再灌注损伤会导致细胞内和细胞外钙离子浓度失衡,破坏细胞内钙离子平衡和细胞外钙离子浓度梯度。
这种钙离子紊乱会引发线粒体功能失调、细胞凋亡和细胞死亡等多种病理生理过程。
4. 血管内皮功能损伤缺血再灌注损伤可导致血管内皮细胞的受损和功能异常,进而引发血管扩张、血小板聚集和血管渗透性增加等现象。
这些改变会进一步造成血管内皮功能的破坏,加重缺血再灌注损伤。
三、缺血再灌注损伤防治策略1. 保护组织氧供在缺血再灌注过程中,保持良好的氧供对减轻损伤非常重要。
提前做好血液输注、氧气供应和改善心血管循环等措施,可以有效预防缺血再灌注损伤的发生。
2. 抗氧化治疗应用抗氧化剂,如维生素C、维生素E和谷胱甘肽等,可以减轻缺血再灌注引起的氧化应激反应。
缺血再灌注损伤机制
PARALLEL研究是迄今为至规模最大的曲美他嗪随机对照研究。 PARALLEL研究是迄今为至规模最大的曲美他嗪随机对照研究。该研究入 研究是迄今为至规模最大的曲美他嗪随机对照研究 选903例稳定性心绞痛患者,在β受体阻滞剂的基础上随机加用曲美他 903例稳定性心绞痛患者, 例稳定性心绞痛患者 嗪或长效硝酸酯(硝酸异山梨酯)治疗12周 嗪或长效硝酸酯(硝酸异山梨酯)治疗12周,结果联合曲美他嗪组每周 12 心绞痛次数较基线时显著降低75.9%, 心绞痛次数较基线时显著降低75.9%,每周硝酸甘油用量较基线时显著 75.9% 降低78.8%,且显著低于联用硝酸酯组。 降低78.8%,且显著低于联用硝酸酯组。 78.8%
结
果
1.显著降低心绞痛发作次数(75.9% 61.6%,p<0.0001) %,p<0.0001 1.显著降低心绞痛发作次数(75.9%比61.6%,p<0.0001) 2.减少硝酸甘油用量(78.8% 63.2%,p<0.0001) %,p<0.0001 2.减少硝酸甘油用量(78.8%比63.2%,p<0.0001) 3.联用曲美他嗪抗心绞痛作用更强,尤其对60岁以 3.联用曲美他嗪抗心绞痛作用更强,尤其对60岁以 联用曲美他嗪抗心绞痛作用更强 60 上的患者及糖尿病患者 4.曲美他嗪组对稳定型心绞痛患者的生活质量的 4.曲美他嗪组对稳定型心绞痛患者的生活质量的 改善更佳 5.曲美他嗪组不良反应发生率显著降低。 5.曲美他嗪组不良反应发生率显著降低。 曲美他嗪组不良反应发生率显著降低
因缺血、 生成减少, 因缺血、缺氧使 ATP 生成减少,钙离子进入细胞 增多,使细胞膜损伤,以及线粒体功能受损。 增多,使细胞膜损伤,以及线粒体功能受损。 1.再灌注时,氧气的增多,就会生成大量的氧自由 1.再灌注时,氧气的增多,就会生成大量的氧自由 再灌注时 基。由于线粒体功能此时尚未恢复,所以对于氧自由基 由于线粒体功能此时尚未恢复, 的 清除能力不足,导致氧自由基增多。氧自由基的增 清除能力不足,导致氧自由基增多。 多,就会对膜磷脂造成损伤,包括细胞膜,细胞器膜 就会对膜磷脂造成损伤,包括细胞膜, 如线粒体膜,溶酶体膜,内质网膜等等的损伤, 如线粒体膜,溶酶体膜,内质网膜等等的损伤,会进 一步损伤细胞。同时氧自由基的增多还会对蛋白质, 一步损伤细胞。同时氧自由基的增多还会对蛋白质, 核酸及细胞外基质造成损伤,从而加重了细胞的凋亡 加重了细胞的凋亡。 核酸及细胞外基质造成损伤,从而加重了细胞通透性增强, 2.再灌注时,由于细胞膜的损伤,通透性增强,使大量的 再灌注时 钙离子顺浓度梯度内流,造成细胞内钙超载 钙超载; 钙离子顺浓度梯度内流,造成细胞内钙超载;同时线 粒体功能的障碍,ATP生成减少, 粒体功能的障碍,ATP生成减少,肌膜及肌浆网膜钙泵 生成减少 功能障碍,不能排出和摄取细胞浆中过多的钙,致使 功能障碍,不能排出和摄取细胞浆中过多的钙, 细胞浆中游离钙浓度增加而进一步造成钙超载。 细胞浆中游离钙浓度增加而进一步造成钙超载。而钙 超载会进一步加重细胞的凋亡。 超载会进一步加重细胞的凋亡。 加重细胞的凋亡
肝脏缺血再灌注损伤发生机制和预防

肝脏缺血再灌注损伤发生机制和预防肝脏是人体最大的器官之一,负责代谢、排泄和合成。
但是,肝脏也是一个容易受到缺血再灌注损伤(I/R)的器官之一。
缺血再灌注损伤是指器官在缺血导致的缺氧状态下再次输送氧气和营养物质时发生的损伤。
肝脏缺血再灌注损伤是肝移植、肝手术等医疗过程中常见的问题。
为了更好地了解肝脏缺血再灌注损伤的发生机制和预防方法,我们需要深入探讨。
一、肝脏缺血再灌注损伤的发生机制肝脏缺血再灌注损伤的发生机制非常复杂。
一般来说,它主要包括以下几个方面:1.缺血造成的低氧状态。
肝脏在缺血的情况下会失去氧气和营养物质,导致细胞内能量供应不足。
这会引起一系列的代谢变化,导致细胞功能异常和细胞死亡。
2.再灌注引起的氧化损伤。
再灌注时,由于氧的重新供应和自由基的产生,肝脏受到氧化损伤是不可避免的。
有研究表明,再灌注会引起一系列活性氧和活性氮物质的释放,导致细胞膜脂质过氧化,细胞结构受损以及特定信号通路的激活。
3.炎症反应的加剧。
缺血再灌注会激发机体的免疫反应,释放炎性因子。
炎性因子参与了炎症反应,具有促进组织的修复和再生作用,但是如果炎症反应过激,会对肝脏造成更大的伤害。
二、肝脏缺血再灌注损伤的预防虽然无法完全避免肝脏缺血再灌注损伤的发生,但是有一些方案可以采取降低其发生概率和降低损伤的程度。
1.改善缺血再灌注所引起的低氧状态。
操作者要做好肝脏缺血的手术、麻醉等方面工作,尽量减轻缺血时导致的缺氧状态。
术前可给予适当的补氧、红细胞输血以及弥散性氧压监测等措施。
2.抗氧化剂的应用。
可以在手术中使用一些抗氧化剂来减轻再灌注时引起的氧化损伤。
例如,维生素C、维生素E、谷胱甘肽等抗氧化剂。
3.预防和调节炎症反应。
在肝移植或手术前,可以使用类固醇、非甾体抗炎药等药物,抑制机体的炎症反应,减少对肝脏的损伤。
4.加强监测和术后支持。
在肝移植或手术后,需要密切监测患者的肝功能,并进行必要的支持治疗,包括输血、肝素治疗、饮食调整等等。
钙超载导致缺血再灌注损伤的机制

钙超载导致缺血再灌注损伤的机制一、引言缺血再灌注损伤(ischemia-reperfusion injury,IRI)是指在缺血状态下组织或器官遭受损伤后再次灌注时发生的一系列病理生理过程。
钙离子在IRI中起着重要的作用,因此钙超载是引起IRI的一个重要机制之一。
二、钙离子在细胞内的作用钙离子在细胞内参与多种生理过程,如神经传递、肌肉收缩、细胞增殖和凋亡等。
在正常情况下,钙离子浓度由多种调控机制保持稳定。
当细胞受到刺激时,如神经冲动或荷尔蒙刺激等,钙离子通道会打开,使得细胞内钙离子浓度升高。
随后,通过多种机制将钙离子重新排泄出去或储存到内质网中。
三、缺血再灌注损伤的发生机制IRI发生的机制非常复杂,在缺血期间由于氧供不足和代谢产物积累导致ATP水平降低。
当氧和营养物质再次供应时,代谢产物被快速清除,细胞内钙离子水平迅速升高。
这种急剧的钙超载会引起多种病理生理反应,如氧化应激、线粒体功能障碍和细胞凋亡等。
四、钙超载在IRI中的作用1. 氧化应激缺血期间细胞内ATP水平下降,导致线粒体功能障碍和ROS的产生。
当氧和营养物质再次供应时,氧化应激会加剧,并且钙超载也会增加ROS的产生。
这些过量的ROS会进一步破坏线粒体和其他细胞器,并损伤DNA、蛋白质和脂质等分子。
2. 线粒体功能障碍缺血期间ATP水平下降,导致线粒体功能受损。
当氧和营养物质再次供应时,急剧的钙超载会引起线粒体通透性转变(mitochondrial permeability transition,MPT),导致线粒体膜电位下降、ATP合成减少和ROS产生增加等不良反应。
3. 细胞凋亡钙超载也会引起细胞凋亡。
在缺血期间,钙离子的浓度下降,导致细胞内多种酶活性下降。
当氧和营养物质再次供应时,急剧的钙超载会引起多种酶活性的增加,如磷酸酶、核酸酶和蛋白酶等。
这些过量的酶活性会引起DNA断裂、蛋白质降解和细胞凋亡等不良反应。
五、预防和治疗IRI的方法由于IRI发生机制非常复杂,目前尚未有有效的治疗方法。
病理生理学ppt课件-第七章--缺血-再灌注损伤

胞所致者为继发
第二节 缺血-再灌注损伤的发生机制
3.线粒体受损
➢ 缺血和再灌注使ATP含量减少,Ca2+经钙泵摄入肌浆 网减少,进入线粒体增多,使线粒体细胞色素氧化酶 系统功能失调,以致进入细胞内的氧,经4价还原生成 的水减少,经单电子还原而形成的活性氧基增多
一、自由基生增多 二、钙超载在缺血-再灌注中的作用 三、白细胞的作用
第二节 缺血-再灌注损伤的发生机制
一、自由基生增多
(一)自由基的概念、特性、类型 ➢ 自由基(free radical)系指外层电子轨道上有单个不配 对电子的原子、原子团和分子的总称,又称游离基 ➢ 其中由氧诱发产生的自由基称为氧自由基 ➢ 活性氧(ROS)和活性氮(RNS)则是指由氧(氮)形成、 并在分子组成上含有氧(氮)的一类化学性质非常活 泼的物质总称
2.其他 氧自由基与多聚不饱和脂肪酸作用后生成的中间代谢
产物,如烷自由基(L∙)、烷氧基( LO ∙、烷过氧基(LOO ∙)等,属于 脂性自由基。
第二节 缺血-再灌注损伤的发生机制
(二)代谢和生物学意义
➢ 当氧在体内获得1个电子时还原生成O2-.,获得2个电子 时生成H2O2,获得3个电子时生成OH·
第二节 缺血-再灌注损伤的发生机制
2.中性粒细胞聚集及激活
➢ 中性粒细胞在吞噬过程中,其摄取氧的绝大部分(70%-90%)在 NADPH氧化酶和NADH氧化酶的催化下接受电子生成氧自由基, 用以杀灭病原微生物及异物
➢ 白细胞吞噬时伴耗氧量显著增加的现象,称为呼吸暴发 (respiratory burst) 或氧暴发
缺血-再灌注损伤发生机制

抑制ATP形成.
2. 细胞膜性结构受损
激活膜磷脂酶A2
3. 促进氧自由基生成
Ca2+↑ XD向XO转化↑
自由基↑
三、微血管损伤和白细胞的作用
(一). 血管内皮细胞与白细胞激活
白细胞
内皮细胞
内皮释放 粘附分子
白细胞释放
趋化介质
(二)介导的缺血-再灌注损伤
① 微血管损伤(无复流现象,no-reflow phenomenon) ② 细胞损伤
ATP→ADP→AMP
缺
腺嘌呤核苷
血
次黄嘌呤核苷
期
次黄嘌呤
黄嘌呤脱氢酶
Ca2+
黄嘌呤氧化酶
O 黄嘌呤+ 2·-+H2O2
再 灌
O2 O2
黄嘌呤 氧化酶
注
尿酸+O2·-+H2O2
期
OH
1. 黄嘌呤氧化酶的形成增多
·
2. 中性粒细胞的大量聚集及激活:呼吸爆发
缺血
激活补体系统
细胞膜分解 趋素氧化酶系统功能失调
4. 儿茶酚胺自身氧化
㈢ 自由基的损伤作用
1. 膜脂质过氧化 2. 蛋白质的功能抑制 3. 破坏核酸和染色体
穿膜糖 蛋白
CH3-S-
膜表面蛋白
SH-SH
磷脂
蛋白质断 裂
蛋白质-蛋 白质交联
二硫交联
-S-S-
脂质-蛋白 质交联
OH HO
CH3-S-
2. 细胞膜通透性增高
3.离子泵功能障碍 4. 儿茶酚胺增多
缺血时,内源性儿茶酚胺释放,刺激α、β受 体,引起Ca2+内流增加。
去甲肾上腺素
H+
α1
P1
缺血再灌注损伤的机制

缺血再灌注损伤的机制缺血再灌注损伤是指在缺血状态下,组织或器官再次得到血液供应后发生的损伤。
这种损伤常见于心脏、肾脏、肝脏和脑等重要器官。
缺血再灌注损伤的机制非常复杂,包括多种细胞和分子水平的变化。
以下将详细介绍缺血再灌注损伤的机制。
一、氧自由基产生在缺血状态下,组织或器官受到氧供应不足,导致细胞内氧化还原平衡被破坏。
当再次进行灌注时,氧气与组织内积聚的还原性物质相遇,产生大量的氧自由基。
这些氧自由基具有高度活性,可以攻击细胞膜、核酸和蛋白质等重要分子结构,导致细胞功能受损。
二、钙离子内流缺血状态下,由于能量供应不足,ATP合成减少,导致钙泵活性下降。
当再次进行灌注时,ATP合成恢复正常,并且大量的钙离子进入细胞内。
这些钙离子与细胞内的蛋白质结合,导致蛋白质构象变化,进而影响细胞的正常功能。
三、炎症反应激活缺血再灌注损伤会导致炎症反应的激活。
在缺血状态下,组织或器官释放一系列的炎症介质,如肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)和白介素-6(IL-6)等。
当再次进行灌注时,这些炎症介质会引起免疫细胞的激活和聚集,进一步加剧组织损伤。
四、线粒体功能障碍缺血再灌注损伤还会导致线粒体功能障碍。
线粒体是细胞内的能量生产中心,当缺血发生时,线粒体受到严重的能量供应不足。
再次进行灌注后,氧气供应恢复,并且大量氧自由基产生,进一步损害线粒体结构和功能。
线粒体功能障碍会导致ATP合成减少,细胞能量供应不足,进而引发细胞死亡。
五、细胞凋亡和坏死缺血再灌注损伤还会导致细胞凋亡和坏死。
在缺血状态下,细胞受到严重的氧供应不足和能量供应不足,导致细胞内的代谢紊乱。
当再次进行灌注时,氧气供应恢复,但由于前述机制的作用,细胞受到进一步损伤。
一部分细胞会发生凋亡,即程序性细胞死亡;另一部分则会发生坏死,即非程序性细胞死亡。
六、血管功能障碍缺血再灌注损伤还会引起血管功能障碍。
在缺血状态下,血管内皮功能受损,导致内皮层的通透性增加。
缺血-再灌注损伤的发生机制

⼀、⾃由基的作⽤ (⼀)⾃由基的概念与类型 ⾃由基(freeradical)的化学性质极为活泼,易于失去电⼦(氧化)或获得电⼦(还原),特别是其氧化作⽤强,故具有强烈的引发脂质过氧化的作⽤。
⽣理情况下,细胞内存在的抗氧化物质可以及时清除⾃由基,使⾃由基的⽣成与降解处于动态平衡;对机体并⽆有害影响。
病理情况下,由于活性氧⽣成过多或机体抗氧化能⼒不⾜,则可引发链式脂质过氧化反应损伤细胞膜,进⽽使细胞死亡。
其种类很多,主要包括: 1.氧⾃由基 2.脂性⾃由基 3.其它 (⼆)氧⾃由基⽣成增多的机制 1.黄嘌呤氧化酶的形成增多黄嘌呤氧化酶(xanthineoxidase,XO)及其前⾝黄嘌呤脱氢酶(xanthinedehydrogenase,XD)主要存在于⽑细⾎管内⽪细胞内。
正常情况下,90%以XD的形式存在,XO仅占10%。
1)当组织缺⾎缺氧时,由于ATP含量降低,离⼦转运功能障碍,Ca2+进⼊细胞激活Ca2+依赖性蛋⽩酶,促使XD⼤量转变为XO. 2)由于ATP分解,ADP、AMP含量升⾼,并依次分解⽣成次黄嘌呤,故缺⾎组织中次黄嘌呤⼤量堆积。
再灌注时,⼤量分⼦氧随⾎液进⼊缺⾎组织,XO在催化次黄嘌呤转变为黄嘌呤并进⽽催化黄嘌呤转变为尿酸的两步反应中,释放出⼤量电⼦,为分⼦氧接受后产⽣O-2和H2O2.H2O2在⾦属离⼦参与下形成更为活跃的OH.,使组织O-2、OH.、H2O2等活性氧⼤量增加。
2.中性粒细胞中性粒细胞在吞噬活动时耗氧量增加,其摄⼈O2的70%-90%在NADPH氧化酶和NADH氧化酶的催化下,接受电⼦形成氧⾃由基,⽤于杀灭病原微⽣物。
组织缺⾎可激活补体系统,或经细胞膜分解产⽣多种具有趋化活性的物质,如C3⽚段、⽩三烯等,吸引、激活中性粒细胞。
再灌注期组织重新获得O2供应,激活的中性粒细胞耗氧量显著增加,产⽣⼤量氧⾃由基,称为呼吸爆发(respiratoryburst)或氧爆发(oxygenburst),造成细胞损伤。
(优选)肝脏缺血再灌注损伤发生机制及防治

细胞因子
国内研究在鼠肝脏部分缺血再灌注损伤过程 中预先给予参附,通过增加抑炎因子IL-10水 平,降低TNF-α,下调其介导的固有免疫应 答最终减轻肝脏缺血再灌注损伤。 Bibo Ke在肝脏部分缺血再灌注过程中通过 IL-10基因转染小鼠使小鼠血清IL-10 水平增 高导致肝细胞损伤减轻 。
Bibo Ke,Xiu-Da Shen,Sei-Ichiro Tsuchihashi,et al. Human Gene Therapy,2007,18 ( 4 ):355-366.
血红素氧合酶系统
由亚铁血红素释放的CO 可能在不同的细胞 和生物学过程中作为一种调控分子,类似 于NO。这两种物质引起平滑肌松弛,导致 内皮组织血管舒张,这可能是CO 介导的抗 缺血再灌注损伤的细胞保护作用的机制。 在灌注时CO 通过抑制血管收缩维持微循环 血流,减少缺血再灌注损伤相关的微血管 血栓形成。
①微血管内血液流变学改变 ②微血管管腔狭窄,阻碍血液灌流; ③微血管通透性增高 ④激活的中性粒细胞与血管内皮细胞可释放
致炎物质,损伤组织细胞。
3 氧自由基和肝脏缺血再灌注损伤
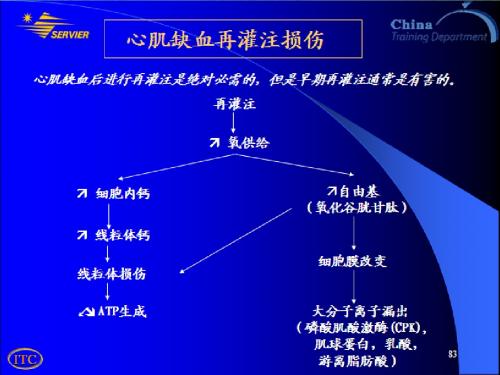
心肌缺血再灌注损伤 机制

心肌缺血再灌注损伤机制
心肌缺血再灌注损伤的机制主要有以下三种理论:
1. 钙超载理论:当心肌缺血缺氧时,心脏就像是一块长期缺乏肥料的土地。
在充氧或再灌流时,会有钙离子进入到细胞中,以尝试对受损的细胞进行修复。
然而,这种钙离子的突然增加会导致细胞内的钙超载,反而加重细胞的损伤。
2. 白细胞渗透论:当组织受到伤害时,细胞的细胞膜会破裂,产生更多的花生四烯酸。
这些物质对人体产生强烈的诱惑力,从而导致大量的白细胞浸润,引发炎症反应。
这种炎症反应在再灌注时可能加重心肌的损伤。
3. 自由基理论:在再灌注过程中,细胞会产生大量的氧自由基。
这些自由基具有强氧化性,会损伤细胞膜和线粒体等细胞结构,导致细胞死亡。
以上内容仅供参考,如需更专业的信息,建议查阅相关文献或咨询专业医生。
缺血再灌注损伤

缺血-再灌注损伤机体组织器官正常代谢、功能的维持,有赖于良好的血液循环。
各种原因造成的局部组织器官的缺血,常常使组织细胞发生缺血性损伤( ischemia injury ),但在动物试验和临床观察中也发现,在一定条件下恢复血液再灌注后,部分动物或患者细胞功能代谢障碍及结构破坏不但未减轻反而加重,因而将这种血液再灌注后缺血性损伤进一步加重的现象称为缺血再灌注损伤( ischemia-reperfusion injury )。
用低氧溶液灌注组织器官或在缺氧的条件下培养细胞一定时间后,再恢复正常氧供应,组织及细胞的损伤不仅未能恢复,反而更趋严重,这种现象称为氧反常( oxygen paradox )。
用无钙溶液灌流大鼠心脏后,再用含钙溶液进行灌流时,心肌细胞的损伤反而加重,称为钙反常( calcium paradox )。
缺血引起的代谢性酸中毒是细胞功能及代谢紊乱的重要原因,但在再灌注时迅速纠正缺血组织的酸中毒,反而会加重缺血再灌注损伤,称为 pH 值反常( PH paradox )。
第一节缺血-再灌注损伤的原因及条件一、原因(一)、组织器官缺血后恢复血液供应如休克时微循环的疏通、冠状动脉痉挛的缓解、心脏骤停后心脑肺复苏等。
(二)、动脉搭桥术、 PTCA 、溶栓疗法等血管再通术后,心脏外科体外循环术、器官移植及断肢再植等。
二、条件并不是所有缺血的组织器官在血流恢复后都会发生缺血 - 再灌注损伤,但许多因素可影响其发生发展和严重程度,常见的原因有:(一)、缺血时间缺血时间的长短与再灌注损伤的发生与否相关,缺血时间过短或过长都不易发生再灌注损伤。
例如:大鼠心肌缺血 2min 以内或 20min 以上进行再灌注,不易发生再灌注损伤;狗心肌缺血 15min 以内或 40min 以上进行再灌注,再灌注损伤不易发生,缺血 15-20min 再灌注,心肌再灌注损伤的发生率高达 25%-50% 。
(二)、侧支循环缺血后侧支循环容易形成者,因可缩短缺血时间和减轻缺血程度,不易发生再灌注损伤,如肺脏。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、自由基的作用(一)自由基的概念与类型自由基(freeradical)的化学性质极为活泼,易于失去电子(氧化)或获得电子(还原),特别是其氧化作用强,故具有强烈的引发脂质过氧化的作用。
生理情况下,细胞内存在的抗氧化物质可以及时清除自由基,使自由基的生成与降解处于动态平衡;对机体并无有害影响。
病理情况下,由于活性氧生成过多或机体抗氧化能力不足,则可引发链式脂质过氧化反应损伤细胞膜,进而使细胞死亡。
其种类很多,主要包括: 1.氧自由基 2.脂性自由基 3.其它(二)氧自由基生成增多的机制 1.黄嘌呤氧化酶的形成增多黄嘌呤氧化酶(xanthineoxidase,XO)及其前身黄嘌呤脱氢酶(xanthinedehydrogenase,XD)主要存在于毛细血管内皮细胞内。
正常情况下,90%以XD的形式存在,XO仅占10%。
1)当组织缺血缺氧时,由于ATP含量降低,离子转运功能障碍,Ca2+进入细胞激活Ca2+依赖性蛋白酶,促使XD大量转变为XO. 2)由于ATP 分解,ADP、AMP含量升高,并依次分解生成次黄嘌呤,故缺血组织中次黄嘌呤大量堆积。
再灌注时,大量分子氧随血液进入缺血组织,XO在催化次黄嘌呤转变为黄嘌呤并进而催化黄嘌呤转变为尿酸的两步反应中,释放出大量电子,为分子氧接受后产生O-2和H2O2.H2O2在金属离子参与下形成更为活跃的OH.,使组织O-2、OH.、H2O2等活性氧大量增加。
2.中性粒细胞中性粒细胞在吞噬活动时耗氧量增加,其摄人O2的70%-90%在NADPH氧化酶和NADH 氧化酶的催化下,接受电子形成氧自由基,用于杀灭病原微生物。
组织缺血可激活补体系统,或经细胞膜分解产生多种具有趋化活性的物质,如C3片段、白三烯等,吸引、激活中性粒细胞。
再灌注期组织重新获得O2供应,激活的中性粒细胞耗氧量显著增加,产生大量氧自由基,称为呼吸爆发(respiratoryburst)或氧爆发(oxygenburst),造成细胞损伤。
(三)自由基的损伤作用自由基发生剂可使正常及缺血组织细胞受到严重损伤,自由基清除剂则可有效减轻缺血-再灌注损伤。
自由基具有极为活泼的反应性,自由基一旦生成,即可经其中间代谢产物不断扩展生成新的自由基,形成连锁反应。
自由基可与各种细胞成分,如膜磷脂、蛋白质、核酸等发生反应,造成细胞结构损伤和功能代谢障碍。
1.膜脂质过氧化(1ipidperoxidation)增强:自由基对磷脂膜的损伤作用主要表现在其可与膜内多价不饱和脂肪酸作用使之发生过氧化,造成多种损害:①破坏膜的正常结构。
脂质过氧化使膜不饱和脂肪酸减少,不饱和脂肪酸/蛋白质的比例失调,膜的液态性、流动性降低,通透性增加,细胞外内流增加;②间接抑制膜蛋白功能。
③促进自由基及其它生物活性物质生成。
形成多种生物活性物质,如前列腺素、血栓素、白三烯等,促进再灌注损伤;④减少ATP生成。
线粒体膜脂质过氧化,导致线粒体功能抑制,ATP生成减少,细胞能量代谢障碍加重。
2.蛋白质功能抑制自由基可使酶的巯基氧化,形成二硫键;也可使氨基酸残基氧化,胞浆及膜蛋白和某些酶交联形成二聚体或更大的聚合物,直接损伤蛋白质的功能 3.破坏核酸及染色体自由基可使碱基羟化或DNA断裂,从而引起染色体畸变或细胞死亡。
