无机化学中常见图形简介综述
化学元素图与解析

[转]化学元素图与解析碳(C)主要性质和用途熔点约为3 550 ℃(金刚石),沸点约为4 827 ℃(升华),密度为3.513 g/cm3(金刚石)、2.260 g/cm3(石墨)(20 ℃)。
用于首饰(金刚石)、炼钢(焦炭)、印刷(炭黑)和精制糖(活性炭)等。
主要性质和用途熔点为-259.1 ℃,沸点为-252.9 ℃,密度为0. 089 88 g/L(10 ℃)。
无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。
工业上用于制造氨、环已烷、甲醇等。
氮(N)主要性质和用途熔点为-209.9 ℃,沸点为-195.8 ℃,密度为1.251 g/L(0 ℃)。
无色无臭气体。
在室温下一般不活泼。
用于制硝酸、化肥、炸药、塑料和染料等。
氧(O)主要性质和用途熔点为-218.4 ℃,沸点为-183.0 ℃,密度为1.429 g/L(0 ℃)。
无色无臭气体。
非常活泼,与除稀有气体以外的所有元素形成氧化物,在水中有一定的溶解性。
用于炼钢、金属切割和化学工业。
氟(F)主要性质和用途熔点为-219.6 ℃,沸点为-188.1 ℃,密度为1.696 g/L(0 ℃)。
淡黄色气体,是最活泼的非金属元素。
用于制氟化试剂以及金属冶炼中的助熔剂等主要性质和用途熔点为-248.7 ℃,沸点为-246.1 ℃,密度为0.899 9 g/L(0 ℃)。
无色无臭气体。
化学性质不活泼。
用于装饰灯(霓红灯广告牌)。
钠(Na)主要性质和用途熔点为97.81 ℃,沸点为883.0 ℃,密度为0.971 g/cm3(20 ℃)。
软的银白色金属,切割时迅速被氧化,跟水剧烈反应。
用于原子反应堆的热交换器中。
镁(Mg)主要性质和用途熔点为648.9 ℃,沸点为1 090 ℃,密度为1.738 g/cm3(20 ℃)。
较软的银白色金属,在空气中燃烧,跟热水反应。
用于制合金以及保护其他金属的牺牲阴极。
硅(Si)主要性质和用途熔点为1410 ℃,沸点为2 355 ℃,密度为2.329 g/cm3(20 ℃)。
无机化学基础知识PPT课件

元素周期表是元素周期律用表 格表达的具体形式,它反映元 素原子的内部结构和它们之间 相互联系的规律。
元素性质递变规律
原子半径
同一周期(稀有气体除外),从 左到右,随着原子序数的递增, 元素原子的半径递减;同一族中, 由上而下,随着原子序数的递增, 元素原子半径递增。
主要化合价
同一周期中,从左到右,随着原 子序数的递增,元素的最高正化 合价递增(从+1价到+7价),第 一周期除外,第二周期的O、F 元素除外;最低负化合价递增 (从-4价到-1价)第一周期除外, 由于金属元素一般无负化合价, 故从ⅣA族开始。元素最高价的 绝对值与最低价的绝对值的和为8。
THANKS
感谢观看
酸碱指示剂
用于指示酸碱反应终点的 试剂,如酚酞、甲基橙等。
沉淀溶解平衡原理及应用
沉淀溶解平衡
应用
在一定条件下,难溶电解质在溶液中 的溶解与沉淀达到动态平衡。
通过控制溶液中的离子浓度,可实现 难溶电解质的分离、提纯和制备。
溶度积常数(Ksp)
表示难溶电解质在溶液中达到沉淀溶 解平衡时,各离子浓度幂的乘积,是 衡量难溶电解质溶解度的重要参数。
元素的金属性和非金 属性
同一周期中,从左到右,随着原 子序数的递增,元素的金属性递 减,非金属性递增;同一族中, 由上而下,随着原子序数的递增, 元素的金属性递增,非金属性递 减。
03
化学键与分子结构
离子键形成及特点
离子键的形成
通过原子间电子转移形成正、负离子,由静电作用相互吸引。
离子键的特点
较高的熔点和沸点,良好的导电性和导热性,在水溶液中易离 解。
03
波尔模型
电子只能在一些特定的轨道上运动,电子在这些轨道上运动时离核的远
化学知识结构框图(超详细)
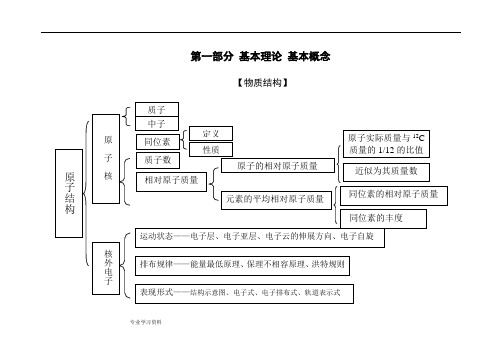
. 专业学习资料 .第一部分 基本理论 基本概念【物质结构】. 专业学习资料.晶体结构. 专业学习资料.晶体熔沸点比较表. 专业学习资料.【元素周期律】. 专业学习资料.【化学反应速率与化学平衡】. 专业学习资料.. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【胶体】【电解质溶液】.. 专业学习资料.. 专业学习资料.【氧化还原反应电化学】. 专业学习资料.【各种化学反应的关系】. 专业学习资料..专业学习资料.【化学反应规律】. 专业学习资料.. 专业学习资料.. 专业学习资料 .【物质的量】nVV n m =→nm M =Vn C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数). 专业学习资料..第二部分 元素及其化合物【元素化合物概述】【非金属元素】. 专业学习资料.【卤族元素】. 专业学习资料.PbS. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【金属元素】.. . .. . ..【铝及其化合物】. 专业学习资料.. 专业学习资料.. 专业学习资料.【化工生产】. 专业学习资料.第三部分 有机物【有机物导学】[有机物推断]浓H2SO4加热苯的硝化醇分子内、间脱水酯化光照——烷基卤代[官能团特征反应]聚酯反应类型与官能团的关系官能团(或物质)的特征反应[各类有机物之间的相互关系]2 =CH 2CH 3 —CH 3 CH CH CH 2 O HCH 3 CH 3 C H 2 C lCH 2 CH 2 Cl CH C HO CHClCH 2-CH NH 2n2HOCH 2 CH 2OHCH 3 C OOHCH 3 C OO CH 2 CH 3第四部分 化学实验导学[物质的分离和提纯][物质的检验][常见气体的实验室制法]第五部分 化学计算。
无机化学常用性质图介绍

当溶液pH增大时,电对的电极电势值减小,到达某一时刻,
会出现 φ<1.065V,这时,φ右θ>φ左θ,Br2可以发生歧化反应。
1.52-0.0709pH<1.065,
pH>6.42。
所以Br2在pH>6.42的介质中可发生歧化反应生成BrO3-和 Br-,pH=6.42称为歧化点。
(6) 对氧化还原的产物作分析判断
如碘在酸性溶液中的电势图为:
+1.19 H5IO6 +1.644 IO3 +1.13 HIO +1.45 I2 +0.54 I
+0.99
在一般的教材或参考书中只介绍两个应用。
(1) 判断元素各种氧化数的相对稳定性(判断是否能发生岐化)
对某一元素,其不同氧化数的稳定性主要取决于相邻电对的 标准电极电势值。若相邻电对的φθ值符合φ右θ> φ左θ,则处于中间 的个体必定是不稳定态,可发生歧化反应,其产物是两相邻的
则所同以理,若-φ有n3θ3=iF个φ3电θn=1对φn1-相θ1++n邻1nnF,22φφ12则θθ+φ(n-θ=n2Fφn12φθ)1n,θ1++其nn2中2φ+2nθ+3=……+n1++ni nni2φiθ
除此之外,能否再发掘一些应用?
(3) 判断元素处于不同氧化数时的氧化还原能力
根据某一电对的电极电势越大,则其氧化型的氧化能力越强, 相应的还原型的还原性越弱的原理。由下列电势图
Cl2+6OH-=ClO3-+5Cl-+3H2O Eθ=φθ(Cl2/Cl-)-φθ(ClO3-/Cl2)=1.358-0.48=0.878(V) Kθ=2.6×1074 说明后一个歧化反应的趋势更大。
(5) 求歧化反应的pH值
下面是溴元素在酸性介质中的电势图
无机化学中常见图形简介

(4) 计算歧化反应和或歧化反应的限度 歧化反应或歧化反应进行的限度可以由反应的平衡常数得到 判断。 如,根据碱性介质中氯元素的电势图 φbθ
ClO3 +0.50 ClO +0.40 +0.48 Cl2 +1.358 Cl
可知Cl2可发生歧化反应。歧化产物既可能是ClO-和Cl-,也 可能是ClO3-和Cl-。对于反应 Cl2+2OH-=ClO-+Cl-+H2O Eθ=φθ(Cl2/Cl-)-φθ(ClO-/Cl2)=1.358-0.40=0.958(V) 根据lgKθ=nEθ/0.0592 可算出反应的平衡常数 Kθ=1.7×1016 而对于Cl2的另一歧化反应 Cl2+6OH-=ClO3-+5Cl-+3H2O Eθ=φθ(Cl2/Cl-)-φθ(ClO3-/Cl2)=1.358-0.48=0.878(V) Kθ=2.6×1074 说明后一个歧化反应的趋势更大。
这种图现在称为自由能-温度图,或艾林罕姆图。这种图 在冶金学上具有特别重要的意义。
艾林罕姆图中的线称为某物 质的氧化线。表示物质与 1 mol O 2 作用生成氧化物的过程。如 图中用Ag2O标记的线,表示4Ag + O 2 → 2Ag 2 O ,称为 Ag 的氧化 线,记作Ag→Ag2O或Ag-Ag2O。 用CO→CO2标记的线,表示2CO +O2→2CO2。 这种以消耗1 mol O2生成氧 化物过程的自由能变作为标准来 对温度作图是为了比较的方便。 显然,如果氧化物的化学式不同, 生成氧化物消耗 O 2 的量也不同。 如 A1 → A 1 2 O 3 , 耗 3/ 2 O 2 ; 而 Na →Na2O, 耗1/2 O2, 这显然不好进 行比较。因此就规定以消耗1 mol O2生成氧化物的过程的自由 能变作为标准来作图并进行比较。
如
无机化学diwuzhang 23页PPT文档

四、分子轨道理论
立论:原子轨道重新“组合” 要点: 1.能量相近、对称性匹配的不同原子的原子轨道可以“组合”成数
目相等的分子轨道,能级将发生变化。 2.分子轨道类型
成键分子轨道:能量低于原子轨道,有σ、π 反键分子轨道:能量高于原子轨道,有σ*、π* 3.电子排布遵循原子结构电子排布原理。 4.分子能级顺序 5.电子在成键轨道上,体系能量降低,形成化学键; 电子在反键轨道上,体系能量升高,不利于形成化学键 小结:MO法计算复杂,描述分子几何构型不够直观。
2.等性、不等性杂化
等性杂化:每个杂化轨道完全等同
不等性杂化:每个杂化轨道不完全等同,即杂化轨道中有不参与 成键的孤电子对。
3.满足轨道最大重叠原理
4.满足化学键之间最小排斥原理
(二)杂化类型与分子空间构型:
SP
SP2
SP3
dSP2 dSP3(SP3d) d2SP3(SP3d2)
直线 三角型 四面体 四边形 三角双锥 八面体
二、极化规律及影响因素: ①变形性:离子半径越大,变形性越大; ②极化能力:外加电场或离子自身的电场强弱 离子半径小、电荷多,电场强度越大,极化能力越大 ③结构影响: 离子的结构对其极化能力和变形性影响较大
当半径和电荷相近时,极化能力和变形性与结构关系: 18e、18+2e>9~17e>8e
无机化学课件12-s区元素

对土壤的影响
土壤污染
S区元素在工业生产过程中 可能通过废渣、废气等途 径进入土壤,导致土壤污 染。
土壤质量下降
这些元素在土壤中积累, 可能影响土壤的理化性质 ,导致土壤质量下降。
农产品安全问题
被污染的土壤可能影响农 作物的生长和品质,进而 影响农产品安全。
对大气的影响
大气污染
S区元素可能以气态或颗粒物的形 式排放到大气中,造成大气污染 。
SUMMAR Y
01
S区元素的概述
定义与特性
定义
S区元素指的是元素周期表中第12族(IIIB族)的元素,包括钪(Sc)、钇(Y )、镧(La)、锕(Ac)等。
特性
S区元素都是金属元素,具有金属的通性,如导电、导热、延展性等。它们在化 学反应中通常表现出较强的还原性,易于失去电子成为正离子。
S区元素在自然界中的存在形式
金属氢化物是S区元素与氢反应生成的化合物,它们具有高的能量密度和稳定性。金属氢化物在能源储存和转换领域有潜在的 应用价值。
金属氢化物在工业中有一定的应用,如作为储氢材料和制备其他金属氢化物的原料。此外,一些金属氢化物还具有特殊的物 理和化学性质,可用于制备新型材料和器件。
REPORT
CATALOG
环保催化剂
利用硫元素制备的催化剂可用于 处理工业废气,降低污染物排放 。
合成新物质
含硫化合物
硫单质或硫化物可与其他元素合成多 种含硫化合物,如硫酸、硫代硫酸盐 等。
高分子材料
含硫元素的高分子材料具有特殊性能 ,如耐高温、抗氧化等,在航空、航 天等领域有广泛应用。
REPORT
CATALOG
DATE
REPORT
CATALOG
DATE
无机化学中常见图形简介

正极: 正极:Cu+/Cu 负极: 负极:Cu2+/Cu+
则两边的个体不稳定,可发生逆歧化反应。 若φ左θ>φ右θ,则两边的个体不稳定,可发生逆歧化反应。 如在进行实验时,为防止 +被氧化,常加入铁钉。 如在进行实验时,为防止Fe2+被氧化,常加入铁钉。
电极反应: 电极反应 BrO3-+5e+ 3H2O = 1/2Br2(l)+6OH+ + 电对BrO3-/ Br2的电极电势受溶液 值影响 的电极电势受溶液pH值影响 电对 φ=φθ+ 0.0592 lg(1/[OH-]6) 5 0.0592 lg(1/[OH-]6)=1.0774 5 pH=6.15
E
− − 3
−
= 1 . 0774V − 0.5196V = 0 . 5578 V nE 5×0.5578V = = = 47 . 11 0.0592V 0.0592V = 1 . 29×10 47
lg K K
Br 2 ( l ) + 2OH ( aq ) Br ( aq ) + BrO ( aq ) + H 2 O(aq)
(5) 系统学习元素及其化合物氧化还原性质的变化规律
Cu
2+
+0.153
Cu+ +0.521 Cu
Cu2+ +0.86 CuI -0.185 Cu -0.43 2++1.12 Cu [Cu(CN)2] Cu
在溶液中,Cu+会歧化,不能稳定存在。 在溶液中, 会歧化,不能稳定存在。 生成Cu(I)的沉淀 的沉淀CuI和Cu(I)的络合物离子 的络合物离子Cu(CN)2-后,由于 生成 的沉淀 和 的络合物离子 Cu+离子浓度下降 , φ (Cu+ /Cu)也将下降,从而使 离子浓度下降, 也将下降, 也将下降 从而使Cu(I)可以 可以 稳定存在。 稳定存在。
无机化学配合物的常见几何构型

(Ph4As)2[Fe(NO3)4]
Na3[TaF8]
Na4[Zr(C2O4)4]·3H2O Sn(NO3)4
H4[W(CN)8]·6H2O
Na3[W(CN)8]·4H2O
V(S2CNMe2)4Cl·CH2Cl2
K3[Cr(O2)4]
K4[Nd(NCS)4(H2O)4] (NCS)3
K4[Eu(NCS)4(H2O)4] (NCS)3·2H2O)
反三角棱柱体 D3d
Trigonal antiprism
旋转畸变
八面体的主要畸变方式
f=0 f = 0~60 三棱柱体
两个三角面 相对旋转
D3h
刚性较强 螯合配体
f = 60 三角反棱柱体
八面体的主要畸变方式
旋转畸变
O
O
环庚三烯
酚酮阴离子
短距刚性 螯合配体
R
R
CC SS
CC
S (Se)
S (Se)
Mg[Th(NO3)6]·8H2O
[Pr(naph)6]3+
naph = 1,8-二氮杂萘
NN
都发生畸变
更高配位数
C.N. = 14
[U(BH4)4]中的U(IV) [U(BH4)4] ·2(C4H8O), [U(BH4)4]·OMe2
畸变的双帽六角反棱柱体
配合物的 常见几何构型
C.N. = 2
直线形 角形
D∞h C2v
配体常做桥
C.N.常高于化学计量式所示
主要:Cu+、Ag+、Hg2+配合物 线形 典型:[ClCuCl]-、[NH3AgNH3]+、 [NCHgCN]
锯齿状:
X
X
无机化学ppt课件

配位化合物的命名遵循一定的规则,包括确定中 心原子和配体的名称、标明氧化态和配位数等。
金属有机化合物类型、合成方法和应用前景
01
类型
金属有机化合物包括金属烷基化合物、金属芳基化合物、金属羰基化合
物等,它们在结构和性质上具有多样性。
02
合成方法
金属有机化合物的合成方法包括金属与有机物的直接反应、金属卤化物
离子键和共价键的强度
决定物质的化学性质,如稳定性、反 应活性等。离子键较强,共价键有强 弱之分。
氢键
一种特殊的分子间作用力,存在于含 有氢原子的分子之间,对物质的熔沸 点、溶解度等性质有显著影响。
04
晶体结构与性质
晶体类型及结构特点
01
02
03
04
离子晶体
由正负离子通过离子键结合而 成,具有高熔点、高硬度等特
原子结构模型及发展历程
道尔顿实心球模型
认为原子是坚硬的、不可再分的 实心球体。
汤姆生枣糕模型
发现电子,提出原子像枣糕一样, 电子像枣子一样镶嵌在原子中。
卢瑟福核式结构模型
通过α粒子散射实验,提出原子 的中心有一个带正电的原子核, 电子绕核旋转。
波尔分层模型
引入量子化概念,解释氢原子光 谱,提出电子在特定轨道上运动。
沉淀溶解平衡原理及应用
沉淀溶解平衡定义
在一定条件下,难溶电解质在溶液中的离子浓度达到平衡状态。
沉淀溶解平衡应用
通过控制溶液中的离子浓度,可实现难溶电解质的分离、提纯和制 备。
溶度积常数(Ksp)
表达难溶电解质在溶液中离子浓度平衡关系的常数,可用于判断沉 淀的生成和溶解条件。
难溶电解质溶解度和溶度积常数计算
化学键类型及形成条件
大学无机化学思维导图第四章

02
化学键与分子结构
离子键与离子晶体
离子键的形成
通过正离子和负离子之间的静电吸引力形成 。
离子晶体的特点
高熔点、硬度大、脆性、导电性差(固态) 、溶解性(在水中易溶解)。
离子晶体的结构
离子晶体中,正离子和负离子交替排列,构 成空间点阵结构。
共价键与分子晶体
共价键的形成
通过原子间共用电子对形成。
配位化合物的分类
根据中心原子和配体的种类以及 配位数的不同,配位化合物可分 为不同类型,如单核配合物、多 核配合物等。
配位化合物的组成和命名
配位化合物的组成表示方 法
配位化合物的组成可以用化学式表示,其中 中心原子和配体的比例以及配体的种类和数 目都有特定的表示方法。
配位化合物的命名规则
配位化合物的命名遵循一定的规则,包括中心原子 、配体和配位数的表示,以及配合物类型的指明等 。
大学无机化学思维导 图第四章
contents
目录
• 原子结构与元素周期律 • 化学键与分子结构 • 配位化合物 • 氧化还原反应与电化学 • 固体无机化学简介
01
原子结构与元素周期律
原子结构模型
道尔顿实心球模型
原子是一个坚硬的实心小球,不可再分。
汤姆生枣糕模型
原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了 正电荷,从而形成了中性原子。
分子晶体的特点
低熔点、硬度小、具有弹性、不导电(固态和液态) 、溶解性(在水中难溶解,易溶于有机溶剂)。
分子晶体的结构
分子晶体中,分子间通过范德华力相互吸引,构成晶 体。
金属键与金属晶体
金属键的形成
通过金属原子间自由电子的共享形成。
金属晶体的特点
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.52-0.0709pH<1.065,
pH>6.42。
所以Br2在pH>6.42的介质中可发生歧化反应生成BrO3-和 Br-,pH=6.42称为歧化点。
(6) 对氧化还原的产物作分析判断
例如,由下列电势图判断H2O2与I-发生氧化还原反应的 产物:
由以上分析,只有选择Zn才是合理的。
(4) 计算歧化反应和或歧化反应的限度
歧化反应或歧化反应进行的限度可以由反应的平衡常数得到
判断。பைடு நூலகம்
如,根据碱性介质中氯元素的电势图
φbθ
ClO3 +0.50 ClO +0.40 +0.48
+1.358 Cl 2
Cl
可知Cl2可发生歧化反应。歧化产物既可能是ClO-和Cl-,也 可能是ClO3-和Cl-。对于反应
(2) 求未知电对的电极电势
利用Gibbs函数变化的加合性,可以从几个相邻电对的已知电
极电势求算任一未知的电对的电极电势。
如
A△rG1θ, φ1θ, n1 B△rG2θ, φ2θ, n2 C △rG3θ, φ3θ, n3
已知φ1θ和φ2θ,求φ3θ。
因为
△rG1θ=-n1Fφ1θ
△rG2θ=-n2Fφ2θ
这是很明显的, 如将两相邻电对组成电池, 则中间物种到右边 物种的电对的还原半反应为电池正极反应,而到左边物种的反应 则为负极反应。电池的电动势为Eθ=φ右θ-φ左θ,若φ右θφ左θ, Eθ>0,表示电池反应可自发进行,即中间物种可发生歧化反应。
若相反,φ左θ>φ右θ,则两边的个体不稳定,可发生逆歧化反 应,两头的个体是反应物,产物是中间的那个个体。如根据 Fe3+ +0.771Fe2+ -0.440 Fe ,可以得出结论,在水溶液中Fe3+和 Fe可发生反应生成Fe2+。
△rG3θ=-n3Fφ3θ
由盖斯定律得, △rG3θ= △rG1θ+ △rG2θ
则所同以理,若-φ有n3θ3=iF个φ3电θn=1对φn1-相θ1++n邻1nnF,22φφ12则θθ+φ(n-θ=n2Fφn12φθ)1n,θ1++其nn2中2φ+2nθ+3=……+n1++ni nni2φiθ
除此之外,能否再发掘一些应用?
例如,在钒的系统中欲只使V(Ⅱ)稳定存在,有Zn、Sn2+和 Fe2+三种还原剂,应选择哪一种?
列出钒和Zn、Sn2+和Fe2+的电势图:
0.255
Zn2+-0.76 Zn
V(Ⅴ) 1.00 V(Ⅳ) 0.71 V(Ⅲ)-0.20 V(Ⅱ)-1.50V(0) Sn4++0.15 Sn2+
0.503
Fe3++0.771 Fe2+
而对于Cu元素, 由其电势图 Cu2++0.153Cu+ +0.521 Cu 可知, Cu+的氧化能力大于Cu2+(0.521>0.153),而Cu的还原能力小于 Cu+ (0.153<0.521) 。
在生产及科学研究中,常常要求在系统中只能允许某元素的 某指定氧化数个体稳定存在于溶液,这时,可以通过选择某一合 理的氧化剂或还原剂来达到这一目的。
无机化学常用性质图介绍
元素电势图及其应用 自由能-温度图 溶解度-pH图 自由能-氧化数图 电势-pH图
一 元素电势图及其应用
一种元素的不同氧化数物种按照其氧化数由低到高从左 到右的顺序排成图式,并在两种氧化数物种之间标出相应的 标准电极电势值。这种表示一种元素各种氧化数之间标准电 极电势的图式称为元素电势图,又称拉蒂默图。
Cl2+2OH-=ClO-+Cl-+H2O Eθ=φθ(Cl2/Cl-)-φθ(ClO-/Cl2)=1.358-0.40=0.958(V) 根据lgKθ=nEθ/0.0592 可算出反应的平衡常数 Kθ=1.7×1016 而对于Cl2的另一歧化反应
Cl2+6OH-=ClO3-+5Cl-+3H2O Eθ=φθ(Cl2/Cl-)-φθ(ClO3-/Cl2)=1.358-0.48=0.878(V) Kθ=2.6×1074 说明后一个歧化反应的趋势更大。
为了只使V(Ⅱ)稳定存在于体系,必须保证其它钒的氧化数形
式不可能存在,因此,被选择的还原剂必须符合以下条件:
① φθ[V(Ⅴ)/V(Ⅱ)] > φθ(Mn+/Mm+),只有Zn、Sn2+符合;
② φθ[V(Ⅳ)/V(Ⅱ)] > φθ(Mn+/Mm+),只有Zn、Sn2+符合;
③ φθ[V(Ⅲ)/V(Ⅱ)] > φθ(Mn+/Mm+),只有Zn符合。
(3) 判断元素处于不同氧化数时的氧化还原能力
根据某一电对的电极电势越大,则其氧化型的氧化能力越强, 相应的还原型的还原性越弱的原理。由下列电势图
Fe3+ +0.771Fe2+ -0.440 Fe
可以知道,作为氧化剂,Fe3+的氧化能力大于Fe2+(+0.771>- 0.440);作为还原剂,Fe的还原能力大于Fe2+(-0.440<+0.771)。
(5) 求歧化反应的pH值
下面是溴元素在酸性介质中的电势图
φaθ
BrO 3 +1.50 HBrO +1.60 Br2 +1.065 Br +1.52
表明在标准状态下,Br2能稳定存在,不能发生歧化反应。 但是由方程
BrO3-+5e+6H+ = ½ Br2(l)+3H2O
可以看出:
电对BrO3-/ φ=φθ+
B0.r0255的91电lg极[B电rO势3-受][H溶+液]6 pH值所影响
假定[BrO3-]=1 mol·L-1,则 φ=1.52+(6×0.0591/5)lg[H+] =1.52-0.0709 pH
当溶液pH增大时,电对的电极电势值减小,到达某一时刻,
会出现 φ<1.065V,这时,φ右θ>φ左θ,Br2可以发生歧化反应。
如碘在酸性溶液中的电势图为:
+1.19 H5IO6 +1.644 IO3 +1.13 HIO +1.45 I2 +0.54 I
+0.99
在一般的教材或参考书中只介绍两个应用。
(1) 判断元素各种氧化数的相对稳定性(判断是否能发生岐化)
对某一元素,其不同氧化数的稳定性主要取决于相邻电对的 标准电极电势值。若相邻电对的φθ值符合φ右θ> φ左θ,则处于中间 的个体必定是不稳定态,可发生歧化反应,其产物是两相邻的 物质。如 Cu2++0.153Cu+ +0.521 Cu 中,Cu+可发生歧化反应生成 Cu2+和Cu。
