精细有机合成课后作业题参考答案
精细有机合成习题三
精细有机合成习题三学号班级一、卤代反应1、芳环上亲电取代卤化时,有哪些重要影响因素?答:1)反应物的结构环上已有取代基影响反应活性和取代位置2)催化剂反应试剂一般单质,催化剂用路易斯酸3)原料杂质。
由于使用路易斯酸催化,原料中的水份、某些杂环化合物会影响催化剂的活性,故工业生产中限制芳烃中水含量。
4)反应温度,温度升高,反应速度快,活性提高,但副产物增多。
5)由于该反应表现连串反应特点,随着反应进程增大,副产物增多,在工艺上必须控制卤化深度。
6)工业生产中,反应器类型对反应有影响。
如釜式反应器返混严重,副反应增加,而塔式反应器能够在一定程度上减少返混现象,副反应少。
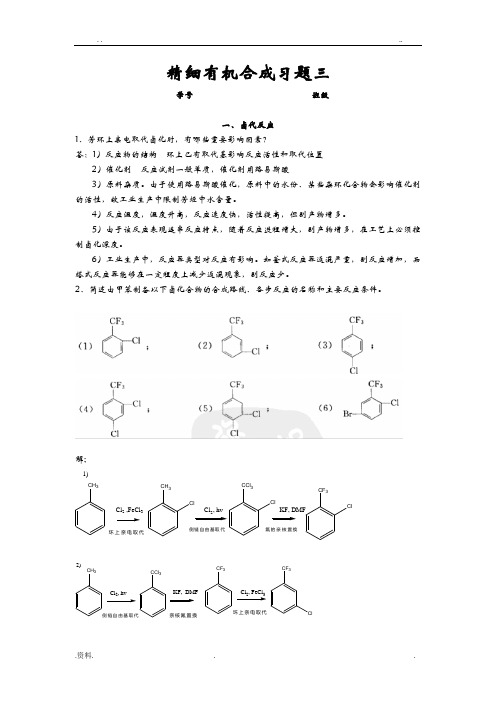
2、简述由甲苯制备以下卤化合物的合成路线、各步反应的名称和主要反应条件。
解;1)CH3Cl2 ,FeCl3CH3ClCl, hvCCl3ClKF, DMFCF3Cl环上亲电取代侧链自由基取代氟的亲核置换2)CH3Cl2, hvCCl3KF, DMFCF323CF3Cl侧链自由基取代亲核氟置换环上亲电取代3)与反应1)类似4)CH 3Cl , FeCl 3CF 3Cl5)CH3CCl 36)CH 33、写出以邻二氯苯、对二氯苯或苯胺为原料制备2,4-二氯氟苯的合成路线、每步反应的名称、各卤化反应的主要反应条件。
ClClFCl环上亲电取代氟亲核置换反应ClCl 2 , FeCl 3ClClClFClClKF , DMSO 环上亲电取代氟亲核置换其它卤代烃制备NH 2ClCl224N 2+HSO 4-ClClNH2ClClNaNO2 ,H2SO4N2+HSO4-ClClCH3OHCl ClCl Cl ClNO2NO2ClClNH2ClClN2+HSO4-ClClXClCl( X= Cl,Br,I,F )4、写出由副产2,3-二氯硝基苯制2,3,4-三氟硝基苯的合成路线中各步反应的名称,各卤化反应的主要反应条件。
ClClNO2ClFNO2ClFClCl, 200°CH SO , HNONO2ClFClNO2FFFKF , DMF /氟亲核置换氯自由基取代亲电硝化反应氟亲核置换二、磺化反应1、现需配制1000 kg H2SO4质量分数为100%的无水硫酸,试计算需用多少千克98.0%硫酸和多少千克20%发烟硫酸?解:20%发烟硫酸按硫酸百分率计=100% +0.225*20%=104.5%设需98%硫酸xkg,则1000=0.98*x+(1000-x)*1.045从而求得x的量。
精细有机合成习题答案

精细有机合成习题答案【篇一:08应化精细有机合成复习题答案】txt>一.单项选择题(8)在下列每小题的四个备选答案中选出一个正确的答案,并将其字母标号填入题干的括号内。
1.如果分子本身包含一个反应活性低的官能团在适当的阶段,通过某种专一性的反应,可转化为反应活性较高的官能团。
这种官能团称为:(b)a.亲电官能团;b.潜官能团;c.亲核官能团;d.极性官能团;2.想象选择一个合适的位置将分子的一个键切断,使分子转变为两个不同的部分。
用双线箭头符号和画一条曲线穿过被切断的键来表示。
这种方法称为:(c)a.极性反转;b.反向分析;c.分子切断;d. 反应选择性;在一系列的转变的某一阶段,引入一个原子或原子团,使后续的反应过程能按设计的要求,有控制地进行,从而保证系列反应能够高效率地完成。
这种引入的原子或原子团称为:(a)a.控制因素;b.潜官能团;;c.极性官能团;d.极性反转;4.在合成设计中使某个原子或原子团的反应特性发生了暂时性的转换称为:(b)a. 关键反应;b.极性转换;c.反应选择性;d.控制因素;5.在复杂化合物的合成中,有些反应转化率很低或正副产物很难分离纯化,反应时间长,这些反应称为:(c)a.反应选择性;b.反应的专一性;c.关键反应;d. .控制因素;6.目标分子—中间体—化工原料的分析过程称为:(b)a.正向合成分析法;b .逆向合成分析法; c.不对称合成分析法;d.关键反应分析法;7.一个反应在底物的不同部位和方向进行,从而形成几种产物时的选择程度称为:(d)a.反应的专一性;b.反应的控制性;c.反应的对称性;d,反应选择性;8.将分子的一个键切断,使分子转变为两个不同的部分,这不同的部分叫:(a)a.合成子;b.合成等价物;c.目标分子;d. 有机中间体;9.绿色化学是指在制造和应用化学品时( a )a.应有效利用(最好可再生)原料,消除废物和避免使用有毒的或危险的试剂和溶剂。
智慧树答案精细有机合成知到课后答案章节测试2022年

第一章1.精细化学品是指经深度加工的,具有功能性或最终使用性的,品种多、产量小、附加价值高的一大类化工产品。
( )答案:对2.精细有机合成的原料资源是( )答案:天然气;石油;煤;农林副产品3.对于一个复杂的精细化学品的合成,下面说法错误的是( )答案:只能采用一种合成路线来完成;4.精细化工率是指精细化工产品销售额占全部化工产品销售额的比例。
()答案:对5.有机精细化学品的合成由由若干个基本反应组成。
这些基本反应我们称之单元反应。
以下属于重要的单元反应的有()答案:卤化反应;硝化反应;氧化反应第二章1.下列取代基,供电子能力强弱顺序正确的是()。
答案:;2.答案:3.对于下面的放射性标记碘负离子I*–与碘甲烷之间的碘交换反应,分别选择水和DMF(N,N-二甲基甲酰胺)作为反应介质,其反应速度()。
答案:在DMF中反应速度快4.答案:5.对于下面两个反应,说法正确的是( )。
答案:a为SN2,b为E2第三章1.指出下列反应中,哪个是亲电试剂()答案:HBr(溴置换醇羟基反应剂)2.利用单质碘使芳环发生碘化反应时,一般向体系中加入氧化剂,其目的是()答案:因为碘化是一个可逆反应,加入氧化剂可使反应进行彻底3.关于芳烃环上取代卤化反应,描述正确的是()。
答案:苯系芳烃,如果环上含吸电子基,难生成σ-配合物,需高温及催化剂,生成间位体;缺π电子的芳杂环,较易发生亲核取代,且多为α位;苯系芳烃,如果环上含给电子基,易生成σ-配合物,生成邻对位体,且易发生多卤代4.根据羰基α-H的取代卤化反应机理,乙醛在碱催化作用下生成()。
答案:三氯乙醛5.脂肪烃和芳烃侧链的取代反应,属于亲电取代反应。
()答案:错第四章1.下列关于磺化π值得说法正确的有()答案:容易磺化的物质π值越小2.以下关于芳环上发生卤化、磺化的说法正确的是()答案:均属亲电历程3.当以浓硫酸或发烟硫酸为磺化剂时,磺化反应的速度可用下式表示,式中ArH表示被磺化的芳烃,则此式说明了()答案:磺化反应的速度与体系中生成的水的量有关,水越少,反应速度越快4.2-萘酚在90 ℃磺化时磺酸基主要进入2-萘酚的()。
精细有机合成化学与工艺学_天津大学中国大学mooc课后章节答案期末考试题库2023年

精细有机合成化学与工艺学_天津大学中国大学mooc课后章节答案期末考试题库2023年1.含有有两个或两个以上强吸电基的芳胺属于碱性很弱的芳胺,重氮化时一般需要使用浓硫酸作为无机酸参考答案:正确2.在气-固相临氢接触催化胺化氢化中,主要使用铜-鎳催化剂,其中铜主要是催化醇的脱氢生成醛或酮,镍主要是催化烯亚胺的加氢生成胺参考答案:正确3.气固相催化氧化需要被氧化物和产物都要有足够的热稳定性参考答案:正确4.芳香族亲电取代反应的历程是经过σ络合物中间产物的两步历程,但是σ络合物的生成并不是控制步骤参考答案:错误5.氧酰化反应又叫做酯化反应参考答案:正确6.烯烃的硫酸酯化是亲电加成反应历程参考答案:正确7.使用三聚氯氰进行N-酰化反应,三个氯均可被取代,且反应速率类似,不易控制反应条件得到一酰化产物参考答案:错误8.使用羧酸与酸酐进行的N-酰化反应类似,都是可逆反应参考答案:错误9.间异丙基甲苯在进行空气液相氧化时,反应可以选择性的发生在异丙基生成叔碳过氧化氢物参考答案:正确10.还原反应也可以指在有机分子中增加氢或减少氧的反应,或者兼而有之的反应参考答案:正确11.在使用硫化碱还原间二硝基苯时,可以得到部分还原产物即间硝基苯胺,而铁粉则容易使间二硝基苯发生完全还原,而不易得到间硝基苯胺参考答案:正确12.苯酚是精细化工的基本原料参考答案:错误13.芳烃用溴素作为溴化剂进行溴化时,常常向反应液中加入氧化剂,目的是将产生的HBr氧化成Br2而充分利用参考答案:正确14.芳环上发生亲电取代反应时,所有第一类取代基都使芳环上电子云密度增大,使芳环活化参考答案:错误15.芳烃用稀硝酸硝化时,反应质点是参考答案:NO正离子16.芳烃氯化生产中要控制原料中的水的含量小于参考答案:0.04 %17.芳烃磺化反应,为了抑制磺化生成砜副反应时,常常加入的添加剂是参考答案:NaSO4_NaHSO418.空气液相氧化时自由基的反应历程,其包括三个阶段为参考答案:链的引发_链的传递_链的终止19.芳胺用亚硫酸氢钠的水解也叫Bucherer反应参考答案:正确20.铁粉还原时,向在水介质中的被还原物与铁粉混合物加入酸的目的是为了清洁铁粉参考答案:错误21.芳烃用氯磺酸磺化时,芳烃与氯磺酸的摩尔比是1:5时,生产的产物是参考答案:芳磺酰氯22.芳环不易直接进行取代氟化,常采用的方法是置换氟化参考答案:正确23.苯酚氯化制备高纯度的2,6-二氯苯酚时,常采用的方法是将反应产物进行多次精馏分离提纯参考答案:错误24.甲苯侧链氯化制备氯化苄时要控制后处理无水操作,否则产物容易水解参考答案:正确25.芳磺酸盐碱熔的特点包括参考答案:三废治理负担大_工艺落后,劳动强度大,工作环境差_不易连续化生产_方法简单,工艺成熟,对设备要求不高26.芳环上的C-烷化反应是连串的不可逆反应参考答案:错误27.甲苯高温磺化,生成邻对位磺化产物,因为甲基是第一位定位基参考答案:错误28.使用卤代烃的芳环上的C-烷化反应是酸催化的付氏烷基化反应,该反应的特点包括参考答案:烷基化反应的质点会发生异构化_易生成待支链的烷基取代基_连串_可逆29.芳烃的亲电取代反应,难易程度为:蒽醌>萘>苯参考答案:错误30.所有溶液中,溶剂和溶质之间的相互作用力均存在氢键缔合作用的专一性力参考答案:错误31.叔卤代烃水解成醇的反应,按照Houghes-Ingold规则,极性溶剂对反应有利参考答案:正确32.芳烃上引入-SO3H不仅可增加水溶性,还可以辅助定位或提高反应活性参考答案:正确33.α-烯烃用SO3 的取代磺化是游离基反应历程参考答案:错误34.某些有机物在室温下在空气中不适用催化剂也能发生缓慢氧化参考答案:正确35.精细有机合成的原料资源是煤、石油、天然气和动植物参考答案:正确36.芳磺酸在酸性条件下的水解反应机理是()参考答案:亲电取代反应37.氯苯是精细化工基本原料参考答案:错误38.醇的氨解的主要工业方法有参考答案:气-固相临氢接触催化胺化氢化法_气-固相接触催化脱水氨解法_高压液相氨解法39.一般钾盐都比钠盐贵,然而四氢硼钾比四氢硼钠的价格更便宜参考答案:正确40.下列芳胺碱性最强的的是参考答案:对甲氧基苯胺41.分子内环合从反应机理上分类包括参考答案:亲核反应_亲电反应_自由基反应42.重氮化时无机酸的用量需要过量,其作用是为了参考答案:产生亚硝酸_溶解芳胺_抑制副反应如重氮氨基化合物的生成43.酚类的氨解方法一般有三种方法包括参考答案:气相氨解法_萘系布赫勒(Bucherer)反应,_液相氨解法44.常用的酰化剂包括参考答案:酰氯_羧酸酯_酸酐_羧酸45.用羧酸的酯化反应是可逆反应,提高酯的收率的方法包括参考答案:从反应混合物中蒸出酯_从反应混合物中蒸出水_用过量的低级醇46.将醇和酚制成钠盐或钾盐,可提高与卤代烃的反应活性参考答案:正确47.环合反应既能形成新的碳环也能形成含杂原子的环参考答案:正确48.在使用稀盐酸和亚硝酸钠进行重氮化时,加入少量的溴化钠或溴化钾能够提高重氮化反映的速率参考答案:正确49.在进行重氮化时,使用不同无机酸会形成不同的活泼质点,最活泼的活性质点是使用浓硫酸时生成的亚硝基正离子参考答案:正确50.重氮基水解反应用于制备苯酚时,不能使用重氮盐酸盐作为原料参考答案:正确51.醇羟基非常活泼,所以醇的氨解能够在较温和的室温下进行参考答案:错误52.环氧烷类的加成胺化的反应速率随着环氧烷类碳原子数的增加而降低,即环氧乙烷 >环氧丙烷>环氧丁烷参考答案:正确53.芳磺酸既可在酸性条件下水解,也可以在碱性条件下水解,水解产物相同参考答案:错误54.带有供电取代基的芳磺酸盐碱熔一般采取熔融碱的常压高温碱熔法参考答案:正确55.用卤代烷作烷化剂的N-烷化反应不可逆,是连串反应参考答案:正确56.以酰氯为酰化剂,使用三氯化铝为催化剂的C-酰化反应,催化剂只需要使用催化的量即原料摩尔量的5%-10%即可参考答案:错误57.用环氧乙烷作烷化剂的N-烷化反应是连串反应,反应不容易控制在一烷基化产品阶段参考答案:正确58.芳香族伯胺与亚硝酸作用生成重氮盐,而脂肪族的伯胺与亚硝酸不反应参考答案:错误59.氨解反应底物易发生水解副反应时可以使用液氨作氨解剂参考答案:正确60.过渡性N-酰化时需考虑的因素包括参考答案:酰化剂价格低廉_酰氨基对下一步反应具有良好的效果_酰化反应容易进行,收率高,质量好_酰氨基易水解61.一般来说芳磺酸盐的碱熔方法包括参考答案:熔融碱的常压高温碱熔法_碱溶液的中温碱熔法62.芳环上氨基的水解包括参考答案:酸性条件水解_亚硫酸氢盐水溶液的水解_碱性水解63.芳香族卤化物使用氨水做氨解剂时一般使用过量氨解剂,其作用是参考答案:降低反应生成的氯化铵在高温时对不锈钢材料的腐蚀作用_改善反应物的流动性_抑制生成二芳基仲胺和酚的副反应64.气-固相临氢接触催化胺化氢化反应的步骤包括参考答案:醇的脱氢生成醛(或酮)_羟基胺的脱水_醛(或酮)的加成胺化_烯亚胺的加氢65.影响重氮化反应的速率的因素包括参考答案:无机酸浓度_无机酸性质_芳胺碱性66.从基本原料出发合成精细化学品,路线越短成本一定越低、路线越合理。
精细有机合成化学与工艺学唐培堃冯亚青答案

课后习题答案2-1李摆正离子CT卓于大分子所构成的软酸.它客易与大分于或大原干所构成的软緘相结合.以下ffl隔子被Q*从水相梅取到有机相时T从易到难的次洋是:C6H3o->r>Br->cr, CH3Q->F-2-2从理论匕讲,应该用菲质子传運、强扱性有机寤札最合适的瀋剂是二甲基亚碉。
优点足:常压沸点189V;反应可在常压进行;具商较好的电子对给电性,屋良好的离子化涪剂「对金耀正离子有良好的榕刑化作用•对氟化钾有较好的潜解性.使F”成为活泼的裸负离子帚低秦卒缺点是:爆蚱下限2.6% (悻积人张炸上隈28$嵋(^):在常压蕉堀时会部分发生甘解.有时会发生康炸。
N,N•二甲墓甲St胺对金8»正离予也有良好的洛剂牝作用,但是它常压沸点只有153X:,如需在190~200匸反应,琥需翼在高压釜中带压操作,不方便*环丁讽的抉点尼:虽然也足强扱性非质子传遏治虬但不是好的离子化溶剂,对羸化钾的谙解度小”优点是;常压沸序高达胡7・3弋,闪点166C,热穆定性好,可使反应在常压235-245t r®tTf反应克毕后*可先过滤除去尢韶分无机盐’然后驗压At 懈,先蒸出反应产物对昭基氛葦(常压沸点Z04^205t >和未反应的对硝着氯苯(常压稱点242C),再回收环丁狠“N-甲基毗略規IH(常压務点204-2O6T2)的觥点是,虽然也是軽极性非质子传逼溶礼但無电于对给体性不显著,也不是好的离子化涪笊.对氛化钾落解度小.不宜单歿用作上述反应的幡剂。
忧点是;鷄稳定性好,闪点95V.燃点M6V,可用于混督藩剂°在二甲基亚血申据合适■的N-甲墓吐喀烷團・配成谨合帶刑,可缓解二甲基亜碘在高沮回源时的爆坤危险性。
关于相转移催化剂.李锈盐中的节基三乙基孰化鞍价廉易得,如果在190-200V 时季铁盐不穂定*可改用链状棄乙二壽或其单烷基■(开对于本反应也可■不用相转移催牝剂'3-6因为生成的产物2.6•二氯-4-硝基苯胺在水外质中很难再引入第三个氯基妨3-10分别写出如下。
精细有机合成智慧树知到答案章节测试2023年山东理工大学

第一章测试1.精细化学品的分类包括()。
A:通用化学品B:专用化学品C:准通用化学品D:精细化学品答案:ABCD2.精细有机合成的原料资源是煤、石油、天然气和动植物()。
A:对B:错答案:A3.中国精细化工产品包括11个产品类别()。
A:对B:错答案:A4.精细化工产品对技术要求不高。
()A:错B:对答案:A5.精细化工产品主要用于工业生产,对人们的生活影响不大。
()A:对B:错答案:B第二章测试1.下列试剂哪一个不是亲电试剂?()A:Fe2+B:Cl2C:Fe3+D:NO2+答案:A2.溶剂与溶质之间的作用力不包括:()A:范德华力B:氢键C:离子键D:库仑力答案:C3.以下可作为相转移催化剂的有()A:冠醚。
B:季铵盐类;C:聚醚类;D:叔胺;答案:AB4.自由基稳定性:()A:对B:错答案:A5.比较下列物质的反应活性酰氯>酸酐>羧酸()A:对B:错答案:A第三章测试1.卤化过程中卤化剂活性:HI < HBr < HCl < HF()A:错B:对答案:A2.作为亲核试剂,苯氧负离子(PhO-) 的反应活性比氢氧根负离子(OH-)和苯硫负离子(PhS-)弱。
()A:对B:错答案:A3.下面哪一个置换卤化最容易发生?()A:B:C:D:答案:D4.苯与卤素的取代卤化反应Ar + X2 == ArX + HX,下面哪一个不能用作催化剂?()A:I2B:HOClC:FeCl3D:FeCl2答案:D5.用卤烷作烷化剂,当烷基相同时,卤烷活性次序正确的是()A:R-I>R-Br>R-ClB:R-Br>R-Cl>R-IC:R-Cl>R-I>R-Br答案:A第四章测试1.高碳脂肪醇与氯磺酸的反应是一个可逆反应,可以在工业中应用生产()A:对B:错答案:B2.用浓硫酸磺化时,亲电质点是HO3+ ()A:对B:错答案:A3.下列关于磺化π值的说法正确的有()A:容易磺化的物质π值越大;B:π值越大,所用磺化剂的量越少;C:π值越大,所用磺化剂的量越多。
精细有机合成化学与工艺学答案

精细有机合成化学与工艺学答案【篇一:精细有机合成化学及工艺学期末复习资料】ss=txt>1. 写出制备2,6-二氯苯胺的其他合成路线的反应式。
2. 制clt酸时,将920kg甲苯用2880kg100%硫酸进行一磺化,然后通入710kg氯气进行氯化,试计算以下数据并进行讨论。
(1)h2so4/c7h7摩尔比;(2)磺化后∏值;(3)磺化后总酸度;(4)cl2/c7h7摩尔比;(5)氯化后总酸度。
13.写出由十二烷基苯用不同方法制十二烷基苯磺酸钠时的主要磺化方法和分离方法,并进行对比。
4.写出由环氧乙烷制备2-氨基乙基磺酸钠的几个合成路线和各步反应的名称。
25.常见杂环化合物结构式及其名称。
345【篇二:精细有机合成化学及工艺学复习参考题】ass=txt>精细化学品:“凡能增进或赋予一种(类)产品以特定功能,或本身具有特定功能的小批量或高纯度化学品”。
精细化学品的特点:①产品功能性强(专用性)②批量小③品种多④利润率高⑤更新换代快精细化工:“生产精细化学品的工业”。
“它属于一类化工产品的生产行业” 。
精细化工的特点:①多品种、小批量②综合生产流程和多功能生产装置③高技术密集度④大量应用复配技术⑤新产品开发周期长,费用高⑥商品性强、市场竞争激烈2、新领域精细化学品的类别。
食品添加剂、饲料添加剂、电子化学品、造纸化学品、塑料助剂、皮革化学品、表面活性剂、水处理剂等。
3、精细化率的定义、我国目前的精细化率。
精细化工率(精细化率)?精细化工产品的总值?100%化工产品的总值精细化率是一个国家或地区化学工业发达程度和化工科技水平高低的重要标志。
我国目前的精细化率为45%。
4、世界精细化工的发展趋势。
发达国家新领域精细化工发展迅速、重视化境友好绿色精细化学品和超高功能及超高附加值产品,发展绿色化生产与生物工程技术。
传统精细化工向发展中国家转移。
5、我国精细化工的现状与存在的主要问题。
●我国精细化工产品的自我供应能力已有了大幅度的提升,传统精细化工产品不仅自给有余,而且大量出口;新领域精细化工产品的整体市场自给率达到70%左右。
精细有机合成课后作业题参考答案

精细有机合成-课后作业题参考答案第2章作业题1、将下列化合物写出结构,按其进行硝化反应的难易次序加以排列:苯、乙酰苯胺、苯乙酮、甲苯、氯苯2、在下列取代反应中,主要生成何种产物?3、什么是溶剂化作用?溶剂化作用指的是每一个被溶解的分子或离子被一层或几层溶剂分子或松或紧地包围的现象。
溶剂化作用是一种十分复杂的现象,它包括溶剂与溶质之间所有专一性和非专一性相互作用的总和。
4、相转移催化主要用于哪类反应?最常用的相转移催化剂是哪类化合物?主要用于液-液非均相亲核取代反应。
最常用的相转移催化剂是季铵盐Q+X-。
第3章作业题1、什么是卤化反应? 引人卤原子有哪些方式?向有机化合物分子中的碳原子上引入卤原子的反应。
引人卤原子的方式有加成卤化、取代卤化、置换卤化。
2、除了氯气以外,还有哪些其他氯化剂?卤化氢+氧化剂、卤化氢或盐、其它。
3、在用溴素进行溴化时,如何充分利用溴?加入强氧化剂次氯酸钠和双氧水等。
4、用碘和氯气进行芳环上的取代碘化时,氯气用量不易控制,是否有简便的碘化方法?(1)I2+H2O2作碘化剂的优点是成本低,操作简便。
缺点是不适用于原料和产物易被H2O2氧化的情况。
(2)I2+Cl2作碘化剂的优点是可用于原料和产物易被H2O2氧化的情况。
缺点是在水介质中使用时会生成具有氧化性的HClO,另外氯气的用量不易控制。
(3)用ICl作碘化剂的优点是碘化时不产生HI,不需要另加氧化剂,可在水介质中用于原料和产物易被氧化的情况。
缺点是ICl是由I2和Cl2反应制得的,易分解,要在使用时临时配制。
5、请写出芳环上取代卤化的反应历程。
6、芳环上亲电取代卤化时,有哪些影响因素?被卤化物的结构、卤化剂、催化剂、卤化深度、卤化介质的PH值、卤化溶剂、卤化温度、被卤化物中和卤化剂中的杂质等。
7、完成下列反应式8、写出从甲苯制备以下化合物的合成路线。
(1)间氯三氟甲苯(2)3,4-二氯三氟甲苯(3)2,4-二氯三氟甲苯(4)2-氯-5-溴三氟甲苯第4章作业题1、采用三氧化硫为磺化剂有哪些优缺点?用三氧化硫磺化,其用量接近理论量,磺化剂利用率高,成本低。
精细有机合成试题与答案

9.3精细有机合成试题及答案一.选择题1.EDTA与金属离子形成配合物的鳌和比为(A )A、1:1B、1:2C、1:3D、1:42.在含有过量配位剂L的配合物ML溶液中,C(M)=A mol/L,加入等体积的水后,C(M)约等于( B )A、aB、a/2C、2aD、2/a3.金属指示剂In在滴定的PH条件下,本身颜色必须(D )A、无色B、蓝色C、深色D、与Min不同4.二苯胺磺酸钠是滴定的常用指示剂。
它是属于( C )A、自身指示剂B、特殊指示剂C、氧化还原指示剂D、其他指示剂5.碘量法中所需标准溶液中在保存中吸收了而发生下述反应:若用该滴定I2溶液则消耗的量将( B )A、偏高B、偏低C、无影响D、无法判断6.在2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O的反应中,还原产物是下面的哪一种( D )A、Cl2B、H2O7.用同一KMnO4标准溶液分别滴定体积相等的FeSO4和H2C2O4溶液,耗用的标准溶液体积相等,对两溶液浓度关系正确表述是( C )A、C(FeSO4)= C(H2C2O4)B、2C(FeSO4)= C(H2C2O4)C、C(FeSO4)=2C(H2C2O4)D、2n(FeSO4)= n(H2C2O4) 8.下列叙述中正确的是( D )A、化学反应动力学是研究反应的快慢和限度的B、反应速率常数大小即是反应速率的大小C、反应级数越大反应速率越大D、活化能的大小不一定总能表示一个反应的快慢,但可表示反应速率常数受温度变化影响的大小9.Fe3O4中Fe的氧化值为( D )A、0B、+2/3C、-2/3D、+8/310.下列因素与均相成核速率无关的是( A )A、陈放时间B、相对过饱和度C、物质的性质D、溶液的浓度11.干燥剂干燥适用于下列(D )的物质。
A、受热易分解B、挥发C、能升华D、三种都有12.在萃取法操作中,要求分配比D(B )才可取得较好的萃取效率。
精细有机合成习题三

精细有机合成习题三学号 班级一、卤代反应1、芳环上亲电取代卤化时,有哪些重要影响因素?答:1)反应物的结构 环上已有取代基影响反应活性和取代位置2)催化剂 反应试剂一般单质,催化剂用路易斯酸3)原料杂质。
由于使用路易斯酸催化,原料中的水份、某些杂环化合物会影响催化剂的活性,故工业生产中限制芳烃中水含量。
4)反应温度,温度升高,反应速度快,活性提高,但副产物增多。
5)由于该反应表现连串反应特点,随着反应进程增大,副产物增多,在工艺上必须控制卤化深度。
6)工业生产中,反应器类型对反应有影响。
如釜式反应器返混严重,副反应增加,而塔式反应器能够在一定程度上减少返混现象,副反应少。
2、简述由甲苯制备以下卤化合物的合成路线、各步反应的名称和主要反应条件。
解;1)CH 3Cl 2 ,FeCl 3CH 3ClCl , hvKF, DMFCF 3Cl环上亲电取代侧链自由基取代2)CH 3Cl 2, hvCCl 3KF, DMFCF 323CF 3Cl侧链自由基取代亲核氟置换环上亲电取代3)与反应1)类似4)CH 3Cl , FeCl 3CF 3Cl Cl5)CH3CCl 3Cl6)CH 33、写出以邻二氯苯、对二氯苯或苯胺为原料制备2,4-二氯氟苯的合成路线、每步反应的名称、各卤化反应的主要反应条件。
ClClFCl环上亲电取代氟亲核置换反应ClClCl 2 , FeCl 3ClClClFClClKF , DMSO 环上亲电取代氟亲核置换其它卤代烃制备NH 2ClCl224N 2+HSO 4-ClClNH 2ClCl224N 2+HSO 4-ClClCl ClNO 2N 2+HSO 4-Cl( X= Cl,Br,I,F )4、写出由副产2,3-二氯硝基苯制2,3,4-三氟硝基苯的合成路线中各步反应的名称,各卤化反应的主要反应条件。
ClClNO 2ClFNO 2ClFClCl , 200°C H 2SO 4 , HNO 3NO 2ClFClNO 2FFFKF , DMF /氟亲核置换氯自由基取代亲电硝化反应氟亲核置换二、磺化反应1、现需配制1000 kg H 2SO 4质量分数为100%的无水硫酸,试计算需用多少千克98.0%硫酸和多少千克20%发烟硫酸?解:20%发烟硫酸按硫酸百分率计=100% +0.225*20%=104.5% 设需98%硫酸xkg ,则 1000=0.98*x+(1000-x )*1.045 从而求得x 的量。
精细有机合成课后习题答案

精细有机合成课后习题答案以下是为大家整理的精细有机合成课后习题答案的相关范文,本文关键词为精细,有机合成,课后,习题,答案,卤化,反应,nbsbrbp,您可以从右上方搜索框检索更多相关文章,如果您觉得有用,请继续关注我们并推荐给您的好友,您可以在综合文库中查看更多范文。
卤化反应nbsbrbpobr2/Acoh,Librbr+brbrbr98%2%+hbrAcoh0oc,12hhbroohnbroh2 o,25ocbroch3(ch2)5chobr2och(c3(ch2)4chbrcho2h5)2osocl2,c5h5noch2ohrt,3~4hoch2clcoohcoclpcl3,no2no2nh2n2+bF4-Fnano2/hclnh4bF4brbr br20XX新增1coohclcl2/pcl2cooh170oco(1)cl2,naoh,h2oo(ch3)3cch3(2)h+(ch3)3cohhonbs,bpocho5h11c2chchocch3ccl5h11cc4,refluxcbrhchocch3hgo,brch3(ch2)14cooh2,ccl2,0occh3(ch2)14br磺化反应clso3nano2nahsono3,mgo260~65ocno2no2no2nh2nahso3so3nano2nh2 nh2nahso3+so3na20XX新增以甲苯为原料合成邻氯甲苯2烷基化反应oh(hc)cohc(ch)3333+h2so465oc抗氧化剂bhTohohc(ch3)3+(ch3)3cohh3po4orhso80o24coch3och3抗氧化剂bhAoh++ch3cochh3hooh塑料抗氧化剂双酚Aoo+cho3IK2co3/acetoneorefluxc4h9cchn-c5h11clhmpT,4h9Lic6h14c4h 9ccLin-cc4h9ccc5h11hcch+hchocucch2110~1200c,4.413*105pahoh2cccc h2ohnh2+2c2hnaoh5cl120~220ocn(c2h5)2+hclnh2+cZncl4h9oho2210c,0 .8mpanhc4h9nhcZncl4h9o2250~300c,2.2mpac4h9nh23(ch3)3n+c10h21chcoohbr30occ10h21chn+(ch3)3coo-hn+nh2ohhnnhch(c h3)2ch2ch2oh(ch3)2so4,naoh(n_c4h9)4n+I-ch2ch2och3c8h17oh+oc8h1 7o(ch2ch2o)nho+ch2o+hclZncl2oclbrncn+cucn215~225oc,15hoohcnAco h,chcl3etohh3cso2o+h3cso2oKcn4酰化反应nao3snh2s+clch0~5onaoc32coclnaoh,ohohch3ch3nh2nco+cocl2+hclnh2 ncoooh2so4,130~140occoohooch3ooch3o+clZncl2/c2h2cl4c(ch3)3c(ch3) 3ooAlcl3,cshcl,h2oclReflux2ho+hcn+hclZncl2nhhclh2ohooooohna,et2oco cho+cl2oh2o,Refluxh2cooonhh4cl,nh4oh,h2o2coo2cl5coch最后,小编希望文章对您有所帮助,如果有不周到的地方请多谅解,更多相关的文章正在创作中,希望您定期关注。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精细有机合成-课后作业题参考答案第2章作业题1、将下列化合物写出结构,按其进行硝化反应的难易次序加以排列:苯、乙酰苯胺、苯乙酮、甲苯、氯苯2、在下列取代反应中,主要生成何种产物?3、什么是溶剂化作用?溶剂化作用指的是每一个被溶解的分子或离子被一层或几层溶剂分子或松或紧地包围的现象。
溶剂化作用是一种十分复杂的现象,它包括溶剂与溶质之间所有专一性和非专一性相互作用的总和。
4、相转移催化主要用于哪类反应?最常用的相转移催化剂是哪类化合物?主要用于液-液非均相亲核取代反应。
最常用的相转移催化剂是季铵盐Q+X-。
第3章作业题1、什么是卤化反应? 引人卤原子有哪些方式?向有机化合物分子中的碳原子上引入卤原子的反应。
引人卤原子的方式有加成卤化、取代卤化、置换卤化。
2、除了氯气以外,还有哪些其他氯化剂?卤化氢+氧化剂、卤化氢或盐、其它。
3、在用溴素进行溴化时,如何充分利用溴?加入强氧化剂次氯酸钠和双氧水等。
4、用碘和氯气进行芳环上的取代碘化时,氯气用量不易控制,是否有简便的碘化方法?(1)I2+H2O2作碘化剂的优点是成本低,操作简便。
缺点是不适用于原料和产物易被H2O2氧化的情况。
(2)I2+Cl2作碘化剂的优点是可用于原料和产物易被H2O2氧化的情况。
缺点是在水介质中使用时会生成具有氧化性的HClO,另外氯气的用量不易控制。
(3)用ICl作碘化剂的优点是碘化时不产生HI,不需要另加氧化剂,可在水介质中用于原料和产物易被氧化的情况。
缺点是ICl是由I2和Cl2反应制得的,易分解,要在使用时临时配制。
5、请写出芳环上取代卤化的反应历程。
6、芳环上亲电取代卤化时,有哪些影响因素?被卤化物的结构、卤化剂、催化剂、卤化深度、卤化介质的PH值、卤化溶剂、卤化温度、被卤化物中和卤化剂中的杂质等。
7、完成下列反应式8、写出从甲苯制备以下化合物的合成路线。
(1)间氯三氟甲苯(2)3,4-二氯三氟甲苯(3)2,4-二氯三氟甲苯(4)2-氯-5-溴三氟甲苯第4章作业题1、采用三氧化硫为磺化剂有哪些优缺点?用三氧化硫磺化,其用量接近理论量,磺化剂利用率高,成本低。
三氧化硫磺化明显的优点是不生成水,无大量废酸,磺化反应快,用量省。
但三氧化硫非常活泼,反应热效应大,容易引起物料局部过热而焦化;注意控制温度和加料次序,并及时散热,以防止爆炸事故的发生;产物黏度大,不利于散热,注意防止或减少多磺化、砜的生成等副反应。
2、简述磺化产物的分离方法的要点。
(1)稀释析出法稀释析出法是利用某些芳磺酸在50%~80%的硫酸中溶解度相对小,高于或低于此浓度则溶解度增大的特性,在磺化结束后将磺化液用水适当稀释,磺化产物即可析出。
(2)直接盐析法利用某些芳磺酸盐在含无机盐(NaCl、KCl、Na2SO3、Na2SO4)的水溶液中溶解不同的特性而分离。
采用NaCl或KCl直接盐析法分离的缺点是有盐酸生成,对设备有强的腐蚀性。
(3)中和盐析法芳磺酸在利用亚硫酸钠、氢氧化钠、碳酸钠、氨水或氧化镁中和时生成的硫酸钠、硫酸铵或硫酸镁促使芳磺酸以钠盐、胺盐和镁盐等形式盐析出来,这种方法对设备的腐蚀性小,是生产常用的分离手段。
(4)脱硫酸钙法当磺化液中含有大量废酸时,可先将磺化在稀释后,用氢氧化钙的悬液进行中和成能溶于水的磺酸钙,而硫酸钙沉淀下来,过滤除去,得到不含无机盐的磺酸钙溶液;将此溶液经碳酸钠溶液处理后,使磺酸钙盐转变为钠盐,碳酸钠转变为碳酸钙,过滤除去。
(5)溶剂萃取法溶剂萃取法是分离磺化物,减少三废的生成的一种新方法。
例如,将萘高温-磺化,得到的β-萘磺酸,稀释水解后,溶液用叔胺(N,N-二苄基十二胺)的甲苯溶液来萃取。
叔胺与β-萘磺酸形成络合物,被萃取到甲苯层中,分出有机层,用碱中和,生成的磺酸盐即转入水层,蒸发至干可得纯度为86.8%的萘磺酸钠。
分离出的叔胺萃取剂可以回收循环使用。
这种方法使废酸中基本不含有机物,便于回收处理,具有较大的发展前途。
3、由萘的三磺化制备1,3,6-萘三磺酸。
100%H SO 1450C3SO 360-800CHO 3SSO 3H65%发烟 H 2SO 3H异构化1550C 1550C65%发烟 H SO 4HO 3SSO 3HSO 3H4、由苯胺制备苯胺-2,4-二磺酸。
NH 2NH 2SO 3HSO 3HNH 2NH 2SO 3H NH 2SO 3HSO 3H(1)苯胺在邻二氯苯中用理论量硫酸在180℃左右进行烘焙磺化得到对氨基苯磺酸。
(2)对氨基苯磺酸在过量20%发烟硫酸中在50℃左右进行磺化得到目的产物5、由2,4-二硝基氯苯制备2,4-二硝基苯磺酸钠。
NO 260~65℃MgONaHSO 3SO 3NaCl NO 2NO 22+2+NO 2+MgCl 2+H 2O6、简述由对硝基甲苯制备以下芳磺酸的合成路线、各步反应的名称、磺化的主要反应条件。
(1) CH 3SO 3HNH 2(2)SO 3HCH 3NH 2(3)CH 3SO 3H NH 2Cl(1)5-氨基-2-甲基苯磺酸,合成路线如下:CH 3SO 3HNO 2CH 3NO 2CH 3SO 3HNH 2对硝基甲苯用过量发烟硫酸或稍过量液体三氧化硫进行磺化,得5-硝基-2-甲基苯磺酸,然后将硝基还原成氨基,得目的产物。
(2)2-氨基-5-甲基苯磺酸,合成路线如下:CH 3NH 2CH 3NO 2CH3SO 3HNH 2将对硝基甲苯进行硝基还原成氨基,得对甲苯胺,然后在邻二氯苯中,用理论量硫酸,在180℃左右进行芳伯胺的烘焙磺化,得目的产物。
(3)2-氨基-4-氯-5-甲基苯磺酸,合成路线如下: CH 3NO 2CH 3NO 2CH 3SO 3H NH 2CH 3NH 2ClClCl对硝基甲苯在铁催化剂存在下进行芳环上的取代氯化。
然后将硝基还原成氨基,最后进行烘焙磺化,得目的产物。
由以上实例可以看出,当目的产物苯系氨基芳磺分子中氨基和磺酸处于邻位或对位时,通常是由相应的芳伯胺经烘焙磺化而得。
但感激和磺酸基处于间位时,大多是由相应的键硝基苯磺酸衍生物经硝基还原成氨基而得。
7、欲配置1000kg 质量分数为100%的H 2SO 4,要用多少千克质量分数为98%的硫酸和多少千克质量分数为20%的发烟硫酸? 解:20%发烟硫酸换算成H 2SO 4的百分含量为:ω(H 2SO 4)=100%+0.225 ω(SO 3)=100%+0.225×0.2=104.5% 设用98%的硫酸X kg ,则发烟硫酸为(1000-X )kg 98%X+104.5×(1000-X )=1000×100%解得 X =692.3kg 1000-X =307.7kg 即要用692.3kg98%的硫酸和307.7kg 质量分数为20%的发烟硫酸。
第5章作业题一、简答题1、影响硝化的主要影响因素有哪些?(1)被硝化物的性质(2). 硝化剂(3)反应温度(4)搅拌(5)相比与硝酸比(6).硝化副反应2、混酸硝化有哪些优缺点?混酸硝化法具有以下优点:(1)硝化能力强,反应速度快,生产能力高;(2)硝酸用量可接近理论量,硝化后分出的废酸可回收循环使用;(3)硫酸的比热容大,可使硝化反应比较平稳地进行;(4)通常可以采用普通碳钢、不锈钢或铸铁作硝化反应器。
主要缺点是:(1)产生大量待浓缩的废硫酸和含酚类及硝基物废水;(2)要求硝化设备具有足够的冷却面积;(3)安全性差。
3、在配制混酸时应考虑哪几个主要问题?(1)设备的防腐措施;(2)有效的机械混合装置;(3)及时导出热量的冷却装置;(4)配酸温度控制在40℃以下,以减少硝酸的挥发和分解;(5)严格控制原料酸的加料顺序和加料速度;(6)配好的混酸经分析合格方可使用,否则必需重新补加相应的原料酸以调整组成。
二、合成题1、简述由甲苯制备以下化合物的合成路线和工艺过程。
1)CH3混酸硝化CH3NO2NO2CH3NO2NH22)CH3混酸硝化CH3NO2Fe ,H OCH3NH2CH3NH2O2N3)CH3混酸硝化CH3NO2Fe, H2OCH3NH2硝化CH3NH2NO2NaNO2,H2SO4CH3NO2N2+HSO4-H POCH3NO2CH3NH2(CH CO)2OCH3NHCOCH3HNO, H SO NHCOCH3CH3O2N H3O+CH3O2NNH23)间甲苯胺用乙酐进行N-乙酰化,得3-乙酰氨基甲苯,后者在浓硫酸中用理论量的发烟硫酸进行一硝化,得3-乙酰氨基-6-硝基甲苯,最后在氢氧化钠的水溶液中或稀硫酸中加热,水解脱去乙酰基,得目的产物。
4)CH3HNO3,H2SO4CH3NO2NO2SnClCH3NO2NH25)CH3NH2NO2 CH3NH2CH3NHCOCH3CH3NO2NHCOCH35)对甲苯胺在乙酸中用乙酰进行N-乙酰化,生成4-乙酰氨基甲苯,接着加入理论量的混酸进行一硝化,得4-乙酰胺基-3-硝基甲苯,最后在氢氧化钠水溶液中或稀盐酸中加热,水解脱乙酰基,即得目的产物。
经过工艺改进,乙酰化法以代替传统的对甲苯磺酰氯酰化法。
三、计算题1、由硝基苯制备间二硝基苯时,需配制组成为H 2SO 4 72%,HNO 3 26%,H 2O 2%的混酸6000kg ,需要20%发烟硫酸,85%废酸及98%硝酸各多少千克。
解:设发烟硫酸、废酸与硝酸的需要量分别为x 、y 、z kg 。
三种酸总重:x+y+z=6000 (1) 硝酸的平衡:0.98z=6000×0.26 (2) 硫酸的平衡:(0.8+0.2×98/80)x+0.85y=6000×0.72 (3) 解(1)、(2)、(3)联立方程式,得x=2938.6kg y=1469.6kg z=1591.8kg2、设1kmol 萘在一硝化时用质量分数为98%硝酸和98%硫酸,要求混酸的脱水值为1.35,硝酸比Φ为1.05,试计算要用98%硝酸和98%的硫酸各多少千克、所配混酸的组成、废酸计算含量和废酸组成。
解:100%的HNO 3用量=1.05kmol=66.15kg 98%的HNO 3用量=66.15/0.98=67.50kg 所用HNO 3中含H 2O=67.50-66.15=1.35kg 理论消耗HNO 3=1.00kmol=63.00kg 剩余HNO 3=66.15-63.00=3.15kg 反应生成的H 2O=1.00kmol=18.00kg设所用98% H 2SO 4的质量为x kg ,所用98% H 2SO 4中含H 2O=0.02x kg, 则 D.V.S.=35.102.01835.198.0=++xx解得:所用98% H 2SO 4的质量x =27.41 kg 混酸中含H 2SO 4=27.41×0.98=26.86kg 所用98% H 2SO 4中含H 2O=27.41-26.86=0.55kg 混酸中含H 2O=1.35+0.55=1.90kg 混酸质量=67.50+27.41=94.91kg混酸组成(质量分数):H 2SO 4 28.30%;HNO 3: 69.70%; H 2O 2.00% 废酸质量=26.86+3.15+1.35+0.55+18=49.91kg废酸计算含量(质量分数)F.N.A.=26.86/49.91=53.82% 废酸中HNO 3含量(质量分数)=3.15/49.91=6.31%废酸中H 2O 含量(质量分数)=(1.35+0.55+18)/49.91=39.87%第6-7章 一、简答题1、写出芳香族硝基化合物用铁屑还原的反应历程。
