华南理工大学物理化学2002年852物理化学考研真题
华南理工大学2010物理化学二(852)考研真题答案

852华南理工大学2010年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试卷上做答无效,试后本卷必须与答题纸一同交回)科目名称:物理化学(二)适用专业:材料物理与化学,化学工程,化学工艺,应用化学,工业催化,能源环境材料及技术,制药工程,生物医学工程,化学工程(专业学位)说明:试题第1题求解问题重复太多,第7题和11题稍难,相图题有一定综合。
葛老师已对试题作了少量规范化处理并完成解答,未参考标准答案。
因此可能有不妥之处,欢迎用电子邮件告知,谢谢!更多信息请看主页:葛华才老师的邮箱:ge1963@1.1mol单原子理想气体,由298K、506.5kPa的始态膨胀到压力为101.3kPa的终态,计算下列各途经的Q、W、∆U、∆H、∆S、∆A与ΔG。
巳知其(298K)=126J·K-1·mol-1。
(1)等温可逆膨胀;(2)外压恒为101.3kPa的等温膨胀;(3)绝热可逆膨胀。
答:(1)恒温,∆U=∆H=0,∆S=13.38J·K-1,Q=3987J,W=-3978J,∆A=-3978J(2)状态函数与(1)同,W==-1982J,Q=1982J(3)Q=0,∆S=0,T2=567.2K,W=3358J,∆H=5596J,∆A=-30561J,∆G=-28323J2.0.1mol的乙醚装在安培瓶中,把它放在一个大瓶中,其中充以0.4mol的35℃、101.3kPa下的N2,然后将安培瓶敲破,乙醚全部挥发成气体。
其过程为35℃下0.1mol乙醚(l)+0.4mol N2(10dm3)=混合气体0.5mol(10dm3)。
已知乙醚正常沸点35℃,蒸发焓∆vap H m=25.1kJ.mol-1,计算:(1)终态乙醚压力;(2)N2的∆H、∆S、∆G;(3)乙醚的∆H、∆S、∆G;(4)整个体系的∆S;(5)环境的熵和总熵。
答:(1)p 乙醚25622Pa ;(2)∆H =0,∆S =0,∆G =0;(3)乙醚的状态:∆H =2.51kJ ,∆S =9.288J .K -1,∆G =-352.1J ;(4)∆S 9.288J .K -1;(5)∆S 环-7.315J .K -1;∆S 总= 1.973J .K -13.试估算被空气饱和的水引起的凝固点的降低值。
华南理工大学考研试题2016年-2018年852物理化学(二)

852A
华南理工大学
2016年攻读硕士学位研究生入学考试试卷(试卷上做答无效,请在答题纸上做答,试后本卷必须与答题纸一同交回)
科目名称:物理化学(二)
适用专业:材料物理与化学;化学工程;化学工艺;生物化工;应用化学;工业催化;能源化学工程;绿色能源化学与技术;生物医学工程;化学工程(专业学位);生物医学工程(专业学位)
(1)标出相区1至5的相态。
2)欲由组成为A的混合物制取纯MX.2H2O,最佳的操作步骤是什么?在图上标出并作简要说明。
3)SR线能否延长至QP线相交?为什么?若是完整相图,这部分是否有缺漏?若有,请补充完善。
2k B(g) + C(g)其中正向和逆向基元反应的速率常数分别为1k - ES 分别为反应物、产物和中间物。
中间物态近似法处理,试证明酶催化反应的动力学方程为
852B
华南理工大学
2018年攻读硕士学位研究生入学考试试卷(试卷上做答无效,请在答题纸上做答,试后本卷必须与答题纸一同交回)
科目名称:物理化学(二)
适用专业:材料科学与工程;化学工程;化学工艺;生物化工;应用化学;工业催化;
能源化学工程;绿色能源化学与技术;化学工程(专硕)
计算两种金属形成的化合物的化学比例式(分子式)。
2015年-2018年华南理工大学852物理化学(二)考研真题试题试卷汇编

1. 400K B 1mol C O2(g)DEFGHI6J 10 dm3 KLM 5 dm3 NODPQGHRSTUVWXYZI6C W[Q[ U \ H]^_ `ab_UcdefgFea 2.5R](15 h)
2. 1 mol 25iCjdk 100 kPa lma 150iCjn_YI6C W[Q[ U[ H[ S \ G]opj\jn_CqrdKfgFehs j 100iBCfgntua 40.637 kJ.mol-1 a 75.29 \ 33.58 J.K-1.mol-1 (vwa 100 kPa)25iBjCxyfgza 69.91 J.K-1.mol-1jn_G vwab_U](15 h)
第 4 页,共 16 页
芝士传媒 × 题源库
...让知识更美味...
9. `; C2H2(g) + H2(g) Ă C2H4(g)a b_U;op 298K B C2H2(g)[H2(g)[C2H4(g)CxyfgĔĕuhsa -1299.6[-285.83[ -1411.0 kJ.mol-1 7 C2H2(g) \ C2H4(g) Cxyfg³ĖėþĘhsa 209.2 \ 68.15 kJ.mol-1]åęºl(1) Z; 298K C¨Kl=Í ? (2) Z;Cum¹ (3) `; 298K CĚěeĜ ĝĞñBğ;.ChKra 100 kPaqĠBą.ChKa? (4) ;ġQÐKø/éCĢģº»? (15 h)
A
1 @
第 2 页,共 16 页
芝士传媒 × 题源库
...让知识更美味...
4. Mg \ Pb 0«h¬®¯°±l] (1) Mg \ Pb ²³C/´.µ¶k·µ¸¶kC¹c«³º»¹ (2) ¼½° 1~8 ~¾C¯¿] (3) ¼½°¯~ 3 \ 5 C¯\ÀÁÂ] (4) °ÀÁÂa 0 CÃÄŹ (5) ÆÇ° a \ b CÈÉÊÃ] (6) ®J a (x=0.2)lM f BË«hC«³Ìa? (7) JZ0«h®=ÍMÎÏ Pb Ð Mg? (15 h)
华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题
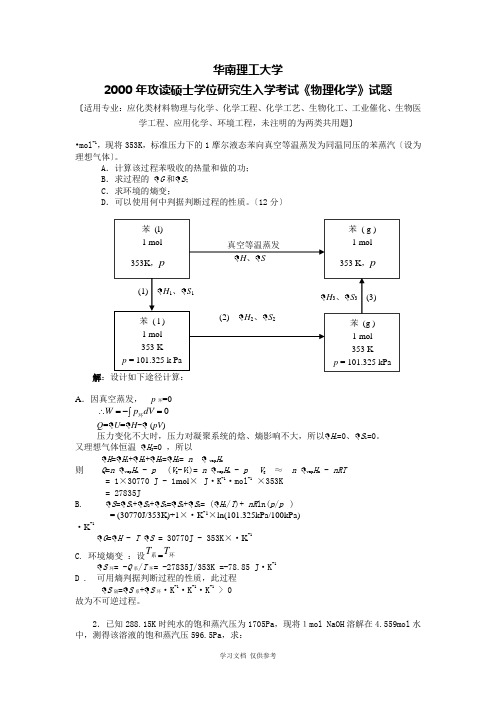
华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题〔适用专业:应化类材料物理与化学、化学工程、化学工艺、生物化工、工业催化、生物医学工程、应用化学、环境工程,未注明的为两类共用题〕•mol -1,现将353K ,标准压力下的1摩尔液态苯向真空等温蒸发为同温同压的苯蒸汽〔设为理想气体〕。
A .计算该过程苯吸收的热量和做的功;B .求过程的 G 和 S ;C .求环境的熵变;D .可以使用何中判据判断过程的性质。
〔12分〕解A .因真空蒸发, p 环=0⎰=-=∴0dV p W 环Q = U = H - (pV )压力变化不大时,压力对凝聚系统的焓、熵影响不大,所以 H 1=0、 S 1=0。
又理想气体恒温 H 3=0 ,所以H = H 1+ H 2+ H 3= H 2= n vap H m则 Q =n vap H m - p (V g -V l )= n vap H m - p V g ≈ n vap H m - nRT= 1×30770 J - 1mol × J ·K -1·mol -1×353K = 27835JB. S = S 1+ S 2+ S 3= S 2+ S 2= ( H 2/T )+ nR ln(p /p )= (30770J/353K)+1×·K -1×ln(101.325kPa/100kPa)·K -1G = H - T S = 30770J - 353K ×·K -1C. 环境熵变 :设系T =环TS 环= -Q 系/T 环= -27835J/353K =-78.85 J ·K -1D . 可用熵判据判断过程的性质,此过程S 隔= S 系+ S 环·K -1·K -1·K -1> 0 故为不可逆过程。
2.已知288.15K 时纯水的饱和蒸汽压为1705Pa ,现将1mol NaOH 溶解在4.559mol 水中,测得该溶液的饱和蒸汽压596.5Pa ,求:真空等温蒸发 H 、 SH 3、 S 3 (3)(1) H 1、 S 1苯 (l)1 mol 353K ,p 苯 ( l ) 1 mol 353 Kp = 101.325 k Pa苯 ( g ) 1 mol 353 K ,p苯 (g ) 1 mol 353 Kp = 101.325 kPa(2) H 2、 S 2A. A. 溶液中水的活度;B. B. 在纯水中和在溶液中,水的化学势的差值。
全国名校物理化学考研真题汇编(含部分答案)

目 录1.华南理工大学物理化学历年考研真题2014年华南理工大学629物理化学(一)考研真题2015年华南理工大学629物理化学(一)考研真题2016年华南理工大学629物理化学(一)考研真题2017年华南理工大学629物理化学(一)考研真题2018年华南理工大学629物理化学(一)考研真题2014年华南理工大学852物理化学(二)考研真题2015年华南理工大学852物理化学(二)考研真题2016年华南理工大学852物理化学(二)考研真题2017年华南理工大学852物理化学(二)考研真题2018年华南理工大学852物理化学(二)考研真题2.湖南大学物理化学历年考研真题2013年湖南大学831物理化学(理)考研真题2014年湖南大学831物理化学(理)考研真题2013年湖南大学832物理化学(工)考研真题3.武汉大学物理化学历年考研真题2013年武汉大学651分析化学和物理化学(C卷)考研真题2015年武汉大学655分析化学和物理化学(B卷)考研真题4.四川大学物理化学历年考研真题2015年四川大学887物理化学考研真题2016年四川大学887物理化学考研真题5.电子科技大学物理化学历年考研真题(含部分答案)2012年电子科技大学834物理化学考研真题及详解2013年电子科技大学834物理化学考研真题及详解2015年电子科技大学834物理化学考研真题6.中国科学技术大学物理化学历年考研真题2010年中国科学技术大学物理化学考研真题2011年中国科学技术大学物理化学考研真题2012年中国科学技术大学物理化学考研真题2013年中国科学技术大学物理化学考研真题2014年中国科学技术大学物理化学考研真题2015年中国科学技术大学物理化学考研真题2015年中国科学技术大学物理化学B考研真题7.其他名校物理化学历年考研真题(含部分答案)2011年南开大学831物理化学(含结构化学)考研真题2011年浙江大学726物理化学(甲)考研真题(含部分答案)2012年浙江大学726物理化学(甲)考研真题及详解2012年天津大学839物理化学考研真题及答案2012年厦门大学826物理化学考研真题2014年北京交通大学981物理化学考研真题2014年北京科技大学627物理化学B考研真题2015年北京科技大学804物理化学A考研真题2015年北京交通大学981物理化学考研真题2015年湘潭大学837物理化学(一)考研真题2014年华南理工大学629物理化学(一)考研真题2015年华南理工大学629物理化学(一)考研真题2016年华南理工大学629物理化学(一)考研真题2017年华南理工大学629物理化学(一)考研真题2018年华南理工大学629物理化学(一)考研真题2014年华南理工大学852物理化学(二)考研真题2015年华南理工大学852物理化学(二)考研真题2016年华南理工大学852物理化学(二)考研真题2017年华南理工大学852物理化学(二)考研真题2018年华南理工大学852物理化学(二)考研真题2013年湖南大学831物理化学(理)考研真题2014年湖南大学831物理化学(理)考研真题2013年湖南大学832物理化学(工)考研真题。
2002年华南理工大学物理化学考研真题及参考答案

3. 已知反应: 4Na (g) + O2 = 2 Na2O(s)
r Gm / (J·mol-1 ) = -1276222 + 890.6T/K-32.34( T/K)ln( T/K)
(a)
而反应: 4Cr(s) + 3 O2(g) 在 298K 时
= 2Cr2O3(s)
(b)
=2256.85 kJ·mol -1 r H m
2. 已知 H2O(l) 和 H2O(g) 的 S m (298K) 分别为 69.940 和 188.83 J·K-1·mol -1 ; f H m (298K)分别为
285.838 kJ·mol -1
和 241.825 kJ·mol -1 ; 假设相变过程的热效应随温度的变化可忽略不计。
= 547.77 J·mol -1 ·K-1 r Sm
rCp, m = 56 假设rCp, m 与温度无关。 (1) (2)
J·mol -1·K-1
写出反应(b)的 r Gm 与温度 T 的关系式;
证明在 p、温度低于 1063K 时 Cr2O3(s) 能被 Na(g)还原,即发生如下反应: 2Cr2O3 + 12Na(g) = 4 Cr(s) + 6 Na2O(s) (12 分) (c)
H = nCp,m(T2-T1) = [1×(12.471+8.3145)×(109.25-273.15)] J =-3407 J T V 10V 109.25 S nCV ,m ln 2 nR ln 2 [1 12.471ln 1 8.315ln 1 ]J K1 7.72J K1 T1 V1 273.15 V1 A U TS U T2 S S1 (T2 T1 ) [ 2043.9 109.25 7.72 13 (109.25 273.15)]J 756.6J G H TS H T2 S S1 (T2 T1 ) 2120J 注意: TS=T2S2-T1 S1 = T2(S1 + S)-T1 S1 ≠T1S + S1T
2003年华南理工大学 《物理化学》考研试题及参考答案(理工)

华南理工大学2003攻读硕士学位研究生入学考试试卷物理化学部分(与化工原理合一门课程)(试题已由葛华才老师整理求解,有错请告知!)1. 1mol 水在100℃、101.325kPa下正常气化, 已知水的正常蒸发焓为40.64 kJ . mol-1,求此过程的Q、W、∆U、∆H、∆S、∆G。
(15分)解:Q=∆H=n∆Vap H m= 1mol×40.64 kJ . mol-1= 40.64kJ (注:若题目未给出蒸发焓,可以不算出数值)∆S= ∆H/T= 40.64kJ/373.15K= 108.9J . K-1(可逆相变过程)∆G=0W= -p[V(g)-V(l)]≈-pV(g) = -nRT= -1mol×8.3145J . K-1 . mol-1×373.15K=-3103J∆U=Q+W= 40.64kJ-3103J = 37.54kJ2. 已知反应2NaHCO3(s) = Na2CO3(s) + H2O(g) + CO2(g)温度为50℃、100℃时系统的平衡总压分别为3950Pa、96300Pa。
设反应的∆r H m与温度无关,试求:(1) 计算50℃时该反应的K、∆r G m。
(2) 计算该反应的∆r H m。
(3) 计算NaHCO3(s)的分解温度。
(15分)解:(1) 设平衡总压为p,则2NaHCO3(s)= Na2CO3(s) + H2O(g) + CO2(g)平衡p/2 p/2K=p[H2O(g)] p [CO2(g)]/ p2 = (p / p)2/4 =(3950Pa/Pa)2/4=0.∆r G m= -RT ln K= -8.3145J . K-1 . mol-1×323.15K×ln(0.)= 21089 J . mol-1(2) T’=373.15K时,K‘= (p’ / p)2/4 =(96300Pa/Pa)2/4=0.2318∆r H m= [RT’T/(T’-T)]ln(K’/ K)=[8.3145J . K-1 . mol-1×373.15K×323.15K/(373.15K-323.15K)]×ln(0.2318/0.)=J . mol-1=128.1 kJ . mol-1(3) 若分解温度即为平衡总压p =Pa 时对应的温度T”,此时 K“= (p ”/ p )2/4 =(Pa/Pa)2/4=0.2567利用等压方程ln (K ”/ K ) = (∆r H m / R )(1/T -1/T”)即 ln(0.2567/0.)=(kJ . mol -1/8.3145J . K -1 . mol -1)(1/323.15K -1/T ”) T ”= 374.06K3.硫酸在常压下与水可形成3种水合物,其相图如右。
华南理工大学2007年攻读硕士研究生入学考试试卷(物理化学二)考研真题与答案

华南理工大学2007年招收硕士学位研究生入学考试试卷(试卷上做答无效,请在答题纸上做答,试后本卷必须与答题纸一同交回)科目名称:852物理化学二适用专业:材料科学与工程学院生物医学工程、材料物理与化学、生物医学工程(专业学位),化学与化工学院化学工程、化学工艺、应用化学、工业催化、能源环境材料及技术、制药工程、化学工程(专业学位)、生物化工1.1mol,-5℃的过冷水,在绝热容器中部分凝结,形成0℃的冰,水两相共存的平衡混合物。
(已知冰在0℃时的摩尔熔化焓是△H=6009J.mol-1,水与冰的定压热容分别为4.184,2.092J.K-1.g-1)。
(1)写出体系物态的变化。
(2)析出多少摩尔冰?(3)计算此过程的△U,△H 和△S。
(4)该过程是可逆的吗?(15分)2.1mol的理想气体从同一始态(298.2K,506.5kPa)分别经过下列过程到达相同的终态(298.2K,101.3kPa),求△U,△H,△S,△G ,Q,W,已知气体的C p,m=2.5R。
(1)等压加热,然后经过等容降温达到终态。
(2)绝热可逆膨胀后,等压加热到终态。
(15分)3.在100-120K的温度范围内,甲烷的蒸汽压与绝对温度T如下式所示:甲烷的正常沸点为112K。
在105Pa下,下列状态变化是等温可逆进行的。
试计算:(1)甲烷的及该过程的Q,W;(2)环境的△S环和总熵变△S总。
(10分)4.25℃时某物质B溶于水溶液,摩尔分数为0.02和0.4时B的蒸汽分压分别为1.43kPa和15.55Pa。
已知纯水在25℃时的蒸汽压为3169Pa,含B摩尔分数较小的水溶液可近似为理想稀溶液,试求:(1)含B摩尔分数为0.02的水溶液中水的蒸汽分压。
(2)溶质B的亨利常数k x。
(3)含B摩尔分数为0.4的水溶液中B的活度及活度系数。
(15分)5.某稀水溶液含有非挥发性溶质,在1.4℃下凝固。
假设该水溶液为理想稀溶液,试求:(1)该溶液的正常沸点。
华南理工大学2001-05年物理化学二真题与解答

华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题(适用专业:应化类含制糖工程,化工类,未注明的为两类共用题)1.苯的正常沸点为353K ,摩尔汽化焓为30.77kJ •mol -1,现将353K ,标准压力下的1摩尔液态苯向真空等温蒸发为同温同压的苯蒸汽(设为理想气体)。
A .计算该过程苯吸收的热量和做的功;B .求过程的 G 和 S ;C .求环境的熵变;D .可以使用何中判据判断过程的性质。
(12分)2.已知288.15K 时纯水的饱和蒸汽压为1705Pa ,现将1mol NaOH 溶解在4.559mol 水中,测得该溶液的饱和蒸汽压596.5Pa ,求:A. 溶液中水的活度;B. 在纯水中和在溶液中,水的化学势的差值。
(应化类做, 10分)3金刚石 石墨 c H m /(kJ ²mol -1)-395.3 -393.4 S m /(J ²K -1²mol -1)2.43 5.69 密度/kg ²dm -33.513 2.260求:A. 298K 时,由石墨转化为金刚石的 r G m ;B. 298K时,由石墨转化为金刚石的最小压力。
(10分) ∙G = G 1+ G 2+ G 3=022d )(0d d G p V V p V G p V p p pp p p ∆-=-=+∆+⎰⎰⎰石金 金 石假设(V 金-V 石)与p 无关,得:(V 金-V 石)( p - p ) = - G 24.对MnO-FeO 二组分系统,已知MnO 和FeO 的熔点分别为1785℃和1370℃;在1430℃时,含有40%和70%FeO(质量%)两固溶体间发生转熔变化,与其平衡的液相组成为85%FeO;在1200℃,两个固溶体的组成为36%FeO和74%FeO。
A.A.试绘制出该系统的相图;B.B.指出个区域和三相线对应的相态和自由度;C.C.当一含74%FeO的二相组分系统,由1650℃缓慢冷至1100℃时,作出冷却曲线,简述其相态的变化。
华南理工大学物理化学考研复习要览(48学时)

物理化学复习要览(48学时)试题结构:一选择题(10题20分)二计算题(6题60分)三简答题(5题20分)第二章热力学第一定律一、重要概念系统与环境,隔离系统,封闭系统,(敞开系统),广延量(加和性:V,U,H,S,A,G),强度量(摩尔量,T,p),功,热,内能,焓,热容,状态与状态函数,平衡态,过程函数(Q,W),可逆过程,节流过程,真空膨胀过程,标准态,标准反应焓,标准生成焓,标准燃烧焓二、重要公式与定义式1. 体积功:δW= -p外dV2. 热力学第一定律:∆U = Q+W,d U =δQ +δW3.焓的定义:H=U + pV4.热容:定容摩尔热容C V,m = δQ V /dT = (∂U m/∂T )V定压摩尔热容C p,m = δQ p /dT = (∂H m/∂T )P理想气体:C p,m- C V,m=R5. 标准摩尔反应焓:由标准生成焓∆f H Bθ (T)或标准燃烧焓∆c H Bθ(T)计算∆r H mθ = ∑v B∆f H Bθ (T) = -∑v B∆c H Bθ (T)6. 基希霍夫公式(适用于相变和化学反应过程)∆r H mθ(T2)= ∆r H mθ(T1)+⎰21TT∆r C p,m d T7. 恒压摩尔反应热与恒容摩尔反应热的关系式Q p-Q V = ∆r H m(T) -∆r U m(T) =∑v B(g)RT8. 理想气体的可逆绝热过程方程:p1V1γ= p2V2γ,p1V1/T1 = p2V2/T2,γ=C p,m/C V,m三、各种过程Q 、W 、∆ U 、∆ H 的计算1.解题时可能要用到的内容(1) 对于气体,题目没有特别声明,一般可认为是理想气体,如N 2,O 2,H 2等。
恒温过程d T =0, ∆ U =∆ H =0, Q =W非恒温过程,∆ U = n C V ,m ∆ T , ∆ H = n C p ,m ∆ T(2) 对于凝聚相,状态函数通常近似认为只与温度有关,而与压力或体积无关,即∆ U ≈∆ H = n C p ,m ∆ T2. 恒压过程:p 外=p =常数,无其他功W '=0(1) W = -p 外(V 2-V 1), ∆ H = Q p =⎰21T T n C p ,m d T , ∆ U =∆ H -∆(pV ),Q =∆ U -W(2) 真空膨胀过程p 外=0,W =0,Q =∆ U理想气体(Joule 实验结果):d T =0,W =0,Q =∆ U =0,∆ H =0(3) 恒外压过程:例1: 1mol 理想气体于27℃ 、101325Pa 状态下受某恒定外压恒温压缩到平衡,再由该状态恒容升温到97 ℃ ,则压力升到1013.25kPa 。
华南理工大学考研物理化学难点、要点概括及考研真题

华南理工大学2001年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试后本卷与答题纸一同交回)科目名称:物理化学(含物理化学实验)适用专业:化学工程、化学工艺、工业催化、环境工程(试题已由葛华才老师整理求解,有错请告知!)1. C6H6在100kPa时的熔点为5℃,摩尔熔化焓为9916J²mol-1,C p,m(l)=126.8J²K-1²mol-1,C p,m(s)=122.6J²K-1²mol-1。
求100kPa、–5℃下1 mol过冷C6H6凝固成固态C6H6的Q、△U、△H、△S、△A、△G,假设凝固过程的体积功可以忽略不计。
(12分)∆H= ∆H1+ ∆H2+ ∆H3= C p,m(l)(T’-T) +∆H2+C p,m(s)(T-T’)=9916 J²mol-1+(122.6-126.8)³(268-278) J²mol-1= 9958 J²mol-1恒压Q= ∆H= 9958 J²mol-1∆U= ∆H- ∆pV ≈∆H=9958 J²mol-1∆S= ∆S1+ ∆S2+ ∆S3= C p,m(l)ln(T’/T) +∆H2/T’+C p,m(s)ln(T/T’)= ∆H2/T’+[C p,m(s)-C p,m(s)]ln(T/T’)=9916 J²mol-1/278K+(122.6-126.8)ln(268/278) J²K-1²mol-1= 35.8 J²K-1²mol-1∆G≈∆A= ∆H- T∆S = 9958 J²mol-1-268K³35.8 J²K-1²mol-1 = 363.6 J²mol-12. 卫生部规定汞蒸气在1m3空气中的最高允许含量为0.01mg。
华南理工大学物理化学(二)考研真题2008—2018

852华南理工大学2008年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试卷上做答无效,试后本卷必须与答题纸一同交回)科目名称:物理化学(二)适用专业:材料物理与化学,材料学材料加工工程,化学工程,化学工艺,应用化学,工业催化,能源环境材料及技术,制药工程,生物医学工程共 3 页1. 4 g Ar(可视为理想气体,其摩尔质量M(Ar)=39.95 g·mol-1)在300 K时,压力为506.6 kPa,今在等温下反抗202.6 kPa的恒定外压进行膨胀。
试分别求下列两种过程的Q,W,ΔU,ΔH,ΔS,ΔA和ΔG。
(1) 若变化为可逆过程;(2) 若变化为不可逆过程。
(15分)2.如图所示,两只 5 dm3充满N2(g,可视为理想气体)的烧瓶浸没在沸水里,瓶内气体压力60795 Pa。
然后把一只瓶浸到冰水混合物中,一只仍在沸水中,试求(1)系统的压力;(2)过程的热(Q)和系统热力学能变化(ΔU);(3)系统焓变。
(10分)3.1 mol压力为P∃的液体A,在其正常沸点下,向真空容器中蒸发,终态变为与始态同温同压的1mol蒸气A。
设蒸气为理想气体,液体体积可以忽略,并已知液体A 在67℃的饱和蒸气压为 0.5P∃,蒸发热为34.92 kJ·mol-1,且与温度无关。
计算上述过程W、Q、ΔU、ΔH、ΔS、ΔG、ΔA。
(15分)4.已知某植物营养液的浓度为0.1mol·dm-3。
(1) 求此溶液在25℃时的渗透压。
若把植物细胞近似看成半透膜,试计算该营养液能被植物提升的高度;(2) 假设植物毛细管半径为0.1μm,该营养液能够完全润湿毛细管,试计算该营养液在毛细管中提升的高度;(3) 根据上述计算结果,判断植物主要依赖何种方式获取养分?(4) 你认为植物能够长的高度极限应该多少?原因?已知该营养液的密度为 1.00kg·dm-3,表面张力为0.0717N·m-1,重力加速度为9.81m·s-2。
华南理工大学2003年攻读硕士学位研究生入学考试《物理化学》试题

华南理工大学2003年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试后本卷与答题纸一同交回)科目名称:物理化学适用专业:材料物理化学、材料加工工程、环境工程、生物医学工程点评:本套题题量偏多,至少多了3题,部分题难度偏大,且其中一道题所给的条件有误,使学生根本无法计算。
1. 一绝热容器中装有10mol、80 ℃的纯水。
已知液态水的恒压摩尔热容C p,m(H2O,l) 为75.3J·mol-1·K-1;水的摩尔气化焓和冰的摩尔焓分别为40 kJ·mol-1、46.004 kJ·mol-1。
在101325Pa下,为了使容器中的水温降至50 ℃。
试问:(1)(1)需加入0℃的冰为多少?(2)(2)水和冰混合过程的总熵变。
(10分)解:本题求解需冰的溶化焓,但题目没有给出,题目给的冰的摩尔焓没有任何意义,所以是一个无法求解的题。
也许,题目给的应该是冰的摩尔升华焓,这时冰的溶化焓可近似计算如下:∆fus H= ∆sub H- ∆vap H= 46.004 kJ·mol-1-40kJ·mol-1=6.004 kJ·mol-1(1)(1)设加入的冰量为x mol,根据绝热条件有Q p=∆H = n(H2O) C p,m(H2O,l)(50-80)K+ x [∆fus H +C p,m(H2O,l)(50-0)K] = 0于是:x =n(H2O) C p,m(H2O,l)×30K/[∆fus H +C p,m(H2O,l)×50K]=10mol×75.3J·mol-1·K-1×30K/[6004 J·mol-1+75.3J·mol-1·K-1×50K]= 2.31 mol(2) ∆S = n(H2O) C p,m(H2O,l)×ln(333.15K/353.15K)+x [∆fus H /273.15K+C p,m(H2O,l)×ln(333.15K/273.15K)]=10mol×75.3J·mol-1·K-1×ln(333.15K/353.15K)+2.31mol×[6004 J·mol-1 /273.15K+75.3J·mol-1·K-1×ln(333.15K/273.15K)]= 41.42 J·K-12. 2mol 理想气体在101325Pa下由300K加热到500K,该过程的热为18kJ。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华南理工大学
2002年攻读硕士学位研究生入学考试试卷
1.在绝热的条件下,将0.4mol某理想气体从200kPa 压缩到1000kPa 时,温度从300K上升到900K,求该过程的W、△H、△S、△U、△G,判断过程的性质并指出判据,已知:该理想气体在300K和200kPa时的摩尔熵为S m=205J∙K-1∙mol-1,定压摩尔热容为C p,m=3.5R (12 分)
2.298K时,反应N2O4(g)=2NO2(g)的平衡常数Kϴ=0.155,标准摩尔焓为57.24kJ∙mol-1(假定温度对反应焓的影响可以忽略不计)。
(共10 分)
求(1) 373K 时反应的平衡常数Kϴ。
(2) 298K,总压为pϴ时N2O4的离解度。
(3) 298K,总压为pϴ,离解前N2O4和N2(惰性气体)物质的量为1:1时N2O4的离解
度。
3.水的蒸汽压与温度之间可用如下关系式表示:
lg(p/Pa) =-A/T+B
若已知水在77℃时的饱和蒸汽压为41.847kPa,求:
(1) 常数A,B 的值以及水的摩尔蒸发焓;
(2) 在多大外压下水的沸点可以改变为101℃;(共8 分)
4.(NH4)2SO4-H2O 所组成的二组分系统,在-19.1℃时有一个低共熔点,此时冰、(NH4)2SO4和浓度为38.4%(质量分数,下同)的(NH4)2SO4水溶液平衡共存。
在108.9℃时(NH4)2SO4饱和溶液(浓度为
51.8%)沸腾。
(1) 试绘出相图示意图。
(2) 分析各组分存在的相平衡。
(3) 含30%的(NH4)2SO4水溶液冷却能否得到纯固体(NH4)2SO4?若不能,如何得到纯固体(NH4)2SO4?
(4) 1kg 含51.8%的(NH4)2SO4水溶液在何温度下能得到最多的纯固体(NH4)2SO4,计算出最多能得到的(NH4)2SO4的量。
(共12 分)
5. 25℃时,电池Zn(s)|ZnCl2(b=0.555mol∙kg-1)|AgCl(s)|Ag(s)的电动势E=1.015V,(∂E/∂T)p=-4.02×10-4V∙K-1。
已知Eϴ(Zn2+/Zn)=-0.7630V, Eϴ(AgCl/Ag,Cl-)=0.2220V。
(1) 写出电池反应。
(2) 求上述反应的平衡常数Kϴ。
(3) 求电解质溶液ZnCl2的平均活度系数。
(4) 求上述反应在定浓条件下,在恒压无其他功的反应器中进行或在电池中可逆地进行时吸放的热量各为多少?(共12 分)
6.25℃时乙醇水溶液的表面张力与溶液中乙醇的浓度c(单位mol∙dm-3)的关系为ϒ/(N∙m-1)=[72-
0.5(c/mol∙dm-3)+0.2(c/mol∙dm-3)2]×10-3计算c=0.6mol∙dm-3时,(1)乙醇在液面的表面过剩;(2)将半径为10-3m 的玻璃毛细管垂直插入该溶液中(设乙醇水溶液完全润湿毛细管),溶液在毛细管中上升高度是多少?已知该溶液的密度为986kg∙m-3,重力加速度为9.8N∙kg-1。
(共8分)
7.乙醛热分解CH3CHO→CH4+CO是不可逆反应,在518℃及恒容条件下,有数据:
初始压力(纯乙醛) 0.400kPa 0.200kPa
100 秒后系统总压 0.500kPa 0.229kPa
求(1)乙醛分解的反应级数;(2)计算518℃时的速率常数;(3)实验测得在538℃时的速率常数是518℃时的两倍,计算该反应的活化能。
(共12 分)
8. 有一平行反应
在500K时,k1、k2分别为4.65s-1和3.74s-1。
求(1)A转化90%所需要的时间;(2)求总反应的表观活化能。
已知两平行反应的活化能E1、E2 分别为20kJ∙mol-1和26 kJ∙mol-1。
(共10分)
9.将稀KI和AgNO3(过量)溶液混合制成溶胶。
(1)写出胶团结构示意图;(2)画出此胶团相对的双电层电势差示意图;(3)如何确定胶粒是带正电还是带负电?(共8 分)
10.在物理化学实验中为了测定反应:I-+ I2= I3-的平衡常数,一种方法是在水溶液系统中加入CCl4溶剂。
请试述在两系统中如何确定上述反应中各物质的平衡浓度,从而计算反应的平衡常数?(共8 分)。
