(新课标)2015届高考化学大一轮复习讲义 第二章 第2讲 离子反应 离子方程式课件
2015届高考化学一轮总复习 专题二 第二单元 电解质 离子反应课件 苏教版

(4)强电解质都是离子化合物,弱电解质都是共价化合物
(
)
解析
电解质溶液导电性的强弱与溶液中离子浓度的大
小及所带电荷数的多少有关,与电解质强弱没有必然联 系,(1)错误;NH3通入水中与水反应生成NH3· H2 O, NH3· H2O能够发生电离而使溶液有较强的导电性,而 NH3本身并不能电离,故NH3不是电解质,(2)错误;弱
举例
2. 电解质的电离 水溶液中或熔融 状态下,离解成 电离是指电解质在__________________ 自由移动离子的过程。 3.电离方程式的书写 (1)强电解质的电离方程式中,用“______ === ”连接,弱电解 质(包括弱酸的酸式酸根)的电离方程式中,用“ ”连 接。 ++SO 2- Na SO ===2Na 2 4 4 如Na2SO4:_________________________ ,HClO: + - HClO H + ClO __________________ (2)多元弱酸的电离分步书写,多元弱碱的电离一步写 + - H2CO3 H +HCO3 , 完。如:H2CO3:________________________ - + 2- HCO H + CO 3 3 _________________________ ;Fe(OH)3:
①硫酸
⑦醋酸 NaHCO3 答案
②盐酸
⑧氯化氢 ①④⑦⑧⑫
③氯气
⑨蔗糖
④硫酸钡
⑩氨气
⑤酒精
⑪CO2 ⑧⑫
2.判断正误,正确的画“√”,错误的画“×” (1)强电解质溶液的导电性比弱电解质溶液的导电性强 ( (2)NH3通入水中,溶液导电性较强,故它是强电解质 ( (3)弱电解质溶液中存在两种共价化合物分子 ( ) ) )
高考化学一轮复习课件第2讲 离子反应课件共58张

第2讲 离子反应 有些化合物的水溶液虽然能导电,但溶液中导电的离子不是其自身电离产生的,故这些化合物不属于电解质,而属于非电解质,如SO2、CO2、SO3、NH3(因溶于水分别生成的H2SO3、
ห้องสมุดไป่ตู้
(1)澄清石灰水中加入稀盐酸: OH-+H+ H2O 。
(2)石灰乳与Na2CO3溶液反应: Ca(OH)2+C O32
CaCO3+2OH- 。
(3)NH4Cl与NaOH两稀溶液混合:
N
H
4
+OH-
NH3·H2O 。
(4)用MnO2与浓盐酸共热制Cl2: MnO2+4H++2Cl- Mn2++Cl2↑+2H2O 。
Al(OH)3
Al3++3OH-
无所求则无所获。
以天下为己任。
生无一锥土,常有四强海心酸。酸式盐完全电离,一步写出。如NaHSO4在水溶液中的电离方程式为NaHSO4
Na++H++S O24 ,
胸把不无意为大 念 穷志沉变,潜节枉得,酸式活下不一,为世何贱在。理易不志熔可。融得,状把态志气下奋的发得电起离,何方事程不可式做为。 NaHSO4
c.N
H
4
与CH3COO-、C
O32
,Mg2+与HC
O3
高考化学一轮总复习 第2章 第2节离子反应课件

OH-===BaSO4↓+H2O( )
菜单
高三总复习·化学
切
(5)NaHCO3 的水解:HCO- 3 +H2O H2CO3+OH-
脉
搏 考
()
点 突
(6)向 NaClO 溶液中通入少量 SO2:2ClO-+SO2+ 课
破
时
H2O===2HClO+SO32-( )
提 升
提
练
素 养
【答案】 (1)× (2)× (3)× (4)× (5)√
升 练
素
养 高
2CH3COOH===Ca2++2CH3COO-+2CO2↑+2H2O(
)
频
考 点
(3)Na2O2
固
体
与
水
反
应
:
2O
2- 2
+
2H2O===4OH
-
+
O2↑( )
菜单
高三总复习·化学
切
(4)向 NaHCO3 溶液中滴加盐酸:HCO- 3 +H+===H2O+
脉
搏 考
CO2↑(
)
点 突
高
频
(6)×
考
点
菜单
高三总复习·化学
【题组二】 考查化学式或离子符号的正确使用
切 脉
2.判断正误(正确的打“√”,错误的打“×”)
搏
考 点
(1) 醋 酸 与 氨 水 混 合 : CH3COOH +
突
破 NH3·H2O===CH3COONH4+H2O( )
课 时
提
提
(2) 碳 酸 氢 钙 溶 液 加 到 醋 酸 中 : Ca(HCO3)2 +
考
点 突
(2)对于微溶性的强电解质:如澄清石灰水中 Ca(OH)2 以 课
2015高考化学一轮复习 第二章 第二讲 离子反应

第二讲离子反应一、选择题1.下列说法中正确的是( )。
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-B.硫酸钡难溶于水,但硫酸钡属于强电解质C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质D.硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2-解析氯化钠在溶解于水时即能电离出Na+和Cl-,电解质的电离无需外加电流的作用,选项A说法错误;硫酸钡虽难溶于水,但硫酸钡溶于水的部分是完全电离的,因此硫酸钡属于强电解质,选项B 说法正确;二氧化碳溶于水生成的碳酸能部分电离,碳酸是弱电解质,而二氧化碳是非电解质,选项C说法错误;硫酸钠在水中的电离方程式应为Na2SO4===2Na++SO2-4,选项D错误。
答案 B2.有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。
下列离子方程式中,只能表示一个化学反应的是 ( )。
①Fe+Cu2+===Fe2++Cu②Ba2++2OH-+2H++SO2-4===BaSO4↓+2H2O③Cl2+H2O===H++Cl-+HClO④CO2-3+2H+===CO2↑+H2O⑤Ag++Cl-===AgCl↓A.只有③ B.②③C.③⑤ D.①④解析离子方程式可表示一类反应,如①可表示金属铁与可溶性铜盐反应,②可表示硫酸或硫酸氢盐与氢氧化钡反应,④可表示可溶性碳酸盐与强酸反应,⑤可表示可溶性银盐与盐酸或盐酸盐反应。
答案 A3.能正确表示下列反应的离子方程式为 ( )。
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO-3+OH-===CO2-3+H2OB.二氧化硫通入次氯酸钠溶液:SO2+ClO-+OH-===SO2-4+Cl-+H2OC.硫化钡加入稀硫酸:BaS+2H+===H2S↑+Ba2+D.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-+H2O===2[Al(OH)4]-解析A中忽略了碳酸钙的生成;B中没配平离子方程式;C中忽略了硫酸钡的生成。
化学高考一轮复习课件:第2章 第2讲 离子反应、离子方程式
答案 ①④⑦⑧⑫ ⑤⑨⑩⑪ ①④⑧⑫ ⑦
①H2SO4===2H++SO42-;
④BaSO4===Ba2++SO24-;
⑦CH3
3COO-+H+;
⑧HCl===H++Cl-;
⑫NaHCO3===Na++HCO3-、HCO-3
注意:要注意离子反应中的多重反应:
①气体与沉淀并行。如向 Ba(OH)2 溶液中滴加 (NH4)2SO4 溶液,若只写成 SO24-+Ba2+===BaSO4↓ 或 NH+ 4 +OH-===NH3↑+H2O 就错了,而应写为 Ba2++2OH-+2NH+ 4 +SO24-===BaSO4↓+2NH3↑ +2H2O。
即时巩固 1 下列说法中一定正确的是( ) A.强电解质溶液的导电性比弱电解质溶液的导 电性强 B.BaSO4 投入水中, 导电性较弱,故它是弱 电解质 C.弱电解质溶液中存在两种共价化合物分子 D.氯水能导电,所以 Cl2 是电解质
解析 电解质溶液导电性的强弱与溶液中离子 浓度的大小及所带电荷数有关,与电解质强弱没有 必然联系,A 错误;尽管 BaSO4 难溶于水,但溶解 的部分全部电离,故其为强电解质,B 错误;弱电解 质溶液中,有未电离的弱电解质和水这两种共价化 合物分子,C 正确;氯气是单质,既不是电解质, 也不是非电解质,D 错误。
A.①②③④⑤
B.②④⑤⑥⑩
C.②③⑦⑧⑨
D.③⑦⑩
解析 ①⑤⑦⑨都是与量有关的离子方程式,
3.三查化学式拆分、化学符号(↑、↓、===、
使用是否正确
如碳酸氢钙溶液与盐酸反应:
Ca(HCO3)2+2H+===Ca2++2H2O+2CO2↑( × ) HCO- 3 +H+===H2O+CO2↑(√ ) 4.四查是否忽略隐含离子反应
高三化学一轮复习 第二章 第2讲 离子反应和离子方程式课件

C.加入Na2CO3溶液:CO23-+2H+===CO2↑+H2O ,
D.加入Zn粒: Zn+2H+===H2↑+Zn2+
,
E.加入NaOH溶液:H++OH-===H2O
。
从A~E可知离子反应发生的条件:①生成难溶的物质;
②生成 难电离 的物质;③生成 易挥发 的物质;④发 生 氧化还原反应 。
(3)离子反应的本质 A~E中,混合后溶液中SO24-的物质的量减少的是 A (填序 号,下同);H+物质的量减少的是 B、C、D、E ;因此 离子反应的本质是溶液中某些离子的物质的量的 减少 。
B.BaSO4投入水中,导电性较弱,故它是弱电解质 C.弱电解质溶液中存在两种共价化合物分子
D.氯水能导电,所以Cl2是电解质 解析 电解质溶液导电性的强弱与溶液中离子浓度的大小
及所带电荷数有关,与电解质强弱没有必然联系,A错误; 尽管BaSO4难溶于水,但溶解的部分全部电离,故其为强 电解质,B错误; 弱电解质溶液中,有未电离的弱电解质和水这两种共价化合
3.电离方程式的书写
(1)强电解质:完全电离,用 === 表示。如H2SO4、
NaOH、(NH4)2SO4的电离方程式分别为 H2SO4===2H++SO24- 、 NaOH===Na++OH- 、
(NH4)2SO4===2NH+ 4 +SO42-
。
(2)弱电解质:部分电离,用
表示。
①多元弱酸分步电离,且电离程度逐步减弱,酸性主要由第
一步电离决定。如H2S电离方程式为 。
②多元弱碱分步电离,但一步写出。
如Cu(OH)2
Cu2++2OH-。
③两性氢氧化物双向电离。如Al(OH)3的电离方程式:
(3)酸式盐
①强酸酸式盐完全电离,一步到底。如NaHSO4在水溶液
高考化学大一轮复习 2.2离子反应课件

4.写出下列典型反应的离子方程式: (1)氯化铝溶液中加入过量氨水 _____________________________________________________ (2)小苏打与乙酸溶液混合 _____________________________________________________ (3)氧化镁溶于稀硫酸 _____________________________________________________ (4)澄清石灰水中加入盐酸 _____________________________________________________
答案:(1)Al3++3NH3·H2O===Al(OH)3↓+3NH+ 4 (2)HCO3-+CH3COOH===CH3COO-+CO2↑+H2O (3)MgO+2H+===Mg2++H2O (4)OH-+H+===H2O (5)Cl2+H2O H++Cl-+HClO (6)Al3++3H2O Al(OH)3(胶体)+3H+ (7)4H++2Cl-+MnO2==△===Cl2↑+2H2O+Mn2+ (8)NH+ 4 +OH-===NH3·H2O
(2)离子方程式的书写步骤(以碳酸钠和盐酸的反应为例)
问题思考: 1.Fe2+能与 NO- 3 共存,但在酸性条件下,二者还能大量存在 吗? 答案:不能大量存在。因为 NO-3 (H+)将 Fe2+氧化为 Fe3+。 2.离子方程式:CO32-+2H+===H2O+CO2↑的含义是什么?
答案:表示可溶性碳酸盐与强酸生成可溶性盐和二氧化碳的反 应。
(10)(NH4)2SO4 溶液与 NaOH 溶液混合加热 _____________________________________________________ (11)Na2SO4 溶液与 AgNO3 溶液混合 _____________________________________________________ (12)NaHCO3 溶液与稀盐酸混合 _____________________________________________________ (13)NaHSO4 溶液与 NaOH 溶液混合 _____________________________________________________
高考化学大一轮复习讲义:第2章 第2节 离子反应 含解析

第二节 离子反应[基础知识自查]1.电解质和非电解质(1)分类依据(2)电解质的强弱与物质类别的关系—强酸、强碱、绝大多数盐,如HNO 3、NaOH 、CaCO 3等|—弱酸、弱碱和水,如乙酸、一水合氨等2.电解质的电离(1)电离是指电解质在水溶液里或熔融状态下,产生了能够自由移动离子的过程。
(2)电离方程式的书写:①强电解质的电离方程式中,用“===”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“”连接。
如Na2SO4:Na2SO4===2Na++SO2-4,HClO:HClO H++ClO-。
②多元弱酸的电离分步书写,多元弱碱的电离一步写出。
如H2CO3:H2CO3H++HCO-3,HCO-3H++CO2-3;Fe(OH)3:Fe(OH)3Fe3++3OH-。
③酸式盐的电离:一元强酸酸式盐与一元弱酸酸式盐的阴离子不同。
如NaHSO4溶液中:NaHSO4===Na++H++SO2-4,NaHCO3溶液中:NaHCO3===Na++HCO-3,HCO-3H++CO2-3;NaHSO4熔化:NaHSO4===Na++HSO-4。
④两性氢氧化物[Al(OH)3]的电离Al3++3OH-碱式Al(OH)3酸式H++AlO-2+H2O[应用体验]1.思考回答(1)CO2、NH3、SO2的水溶液导电,那么CO2、NH3、SO2是电解质吗?为什么?(2)CaCO3、BaSO4、AgCl溶于水形成的溶液导电性很差,能否说明CaCO3、BaSO4、AgCl为弱电解质?为什么?[提示](1)CO2、NH3、SO2为非电解质。
CO2、NH3、SO2的水溶液中生成了H2CO3、NH3·H2O、H2SO3这些电解质而使溶液导电。
(2)CaCO3、BaSO4、AgCl为强电解质。
这三种物质在水中溶解度很小,离子浓度很小,导电性很差,但溶于水的这三种物质全部电离,应属强电解质。
2.有下列物质:①HF②H2S③H2SO4④Fe(OH)2⑤NaHSO3⑥Na2CO3⑦SO3⑧BaCO3(1)强电解质有________(填序号)。
高三化学一轮复习 第二章 第2节 电解质离子反应 精品课件 鲁科版必修1

Ba2++2OH-===BaSO4↓+Cu(OH)2↓,如果只写一 半忽视了另一半,则不正确。
4.看电解质拆分是否正确 (1)强酸、强碱和可溶性盐写成离子。 (2)微溶性物质的澄清溶液写成离子, 浊液写成化学式。 (3)可溶性多元弱酸酸式盐的酸式酸根一律保留酸式酸
- -
D.在强碱溶液中次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4: 3ClO +2Fe(OH)3===2FeO2 4 +3Cl +H2O+4H
- - - +
解析
A 项,应生成 CaCO3;B 项,H+前化学计
量数应为 4;C 项正确,通入过量 CO2 将生成 HCO- 3; D 项,在强碱性溶液中,产物 H+将最终生成 H2O。
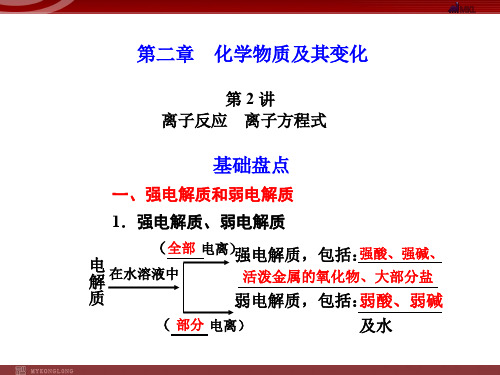
• 1.强电解质和弱电解质 • (1)电解质:在 水溶液中或熔融状态 下 化合物 能够导电的 。 水溶液中和熔融状态 • (2)非电解质:在 下都不导 化合物 电的 。 水溶液中全部电离成离子的电解质 • (3)强电解质:在 叫 强电解质。
在水溶液中部分电离成离子的电解质 • (4)弱电解质: 叫弱电解质。 • 在强电解质的水溶液中,溶质的存在形式 阴、阳离子 溶质分子 是:只有 ,没有 ; 而在弱电解质的溶液中,既有 阴、阳离子 溶质分子 ,又有 ,并且存在着电离 平衡。 酸、碱、盐 • 在中学阶段,常见的电解质主要是 等化合物。 强碱 强酸 大多数盐 • 强电解质主要有 弱酸 弱碱 、 极少数的盐 、 水 ;弱电解质主要有 、 、 和 。
• 下列物质中,属于强电解质的是 ________(均填序号);属于弱电解质的是 ________;属于非电解质的是________。 • ①氨气 ②氨水 ③盐酸 ④纯醋 酸 • ⑤硫酸钡 ⑥氯化银 ⑦氯化钠 ⑧二氧化碳 • ⑨醋酸铵 ⑩氢气
高考化学一轮复习第二章第二讲电解质离子反应-PPT文档资料67页

考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
热点透析1
5.离子方程式的书写步骤(以CaCO3与盐酸的反应为例)
——写出正确的化学方程式
C__a_C__O_3_+__2_H__C_l_=_=__=_C_a_C__l_2+__C__O__2↑__+___H_2_O_。
——把易溶解且易电离的物质写成离子形式
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
热点透析1
2.离子方程式正误判断
(1)看离子反应是否符合客观事实,不可主观臆造产物
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
热点透析1
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
热点透析1
一种关系………………………………………………………………………………………… 电解质、非电解质、强电解质、弱电解质之间的关系
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
热点透析1
(3)酸式盐
①强酸酸式盐完全电离,一步到底。如NaHSO4在水溶液中 的电离方程式为_N_a_H__S_O__4=_=__=_N_a_+__+__H_+_+__S__O_4_2-_,在熔融状 态下的电离方程式为_N_a_H__S_O_4_=_=_=_N__a_+_+__H__S_O_4_-_。
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
热点透析1
2.强电解质、弱电解质
电 在水溶(全部电离)强电解质,包括:强__酸__、__强__碱___、__大__部__分__盐__等 解 液中
2018学年度2015级高考化学一轮复习《离子反应》(PPT课件共张) (共94张PPT)

(1)金属能导电,所以金属是电解质( × )
(2)Cl2的水溶液能导电,所以Cl2是电解质( × )
(3)硫酸在水溶液中能完全电离,所以稀硫酸是强电解质( × )
(4)SO2、NH3的水溶液能导电,所以SO2、NH3均是电解质( × )
(5)BaSO4的水溶液的导电性很弱,故它是弱电解质( × )
(6)强电解质溶液的导电性比弱电解质溶液的导电性强( × )
第2讲 离子反应
考纲要求
1.了解电解质的概念,了解强电解质和弱电解质的概念。 2.了解电解质在水溶液中的电离以及电解质溶液的导电性。 3. 了解离子反应的概念、离子反应发生的条件,能正确书写
离子方程式,并能进行有关计算。
一、知识梳理
1.电离
电解质在水溶液中或熔融状态下离解成自由移动离子的过程。
2.电解质和非电解质
(5)向NaOH溶液中通入少量Cl2( ③ )
(6)向饱和石灰水中不断通入CO2( ① )
答案
3.同一温度下,强电解质溶液a、弱电解质溶液b、金属导体c三者的导电能
力相同,若升高温度后,它们的导电能力强弱顺序是( A )
A.b>a>c
C.c>a>b
B.a=b=c
D.b>c>a
解析 : 金属导体随温度升高导电能力逐渐减弱;强电解质不存在电离平衡,
NaCl===Na++Cl- (7)NaCl________________ ;
2+ 2- BaSO ===Ba + SO 4 4 ; (8)BaSO4____________________
2- + - - + NaHCO ===Na + HCO 、 HCO H + CO 3 3 3 3 ; (9)NaHCO3__________________________________________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过渡元素中的常见弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2 等。
考点一
知识梳理
递进题组
返回
递进题组 题组一
1
题组二
2
3
考点一
知识梳理
递进题组
返回
递进题组 题组一
1
题组二
2
3
题组一
电离方程式的书写——理解离子反应的基石
1.写出下列典型物质的电离方程式 + 2- H SO ===2H + SO 2 4 4 (1)H2SO4___________________________________ ;
考点一
知识梳理
递进题组
返回
知识梳理
2.强电解质和弱电解质的比较 强电解质 在水溶液中能 完全 定义 电离的电解质 电离平衡
弱电解质 在水溶液中只能 部分 电离的电解质
不存在
存在
水合离子、水分子、 弱电解质分子
溶液中存在 水合离子、 水分子 微粒种类 电离过程
不可逆、不存在电
离平衡
可逆、存在电离平衡
- 3+ Fe(OH) Fe + 3OH 3 (4)Fe(OH)3_________________________________ ; + - NH · H O NH + OH 3 2 4 (5)NH3· H2O________________________________ ;
NaCl===Na +Cl (6)NaCl____________________________________ ;
+ - - + 2- H CO H + HCO 、 HCO H + CO 2 3 3 3 3 ; (2)H2CO3_____________________________________ - 2+ Ca(OH) ===Ca + 2OH (3)Ca(OH)2_________________________________ ; 2
离子反应和离子方程式
用分类思想突破跟量有关的离 子方程式的书写
离子 反应 离子 方程 式
考点三
考点四
突破离子方程式正误判断的 “四个陷阱”知识梳理
I
考点一 电解质
1.电解质和非电解质的比较 相同 定义 不同点 实例 点 在水溶液里或熔 一定条件下能 NaCl 电解 都 融状态下能够导 够电离产生离 H2SO4 质 是 电的化合物 子,能导电 NaOH 化 在水溶液里和熔 合 非电 不能电离 蔗糖 融状态下都不导 物 解质 不能导电 酒精 电的化合物 注意 单质和混合物既不是电解质也不是非电解质。
错误; (5)CaO 是强电解质,是因为它的水溶液能导电( × ) 解析 CaO 是强电解质,是因为熔化时,能完全电离,能
导电,它的水溶液能导电,是因为 CaO 和 H2O 反应生成 Ca(OH)2, Ca(OH)2 能电离出自由移动的 Ca2+和 OH-, 错误。
考点一
知识梳理
递进题组
返回
知识梳理
考点一
+
-
知识梳理
递进题组
考点一
知识梳理
递进题组
返回
知识梳理
强酸:HCl、H2SO4、 弱酸:CH3COOH、 HNO3、 HClO4、 HBr、 HCN、H2S、H2CO3 等 HI 等 弱碱:NH3· H2O、 举 强碱: KOH、 NaOH、 Cu(OH)2 等 例 Ba(OH)2 等 H2O 及小部分盐: 绝大部分盐:BaSO4、 (CH3COO)2Pb 等 BaCl2 等 3.电离 电解质在水溶液中或熔融状态下离解成 自由移动 离子 的过程。
①④⑦⑧⑫ ,属于 3.下列物质中,属于电解质的是_____________ ⑤⑨⑩⑪ ; 属 于 强 电 解 质 的 是 非 电 解 质 的 是 __________ ①④⑧⑫ ,属于弱电解质的是________ ⑦ 。 __________
①H2SO4 ⑥铜 ② 盐酸 ③ 氯气 ④ 硫酸钡 ⑤ 酒精 ⑦醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气
离,故其为强电解质,错误;
考点一
知识梳理
递进题组
返回
知识梳理
(3)弱电解质溶液中存在两种共价化合物分子 ( √ ) 解析 弱电解质溶液中, 有未电离的弱电解质和水这两
种共价化合物分子,正确; (4)强电解质都是离子化合物,弱电解质都是共价化合 物 ( × ) 解析 HCl、H2SO4 都是共价化合物但却是强电解质,
考点一
知识梳理
递进题组
返回
知识梳理
深度思考
1.某物质溶于水所得的溶液能导电,该物质一定是电 解质吗?试举例说明。 答案 不一定,如 Cl2 的水溶液能导电,但它不是化
合物,所以它既不是电解质,也不是非电解质。再 如 CO2、SO2、NH3 的水溶液也能导电,但导电的原 因并不是 CO2、SO2、NH3 分子的电离所致,而是它 们与水反应生成的 H2CO3、H2SO3、NH3· H2O 电离产 生自由移动的离子所致,故 CO2、SO2、NH3 是非电 解质。
考点一
知识梳理
递进题组
返回
知识梳理
2.判断正误,正确的划“√”,错误的划“×” (1) 强电解质溶液的导电性比弱电解质溶液的导电 性强 ( × ) 电解质溶液导电性的强弱与溶液中离子浓
解析
度的大小及所带电荷数的多少有关,与电解质强弱 没有必然联系,错误;
(2)BaSO4 投入水中, 导电性较弱,故它是弱电解 质 ( × ) 解析 尽管 BaSO4 难溶于水, 但溶解的部分全部电
化学
人教版
第二章
第2讲
化学物质及其变化
离子反应 离子方程式
[考纲要求] 1.了解电解质的概念,了解强电解质和弱电解质的 概念。 2.了解电解质在水溶液中的电离以及电解质溶液的 导电性。 3.了解离子反应的概念、离子反应发生的条件,能 正确书写离子方程式,并判断其正误。
知识梳理 考点一 电解质
考点二
⑪CO2 ⑫NaHCO3
考点一
知识梳理
递进题组
返回
知识梳理
反思归纳
依据元素周期表,突破强、弱电解质的记忆 ⅠA:除 LiOH 外其余都是强碱。 ⅡA:除 Mg(OH)2 外其余都是强碱。 ⅢA:Al(OH)3 是两性氢氧化物。 ⅣA:H2CO3、H2SiO3 均为弱酸。 ⅤA:强酸:HNO3 中强(或弱)酸:HNO2、H3PO4。 ⅥA:强酸:H2SO4 弱酸:H2SO3、H2S ⅦA:强酸:HCl、HBr、HI、HClO4 等 弱酸:HF、HClO 等。
