兽药GMP验收程序
兽药GMP检查验收项目(生物制品)

兽药 GMP 检查验收工程〔生物制品〕序号*001 002003 *004 005 章节条款内容企业应建立生产和质量治理机构,明确各类机构和人员的职责。
应建立生产治理和质量治理人员的个人档案。
企业主管生产治理的负责人和质量治理的负责人应具有兽医、生物制药等相关专业大专以上学历,并具有生产、质量治理工作阅历。
生产治理部门的负责人和质量治理部门的负责人应具有兽医、生物制药等相关专业大专以上学历,有兽医生物制品生产、质量治理阅历。
生产治理和质量治理负责人应由专职人员担当,不得相互兼任。
负责部门结果行政部行政部行政部行政部行政部06机构直接从事生产操作的人员应具备高中以上文化程度,其根底理论学问和实际操作技能应符合制品生产需要。
行政部07与08人员09101112*013014015厂房016与017设施018019 应制定年度人员培训打算,并应依据人员、制品、法律法规变化等实际状况调整培训内容。
从事与高风险性微生物和高毒性物质有关制品的生产、检验人员,应经相应专业的技术培训。
生产、检验人员上岗前应经过相应的岗位培训。
企业负责人和部门负责人应定期承受有关法律、法规培训。
专职质量检验人员应具有本专业中专以上文化程度,并经卫生学、微生物学等培训,具有根底理论学问和实际操作技能,持有中国兽医药品监察所核发的培训合格证。
专职质量检验人员数量应符合制品检验和有关治理需要。
有关人员的理论考核和现场操作考核结果应符合要求。
质量治理部门负责人任命、变更应报中国兽医药品监察所和省级兽药监察机构备案。
厂区四周不应有影响生物制品质量的污染源;企业生产环境应干净,其地面、路面、空气、场地、水质等应符合要求。
生产、仓储、行政、生活和关心区的总体布局应合理,不得相互阻碍。
生产区域的布局要顺应工艺流程,削减生产流程的迂回、来回,人流、物流应分开,走向应合理。
同一厂房内不同生产区域之间的生产操作应不相互阻碍。
干净区内不同操作间之间相互联系应符合工艺需要,必要时要有防止穿插污染的措施。
兽药gmp验收流程

兽药gmp验收流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!兽药gmp验收流程兽药GMP验收流程包括以下关键步骤:一、准备阶段1.1 制定验收计划:根据企业规模和生产线数量,制定验收计划,确定验收时间、地点、人员等。
兽药生产企业申请GMP验收的基本程序

兽药生产企业申请GMP验收的基本程序1、企业填写GMP验收申请书(各省药政管理部门有样表)一式三份。
2、企业填写完应填报内容后,送至当地(省)药政主管部门签署(建议)验收意见(并盖章)。
<在此之前,为慎重起见,企业最好事先邀请有关(GMP验收)专家到现场进行指导> 3、企业再将申请书送至当地(省)兽药监察部门,由其出具将要验收车间(企业)所生产品种的检验报告<同时送去样品,一个品种三个批次>4、企业将填写完整的申请书(一式两份)及相关的GMP申请书附件内容<附后>,一并送至农业部药政处,正式申请验收.注:1、农业部同意安排验收后,一般会提前一个月通知当地药政(或企业)具体验收时间。
2、如果验收的车间(企业)有空气净化级别要求,则农业部药政处将在正式验收前,通知企业联系指定的部门到现场进行测试<测试合格才安排正式验收,否则,不予验收>3、GMP申请书附件内容<装订成册,加封面为好>:(1)《兽药生产许可证》、《营业执照》(复印件;新开办企业除外);(2)兽药生产和质量管理自查情况(包括企业概况、GMP实施情况信培训情况等;新开办企业除外);(3)兽药生产企业(车间)的负责人、检验人员文化程度登记表、技术人员比例情况表;(4)兽药生产企业(车间)的组织机构图(包括各组织部门的功能及相互关系,部门负责人)(5)兽药生产企业(车间)生产的所有剂型和品种表,并附产品法定文件(如批准文号批件等;新建企业申报拟生产的所有剂型和品种表);(6)兽药生产企业(车间)的环境条件、仓储及总平面布置图;(7)兽药生产车间概况及工艺布局平面图(包括更衣室、洗手间、人流和物流通道、气闸等,并注明空气洁净度等级);(8)农业部指定的空气净化监测单位出具的检验报告书;(9)所生产剂型或品种工艺流程图,并注明主要生产过程控制要点;(10)兽药生产企业(车间)的关键工序、主要设备的配置、验证情况和检验仪器、仪表的配置、校验情况;(11)兽药生产企业(车间)当年生产产品的主要销售地区、单位记录(新开办企业除外);(12)兽药生产企业(车间)生产管理、质量管理的现行文件目录。
中华人民共和国农业部公告 第2262号

中华人民共和国农业部公告第2262号根据《兽药管理条例》和《兽药生产质量管理规范》有关规定,我部组织修订了《兽药生产质量管理规范检查验收办法》(附后)。
现予公布,自公布之日起施行。
特此公告。
农业部2015年5月25日兽药生产质量管理规范检查验收办法第一章总则第一条为规范兽药生产质量管理规范(以下简称“兽药GMP”)检查验收活动,根据《兽药管理条例》和《兽药生产质量管理规范》的规定,制定本办法。
第二条农业部负责制定兽药GMP及其检查验收评定标准,负责全国兽药GMP检查验收工作的指导和监督,具体工作由农业部兽药GMP工作委员会办公室承担。
省级人民政府兽医主管部门负责本辖区兽药GMP检查验收申报资料的受理和审查、组织现场检查验收、省级兽药GMP检查员培训和管理及企业兽药GMP日常监管工作。
第二章申报与审查第三条新建、复验、原址改扩建、异地扩建和迁址重建企业应当提出兽药GMP检查验收申请。
复验企业应当在《兽药生产许可证》有效期届满6个月前提交申请。
第四条申请验收企业应当填报《兽药GMP检查验收申请表》(表1),并按以下要求报送申报资料(电子文档,但《兽药GMP检查验收申请表》及第4、5、8、14目资料还需提供书面材料)。
新建企业须提供第1至第13目资料;原址改扩建、复验、异地扩建和迁址重建企业须提供第1目至第17目资料,迁址重建企业还须提供迁址后试生产产品的第12、13目资料;中药提取企业须提供第18目资料。
1.企业概况;2.企业组织机构图(须注明各部门名称、负责人、职能及相互关系);- 1 -3.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;4.企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所(含检验动物房)平面布置图及仪器设备布置图;5.生产车间(含生产动物房)概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,人流、物流流向及空气洁净级别);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;6.生产的关键工序、主要设备、制水系统、空气净化系统及产品工艺验证情况;7.检验用计量器具(包括仪器仪表、量具、衡器等)校验情况;8.申请验收前6个月内由空气净化检测资质单位出具的洁净室(区)检测报告;9.生产设备设施、检验仪器设备目录(需注明规格、型号、主要技术参数);10.所有兽药GMP文件目录、具体内容及与文件相对应的空白记录、凭证样张;11.兽药GMP运行情况报告;12.(拟)生产兽药类别、剂型及产品目录(每条生产线应当至少选择具有剂型代表性的2个品种作为试生产产品;少于2个品种或者属于特殊产品及原料药品的,可选择1个品种试生产,每个品种至少试生产3批);13.试生产兽药国家标准产品的工艺流程图、主要过程控制点和控制项目;14.《兽药生产许可证》和法定代表人授权书;15.企业自查情况和GMP实施情况;16.企业近3年产品质量情况,包括被抽检产品的品种与批次,不合格产品的品种与批次,被列为重点监控企业的情况或接受行政处罚的情况,以及整改实施情况与整改结果;17.已获批准生产的产品目录和产品生产、质量管理文件目录(包括产品批准文号批件、质量标准目录等);所生产品种的工艺流程图、主要过程控制点和控制项目;18.中药提取工艺方法和与提取工艺相应的厂房设施清单及各类文件、标准和操作规程。
兽药gmp验收标准

兽药gmp验收标准在兽药生产行业,GMP(Good Manufacturing Practice)验收标准是非常重要的。
GMP是指一套确保生产过程符合质量标准的规范,它涵盖了从原材料采购到生产加工再到最终产品出厂的全过程管理。
因此,兽药生产企业必须严格按照GMP验收标准进行生产,以确保产品质量和安全性。
首先,兽药生产企业在进行GMP验收时,需要对生产设施进行全面检查。
生产设施应当符合相关的卫生、安全、环保标准,并且要保持良好的清洁和消毒状态。
此外,生产设施还应当具备良好的通风、照明和排水系统,以确保生产环境的卫生和安全。
其次,原材料的采购和使用也是GMP验收的重点内容。
兽药生产企业必须确保所采购的原材料符合国家相关标准,且具有合法的采购渠道和证明文件。
在使用原材料时,企业必须按照标准操作程序进行验收、储存和使用,以确保原材料的质量和安全性。
另外,生产工艺和生产操作也是GMP验收的核心内容。
生产企业必须建立健全的生产工艺流程和操作规程,确保生产过程的合理性和可行性。
同时,企业还必须对生产操作人员进行培训和考核,确保他们具备必要的操作技能和知识,从而保证生产过程的安全和稳定。
此外,产品质量控制和质量管理也是GMP验收的重要环节。
企业必须建立完善的质量控制体系,对产品的各个环节进行严格监控和检测,确保产品质量符合相关标准。
同时,企业还必须建立质量档案,对产品的生产过程和质量信息进行记录和归档,以备查验。
最后,GMP验收还包括对产品的最终检验和出厂检验。
企业必须对产品进行全面的最终检验,确保产品符合相关标准和规定。
同时,企业还必须对产品进行出厂检验,确保产品的包装、标识和质量符合相关要求,从而确保产品的安全性和合法性。
总之,兽药GMP验收标准是保障兽药生产质量和安全的重要手段,企业必须严格按照相关标准进行生产,确保产品的质量和安全性。
只有这样,才能赢得消费者和监管部门的信任和认可,从而在市场竞争中立于不败之地。
兽药生产质量管理规范检查验收制度

兽药生产质量管理规范检查验收制度1.引言兽药生产质量管理是保证兽药质量安全的关键环节。
为了确保兽药生产过程中的合规性和标准化,制定兽药生产质量管理规范检查验收制度具有重要意义。
本文档旨在介绍兽药生产质量管理规范的检查验收流程及具体要求。
2.检查验收机构兽药生产质量管理规范检查验收机构负责对兽药生产企业进行质量管理规范的检查和验收工作。
该机构由相关监管部门指定,具备兽药生产质量管理规范专业知识和丰富的实践经验。
3.检查验收要求3.1 设施设备检查兽药生产企业的设施设备是生产质量的基础保障。
检查人员将对以下设施设备进行检查验收:•生产车间:包括空气洁净度、温湿度控制、通风系统等。
•药品存放区域:检查药品存放条件、防潮措施、防火设施等。
•实验室设备:检查实验室设备的齐全性、准确性和可靠性。
•仓库管理:检查仓库的货物储存方法、防潮、防火等。
3.2 原料检查兽药生产所使用的原料质量直接影响产品的品质。
检查人员将对兽药生产企业的原料进行检查验收:•原料供应链:检查原料采购渠道和采购合同记录。
•原料质量检测:核查原料质量检测报告和记录。
•原料存放管理:核查原料的存放条件和防潮、防火等措施。
3.3 生产过程检查生产过程是兽药生产质量管理的重要环节。
检查人员将对兽药生产过程进行检查验收:•生产记录:核查生产记录的准确性和完整性。
•清洁卫生管理:检查生产车间的卫生状况和清洁管理措施。
•批生产记录:检查批生产记录的填写是否规范、完整。
•关键工序的检查:针对关键工序进行抽查,确保操作规范和合规性。
3.4 产品检查产品质量是兽药生产质量管理的最终目标。
检查人员将对兽药产品进行检查验收:•产品质量检测:对产品质量进行抽样检测,包括药品含量、纯度等。
•产品标签标识:核查产品标签是否准确、完整,是否包含必要的信息。
•包装质量:检查产品包装的完好性和印刷质量。
•质量记录:核查产品质量记录和追溯系统的完整性和规范性。
4.检查验收流程兽药生产质量管理规范的检查验收流程如下:1.通知:检查机构提前通知被检查企业,并约定检查时间和地点。
兽药经营质量管理规范现场检查验收方案

兽药经营质量管理规范现场检查验收方案一、目的和背景兽药经营质量管理规范(Good Manufacturing Practice,简称GMP)是为了确保兽药生产企业在生产过程中符合质量管理要求,保证兽药的合理安全使用而制定的一套标准和规范。
本方案旨在通过现场检查和验收,评估兽药企业是否符合GMP的相关要求。
二、检查和验收范围1.企业的生产和包装车间,包括设备、工艺布局、环境控制、物料存储等。
2.质量管理体系,包括品质保证、质量控制、原辅材料管理等。
三、检查和验收内容1.生产和包装车间检查检查工作人员应对生产和包装车间的工艺流程、设备使用和维护、环境控制、物料储存等方面进行验证和确认。
2.质量管理体系检查检查工作人员应查阅企业的GMP文件,对品质保证、质量控制和原辅材料管理等方面进行验证和确认。
3.文件管理和记录检查四、检查和验收流程1.制定检查计划根据企业申请和相关文件,制定检查计划,明确检查的范围和内容,确保检查的全面性和系统性。
2.检查准备检查工作人员应提前获取企业的相关文件、记录和报告,并对其进行初步审核,了解企业的基本情况和GMP的实施情况。
3.现场检查根据检查计划,检查工作人员前往企业进行现场检查,对生产和包装车间、质量管理体系和文件管理和记录进行全面检查。
4.检查记录和整理检查工作人员应对检查过程中的重要发现、问题和意见进行详细记录,并整理成检查报告。
5.评估和验收根据检查报告,评估企业是否符合GMP的要求,并根据评估结果做出相应的验收决定。
五、检查和验收依据本方案的检查和验收依据主要有以下文件和标准:1.国家药品监督管理局《兽药生产质量管理规范》。
2.国家药品监督管理局《兽药生产质量管理规范检查评价指导原则》。
3.国家药品监督管理局相关文件和指南。
六、检查和验收结果及处理方式1.合格:企业符合GMP的相关要求,允许其继续经营兽药业务。
2.不合格:企业未能符合GMP的相关要求,需整改不符合项,并重新申请现场检查和验收。
兽药GMP验收准备要点

4、软件检查
各类制度、标准、规程、记录分类整理,合 理装订编号,便于查找。 软件可准备2-3套,报农业部的申报材料可 准备一套。 除陪同人员外,可增加软件编制人员在软件 检查现场。应对规程、标准、记录的分类、 编号、内容十分熟悉。
28
5、人员考核
分为二个部分: 1、车间、质检、仓库等的现场考核。 2、集中考核。
10
3、核实软件及记录 重点检查各类制度、规程、标准项目内容 是否符合要求,核对各项记录、凭证,是否 与制度规定一致。
11
4、人员考核 对企业负责人、企业中层技术和管理人员、 关键岗位(如质检、称量、配液、混合、灌装、 分装、仓库、制水、空调等)的操作人员进行 法规、管理知识和操作技能等方面的考核。根 据考核结果和现场操作综合判定人员整体素质 状况。
18
三、验收注意事项
1、接待安排 2、首次会议 3、现场检查 4、软件检查 5、人员考核 6、末次会议
19
1、接待安排
接送:守时安全 住宿:安静清洁 吃饭:卫生随意 参观:因地制宜 作息:保证休息
20
2、首次会议
会议室:横幅 座位 席卡 汇报材料: 投影:简洁提纲式、照片、工艺图 文字材料:(讲20分钟)至少六份 1、基本情况 企业名称、成立时间、地 址;GMP建设时间、完成时间、新(改) 建、厂区总面积、其中车间、质检、仓库 面积、总投入;报验几条生产线。
16
(2)企业对检查报告、缺陷项目表进行确认; (3)双方在检查报告、缺陷项目表上签字; (4)缺陷项目表、检查报告和评定标准打分表 一式两份报农业部,交省兽药管理部门一份。
(5) 检查组长讲话,企业负责人讲话,观察员 讲话。
(6) 合影留念(做广告也要用)。
兽药GMP检查验收评定标准

兽药GMP检查验收评定标准(生物制品)
一、兽药GMP检查验收评定标准说明
(一)本标准根据《兽药生产质量管理规范》(以下简称兽药GMP)及其附录制定。
(二)兽药GMP检查验收项目共224项,其中关键项目(条款号前加“*”)25项,一般项目199项。
检查项目分布状况(关键项/检查项):机构与人员3/14;厂房与设施7/62;设备1/22;物料5/25;卫生0/16;验证1/14;文件1/14;生产管理2/20;质量管理3/21;产品销售与收回1/6;投诉与不良反应报告0/4;自检1/6。
(三)在组织兽药GMP检查验收时,须根据申请验收的范围,按照兽药GMP检查验收项目确定相应的检查项目,并进行全面检查和评定。
(四)现场检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
(五)在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查验收组应调查取证并详细记录。
(六)结果评定1.未发现严重缺陷,且一般缺陷≤20%的,现场做出“推荐”结论。
2.发现严重缺陷或一般缺陷>20%的,现场做出“不推荐”结论。
兽药gmp验收

兽药gmp验收关于兽药GMP验收的重要性和流程。
引言:兽药作为保障动物健康和安全的重要工具,在动物饲养和养殖中扮演着至关重要的角色。
然而,由于兽药对动物和人类健康均具有潜在的风险,因此兽药的生产和销售必须符合严格的质量控制标准。
其中,兽药GMP验收作为兽药行业的质量保证措施之一,是确保兽药产品安全和有效性的重要步骤。
一、兽药GMP验收的重要性兽药GMP(Good Manufacturing Practice)验收是指对兽药生产企业进行的全面考核,以确保其兽药生产过程符合相关法规和标准。
兽药GMP验收对于保障兽药的质量和安全至关重要,具有以下几个重要性:1. 提高产品质量:通过对生产企业的全面考核,能够确保企业在生产过程中遵循正确的操作规程和标准,从而提高兽药产品的质量。
2. 保障动物安全:兽药作为直接应用于动物体内的产品,其质量和安全性对动物的健康至关重要。
兽药GMP验收能够确保兽药产品符合相关法规和标准,减少动物因使用劣质兽药而引起的健康风险。
3. 保护人类健康:兽药在动物体内使用后,可能通过动物产品(如肉类和乳制品)的食用途径影响到人类健康。
兽药GMP验收能够确保兽药产品的安全性,减少因人类摄入兽药残留物而引起的潜在健康风险。
4. 促进行业健康发展:通过对兽药生产企业的全面考核,可以规范行业的生产和销售行为,以提高整个兽药行业的整体质量水平,促进行业的健康发展。
二、兽药GMP验收的流程兽药GMP验收主要包括申请阶段、准备阶段、实施阶段和评估阶段。
1. 申请阶段:企业向相关管理部门递交兽药GMP验收申请,申请材料需包括生产设备、工艺流程、质量标准、人员配备等信息。
2. 准备阶段:企业根据相关要求进行准备,包括建立GMP管理体系,制定操作规程、培训员工、配备必要的设备和仪器等。
3. 实施阶段:相关管理部门对企业进行现场检查,包括对生产场所、设备、工艺流程、质量控制等方面的考核。
4. 评估阶段:根据实施阶段的检查结果,评估企业是否符合相关法规和标准。
兽药GMP检查验收评定标准

兽药GMP检查验收评定标准兽药GMP检查验收评定标准一、兽药GMP检查验收评定规则1、根据《兽药生产质量管理规范》(以下简称兽药GMP)及其附录,制定兽药GMP检查验收评定标准。
2、兽药GMP检查验收项目共220项,其中关键项目(条款号前加“*”)47项,一般项目173项。
检查项目分布状况(关键项/检查项):机构与人员3/15;厂房与设施10/55;设备5/22;物料8/23;卫生0/19;验证3/10;文件1/11;生产管理12/35;质量管理5/17;产品销售与收回0/5;投诉与不良反应报告0/3;自检0/3。
3、在组织兽药GMP验收检查时,须以申请检查范围,按照兽药GMP检查验收项目,确定相应的检查范围和内容,其中条款前加“#”的为静态检查时不进行评定的条款。
4、现场检查时,应对所列项目及其涵盖内容进行全面检查,并逐项作出评定。
评定结果分为“N”、“Yˉ”和“Y”三档,凡属完整、齐全的项目,应判定为“Y”;凡属项目内容基本完整、齐全,但尚不够完善的项目,应判定为“Yˉ”;判定某项基本符合要求(如打分应在75分以上)的,打“Y”;判定某项存在一定缺陷(如打分应在75-50分之间)的,打“Yˉ”;判定某项缺陷严重(如打分应在50分以下)的,打“N”。
汇总时按照3个“Yˉ”相当于1个“N”和2个“Y”的原则核定。
通过百分率计算来评定是否符合GMP。
关键项目不合格的则称为严重缺陷;一般项目不合格的则称为一般缺陷。
一般缺陷项目或检查中发现的其它问题严重影响兽药质量则视同为严重缺陷,检察员对此应调查取证,详细记录。
5、非洁净区生产环境要求及卫生等参照洁净区管理标准。
6、静态检查验收应在完成主要生产设备、灭菌设备、工艺用水设施等性能确认试验验证及产品工艺验证等工作的基础上进行。
37、结果评定4二、兽药GMP检查验收项目5678910111213141516171819202122232425262728293031323334353637384041424344454647484950。
兽药GMP认证—认证主要程序(兽药管理课件)
江苏省农业由 相应的机构发布公告。
兽药管理
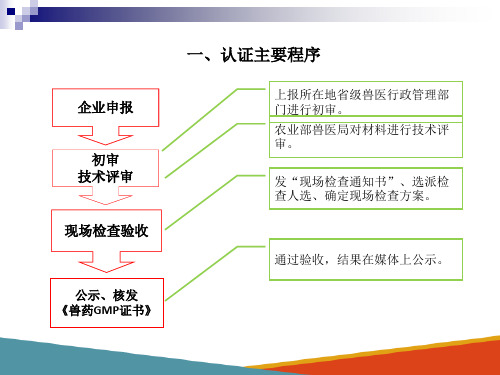
一、认证主要程序
企业申报
初审 技术评审
现场检查验收
公示、核发 《兽药GMP证书》
上报所在地省级兽医行政管理部 门进行初审。 农业部兽医局对材料进行技术评 审。
发“现场检查通知书”、选派检 查人选、确定现场检查方案。
通过验收,结果在媒体上公示。
2015年10月12日 第12批兽药企业GMP检查验收情况公示 根据《兽药生产质量管理规范》的规定,依照《兽药生产质量管理规范 检查验收办法》,省农委派出的专家组对苏州科牧动物药品有限公司等4家 企业实施GMP的情况进行现场检查验收。现将检查情况在江苏动物卫生监督 网上予以公示,公示时间为2015年10月12日至2015年10月19日,请将意见 和建议反馈给江苏省动物卫生监督所。
兽药gmp验收流程

兽药gmp验收流程英文回答:GMP (Good Manufacturing Practice) is a set of guidelines and regulations that ensure the quality and safety of pharmaceutical products, including animal medicines. GMP encompasses various aspects of the manufacturing process, from the sourcing of raw materials to the final packaging and distribution of the product. The GMP inspection and acceptance process for animal medicines involves several steps to verify compliance with these guidelines.Firstly, the manufacturer must establish and maintain a comprehensive Quality Management System (QMS) that covers all aspects of the manufacturing process. This includes documentation of procedures, specifications, and records to ensure traceability and accountability. The QMS should also include regular training programs for employees to ensure their understanding and adherence to GMP requirements.Secondly, the manufacturing facilities and equipment must meet specific GMP standards. This includes having a suitable and controlled environment to prevent contamination, proper storage conditions for raw materials and finished products, and validated manufacturing processes that consistently produce products of the desired quality. Regular maintenance and calibration of equipment are also essential to ensure accuracy and reliability.Thirdly, the raw materials used in the production of animal medicines must be sourced from approved suppliers and undergo thorough testing and qualification. This includes testing for identity, purity, potency, and any potential contaminants. The manufacturer should also have a robust system in place to monitor and control the quality of incoming materials, including regular audits of suppliers.Once the manufacturing process is complete, thefinished products must undergo rigorous quality control testing to ensure they meet the required specifications.This includes testing for potency, purity, stability, and any potential contaminants. Samples of the finished products should be retained for future reference and traceability.In addition to the above steps, GMP also requires the implementation of a robust system for handling deviations, complaints, and recalls. This includes investigating and documenting any deviations from established procedures, implementing corrective and preventive actions, and maintaining records of all incidents and actions taken.Overall, the GMP inspection and acceptance process for animal medicines involves a comprehensive evaluation of the manufacturing facilities, equipment, processes, and quality control systems. It aims to ensure that animal medicines are produced consistently and meet the required standards of quality, safety, and efficacy.中文回答:兽药GMP(良好生产规范)是一套确保兽药产品质量和安全的指导方针和规定。
兽药GMP检查验收评定标准

兽药GMP检查验收评定标准一、兽药GMP检查验收评定规则1、根据《兽药生产质量管理规范》(以下简称兽药GMP)及其附录,制定兽药GMP检查验收评定标准。
2、兽药GMP检查验收项目共220项,其中关键项目(条款号前加“*”)47项,一般项目173项。
检查项目分布状况(关键项/检查项):机构与人员3/15;厂房与设施10/55;设备5/22;物料8/23;卫生0/19;验证3/10;文件1/11;生产管理12/35;质量管理5/17;产品销售与收回0/5;投诉与不良反应报告0/3;自检0/3。
3、在组织兽药GMP验收检查时,须以申请检查范围,按照兽药GMP检查验收项目,确定相应的检查范围和内容,其中条款前加“#”的为静态检查时不进行评定的条款。
4、现场检查时,应对所列项目及其涵盖内容进行全面检查,并逐项作出评定。
评定结果分为“N”、“Yˉ”和“Y”三档,凡属完整、齐全的项目,应判定为“Y”;凡属项目内容基本完整、齐全,但尚不够完善的项目,应判定为“Yˉ”;判定某项基本符合要求(如打分应在75分以上)的,打“Y”;判定某项存在一定缺陷(如打分应在75-50分之间)的,打“Yˉ”;判定某项缺陷严重(如打分应在50分以下)的,打“N”。
汇总时按照3个“Yˉ”相当于1个“N”和2个“Y”的原则核定。
通过百分率计算来评定是否符合GMP。
关键项目不合格的则称为严重缺陷;一般项目不合格的则称为一般缺陷。
一般缺陷项目或检查中发现的其它问题严重影响兽药质量则视同为严重缺陷,检察员对此应调查取证,详细记录。
5、非洁净区生产环境要求及卫生等参照洁净区管理标准。
6、静态检查验收应在完成主要生产设备、灭菌设备、工艺用水设施等性能确认试验验证及产品工艺验证等工作的基础上进行。
7、结果评定二、兽药GMP检查验收项目综合评定结果:涉及总条款条,其中涉及一般条款条,结果属于“Y”条,属于“Yˉ” 条,属于“N” 条,符合率为 %。
涉及关键条款条,结果属于“Y”条,属于“Yˉ” 条,属于“N” 条;符合率为 %。
兽药gmp验收指南

兽药gmp验收指南英文回答:GMP Acceptance Guidelines for Veterinary Medicinal Products.The GMP Acceptance Guidelines for Veterinary Medicinal Products are a set of requirements that must be met by manufacturers of veterinary medicinal products in order to ensure the quality and safety of their products. The guidelines cover all aspects of the manufacturing process, from the sourcing of raw materials to the distribution of finished products.The guidelines are based on the principles of Good Manufacturing Practice (GMP), which are a set of quality management practices that are designed to ensure that products are consistently produced and controlled to the highest standards of quality. The GMP Acceptance Guidelines for Veterinary Medicinal Products have been adapted to thespecific requirements of the veterinary pharmaceutical industry and include additional requirements that are necessary to ensure the safety of veterinary medicinal products.The guidelines are divided into four main sections:Part I: General Requirements.Part II: Premises and Equipment.Part III: Production.Part IV: Quality Control.Part I: General Requirements covers the overall requirements that apply to all manufacturers of veterinary medicinal products. These requirements include the need to have a quality management system in place, to have trained and qualified personnel, and to have adequate facilities and equipment.Part II: Premises and Equipment covers the requirements for the premises and equipment that are used in the manufacture of veterinary medicinal products. These requirements include the need to have clean and well-maintained premises, to have equipment that is suitable for the purpose for which it is intended, and to have adequate storage facilities.Part III: Production covers the requirements for the production of veterinary medicinal products. These requirements include the need to follow written procedures, to use appropriate quality control measures, and to have a system in place to prevent contamination.Part IV: Quality Control covers the requirements for the quality control of veterinary medicinal products. These requirements include the need to have a quality controlunit that is independent of the production unit, to conduct appropriate tests on raw materials and finished products, and to have a system in place to investigate and resolve complaints.The GMP Acceptance Guidelines for Veterinary Medicinal Products are essential for ensuring the quality and safety of veterinary medicinal products. By following these guidelines, manufacturers can help to ensure that their products are effective, safe, and of high quality.中文回答:兽药GMP验收指南。
兽药GMP检查验收项

生产管理
应制定工艺查证制度并组织实施。 应有防止物料及制品所产生的气体、蒸汽、 喷雾物或生物体等引起交叉污染的措施。 直接接触制品的包装材料、设备和其他物品 应按规定清洗、干燥、灭菌,对灭菌物品应 规定使用时限。 每一生产操作间或生产用设备、容器应有所 生产的制品或物料的名称、批号、数量等状 态标志。
验证
关键设备的验证应全面、合理。 应根据验证方案进行验证。 影响制品质量的主要因素发生变化或生产一 定周期后应进行再验证。 验证工作完成后应写出验证报告,由验证工 作负责人审核、批准。 验证文件归档应符合要求。
文件
应有完整的生产管理、质量管理文件和各类 管理制度、记录。 生产管理文件应包括生产工艺规程、岗位操 作法或标准操作规程、批生产记录等。 生产工艺规程内容应符合要求。 岗位操作法内容应符合要求。 标准操作规程内容应符合要求。 设计的批生产记录内容应符合要求。
生产管理
生产前应确认无上次生产遗留物。 不同品种的抗原(半成品)制备如用同一生 产线,其生产操作不得同时进行,应在一种 制品制备后,进行有效的清洁、消毒,并进 行验证。 有数条包装线同时包装时,应采取隔离或其 他有效防止混淆的设施。 生产过程中应按照工艺、质量控制要点进行 质量检测,并填写记录。
质量管理
质量管理部门应建立制品批检验记录制度, 批检验记录应符合要求。 质量管理部门应负责建立制品质量档案,质 量档案内容应符合要求。 质量管理部门应履行制订企业质量责任制和 质量管理及检验人员职责的职责。 质量管理部门应履行组织自检工作的职责。
质量管理
质量管理部门应履行审核验证方案的职责。 质量管理部门应履行制修订物料、半成品和 成品的内控标准和检验操作规程的职责。 质量管理部门应负责制定取样和留样观察制 度,内容应符合要求。 质量管理部门应负责制订检验用设施、设备、 仪器、试剂、试液、标准品(或对照品)、 滴定液、培养基、实验动物、消毒剂的使用 及管理办法。
兽药GMP检查验收评定标准课件

看图纸、看现场。 1301 生产区是否有与生产规模相适应的面积和空间;是否便于 生产操作和安置设备。
厂房和设施应有足够空间,以便于生产操作及设备和物料 的有序放置。 1302 中药材的筛选、粉碎、蒸、炒、炙、煅和中药材、中药饮 片的提取、浓缩等厂房和有关设施是否与其生产规模相适应, 是否有良好的通风、除尘、除烟、降温及防止污染和交叉污染 等设施。
的交界处。 1203 洁净室(区)内是否使用无脱落物、易清洗、易消毒的卫生 工具,其清洗、存放地点是否对产品和生产环境造成污染,并
限定使用区域。 指清洁工具。洗存可分开,也可在一个房间。
1204 净选药材的厂房是否设拣选工作台,工作台表面是否平整、 不易产生脱落物。
检查净选药材的工作台。
1205 直接入药的净药材和干膏的配料、粉碎、混合、过筛等生 产操作的厂房是否达到门窗密闭,并有除尘、排湿、排风、降 温等设施。
看现场。没有电梯的不涉及。
1101 厂房及仓储区是否有防止昆虫、鼠类和其他动物进入的设 施。
1. 应有防止昆虫和其他动物进入的设施。 2. 有相应的书面规程。 1102 企业是否具有有关管理部门核发的消防安全合格证。 看消防合格证。 1201 非洁净厂房地面、天棚、墙壁等内表面是否平整、清洁、 无污迹、易清洁。 看现场。 1202 洁净室(区)内表面是否平整光滑、耐冲击、无裂缝、接口 严密、无颗粒物脱落,并能耐受清洗和消毒;洁净室(区)的墙壁 与地面的交界处是否成弧形或采取其他措施。 看现场。接口处打胶要严密,弧形是指洁净区墙壁与地面
0602 从事原料药生产的人员是否接受原料药生产特定操作的 有关知识培训。
兽药生产质量管理规范检查验收办法(农业部公告第496号)

【发布单位】农业部【发布文号】农业部公告第496号【发布日期】2005-04-27【生效日期】2005-06-01【失效日期】【所属类别】政策参考【文件来源】农业部兽药生产质量管理规范检查验收办法(农业部公告第496号)第一章总则第一条第一条为规范兽药GMP检查验收活动,根据《兽药管理条例》和《兽药生产质量管理规范》(以下简称兽药GMP)的规定,制定本办法。
第二条第二条农业部负责全国兽药GMP管理工作和国际兽药贸易中GMP互认工作。
省级兽医行政管理部门负责本辖区兽药GMP培训、技术指导、监督检查和管理工作。
第三条第三条农业部兽药GMP工作委员会办公室(以下简称兽药GMP办公室)负责组织兽药GMP申报资料的受理和审查、现场检查验收、日常管理和农业部交办的有关具体工作。
第二章申报与审查第四条第四条新建(含已获得兽药生产许可证的企业拟新增产品剂型的)或改扩建的兽药GMP企业,应当提出兽药GMP检查验收申请。
第五条第五条申请兽药GMP检查验收的企业应当填报《兽药GMP检查验收申请表》(见附录1),并按以下要求向兽药GMP办公室报送书面及电子文档的申报资料各一份(其中电子文档应填齐生产和检验管理文件的全部内容):(一)新建企业1.企业概况;2.拟生产兽药类别、剂型及产品目录;3.企业组织机构图(须注明各部门名称、负责人、职能及相互关系);4.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;5.企业周边环境图;总平面布置图;仓储平面布置图;质量检验场所平面布置图及仪器设备布置图;6.生产车间概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,人流、物流流向及空气洁净度级别);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;7.拟生产兽药产品的工艺流程图、主要过程控制点和控制项目及产品的生产、质量管理文件目录;8.生产的关键工序、主要设备、制水系统、空气净化系统、检验仪器设备及产品工艺验证报告;9.检验用仪器仪表、量具、衡器校验情况报告;10.农业部认可实验室出具的洁净室检测报告书;11.其他兽药GMP管理文件目录及与文件相对应的记录、凭证样张;12.生产设备设施、检验仪器设备目录(需注明规格、型号、主要技术参数);13.兽药GMP运行情况报告;14. 试产兽药国家标准产品的批生产、批检验记录复印件(每条生产线应选择具有剂型代表性的2--4个品种,每个品种至少3个批次的记录;少于2个品种或者属于特殊产品及原料药品的,应提供所生产品种的记录)。
兽药gmp检查验收评定标准

兽药gmp检查验收评定标准兽药GMP检查验收评定标准。
兽药GMP检查验收评定标准是指对兽药生产企业进行GMP检查和验收评定时所遵循的标准和规定。
兽药GMP检查验收评定标准的制定旨在保障兽药生产质量和安全,提高兽药生产企业的管理水平和生产工艺,促进兽药行业的健康发展。
一、兽药GMP检查验收评定标准的内容。
1.生产场所和设施的要求。
兽药GMP检查验收评定标准对生产场所和设施提出了严格要求,包括场地选择、建筑和构筑物、环境控制、清洁和卫生、设施设备等方面的规定。
2.人员管理和培训。
兽药GMP检查验收评定标准对生产企业的人员管理和培训提出了要求,包括人员资格、岗位职责、培训计划和记录等内容。
3.质量管理体系。
兽药GMP检查验收评定标准要求生产企业建立健全的质量管理体系,包括质量方针和目标、质量手册、程序文件、记录文件等内容。
4.原辅料的采购和控制。
兽药GMP检查验收评定标准对原辅料的采购和控制提出了具体要求,包括供应商评估、采购程序、接收检验、原辅料贮存等方面的规定。
5.生产过程的控制。
兽药GMP检查验收评定标准要求生产企业对生产过程进行严格控制,包括工艺验证、生产记录、变更控制、清洁验证等内容。
6.产品质量的控制。
兽药GMP检查验收评定标准对产品质量的控制提出了具体要求,包括质量特性、质量标准、检验方法、样品管理等方面的规定。
7.不合格品的处理。
兽药GMP检查验收评定标准要求生产企业建立不合格品处理程序,包括不合格品的评估、处理、记录和报告等内容。
二、兽药GMP检查验收评定标准的重要性。
兽药GMP检查验收评定标准的制定和执行对于提高兽药生产企业的管理水平、规范生产行为、保障产品质量和安全具有重要意义。
只有严格执行兽药GMP检查验收评定标准,才能有效地防止兽药生产企业出现质量安全事故,保障兽药产品的质量和安全,增强消费者对兽药产品的信心。
三、兽药GMP检查验收评定标准的实施。
为了确保兽药GMP检查验收评定标准的有效实施,相关部门应加强对兽药生产企业的监督检查,及时发现和纠正存在的问题和缺陷。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
兽药GMP 验收程序及注意事项1、首次会议参会人员:检查组全体人员,观察员,被检查企业负责人、与检查范围有关的企业中层技术和管理人员。
检查组长主持会议。
会议流程:1)检查组长介绍检查组成员,宣读检查范围、检查路线、日程安排、工作纪律;2)企业负责人介绍参加会议的企业人员,汇报GMp 筹备、建设情况,确定联络人。
2、现场检查检查路线:厂区周边环境和厂区环境——生产车间——辅助设施——仓库——质检室。
检查重点:按照检查要点,重点查看现场环境、布局和卫生状况;设施配置、运行状况;人员操作熟练规范程度;核实批生产、批检验、批包装纪律及物料检验等各项纪律在案的真实性、准确性;物料流转制度执行情况等。
3、核实软件及记录重点检查各类制度、规程、标准项目内容是否符合要求,核对各项记录、凭证,是否与制度规定一致。
4、人员考核对企业负责人、企业中层技术和管理人员、关键岗位(如质检、称量、配液、混合、灌装、分装、仓库、制水、空调等)的操作人员进行法规、管理知识和操作技能等方面的考核。
根据考核结果和现场操作综合判定人员整体素质状况。
5、组织评议结合实际,对照“标准”,逐条做出综合评价,并形成检查报告、缺陷项目表。
一个条款的结果判定:Y 基本符合要求(75 分以上);Y- 存在一定缺陷(50-75 分);N 严重缺陷(50 分一下)。
通过要求:关键项N 为0一般项化药N《=22%中药N《=25%折算:1、只计算一般项的缺陷。
2、三个丫-折成一个N。
3、将一般项的N和丫-折算成N,以N数除以一般项检查条款数,即为不符合率。
4、用100%减不符合率为得分。
6、末次会议参会人员为首次会议人员。
征得检查组同意后,也可企业全体人员参加。
工作流程:1)交换意见。
检查组长宣读检查报告,缺陷项内容。
必要时,其他检查人员进行补充。
检查组应针对缺陷项目表,提出具体的和尽可能详细的整改内容,并告知报告基本要求;企业就检查报告及缺陷项目内容提出交换意见。
2)企业对检查报告、缺陷项目表进行确认;3)双方在检查报告、缺陷项目表上签字;4)缺陷项目表、检查报告和评定标准打分表一式两份报农业部,交省兽药管理部门一份。
5)检查组长讲话,企业负责人讲话,观察员讲话。
6)合影留念(做广告也要用)检查结束后,组长将检查报告、缺陷项目表、现场检查方案、企业有关信息(厂名和地址)中英文名称等材料一并上报农业部。
验收注意事项1、接待安排接送:守时安全住宿:安静清洁吃饭:卫生随意参观:因地制宜作息:保证休息2、首次会议会议室:横幅、座位、席卡汇报材料:投影:简洁提纲式、照片、工艺图文字材料:(讲20分钟)至少六份1)基本情况:企业名称、成立时间、地址;GMP建设时间、完成时间、新(改)建、厂区总面积、其中车间、质检、仓库面积、总投入;报验几条生产线。
2)GMP 建设所做的主要工作工艺布局、设备选型、软件编制、人员培训3)试运行及自检试运行情况。
兽药生产全过程质量控制措施和质量保证能力。
降低人为差错、防止交叉□ □ n n n n13检污染、质量体系运行。
附:工艺图、组织结构图、人员花名册。
办公用品:笔记本、铅笔、橡皮、计算器、一台打印机(检查纸、墨)。
3、现场检查陪同人员:2-4 人,负责人生产、质检。
有净化的考虑分批。
陪同人员示范、引导。
回答问题不抢、不等、不估计。
检查流程:内外环境、车间、辅助设施、仓库、质检。
粉剂车间流程:容器具、洁具、洗衣、生产流程:原辅料入口、暂存、称量、混合、待检、内包、外包、包材入口、产品出口。
操作人员:检查时应全部在岗。
检查时正常工作,按要求回答问题。
特别注意规定、操作、回答问题的一致。
按规定进出车间。
一班人员两条线的,分别检查。
应熟练掌握相关规程、制度、纪律要求并按之操作。
标识标志:功能间、管道、设备、物料标识。
仓库分区:检定标志、清洁状态。
规程纪律:每个岗位有相关规程(有效版本)、纪录、清场合格证。
不缺、不重、不串,记录及时。
生产指令与实际生产相符。
检查的几个关键点:1)操作规范、熟练,符合规定。
操作人员熟悉相关规程。
2)标签领用记录、标签柜、标签销毁及退回及相关规定。
3)有控温控湿要求功能间的温湿度计、温湿度记录及生产时是否在规定范围4)QA 检查及记录。
装量差异、清洁等。
5)相关设备、仪表经过检定。
6)状态标志、功能间标识、管道内容物标识、设备卡符合规定。
传递物料有状态标识。
7)车间环境、设备的清洁。
是否使用过。
8)参观工作服、帽、鞋等准备,专柜存放。
要求专家按规定更衣、洗手。
4、软件检查各类制度、标准、规程、记录分类整理,合理装订编号,便于查找。
软件可准备2-3 套,报农业部的身边材料可准备一套。
除陪同人员外,可增加软件编制人员再软件检查现场。
应对规程、标准、记录的分类、编号、内容十分熟悉。
5、人员考核分两部分:1)车间、质检、仓库等的现场考核。
2)集中考核。
现场考核重点:与本岗位相关的制度、规程、记录、应知应会。
与生产实践直接相关的问题。
集中考核:法律、法规、管理文件规定。
兽药GMP 相关知识。
企业各类管理制度规定。
操作规程、标准及验证。
检查中发现的问题。
中层以上管理人员以制度、规定、法律法规、GMP 为主,一般人员以操作为主。
一般制定人回答,回答不完整可补充。
6、末次会议检查组长主持会议。
对检查组的检查结论和指出的缺陷有异议的应现场提出。
无异议的可简单表示同意即可。
可准备通过验收横幅,签字时悬挂可准备现场拍照,签字时及签字后企业负责人准备简单发言。
兽药GMP 验收程序验收时间:一般两天验收程序:第一阶段首次会议,双方见面检查组组长主持,介绍检查组成员;宣读检查纪律,确认检查范围、介绍检查要求和注意事项;(注意检查组人员的分工,并安排联络员.)公司介绍主要管理人员,简要汇报兽药GMP 实施情况;第四阶段1、检查全部的文件;2、与公司有关人员座谈,进行人员考核;第五阶段检查组综合评定,撰写检查报告;末次会议检查组宣读检查报告及结论;(公司负责人要表态)迎接验收有关注意事项一、预验收1、省畜牧办组织专家进行预验收;2、严格按照农业部的标准、程序进行;3、省检查组提出整改意见;(检查缺陷项目表)4、企业全部整改完毕后,由市畜牧局报省,省畜牧办审核后报农业部兽医局;注意:需要换证的要换生产许可证二、上报材料按照农业部第267 号公告要求的内容:1、书面材料、电子文档各 1 份;2、兽药GMP 检查验收申请表三份;3、兽药GMP 检查验收初审表三份;三、做好有关准备工作1、加强组织协调,搞好人员分工,全体人员进入状态;2、搞好厂区环境卫生、准备欢迎横幅;3、人员服装整洁;4、准备好接待车辆;5、选好宾馆;(环境好、卫生、安全、服务好)四、食宿安排1、住宿:组长安排一个套间,其他专家每人安排一个标准间;房间要有鲜花、水果等,开通电话;企业安排一个房间做接待,负责联络;入住前把专家、企业负责人、观察员住的房间号和电话印好放到房间;2、就餐:环境较好、卫生;有地方特色,不重复;减少陪同人员、就餐时间尽量短;五、首次会议(汇报情况)1、准备好会议室(大小适中):欢迎横幅--- 汇报材料、打分表;笔记本、笔、铅笔、计算器等文具;水果、茶水、矿泉水等;汇报:(1)多媒体、手提电脑;(2)时间:15 分钟;(3 )材料内容:要有厂区平面图、车间平面图、主要生产设备、化验仪器的照片、人员名单和企业机构设置图;会议室门口列队欢迎专家;六、现场检查1、厂区门口列队欢迎;2、一位熟悉生产的管理人员进行全程陪同;3、每个车间(化验室、仓库)有一人陪同、介绍并做好记录,陪同人员一定不要太多;4、进车间严格按要求去做,但要灵活处理(注意工作服、鞋套);5、动态验收正常运转,静态验收每个岗位都要有操作工人在岗;6、安排专人搞好服务(提包、打伞、矿泉水);七、审查文件材料1、材料尽可能齐全并分好类;2、有几个专家找几个联络员(每组最好有两个人),要认真负责;3、好改的马上改;没有的材料立即找或现场补;八、人员考核1、抽到的人员要全部到位;2、不要怯场、按平时掌握的说;3、不懂不要说;不明白可以立即问、别人也可以补充;4、给经理提问的问题主要是有关兽药法规和兽药的基本知识;关键岗位必考;5、现场检查和文件审查过程中发现有问题的地方还要提问;(关键是平时做好培训工作)九、末次会议1、准备好打印机并调试好;2、横幅、胸花、照相机;3、宣布验收结果(中层以上的人员参加并做好记录);3、企业表态、致谢;4、双方签字;十、其它注意事项1、安排专家适当休息、劳逸结合;2、注意搞好衔接(车辆、现场检查);3、注意态度问题,虚心接受专家意见;中华人民共和国农业部公告第1427 号为进一步规范兽药GMF检查验收工作,根据《兽药管理条例》和《兽药生产质量管理规范》(以下简称兽药GMP,我部组织修订了《兽药生产质量管理规范检查验收办法》,现予公布,自2010年9 月1 日起施行。
农业部二O—O年七月二十三日兽药生产质量管理规范检查验收办法第一章总则第一条为规范兽药GMF检查验收活动,根据《兽药管理条例》和《兽药生产质量管理规范》(简称“兽药GMP )的规定,制定本办法。
第二条农业部主管全国兽药GMP佥查验收工作。
农业部兽药GMPL作委员会办公室(简称“兽药GMP、公室”)承担兽药GM呻报资料的受理和审查、组织现场检查验收、兽药GMF检查员培训与管理及农业部交办的其他工作。
第三条省级人民政府兽医主管部门负责本辖区兽药GMP佥查验收申报资料审核及企业兽药GMF日常监管工作。
第二章申报与审查第四条新建、改扩建和复验企业应当提出兽药GM脸查验收申请。
复验应当在《兽药GMF证书》有效期满6个月前提交申请。
第五条申请验收企业应当填报《兽药GM脸查验收申请表》(表1),并按以下要求报送书面及电子文档的申报资料各一份(电子文档应当包含以下所有资料;书面材料仅需提供《兽药GMF检查验收申请表》及以下第4、5、8、12 目资料)。
(一)新建企业1.企业概况。
2.企业组织机构图(须注明各部门名称、负责人、职能及相互关系)。
3.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表。
4.企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所(含检验动物房)平面布置图及仪器设备布置图。
5.生产车间(含生产动物房)概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,人流、物流流向及空气洁净级别);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图。
6.生产的关键工序、主要设备、制水系统、空气净化系统及产品工艺验证情况。
