苯环上亲电取代反应的定位规律共19页
苯环上亲电取代反应的定位规律
定位规律的理论解释
H 是交替极化, 是交替极化,即使甲基的邻位和对位上 H C H 电子云密度增加的更多些, 电子云密度增加的更多些,量子化学计 甲苯中各碳上电子云密度分布如图。 算,甲苯中各碳上电子云密度分布如图。 O 甲苯中各碳上电子云密度分布如图 O 所以亲电试剂主要进攻邻位和对位。 所以亲电试剂主要进攻邻位和对位。 从反应历程和σ 络合物的稳定性看: 从反应历程和σ-络合物的稳定性看: O H H H 慢 δ E E E +E
一、定位规律
由此可以看出,当芳环上已有取代基时,新引入基团是否容易, 由此可以看出,当芳环上已有取代基时,新引入基团是否容易, 进入哪个位置,主要由芳环原来取代基的性质所决定。 进入哪个位置,主要由芳环原来取代基的性质所决定。我们把 芳环上原来的取代基叫做定位基 定位基。 芳环上原来的取代基叫做定位基。而把定位基支配新引入基团 进入芳环的位置和定位能力的大小称为定位规律或定位效应 定位规律或定位效应。 进入芳环的位置和定位能力的大小称为定位规律或定位效应。 第一类定位基称为邻 对位定位基, 第一类定位基称为邻、对位定位基,它使新引入的基团主要进入 定位基的邻、对位。除卤素之外,它们都是供电子基, 定位基的邻、对位。除卤素之外,它们都是供电子基,使芳环 上电子云密度增加,活化芳环,亲电取代活性大于苯。 上电子云密度增加,活化芳环,亲电取代活性大于苯。它们定 位能力强弱的次序为: >-OH> 位能力强弱的次序为:-O->-N(CH3)2>-NH2>- > >-NHCOCH3>-R>- >-OCOCH3>- 6H5>-F> >-C -OCH3>- >- > >-Br>- -Cl>- >- >- >-I 可以看出,这些基团与芳环相连的原子(除 和 外 都有未共用 可以看出,这些基团与芳环相连的原子 除R和Ph外)都有未共用 电子对,可以芳环发生P- 超共轭,使芳环上电子云密度增加。 电子对,可以芳环发生 -π超共轭,使芳环上电子云密度增加。
苯环亲电取代反应的定位规律和理论解释

苯环亲电取代反应的定位规律和理论解释
苯环亲电取代反应是一种常见的有机化学反应,它指的是苯环上的一个电子富位碳原子被其他物质的电子富位原子所取代的反应。
这种反应可以通过电离平衡和等温线来解释。
苯环亲电取代反应的定位规律是,取代反应的定位总是优先发生在苯环上最容易被取代的位置。
在二甲苯和苯乙烯这类苯环中,电子富位碳原子多半是取代反应的首选目标;而在苯并环烷和苯并三唑这类苯环中,取代反应更多地会发生在含氧原子的位置。
苯环亲电取代反应的理论解释可以通过极化和电离平衡来进行。
极化是指分子内部电荷分布的不均匀现象,它会导致分子内部电子密度的不均匀分布,从而使得某些原子或基团更容易被
取代。
电离平衡则是指反应中电子富余和电子缺乏的均衡状态,它决定了反应的方向和速率。
苯环亲电取代反应的定位规律可以通过电离平衡来解释。
由于苯环上某些原子的电离能更高,因此它们更容易被取代。
而由于苯环上某些原子的电离能更低,因此它们更难被取代。
这就是为什么苯环亲电取代反应的定位总是优先发生在苯环上最容易被取代的位置的原因。
通过对苯环亲电取代反应的定位规律和理论解释的研究,我们可以更好地理解和掌握这种常见的有机化学反应,并运用到实际应用中。
4-3 芳香烃 定位规则

7 6
1、8位,2、7位,3、6位, 4、5位,9、10位等同
蒽、菲比苯活泼,可生取代、氧化、还原等反应,试剂 主要进攻9,10位
O
Na2Cr2O7, 25 %H2SO4 100 0C 99%
O2 , V2O5 91%
O
9,10-蒽醌
Na2Cr2O7, 25 %H2SO4 100 0C
O O
9,10-菲醌
6 个π 电子 n=1 10 个π 电子 n=2
其他不含苯环,π电子数为4n+2的环状多烯烃Байду номын сангаас具有芳性, 我们称它们为非苯系芳烃。
2 单环化合物芳香性的判别
三元环
无芳香性
无芳香性
+ +
有芳香性
四元环
CH3 ++ CH3 CH3 CH3
无芳香性
有芳香性
五元环
环戊二烯负离子
H H
Na N2
苯
Na
H
H
NO2 70%
一、两类定位基
由此可见,当一取代苯(C6H5G)通过亲电取代反应引入 第二个取代基时,它所进入的位置,受第一个取代基G的
指令,由G决定第二个取代基进入的位置。
G―基团可分为两类: 1.第一类定位基(即邻对位定位基)
―O-、 ―N(CH3)2 > ―NH2 > ―OH > ―OCH3 >
π 电子 =10, HH n =2
但由于轮内氢原子间的斥力大,使环发生扭转, 不能共平面,故无芳香性
(2) [14] 轮烯
π 电子 =14, H H H H n =3
但由于轮内氢原子间的斥力大,使环发生扭转, 不能共平面,故无芳香性
(3)[18] 轮烯
苯环上亲电取代反应的定位规律

之阳早格格创做苯环上亲电与代反应的定位程序基础观念:定位基:正在举止亲电与代反当令,苯环上本有与代基,不但是效率着苯环的与代反应活性,共时决断着第二个与代基加进苯环的位子,即决断与代反应的位子.本有与代基称干定位基.一、二类定位基正在一元与代苯的亲电与代反应中,新加进的与代基不妨与代定位基的邻、间、对于位上的氢本子,死成三种同构体.如果定位基不效率,死成的产品是三种同构体的混同物,其中邻位与代物 40%(2/5)、间位与代物 40%(2/5)战对于位与代物 20%(1/5).本量上惟有一种或者二种主要产品.比方百般一元与代苯举止硝化反应,得到下表所示的截止:排正在苯前里的与代硝化产品主假如邻位战对于位与代物,除卤苯中,其余与代苯硝化速率皆比苯快;排正在苯后里与代硝化产品主假如间位与代物,硝化速率比苯缓得多.归纳洪量真验截止,根据苯环上的与代基(定位基)正在亲电与代反应中的定位效率,普遍分为二类:第一类定位基又称邻对于位定位基:—O-,—N(CH3)2,—NH2,—OH,—OCH3,—NHCOCH3,—OCOCH3,—F,—Cl,—Br,—I,—R,—C6H5等.第二类定位基又称间位定位基:—N+(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—N+H3等.二类定位基的结构特性:第一类定位基与苯环间接贯串的本子上惟有单键,且普遍有孤对于电子或者是背离子;第二类定位基与苯环间接贯串的本子上有沉键,且沉键的另一端是电背性大的元素或者戴正电荷.二类定位基中每个与代基的定位本领分歧,其强度序次近似如上列程序.苯环上亲电与代反应的定位程序二、定位程序的电子表里阐明正在一与代苯中,由于与代基的电子效力沿着苯环共轭链传播,正在环上出现了电子云稀度较大战较小的接替分集局里,果而环上诸位子举止亲电与代反应的易易程度分歧,出现二种定位效率.也不妨从一与代苯举止亲电与代反应死成的中间体σ络合物的相对于宁静性的角度举止观察,当亲电试剂 E+打击一与代时,死成三苯σ络合物:Z 分歧,死成的三种σ 络合物碳正离子的宁静性分歧,出现了二种定位效率.1.第一类定位基对于苯环的效率及其定位效力以甲基、氨基战卤素本子为例证明.甲基正在甲苯中,甲基的碳为 sp3纯化,苯环碳为 sp2纯化,sp2纯化碳的电背性比 sp3纯化碳的大,果此,甲基表示出供电子的诱导效力(A).其余,甲基 C—H σ 键的轨讲与苯环的π 轨讲产死σ—π 超共轭体系(B).供电诱导效力战超共轭效力的截止,苯环上电子稀度减少,更加邻、对于位减少得更多.果此,甲苯举止亲电与代反应比苯简单,而且主要爆收正在邻、对于位上.亲电试剂 E+打击甲基的邻、间、对于位子,产死三种σ 络合物中间体,三种σ 络合物碳正离子的宁静性可用共振纯化体表示:打击邻位:打击对于位:打击间位:亲电试剂打击苯死成的σ 络合物的碳正离子也不妨用共振纯化体表示:苯环上亲电与代反应的定位程序隐然,共振纯化体Ⅰ战Ⅱ比Ⅲ宁静,果为Ⅰc战Ⅱb的正电荷正在有供电基的叔碳上,较分别.而正在Ⅲ中,正电荷皆分集正在仲碳上,不宁静.所以甲基是邻对于位定位基.共振纯化体Ⅲ比Ⅳ宁静,虽然正在Ⅲ战Ⅳ中的共振极限结构式皆是正电荷分集正在仲碳上,但是甲基有供电性,使Ⅲ的正电荷不妨分别正在环战甲基上,果此,甲基活化了苯环. 从共轭效力战共振论二种瞅面分解、观察甲苯的亲电与代反应,皆得出甲基是第一类定位基、有活化苯环效率的普遍论断.氨基正在苯胺中,N—C 键为极性键,N有吸电子的诱导效力(C),使环上电子稀度缩小;但是共时氮本子有孤对于电子,与苯环产死供电的p—π共轭效力(D),使环上电子稀度减少:正在那里,共轭效力大于诱导效力,所以概括效力使是环上电子稀度减少,更加是氨基的邻位战对于位减少更多.果此,苯胺举止亲电与代反应比苯更简单,且主要爆收正在氨基的邻、对于位上.观察死成的中间体σ络合物碳正离子的宁静性也得到共样的论断.(3)卤本子卤本子比较特殊,是一类使苯环钝化的第一类定位基.以氯苯为例,正在氯苯中氯本子是强吸支电子基,强的吸电子诱导效力使苯环电子稀度落矮,比苯易举止亲电与代反应.但是氯本子与苯环又有强的供电的 p-π 共轭效力(C的2p轨讲与 Cl 的 3p 轨讲产死 p-π 共轭体系,不 C 的 2p 轨讲与 N 的 2p 轨讲产死的 p-π 共轭体系灵验),使氯本子邻、对于位上电子稀度缩小得已几,果此表示出邻对于位定位基的本量.2.第二类定位基对于苯环的效率及其定位效力以硝基苯为例证明.正在硝基苯中,硝基存留着吸电子的诱导效力(E),还存留着吸电子的π-π共轭效力(F):那二种电子效力皆使苯环上电子稀度落矮,亲电与代反应比苯易;共轭效力的截止,使硝基的间位上电子稀度落矮得少些,表示出间位定位基的效率.亲电试剂打击硝基苯时,产死邻、间、对于三种σ 络合物中间体:打击邻位:打击对于位:打击间位:共振纯化体Ⅲ比Ⅰ战Ⅱ宁静,果为正在Ⅰ战Ⅱ中有正电荷分集正在有强吸电子基团的叔碳上的极限结构式Ⅰc战Ⅱb不宁静.果此,硝基是第二类定位基,与代反应爆收正在间位上.共振纯化体Ⅲ有强吸电子基团,与相映的苯的共振纯化体相比,Ⅲ不宁静.果此,硝基表示出钝化苯环的效率.苯环上亲电与代反应的定位程序三、对于邻、对于位产品比率的效率果素1.空间效力环上有邻对于位定位基存留时,死成邻位战对于位产品的比率与定位基战新加进基团的体积有闭系.那二种基大众积越大,空间位阻越大,邻位产品越少.烷基苯的硝化反应随着烷基的体积删大,邻位硝基苯的比率缩小.烷基硝化反当令同构体分集苯环上本有定位基稳定,随着加进基大众积删大,邻位同构体的比率也缩小.如表所示.甲基苯烷基化时同构分集2.反应温度的效率反应温度分歧,邻、对于位同构体的比率分歧.如3.催化剂的效率利用新颖催化技能,不妨统造与代基的定位效率,如使用有择型催化效率的分子筛催化乙苯的乙基化,不妨得到下采用性的对于二乙苯.工业上便是用分子筛催化合成对于二乙苯.后者催化脱氢,得到接联散苯乙烯的共散单体对于二乙烯基苯:甲苯与丙烯烷基化反应,使用分歧孔径的分子筛催化剂,分别得到间甲基同丙苯战对于甲基同丙基苯.已应用于工业死产拆置上.间甲基同丙基苯战对于甲基同丙基苯分别是造备间甲基苯酚战对于甲基苯酚的本料.四、二元与代苯的定位程序当苯环上有二个与代基时,第三个与代基加进苯环的位子,主要由本去的二个与代基的本量决断.大概上道,苯环上有二个与代基时,有三种定位情况.苯环上亲电与代反应的定位程序1.苯环上本有二个与代基对于引进第三个与代基的定位效率普遍,第三个与代基加进苯环的位子便由它们共共定位.比方,下列化合物引进第三个与代基时,第三个与代基主要加进箭头所示的位子:2.苯环上本有二个与代基,对于加进第三个与代基的定位效率纷歧致,二个与代基属共一类定位基,那时第三个与代基加进苯环的位子主要由定位效率强的与代基所决断.如果二个与代基定位效率强度较小时,得到二个定位基定位效率的混同物:3.苯环上本有二个与代基对于引进第三个与代基的定位效率纷歧致,二个与代基分歧类定位基时,那时第三个与代基加进苯环的位子主要由第一类定位基定位:正在思量第三个与代基加进苯环的位子时,除思量本有二个与代基的定位效率中,还该当思量空间位阻,如3-乙酰氨基苯甲酸的 2 位与代产品很少.五、定位程序正在有机合成上的应用应用定位程序不妨采用可止的合成门路,得到较下的产率战预防搀纯的分散历程.比方由甲苯合成间硝基苯甲酸,应采与先氧化后硝化的步调:由对于硝基甲苯合成2,4-二硝基苯甲酸,其合成门路犹如下二条:隐然第一条合成门路较合理,不妨简化分散步调,共时硝化一步反应较第二条门路的硝化一步反应易举止,果为二个与代基(—CH3,—NO2)的定位效率是普遍的. 定位程序只适用于能源教统造的反应.比方,叔丁苯正在FeCl3 催化下,与叔丁基氯反应死成对于二叔丁基苯:苯环上亲电与代反应的定位程序那与定位程序普遍,但是用过量的AlCl3为催化剂,则死成1,3,5-三叔丁基苯:那是果为正在过量强酸效率下,烷基化战脱烷基化完毕仄稳,邻、对于位烷基化快,脱烷基化也简单;间位烷基化缓,脱烷基化也较易,末尾形成热力教上宁静的均三叔丁基苯.六、闭键词汇定位基,定位程序,二类定位基,定位程序的本量阐明,二元与代苯的定位程序,定位程序的应用。
4.5 苯环上亲电取代反应定位规则解析

且为邻位或对位。
OCH3
OCH3
HNO3
85% 4-硝基-1-萘甲醚
NO2
NHCOCH3 HNO3, CH3COOH
NO2 NHCOCH3
47-49%
N-乙酰基-1-硝基-2-萘胺
原取代基为致钝基,亲电试剂进异环α-位。
NO2
NO2
HNO3 H2SO4
SO3H HNO3 H2SO4
+
NO2 45%
SbF6-
Ph
Ph
mp=221℃
4.10 芳烃的工业来源
1、从煤焦油中分离 2、从石油裂解产物中分离 3、芳构化
4.10.1 从煤焦油中分离:
•轻油<170℃: 苯、甲苯、二甲苯
H3C
CH3
•酚油170-210℃:异丙苯、均四甲苯
H3C
CH3
•萘油210-230℃:萘、甲基萘、二甲基萘等
CH3
CH3
..
H
E
Z E H
Z
Z E H
Z E H
不稳定极限结构
Z
Z
EH Z
EH
EH
不稳定极限结构
Z
Z
H
H
H
E
E
E
进攻邻位
NO2 E
H
NO2
NO2
E+ 进攻对位
EH
进攻间位
NO2
H E
NO2 E H
NO2
NO2 E
H
NO2 E H
极不稳定极限结构
NO2
NO2
EH
EH
EH
极不稳定极限结构
NO2
H E
NO2
H E
苯环上亲电取代反应的定位规律

苯环上亲电取代反应的定位规律苯环上亲电取代反应的定位规律基本概念:定位基:在进行亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第二个取代基进入苯环的位置,即决定取代反应的位置。
原有取代基称做定位基。
一、两类定位基在一元取代苯的亲电取代反应中,新进入的取代基可以取代定位基的邻、间、对位上的氢原子,生成三种异构体。
如果定位基没有影响,生成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。
实际上只有一种或二种主要产物。
例如各种一元取代苯进行硝化反应,得到下表所示的结果:1.第一类定位基对苯环的影响及其定位效应以甲基、氨基和卤素原子为例说明。
甲基在甲苯中,甲基的碳为sp3杂化,苯环碳为sp2杂化,sp2杂化碳的电负性比sp3杂化碳的大,因此,甲基表现出供电子的诱导效应(A)。
另外,甲基C—H σ 键的轨道与苯环的π 轨道形成σ—π 超共轭体系(B)。
供电诱导效应和超共轭效应的结果,苯环上电子密度增加,尤其邻、对位增加得更多。
因此,甲苯进行亲电取代反应比苯容易,而且主要发生在邻、对位上。
亲电试剂E+进攻甲基的邻、间、对位置,形成三种σ 络合物中间体,三种σ 络合物碳正离子的稳定性可用共振杂化体表示:进攻邻位:进攻对位:进攻间位:亲电试剂进攻苯生成的σ 络合物的碳正离子也可以用共振杂化体表示:苯环上亲电取代反应的定位规律显然,共振杂化体Ⅰ和Ⅱ比Ⅲ稳定,因为Ⅰc和Ⅱb的正电荷在有供电基的叔碳上,较分散。
而在Ⅲ中,正电荷都分布在仲碳上,不稳定。
所以甲基是邻对位定位基。
共振杂化体Ⅲ比Ⅳ稳定,虽然在Ⅲ和Ⅳ中的共振极限结构式都是正电荷分布在仲碳上,但甲基有供电性,使Ⅲ的正电荷可以分散在环和甲基上,因此,甲基活化了苯环。
从共轭效应和共振论两种观点分析、考察甲苯的亲电取代反应,都得出甲基是第一类定位基、有活化苯环作用的一致结论。
苯及苯环上的亲电取代反应
五、定位规则在有机合成上的应用
CH3 NO2
例一:由
合成
CH3 CH3Cl AlCl3 con H2SO4 100 。 C
CH3 混酸 SO3H
CH3 NO2
SO3H
CH3 dil H2SO4 NO2
例二: 由 O2N
路线一:
O2N CH3 混酸 O2N
CH3 合成 O2N
COOH NO2
CH3 NO2
Cl2 h
CH2CH3
Br2 h
CHCH3 + Cl 56%
CH2CH2Cl 44%
CHCH3 (用NBS / CCl4亦可) Br 100%
溴代比氯代的选择性更高
注意α-H的卤代反应条件与苯环上的卤代反应条件 是不相同的,不可混淆。
四、取代苯的亲电取代反应的活性和定位规律
1、取代基定位及活化、钝化作用 *** 第一类定位基
HOOC NO2 COOH O2N
三、非苯系芳香烃
C H3 C H2C H2C C H 3 C l C HC H 3 C H3
AlCl 3
C H3 C H3
分子内烷基化
C H2C H2C H2 C C l
=
O
AlCl 3
分子内酰基化
=
O
不同点
a. 烷基化反应难停留在一取代阶段,而 酰基化反应却可以停留在一取代阶段。
C H3
CH3Cl AlCl 3 CH3Cl AlCl 3
在极性溶剂中,萘的酰基化产物以β-异构体为主;在非 极性溶剂中以α-异构体为主。
CH2COOH + ClCH2COOH FeCl3 KBr 。C 200-218
工业上用于制备α-萘乙酸(一种植物生长激素)
苯环上亲电取代反应的定位规律
A
A
1b
1c
A
A
+ E≡ + E
H
H
2
2a
A
A
+ ≡+
+
E
H
2b
A
+
+
E H
2c
A
+
HE
3
HE
3a
HE
3b
HE
3c
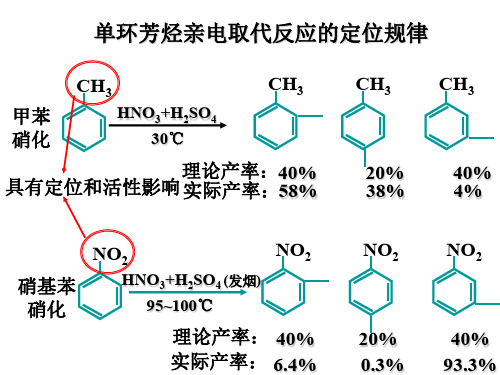
①甲苯 —CH3 供电,稳定的共振式
CH3 E
CH3 E
CH3 E
+ H≡ + H
+H
4
CH3
4a
CH3
4b
CH3
+ E≡
H
5
CH3
+E H
5a
CH3
+
E
H
5b
CH3
+
≡
+
+
HE
6
HE
单环芳烃亲电取代反应的定位规律
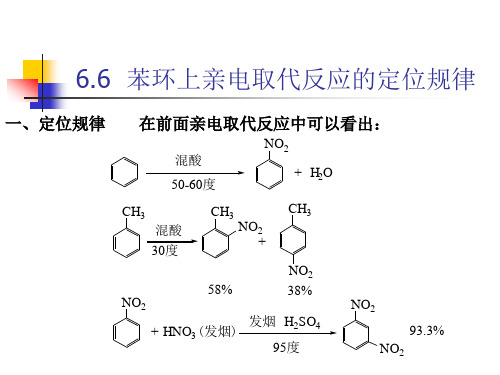
甲苯 硝化
CH3
HNO3+H2SO4 30℃
CH3
具有定位和活性影响
理论产率:40% 实际产率:58%
CH3
20% 38%
CH3
40% 4%
硝基苯 硝化
NO2
HNO3+H2SO4 (发烟) 95~100℃
NO2
理论产率: 40% 实际产率: 6.4%
NO2
20% 0.3%
12b
HE
12c
HE
12d
3.二取代苯的定位规律
OH
CH3
CHO
空间阻位
苯环上亲电取代反应的定位规律

HNO3 , H2SO4 30℃ ~60℃
NO2
•磺化 低温(80℃)与浓硫酸生成﹣萘磺酸;高温(165℃)
生成﹣萘磺酸。 ﹣萘磺酸与硫酸共热,也转变为﹣萘磺酸。
+ H 2SO4
80℃ 165℃
SO3H (>95 %)
SO3H (>85 %)
原因:磺酸基体积大,与8位氢原子间距小于其范德华半径之和
•分子式:C10H8;由两个苯环共用两个碳原子并联而成。
•结构:
0.142 0.136
0.1390.140
( 单 位n:m)
8α 7β
6β 5α
1α 2β
3β 4α
——两个苯环共平面;C—C键长介于C—C单键和C = C双键之间 (碳碳单键154pm长,双键134pm长);C—C键键长并不完全相同;
,故﹣萘磺酸稳定性小于﹣萘磺酸。
空间作用大(不稳定) H SO3H
空间作用小(稳定) H
SO3H
H
﹣萘磺酸动力学,﹣萘磺酸热力学控制。﹣萘磺酸是重要的
有机合成中间体,可转化为﹣萘酚、 2020/3/11
﹣萘胺等(合成偶氮染料13的
中间体)。
•酰基化(傅﹣克反应)
——概况 萘的酰基化反应产物与温度和溶剂的极性有关。低温和
NO2 还原
氧化
NO2 COOH COOH
2020/3/11
17
(c)还原反应
用金属钠在液氨和乙醇的混合液中还原生成1,4﹣二氢萘。产物中 的一个孤立双键不被还原。
Na , C2H5OH NH3 (液 )
催 化 加 氢 时 , 可 生 成 1,2,3,4 四 氢 化 萘 ( 又 称 萘 满 ) 或 十 氢 化 萘 (又称萘烷)。
苯环上亲电取代反应的定位规律

苯环上亲电取代反应的定位规律苯环上亲电取代反应的定位规律基本概念:定位基:在进行亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第二个取代基进入苯环的位置,即决定取代反应的位置。
原有取代基称做定位基。
一、两类定位基在一元取代苯的亲电取代反应中,新进入的取代基可以取代定位基的邻、间、对位上的氢原子,生成三种异构体。
如果定位基没有影响,生成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。
实际上只有一种或二种主要产物。
例如各种一元取代苯进行硝化反应,得到下表所示的结果:1.第一类定位基对苯环的影响及其定位效应以甲基、氨基和卤素原子为例说明。
甲基在甲苯中,甲基的碳为sp3杂化,苯环碳为sp2杂化,sp2杂化碳的电负性比sp3杂化碳的大,因此,甲基表现出供电子的诱导效应(A)。
另外,甲基C—H σ 键的轨道与苯环的π 轨道形成σ—π 超共轭体系(B)。
供电诱导效应和超共轭效应的结果,苯环上电子密度增加,尤其邻、对位增加得更多。
因此,甲苯进行亲电取代反应比苯容易,而且主要发生在邻、对位上。
亲电试剂E+进攻甲基的邻、间、对位置,形成三种σ 络合物中间体,三种σ 络合物碳正离子的稳定性可用共振杂化体表示:进攻邻位:进攻对位:进攻间位:亲电试剂进攻苯生成的σ 络合物的碳正离子也可以用共振杂化体表示:苯环上亲电取代反应的定位规律显然,共振杂化体Ⅰ和Ⅱ比Ⅲ稳定,因为Ⅰc和Ⅱb的正电荷在有供电基的叔碳上,较分散。
而在Ⅲ中,正电荷都分布在仲碳上,不稳定。
所以甲基是邻对位定位基。
共振杂化体Ⅲ比Ⅳ稳定,虽然在Ⅲ和Ⅳ中的共振极限结构式都是正电荷分布在仲碳上,但甲基有供电性,使Ⅲ的正电荷可以分散在环和甲基上,因此,甲基活化了苯环。
从共轭效应和共振论两种观点分析、考察甲苯的亲电取代反应,都得出甲基是第一类定位基、有活化苯环作用的一致结论。
苯环上亲电取代反应的定位规则及应用

苯环上亲电取代反应的定位规则及应用吕剑泓;巢志聪;蔡定建【摘要】苯作为重要的工业合成原料,由于苯环上有多个取代位置,因此对苯环进行二元取代时会产生不同的取代产物,所以通过苯环上进行取代反应定位规则的研究可以对其取代反应进行产物预测,同时苯环上的取代反应在有机合成的反应中有着重要的作用,但其合成过程中产生的副反应比较多,因而对其取代反应的定位规则的研究以及在有机合成的应用研究就显得极其重要。
%Benzenes is an important raw material in the industrial synthesis.Benzene ring has multiple substitution position, as the result, disubstituted reaction of benzene ring produces different products.The research on the positioning rules of substitution reaction on the benzene ring can project the products producing by the reaction , and it plays an important role in organic synthesis reaction as the frequent side reaction in the synthesis.【期刊名称】《广州化工》【年(卷),期】2015(000)006【总页数】3页(P10-12)【关键词】有机化学;苯的取代;定位规则【作者】吕剑泓;巢志聪;蔡定建【作者单位】江西理工大学冶金与化学工程学院,江西赣州 341000;江西理工大学冶金与化学工程学院,江西赣州 341000;江西理工大学冶金与化学工程学院,江西赣州 341000【正文语种】中文1 定位规则苯做为一种芳香烃[1],看似具有高度的不饱和性但实际上不容易进行加成反应和氧化反应,比较容易进行亲电取代反应。
苯环上亲电取代反应的定位规律

O 2 + 7O2
V2 O5 , K SO4 2 385℃~390℃
2 O
O + 4CO 2 + 4H2O
取代萘氧化时环破裂的规律: 取代基为邻对位定位基,使所在
环活化,氧化时同环破裂;取代基为间位定位基,使所在环钝化, 氧化时异环破裂。
H2 / Ni 150℃ H2 / Ni 200℃
应用:四氢化萘和十氢化萘是两种良好的高沸点溶剂。
2003年9月27日(15-16到此止) 思考题:P864:8,9
2013-6-30
作业:P866习题1的5的c,d;习题3的4,5
18
2013-6-30
10
(2)萘的性质 物理性质
萘为无色片状晶体,熔点80.2℃,沸点218℃,易升华。萘有特 殊的气味,不溶于水,溶于乙醇、乙醚及苯中。
2013-6-30
11
化学性质 ——概况 与苯相似,但芳香性比苯差,更易发生亲电取代反应。 位电子云密度比位高,亲电取代首先在位。但1与8
萘的离域能
254.98kJ•mol –1,稳定,但比两个单独苯环离域能 的总和(300kJ•mol‐1)小,故芳香性比苯差,比苯活泼。
萘衍生物的命名
与多官能团取代苯的母体优先选择次序相同。 常见官能团的优先次序为: ﹣COOH , ﹣SO3H , ﹣COOR , ﹣COX , ﹣CONH2 , ﹣CN , ﹣CHO,﹣CO﹣R,﹣OH,﹣NH2,﹣C≡C﹣, C=C ,﹣OR, ﹣X,﹣NO2。 排在前面的官能团优先选择为母体,后三个官能团以苯为母体:
原因:电子云密度较高的环,较活泼,易被氧化破裂。
苯环上取代反应的定位规则

苯环上原有的取代基对新导入取代基有影响,这种影响包括反应活性和进入位置两个方面。
通常,苯环上原有的第一取代基称为定位基,从大量实验事实的分析总结中发现,定位基的定位作用遵循一定的规律,这一规律称为苯环上亲电取代反应定位规律(又称定位规则)。
下面分别讨论定位基的类型;定位规则的理论解释;二元取代苯的定位规律;定位规律的应用。
(一)定位基的类型1.邻、对位定位基。
这类定位基的结构特征是定位基中与苯环直接相连的原子不含不饱和键(芳烃基例外),不带正电荷,且多数具有未共用电子对。
常见的邻、对位定位基及其反应活性(相对苯而言)如下:强致活基团:―NH2(―NHR,―NR2),―OH中致活基团:―OCH3(―OR),―NHCOCH3(-NHCOR)弱致活基团:―ph(―Ar),―CH3(-R)弱致钝基团:―F,―Cl,―Br,―I这类定位基多数使亲电取代反应较苯容易进行,但卤素例外。
2.间位定位基。
这类定位基的结构特征是定位基中与苯环直接相连的原子一般都含有不饱和键(-CX3例外)或带正电荷。
常见的间位定位基及其定位效应从强到弱顺序如下:―N+H3,―N+R3,―NO2,―C F3,―CCl3,―CN,―SO3H,―COH,―COR,―COOH,―COOR,―CONH2等。
这类定位基属致钝基团,通常使苯环上亲电取代反应较苯难进行,且排在越前面的定位基,定位效应越强,反应也越难进行。
(二)定位规则的理论解释苯环上的取代反应是亲电取代反应。
因此,从反应活性的角度分析,凡有助于提高苯环上电子云密度的基团,就能使苯环活化,反应活性提高;反之,凡是使环上电子云密度降低的基团,就能使苯环钝化,反应活性降低。
从反应位置的角度分析,当苯环上没有取代基时,环上六个碳原子的电子云密度是均等的;但当苯环上有取代基时,由于取代基的电子效应沿着苯环共轭体系传递。
在环上出现了出现了电子云密度的疏密交替分布现象。
第二个取代基总是进入苯环上电子云密度相对较大的部位,从而使这些碳原子上的取代物占了多数。
苯环上取代反应的定位规则

苯环上取代反应的定位规则编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(苯环上取代反应的定位规则)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为苯环上取代反应的定位规则的全部内容。
苯环上原有的取代基对新导入取代基有影响,这种影响包括反应活性和进入位置两个方面。
通常,苯环上原有的第一取代基称为定位基,从大量实验事实的分析总结中发现,定位基的定位作用遵循一定的规律,这一规律称为苯环上亲电取代反应定位规律(又称定位规则)。
下面分别讨论定位基的类型;定位规则的理论解释;二元取代苯的定位规律;定位规律的应用.(一)定位基的类型 1.邻、对位定位基。
这类定位基的结构特征是定位基中与苯环直接相连的原子不含不饱和键(芳烃基例外),不带正电荷,且多数具有未共用电子对.常见的邻、对位定位基及其反应活性(相对苯而言)如下:强致活基团:―NH2(―NHR,―NR2),―OH 中致活基团:―OCH3(―OR),―NHCOCH3(-NHCOR) 弱致活基团:―ph(―Ar),―CH3(-R)弱致钝基团:―F,―Cl,―Br,―I 这类定位基多数使亲电取代反应较苯容易进行,但卤素例外.2.间位定位基。
这类定位基的结构特征是定位基中与苯环直接相连的原子一般都含有不饱和键(-CX3例外)或带正电荷。
常见的间位定位基及其定位效应从强到弱顺序如下:―N+H3,―N+R3,―NO2,―CF3,―CCl3,―CN,―SO3H,―COH,―COR,―COOH,―COOR,―CONH2等。
这类定位基属致钝基团,通常使苯环上亲电取代反应较苯难进行,且排在越前面的定位基,定位效应越强,反应也越难进行。
4.5 苯环上亲电取代反应定位规则解析

取代苯硝化时相对速率与异构体分布
R
HNO3 H2SO4
R
R
NO2
NO2
R NO2
R=
—H
—OCH3 —NHCOCH3 —CH3 —C(CH3) 3 —CH2Cl —CL
NO2
SO3H
主要产物
8-硝基-2-萘磺酸
NO2 NO2
13%
SO3H
NO2
次要产物
4.6.2.3 加成反应
Na, 液NH3, C2H5OH
H2,Pd—C, 高温高压 or Na— Hg, C2H5OH
1,2,3,4-四氢化萘
磺化及烷基化、酰基化通常发生在β-位
CH3 96%H2SO4
90-100 0CHO3S
CH3
80%
6-甲基-2-萘磺酸
O CH3
AlCl3
O PhNO2
H3C
O
COCH2CH2COOH
60-70%
4-[2-(6-甲基萘基)]-4-氧代丁酸
4.6.2.2 萘的二元取代
原取代基为致活基:亲电试剂进同环α-位,
CH3 R
CH3
53.8
45 37.5 0
R
28.8 25 32.7 93
CH3
R
17.3 30 29.8 7
Cl E+
氯化(Cl) 硝 化(NO2) 溴 化(Br) 磺 化(SO3H)
Cl
Cl
E
E
39
55
30
70
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
—— +I增加苯环上所有碳原子的电子密度(与苯相比较),‐I效 应降低电子密度。
——共轭和超共轭效应沿苯环的共轭链只能传递到定位基的邻位 和对位,不能传递到间位碳原子上:+C效应使邻、对位电子密度增 大较多,而‐C效应使间位电子密度降低较少。
例:﹣CH3,﹣OH和﹣NO2。 ﹣CH3:+I和+C; ﹣OH:‐I和‐C+C; -NO2:﹣I和﹣C。
——羟基 +C大于‐I,净结果是苯酚中电子密度比苯大。亲电
取代反应也比苯容易
——硝基 硝基苯中硝基的间位电子密度高于邻对位,亲电试剂
E+首先进攻电子密度较高的间位,因此硝基是间位定位基。硝基的 ‐C 和 ‐I 使 硝 基 苯 中 苯 环 每 个 碳 原 子 的 电 子 密 度 都 降 低 ( 与 苯 相 比),亲电取代反应比苯困难
H
HCH
-
δ-
δ
δ
甲26苯 .06.2的 020 电子效应
..
HO
-
δ-
δ
δ-
苯酚的电子效应
O NO
δ-
δ-
硝基苯的电3 子
——甲基 邻、对位电子密度高于间位,亲电试剂E+首先进攻邻、
对位,甲基是邻对位定位基。甲基具有+I和供电子的超共轭效应+C , 使甲苯中苯环电子密度增大,亲电取代反应比苯容易
邻对位定位基 (第一类)
间位定位基 (第二类)
强烈活化:
‐O‐,‐NR2,‐NHR,‐NH2,‐OH
中等活性:
‐OR,‐NHCOR,‐OCOR
较弱活化:
‐Ph,‐R
较弱钝化:
‐F, ‐Cl, ‐Br, ‐I, ‐CH2Cl
强烈钝化:
‐+NR3 ,‐+NH3 ,‐NO2,‐CF3 , ‐CCl3
中等钝化:
•分子式:C10H8;由两个苯环共用两个碳原子并联而成。
•结构:
0.1420.136 0.1309.140
( 单n位 m) :
8α 1α
7β
2β
6β
3β
5α 4α
——两个苯环共平面;C—C键长介于C—C单键和C = C双键之间 (碳碳单键154pm长,双键134pm长);C—C键键长并不完全相同;
——1,4,5,8 位 等 同 , 称 位 , 其 取 代 物 称 取 代 物 (1- 取 代 物 ) ;
26.06.2020
NHC3OCH COOH
C3H N2O
CHO
OH
6
•补充:定位规则在有机合成中的应用
苯环上取代反应的定位规则不仅可用于解释某些现象,而且 可用于指导多官能团取代苯的合成。 例:由苯合成间硝基对氯苯磺酸
Cl
NO2
SO3H
——反应的第一步不能是硝化或磺化。因为硝基和磺基皆为间位定 位基故只能氯化。
26.06.2020
9
(2)萘的性质
•物理性质
萘为无色片状晶体,熔点80.2℃,沸点218℃,易升华。萘有特 殊的气味,不溶于水,溶于乙醇、乙醚及苯中。
26.06.2020
10
•化学性质
——概况
•与苯相似,但芳香性比苯差,更易发生亲电取代反应。
•位电子云密度比位高,亲电取代首先在位。但1与8
或4与5位相距很近,有大的取代基(如磺酸基)时在位较稳定。
(2)第二类定位基—间位定位基
—— 使 新 引 入 的 取 代 基 主 要 进 入 它 的 间 位 ( 间 位 异 构 体 大 于 40%);
——使苯环钝化。这类定位基与苯环相连接的碳原子上一般具有 重键(电负性较大)或带正电荷。
26.06.2020
2
2. 定位规律的理论解释
(1)定位基的电子效应 I效应与C效应共同作用的结果。
2,3,6,7位等同,称位,其取代物称取代物(2-取代物) 。
26.06.2020
8
•与苯相似,萘的每个碳原子各以三个键分别与其他三个原子相连;
每个碳原子的p轨道的对称轴都垂直键所在平面并相互交盖形成一 个闭合的共轭系统。
•萘的离域能 254.98kJ•mol –1,稳定,但比两个单独苯环离域能
的总和(300kJ•mol‐1)小,故芳香性比苯差,比苯活泼。源自律决定:C3HN2O
C3H(空 很间 少阻 进碍 入 S大 3 O )H
C2H5
C3H
C3H
N2O
(2)两个定位基属同一类,但对第三个取代基定位作用不一致,
主要由强定位基决定;若定位效应相近,可得混合物:
OC 3 H
COOH
N2H C3H
C3H Cl
(3)两个C定3H位基不属同N一2O 类,对第三个取代基定位作用不一致, 第三个取代基进入苯环的位置主要由第一类定位基定位:
•萘衍生物的命名
与多官能团取代苯的母体优先选择次序相同。
常见官能团的优先次序为:
﹣COOH , ﹣SO3H , ﹣COOR , ﹣COX , ﹣CONH2 , ﹣CN , ﹣CHO,﹣CO﹣R,﹣OH,﹣NH2,﹣C≡C﹣, C=C ,﹣OR, ﹣X,﹣NO2。 排在前面的官能团优先选择为母体,后三个官能团以苯为母体:
——温度和催化剂
•烷基苯磺化,升高反应温度利于提高对位取代物的比例;
•溴苯氯化,分别用氯化铝和氯化铁作催化剂,所得异构体分
别是对位较多和邻位较多。
3. 二元取代苯的定位规律
苯环上已有两个取代基时,第三个取代基进入苯环的位置,取决 于原来两个取代基的定位效应。
26.06.2020
5
(1)原有两个定位基对第三个取代基定位作用一致时,由定位规
‐CN, ‐SO3H, ‐CHO, ‐COR,‐COOH, ‐CONH2
26.06.2020
1
(1)第一类定位基—邻对位定位基
——使新引入的取代基主要进入它的邻、对位(邻位和对位异构 体之和大于60%);
——除卤素、氯甲基外,一般使苯环活化。这类定位基与苯环直 接相连接的碳原子上,一般只具有单键(有未共用电子对)或带负电 荷。
——硝基和磺基先引入哪一个呢?氯虽是邻对位定位基,但它使苯 环钝化,故硝化或磺化要比苯需要较高的反应条件。磺化反应在较 高温度(100 ℃)时以对位为主,正是需要的。若先硝化,将得到邻、 对两种产物。故应先磺化再硝化。此时,二者定位效应一致。
26.06.2020
7
15.3.6 稠环芳烃
1. 萘
(1)萘的结构
26.06.2020
4
(2)定位基的立体效应
——苯环上有邻对位定位基时,生成的邻位和对位产物之比与苯 环上定位基和引入基团的体积有关:两种基团体积越大,空间位阻 越大,邻位产物越少。
——示例:甲基苯硝化,邻位产物占58.5%;叔丁苯硝化,邻位 产物占15.8%;叔丁苯磺化,几乎生成100%的对位产物。
