苯环上的亲电取代反应
苯环侧链的卤代反应为亲电取代反应

苯环侧链的卤代反应为亲电取代反应。
亲电取代反应,也称为烃基取代反应,是特殊的卤化反应,它将
苯环侧链中的一个原子取代为另外一种取代物,也就是一个烃基。
它
的反应原理是基团的亲电力克服了它的稳定性,使其与共价键破坏,
使其核突去离子形成,最后形成新的稳定反应物。
在苯环侧链上进行亲电取代反应,需要一种称为分子夹具的中间体。
只有它才能将受体分子与亲电取代物接近,受体分子和取代物才
能开始反应。
在反应过程中,受体分子的苯环中的共价键被剪断,形
成了碱金属离子,因此是典型的卤化反应。
苯环侧链上夹具分子的苯
键开始破坏,给出碱金属离子,然后,反应物和碱金属开始发生反应,形成新的共价键以及氢键,形成新的反应物。
在发生苯环侧链亲电取代反应时,要避免活性化反应,也就是要
避免在反应过程中受体分子和取代物发生聚合反应。
为了避免这种情
况发生,通常会在夹具分子中加入一种化学离子,如氯离子,硫离子等,来平衡活性化反应。
总之,苯环侧链的亲电取代反应是一种典型的取代型卤化反应。
它需要一种特定的中间体分子支撑,这种中间体可以让受体分子和取
代物开始发生作用。
此外,由于活性化反应容易发生,因此还需要加
入离子,以避免活性化反应发生。
苯环上亲电取代反应机理

同学们,大家好。
今天讲的是苯环上的亲电取代反应的机理:苯环上的大π键使苯环富含π电子,因此它是一个很强的负电场,容易受到亲电试剂的进攻,发生亲电反应。
当亲电试剂靠近苯环时,苯环上的大π键和亲电试剂形成配位键,生成π-络合物,在π-络合物中,亲电试剂进一步吸引π电子,使π电子发生偏移,生成σ-络合物,σ-络合物失去氢离子,从而生成具有完整苯环的亲电取代的产物。
在这三步反应中,π-络合物的形成,大π键没有被破坏,所以会很容易进行,而由π-络合物生成σ-络合物,大π键被破坏掉,反应很难进行,所以反应比较慢,而σ-络合物又非常不稳定,很容易失去氢离子,生成稳定的具有苯环结构的取代产物,所以第三步也比较快。
因为第一步反应很快,对整个反应影响也比较小,所以苯环上的亲电取代反应机理一般简化为两步。
第一步亲电试剂靠近苯环,生成σ-络合物;σ-络合物失去氢离子,生成最终的取代产物。
第一步反应非常慢,是整个反应的决速步骤。
在决速步骤中生成的σ-络合物,实际上就是碳正离子,而且是烯丙基型碳正离子,在烯丙基型碳正离子中,存在p-π共轭效应,所以σ-络合物的共振结构可以用下面三个极限式来表示。
通过以上的学习,我们已经知道了苯环的亲电取代机理包含了两步,那么苯环的硝化反应、磺化反应、卤化反应等,这些亲电取代反应中亲电试剂是什么呢?这些亲电试剂又是如何产生的?下面让我们来一一分析。
例如硝化反应,在硝化反应中是浓硝酸和浓硫酸和苯环的作用,那它的亲电试剂是什么呢?硫酸的酸性比硝酸强,二者共处,硝酸表现出碱性,硫酸表现出酸性,硝酸中的氧用孤对电子与硫酸中的氢离子结合,结合之后的硝酸,氮氧键极性增大,更容易断裂,断裂时电子转向氧,生成一分子的水,还有一个阳离子,该阳离子叫硝酰阳离子,硝酰阳离子具有亲电性,因此,它可以和苯环发生亲电取代反应。
硝酰阳离子靠近苯环,生成σ-络合物,σ-络合物失去氢离子,生成最终取代的产物硝基苯。
所以硝化反应的亲电试剂是硝酰阳离子,硫酸的作用是帮助硝酸产生亲电离子:硝酰阳离子。
苯环上亲电取代反应的定位规律
定位规律的理论解释
H 是交替极化, 是交替极化,即使甲基的邻位和对位上 H C H 电子云密度增加的更多些, 电子云密度增加的更多些,量子化学计 甲苯中各碳上电子云密度分布如图。 算,甲苯中各碳上电子云密度分布如图。 O 甲苯中各碳上电子云密度分布如图 O 所以亲电试剂主要进攻邻位和对位。 所以亲电试剂主要进攻邻位和对位。 从反应历程和σ 络合物的稳定性看: 从反应历程和σ-络合物的稳定性看: O H H H 慢 δ E E E +E
一、定位规律
由此可以看出,当芳环上已有取代基时,新引入基团是否容易, 由此可以看出,当芳环上已有取代基时,新引入基团是否容易, 进入哪个位置,主要由芳环原来取代基的性质所决定。 进入哪个位置,主要由芳环原来取代基的性质所决定。我们把 芳环上原来的取代基叫做定位基 定位基。 芳环上原来的取代基叫做定位基。而把定位基支配新引入基团 进入芳环的位置和定位能力的大小称为定位规律或定位效应 定位规律或定位效应。 进入芳环的位置和定位能力的大小称为定位规律或定位效应。 第一类定位基称为邻 对位定位基, 第一类定位基称为邻、对位定位基,它使新引入的基团主要进入 定位基的邻、对位。除卤素之外,它们都是供电子基, 定位基的邻、对位。除卤素之外,它们都是供电子基,使芳环 上电子云密度增加,活化芳环,亲电取代活性大于苯。 上电子云密度增加,活化芳环,亲电取代活性大于苯。它们定 位能力强弱的次序为: >-OH> 位能力强弱的次序为:-O->-N(CH3)2>-NH2>- > >-NHCOCH3>-R>- >-OCOCH3>- 6H5>-F> >-C -OCH3>- >- > >-Br>- -Cl>- >- >- >-I 可以看出,这些基团与芳环相连的原子(除 和 外 都有未共用 可以看出,这些基团与芳环相连的原子 除R和Ph外)都有未共用 电子对,可以芳环发生P- 超共轭,使芳环上电子云密度增加。 电子对,可以芳环发生 -π超共轭,使芳环上电子云密度增加。
苯环上的亲电子取代反应及定位效应与反应活性正文

苯环上的亲电子取代反应及定位效应与反应活性一、苯的亲电子取代反应1.简介苯环平面的上下有π电子云①,与σ键②相比,平行重叠的π电子云结合较疏松,因此在反应中苯环可充当一个电子源,与缺电子的亲电试剂③发生反应,类似于烯烃中π键④的性质。
但是苯环中π电子又有别于烯烃,π键共振形成的大π键⑤使苯环具有特殊的稳定性,反应中总是保持苯环的结构。
苯的结构特点决定苯的化学性质,它容易发生亲电子取代反应⑥。
π键σ键电子云2.卤代⑦苯与卤素作用,在三卤化铁(FeX3)的催化下,得到卤代苯,同时放出卤化氢。
(1)与Cl2反应FeCl3+Cl2+HCl反应2FeBr3+ Br2 +HBr(3)与I2反应:碘活性不够,只有与非常活泼的芳香化合物才能发生取代反应。
目前采用氧化剂将碘氧化为碘正离子后直接引入苯环。
HNO3I+I286%)铁屑与卤素反应产生三卤化铁,起到同样的作用。
3Br2+2Fe 2FeBr3苯与氯、溴的取代反应应用十分广泛。
其公认的反应历程是首先缺电子的FeX3与卤素络合,促进卤素之间σ键的极化、异裂。
FeX3+X2X++FeX4-带正电的卤素进攻苯环的π电子。
形成苯碳正离子中间体,类似于烯烃的亲电加成,这一步是速度决定步骤+二卤代烃+X-也可失去质子,恢复苯的骨架。
苯的稳定性起了决定作用,得到取代而不是加成产物。
-H++FeX3+HX3.硝化苯与浓硝酸和浓硫酸的混合物(称混酸)反应,生成硝基苯。
浓H2SO4+HNO3(浓)(98%)+H2O50℃其反应历程如下:浓硫酸的酸性比硝酸的强,它作为酸提供质子(H+),硝酸作为碱提供氢氧根(OH-),去掉一分子水,产生硝基正离子,硝基正离子具有很强的亲电子性,与苯发生亲电子取代反应。
若采用浓硝酸,则反应速度明显减慢,这是由于浓硝酸中仅存在少量的硝基正离子。
4.磺化不同浓度的硫酸与苯反应的速度不同,浓度越高反应越快。
含三氧化硫的发烟硫酸的反+H2SO4(7%SO3(52%)+H2O磺化反应也是亲电取代反应,通常认为亲电试剂是三氧化硫。
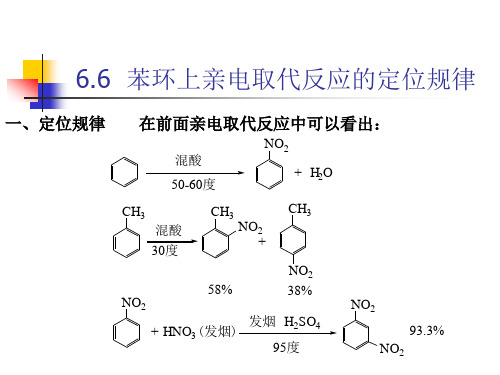
苯环上亲电取代反应的定位规律
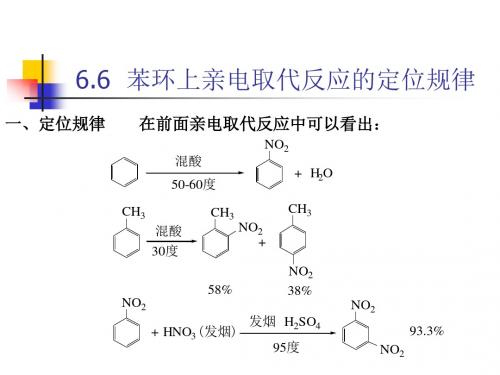
NO2 + H2O
CH3 混酸
30度
CH3
CH3
NO2
+
58% NO2
+ HNO3 (发烟)
NO2 38%
发烟 H2SO4 95度
NO2
93.3% NO2
一、定位规律
由此可以看出,当芳环上已有取代基时,新引入基团是否容易, 进入哪个位置,主要由芳环原来取代基的性质所决定。我们把 芳环上原来的取代基叫做定位基。而把定位基支配新引入基团 进入芳环的位置和定位能力的大小称为定位规律或定位效应。间对 邻Fra bibliotek反应进程
inductive effect
conjugative effect
(2) 苯酚
我们只从反应物的电子效应云解释: 诱导效应使芳环电子云密度降低,用“-I”表示。 共轭效应使芳环电子云密度增加,用“+C”表示。 O
OH O
但在苯酚中,︱+C︱>> ︱-I︱,所以总的结果
使苯环电子云密度增加。与甲苯相似。。。
使芳环上电子云密度降低,用“-I”表示。O
π 从共轭效应看,硝基有一个
4 3
键,当它
与苯环相连时,就与苯环的大键发生-
O O
π 共轭,形成
10 9
大共轭体系。在这个大共轭
体系中,由于氧的电负性较大,使共轭体系
O
中电子云向氧一边偏移,表现为吸电子性。 N O
用“-C”表示。总的结果是:诱导和共轭
NO2 0.70 0.705 0.79
0.72
O N
O
方向一致,都使苯环电子云密度降低。亲电取代比苯更难。
与硝基苯相似的还有苯磺酸、苯甲酸、苯甲腈等。
三、二取代苯的定位规律
苯环亲电取代反应的定位规律和理论解释

苯环亲电取代反应的定位规律和理论解释
苯环亲电取代反应是一种常见的有机化学反应,它指的是苯环上的一个电子富位碳原子被其他物质的电子富位原子所取代的反应。
这种反应可以通过电离平衡和等温线来解释。
苯环亲电取代反应的定位规律是,取代反应的定位总是优先发生在苯环上最容易被取代的位置。
在二甲苯和苯乙烯这类苯环中,电子富位碳原子多半是取代反应的首选目标;而在苯并环烷和苯并三唑这类苯环中,取代反应更多地会发生在含氧原子的位置。
苯环亲电取代反应的理论解释可以通过极化和电离平衡来进行。
极化是指分子内部电荷分布的不均匀现象,它会导致分子内部电子密度的不均匀分布,从而使得某些原子或基团更容易被
取代。
电离平衡则是指反应中电子富余和电子缺乏的均衡状态,它决定了反应的方向和速率。
苯环亲电取代反应的定位规律可以通过电离平衡来解释。
由于苯环上某些原子的电离能更高,因此它们更容易被取代。
而由于苯环上某些原子的电离能更低,因此它们更难被取代。
这就是为什么苯环亲电取代反应的定位总是优先发生在苯环上最容易被取代的位置的原因。
通过对苯环亲电取代反应的定位规律和理论解释的研究,我们可以更好地理解和掌握这种常见的有机化学反应,并运用到实际应用中。
苯环上的亲电取代反应

苯环上的亲电取代反应1. 概述亲电取代反应是化学中一种常见的反应类型,它可以在有机分子中引入新的官能团或取代已有的官能团。
苯环上的亲电取代反应是指在苯环上进行亲电取代反应的过程。
苯环是由6个碳原子构成的环状结构,由于苯环具有特殊的共轭性和稳定性,因此苯环上的反应需要一定的条件和催化剂。
在苯环上进行亲电取代反应的机理通常分为两种类型:亲电取代和自由基取代。
亲电取代是指通过亲电试剂与苯环上的π电子发生作用,形成共轭稳定的化合物;自由基取代则是指在自由基试剂的作用下,发生自由基取代反应。
2. 亲电取代反应的机理亲电取代反应的机理主要涉及以下步骤:2.1 亲电试剂的进攻亲电试剂(如卤代烷、羧酸酰基等)与苯环上的π电子发生亲电进攻反应,形成中间体。
这一步骤是整个反应的关键,亲电试剂的进攻位置主要受到取代基的取向效应和反应条件的影响。
2.2 中间体的稳定化形成的中间体会进行稳定化反应,主要是通过迁移质子或电子的方式使中间体更加稳定。
2.3 取代产物的生成在稳定化反应后,中间体会生成取代产物,同时释放出催化剂或其他副产物。
取代产物的结构和性质取决于亲电试剂和反应条件。
3. 亲电取代反应的条件亲电取代反应的条件包括温度、催化剂、试剂浓度等因素。
3.1 温度亲电取代反应通常在室温下进行,较高的温度可能导致副反应的发生,降低产率。
3.2 催化剂某些反应需要催化剂的存在才能进行,常用的催化剂有铝黄原、铁黄原等。
催化剂可以提高反应速率和产物选择性。
3.3 试剂浓度试剂浓度对反应速率和产率有一定影响,较高的试剂浓度可以提高反应速率和产率,但过高的浓度可能导致副反应的发生。
4. 苯环上的常见亲电取代反应4.1 卤代取代反应卤代取代反应是最常见的亲电取代反应之一。
在卤代取代反应中,卤代烷与苯环上的π电子发生反应,取代其中的氢原子形成卤代苯。
4.2 羟基取代反应羟基取代反应是在苯环上引入羟基(-OH)官能团的反应。
常见的羟基取代反应有酰基氯与苯的反应,生成苯酚(phenol)。
苯环上亲电取代反应的定位规律

HNO3 , H2SO4 30℃ ~60℃
NO2
•磺化 低温(80℃)与浓硫酸生成﹣萘磺酸;高温(165℃)
生成﹣萘磺酸。 ﹣萘磺酸与硫酸共热,也转变为﹣萘磺酸。
+ H 2SO4
80℃ 165℃
SO3H (>95 %)
SO3H (>85 %)
原因:磺酸基体积大,与8位氢原子间距小于其范德华半径之和
•分子式:C10H8;由两个苯环共用两个碳原子并联而成。
•结构:
0.142 0.136
0.1390.140
( 单 位n:m)
8α 7β
6β 5α
1α 2β
3β 4α
——两个苯环共平面;C—C键长介于C—C单键和C = C双键之间 (碳碳单键154pm长,双键134pm长);C—C键键长并不完全相同;
,故﹣萘磺酸稳定性小于﹣萘磺酸。
空间作用大(不稳定) H SO3H
空间作用小(稳定) H
SO3H
H
﹣萘磺酸动力学,﹣萘磺酸热力学控制。﹣萘磺酸是重要的
有机合成中间体,可转化为﹣萘酚、 2020/3/11
﹣萘胺等(合成偶氮染料13的
中间体)。
•酰基化(傅﹣克反应)
——概况 萘的酰基化反应产物与温度和溶剂的极性有关。低温和
NO2 还原
氧化
NO2 COOH COOH
2020/3/11
17
(c)还原反应
用金属钠在液氨和乙醇的混合液中还原生成1,4﹣二氢萘。产物中 的一个孤立双键不被还原。
Na , C2H5OH NH3 (液 )
催 化 加 氢 时 , 可 生 成 1,2,3,4 四 氢 化 萘 ( 又 称 萘 满 ) 或 十 氢 化 萘 (又称萘烷)。
苯环上亲电取代反应的定位规律

解析复杂化合物结构
对于复杂化合物,利用定位规律可以快速准确地解析其苯环结构, 提高解析效率。
验证实验结果
在化学实验中,利用定位规律可以验证实验结果是否正确,确保实 验数据的可靠性。
在反应机理研究中的应用
揭示反应机理
定位规律有助于揭示亲电取代反应的机理,了解 反应过程中电子转移和键合情况。
定位规律的重要性
01
02
03
预测反应结果
了解苯环上亲电取代反应 的定位规律,可以帮助预 测反应结果,指导合成路 径的设计。
提高产物纯度
通过控制反应条件和选择 适当的取代基,可以减少 副反应的发生,提高产物 纯度。
促进化学研究
定位规律是苯环上亲电取 代反应的重要研究内容, 有助于深入了解有机化学 反应的本质和机制。
共轭效应
总结词
共轭效应是指苯环上的π电子参与形成大π键,导致苯环上电子云分布发生变化,从 而影响取代反应的定位规律。
详细描述
当苯环上存在某些取代基时,如乙烯基、乙炔基等,它们可以与苯环形成共轭体 系,使苯环上的电子云分布发生变化。这种变化可以增强苯环对亲电试剂的活性 ,从而影响取代反应的定位。
空间效应
定位规律是亲电取代反应中,苯环上取代基的 定位效应和取代反应的取向之间的规律。
邻对位定位基:通常能增强苯环的电子云密度, 使亲电试剂更容易进攻苯环上的碳原子,如羟基 、氨基、烷氧基等。
对未来研已有取代基对亲电取代反应 的影响机制。
探索新的实验方法和技术,以 更精确地测定苯环上亲电取代 反应的动力学和热力学性质。
指导反应设计
根据定位规律,可以预测反应的可能路径和产物, 为新反应的设计提供理论支持。
苯环上的亲电取代反应

苯环上的亲电取代反应苯环上的亲电取代反应是有机化学中比较常见的一类反应。
它通常发生在苯环上的芳香性碳原子上,将亲电试剂与苯环上的氢原子置换掉,从而形成新的有机化合物。
这种反应常被用于制备苯环上的取代基,也可以用于制备其他复杂的有机化合物。
亲电取代反应中通常使用的亲电试剂包括卤化物、烷基化试剂、酰基化试剂、亚硝基化试剂等。
这些试剂可以与苯环上的氢原子发生反应,将自身的功能基固定在苯环上。
其中最常见的反应是取代反应,它指的是亲电试剂与苯环上的氢原子形成互换反应,产生取代基的过程。
在这个反应中,苯环的芳香性被打破,导致反应产物失去了一部分芳香性。
在苯环上的亲电取代反应中,通常需要加入辅助试剂来促进反应的进行。
这些辅助试剂可以帮助亲电试剂与苯环上的氢原子发生反应,并促进反应的速度和选择性。
常用的辅助试剂包括路易斯酸类催化剂、氧化剂、酸类催化剂等。
在实验室中,常用的亲电试剂包括溴化亚铁、溴化亚锡、三氟甲磺酸等。
其中溴化亚铁和溴化亚锡是常见的卤化物类试剂,它们与苯环上的氢原子发生反应,形成卤代苯基。
三氟甲磺酸是一种强烷基化试剂,它可以将甲基基固定在苯环上。
不同的亲电试剂在苯环上的取代反应中,产生的取代基种类不同。
苯环上的取代基又可以进一步反应,形成各种复合化合物。
因此,苯环上的亲电取代反应在有机合成中扮演着重要的角色,也是化学家们需要掌握的重要技术之一。
总之,苯环上的亲电取代反应是有机化学中必不可少的一环。
通过选择不同的亲电试剂和辅助试剂,可以产生不同的取代基,从而制备出各种不同的有机化合物。
在实验中,需要注意反应物的选择、反应条件的控制和安全操作,以确保反应的高效和可靠性。
苯环上亲电取代反应的定位规律

O 2 + 7O2
V2 O5 , K SO4 2 385℃~390℃
2 O
O + 4CO 2 + 4H2O
取代萘氧化时环破裂的规律: 取代基为邻对位定位基,使所在
环活化,氧化时同环破裂;取代基为间位定位基,使所在环钝化, 氧化时异环破裂。
H2 / Ni 150℃ H2 / Ni 200℃
应用:四氢化萘和十氢化萘是两种良好的高沸点溶剂。
2003年9月27日(15-16到此止) 思考题:P864:8,9
2013-6-30
作业:P866习题1的5的c,d;习题3的4,5
18
2013-6-30
10
(2)萘的性质 物理性质
萘为无色片状晶体,熔点80.2℃,沸点218℃,易升华。萘有特 殊的气味,不溶于水,溶于乙醇、乙醚及苯中。
2013-6-30
11
化学性质 ——概况 与苯相似,但芳香性比苯差,更易发生亲电取代反应。 位电子云密度比位高,亲电取代首先在位。但1与8
萘的离域能
254.98kJ•mol –1,稳定,但比两个单独苯环离域能 的总和(300kJ•mol‐1)小,故芳香性比苯差,比苯活泼。
萘衍生物的命名
与多官能团取代苯的母体优先选择次序相同。 常见官能团的优先次序为: ﹣COOH , ﹣SO3H , ﹣COOR , ﹣COX , ﹣CONH2 , ﹣CN , ﹣CHO,﹣CO﹣R,﹣OH,﹣NH2,﹣C≡C﹣, C=C ,﹣OR, ﹣X,﹣NO2。 排在前面的官能团优先选择为母体,后三个官能团以苯为母体:
原因:电子云密度较高的环,较活泼,易被氧化破裂。
(1) 苯环上的亲电取代反应

CH 3 O hv,CCl4 64% CH2Br O
+
NBr
+
NH
O
O
CH3 hv ~100%
CH2Cl
+ Cl2
32
当苯环上所连接的烷基较长时,侧链卤化仍主要发 生在α-位 56% 44%
Cl Cl2
hv
CHCH3 + Br
(2)氯代 + Cl2
AlCl3
Cl + HCl
催化剂:路易斯酸,FeCl3、AlCl3均可,使Cl2异裂为Cl+。
15
对于不同的卤素,与苯环发生取代反应的活性 顺序是:氟>氯>溴>碘。其中氟反应很猛烈;碘化 反应不但慢,且生成的碘化氢是还原剂,从而使该 反应成为可逆反应,且以逆反应为主。 (3)碘代 + I2
13
5.4芳环上的亲电取代反应:
试剂中的亲电部分从芳环上取代一个H原子:
磺化
硝化Байду номын сангаас
SO3H
NO2
R 烷基化
O
卤化
X
H
芳环上亲电取代反应的类型
C
R
酰基化
14
1. 卤代反应(在三卤化铁等催化剂的作用下,苯与卤素作用生成卤代苯)
(1) 溴代: + Br2
Fe
•Br 注意: 2 为液溴
Δ
Br
+ HBr
•催化剂实际上是FeBr3,使Br2异裂成Br+
4
5.1 芳烃的构造异构和命名
5.1.1.构造异构
苯及其同系物的通式为CnH2n-6 苯中的六个碳原子和六个氢原子分别是等同的。因此,苯 和一取代苯各只有一种;但是当苯环上的取代基含有多个碳原 子时,与脂肪烃相似,因碳链构造不同,也可以产生构造异构。 因取代基在环上的相对位次不同,异构现象较为复杂。
苯环上的亲电取代反应—卤代

• 因而使得被进攻的那个碳原子脱离了共轭体系,剩下的四个π 电子则分部在余下的五个碳原子上,因而带了一个正电荷。
• 在FeBr4-的作用下,很快使碳正离子消去一个质子,恢复了 原来的苯环。
无催化剂存在时,苯与溴或氯并不发生反 应,苯不能使溴的四氯化碳溶液褪色。在 催化剂如 FeX3 或铁粉存在下,则生成溴苯 或氯苯。催化剂的作用是使卤素变成强亲 电试剂,促进反应。
反应机理:
• 苯与 I2 的反应需要在氧化剂(如 HNO3)存在下进行,氧化剂的作用是 产生碘正离子:
注意: 反应通常用Cl2、Br2 。氟代过于剧烈, 反应难以控制 中间体碳正离子(苯鎓离子)远不及 苯环稳定,生成碳正离子(苯鎓离子 )是决定反应速率的关键步骤 卤代要加催化剂,催化剂也可用Fe
谢谢~
苯环上的亲电取代反应 ——卤代
演讲:王海涛
亲电取代反应
亲电试剂 E+进攻苯环,与苯环的π电子作用生成π络合物 ,紧接着E+从苯环π体系中获得两个电子,与苯环的一个 碳原子形成σ键,生成σ络合物(方基正离子中间体),σ 络合物内能高不稳定,sp3杂化的碳原子失去一个质子,恢 复芳香结构,形成取代产物。 • 生成σ络合物这一步是决定反应速率的与卤 素作用生成卤化苯的反应称作卤代反 应或卤化反应。
l C
Fe 或 3 Cl + 2 5 5 ~ 6 0 ℃ FeCl
+ HCl
r B
+Br 2
FeBr Fe 或 3
5 5 ~ 6 0 ℃
+ HBr
• 氯或溴本身不能与苯起取代反应,必须在Lewis酸的帮助下, 才能使氯或溴分子极化.因此,卤化的第一步是苯环形成π络 合物,在Lewis酸FeBr3帮助下,进一步生成σ络合物,苯环两 个π电子与Br+生成C-Br键。
苯环上亲电取代反应的定位规律
E
1.011
快 -H
E
06
-络合物 由 反 应 历 程 看 , - 络 合 物 越 稳 定, 反应 的活
化能越小,越容易反应。
定位规律的理 论解释
CH 当 亲 电 试 剂 进 攻 甲 苯 时 , 可 能
3 形 成 三 种 - 络 合 物 , 即
O
H
E 与 带 部 分 正 电 荷 的 碳
就
较O稳
定
,
可以看出,间位定位基(除带正电荷的-+NH3外)都是由电负性 较大的原子组成,且含有不饱和键,可以与芳环发生 - 共轭, 使芳环电子云密度降低。
二、定位规律 的理论解释
亲电取代反应的定位规 律可从反应物的电子效 应和 -络合物的稳定 性两方面去解释。
邻、对位取代基对苯环 的影响,以甲苯、苯酚 和氯苯为例。
CH 3
OH
NO2
NO2
OH
NO2COOHFra bibliotekCH 3
NH2
OH
NO2
COCH3
四、空间C效H3 应
空间效应:C又H3称空间阻碍效CH应3或空间位阻效 浓H2S应O。4 是分子中原S有O3基H 团对新引入基团产生的
一种空间阻碍作用。+例如:
室温
32%
SO3H 62%
100度
13%
79%
CH(CH 3)2 Cl
可以看出,这些基团与芳环相连的原子(除R和Ph外)都有未共用电子对,可以芳环 发生P- 超共轭,使芳环上电子云密度增加。
定位规律
第二类定位基称为间位定位基。它们使新引入基团主要进入定位 基的间位。间位定位基都是吸电子基,使芳环上电子云密度降低, 钝化芳环,亲电取代反应活性小于苯。它们定位能力强弱的次序 为: -+NH3>-NO2>-CN>-SO3H>-COOH>- CHO>-COCH3>-COOCH3>-CONH2
苯环上亲电取代反应的定位规律
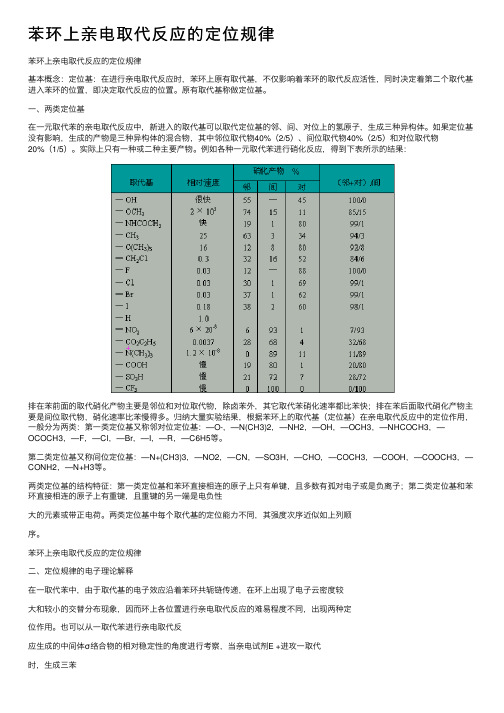
苯环上亲电取代反应的定位规律苯环上亲电取代反应的定位规律基本概念:定位基:在进⾏亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第⼆个取代基进⼊苯环的位置,即决定取代反应的位置。
原有取代基称做定位基。
⼀、两类定位基在⼀元取代苯的亲电取代反应中,新进⼊的取代基可以取代定位基的邻、间、对位上的氢原⼦,⽣成三种异构体。
如果定位基没有影响,⽣成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。
实际上只有⼀种或⼆种主要产物。
例如各种⼀元取代苯进⾏硝化反应,得到下表所⽰的结果:排在苯前⾯的取代硝化产物主要是邻位和对位取代物,除卤苯外,其它取代苯硝化速率都⽐苯快;排在苯后⾯取代硝化产物主要是间位取代物,硝化速率⽐苯慢得多。
归纳⼤量实验结果,根据苯环上的取代基(定位基)在亲电取代反应中的定位作⽤,⼀般分为两类:第⼀类定位基⼜称邻对位定位基:—O-,—N(CH3)2,—NH2,—OH,—OCH3,—NHCOCH3,—OCOCH3,—F,—Cl,—Br,—I,—R,—C6H5等。
第⼆类定位基⼜称间位定位基:—N+(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—N+H3等。
两类定位基的结构特征:第⼀类定位基和苯环直接相连的原⼦上只有单键,且多数有孤对电⼦或是负离⼦;第⼆类定位基和苯环直接相连的原⼦上有重键,且重键的另⼀端是电负性⼤的元素或带正电荷。
两类定位基中每个取代基的定位能⼒不同,其强度次序近似如上列顺序。
苯环上亲电取代反应的定位规律⼆、定位规律的电⼦理论解释在⼀取代苯中,由于取代基的电⼦效应沿着苯环共轭链传递,在环上出现了电⼦云密度较⼤和较⼩的交替分布现象,因⽽环上各位置进⾏亲电取代反应的难易程度不同,出现两种定位作⽤。
也可以从⼀取代苯进⾏亲电取代反应⽣成的中间体σ络合物的相对稳定性的⾓度进⾏考察,当亲电试剂E +进攻⼀取代时,⽣成三苯σ络合物:Z 不同,⽣成的三种σ络合物碳正离⼦的稳定性不同,出现了两种定位作⽤。
苯亲电取代反应历程

苯亲电取代反应历程1. 引言苯是有机化学中最简单的芳香烃,由于其特殊的结构和性质,在有机合成中具有重要的地位。
苯亲电取代反应是一类常见的反应,通过在苯环上引入亲电试剂,可以实现对苯环上氢原子的取代,从而合成各种取代苯化合物。
本文将介绍苯亲电取代反应的历程、机理以及一些典型的实例。
2. 反应机理苯亲电取代反应是一个两步反应过程,包括亲电试剂进攻和芳香稳定化两个步骤。
2.1 亲电试剂进攻在第一步中,亲电试剂(通常为卤代烷或酸酐)与苯环发生加成反应,生成一个带正离子中间体。
这个中间体具有较高的能量,因为它违背了芳香性规则。
2.2 芳香稳定化在第二步中,带正离子中间体通过负离子攻击或负离子相邻基团共轭系统的形式进行芳香稳定化。
负离子可以是一个碱(如氢氧根离子)或一个碱性试剂(如碱金属或碱土金属)。
这个步骤是整个反应的关键,使得中间体恢复为稳定的芳香化合物。
3. 典型实例3.1 氯代苯的制备氯代苯是一种常见的取代苯化合物,通常用于有机合成和药物制备中。
它可以通过苯亲电取代反应来合成。
反应方程式如下:C6H6 + Cl2 -> C6H5Cl + HCl在这个反应中,氯气作为亲电试剂与苯发生加成反应,生成带正离子中间体C6H5+。
然后,这个中间体通过负离子攻击形成稳定的氯代苯,并释放出HCl。
3.2 酰基化反应酰基化反应是一类重要的取代反应,可用于合成酮、醛等化合物。
在酰基化反应中,酸酐作为亲电试剂与苯发生加成反应。
例如,乙酸酐与苯发生酰基化反应:C6H6 + (CH3CO)2O -> C6H5COCH3 + CH3COOH在这个反应中,乙酸酐与苯发生加成反应,生成带正离子中间体C6H5CO+。
然后,这个中间体通过负离子攻击形成稳定的乙酰苯,并释放出乙酸。
4. 反应条件苯亲电取代反应的条件取决于具体的反应类型和试剂选择。
一般来说,以下条件可能适用:•反应温度:通常在室温下进行,但某些情况下需要加热。
有机化学

一、亲电取代反应类型及反应机理
1. 亲电取代反应类型
苯环上氢的亲电取代反应:苯环上电子云 密度高,易被亲电试剂进攻,引起 C—H 键的 氢被取代,称为亲电取代反应。
(1) 卤代:
+ X2
FeX 3 或 Fe
X
+ HX
F2 > Br2 > Cl 2 > I2 例: CH 3 + Br2
+ C CH AICI 3 4
O. AICI3 CCH3
O
COCH3+ AI(OH) + 3HCI
3
特点:
①酰基化反应不发生酰基异构现象。 ②酰基化反应不能生成多元酰基取代产物。 ③酰基化产物含有羰基,能与路易斯酸络合, 消耗催化剂,催化剂用量一般至少是酰化试剂的二 倍。 苯环上有强吸电子基时,不发生酰基化反应。 ④应用:可以用于制备芳酮及长链正构烷基苯。
5.氯甲基化反应
在无水 ZnCl2 存在下,芳烃与甲醛及氯化氢作用 下,结果苯环上的氢被氯甲基(—CH2Cl)取代, 称为氯甲基化反应。
ZnCI2 1 (CH O) +3 + 2 3 HCI
CH2CI+ H O 2
问题讨论:
①反应机理:本反应机理尚有争议。一般认为 可能是按下述机理进行的:
2 CH2OH + ZnCI4 2 H2C O+2HCI + ZnCI2 H CH2OH CH2OH + + + -H + + H +2 CH2OH CH2OH + HCI CH2CI + H 2O
AlCl 3
C H2C H2C H3
+ (主 ) C O C HC H3 2 (次 ) C H2C H2C H3
苯亲电取代反应历程

苯亲电取代反应历程苯亲电取代反应是一种重要的有机合成方法,它可以通过在苯环上引入不同的官能团来合成各种有机化合物。
本文将详细介绍苯亲电取代反应的历程。
1. 反应机理苯亲电取代反应是一种亲电取代反应,其反应机理可以分为两个步骤:首先是亲电试剂攻击芳香环,形成一个中间体;然后中间体再失去一个负离子,生成最终产物。
具体来说,该反应分为以下三步:(1)亲电试剂的进攻:在苯环上加入一个新的官能团需要先有一种强亲电试剂来进行攻击。
常见的亲电试剂包括卤素、磺酰氯、酰氯、硝基等。
以卤素为例,当卤素分子接近苯环时,卤素原子与芳香环上的碳原子形成了一个临时化学键。
(2)中间体的形成:在第一步中,卤素和苯环形成了一个临时化学键,并且这个键不太稳定。
因此,在第二步中,这个键会断裂并重新组合,形成一个新的化学物质,即中间体。
中间体是一个非常重要的中间产物,它包含了新官能团与苯环上的碳原子。
(3)负离子的失去:在第三步中,中间体会失去一个负离子,生成最终产物。
这个过程也称为脱离反应。
在这个过程中,新官能团会取代苯环上的一个氢原子,并且负离子会从分子中释放出来。
2. 影响反应速率的因素苯亲电取代反应速率受到以下几个因素的影响:(1)亲电试剂的性质:不同的亲电试剂对反应速率有不同的影响。
一般来说,亲电性越强的试剂反应速率越快。
(2)芳香环上基团的性质:苯环上已经存在着其他基团时,新加入官能团时就会受到这些基团的影响。
一些基团可以增加反应速率,而另一些则会减慢反应速率。
(3)溶剂:溶剂对反应速率也有很大影响。
有些溶剂可以促进反应发生,而其他溶剂则可能抑制反应。
3. 应用领域苯亲电取代反应在有机化学中应用广泛,可以合成各种有机化合物。
例如,它可以用于制备芳香族酮、芳香族酸、芳香族醇、芳香族胺等化合物。
此外,苯亲电取代反应还可用于制备药物、染料和高分子材料等。
4. 反应类型苯亲电取代反应的类型包括以下几种:(1)卤代烷的取代:这是最常见的苯亲电取代反应之一。
苯环上的亲电取代反应

苯环上的亲电取代反应苯环是一种芳香族化合物,由于其结构的稳定性,其进行亲电取代反应的能力较弱。
然而,通过引入适当的基团和适当的反应条件,苯环上的亲电取代反应依然是重要且有价值的反应。
本文将对苯环上的亲电取代反应进行详细的讨论,包括反应机理、基团的选择、反应条件等。
一、反应机理亲电取代反应是通过外部的电子亲和力较强的电离或分子与芳香族化合物发生反应的过程。
在苯环上的亲电取代反应,其反应机制主要有以下两种:1. 电子亲和力强的电离或分子与苯环发生反应。
这种反应一般需要强的反应条件以激发分子的反应性能。
典型的实例是邻硝基苯和硝酸,由硝酸的碱性作用(形成NO2-)和酰基硝化作用(形成亲电性更强的NO+2)两个反应生成邻硝基苯。
2. 亲电性较强的反应物与苯环经过一个中间体,即通常所说的共轭碳负离子,发生反应。
这种反应机理是最常见的亲电取代反应机制之一。
基本反应的机理如下图:1.进攻性亲电子(比如卤原子、硝基、磺酰基等)在亲电性反应物的催化下,向苯环上的一个碳原子发起进攻,并将其取代。
2.这个过程中,苯环上原有的负离子中心会向新结构上的离子中心所在的位置移动。
这个移动过程是一个桥式转移,大约持续10-14秒的时间。
3.负离子中心和离子中心在过渡态的情况下相互重叠,而这个过渡态非常不稳定,因此在这样非常高能量的条件下,它立即形成了一个新的芳香族环,并把原来的离子中心转移到了新的位置。
二、基团的选择苯环上的亲电取代反应需要适当的基团参与才能得到较好的反应效果。
不同的基团对亲电取代反应的作用是不同的。
基团的选择可以从下列几个方面考虑:1. 引入电子给体基团的选择:引入电子给予基团可通过提高苯链上的零点位能增加苯环上位点的亲电性,促进取代反应的进行。
如:氨基(—NH2)、羟基(-OH)、甲氧基(-OCH3)、醇基(-OCH2CH3)等。
2. 引入电子受体基团的选择:引入电子受体基团也可以增加苯环上的亲电性。
如:硝基(-NO2)、卤原子(氯、溴、碘等)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、傅-克反应
烷基化—— 被 -R 取代 傅-克反应 O 酰基化—— 被 R-C- 取代
O
无水AlCl AlCl3 无水
O
=
++
CH3
C CH3CH2O Br C O
C CH CH3 CH 2 3
乙苯
O
3 HBr ++ CH
C OH
CH3
乙酸酐
苯乙酮
乙酸
亲电取代反应
4、傅-克反应
路易斯酸,AlCl3, FeCl3 傅-克烷基化反应
药用基础化学/芳香烃
苯环上的亲电取代反应
苯的结构 杂化轨道理论:
苯的化学性质较为稳定
Br2 / CCl4 H2O / H+ KMnO4 H2 / Pt or Ni 常温常压
一些能与烯烃反应的试剂
不反应
与烯烃相比 较,苯环性 质不活泼, 非常稳定。
•与亲电试剂发生取代反应,而不发生加成反应
Br Br2 / Fe Br Br
NO2
NO2
+
HNO3(发烟)
浓H2SO4 90℃ NO2 间二硝基苯
+
H2 O
ቤተ መጻሕፍቲ ባይዱ
亲电取代反应
2、硝化反应
烷基苯的硝化比苯容易,主要生成邻位和对位产物:
亲电取代反应
3、磺化反应
苯环上的氢原子被磺酸基(一SO3H)取代的反应,称为磺化
反应。苯与浓硫酸作用,在苯环上引入磺酸基生成苯磺酸。
例如:
谢
制作人:
谢
石 云
AlX3 R
+
注意:重排反应!
RX
+ CH3CH2CH2Cl
AlCl3
CH
CH3 CH3
+
CH2CH2CH3
异丙苯(65~69%) 正丙苯(35~31% )
亲电取代反应
4、傅-克反应
傅-克酰基化反应
O
路易斯酸,AlCl3, FeCl3
O
+R
C X
FeX3
C
R
酰卤或酸酐
注意:无重排反应!可通过还原制备长链芳烃。
Br取代了H
亲电取代反应
1、卤代反应
+ Cl2 Fe或FeCl 3 55℃ ~ 60℃ 氯苯
Cl
+
HCl
烷基苯的卤代反应比苯容易,主要生成邻、对位取代产 物。例如:
邻溴甲苯
对溴甲苯
亲电取代反应
1、卤代反应
如果没有催化剂存在,在紫外线照射或加热条件下,甲苯
侧链上的氢原子也会被卤素取代:
CH3 CH2Cl
+
H2SO4(浓)
75℃ ~ 80℃
SO 3H
+
H2 O
苯磺酸
亲电取代反应
3、磺化反应
SO 3H SO 3H
+
H2SO4(SO3)
200℃ ~ 2200℃
SO 3H
间苯二磺酸
+
H2 O
发烟硫酸
CH3
CH3
CH3 SO 3H
+
H2SO4(浓)
+
SO 3H
对甲基苯磺酸
+
H2 O
邻甲基苯磺酸
亲电取代反应
+ Cl2
紫外线
+ HCl
亲电取代反应
2、硝化反应
苯与浓硝酸和浓硫酸的混合物(称为混酸)共热,在苯环上
引入一个硝基。例如:
浓H2SO4 + HNO3(浓) 55℃ ~ 60℃ 硝基苯
NO2 +
H2 O
亲电取代反应
2、硝化反应
硝基苯的进一步硝化比苯困难,需要更高的温度或发烟硝 酸和浓硫酸的混合物作硝化试剂,主要生成间二硝基苯。
