8硫酸铝钾的制备及其晶体的培养
明矾做水晶实验报告(3篇)

第1篇一、实验目的1. 了解明矾的性质和用途。
2. 掌握利用明矾制作水晶的方法。
3. 观察水晶生长过程,了解晶体生长的规律。
二、实验原理明矾(硫酸铝钾)是一种含有结晶水的无机盐,化学式为KAl(SO4)2·12H2O。
在水中,明矾可以溶解并逐渐析出晶体,形成水晶。
本实验通过控制明矾与水的比例、温度、时间等因素,使水晶生长得更加完整和美丽。
三、实验材料与仪器1. 实验材料:明矾、温水、小石头、棒棒糖棍、线、食用色素(可选)。
2. 实验仪器:平底玻璃杯、电子秤、计时器、温度计。
四、实验步骤1. 准备工作:将明矾、小石头、棒棒糖棍、线准备好,并将明矾准确称量。
2. 洗净小石头:将小石头用流水清洗干净,确保无杂质。
3. 配制明矾溶液:将称量好的明矾放入平底玻璃杯中,加入适量温水,用棒棒糖棍搅拌至明矾完全溶解。
4. 放置小石头:将洗净的小石头放入溶液中,或者用线拴住小石头,将线的另一端缠在棒棒糖棍上,使其悬挂在溶液中。
5. 调整溶液温度:将玻璃杯放置在温暖的地方,使溶液温度保持在适宜范围内。
6. 观察生长过程:每隔一段时间观察水晶生长情况,记录晶体形态、大小等变化。
7. 培育过程:根据实验需求,调整明矾溶液的浓度、温度等条件,促进水晶生长。
8. 结晶结束:当水晶达到预期大小和形态后,停止实验。
五、实验结果与分析1. 实验结果:经过一段时间,小石头表面逐渐形成了一层透明的水晶,晶体形态优美,具有一定的光泽。
2. 结果分析:明矾在水中溶解后,通过析出晶体形成水晶。
小石头表面成为晶体生长的基底,晶体逐渐长大,最终形成美丽的水晶。
六、实验总结1. 明矾是一种可制作水晶的无机盐,通过控制溶液浓度、温度等因素,可以培养出美丽的水晶。
2. 本实验成功制作了水晶,验证了明矾的晶体生长能力。
3. 在实验过程中,应注意观察水晶生长过程,及时调整实验条件,以确保水晶品质。
七、实验建议1. 在实验过程中,注意观察水晶生长情况,及时调整实验条件,以确保水晶品质。
废铝箔之硫酸铝钾大晶体及碱式碳酸铜制备培训资料

废铝箔之硫酸铝钾大晶体及碱式碳酸铜制备实验题目:由废铝箔制备硫酸铝钾大晶体一、实验目的1、巩固对铝和氢氧化铝两性的认识,掌握复盐晶体的制备方法;2、了解从水溶液中培养大晶体的方法,制备硫酸铝钾大晶体。
3、掌握沉淀与溶液分离的几种操作方法。
二、实验原理1、明矾的性状明矾又称白矾、钾矾、钾铝矾、钾明矾、十二水硫酸铝钾。
是含有结晶水的硫酸钾和硫酸铝的复盐。
化学式KAl(SO4)2·12H2O,式量474.39,正八面体晶形,有玻璃光泽,密度1.757g/cm3,熔点92.5℃。
64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,不溶于乙醇。
在20度,1个标准大气压下,明矾在水中的溶解度约为5.90g。
表1 溶解度的参照表2、明矾晶体的实验制备原理铝屑溶于浓氢氧化钾溶液,可生成可溶性的四羟基合铝(Ⅲ)酸钾K[Al(OH)4],用稀H 2SO 4调节溶液的pH 值,将其转化为氢氧化铝,使氢氧化铝溶于硫酸,溶液浓缩后经冷却有较小的同晶复盐,此复盐称为明矾[KAl(SO 4)2·12H 2O ]。
小晶体经过数天的培养,明矾则以大块晶体结晶出来。
制备中的化学反应如下:2Al + 2KOH + 6H 2O ══ 2K[Al(OH)4] + 3H 2↑ 2 K[Al(OH)4] + H 2SO 4 ══ 2Al(OH)3↓+ K 2SO 4 + 2H 2O 2Al(OH)3 + 3H 2SO 4 ══ Al 2(SO 4)3 + 6 H 2O Al 2 (SO 4)3 + K 2SO 4 + 24H 2O ══2KAl(SO 4)2·12H 2O三、实验步骤1、工艺流程图废铝→溶解→过滤→酸化→浓缩→结晶→过滤单晶培养→明矾单晶2、明矾晶体的实验制备取50mL2mol·L -1 KOH 溶液,分多次加入2g 废铝制品(铝质牙膏壳、铝合金易拉罐等),反应完毕后用布氏漏斗抽滤,取清液稀释到l00mL ,在不断搅拌下,滴加3 mol·L -1 H 2SO 4溶液,调ph6-7(按化学反应式计量,约41mL)。
硫酸铝钾的制备及其形貌分析

硫酸铝钾的制备及其形貌分析
张卓;韩晓晶;石媛
【期刊名称】《山西科技》
【年(卷),期】2016(031)004
【摘要】本实验采用铝屑、硫酸钾等制备硫酸铝钾晶体,所得产率为63.4%,并采用扫描电镜对硫酸铝钾晶体形貌结构进行表征分析.结果表明:加入晶种后,硫酸铝钾逐渐长成均匀的球形结构;采用无水乙醇对硫酸铝钾晶体进行洗涤,随着硫酸铝钾浓度的增大,球形结构逐渐被破坏,变成无规则的多边形.
【总页数】3页(P55-57)
【作者】张卓;韩晓晶;石媛
【作者单位】山西省分析科学研究院,山西太原,030006;吕梁学院,山西吕
梁,033001;山西省分析科学研究院,山西太原,030006
【正文语种】中文
【中图分类】TQ13
【相关文献】
1.用化肥废催化剂制备硫酸铝钾 [J], 冯彦琳;罗锦超;方莉;周晖琴
2.氢氧化钾法与硫酸法制备硫酸铝钾的区别探讨 [J], 彭敏;石建新;王周;赖瑢;李莲云;郑赛利;陈六平
3.硫酸铝钾制备实验的改进研究 [J], 王红云;钟四姣
4.纳米氧化铁的制备及形貌分析 [J], 孙天昊;郝素菊;蒋武锋;张玉柱
5.DMF体系中Cu2O球晶的制备及形貌分析 [J], 饶盛源;邱志惠;徐金燕;徐鑫;张琦;隆颖;阮青锋
因版权原因,仅展示原文概要,查看原文内容请购买。
硫酸铝钾大晶体的制备

硫酸铝钾大晶体的制备
10
注意事项
制备大晶体时,溶液浓度不易过高,过滤掉未溶解的固体; 注意经常观察,如有许多小晶体析出,需重新溶解再放晶种;
硫酸铝钾大晶体的制备
11
实验结果
05级化学系学生明矾晶体产品, 紫色的为铬铝矾
硫酸铝钾大晶体的制备 12
实验结果
如果溶液浓度太大,晶体析出会过快, 易形成许多小晶体,造成失败。
------化学系05级林辉
硫酸铝钾大晶体的制备 15
学生心得
制备KAl(SO4)2·12H2O是一次愉快的经历。把Al投入酸中,看着它激烈 地吹着泡泡。药品从沉淀到溶解,如同经历着一次次生命的轮回。我则 像一个虔诚的信徒,一步都不敢有所差错。终于等到了KAl(SO4)2原料的 制备结束。加水,加明矾,用玻棒开始搅拌。KAl(SO4)2在旋涡中翩然起 舞,高低浮沉,舞步细碎。用电炉的温度加热这个舞会,KAl(SO4)2一点 一点缩小,最后消失于舞曲的最后一个乐符…… 当我把悬挂着晶体的玻 棒小心地提起时,我看着那颗培养出来的晶体慢慢地露出液面,表面未 干涸的水珠折射着耀眼的光……..
硫酸铝钾大晶体的制备
13
学生心得
直到1个多月前在实验室中我亲身制备明矾大晶体,才真正明白什 么叫“结晶”,明白人们为什么把一切美好事物的慢慢积聚叫做结晶。因为 那真是一个充满了未知、等待、失望和快乐的过程。在不安中耐心等待 是一个恼人但也有趣的过程 …… 我时常想像一个个小小的分子是怎样 悄悄靠在拴在细线一端的晶种上,又一个个连起来一层层覆盖着并最终 成为一个美丽的八面体,折射着冬日里的缕缕阳光。那是一个多么奇妙 的过程!其实第二天我就按捺不住跑到实验室去看我的晶体,但丝毫不 见变化。……“求之不得,寤寐思服,悠哉悠哉,辗转反侧”恰如其分。
硫酸铝钾大晶体制备实验

硫酸铝钾大晶体制备实验实验目的:通过硫酸铝钾大晶体制备实验,掌握一定的化学合成实验操作技能,了解硫酸铝钾大晶体的制备方法,探究其晶体结构和形态。
实验原理:硫酸铝钾是一种无机化合物,其化学式为KAl(SO4)2·12H2O,因结构中的铝与钾数目相等而得名。
硫酸铝钾是一种白色晶体,具有较好的化学稳定性,可应用于制备砌体、耐火材料、色素、催化剂等领域。
硫酸铝钾的制备方法多种多样,其中最为广泛的一种是采用铝饼、硫酸、钾铬酸盐和水反应进行制备。
实验中采用的硫酸铝钾大晶体制备方法是利用反应混合物中硫酸铝离子的添加过度,使过盈离子形成大晶体结构的方法。
实验材料:铝饼、硫酸、钾铬酸盐、蒸馏水。
实验步骤:1.准备5.0g的铝饼,将铝饼割成碎片。
2.将铝碎片投入已加入42ml蒸馏水的500ml三口瓶中。
3.将200ml的硫酸慢慢滴入三口瓶中,同时加入1g的钾铬酸盐,在加的过程中要注意控制温度以免瓶口脱落。
将瓶口随时以手指盖住,以免出现液位突然升高溢出。
4.反应开始后,铝片逐渐消耗,放出氢气。
反应完成后,瓶中会有固体沉淀,这时可以去除瓶口手指,用香烟纸探入瓶口检查是否有气体逸出。
5.将倒入多余的硫酸完全放干,再加入60ml蒸馏水,用通量为20ml/min的水流冲洗。
将所得物转移到玻璃棒上进行过滤,最后再冲洗一下。
6.将所得硫酸铝钾晶体放到烘箱中干燥,即可得到晶体。
实验结果:通过上述实验步骤,最终得到了硫酸铝钾的晶体,晶体颜色为淡黄色,结晶形态为棱柱形状。
在显微镜下观察晶体表面,晶体呈现出光滑平整的形态,表明反应过程的控制十分精准。
通过本次实验,我们掌握了硫酸铝钾大晶体的制备方法,并对其晶体结构和形态进行了探究。
通过实验结果的观察和分析,我们发现制备过程中对反应条件的控制非常关键,如严格控制反应时的温度、慢慢滴加硫酸以及注意安全问题等都是非常重要的。
最终得到的硫酸铝钾晶体品质良好,结晶形态规整,这将为我们今后在工业上的应用提供参考和借鉴。
硫酸铝钾的制备

硫酸铝钾的制备及其晶体的培养老师,这个实验我做了几次,冷却时间很长,还有你帮我看看有什么需要改进的地方,改进后再重做,而且不引入晶体非常难结晶摘要:2、实验部分:2.1、实验原理:本实验利用金属铝溶于氢氧化钠溶液,生成可溶性的四羟基铝酸钠:2Al+2KOH+6H2O===2K[Al(OH)4]+3H2金属铝中其他金属或杂质则不溶,过滤除去杂质,用硫酸溶液中和四羟基合铝酸钾可制得微溶于水的复盐明矾----硫酸铝钾K2SO4•Al2(SO4)3 ·24H2O2K[Al(OH)4] + 4 H2SO4 + 16 H2O ==== K2SO4•Al2(SO4)3•24H2O 明矾单晶的培养:2.2、实验仪器和试剂:实验仪器:烧杯(250ml、10ml各一个)、锥形瓶(10ml)、玻璃棒、托盘天平,抽滤瓶、布氏漏斗、洗耳球、三脚架、石棉网、酒精灯、半微量漏斗实验试剂:Al屑、KOH(C.P.)、H2SO4(6mol/L)、KOH(C.P.)、乙醇(95%)2.3实验装置:四羟基铝酸钠的合成(铝屑溶解)(水浴反应)(减压抽滤)(K[Al(OH)4]溶液)硫酸铝钾的合成(氢氧化铝)(溶解沉淀,蒸发浓缩)(冷却结晶)(产品)2.4、实验步骤四羟基合铝酸钾的制备称取0.4gKOH 固体,至于10m 锥形瓶中,加入5ml 蒸馏水使之溶解。
在60℃水浴微热反应,称取0.2gAl 屑分批加入溶液中(反应剧烈,防止溅出),至不再有气泡产生,说明反应完毕,然后加入2ml 蒸馏水,然后进行微型减压抽滤,将滤液转入10ml 烧杯中,称量其他的杂质金属和残留物。
硫酸铝钾的制备向小烧杯的溶液中慢慢滴加6mol/LH2SO4溶液,并不断搅拌,将中和后的溶液加热2分钟(勿沸),使沉淀完全溶解,冷却至室温后,然后放在冰水混合物中冷却、结晶。
减压抽滤,用0.5ml95%乙醇洗涤晶体2次,将晶体用滤纸吸干,称重。
平行三次实验取平均值(见工艺流程图1)四羟基合铝酸钾的制备10ml 滤渣(待称量)滤液10ml 10ml 10ml4.4实验数据处理室温:26℃日期:4月15日。
明矾晶体的实验报告

一、实验目的1. 了解明矾晶体的制备过程;2. 掌握溶液饱和度的控制方法;3. 熟悉晶体生长的基本原理。
二、实验原理明矾(硫酸铝钾)是一种含有结晶水的无机盐,其化学式为KAl(SO4)2·12H2O。
在实验室中,明矾晶体的制备通常采用冷却热饱和溶液法。
当溶液温度降低时,溶质的溶解度降低,从而析出晶体。
三、实验用品1. 仪器:烧杯、玻璃棒、漏斗、滤纸、镊子、线;2. 试剂:明矾、蒸馏水。
四、实验步骤1. 称取5g明矾,放入烧杯中;2. 加入50mL蒸馏水,用玻璃棒搅拌溶解;3. 将烧杯置于热板上加热,不断搅拌,使明矾完全溶解;4. 将烧杯从热板上取下,待溶液自然冷却至室温;5. 用漏斗和滤纸过滤溶液,去除不溶性杂质;6. 将滤液倒入洁净的烧杯中,静置过夜;7. 第二天,用镊子取出晶体,用蒸馏水冲洗干净;8. 将晶体放在滤纸上晾干。
五、实验结果通过实验,成功制备了明矾晶体。
晶体呈透明、八面体形状,具有一定的光泽。
六、实验分析1. 溶液饱和度的控制:在实验过程中,控制溶液饱和度是制备晶体的关键。
通过加热使明矾完全溶解,再自然冷却至室温,使溶液达到饱和状态。
2. 晶体生长条件:晶体生长过程中,应注意以下几点:a. 保持溶液纯净,避免杂质干扰晶体生长;b. 控制溶液浓度,避免晶体生长过快或过慢;c. 避免溶液剧烈振荡,以免影响晶体生长;d. 保持环境稳定,避免温度、湿度等条件变化对晶体生长的影响。
七、实验总结本次实验成功制备了明矾晶体,掌握了溶液饱和度的控制方法和晶体生长的基本原理。
在实验过程中,应注意溶液纯净、控制浓度、避免振荡和保持环境稳定,以确保晶体生长质量。
通过本次实验,提高了对晶体生长过程的认识,为今后相关实验研究奠定了基础。
无机及分析化学实验-硫酸铝钾的制备及铝含量的测定
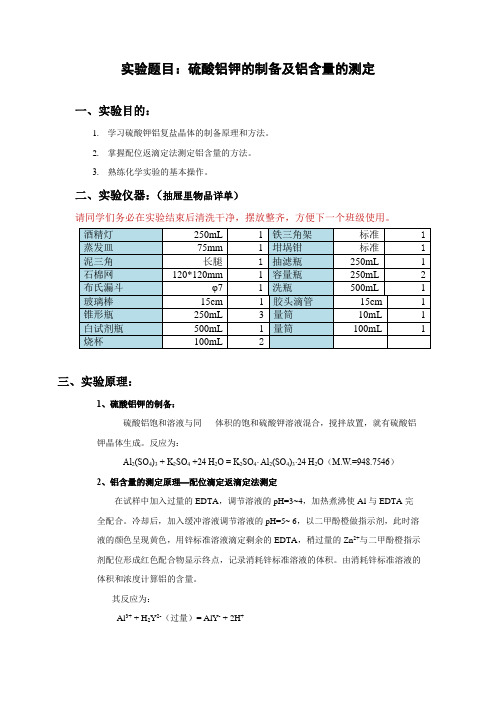
实验题目:硫酸铝钾的制备及铝含量的测定一、实验目的:1.学习硫酸钾铝复盐晶体的制备原理和方法。
2.掌握配位返滴定法测定铝含量的方法。
3. 熟练化学实验的基本操作。
二、实验仪器:(抽屉里物品详单)请同学们务必在实验结束后清洗干净,摆放整齐,方便下一个班级使用。
三、实验原理:1、硫酸铝钾的制备:硫酸铝饱和溶液与同体积的饱和硫酸钾溶液混合,搅拌放置,就有硫酸铝钾晶体生成。
反应为:Al2(SO4)3 + K2SO4 +24 H2O = K2SO4⋅ Al2(SO4)3⋅24 H2O(M.W.=948.7546)2、铝含量的测定原理−配位滴定返滴定法测定在试样中加入过量的EDTA,调节溶液的pH=3~4,加热煮沸使Al与EDTA完全配合。
冷却后,加入缓冲溶液调节溶液的pH=5~ 6,以二甲酚橙做指示剂,此时溶液的颜色呈现黄色,用锌标准溶液滴定剩余的EDTA,稍过量的Zn2+与二甲酚橙指示剂配位形成红色配合物显示终点,记录消耗锌标准溶液的体积。
由消耗锌标准溶液的体积和浓度计算铝的含量。
其反应为:Al3+ + H2Y2-(过量)= AlY- + 2H+H2Y2- + Zn2+ = ZnY2- + 2H+(滴定剩余的EDTA)Zn2+ + In2- =ZnIn(黄色)(红色)该实验中EDTA加入量的多少、终点的正确判断是保证分析结果准确与否的关键,而恰恰是在这些步骤上容易出现问题,导致实验的失败。
四、实验内容:1、硫酸铝钾的制备称量3.5g的硫酸铝晶体置于100mL小烧杯中,加入9mL(8.6ml)去离子水配成室温下的饱和溶液。
另称取2.0g K2SO4固体,在另一100mL小烧杯加入20mL去离子水加热溶解(加热溶解只需5min,不加热需要40min)配饱和溶液,然后将两溶液混合,倒入蒸发皿,加热浓缩12min后,立即停止加热,冰水冷却至室温(可稍微搅拌以加快结晶)有K2SO4⋅Al2(SO4)3⋅24H2O晶体析出,减压过滤,压干称重,计算产率。
硫酸铝钾晶体

硫酸铝钾晶体硫酸铝钾晶体是一种具有独特结构和性质的化合物,它在工业、科研和生活中都有广泛的应用。
本文将分步骤阐述硫酸铝钾晶体的制备、结构特点、性质以及应用领域,以展示其重要性和价值。
一、制备方法硫酸铝钾晶体的制备方法主要包括溶液法、水热法、气相沉积法等。
其中,溶液法是较为常用的制备方法。
具体步骤为:先将适量的氢氧化钾溶解在水中,加入适量的硫酸铝,搅拌均匀后,滴加稀硫酸,得到混合物。
将这个混合物加热,使其溶解,然后慢慢地冷却,即可获得硫酸铝钾晶体。
二、结构特点硫酸铝钾晶体的结构为六方晶系,属于六方密最紧堆积结构。
它的单位晶胞中,每个铝原子被六个氧原子所包围,每个钾原子则被十二个氧原子所包围。
硫酸铝钾晶体具有较高的晶体硬度和熔点,因此具有较好的热稳定性。
三、性质硫酸铝钾晶体具有许多优良的性质,如高硬度、高熔点、抗腐蚀、抗辐射等。
此外,该化合物在电子工业中也有广泛的应用,因为它具有良好的电化学性能和资源丰富、价格相对低廉的优点。
同时,硫酸铝钾晶体还具有一定的光学特性,比如光学吸收和非线性光学效应等。
四、应用领域硫酸铝钾晶体的应用领域非常广泛,特别是在电子工业领域中。
它既可以作为透明导电膜,用于显示面板、光伏电池和太阳能电池等;也可以用作光学传感器和非线性光学材料,应用于光通讯、激光器和光储存器等领域。
此外,硫酸铝钾晶体还可以用于制备高纯度铝、光学玻璃和硅片等。
它在工业、科研和生活中都有重要的应用价值。
综上所述,硫酸铝钾晶体是一种具有独特结构和性质的化合物,其制备方法简单、用途广泛。
相信随着科学技术的不断进步,它在未来的应用领域中还会有更加广泛而深入的发展。
做硫酸铝钾的工艺流程

做硫酸铝钾的工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!硫酸铝钾,又称硫酸铝钾泻剂,是一种常用的医药原料,具有止泻、收敛、干燥作用。
硫酸铝结晶制备

硫酸铝结晶制备硫酸铝是一种常见的无机化合物,广泛应用于水处理、纸浆、医药等领域。
硫酸铝的制备方法有很多种,其中硫酸铝结晶法是应用最广泛的一种方法之一。
本文将介绍硫酸铝结晶制备的步骤及其工艺参数。
1. 原料准备硫酸铝的制备通常采用天然矿石或工业废渣等作为原料。
其中,以黄铁矾为原料制备硫酸铝的方法已得到广泛应用。
黄铁矾是一种含铁、硫酸铝盐的矿物,由于其含铁量较高,所以在制备过程中需加入还原剂还原铁的氧化物。
此外,还需准备所需的水和生产设备。
2. 反应过程硫酸铝的制备主要是通过黄铁矾和还原剂的反应得到。
反应的化学方程式为:Fe2(SO4)3 + xFeSO4 + yH2O → 2FeSO4·xH2O + Al2(SO4)3·nH2O其中,x、y、n为反应条件的影响因素,也就是工艺参数。
反应过程分为两步:(1) 还原反应。
将黄铁矾、还原剂和水混合后加热,通过还原反应将黄铁矾中的Fe3+还原成Fe2+,生成亚铁离子。
(2) 氧化反应。
将还原后的液体缓慢加入氧化剂,使亚铁离子氧化成Fe3+,同时将黄铁矾中的硫酸铝盐分离出来,生成硫酸铝晶体。
3. 结晶和分离反应后的溶液经过结晶和分离处理,即可得到硫酸铝产品。
结晶过程是将反应后的溶液在密闭的容器内缓慢晾晒,使其中的硫酸铝盐结晶。
分离过程是将结晶后的固体和液体分离,常用方法为过滤或离心分离。
4. 工艺参数(1) 温度。
在还原反应中,温度的升高有利于反应的进行,但温度过高可能导致产物失水,降低产量。
在氧化反应中,温度的升高有利于晶体生长,但温度过高可能也导致产物失水和结晶过度。
(2) pH值。
pH值是指溶液的酸碱度,对反应速率和产物质量有着重要的影响。
反应开始时,pH值应控制在2.5左右。
当溶液中硫酸铝盐浓度降低时,pH值应调整为4.0左右。
(3) 氧化剂的种类和用量。
常用的氧化剂有过氧化氢、氧气、氧化亚氮等。
氧化剂的种类和用量会影响晶体的大小、产量和质量。
实验 - 硫酸铝钾实验报告

十二水合硫酸铝钾晶体的制备一、实验目的1.了解从Al制备硫酸铝钾的原理及过程。
2.熟练掌握溶解、结晶、抽滤等基本操作。
3.熟悉Al及Al(OH)3的两性。
二、实验原理1、制备方法:2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑金属铝中其他杂质不溶于NaOH溶液,生成可溶性的四羟基合铝酸钠。
用H2SO4调节此溶液的pH为8~9,即有Al(OH)3沉淀产生,分离后在沉淀中加入H2SO4使Al(OH)3溶解,反应式如下:3 H2SO4+ 2 Al(OH)3→2Al2(SO4)3+6H2O在Al2(SO4)3中加入等量的K2SO4固体,即可得硫酸铝钾:Al2(SO4)3+ K2SO4 +24H2O →2KAl(SO4)2·12H2O↓2、物理常数(1)硫酸钾在水中的溶解度:(2)硫酸铝钾的无水物的溶解度如下:(3)十二水合硫酸铝钾熔点92.5℃。
92.5℃时失去9个分子结晶水,200℃时失去12个分子结晶水,溶于水,不溶于乙醇。
三、仪器与试剂四、实验步骤1.Al(OH)3的制备(1)打开水浴锅预热,称取4.5gNaOH固体,置于250mL烧杯中,加入60mL蒸馏水。
称取2g铝屑,分批加入NaOH溶液。
反应至不再有气泡,说明反应已完全。
(2)然后加蒸馏水,使体积约为80mL,趁热过滤。
将滤液转入250mL烧杯,用电炉加热沸腾,在不断搅拌下,滴加约10mL的3mol/L H2SO4,使溶液pH为8~9.生成白色沉淀(3)继续搅拌,水浴加热数分钟,然后抽滤,并用沸水洗涤沉淀,直至洗涤液的pH降到7左右,抽滤。
2. Al2(SO4)3的制备将制得的Al(OH)3沉淀转入烧杯,加入约20mL1:1 H2SO4(10.1mol/L),并不断搅拌,水浴加热使沉淀溶解,得到Al2(SO4)3溶液。
3.十二水合硫酸铝钾的制备将Al2(SO4)3溶液与6.5gK2SO4配成的饱和溶液相混合,搅拌均匀,充分冷却后,减压抽滤,并用95%乙醇洗涤,尽量抽干,称量,计算产率。
8硫酸铝钾的制备及其晶体的培养

实验8硫酸铝钾的制备及其晶体的培养一、实验目的1.了解从铝制备硫酸铝钾的原理及过程;2.进一步认识Al及Al(OH)3的两性;3.学习从溶液中培养晶体的原理和方法。
二、实验原理硫酸铝同碱金属的硫酸盐(K2SO4)作用生成硫酸铝钾复盐。
硫酸铝钾(K2SO4·Al2(SO4)3·24H2O)俗称明矾,它是一种无色晶体,易溶于水,并水解生成Al(OH)3胶状沉淀。
它具有较强的吸附性能,是工业上重要的铝盐,可作为净水剂、造纸充填剂等多种用途。
本实验利用金属铝溶于氢氧化钠溶液,生成可溶性的四羟基铝酸钠,金属铝中其它的杂质则不溶,过滤除去杂质。
随后用H2SO4调节此溶液的pH值为8-9,即有Al(OH)3沉淀产生,分离后,在沉淀中加入H2SO4,使Al(OH)3转化为Al2(SO4)3,然后制成Al2(SO4)3晶体,将Al2(SO4)3晶体和K2SO4晶体分别制成饱和溶液,混合后就有明矾生成。
有关反应如下:2Al + 2NaOH + 6H2O === 2Na[Al(OH) 4] + 3H2[Al(OH)4 ]-+ H+ === Al(OH)3 + H2O2Al(OH)3 + 3H2SO4 === Al2(SO4)3 + 6H2OAl2(SO4)3 + K2SO4 + 24H2O === K2SO4·Al2(SO4)3·24H2O明矾单晶的培养:当有K2SO4·Al2(SO4)3·24H2O晶体析出后,过滤得到晶体后,选出规整的作为晶种,放在滤液中,盖上表面皿,让溶液自然蒸发,结晶就会逐渐长大,成为大的单晶,单晶具有八面体晶形。
为使晶种长成大的单晶,重要的是溶液温度不要变化太大,使溶液的水分缓慢蒸发。
另外为长成大结晶,也可将生成的晶体系上尼龙绳,悬在溶液中。
这样晶体在各方面生长速度不受影响,生成的晶体更规则。
三、实验用品仪器与材料:烧杯,电子台秤,布氏漏斗,蒸发皿,酒精灯,三脚架,石棉网,火柴,玻璃漏斗,量筒,滤纸,pH试纸,尼龙线。
废铝箔之硫酸铝钾大晶体及碱式碳酸铜制备

实验题目:由废铝箔制备硫酸铝钾大晶体令狐采学一、实验目的1、巩固对铝和氢氧化铝两性的认识,掌握复盐晶体的制备方法;2、了解从水溶液中培养大晶体的方法,制备硫酸铝钾大晶体。
3、掌握沉淀与溶液分离的几种操作方法。
二、实验原理1、明矾的性状明矾又称白矾、钾矾、钾铝矾、钾明矾、十二水硫酸铝钾。
是含有结晶水的硫酸钾和硫酸铝的复盐。
化学式KAl(SO4)2·12H2O,式量474.39,正八面体晶形,有玻璃光泽,密度1.757g/cm3,熔点92.5℃。
64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,不溶于乙醇。
在20度,1个标准大气压下,明矾在水中的溶解度约为5.90g。
表1 溶解度的参照表2、明矾晶体的实验制备原理铝屑溶于浓氢氧化钾溶液,可生成可溶性的四羟基合铝(Ⅲ)酸钾K[Al(OH)4],用稀H2SO4调节溶液的pH 值,将其转化为氢氧化铝,使氢氧化铝溶于硫酸,溶液浓缩后经冷却有较小的同晶复盐,此复盐称为明矾[KAl(SO4)2·12H2O]。
小晶体经过数天的培养,明矾则以大块晶体结晶出来。
制备中的化学反应如下: 2Al + 2KOH + 6H2O ══ 2K[Al(OH)4] + 3H2↑ 2 K[Al(OH)4] + H2SO4 ══ 2Al(OH)3↓+ K2SO4 + 2H2O 2Al(OH)3 + 3H2SO4 ══ Al2(SO4)3 + 6 H2OAl2 (SO4)3 + K2SO4 + 24H2O ══2KAl(SO4)2·12H2O 三、实验步骤 1、工艺流程图废铝→溶解→过滤→酸化→浓缩→结晶→过滤单晶培养→明矾单晶2、明矾晶体的实验制备取50mL2mol·L -1 KOH 溶液,分多次加入2g 废铝制品(铝质牙膏壳、铝合金易拉罐等),反应完毕后用布氏漏斗抽滤,取清液稀释到l00mL ,在不断搅拌下,滴加3 mol·L -1 H2SO4溶液,调ph6-7(按化学反应式计量,约41mL)。
硫酸铝钾实验报告

硫酸铝钾大晶体的制备一、实验目的1.了解从铝制备硫酸铝钾的原理及过程。
2.了解从水溶液中培养大晶体的方法,制备硫酸铝钾大晶体。
3.熟练掌握溶解、结晶、抽滤等基本操作。
二、实验原理1、制备方法:2Al+2NaOH+6H2O→2NaAl(OH)4+3H2↑金属铝中其他杂质不溶于NaOH溶液,生成可溶性的四羟基铝酸钠。
用H2SO4调节此溶液的pH为8~9,即有Al(OH)3沉淀产生,分离后在沉淀中加入H2SO4使Al(OH)3溶解,反应式如下:3 H2SO4+ 2 Al(OH)3→2Al2(SO4)3+6H2O在Al2(SO4)3中加入等量的K2SO4固体,即可得硫酸铝钾Al2(SO4)3+ K2SO4 +24H2O →2KAl(SO4)2·12H2O↓2、溶解度(1)硫酸钾在水中的溶解度:温度 : 0℃10℃20℃30℃40℃60℃80℃ 90℃100℃溶解度: 7.4 9.3 11.1 13.0 14.8 18.2 21.4 22.9 24.1(2)十二水硫酸钾铝的无水物的溶解度如下:100度:154克/100克水80度:71.克/100克水,20度:5.9克/100克水.三、仪器与试剂仪器:托盘天平,水浴锅,抽滤瓶,布氏漏斗,烧杯,量筒,丝线试剂:易拉罐;K2SO4(s );浓H2SO4;3mol/L H2SO4 ,NaOH(s)四、实验步骤1.Al(OH)3的制备称取4.5gNaOH固体,置于250mL烧杯中,加入60mL蒸馏水。
称取2g剪好的铝条,分批加入NaOH溶液。
反应至不再有气泡,说明反应已完全。
然后加蒸馏水,使体积约为80mL,趁热过滤。
将滤液转入250mL烧杯,加热沸腾,在不断搅拌下,滴加3mol/L H2SO4,使溶液pH为8~9.继续搅拌,水浴加热数分钟,然后抽滤,并用沸水洗涤沉淀,直至洗涤液的pH降到7左右,抽滤。
2. Al2(SO4)3的制备将制的Al(OH)3 沉淀转入烧杯,加入约20mL1:1 H2SO4,并不断搅拌,水浴加热使沉淀溶解,得到Al2(SO4)3溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验8硫酸铝钾的制备及其晶体的培养
一、实验目的
1.了解从铝制备硫酸铝钾的原理及过程;
2.进一步认识Al及Al(OH)3的两性;
3.学习从溶液中培养晶体的原理和方法。
二、实验原理
硫酸铝同碱金属的硫酸盐(K2SO4)作用生成硫酸铝钾复盐。
硫酸铝钾(K2SO4·Al2(SO4)3·24H2O)俗称明矾,它是一种无色晶体,易溶于水,并水解生成Al(OH)3胶状沉淀。
它具有较强的吸附性能,是工业上重要的铝盐,可作为净水剂、造纸充填剂等多种用途。
本实验利用金属铝溶于氢氧化钠溶液,生成可溶性的四羟基铝酸钠,金属铝中其它的杂质则不溶,过滤除去杂质。
随后用H2SO4调节此溶液的pH值为8-9,即有Al(OH)3沉淀产生,分离后,在沉淀中加入H2SO4,使Al(OH)3转化为Al2(SO4)3,然后制成Al2(SO4)3晶体,将Al2(SO4)3晶体和K2SO4晶体分别制成饱和溶液,混合后就有明矾生成。
有关反应如下:
2Al + 2NaOH + 6H2O === 2Na[Al(OH) 4] + 3H2
[Al(OH)4 ]-+ H+ === Al(OH)3 + H2O
2Al(OH)3 + 3H2SO4 === Al2(SO4)3 + 6H2O
Al2(SO4)3 + K2SO4 + 24H2O === K2SO4·Al2(SO4)3·24H2O
明矾单晶的培养:当有K2SO4·Al2(SO4)3·24H2O晶体析出后,过滤得到晶体后,选出规整的作为晶种,放在滤液中,盖上表面皿,让溶液自然蒸发,结晶就会逐渐长大,成为大的单晶,单晶具有八面体晶形。
为使晶种长成大的单晶,重要的是溶液温度不要变化太大,使溶液的水分缓慢蒸发。
另外为长成大结晶,也可将生成的晶体系上尼龙绳,悬在溶液中。
这样晶体在各方面生长速度不受影响,生成的晶体更规则。
三、实验用品
仪器与材料:烧杯,电子台秤,布氏漏斗,蒸发皿,酒精灯,三脚架,石棉网,火柴,玻璃漏斗,量筒,滤纸,pH试纸,尼龙线。
固体试剂:Al屑(C.P),NaOH(C.P) ,K2SO4(C.P)。
液体试剂:H2SO4(3mol·L-1,1:1),BaCl2(0.1 mol·L-1)。
四、实验内容
1.Al(OH)3的生成
称取2.3克NaOH固体,置于200mL烧杯中,加入30mL蒸馏水溶解。
称取1克铝屑,分批放入溶液中(反应剧烈,防止溅出,应在通风橱内进行),至不再有气泡产生,说明反应完毕,然后再加入蒸馏水,使体积约为40mL,抽滤。
将滤液转入200mL烧杯中,加热至沸,在不断搅拌下,滴加3mol·L-1H2SO4,使溶液的pH为8-9,继续搅拌煮沸数分钟,然后抽滤,并用沸水洗涤沉淀,直至洗涤液的pH值降至7左右,抽干。
2.Al2(SO4)3的制备
将制得的Al(OH)3转入烧杯中,在不断搅拌下,加入1:1 H2SO4,并水浴加热。
当溶液变清后,
停止加入硫酸,得Al2(SO4)3溶液。
浓缩溶液为原体积的二分之一,取下,用水冷却至室温,待结晶完全后,抽滤,将晶体用滤纸吸干,称重。
3.明矾的制备及大晶体的培养
将称重的硫酸铝晶体置于小烧杯中,配成室温下的饱和溶液。
另称取K2SO4固体,也配成同体积饱和溶液,然后将等体积的两饱和溶液相混合,搅拌均匀。
放置后,就会有明矾晶体析出。
过滤,选出规整的作为晶种,放在滤液中,盖上表面皿,让溶液自然蒸发,结晶就会逐渐长大,成为大的单晶,单晶具有八面体晶形。
为使晶种生成大的单晶,重要的是溶液温度不要变化太大,使溶液的水分缓慢蒸发。
为生成大结晶,也可将生成的晶体系上尼龙绳,悬在溶液中。
这样晶体在各方面生长速度不受影响。
4.性质实验:取少量明矾晶体,验证溶液中存在Al3+、K+、SO42-离子,并写出方程式。
五、预习内容
1.查阅资料,找出检验溶液中含有Al3+、K+、SO42-离子的最简单,最可行的方法。
2.查出Al2(SO4)3和K2SO4在不同温度下的溶解度。
六、思考题
1.为什么用碱溶解Al?
2.将硫酸钾和硫酸铝两种饱和溶液混合能够制得明矾晶体,用溶解度来说明其理由。
