促甲状腺素化学发光免疫定量检测试剂盒的研制(精)
化学发光试剂临床意义

名 称:人垂体泌乳素(PRL)诊断试剂盒(化学发光免疫分析法) 临床意义:人垂体泌乳素(PRL)是由垂体前叶产生的,由 198 个氨基酸组成的单链多肽,分子量 22kD,其结构与生物学方面与生长激素、胎泌乳素属同类激素。PRL 直接作用于体细胞,促进乳 腺生长、发育和乳液形成。此外,尚有促进卵巢分泌甾体激素 、黄体形成与溶解的作用。非妊娠 妇女与男性 PRL 水平相当,妊娠后 PRL 水平逐渐增加,至分娩前达到高峰,哺乳期进一步增加。 PRL 测定对垂体疾病,特别是垂体瘤和各种原因引起的高泌乳素血症及月经异常和不孕症的病因 诊断与鉴别有重要意义。
2
北京华科泰生物技术有限公司
化学发光各项目的临床意义
名 称:高灵敏人促甲状腺激素(TSH)诊断试剂盒(化学发光免疫分析法) 临床意义:促甲状腺激素(TSH)的分泌受血清中 T3 和 T4 浓度的负反馈调节。TSH 主要作用于甲 状腺,它能增加甲状腺合成并分泌甲状腺激素 T3 和 T4。测定血清中 TSH 的含量,是诊断甲状腺功 能和研究下丘脑-垂体-甲状腺轴的重要指标之一。在甲状腺功能评估中,可鉴别原发性和继发性 (垂体性或下丘脑性)甲状腺功能低下症,并可作为对甲低症疗效观察的指标。此外,可观察垂体 TSH 的储存功能,进一步区别下丘脑和垂体的病变;与 T4 联合使用是目前诊断新生儿先天性甲低 的唯一方法。
ft4-化学发光法

ft4-化学发光法
FT4(Free Thyroxine)是衡量甲状腺功能的生化指标之一,化学发光法是常用的测定FT4浓度的方法之一。
以下是关于FT4的化学发光法的基本介绍:
化学发光法是一种基于光学原理的分析方法,通过测量光的发射或吸收来定量分析物质的浓度。
在测量FT4浓度时,常用的化学发光法是通过测量甲状腺素(包括游离型和结合型甲状腺素)与特异性抗体间的结合反应来间接测定FT4浓度。
具体步骤如下:
1. 准备试剂:准备化学发光试剂盒,其中包括含有特异性抗体的试剂、底物和共反应试剂等。
2. 准备样本:样本通常是血液或血清。
3. 加入抗体:将样本与化学发光试剂盒中的含有特异性抗体的试剂混合,使抗体与甲状腺素结合。
4. 反应:抗体与甲状腺素结合形成复合物,抑制了发光底物的化学反应。
5. 检测:通过光学分析仪器测量未被消耗的发光底物或被消耗的发光底物的减少来计算FT4浓度。
化学发光法具有灵敏度高、特异性好和操作简便等优点,因此在测定FT4等生化指标时被广泛应用。
需要指出的是,具体的实验步骤和试剂种类可能因具体试剂盒的不同而有所差异。
因此,在具体实验操作过程中,应当遵循所使用试剂盒的说明书,并按照实验室的标准操作程序进行。
总甲状腺素(TT4)测定试剂盒(化学发光免疫分析法)产品技术要求kr

总甲状腺素(TT4)测定试剂盒(化学发光免疫分析
法)
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;R1 组分应为棕色含固体微粒的液体,无板结、无絮状物。
R2 和R3 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
其中R1≥5.6mL,R2≥6.0mL,R3≥6.0mL。
2.3准确性
用T4 国家标准品配制成与试剂盒对应校准品定标曲线中相应的5 个浓度点进行分析测定,用双对数或其他适当的数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t 检验);以T4 国家标准曲线为对照,试剂盒定标曲线校准品的实测值与标示值的效价比在0.900~1.100 之间。
2.4最低检出限
最低检出限应不大于0.5 μg/dL。
2.5线性
试剂盒在0.5-24 μg/dL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 8%。
2.7批间差
变异系数CV 应≤ 15%。
2.8特异性
浓度不低于500ng/mL 的TT3,检测结果应不高于15.0ng/mL。
浓度不低于50ng/mL 的rT3,检测结果应不高于最低检出限。
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求爱康试剂

促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)1.性能指标1.1试剂条性能指标1.1.1外观试剂盒各组分应齐全、完整,液体无渗漏,包装标签应清晰、准确、牢固;试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
1.1.2空白限应不大于0.005μIU/mL。
1.1.3准确度1.1.3.1在试剂盒规定的线性区间内,检测促甲状腺素国家标准品,测定结果的相对偏差应在±10%范围内。
1.1.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差应在±10%范围内。
1.1.4线性区间试剂盒在0.02μIU/mL~100μIU/mL区间内,其线性相关系数(r)应不小于0.9900。
1.1.5分析内精密度变异系数(CV)应不大于8.0%。
1.1.6批间精密度变异系数(CV)应不大于15.0%。
1.1.7特异性a)含浓度不低于200 mIU/mL的FSH的零浓度TSH样本,检测结果应不高于0.005μIU/mL;b)含浓度不低于200 mIU/mL的LH的零浓度TSH样本,检测结果应不高于0.005μIU/mL;c)含浓度不低于1000mIU/m L的HCG的零浓度TSH样本,检测结果应不高于0.005μIU/mL。
1.2校准品性能指标1.2.1外观校准品应为无色或浅黄色透明液体。
1.2.2装量装量偏差应在±10%之内。
1.2.3准确度Cal 1、Cal 2实测值与标示值的偏差应在±10%以内。
1.2.4均一性对同一瓶校准品1、校准品2分别重复10次检测,对同一批次10瓶校准品1、校准品2进行检测,检测校准品1、校准品2瓶内差CV应≤10%,批内瓶间差CV应≤10%。
1.3质控品性能指标1.3.1外观质控品应为无色或浅黄色透明液体。
河南省药品监督管理局关于批准注册104个第二类医疗器械产品的公告(2024年9月)

河南省药品监督管理局关于批准注册104个第二类医疗器械产品的公告(2024年9月)
文章属性
•【制定机关】河南省药品监督管理局
•【公布日期】2024.10.11
•【字号】2024年第89号
•【施行日期】2024.10.11
•【效力等级】地方规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
河南省药品监督管理局关于批准注册104个第二类医疗器械
产品的公告(2024年9月)
2024年第89号
2024年9月,河南省药品监督管理局共批准注册第二类医疗器械产品104个,具体产品详见附件。
特此公告。
附件:2024年9月批准注册医疗器械产品目录
2024年10月11日
2024年9月批准注册医疗器械产品目录。
TSH促甲状腺素化学发光免疫定量检测探究

TSH促甲状腺素化学发光免疫定量检测的探究【摘要】目的:研制人血清中促甲状腺素(tsh)的化学发光免疫检测试剂盒。
方法:采用辣根过氧化物酶标记的抗tshβ亚单位特异性单克隆抗体(mab),与固相包被的抗tshα亚单位的另一mab配对,以鲁米诺作为底物,采用两步法建立了双位点夹心法人血清tsh的化学发光免疫定量分析法。
结果:该方法灵敏度为0.0788 miu/l,批内cv平均为4.7%,批间cv平均为8.4%,平均回收率为93.05%。
该检测与lh、 fsh和hcg无交叉反应。
【关键词】促甲状腺激素(tsh);化学发光免疫分析法;试剂盒甲状腺功能改变时, tsh的波动较甲状腺激素更迅速且明显,是反映下丘脑、垂体、甲状腺轴功能的敏感指标,因此采用灵敏度高的tsh免疫分析法具有重要的意义。
化学发光免疫分析(chemiluminescent immunoassay, clia)是一种灵敏的免疫分析方法,在免疫诊断试剂研制中已得到了广泛的应用[3]。
本研究根据化学发光免疫分析法的原理研制了血清tsh的检测试剂盒,与国内外同类产品相比具有简便、快捷、成本低等优点。
1 材料和方法1.1 材料 tsh单克隆抗体(mab)、 tsh标准品抗原和辣根过氧化物酶(hrp)为sigma公司产品,光免板为thermo electron公司产品,化学发光底物为biorad公司产品。
1.2 方法1.2.1 标准品的配制将tsh抗原标定后溶于小牛血清中,配制成含0.1, 1, 5, 20, 100 miu/l的标准溶液。
1.2.2 抗体包被板的制备将100μl含tsh mab(0.5mg/l)的ph9.6碳酸盐缓冲液加至包被板中, 37℃包被2 h,再用含10 mg/l bsa的0.01 mol/l ph7.4磷酸盐缓冲液于37℃封闭2 h后晾干备用。
1.2.3 酶标记物的制备 tsh的酶标记物采用过碘酸钠法制备,然后经0.01 mol/l ph7.4磷酸盐缓冲液透析过夜后,加入等量的甘油于-20℃保存备用。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
TSH操作规程

9.12如对实验结果有疑问,应重复试验。
9.13为保证实验的准确性,处理后得到的血样应不含纤维蛋白、红细胞、血脂等,并要保证血样吸取的量的准确性,否则容易引起测量值的差异。
9.14本试剂盒应置2—8℃保存,有效期参考瓶上所贴标签。
标准操作规程
版本:
执行日期:
共3页第2页
4.仪器(用户自备)
4.1时间分辨荧光分析仪;
4.2微孔洗涤机;
4.3微孔振荡器;
5.操作步骤
5.1.试剂的准备
(1)洗涤液:将40ml浓缩洗液和960ml蒸馏水在干净的洗液瓶中混合,作为工作洗涤液。
(2)将分析缓冲液、校准品、待测样品和所需数量的微孔反应条平衡至室温(20~25℃)。
血清促甲状腺激素(TSH)诊断试剂盒
时间分辨免疫荧光分析法
标准操作规程
文件编号
编写者
审核者
批准者
医院
医院:
科:
室:
血清促甲状腺激素(TSH)诊断试剂盒
时间分辨免疫荧光分析法
标准操作规程
版本:
执行日期:
共3页第1页
1.原理
本试剂盒采用双抗体夹心一步法。抗人TSH单抗包被于96孔荧免板,校准品或样品中的TSH与包被单抗及铕离子(Eu3+)标记的单抗于微孔内表面发生免疫反应,通过洗涤分离微孔表面的夹心免疫复合物与游离的标记单抗。微孔表面免疫复合物中的Eu3+被荧光增强液解离后形成稳定的荧光配合物,荧光强度与校准品或样品中的TSH浓度呈正比例,通过校准曲线可得出样品中TSH浓度。
2.样本处理
使用血清或用肝素抗凝的血浆。不能使用以EDTA或柠檬酸盐作抗凝剂的血浆样本。2~8℃条件下样本可保存二周,–20℃可保存更长时间。避免样本反复冻融。
两种化学发光分析仪检测促甲状腺激素(TSH)结果的比对分析

海峡药学2691年 第33卷第(期表6稳定性试验结果6 h 2h 4h 峰面积6h 8h 14 h 18 h 24hRSD ( % )494635462067494832496625 4968264456149606548627 6. 86表7含量测定结果批号樟脑含量( %)平均( % )RSD ( % )261595148724485246862454 354615961685.268525885229 6. 79261598428.4128. 55108.476. 23.2田静4〕测定樟脑时采用流动相为三氯甲烷-甲醇-水(4 :52:30),该流动相采用了毒性较大的三氯甲烷。
与文献4〕方 法比较,本方法的流动相更经济、环保。
作者简介:单景庆,男(268 -),毕业于天津医科大学,本科,职称:副 主任技师,研究方向:临床生物化学。
参考文献〔4田静,许亚玲,杨迪.反相高效液相色谱法测定复方薄荷脑滴鼻液中樟脑的含量〔J 〕.中国药房9525,2(12) :944W45.〔2〕陈念祖,王东蕾,黄滔敏■ RP-HPLC 法测定薄荷脑樟脑滴鼻液中樟脑的含量中国药房S069 96(6):453W55.4〕谢军,彭贤东,龙凤,等.复方薄荷脑滴鼻液的质量控制〔〕.中国药业 9612,44) :47T8.〔〕王慧•紫外-可见分光光度法测定复方薄荷脑滴鼻液中樟脑的含量4〕海峡药学,62,6(4 : 85 96.4〕王爱武,刘帅S 长鉴,等•复方薄荷脑滴鼻液质量控制方法的改进〔〕•中国医院用药评价与分析,2513,4(7) :628W39•J 6〕邱财荣,殷萌,孔爱英,等•气相色谱法测定复方薄荷脑滴鼻液中薄荷脑和樟脑的含量〔〕•西北国防医学杂志,64 96(9):584- 5852〔7〕姚鑫,程宗琦,姜玮,等•气相色谱法测定复方薄荷脑滴鼻液中樟脑和薄荷脑的含量4〕西北药学杂志,62 04(5 ):594999.4〕马海平,王曼,朱军,等•气相色谱法检测复方薄荷脑滴鼻剂薄荷脑和樟脑的含量4〕湖北医药学院学报961908(6) :561965.•临床药学•两种化学发光分析仪检测促甲状腺激素(TSH)结果的比对分析单景庆(天津市宝坻区宝平医院,天津391876)摘要:目的 通过比较两台不同化学发光免疫分析仪(Ruhc hUas c411全自动化学发光分析仪和雅培U906SR 全自动化学发光分析仪)的促甲状腺激素(TSH)检测结果,验证两种不同分析仪检测促甲状腺激素(TSH)的准确性。
促甲状腺激素测定试剂盒(时间分辨荧光免疫分析法)产品技术要求广州市丰华生物

2. 性能指标2.1 装量试剂盒各溶液最大允许负偏差为 6.0%。
2.2 外观试剂盒中校准品为无色或者淡黄色液体,其它液体组份试剂均为澄清透明;微孔反应板应封口良好,无破损。
2.3 灵敏度试剂盒的灵敏度应不高于0.25μIU/ml。
2.4 特异性用黄体生成素(hLH)250U/L 进行检测,测得表观hTSH 浓度不高于0.25μIU/ml。
用促卵泡激素(hFSH)250U/L 进行检测,测得表观hTSH 浓度不高于0.25μIU/ml。
用绒毛膜促性腺激素(hCG)10000U/L 进行检测,测得表观hTSH 浓度不高于0.25 μIU/ml。
2.5 线性相关系数试剂(盒)的线性范围(0.25 μIU/ml~324 μIU/ml)内的线性应符合如下要求:a)线性相关系数r≥0.990;b)检测浓度<100μIU/ml 的hTSH 时,线性的绝对偏差应在±10μIU/ml 范围内;检测浓度≥100μIU/ml 的hTSH 时,线性相对偏差不超过±20%。
2.6 测量准确度测定浓度为50μIU/ml(允许偏差为±20%)的hTSH 国家标准品,测定结果的相对偏差应在±10%范围内。
2.7 测量精密度2.7.1 批内不精密度试剂盒的批内不精密度(CV)应不超过15.0%;2.7.2 批间不精密度试剂盒的批间不精密度(CV)应不超过20.0%。
2.8 质控品测定值用三种不同浓度的质控品进行测定,测定结果应在允许范围内。
2.9 HOOK 效应检测浓度为2000μIU/ml 的hTSH 时,其荧光值仍高于324μIU/ml 校准品的荧光值。
总甲状腺素(TT4)测定试剂盒(磁微粒化学发光法)产品技术要求hkt

总甲状腺素(TT4)测定试剂盒(磁微粒化学发光法)组成:适用范围:本试剂盒用于体外定量测定人血清中总甲状腺素(TT4)的含量。
1.1规格100人份/盒、500人份/盒。
1.2主要组成成分注:校准品靶值、质控品质控范围批特异,具体浓度详见标签。
2.1 外观试剂盒各组分应齐全、完整,液体无渗漏;各液体组分应澄明,无沉淀或絮状物。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至中国食品药品检定研究院提供的国家标准品(编号:150551)。
2.3 准确度试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用Log-Logit模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.4 线性在线性范围 [20,320]ng/mL内,用Log(x)-Logit (y)模型拟合,线性相关系数的绝对值(|r|)应不低于0.9900。
2.5 重复性分别检测高值和低值两个样本,重复性(CV)应不高于8.0%。
2.6 批间差在三个不同批次产品之间,样本测定结果的变异系数(CV)应不高于15.0%。
2.7 空白限空白限应不高于10.0ng/mL。
2.8 特异性2.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性稳定性可选用以下其中一种方法进行验证:2.10.1 2℃~8℃储存,有效期12个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2 取有效期内的试剂盒在37℃放置7天,分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
促甲状腺素吖啶酯化学发光免疫分析方法的建立

促甲状腺素吖啶酯化学发光免疫分析方法的建立周齐洋;徐海伟【摘要】目的建立一种定量检测人血清促甲状腺素(TSH)的方法.方法根据双抗体夹心法实验原理,分别用吖啶酯和生物素标记两株不同的单克隆抗体,链霉亲和素包被微粒,通过链霉亲和素-生物素系统分离固相和液相完成检测.结果本方法的最低检测限为0.01 μIU/mL,线性范围0.3~60μIU/mL,批内变异为1.9%~2.3%,总变异为6.4%~8.6%,与ROCHE公司的促甲状腺素检测试剂盒(电化学发光法)比对,相关系数r=0.9935.结果本方法的各项指标均能满足临床检测的要求,可以临床推广应用.【期刊名称】《标记免疫分析与临床》【年(卷),期】2015(022)012【总页数】4页(P1283-1286)【关键词】促甲状腺素;化学发光;免疫定量分析【作者】周齐洋;徐海伟【作者单位】江苏省医疗器械检验所,江苏南京210012;苏州长光华医生物试剂有限公司,江苏苏州215163【正文语种】中文TSH的主要生理作用是调节甲状腺激素的合成与分泌,血液中甲状腺激素水平与腺垂体分泌TSH的量之间有负反馈抑制关系。
测定血清中TSH的浓度是判断甲状腺功能是否正常的首选指标,也是研究下丘脑-垂体-甲状腺轴反馈调节机制等的重要参数,临床上多用于甲状腺功能亢进(甲亢)和减退(甲减)的诊断、原发与继发性甲减的鉴别诊断、监测甲亢和甲减的疗效、亚临床甲亢的诊断、新生儿甲低的筛查以及垂体TSH瘤的实验室诊断等。
本文根据化学发光免疫定量分析法的原理,采用吖啶酯化学发光免疫分析技术,用双抗体夹心法建立了测定人血清中TSH含量的方法,并通过对标记抗体稀释度、加样量、反应时间等条件选择实验,对本方法的各项性能指标进行了分析,建立了参考范围。
现将实验结果报道如下。
材料与方法1 实验仪器和材料促甲状腺素单克隆抗体和抗原购自Fitzgerald公司,吖啶酯和生物素购自Sigma 公司,化学发光底物液及链霉亲和素包被的磁微粒由苏州长光华医生物试剂有限公司提供,其他试剂均为分析纯。
促甲状腺素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求yuande

促甲状腺素(TSH)测定试剂盒(化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清或血浆中的TSH的含量。
1.1 产品规格
试剂盒规格为48人份/盒、96人份/盒。
1.2主要组成成分
促甲状腺素(TSH)测定试剂盒(化学发光免疫分析法)主要组成成分
a) 酶结合物
以含牛血清白蛋白的缓冲液配制的连接HRP的TSH单克隆抗体,其中含
ProClin300做为防腐剂。
b) 校准品
校准品主要以小牛血清为稀释液,其中含ProClin300做为防腐剂,校准品A~F 中含TSH的目标浓度分别约为0、0.25 mIU/L、0.5 mIU/L、4.0 mIU/L、
10 mIU/L、50 mIU/L。
校准品具体浓度详见标签及试剂盒参数IC卡。
c) 发光液
发光液A主要成份为鲁米诺,发光液B主要成份为过氧化脲,两者均以pH8.6
的Tris-HCl缓冲液配制。
d) 包被微孔板
包被有TSH单克隆抗体白色聚苯乙烯微孔板,用铝箔袋真空包装。
e) 质控品(备选)
以正常人血清为基质制备的冻干品,其中含ProClin300做为防腐剂,其中值的靶值浓度范围QCⅠ为1.00 mIU/L~3.00 mIU/L,QCⅡ为5.00 mIU/L~8.50 mIU/L。
质控品具体浓度详见质控品参数表。
不同批号试剂盒中的相同组分不能互换。
化学发光免疫测定技术在甲状腺肿瘤检验中的价值分析

医学食疗与健康 2023年7月上第21卷第19期·实验研究·作者简介:闭珏(1986.01—),女,本科学历,主管技师,研究方向:临床免疫检验。
化学发光免疫测定技术在甲状腺肿瘤检验中的价值分析闭珏…聂兴旺(贵州医科大学第二附属医院(黔东南州第二人民医院),贵州 凯里 556000)【摘要】目的:对甲状腺肿瘤检验中,化学发光免疫测定技术实施价值进行分析。
方法:2020年1月至2022年1月,将贵州医科大学第二附属医院接收的疑似甲状腺肿瘤患者50例作为此次评估对象,以病理学诊断结果为金标准,分别对患者实施(chemiluminescence…immunoassay,CLIA),对上述措施的检验价值进行评估,分析检验措施实施后的甲状腺球蛋白水平及个数、甲状腺激素、特异度、敏感性、准确性差异。
结果:CLIA 得到的TSH (3.42±0.25)μIU/mL、FT4(83.33±7.25)pmol/L、FT3(36.12±5.59)pmol/L ;甲状腺球蛋白水平(695.12±57.12)μg/L ;与金标准诊断相比,CLIA 的阳性检出率与之一致性较高(P >0.05),且特异度、敏感性、准确性均较高。
结论:CLIA 检验价值高,具有较高的特异性、敏感性、准确性,对疾病后续诊断以及针对性治疗具有指导意义。
【关键词】甲状腺肿瘤;CLIA ;准确性;甲状腺激素;特异性;敏感性【中图分类号】R446…【文献标识码】A…【文章编号】2096-5249(2023)19-0070-04甲状腺肿瘤是一种临床常见的肿瘤疾病,发病率较高。
临床研究结果显示,疾病发病后,在身体前颈中央位置有明显的肿块,肿块组织可随吞咽运动上下移动。
随着病情的发展及恶化,患者会出现吞咽困难和呼吸障碍等症状表现,对患者的生活质量、机体健康水平产生消极影响。
流行病学调查发现,近年来甲状腺肿瘤的发病率较高,且呈现出逐渐增加的趋势,疾病多发人群为15-40岁,成为影响居民身心健康的公共卫生疾病[1]。
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求dacheng
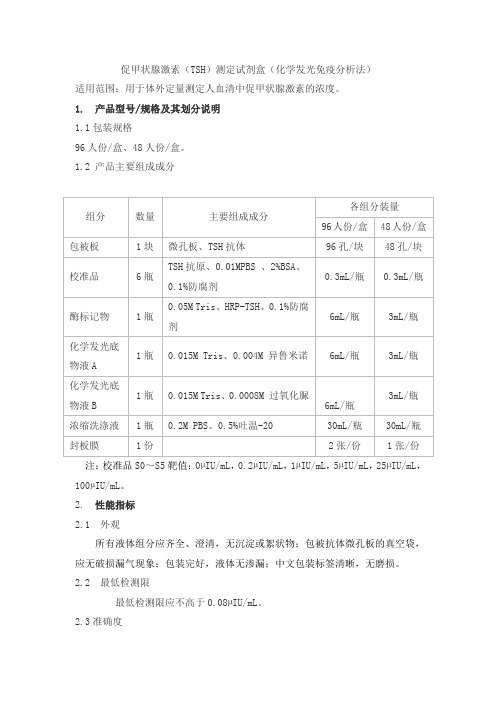
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中促甲状腺激素的浓度。
1. 产品型号/规格及其划分说明1.1包装规格96人份/盒、48人份/盒。
1.2 产品主要组成成分注:校准品S0~S5靶值:0µIU/mL,0.2µIU/mL,1µIU/mL,5µIU/mL,25µIU/mL,100µIU/mL。
2. 性能指标2.1 外观所有液体组分应齐全、澄清,无沉淀或絮状物;包被抗体微孔板的真空袋,应无破损漏气现象;包装完好,液体无渗漏;中文包装标签清晰,无磨损。
2.2 最低检测限最低检测限应不高于0.08µIU/mL。
2.3准确度试剂盒内校准品与相应浓度的国家标准品(编号:150530)同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以TSH国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.4 线性[0.2,100]µIU/mL浓度范围内,相关系数(r)绝对值应不低于0.9900。
2.5 重复性用高低两个浓度的样本,各重复检测10次,变异系数(CV)应不大于15%。
2.6 批间差用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的批间变异系数(CV)应不大于20.0%。
2.7 特异性特异性应符合如下要求:a)不低于浓度为200IU/L的促卵泡生成激素(FSH),在本试剂盒上的测定结果应不高于试剂盒的最低检测限水平;b)不低于浓度为200IU/L的促黄体生成激素(LH),在本试剂盒上的测定结果应不高于试剂盒的最低检测限水平;c)不低于浓度为1000IU/L的人绒毛膜促性腺激素(HCG),在本试剂盒上的测定结果应不高于试剂盒的最低检测限水平。
2.8 稳定性2℃~8℃放置8个月后,测定结果应符合2.1~2.5各项要求。
促甲状腺激素受体化学发光的原理

促甲状腺激素受体化学发光的原理
促甲状腺激素受体(thyroid-stimulating hormone receptor,TSHR)化学发光的原理主要包括以下几个步骤:
1. 样品制备:将待测物(可能是生物体内的甲状腺激素或TSHR样本)进行提取、纯化和标记处理。
2. 受体结合:将待测物与标记的TSHR结合。
标记可以是发
光染料、荧光标记物、放射性同位素等,用于发出可被探测的信号。
3. 受体结合过程中形成复合物:当TSHR与待测物发生结合后,将形成一个复合物。
4. 反应物添加:向反应体系中加入荧光增强剂、阻尼剂、缓冲液等物质,以提高化学发光效果。
5. 激发发光:在适当的条件下,使复合物受到激发(例如加热、加入化学试剂等),进而产生发光现象。
这是由于标记物本身的特性决定的,例如染料的荧光性质或放射性同位素的放射性衰变等。
6. 光信号检测:使用光学设备检测生成的发光信号,如荧光光子计数、放射性计数等。
根据信号的强度或数量,可以确定待测物浓度或受体结合程度等信息。
整个过程通过化学发光的原理实现了对促甲状腺激素受体的检
测和定量分析,有助于了解甲状腺激素调节机制以及相关疾病的诊断和治疗。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
促甲状腺素化学发光免疫定量检测试剂盒的研制
作者:王青, 王缦*, 魏东芝, 陈寒柏, 张黎明作者单位:华东理工大学生物化学与分子生物学系, 上海 200237; 上海科华生物工程股份有限公司, 上海 200233
【摘要】目的: 研制人血清中促甲状腺素(TSH)的化学发光免疫检测试剂盒。
方法: 采用辣根过氧化物酶标记的抗TSHβ亚单位特异性单克隆抗体(mAb), 与固相包被的抗TSHα亚单位的另一mAb配对, 以鲁米诺作为底物, 采用两步法建立了双位点夹心法人血清TSH的化学发光免疫定量分析法。
结果: 该方法灵敏度为0.0788 mIU/L, 批内CV平均为4.7%, 批间CV平均为8.4%, 平均回收率为93.05%。
该检测与LH、 FSH和HCG无交叉反应。
部分实验样品的测试结果显示该试剂与国外同类试剂(雅培architect i2000)的测定结果明显相关(r=0.984)。
结论: 该方法具有较高的灵敏度、重复性和准确度, 与其他同类产品相比简便、快捷、成本低, 适于临床检测和科研应用。
【关键词】促甲状腺激素(TSH) 化学发光免疫分析法试剂盒
促甲状腺激素(thyroid stimulating hormone, thyrotropin, TSH)是一种由垂体前叶分泌的糖蛋白激素, 由α和β2个亚基组成, 相对分子质量(Mr)为28000[1]。
TSH本身受下丘脑分泌的TSH释放激素TRH的调控, TSH的主要生理作用是调节甲状腺激素的合成与分泌, 血液中甲状腺激素水平与腺垂体分泌TSH的量之间有负反馈抑制关系[2]。
甲状腺功能改变时, TSH的波动较甲状腺激素更迅速且明显, 是反映下丘脑垂体甲状腺轴功能的敏感指标, 因此采用灵敏度高的TSH免疫分析法具有重要的意义。
化学发光免疫分析(chemiluminescent immunoassay, CLIA)是一种灵敏的免疫分析方法, 在免疫诊断试剂研制中已得到了广泛的应用[3]。
本研究根据化学发光免疫分析法的原理研制了血清TSH的检测试剂盒, 与国内外同类产品相比具有简便、快捷、成本低等优点。
1 材料和方法
1.1 材料 TSH单克隆抗体(mAb)、 TSH标准品抗原和辣根过氧化物酶(HRP)为Sigma公司产品, 光免板为Thermo Electron公司产品, 化学发光底物为BioRad公司产品。
1.2 方法
1.2.1 标准品的配制将TSH抗原标定后溶于小牛血清中, 配制成含0.1, 1, 5, 20, 100 mIU/L的标准溶液。
1.2.2 抗体包被板的制备将100μL含TSH mAb(0.5mg/L)的pH9.6碳酸盐缓冲液加至包被板中, 37℃包被2 h, 再用含10 mg/L BSA的0.01 mol/L
pH7.4磷酸盐缓冲液于37℃封闭2 h后晾干备用。
1.2.3 酶标记物的制备 TSH的酶标记物采用过碘酸钠法制备, 然后经0.01 mol/L pH7.4磷酸盐缓冲液透析过夜后, 加入等量的甘油于-20℃保存备用。
1.2.4 检测方法将50 μL待测样品或标准品加入包被TSH的光免板中, 37℃温育30 min, 弃反应液, 用洗涤液(含0.5 mg/L Tween20的0.01 mol/L pH7.4磷酸盐缓冲液)洗5次, 加酶标记物50 μL, 37℃温育30 min后同样用洗涤液洗5次, 然后加入发光底物于5~10 min内测定各孔的发光值RLU。
样
本中的TSH浓度依据由标准品TSH浓度和对应的RLU建立的数学模型进行定量。
2 结果
2.1 动力学性质在HRP鲁米诺H2O2发光体系中, 将不同量的免疫复合物加入发光液中, 发光强度(RLU)随反应时间而变化。
10 min后RLU接近峰值, 在5~15 min内RLU较为稳定, 随后开始缓慢下降。
2.2 反应条件优化
2.2.1 加样量对RLU的影响样本和酶标记物的加样量分别为50 μL和
100 μL考查标准品(0、 0.1、 1、 5、 20、 100 mIU/L)RLU, 发现加样量为100 μL与50 μL RLU相差不大, 说明50 μL的加样量反应能达到平衡(图1)。
图1 加样量对RLU的影响(略)
2.2.2 反应模式对RLU的影响采用二步法。
第一步: 加入标准品和待测样品后, 将反应体系在37℃分别温育15、 30、 45、 60 min; 第二步: 加入酶标记抗体后, 将反应体系在37℃分别温育15、 30、 45、 60 min。
结果表明温育时间为30 min时反应皆能达到平衡(图2)。
图2 温育时间对RLU的影响(略)
A: 第一步温育时间对RLU的影响; B: 第二步温育时间对RLU的影响.
2.3 稳定性将试剂盒放置于37℃ 6 d后, 比较与放置前参考标准品各点RLU值, 参考标准品各点RLU值未见明显降低, 且本底发光值无明显升高, 表
明试剂盒标准曲线无明显漂移, 满足稳定性要求。
2.4 方法学评价
2.4.1 标准曲线与灵敏度在设定的免疫反应和发光条件下, 以标准血清的浓度(0~100 mIU/L)制作的标准曲线见图3。
同时测定20个零标准, 用零标准均值加上2倍标准差, 计算出此方法的灵敏度为0.0788 mIU/L。
图3 TSH标准曲线(略)
2.4.2 精密度取低(4.44 mIU/L)、中(19.45 mIU/L)和高(79.23 mIU/L)3种TSH浓度各重复测定10次, 测定批内CV分别为6.2%、
3.3%和
4.6%, 平均
为4.7%。
隔日分别进行5次独立试验, 测批间CV分别为8.3%、 7.6%和9.3%, 平均为8.4%。
2.4.3 准确性在已知TSH浓度的血清中加入3种不同浓度的标准血清,测
定加入回收率为93.05%。
将TSH浓度为44.42 mIU/L的血清用标准零血清分别
按1/2、 1/4、 1/8、 1/16稀释, 测量各稀释浓度的TSH含量, 测定稀释回收率为99.86%。
2.4.4 特异性在已知浓度的血清样品中加入不同浓度的LH、 FSH和HCG 后, 对TSH的测定无干扰。
2.4.5 与进口试剂的比较将研制的TSH CLIA定量检测试剂盒与Abbott architect i2000全自动化学发光系统共同对30例正常人、 20例甲亢及80例甲低临床标本进行检测, 通过数据分析, 得出两个检测系统所得数值具有明显
相关性(图4)。
图4 与Abbott全自动化学发光系统相关性曲线(略)
3 讨论
血清促甲状腺素定量检测的方法主要有放射免疫法、酶联免疫法、时间
分辨荧光免疫法和化学发光免疫法等几种[4]。
考虑到目前化学发光和时间分辨荧光分析仪器几乎全部为国外厂商生产, 而绝大多数厂商采用仪器加试剂盒捆
绑销售的垄断模式, 并在仪器中人为设置排它性检测程序, 从而抬高了配套试
剂盒价格, 增加了检测成本, 所以本工作旨在开发国产低价、稳定、通用的
人血TSH CLIA试剂盒。
首先对读数时间进行了动力学研究, 发现其在5~15 min内RLU处于平台期,反应时间选择10 min。
其次对反应条件进行了实验摸索, 在不同的温育时间和加样量的条件下, 各RLU值相差不大, 因此选择了50 μL
的加样量与两步共1 h的反应时间。
我们研制的TSH化学发光免疫测定试剂盒通过方法学鉴定表明无论是灵敏度、准确性、特异性等技术指标均达到了临床诊断的要求[5]; 同时该方法具有操作方便, 反应时间短和成本低等优点, 具有较广阔的市场应用前景。
【参考文献】
[1] Hay ID, Bayer MF, Kaplan MM, et al. American thyroid association assessment of current free thyroid hormone and
thyrotropin measurements and guidelines for future clinical assays[J]. Clin Chem, 1991, 37(11): 2002-2008.
[2] 尹东光, 贺佑丰, 刘一兵, 等. 促甲状腺激素化学发光免疫分析的研
究[J]. 分析化学研究报告, 2004, 7(32): 893-896.
[3] 叶成果. 促黄体生成素化学发光免疫定量检测试剂盒的研制[J]. 河南科技大学学报, 2004, 22(2): 83-84.
[4] 任均田. 促甲状腺素实验检测进展[J]. 国外医学·放射医学核医学分册, 2002, 26(2): 57-60.
[5] 王永宁, 李荣秀, 李成武, 等. 微粒子化学发光免疫测定促甲状腺素
敏感性方法的建立和应用[J]. 细胞与分子免疫学杂志, 2004, 20(5): 629-631.。
