各种细胞转染方法比较
细胞转染实验总结

细胞转染实验总结引言细胞转染是生物学研究中常用的实验技术,用于将外源DNA、RNA或蛋白质引入到目标细胞中。
通过细胞转染,可以实现基因表达、基因敲除、蛋白质定位等多种研究目的。
本文总结了细胞转染实验的基本原理、常用方法和注意事项。
基本原理细胞转染实验的基本原理是通过物理或化学方法将外源DNA、RNA或蛋白质传递到目标细胞内。
细胞内的转染物质可以在细胞内进行表达、干扰或定位,从而实现对目标细胞功能的研究。
常见的细胞转染方法包括:1.电穿孔法:通过应用电流使细胞膜发生临时孔洞,从而使转染物质进入细胞内。
2.化学转染法:利用聚合物、脂质体等化学物质,将目标物质载体化,并与细胞膜结合,实现内源化学转染。
3.病毒载体介导转染法:利用病毒(如腺病毒、逆转录病毒等)作为载体,传递目标物质到细胞内。
常用方法1. 电穿孔法电穿孔法是细胞转染中常用的物理方法之一。
通过应用高电压或脉冲电场,可以使细胞膜发生临时性孔洞,从而使外源DNA、RNA或蛋白质进入细胞内。
常用的电穿孔方法包括:•电转染:将转染物质与细胞悬浮液混合后施加电脉冲,使细胞膜发生孔洞并吸收转染物质。
•静电转染:将转染物质与带正电荷的载体(如聚乙烯亚胺)混合后,与带负电荷的细胞膜相互吸引,从而将转染物质导入细胞内。
2. 化学转染法化学转染法是一种通过化学物质介导的细胞转染方法。
常用的化学转染法有:•使用聚合物:聚合物(如聚乙烯亚胺、聚合丙烯酸等)能与转染物质结合成复合物,使其稳定且易于细胞摄取。
•脂质体转染:脂质体是由磷脂、胆固醇等成分构成的脂质双层结构,可以包裹转染物质形成脂质体-转染物复合物,通过与细胞膜融合实现内源转染。
3. 病毒载体介导转染法病毒载体介导转染法是细胞转染中较常用的方法之一。
常见的病毒载体包括:•腺病毒:腺病毒是一种双链DNA病毒,可以携带大片段的外源DNA,并有效地传递到目标细胞内。
•逆转录病毒:逆转录病毒(如 lentivirus、retrovirus等)可以将外源RNA逆转录成DNA,然后整合到宿主细胞基因组中。
细胞转染的原理操作步骤以及小技巧

细胞转染的原理操作步骤以及小技巧细胞转染是一种将外源DNA、RNA、蛋白质等分子导入到细胞内的实验技术。
这种技术可以用来研究基因功能、发现新的信号通路和治疗基因疾病等。
下面将介绍细胞转染的原理、操作步骤以及一些小技巧。
一、细胞转染的原理:细胞转染主要通过三种方法实现:物理法、化学法和生物学法。
1.物理法:通过高压、电穿孔、微射流等方式,使细胞膜发生瞬时破裂,从而使DNA、RNA等外源分子进入细胞。
常用的物理法有电穿孔法和基因枪法。
2.化学法:通过化学物质,如聚吡咯、脂质体等,使外源分子与细胞膜结合,从而实现转染。
常用的化学法有聚乙烯亚胺(PEI)法、磷酸钙共沉淀法等。
3.生物学法:通过利用病毒载体将外源基因导入目标细胞,实现基因的转移。
常用的生物学法有腺相关病毒(AAV)转染、逆转录病毒(RETRO)转染等。
二、细胞转染的操作步骤:1.细胞的预处理:根据细胞类型和实验要求,将细胞培养至合适的状态。
通常细胞应处于快速生长期,但还未达到接触抑制的阶段。
对于一些特定的细胞,如悬浮细胞,可能需要将其转接至适当的培养基中。
2.外源分子的准备:将外源DNA、RNA等转染载体制备好。
如将DNA克隆并纯化至高质量的质粒DNA,或将RNA合成或纯化。
根据实验要求选择合适的转染载体。
3.转染方法的选择:根据实验要求选择合适的转染方法,如物理法、化学法或生物学法。
一般情况下,物理法适用于悬浮细胞,化学法适用于贴壁细胞,而生物学法适用于大多数细胞类型。
4.细胞转染操作:a.物理法:i.电穿孔法:将细胞悬浮于含有外源分子的缓冲液中,然后通过电穿孔仪的电极或电穿孔板进行电穿孔。
ii. 基因枪法:使用基因枪将外源分子直接“枪”入目标细胞中。
b.化学法:i.PEI法:将PEI与外源DNA或RNA按一定比例混合,在适当条件下形成复合物,然后添加至目标细胞中。
ii. 磷酸钙共沉淀法:将外源DNA与磷酸钙按比例混合,并静置形成磷酸钙- DNA沉淀,然后加入至目标细胞中。
各种转染方法比较

各种转染方法比较
转染是一种常见的基因表达技术,在微生物、植物、动物等生物的基
因组研究与分析中被广泛应用。
它能够将外源DNA片段引入生物体,从而
产生基因表达,使得目的基因被特定的染色体位置激活。
此外,在转染中
作为功能基因的外源基因,可以约束提示其他的基因表达。
目前,转染在科学领域的应用众多,主要有包二聚体转染、质粒转染、酶联转染、质粒转化、脂质体转染、病毒转染等几种技术。
1、包二聚体转染
包二聚体转染是由三部分组成:DNA片段,10%二聚体和CaCl2溶液,将需要转染的DNA片段溶解在CaCl2溶液中,添加二聚体并调节pH值,
即可形成包二聚体复合体,将复合体注入细胞内,从而达到转染目的。
应
用包二聚体的转染方法可以很好地穿越细胞膜,可以达到突变外源基因的
目的,并且细胞损伤小,可以获得相对高的转染能力。
2、质粒转染
质粒转染是一种常见的转染技术,它是由PEG6000、KCl、CaCl2等混
合物组成,将要转染的DNA与混合物结合,然后把质粒-DNA复合物注入
细胞内,即可转染。
U937单核细胞几种不同转染方法的比较

Co p r s n o he t a s e to f i i nc f m a io f t r n f c i n e fc e y o U9 7 m o o y e y d f e e tm e h d 3 n c t s b if r n t o s
[ btat Obet e T rn fc rcmbn n ts d pRE 2E F - P no U9 7 mo oye y A s c] r jci o ta set eo ia tpami I S ~ G P TF I it 3 n c tsb v 2
dfee tm eh d ,a d t c ur h t o t etrta se t n ef in y M eh d Th el r i r n t o s n o a q i t eme h d wih b te r n fci fi e c . f e o c to s e c l we e s dvd d it r u s ta se td b ifrn to swi lcr p r t n, Efe tn r n fcin r a e t iie n o6 g o p r n fce y dfee tme h d t ee to o a i h o fce e ta se t e g n , o
将 重 组 pR S G PT P一 粒 体 外 成 功 转 染 人 U9 7单 核 细 胞 中 , 过 优 I E 2E F F I 2质 3 通
化 转 染 方 法 提 高 转 染 效 率 、 低 对 细 胞 活 力 的 影 响 , 基 因 治 疗 提供 了实 验 基 础 。 降 为
【 键词 1 U 3 关 9 7单 核 细 胞 ; 转 染 效 率 ; 电穿 孔 ; 脂 质 体 【 图分 类号 】 Q 3 3 3 中 4 . 7 【 文献 标 志码 】 A
各种转染方法比较

各种转染方法比较不同的实验室转染方法选择会依赖于多个相关因素,如目标细胞类型、转染效率、细胞毒性、需求的表达时间、实验的规模和预算等。
以下是一些常见的转染方法的比较:1. 离子交换法(Calcium phosphate transfection)离子交换法是最早开发和使用的转染方法之一、它使用磷酸钙和DNA或RNA的复合物在细胞表面形成凝析沉淀物。
该方法简单、经济且较为普遍,适用于许多细胞类型。
然而,它的转染效率较低,存在较多的细胞毒性。
2. 迷走转染法(Lipofection)迷走转染法是当前最常用的转染技术之一,通过磷脂体(例如Lipofectamine)与质粒DNA形成复合物。
该方法转染效率高,而且适用于许多类型的细胞,包括哺乳动物和非哺乳动物。
然而,迷走转染法存在一些限制,如细胞毒性、稳定性较差,和细胞特异性。
3. 电穿孔法(Electroporation)电穿孔法是通过应用电场使细胞膜暂时性孔化来实现转染效果。
它可以用于转染各种类型的细胞,包括哺乳动物、鸟类和植物。
电穿孔法的转染效率高,但存在一定的细胞毒性和细胞损伤风险。
此外,电穿孔设备的成本较高,需要专门训练的技术人员来操作。
4. 病毒载体转染法(Viral vector transfection)病毒载体转染法使用经修饰的病毒作为转染载体,可实现高效的基因传递和表达。
常用的病毒载体包括腺病毒、衣壳病毒和逆转录病毒。
这些病毒对于不同类型的细胞具有不同的亲和力和转染效率。
然而,病毒载体转染法的主要限制是细胞对病毒的感染能力,以及在临床应用中可能引发的安全性问题。
5. 直接注射法(Direct microinjection)直接注射法是一种机械刺伤细胞膜直接将DNA注入细胞的方法。
这种方法对于特定的细胞类型具有高效转染的能力,如哺乳动物受精卵和干细胞。
它可以实现精确控制和单细胞水平的转染,但需要昂贵的设备和专业技能。
总结起来,转染方法的选择应根据实验的具体需求来进行。
各种转染方法比较

各种转染方法比较转染是将外源DNA或RNA导入体细胞的一种常用技术,用于研究基因功能、疾病机制、基因治疗等领域。
常用的转染方法包括化学法、电穿孔法、病毒载体介导转染和生物矢量直接注射法等。
下面将对这些转染方法进行详细比较。
1.化学法:化学法是最简单、最常用的转染方法之一,主要通过化学试剂与DNA或RNA形成复合物,进而被细胞摄取。
常用的化学试剂有钙磷酸盐、聚乙烯亚胺(PEI)、脂质体、高分子聚合物等。
化学法的优势在于易操作、适用于不同细胞类型,且无需特殊设备。
但其转染效率相对较低,引起细胞毒性的风险较高。
2.电穿孔法:电穿孔法又称为电转染法,通过利用电场作用使细胞膜发生瞬时通透性,使外源DNA或RNA进入细胞。
这种方法可使用电脉冲仪或特殊转染设备进行操作,适用于多种细胞类型。
相比于化学法,电穿孔法的转染效率更高,但对细胞的毒性稍高。
3.病毒载体介导转染:病毒载体介导转染是一种高效的转染方法,常用的病毒载体有腺病毒(Adenovirus)、腺相关病毒(Adeno-associated virus,AAV)、逆转录病毒(Retrovirus)和慢病毒(Lentivirus)等。
这些病毒载体不仅能将外源DNA或RNA导入细胞,还能使其在细胞内稳定表达。
病毒载体介导转染的优势在于高转染效率、稳定表达,适用于许多细胞类型。
然而,为了避免潜在的致病性和免疫反应,需要选择无毒性、无致病性的病毒载体。
4.生物矢量直接注射法:生物矢量直接注射法是将外源DNA或RNA直接注射到体内,让其进入目标细胞。
这种方法适用于许多动物模型研究,如小鼠、斑马鱼等。
生物矢量直接注射法的优势在于转染效率高、实验操作简单,但对于人体病理研究等实验要求较高的场景,其应用范围较窄。
根据以上比较,选择适合自己研究需求和细胞类型的转染方法非常重要。
需要考虑的因素包括转染效率、细胞毒性、操作难度、成本等。
在实际应用中,有时也可结合多种方法,例如将化学法与电穿孔法相结合,能够提高转染效率。
各种细胞转染方法比较
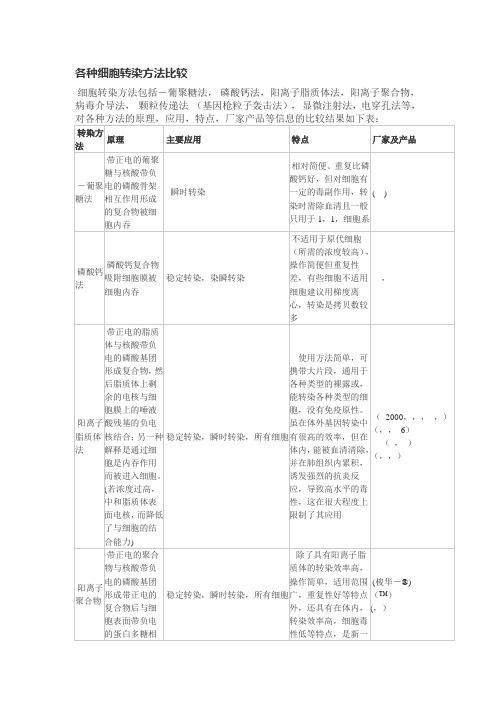
相对简便、重复比磷酸钙好,但对细胞有一定的毒副作用,转染时需除血清且一般只用于1,1,细胞系
( )
磷酸钙法
磷酸钙复合物吸附细胞膜被细胞内吞
稳定转染,染瞬转染
不适用于原代细胞(所需的浓度较高),操作简便但重复性差,有些细胞不适用
细胞建议用梯度离心,转染是拷贝数较多
,
阳离子脂质体法
带正电的脂质体与核酸带负电的磷酸基团形成复合物,然后脂质体上剩余的电核与细胞膜上的唾液酸残基的负电核结合;另一种解释是通过细胞是内吞作用而被进入细胞。(若浓度过高,中和脂质体表面电核,而降低了与细胞的结合能力)
稳定转染,瞬时转染,所有细胞
使用方法简单,可携带大片段,通用于各种类型的裸露或,能转染各种类型的细胞,没有免疫原性。虽在体外基因转染中有很高的效率,但在体内,能被血清清除,并在肺组织内累积,诱发强烈的抗炎反应,导致高水平的毒性,这在很大程度上限制了其应用
(2000,,,,)
(,,6)
(,)
(,,)
阳离子聚合物
带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。
稳定转染,瞬时转染,所有细胞
除了具有阳离子脂质体的转染效率高,操作简单,适用范围广,重复性好等特点外,还具有在体内,转染效率高,细胞毒性低等特点,是新一代的转染试剂。
(梭华-®)
(™)(,)病Fra bibliotek介导法逆转录病毒()
通过病毒中膜糖蛋白和宿主细胞表面的受体相互作用而进入宿主细胞,之后反转入酶启动合成并随机整合到宿主基因组中
稳定转染,特定宿主细胞
可用于难转染的细胞、原代细胞,体内细胞等,但携带基因不能太大(<8),细胞需处分裂期,需考虑安全因素
转染细胞的技术分类及效率

转染细胞的技术分类及效率
转染细胞是指向细胞引入外源DNA、RNA或蛋白质的过程,用于
基因编辑、基因表达研究等领域。
转染技术根据介导物质的不同可
以分为化学转染、生物转染和物理转染三种主要分类。
化学转染是利用化学试剂将外源DNA或RNA导入细胞内的一种
方法,常用的试剂包括聚乙烯亚胺(PEI)、脂质体、钙磷沉淀法等。
这些试剂能够与DNA或RNA形成复合物,通过与细胞膜融合或内吞
作用将外源物质导入细胞内。
化学转染的优点是操作简单、成本低廉,但效率较低,且对细胞有一定的毒性。
生物转染是利用病毒或细菌等生物载体将外源DNA导入细胞内
的方法。
常用的生物载体包括腺病毒、腺相关病毒、逆转录病毒等。
生物转染的优点是转染效率高,但存在生物安全性和操作复杂的缺点。
物理转染是利用物理手段将外源DNA或RNA导入细胞内的方法,常用的包括电穿孔法、基因枪法和超声波法等。
这些方法通过物理
力量破坏细胞膜结构,使外源DNA或RNA得以进入细胞内。
物理转
染的优点是对细胞毒性小,但操作复杂,且适用细胞类型有限。
转染效率受多种因素影响,包括转染方法、细胞类型、外源DNA/RNA的大小和浓度等。
一般来说,生物转染的效率较高,化学转染次之,物理转染效率相对较低。
此外,优化转染条件、选择合适的转染试剂和载体,以及细胞的状态和密度等因素也会对转染效率产生影响。
综上所述,转染技术根据介导物质的不同可以分为化学转染、生物转染和物理转染三种主要分类,它们各有优缺点,转染效率受多种因素影响,需要根据具体实验要求选择合适的转染方法。
细胞转染

磷酸钙法
即磷酸钙共沉淀转染法,先将DNA和氯化钙混合, 然后加入到PBS中慢慢形成DNA磷酸钙沉淀,最 后把含有沉沉淀的混悬液加到培养的细胞上, 通过细胞胞膜的内吞作用摄入DNA。磷酸钙似乎 还通过抑制血清中和细胞内的核酸酶活性而保 护外源DNA免受降解。
磷酸钙法
核酸以磷酸钙-DNA共沉淀物的形式出现时,可 使DNA附在细胞表面,利于细胞吞入摄取,或通 过细胞膜脂相收缩时裂开的空隙进入细胞内, 进入细胞的DNA仅有1%~5%可以进入细胞核中, 其中仅有不到1%的DNA可以与细胞DNA整合,在 细胞中进行稳定表达,基因转导的频率大约为 10-4,这项技术能用于任何DNA导入哺乳类动物 进行暂时性表达或长期转化的研究。此方法对 于贴壁细胞转染是最常用并首选的方法。
脂质体转染法
阳离子脂质体表面带正电荷,能与核酸的磷酸 根通过静电作用,将DNA分子包裹入内,形成 DNA脂复合物,也能被表面带负电的细胞膜吸附, 再通过融合或细胞内吞进入细胞。
脂质体转染法
脂质体转染法
1. 脂质体转染适用于把DNA转染入悬浮或贴壁培养 细胞,可用于瞬时转染和稳定转染。 2. 转染效率高,比磷酸钙法高5-100倍。 3. 能够把DNA和RNA转染到各种细胞。 4. 转染的稳定性好,可重复性高。 5. 转染时最好不加血清和抗生素。 6. 阳离子脂质体细胞毒性相对较高,对部分细胞可 能会干扰细胞的代谢。由于脂质体对细胞有一定 的毒性,所以转染时间一般不超过24小时。 7. 常用细胞类型:cos-7 、BHK、NIH3T3 、Hela等。
理想的细胞转染
转染效率高,不影响细胞正常生理活动 细胞毒性 重复性好 安全 方法简单 省时、经济
报告基因
细胞转染Cell Transfection

细胞培养
• HeLa, HepG-2, NIH /3T3 细胞培养于含 10% 新生小牛血清的 DMEM 高糖培养液, 37 C , 5% CO2, 90% 相对湿度培养箱中 . 在解冻小鼠 ES 细胞前, 先培养饲养层细胞 C57BL, 待长满后, 用 含 10 ug /mL 的mitomycin C处理 2 ~ 2. 51h, 用 37 C 预热的 PBS 漂洗两次, 加普通培养液过夜培养 . 第二天, 解冻小鼠 ES 细胞, 在含 10% 胎牛血清7 . 175 X 109 pmoI /L LIF饲养层上培养 .
•
转染试剂
细胞状态 转染方法
载体构建
•
细胞培养物 细胞密度 血清
抗生素
氮磷比 DNA质量
1. 转染试剂
• 不同细胞系转染效率通常不同, 但细胞系的选择通常是根据实验 的需要, 因此在转染实验前应根据实验要求和细胞特性选择适合 的转染试剂。 每种转染试剂都会提供一些已经成功转染的细胞株 列表和文献, 通过这些资料可选择最适合实验设计的转染试剂。 当然, 最适合的是高效、 低毒、 方便、 廉价的转染试剂。
• 小鼠 ES 细胞, 用 冰预冷的 PBS 将处于对数生长期的细胞重悬为 1 X 107 个 /mL, 取 0. 8 mL 细胞悬液与 25 ug 线性化的 Target Vector 混合, 加到 4 mm 电击池, 冰上放置 5 min (对照组室温放置) • 用 电压 240 V,电阻 ,电容 500 uF 和 950 uF 分别进行电穿孔转染, 电击 后冰上放置 5 mi n (对照组室温放置) • 将细胞转移到装有预热培养液的 15 mL 离心管中 , 轻轻吸打均匀后, 将 细胞悬液平均分到 6 个装有预热培养液( 含 7 . 175 X109 pmoI /L LIF)铺 好饲养层的 10 cm 培养皿中 , 摇匀, 常规条件培养 • 24 h后换新鲜培养液, 电击后 48 h,加250ug /mL G418 及 2 umoI /L gancycIovir 进行选择, 每天更换选择培养液
哺乳动物细胞转染方法总结

转染原理
特点
阳离子脂质体转染法
带正电荷的脂质体靠静电作用和DNA结合形成脂质体-DNA复合物然后通过细胞的内吞作用进入细胞
操作简便
瞬时转染稳定转染各种细胞
适用于各种裸露DNA,RNA片段
适用于各种细胞
对DNA浓度有一定要求
对细胞有一定毒性
阳离子聚合物(PEI)
带正电的阳离子聚合物和核酸的磷酸基团结合形成带正点复合物与带负电的细胞膜接触,内吞进入细胞
适用性广,适于质粒和几十kb的基因组片段
瞬时转染稳定转染各种细胞
针对不同的细胞要优化实验条件
细胞致死率高
显微注射法
利用显微操作系统和显微注射技术将DNA注射进入细胞
整合率高,适用于工程改造转基因动物
瞬时转染稳定转染各种细胞
设备昂贵外源基因的整合位点和拷贝数无法控制
会导致片段突变缺失
逆转录病毒转染
利用病毒的膜蛋白可以和细胞表面受体结合而进入细胞,利用宿主细胞酶自行转录复制合成DNA并随机整合到细胞基因组中
与阳离子脂质体类似,但是具有很低的毒性,操作简单实用性广,为新一代转染试剂
瞬时转染稳定转染各种细胞
磷酸钙法
磷酸钙-DNA沉淀附着在细胞膜,促进细胞的内吞作用
操作简单
瞬时转染稳定转染大部分细胞
磷酸钙-DNA沉淀附着在细胞膜
不适用于原代细胞
电穿孔法
高脉冲的电压破坏细胞膜,在细胞膜表面形成孔道,DNA由孔道进入细胞
转染效率高适合难转染细胞转染
瞬时转染稳定转染特定细胞
利用病毒介导转染,外源基因整合较为稳定
细胞转染

2.哺乳动物细胞表达载体的选择
哺乳动物细胞表达载体有2大类:质粒型载体和病毒 型载体
(1)质粒型载体
哺乳动物细胞质粒型载体大多数是通过细菌质 粒而获得的,主要是在质粒的基础上插入了一些病 毒或其他一些物种及人的基因表达调控序列。
• 当neo基因被整合进真核细胞基因组合适的 地方后,则能启动neo基因编码的序列转录 为mRNA,从而获得抗性产物氨基糖苷磷 酸转移酶的高效表达,使细胞获得抗性而 能在含有G418的选择性培养基中生长。目 前G418的这一特性已在基因转移,敲除, 抗性筛选以及转基因动物等方面得以广泛 应用。
• 转染是否成功的影响因素很多,如需要转 染的细胞类型(对于困难的细胞系尤其如 此),需要被转染的分子(DNA、RNA、 寡核苷酸、蛋白质),转染试剂等。但无 论在何种情况下,转染的成功均取决于转 染效率、低细胞毒性以及重现性这几个要 素。
• 利用脂质体转染法最重要的就是防止其毒 性,因此脂质体与质粒的比例,细胞密度 以及转染的时间长短和培养基中血清的含 量都是影响转染效率的重要问题,通过实 验摸索的合适转染条件对于效率的提高有 巨大的作用。
• 此图为脂质体转染后荧光蛋白的表达
物理方法
包括电穿孔、显微注射及基因枪等方法。
(1)电穿孔法
病毒型载体已被广泛地用于将外源基因导入哺乳 动物细胞或替换哺乳动物细胞中的缺陷基因,这类载 体将来在基因治疗中将具有非常重要的价值。目前应 用的病毒类型包括:逆转录病毒、腺病毒、牛痘病毒 和杆状病毒等。
A.逆转录病毒载体
逆转录病毒的优点是,可以使外源基因整合到基 因组中,因而可以被稳定传代和表达。但是,由于逆 转录病毒的插入位点是随机的,因而在基因组内的整 合有可能破坏一些内源基因的结构,尤其是当插人到 一些重要的基因位点时会导致细胞的异常。
几种转染方法的比较

几种转染方法的比较
目前,基因转染技术已经发展为分子生物学、生物工程和基因治疗等
领域的重要实用工具,它可以极大地提高研究的效率和准确度,是许多重
要的基础实验的重要手段。
基因转染,就是把DNA片段植入受体细胞,使
其形成完整的外源基因,从而使其编码的蛋白质可以表达出来。
其中,质
粒转染(经典CaCl2转染)、电穿孔转染、膜融合转染、磁珠转染、膜膜
转染、管状细胞转染(cylinder-mediated gene transfer)、病毒转染
和小肠转染等转染方法,是目前比较常用的基因转染方法。
一、质粒转染
质粒转染是将外源DNA片段载体在质粒上,用极低的浓度CaCl2诱导
细胞膜的瞬时通透性,使外源基因可以通过通透的细胞膜进入细胞,这是
质粒转染的原理,也是最常用的一种质粒转染方法。
质粒转染的优点:
(1)操作简单,易于大批量高效率的实验。
(2)操作条件宽松,不受受体细胞类型的限制,可以适应多种宿主
细胞。
(3)转染效率高,可以达到百分之九十以上。
(4)可以通过有效的筛选系统,有效控制外源DNA的插入和表达量。
质粒转染的缺点:
(1)转染过程对细胞毒性较大,转染效率有限。
8、细胞转染(脂质体介导法)

三、实验材料与器材
1材料
293T细胞
MyoD表达质粒和EGFP表达质粒
DMEM培养基
链霉素/青霉素(双抗)
FCS(小牛血清)
PBS(磷酸盐缓冲溶液)
胰酶/EDTA消化液
转染试剂(TransFast)
2、器材
20ul/ 200ul/1ml微量移液器和Tip头
利于形成小的转染复合物,从而提高转染效率,但同时细胞毒性也增大。超高分枝的、较柔
性的PEI衍生物含有额外的仲胺基和叔胺基,在染实验中发现这种PEI的毒性低,但转染效
率却较高。
Gen Escort是采用各种分枝状和超高分枝状的小分子PEI与各种含有生理条件下可降解键的
交联剂交联,合成出的一系列高分枝的可降解的PEI衍生物。聚合物的分枝结构使得其具有
一、实验目的
学习和掌握外源基因导入真核细胞的主要方法——脂质体介导的转染。了解外源基因进入的
一般性方法,观测外源蛋白的表达(绿色荧光蛋白) ,为染色准备实验材料。
二、实验原理
上图所示是脂质体介导转染的示意图,它显示了外源质粒进入细胞的一般过程。
外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体介导法和病毒介导法。电击
法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体
物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;病毒法是利用包装了
外源基因的病毒感染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控
制较严、难度较大;病毒法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对 于很多普通细胞系,一般的瞬时转染方法多采用脂质体法。
细胞转染的方法和基本原理

细胞转染的方法和基本原理细胞转染是生物学研究中常用的实验技术,用于将外源DNA、RNA或蛋白质引入到靶细胞中。
本文将介绍细胞转染的方法和基本原理。
一、细胞转染的方法1. 化学法转染:化学法转染是最常用的细胞转染方法之一。
通过利用化学物质如聚乙烯亚胺(PEI)或脂质体等,将外源DNA或RNA 包裹成复合物,与细胞膜结合后进入细胞。
这种方法操作简单、成本低廉,适用于多种细胞类型。
但转染效率较低,对细胞有一定毒性。
2. 病毒载体转染:病毒载体转染是一种高效的细胞转染方法。
病毒载体可以将外源基因嵌入病毒基因组中,然后通过感染细胞的方式将基因导入细胞内。
常用的病毒载体有腺病毒、逆转录病毒等。
这种方法转染效率高,适用于多种细胞类型,但需要特殊设备和技术,同时也有一定的生物安全风险。
3. 电穿孔法转染:电穿孔法利用高压脉冲作用于细胞膜,破坏细胞膜结构,从而使外源DNA或RNA进入细胞。
这种方法操作简单,转染效率较高,但对细胞有一定的毒性,并且只适用于某些特定的细胞类型。
4. 基因枪法转染:基因枪法是一种生理穿孔法,通过利用高压气体或火药驱动基因枪,将外源DNA或RNA以微粒形式直接射入细胞。
这种方法适用于多种细胞类型,转染效率较高,但需要特殊设备和技术,并且对细胞有一定的毒性。
二、细胞转染的基本原理细胞转染的基本原理是通过一定的方法将外源DNA、RNA或蛋白质引入靶细胞,使其在细胞内表达或功能发挥。
转染后的细胞可以用于研究基因功能、蛋白质表达及相互作用等。
细胞转染的基本原理可以分为三个步骤:吸附、内化和表达。
1. 吸附:在化学法转染中,外源DNA或RNA会与载体相结合形成复合物,通过静电作用与细胞膜结合。
在病毒载体转染中,病毒载体会与细胞膜表面的受体结合。
吸附是转染的第一步,直接影响转染效率。
2. 内化:吸附后,外源DNA、RNA或蛋白质需要进入细胞内部。
在化学法转染中,复合物通过细胞膜的内吞作用或直接渗透进入细胞质。
细胞转染方法

细胞转染方法根据不同的试验目的,外源DNA导入哺乳细胞有两种类型:瞬时转染和稳定转染。
瞬时转染是指外源基因进入受体细胞后,存在于游离的载体上,不整合到细胞的染色体上,在外源基因导入细胞1-4天后收获细胞进行分析;稳定转染需要外源基因整合到细胞的染色体上,从而得到稳定的转染细胞株。
下面介绍几种转染方法:DEAE-葡聚糖:这是早在1965年出现的转染方法。
带正电的DEAE-葡聚糖或polybrene(多聚季胺)多聚体可以结合带负电的DNA分子,使得DNA复合物结合在带负电的细胞表面。
通过使用DMSO或甘油获得的渗透休克,也可能是细胞内吞作用使得DNA复合体进入细胞。
DEAE-葡聚糖仅限于瞬时转染,可重复性好,转染时要除掉血清。
磷酸钙共沉淀转染:最早在1973年开始采用。
氯化钙+DNA+磷酸缓冲液按一定的比例混和,形成极小的磷酸钙-DNA复合物沉淀黏附在细胞膜表面,借助内吞作用进入细胞质。
沉淀颗粒的大小和质量对于转染的成功至关重要,pH值、钙离子浓度、DNA浓度、沉淀反应时间、细胞孵育时间乃至各组分加入顺序和混合的方式都可能对结果产生影响,重复性不佳。
此法较易得到稳定转染,但转染原代细胞比较困难。
电穿孔法:通过短暂的高电场电脉冲处理细胞,沿细胞膜的电压差异会导致细胞膜的暂时穿孔。
DNA被认为是穿过孔扩散到细胞内的。
电脉冲和场强的优化对于成功的转染非常重要,因为过高的场强和过长的电脉冲时间会不可逆地伤害细胞膜而裂解细胞。
理论上说电穿孔法可用于各种细胞,且不需要另外采购特殊试剂,但需要昂贵的电转仪。
此法每次转染需要更多的细胞和DNA,因为细胞的死亡率高。
每种细胞电转的条件都需要进行多次优化。
脂质体法:中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA 导入细胞膜内。
带正电的阳离子脂质体则不同,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。
细胞稳定转染方法

G418筛选稳定表达细胞系经验总结我做了稳定转染,从G418浓度确定到最后的单克隆化鉴定。
有自己的体会也有其他战友遇到的情况, 和大家分享. 没有总结好的地方,大家补充。
筛选之前确定G418浓度:1、由于每种细胞对G418的敏感性不同,而且不同的厂家生产的G418有效成分的比重不同,一般1g的粉剂中有效的G418含量大约为0.722g。
2、G418是新霉素的类似物,两者都是通过抑制核糖体的功能和蛋白质的合成而杀死细胞的。
但是新霉素对真核细胞无作用而G418对细菌和真核细胞都起作用。
neo就是编码3‘磷酸转移酶的基因,它表达的蛋白能够分解新霉素G418。
在进行转染时细胞膜受到影响,抗生素可能对细胞产生较大影响,加上G418有杀菌作用,所以有人主张转转染时不加其它抗生素。
3、汇合度对G418筛选结果的影响很大,一般筛选时汇合度不宜超过50%4,G418的活性不尽相同,所以在筛选之前,一定要确定G418的最佳筛选浓度。
具体如下:将细胞稀释到1000个细胞/ml,在100ug/ml~1mg/ml的G418浓度范围内进行筛选,选择出在10~14天内使细胞全部死亡的最低G418浓度来进行下一步的筛选试验。
一个具体试验:3x106个细胞电转后,分别接种1/4000,1/1000,1/300细胞到24孔板中,48h后加药筛选,此时1/300细胞孔内大约50%汇合度。
理论上1/4000孔内应有4%的汇合度。
筛选9天后,观察1/4000孔内有两三个克隆,按比例1/300孔内应该有几十个克隆,事实上,它们几乎全死光了,只有几个克隆。
加药时间和维持浓度1,由于基因转染到细胞内之后要一段时间才能表达出蛋白质。
所以筛选不能太早;但是也不能太晚,因为转染了外源基因的细胞代谢负荷较大,增值较慢,时间长了就会被没有外源基因转入的细胞所淹没,最终导致筛选不出阳性克隆,一般要在转染24小时之后才开始加G418筛选。
随着细胞的代谢G418的浓度和活性都会下降,所以每3~5天都要更换一次含有G418的筛选液。
32Dp210细胞稳定转染方法的比较

[ sr c] jcieTo s ac o h e ta po c e o ta setpa mi EGFP— CEB no 3 Dp 1 . M eh d t nc p lme dae Ab ta tObetv e rh fr teb s p ra h st rn fc ls d p P it 2 2 0 to sCai i oy rme itd o
G4 8 Re u t e to r n f ci n h d t e h g e t ta se t ta s e to fiin y( 8 ) wih t e mo tma c co e fs a l r n f ci n a d t e 1 . s l El cr t a se t a h i h s r n in r n fc i n efce c 5 .9 s o , t h s s ln s o t b y t a se t n h o l a tt e t k n t o m i a cco e ( 1 d y ) C t n cp l me e it d t a se t ta s e to n to i io o et a s e to a h o ef— e s i a e o f r b g m s l n s 2 a s . a i i o y rm d a e r n in r n fc i n a d Ca in c l s m r n fc in h d t el w fi m o p ce c ( . a d 5 8 in y 1 7 n . r s e tv l ) t e t t o sh d fw o iie co e ,ti mp s i l t e o ii e c l e p c ie y . h wo me h d a e p stv l n s i si o sb e o g tp st el Co c u i n E e to r n f ci n i v s. n l s l c r t a se t s o o
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GIBCO BRL,Promega
阳离子脂质体法
带正电的脂质体与核酸带负电的磷酸基团形成复合物,然后脂质体上剩余的电核与细胞膜上的唾液酸残基的负电核结合;另一种解释是通过细胞是内吞作用而被进入细胞。(若DNA浓度过高,中和脂质体表面电核,而降低了与细胞的结合能力)
显微注射法
用显微操作将DNA直接注入靶细胞核
稳定转染,瞬时转染
转染细胞数有限,多用于工程改造或转基因动物的胚胎细胞
电穿孔法
高脉冲电压破坏细胞膜电位,DNA通过膜上形成的小孔导入
稳定转染,瞬时转染,所有细胞
适用性广,除了质粒外,还可转染大的基因组(>65kb)但细胞致死率高,DNA和细胞用量大,需根据不同细胞类型优化电穿孔实验条件,拷贝数较少1-20
Roche(Dosper,DOTAP,FuGENE6)
CPG Biotech Co(GeneLimoPlus,GeneLimoSuper)
Promega(Transfast,Tfx,Transfectam)
阳离子聚合物
带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。
瞬时转染,特定宿主细胞
可用于难转染的细胞,需考虑安全因素
中国科学院典型培养物保藏委员会
Biolistic颗粒传递法(基因枪粒子轰击法)
将DNA用显微重金属颗粒沉淀,再将包被好的颗粒用弹道装置投射入细胞,DNA在胞内逐步释放,表达
瞬时性转染,稳定转染
可用于:人的表皮细胞,纤维原细胞,淋巴细胞系以及原代细胞
稳定转染,瞬时转染,所有细胞
使用方法简单,可携带大片段DNA,通用于各种类型的裸露DNA或RNA,能转染各种类型的细胞,没有免疫原性。虽在体外基因转染中有很高的效率,但在体内,能被血清清除,并在肺组织内累积,诱发强烈的抗炎反应,导致高水平的毒性,这在很大程度上限制了其应用
Invitrogen(Lipofectamine2000,Lipofectamine,Lipofectin,LipofectaminePlus,Cellfectin)
稳定转染,瞬时转染,所有细胞
除了具有阳离子脂质体的转染效率高,操作简单,适用范围广,重复性好等特点外,还具有在体内,转染效率高,细胞毒性低等特点,是新一代的转染试剂。
Sunma(梭华-Sofast®)
Qbiogene(jetPEI™)
Qiagen(SuperFect,Polyfect)
病毒介导法
逆转录病毒(RNA)
瞬时转染
相对简便、重复比磷酸钙好,但对细胞有一定的毒副作用,转染时需除血清且一般只用于BSC-1,CV-1,COS细胞系
Sigma-Aldrich(DEAE-Dextran Transfection Kit)
磷酸钙法
磷酸钙DNA复合物吸附细胞膜被细胞内吞
稳定转染,染瞬转染
不适用于原代细胞(所需的DNA浓度较高),操作简便但重复性差,有些细胞不适用
通过病毒中膜糖蛋白和宿主细胞表面的受体相互作用而进入宿主细胞,之后反转入酶启动合成DNA并随机整合到宿主基因组中
稳定转染,特定宿主细胞
可用于难转染的细胞、原代细胞,体内细胞等,但携带基因不能太大(<8kb),细胞需处分裂期,需考虑安全因素
中国科学院,继而在αv整合素介导下被细胞内吞
各种细胞转染方法比较
细胞转染方法包括DEAE-葡聚糖法,磷酸钙法,阳离子脂质体法,阳离子聚合物,病毒介导法,Biolistic颗粒传递法(基因枪粒子轰击法),显微注射法,电穿孔法等,对各种方法的原理,应用,特点,厂家产品等信息的比较结果如下表:
转染方法
原理
主要应用
特点
厂家及产品
DEAE-葡聚糖法
带正电的DEAE-葡聚糖与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞
