土壤硝化作用强度测定
矿化、硝化与反硝化实验方法

土壤矿化、硝化与反硝化1.矿化培养矿化培养试验采用风干土淹水密闭培养法,预培2 周来消除干土效应。
称取过20 目筛风干土5g,每层土样称取3份,分别置于10×180 mm 的试管中。
将试管平放于桌面上小心滚动,使管中土面倾斜,用移液管缓缓加入5 ml去离子水。
加水后检查各试管中的土壤是否完全润湿,并尽量驱出土中的空气,然后用橡皮塞密封管口,置于25o C 的培养箱中恒温培养,约每周换气一次,并驱除土中气体(在培养后期换气的时间间隔可长一些);分别于淹水后第0 周、1,3 周、5 周、7 周、10 周、14周时进行取样测定土壤中的铵态氮的含量,每层土样测定3 管,作为3 个重复。
测定时用20ml 2.5 mol/L KCl 将管中土壤全部洗入100ml 三角瓶中,振荡1 小时后静置半小时过滤,将滤液储存在塑料瓶中备测。
(1)每个培养管吸取培养溶液:5ml去离子水(2) 培养周期:预培2 周,分别于淹水后第0 周、2 周、4 周、6 周、8 周、10 周和12 周时进行取样测定土壤中的铵态氮的含量,每层土样测定3 管,作为3 个重复。
(3) 培养结束处理:测定时用20ml 2.5 mol/L KCl 将管中土壤全部洗入100ml三角瓶中,振荡1 小时后静置半小时过滤,将滤液储存在塑料瓶中备测。
2.土壤硝化试验方法如下:称取5g 过20 目筛的每层供试土样各2份,分别放入10×180 mm 的试管中,其中0天培养则不加铵,另外第7天、14 天、21 天和28 天分别取样的分别加入1.125 mgN (NH4)2SO4溶液,然后加水至田间持水量的80%,瓶口用塑料薄膜封口以减少水分损失,称重后置于25o C 的培养箱中恒温培养。
预培3 天后,对不加铵的分别加22.7ml 2.2mol/L KCL 溶液,振荡1 小时后,过滤到干净的塑料瓶中,测定铵态氮和硝态氮的含量作为初始量;而对加铵培养瓶称重,通气30 分钟并补充水分至原重,然后继续恒温培养,并开始计算时间,每隔3 天对加铵培养瓶通气一次并称重补充水分至原重,在正式培养后的第7天、14 天、21 天和28 天分别取样,每层土样各取3 瓶作为3 个重复,分别加25ml 2 mol/L KCL溶液,振荡1 小时后,过滤到干净的塑料瓶中,测定铵态氮和硝态氮的含量。
实验二十三 土壤硝化作用强度的测定

实验二十三硝化作用强度的测定硝化作用强度的测定◆目的要求◆实验材料◆试验程序◆土壤硝化作用强度◆思考题目的要求掌握硝化作用强度的测定方法,从而使学生进一步了解土壤中氮素如何有效利用及对环境污染的影响。
◆样品:新鲜土壤。
◆培养基:硝化作用第二阶段用培养基,药品用分析纯。
配方如下:NaNO2 1gMgSO4·7H2O 0.03gMnSO4·4H2O 0.01g K2HPO40.75g NaCO3(无水)1g NaH2PO40.25g CaCO3 3.0g 蒸馏水1000mL◆格利斯试剂:1. 溶液Ⅰ 称取对氨基苯磺酸0.5g,溶于150ml30%醋酸溶液中,保存于棕色瓶中。
2.溶液Ⅱ 称取α-萘胺0.5g,加入50mL蒸馏水中,煮沸后,缓缓加入30%的醋酸溶液150mL,保存于棕色瓶中。
◆亚硝酸银标准液称取1.5000g分析纯亚硝酸钠于烧杯中,加蒸馏水溶解后洗入1000mL容量瓶中,再加蒸馏水至刻度,摇匀。
用时以此液稀释成标准液(每mL含0.01mg的NO2-)其它:容量瓶(50mL、100mL、1000mL)、移液管(1mL、5mL)、三角瓶、漏斗、滤纸、玻棒、洗瓶等及分光光度计。
实验程序◆培养基的配制及1/10土壤悬液的制备◆接种培养◆用比色法测定虑液中的亚硝酸银含量实验程序1 (培养基的配制及1/10土壤悬液的制备)◆在150mL三角瓶中装30mL硝酸细菌培养基(要准确称量),灭菌,每组2只.◆在150mL三角瓶中装45mL蒸馏水,并放入少许玻璃珠灭菌,每组1只.◆1/10土壤悬液的制备称5g土壤放入装有45mL带玻璃珠的三角瓶中,振摇5min。
(接种培养)◆吸取1/10土壤悬液1mL接种到硝酸细菌培养基中,每组接2只三角瓶过滤立即用以测定原始培养液中亚硝酸根含量,另一支三角瓶置于280C 温室中培养15d.◆培养结束,取出三角瓶,培养液进行过滤。
(用比色法测定滤液中的亚硝酸根含量)◆取滤液1mL于50mL容量瓶中,稀释至约40mL,加入1mL格利斯试剂Ⅰ,放置10min。
土壤反硝化作用研究进展

土壤反硝化作用研究进展作者:吕海霞杨丹丹牛犇来源:《河南农业·综合版》2020年第10期土壤反硝化作用是氮素生物地球化学循环的重要环节,是实现完整氮素循环不可缺少的组成部分。
一、国内外研究进展(一)影响因素19世纪五六十年代以来,国际上对土壤反硝化作用进行了大量的研究,特别是在其发生条件、研究方法及产物组成上有很大的进展。
一般认为pH值和有机碳含量是影响土壤反硝化作用的重要因素。
(二)发生要求反硝化过程通常用于描述氮氧化物(NO3-或NO2-)还原转化成氮气体(N2O和N2)的过程。
反硝化作用发生的总要求是:反硝化微生物并且具有代谢能力;合适的电子供体;嫌气条件或O2的有效性受到限制;N的氧化物,如 NO3-、NO2-、NO或N2O作为末端电子受体;适当的温度。
只有在上述条件同时满足的情况下,反硝化作用才能显著。
(三)研究方法土壤反硝化作用的研究方法种类很多,根据是在室内或是室外测定的不同,一般可分为田间原位测定方法和实验室培养测定方法两类。
根据测定的是产物还是反硝化底物的不同,可分为直接气体产物测定法、间接平衡差减法和底物消失速率测定法。
另外,根据测定中所用试剂的不同,又可将其分为15N同位素方法和乙炔抑制法。
(四)产生的效应反硝化的气态产物为NO, N2O和N2 。
反硝化作用对环境所产生的效应取决于其所产生的终产物及不同产物之间的比例。
众所周知,N2O是重要的温室气体之一,参与大气的光化学反应,而且很容易破坏臭氧层。
在百年时间尺度上N2O的全球增温潜势是CO2的296倍,其在大气中的寿命为120年。
自1988年以来,N2O以每年0.8 ug/L的速率增长,2004年浓度达318.6 ug/L ,比工业革命前(270 ug/L)增长了18%。
全球N2O年排放量是16.4Tg,其中土壤是N2O重要的排放源,约占年总排放量的62.2% ,施肥农业土壤上排放的N2O-N约为2.8 Tg。
产物NO虽然不是温室气体,但其是大气中的活性物质,在对流层中很容易被氧化成NO2。
凯氏定氮法 标准-概述说明以及解释

凯氏定氮法标准-概述说明以及解释1.引言1.1 概述凯氏定氮法是一种常用的分析方法,用于确定物质中的氮含量。
该方法基于凯氏反应,即将有机或无机物中的氮转化为氨,再通过氨测定确定氮的含量。
凯氏定氮法简单、灵敏度高,并能够适用于各种类型的样品。
文章的概述部分旨在介绍凯氏定氮法的基本背景和重要性。
首先,我们将对凯氏定氮法的原理和相关的基本步骤进行阐述。
接着,我们将探讨凯氏定氮法在不同领域中的广泛应用,并特别关注其在环境科学、农业和食品安全等领域的应用情况。
凯氏定氮法具有一些独特的优点,如操作简便、成本低廉、准确性高等。
然而,同时我们也必须认识到凯氏定氮法存在一定的局限性,如对某些有机物的测定存在困难等。
针对这些问题,本文还将展望凯氏定氮法未来的发展方向,并探讨可能的改进和创新。
总而言之,本文将全面介绍凯氏定氮法的原理、步骤和应用,并对其优点、局限性进行评估。
通过深入了解凯氏定氮法,我们可以更好地理解其在实际应用中的潜力和局限性,并为其未来的研究和应用提供参考。
文章结构部分的内容可以如下所示:1.2 文章结构本文将按照以下结构来展开对凯氏定氮法的介绍和分析:第一部分,引言,将对凯氏定氮法进行概述,简要介绍该方法的背景和相关概念。
同时,本部分还将描述文章的目的,即通过对凯氏定氮法的详细介绍和分析,帮助读者更好地理解和应用该方法。
第二部分,正文,将重点介绍凯氏定氮法的原理、步骤和应用。
2.1小节将详细阐述凯氏定氮法的原理,包括氛围压降法和热导法两种常见的方法。
2.2小节将详细描述凯氏定氮法的步骤,包括样品的预处理、试剂的选择和实验操作等。
2.3小节将探讨凯氏定氮法在不同领域的应用,例如土壤分析、环境监测等,以及其在实际应用中的优点和限制。
第三部分,结论,将对凯氏定氮法进行总结并展望其未来的发展。
3.1小节将概述凯氏定氮法的优点,如准确性高、灵敏度好等。
3.2小节将强调凯氏定氮法的局限性,如样品处理过程中的误差、仪器设备的限制等。
中国陆地生态系统土壤氮矿化速率和硝化速率及影响因素

表 2 中国南北方土壤理化指标、总矿化速率( N min ) 和总硝化速率( N nit ) 差异
Table 2 Difference of soil physical and chemical parameters, gross nitrogen mineralization rates ( N min ) and gross nitrification rates ( N nit )
地( 牧草、湿地草本和高山草甸) 和农田( 耕作土壤) ( 图 1) [3] 。 植被类型“ 林地” 包括雨林、阔叶林和针叶林;
植被类型“ 草地” 包括多年生草本植物和一年生草本植物;植被类型“ 农田” 包括施肥土壤和未施肥土壤。 以
“ 秦岭—淮河” 为界分为南方和北方( 北方包括降水量小于 800 mm 青藏高原地区) 。
平均含量在南北方地区不存在显著差异。 北方土壤氮
图 1 中国陆地生态系统土壤 N min 和 N nit 已发表文献采样点空间
总转化速率大于南方土壤,N min 和 N nit 比南方土壤分别
高约 80%和ቤተ መጻሕፍቲ ባይዱ21%。 N min ( P = 0.027) 在南北方地区差异
显著,而 N nit( P>0.05) 差异不显著( 表 2) 。
指标和土壤氮总转化速率差异;采用相关分析和逐步回
归分析确定土壤理化指标与氮总转化速率之间的关系,
在一元回归分析中拟合显著的土壤理化指标列为多元
回归参数。 所有统计分析中显著性水平 P<0.05 视为差
异显著。 数据统计分析使用 SPSS 20.0,图形制作使用
Origin 2016 软件。
(新)土壤硝化作用强度的测定

实验程序3
(用比色法测定滤液中的亚硝酸根含量)
结果计算
NO2-(mg/30mL)=X(mg/mL) ×比色体积×稀 释倍数 ×10-3
式中X(mg/mL)——由标准曲线查知 10-3——换算为mg
土壤硝化作用强度
计算公式:
原始培养基中NO2- 量-培养基中NO2- 量 硝化作用强度= ×100% 原始培养基中NO2- 量
思考题
什么叫硝化作用?硝化作用由哪
两类细菌参与? 根据硝酸细菌培养基的组成成分, 硝酸细菌属何种营养类型? 本实验的原理是什么? 实验中要注意什么?
实验二十三
结
束
菌培养基中,每组接2只三角瓶过 滤立即用以测定原始培养液中亚硝 酸根含量,另一支三角瓶置于280C 温室中培养15d. 培养结束,取出三角瓶,培养液进 行过滤。
实验程序3
(用比色法测定滤液中的亚硝酸根含量) 取滤液1mL于50mL容量瓶中,稀释至约 40mL,加入1mL格利斯试剂Ⅰ,放置 10min。再加入1mL格利斯试剂Ⅱ和 1mL2%醋酸钠溶液,显色后稀释至刻度, 放置10min后,用分光光度计(波长 520nm)比色测定。 亚硝酸银标准曲线的绘制 吸取压硝酸银 标准液0、1、2、3、4、5mL,分别放 入50mL容量瓶中,定容。与待测样品同 样条件进行比色,以浓度为横坐标,以光 密度为纵坐标绘制标准曲线。
实验材料2
格利斯试剂: 1. 溶液Ⅰ 称取对氨基苯磺酸0.5g,溶于 150ml30%醋酸溶液中,保存于棕色瓶中。 2.溶液Ⅱ 称取α-萘胺0.5g,加入50mL 蒸馏水中,煮沸后,缓缓加入30%的醋酸 溶液150mL,保存于棕色瓶中。 亚硝酸银标准液 称取1.5000g分析纯亚 硝酸钠于烧杯中,加蒸馏水溶解后洗入 1000mL容量瓶中 ,再加蒸馏水至刻度, 摇匀。用时以此液稀释成标准液(每mL含 0.01mg的NO2-)
硝化作用强度的测定

6.亚硝酸根标准曲线的绘制,吸取亚硝酸根标准液0、1、2、3、4、5ml分别放入50ml容量瓶中,定容,与待测样品同样条件进行比色,以浓度为横坐标,以OD值为纵坐标绘制标准曲线。
三、实验步骤
培养基的配置及1/10土壤悬液的制备-----接种培养-----用比色法测定滤液中的亚硝酸根含量。
1.在150ml三角瓶中装30ml硝酸细菌培养基,灭菌每组2瓶。
2.在150ml三角瓶中装45ml蒸馏水,并放入少许玻璃珠,灭菌每组1瓶。
3.称5g土于45ml三角瓶中,震荡5分钟。
4.取1ml于硝酸细菌培养基中,每组接2瓶,其中一瓶立即过滤用以测定原始培养基中亚硝酸根含量,另一瓶置于28温箱培养15天,培养结束,取出三角瓶,培养液进行过滤。
硝化作用强度的测定
一、目的要求
掌握硝化强度的测定方法,了解土壤中氮素如何有效利பைடு நூலகம்及对环境污染的影响。
二、实验材料
样品:新鲜土样
培养基:硝化作用第二阶段培养基
亚硝酸钠1克;硫酸镁0.03克;硫酸锰0.01克
磷酸氢二钾0.75克;碳酸钙3.0克;水1000毫升
格里斯试剂:
1.溶液Ⅰ:称取对氨基苯磺酸0.5g(0.05g)溶于150ml(15ml) 30%醋酸溶液中,保存于棕色瓶中。
四、结果计算
NO2–(mg/30ml)=X(ug/ml)*比色体积*稀释倍数*10-3
X(由标准曲线查知)10-3(换算为ml)
土壤消化强度=原始培养基中NO2–量—培养基中NO2–量
土壤硝化作用研究概况

土壤硝化作用研究概况
土壤硝化作用的研究对于了解土壤氮汇流量以及陆地环境质量管理非常重要。
硝酸盐氧化过程是土壤氮循环的重要组成部分,也是污染物、挥发性有机物和氨氮的形成和降解的关键过程。
硝化作用是氮循环中重要的代谢途径,影响着土壤中氮浓度以及其他氮汇流量。
近年来,研究者们一直在收集对土壤硝化作用进行研究的有关细节。
硝化作用研究的最新发展包括硝化菌的分子鉴定及其耐药性分析,硝化微生物的微生物生态学的研究,以及硝化细菌的生物抑制活性的研究等。
此外,土壤硝化作用受土壤中养分、水分、温度、pH值、有机质等自然条件以及农药、硝脲类生物激活剂、硫酸盐及重金属等污染物的性质和浓度影响。
土壤硝化作用是控制土壤、植物、水体及大气中氮汇流量的重要组成部分。
由于有了这些发展,研究者们能够利用硝化研究来深入了解土壤的氮循环,进而更好的控制这些氮汇流量,减少环境污染的同时也提高植物的产量。
因此,土壤硝化作用的研究对改善环境质量和确保可持续发展具有重要意义。
具体而言,研究应集中于(1)土壤硝化过程中微生物介导的具体机制;(2)土壤氮汇流量的影响因素;(3)土壤多样性的调控能力;(4)陆地环境中生态系统氮循环的综合研究;(5)植物根系氮汇利用效率及其对土壤氮循环的影响;(6)土壤有机硝酸盐氧化作用及其氮汇流量的控制技术等。
总而言之,研究土壤硝化作用有助于深入了解土壤氮汇流量和环境质量管理,同时也能够帮助人们解决潜在的环境问题。
只有深入了解以及彻底把握硝化作用,我们才能通过科学熟知的研究、管理这些氮汇流量,同时保护环境,实现可持续发展。
包气带土层的反硝化强度测定方法研究

264
地 球
与
环
境
2011 年
构、 土层厚度等与反硝化作用量的变化关系。 ( 2) 较 难区分采集气体中的 N O 量 , 哪些产自硝化作用 ,
2
对不同深度土层微生物固持无机氮量的测定。将这 些补充测试量加入到反硝化作用过程的氮均衡计算 中即可。
哪些产自反硝化作用? 将使依据 N2 O 量变化进行 的反硝化强度测定, 产生较大偏差。( 3) 也较难区分 不同厚度土层和最大稳定埋深水 分运移零通量 面 上、 下土层以及地下含水层间的反硝化作用量差别。 不能真实评估地下水位之上土层的相关防护能力。 ( 4) 施入的 N 肥料与土壤原有的氮素间存在生物 交换作用及土壤气体的逸出不通畅等, 将使反硝化 强度值的测定偏低。 ( 5) 反硝化过程的分馏作用, 使 N2O、 N 2 气体 偏向贫 N, 而 底物硝 态氮 偏向富 集
施用氮肥是农业增产的重要手段, 广施氮肥易 引起包气带土层和地下水中的氮素污染。土壤反硝 化作用是农田氮素损失、 消散的重要途径, 也是包气 带土层中的氮污染净化和地下水污染防护的根本力 量所在。田间土层的反硝化强度测定, 即是利用一 定的分析技术和测试方法对田间土层的转化、 消散 氮素能力进行实测认知的一项活动。田间土层反硝 化强度的测定将在认识掌握农田氮素损失、 土壤氮 的污染治理、 地下水的污染防护、 农田施肥与种植结 构调整、 包气带土层的氮污染容量评价等方面 , 发挥 重要而无可替代的作用。 对于田间包气带土层防护地下水污染的反硝化 强度测定 , 目前还没 有较好的方法 满足应用需求。 现行的相关测定方法大多适用性狭窄, 它们在面对 这一领域的应用时, 还存在许多问题与不足 [ 1] 。当 下亟需有适宜的测试方法来满足应用。为此 , 本文 重点针对田间包气带土层防护地下水污染的反硝化 强度测定进行了探讨研究。
土壤酶检测报告

土壤酶检测报告1. 引言土壤是地球上最重要的自然资源之一,它对农田和生态系统的健康发展至关重要。
土壤酶是土壤微生物代谢的重要标志,其活性和种类对土壤质量和生态系统功能具有重要影响。
本文档旨在通过土壤酶检测报告提供有关土壤酶活性的信息,以便对土壤质量进行评估和改进农业管理实践。
2. 实验方法土壤酶检测使用的方法通常包括测定酶的活性以及酶的种类和含量。
本次检测采用以下方法实施:2.1 酶活性测定采用测定酶活性的方法来评估土壤中不同酶的活性水平。
常用的酶活性指标包括脲酶、过氧化氢酶、过氧化物酶、硝化酶等。
2.2 酶种类和含量测定通过测定土壤中酶的种类和含量,可以更全面地了解土壤微生物群落的组成和功能。
常用的测定方法包括酶谱分析、PCR扩增和基因测序等。
3. 实验结果经过酶活性测定和酶种类和含量测定,我们得到了以下结果:3.1 酶活性酶名活性水平(单位)脲酶100过氧化氢酶50过氧化物酶80硝化酶1203.2 酶种类和含量经过酶种类和含量测定,我们发现土壤中存在多种酶,例如脲酶、过氧化氢酶和过氧化物酶。
其中脲酶的含量最高,过氧化氢酶和过氧化物酶的含量稍低。
4. 结果分析通过对土壤酶活性和酶种类和含量的测定结果进行分析,我们可以得出以下结论:1.脲酶活性较高,说明土壤中存在一定数量的氮素有机化合物,并能迅速转化为植物可用的无机氮。
2.过氧化氢酶和过氧化物酶活性适中,说明土壤中的有机物和废弃物可以被有效分解和降解。
3.硝化酶活性较高,说明土壤中存在一定的硝化作用,有机氮逐渐转化为无机氮。
5. 结论与建议根据检测结果的分析,我们得出以下结论和建议:1.土壤酶活性良好,说明土壤中的微生物群落活跃,有机物分解和养分转化能力强。
建议保持良好的农田管理实践,如定期施肥、轮作和集约耕作等,以促进土壤健康发展。
2.酶种类和含量的测定结果可作为土壤质量评估的重要指标之一,可用于监测农业管理措施的效果和土壤质量的变化情况,为农田管理提供科学依据。
土壤中硝氮、氨氮测定方法
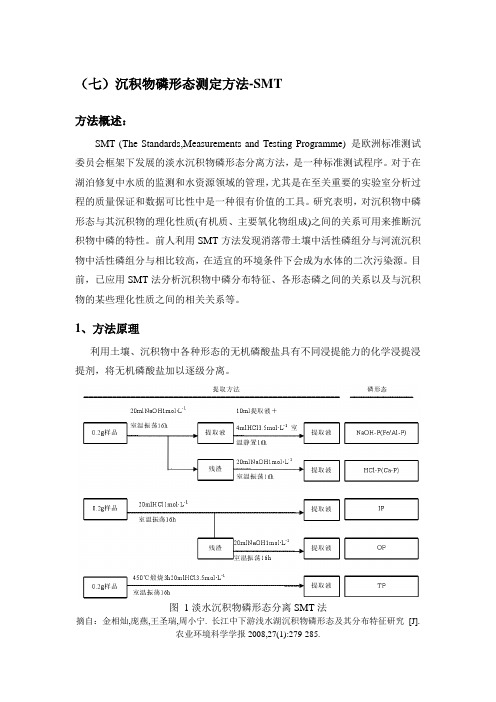
(七)沉积物磷形态测定方法-SMT方法概述:SMT (The Standards,Measurements and Testing Programme) 是欧洲标准测试委员会框架下发展的淡水沉积物磷形态分离方法,是一种标准测试程序。
对于在湖泊修复中水质的监测和水资源领域的管理,尤其是在至关重要的实验室分析过程的质量保证和数据可比性中是一种很有价值的工具。
研究表明,对沉积物中磷形态与其沉积物的理化性质(有机质、主要氧化物组成)之间的关系可用来推断沉积物中磷的特性。
前人利用SMT方法发现消落带土壤中活性磷组分与河流沉积物中活性磷组分与相比较高,在适宜的环境条件下会成为水体的二次污染源。
目前,已应用SMT法分析沉积物中磷分布特征、各形态磷之间的关系以及与沉积物的某些理化性质之间的相关关系等。
1、方法原理利用土壤、沉积物中各种形态的无机磷酸盐具有不同浸提能力的化学浸提浸提剂,将无机磷酸盐加以逐级分离。
图1淡水沉积物磷形态分离SMT法摘自:金相灿,庞燕,王圣瑞,周小宁. 长江中下游浅水湖沉积物磷形态及其分布特征研究[J].农业环境科学学报2008,27(1):279-285.2、需要的设备与实验条件紫外分光光度计、高压灭菌锅3、所需试剂及操作步骤(一)所需要的试剂(1)5N H2SO4:70mL浓硫酸-500mL水中,置于常温下保存;(2)酒石酸锑钾溶液:准确称取1.3715g酒石酸锑钾于500mL容量瓶中,溶解定容,充分摇匀后将该溶液贮存在棕色或其他试剂瓶(玻璃瓶)中,将其置于4℃下保存。
(3)钼酸铵溶液:准确称取40g钼酸铵于1000mL容量瓶中,加适量水待其完全溶解后加水稀释至刻度线,充分摇匀后将该溶液贮存在棕色或其他试剂瓶(玻璃瓶)中,将其置于冰箱中于4℃下保存。
(4)抗坏血酸溶液:准确称取17.6g抗坏血酸1000mL容量瓶中,加适量水待其完全溶解后加水稀释至刻度线,充分摇匀后将该溶液贮存在棕色或其他试剂瓶(玻璃瓶)中,将其置于冰箱中于4℃下保存。
亚热带稻田土壤反硝化动力学参数估算

亚热带稻田土壤反硝化动力学参数估算邹刚华;赵凤亮;单颖;李勇【摘要】反硝化作用是土壤氮素损失的重要途径,对反硝化潜势的准确估算是农业精准施肥的必然要求.以亚热带典型红壤稻田土作为研究对象,足量添加外源氮进行室内淹水厌氧培养获取反硝化作用动态,并分别用米氏方程和一级动力学方程对其拟合,最后利用土壤基本理化性质对反硝化动力学参数进行估算.结果表明:米氏方程更适合反硝化动力学拟合,最佳的米氏常数(Km)为35 mg/kg;米氏最大速率常数(vmax)与一级动力学速率常数(K)具有显著的相关性(r=0.96,P<0.05).土壤总氮,砂粒和粉粒以及土壤容重对vmax影响最大.利用总氮和粉粒含量作为输入参数估算了vmax,准确度达66%.所构建的参数方程既充分挖掘了土壤基础数据潜能,又能快速地获取土壤反硝化动力学曲线,省时省力.【期刊名称】《土壤》【年(卷),期】2019(051)003【总页数】7页(P517-523)【关键词】反硝化作用;酶动力学;红壤;参数估算;传递函数【作者】邹刚华;赵凤亮;单颖;李勇【作者单位】中国热带农业科学院环境与植物保护研究所,海口 571101;中国热带农业科学院环境与植物保护研究所,海口 571101;中国热带农业科学院环境与植物保护研究所,海口 571101;中国科学院亚热带农业生态研究所,长沙 410125【正文语种】中文【中图分类】S153.4氮素是植物生长必需和作物高产的重要因子,化肥的施用在提高作物产量同时,也产生了很多环境问题,如土壤酸化、土地板结、温室气体排放以及水体富营养化等[1-3],如何提高农田氮素利用成为了农业精准施肥的瓶颈。
过量氮肥输入除了造成氮素的浪费之外[4],也加剧了氮素的转化损失[5]。
其中,反硝化作用是农田氮素损失的重要途径之一,了解土壤潜在反硝化势是优化施肥的必要前提。
土壤反硝化作用受诸多因素影响,如影响酶反应速率的pH和温度、土壤质地以及底物浓度等[6]。
基质诱导硝化测定的土壤中锌的毒性阈值、主控因子及预测模型研究

基质诱导硝化测定的土壤中锌的毒性阈值、主控因子及预测模型研究林蕾;刘继芳;陈世宝;马义兵【摘要】选取我国有代表性的16种土壤,通过基质诱导硝化(SIN)的方法,研究了淋洗与未淋洗处理后,土壤中外源Zn对不同土壤潜在硝化速率(PNR)的影响.结果表明:在未淋洗处理土壤中Zn毒性的EC50(使PNR降低至对照一半土壤中Zn的浓度)值的范围为197~1 874 mg·kg-1,相差近9.51倍;总体而言,土壤pH、有机碳及粘粒含量的提高可以降低土壤中Zn的毒性.偏相关分析结果表明,影响土壤中Zn对潜在硝化速率抑制作用的主要因子依次为土壤pH、有机碳含量及粘粒含量;淋洗处理明显提高了土壤中外源Zn的毒性阈值浓度,在不同土壤中,淋洗因子(定义为淋洗后的土壤Zn毒性的EC50与非淋洗EC50的比值)范围为1.16~1.43;基于土壤主要性质的多元回归预测模型结果表明,利用土壤性状(pH、有机碳和粘粒含量)可以很好地预测土壤中Zn对硝化速率抑制的毒性阈值.【期刊名称】《生态毒理学报》【年(卷),期】2012(007)006【总页数】7页(P657-663)【关键词】Zn;潜在硝化速率;毒性阈值;预测模型【作者】林蕾;刘继芳;陈世宝;马义兵【作者单位】中国农科院农业资源与农业区划研究所农业部植物营养与施肥重点实验室,北京100081;中国农科院农业资源与农业区划研究所农业部植物营养与施肥重点实验室,北京100081;中国农科院农业资源与农业区划研究所农业部植物营养与施肥重点实验室,北京100081;中国农科院农业资源与农业区划研究所农业部植物营养与施肥重点实验室,北京100081【正文语种】中文【中图分类】X171.5在土壤重金属污染防治研究中,重金属污染的源头控制和环境质量标准与立法是关键。
目前在我国土壤环境质量标准研究中,由于有关土壤中重金属行为和毒性的科学数据积累不足,致使我国在土壤环境立法过程中主要参考了欧美的相关标准,而忽视了土壤重金属环境质量标准的复杂性和区域分异性。
《土壤质量硝化潜势和硝化抑制的测定氨氧化快速检测》

《土壤质量硝化潜势和硝化抑制的测定氨氧化快速检测》Soil quality – Determination of potential nitrification and inhibition of nitrification – Rapid test byammonium oxidation(ISO 15685:2012)国家标准(征求意见稿)编制说明国家标准《土壤质量-硝化潜势和硝化抑制的测定-氨氧化快速检测》标准起草组二〇一九年一月项目名称:土壤质量-硝化潜势和硝化抑制的测定-氨氧化快速检测计划编号:20184361-T-326项目负责单位:江苏省农业科学院项目负责人:杨林章技术委员会:全国土壤质量标准化技术委员会(SAC/TC 404)目录1、编制的目的和意义 (1)2、任选来源 (1)3、编制过程 (1)3.1预研阶段 (1)3.2立项阶段 (2)3.3起草阶段 (2)4、标准编制原则和主要内容 (2)4.1基本原则 (2)4.2技术路线 (3)4.3技术内容 (3)5、与现行法律、法规、标准的协调性 (3)6、国内外有关标准现状 (3)7、对标准贯彻的建议 (4)1、编制的目的和意义硝化作用在氮转化过程中扮演着重要的作用,可作为污染物对土壤影响的评价指标。
硝化过程的进行常常通过“硝化势”的大小来衡量。
通常将NH4+作为基质加入土壤中,通过培养试验测定土壤硝氮或亚硝氮浓度来估算硝化势,培育期在几个小时到50天不等。
目前,我国尚没有土壤硝化潜势及硝化抑制相关的国家标准和行业标准。
因此,制定《土壤质量-硝化作用潜势的测定和硝化作用的抑制-氧化铵快速试验》具有重要的意义。
本标准规定了土壤硝化潜势和硝化抑制的快速测定方法,该方法适合各种土壤类型的测定,可应用于土壤和废弃物质量的快速鉴定,以及耕作方式、生物固体和土壤污染物等影响效果的评定。
2、任选来源2018年12月中国标准化管理委员会下达了《关于下达2018年第四批推荐性国家标准制计划的通知》(国标委发函[2018] 83号)其中《土壤质量硝化作用潜势的测定和硝化作用的抑制氧化铵快速试验》获得批准成为2018年第四批国家标准制订计划项目,计划编号20184361-T-326,主管部门为农业部,技术归口单位为全国土壤质量标准化技术委员会,由江苏省农业科学院承担起草工作。
土壤硝化作用强度测定

土壤硝化作用强度测定
土壤硝化作用强度测定
一、原理
将定量的土壤接种到硝化细菌培养基中,由于土壤中硝化细菌的作用,是亚硝酸氧化成硝酸,用培养基中亚硝酸的消失量占原始培养基中亚硝酸含量的百分比作为硝化作用强度的指标。
亚硝酸能与格利斯试剂反应产生一种紫红色的化合物,该显色反应不易受硝态氮的干扰。
二、药品器材
1.硝化细菌培养基:NaNO2 1g MgSO4·7H2O0.03g MnSO4·4H2O 0.01g K2HPO40.75g
Na2CO3(无水)1g NaH2PO40.25g超纯水1000ML
2.格利斯试剂:溶液一,称取磺胺酸0.5g,溶于150ml醋酸溶液(30%)中,保存于棕色
瓶中。
溶液二,称取α-萘胺0.5g,加入50ml蒸馏水中,煮沸后,缓缓加入30%的醋酸溶液150ml,保存于棕色瓶中。
3.亚硝酸根标准溶液:称取1.500g分析纯亚硝酸那于烧杯中,加蒸馏水溶解后定容至
1000ml,此溶液亚硝酸根离子浓度为1mg/ml。
用时以此液配成亚硝酸根标准溶液(亚硝酸根离子浓度为0.01mg/ml)。
三、步骤
1.在150ml三角瓶中装30ml硝化细菌培养基,灭菌。
2.冷却后的培养基中接种1/10土壤悬液1ml,于28℃恒温培养15d,取出三角瓶过滤。
3.用比色法测定滤液中的亚硝酸含量。
四、硝化作用强度
硝化作用强度=(原始培养基中亚硝酸根含量-培养后培养基中亚硝酸根含量)/原始培养基中亚硝酸根含量*100%。
亚硝化球菌属(Nitrososphaera)可能是酸性土壤硝化作用的重要驱动者

土 壤 (Soils), 2021, 53(1): 13–20①基金项目:国家重点研发计划项目(2018YFC0407604,2016YFD0200302)和国家自然科学基金项目(51779077,91747104)资助。
* 通讯作者作者简介:李文兴 (1993—),女,山西大同人,硕士研究生,主要从事土壤氮循环微生物研究。
DOI: 10.13758/ki.tr.2021.01.003李文兴, 郑曼曼, 王超, 等. 亚硝化球菌属(Nitrososphaera )可能是酸性土壤硝化作用的重要驱动者. 土壤, 2021, 53(1): 13–20.亚硝化球菌属(Nitrososphaera )可能是酸性土壤硝化作用的重要驱动者①李文兴1,2,郑曼曼1,2,王 超1*,沈仁芳1,2(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)摘 要:选择初始pH 相近的两个酸性土壤 (JX-3和JX-7) 样品进行培养试验,探讨了氨氧化古菌(ammonia-oxidizing archaea, AOA)和氨氧化细菌(ammonia-oxidizing bacteria, AOB)在酸性土壤硝化过程中所发挥的作用。
结果显示,经过50 d 的培养,JX-7样品硝化速率显著高于JX-3,且明显降低土壤pH 。
培养后,两个土壤样品AOB 丰度均增加,但样品间没有显著差异;JX-7土壤AOA 丰度显著增加,而JX-3无显著变化。
两个土壤样品AOA 群落组成本身存在分异,但对于同一样品培养前后均无显著分异;AOB 群落组成在两土壤间没有分异,但培养前后分别有分异。
培养后,JX-7样品中AOA 优势属Nitrososphaera 和某些未知微生物的个别OTUs 绝对丰度显著增加,而两样品AOB 中Nitrosospira 属的一些OTUs 的绝对丰度均显著增加。
生活垃圾焚烧厂周边土壤硝化和反硝化功能基因分布特征及影响因子

生活垃圾焚烧厂周边土壤硝化和反硝化功能基因分布特征及影响因子孙许超;郭彦海;张士兵;钱雅洁;刘振鸿;薛罡;高品【摘要】以上海某垃圾焚烧厂为研究对象,采用电感耦合等离子体发射光谱(ICP-OES)和荧光定量 PCR 定量分析了其周边土壤中重金属(Cd、Pb、Cu、Ni、Cr、Zn和As)含量水平,及不同硝化和反硝化功能基因丰度(AOB-amoA、nxrB、narG、nirS、norB 和 nosZ),并通过空间插值法分析了目标重金属与硝化和反硝化功能基因的空间分布特征,同时通过相关性分析和冗余分析探讨了土壤重金属及其理化性质对硝化和反硝化功能基因丰度变化的作用影响.结果表明,研究区域土壤中Cd、Pb、Cu、Ni、Cr、Zn和As的含量分别为0.083~1.065、15.54~43.17、18.30~65.52、24.58~41.65、65.04~201.0、58.96~153.5和0.098~5.115 mg·kg-1,而土壤中AOB-amoA、nxrB、narG、nirS、norB和nosZ基因丰度分别为4.89×102~1.34×105copies·g-1、5.43×106~5.41×107copies·g-1、1.21×106~7.91×106copies·g-1、3.79×106~7.39×107copies·g-1、1.61×105~ 1.33×107copies·g-1和1.44×104~2.18×105copies·g-1.由空间插值分析结果可知,土壤中重金属主要来源于焚烧烟气排放沉降,硝化和反硝化功能基因的空间分布特征与土壤总氮及重金属均具有相似性.相关性分析和冗余分析结果显示,除Cd和Zn外,其余重金属含量对硝化和反硝化功能基因丰度影响不显著,表明垃圾焚烧厂周边土壤中重金属污染对氮循环过程影响较小.相比之下,土壤理化性质如总有机碳、总氮等对硝化和反硝化功能基因丰度影响更显著.该研究可为相关地区垃圾焚烧厂周边土壤重金属污染控制及微生物生态风险评价提供参考.%The contents of heavy metals (i.e., Cd, Pb, Cu, Ni, Cr, Zn and As) and quantities of nitrification and denitrification functional genes(i.e.,AOB-amoA,nxrB,narG,nirS,norB and nosZ)were determined in the surface soils surrounding a municipal solid waste incineration (MSWI) plant in Shanghai by using an inductively coupled plasma optical emission spectrometer (ICP-OES) and quantitative PCR (qPCR), respectively. The spatial distribution characteristics of these heavy metals and functional genes were analyzed by a spatial interpolation method, and the effects of heavy metals and soil physicochemical properties on the quantities of nitrification and denitrification functional genes were also studied by correlation analysis and redundancy analysis. The results showed that the contents of Cd, Pb, Cu, Ni, Cr, Zn, and As were 0.083~1.065, 15.54~43.17, 18.30~65.52, 24.58~41.65, 65.04~201.0, 58.96~153.5,and 0.098~5.115 mg·kg-1,respectively, while the quantities of AOB-amoA, nxrB,narG, nirS, norB,and nosZ genes were 4.89×102~1.34×105copies·g-1(dry soil),5.43×106~5.41×107copies·g-1, 1.21×106~7.91×106copies·g-1,3.79×106~7.39×107 copies·g-1, 1.61×105~1.33×107copies·g-1and1.44×104~2.18×105copies·g-1, respectively. The results of spatial interpolation suggested that the detected heavy metals in soils mainly originated from the precipitation of incineration flue gas, and the spatial distribution characteristics of functional genes were similar to those of total nitrogen (TN) and heavy metals. Besides, the results of correlation analysis and redundancy analysis indicated that the effect of heavy metal contents on the quantities of nitrification and denitrification functional genes was not significant, except Cd and Zn, suggesting that the soil heavy metal pollution surrounding the MSWI plant had little influence on thenitrogen cycles. By contrast, a positive significant correlation was found between soil physicochemical properties such as pH, TOC and TN and the quantities of nitrification and denitrification functional genes. This study provides references for control of heavy metal pollution and microbial ecological risk assessment in soils surrounding MSWI plants.【期刊名称】《生态环境学报》【年(卷),期】2018(027)002【总页数】8页(P373-380)【关键词】垃圾焚烧厂;硝化;反硝化;功能基因;重金属【作者】孙许超;郭彦海;张士兵;钱雅洁;刘振鸿;薛罡;高品【作者单位】东华大学环境科学与工程学院,上海 201620;东华大学环境科学与工程学院,上海 201620;东华大学环境科学与工程学院,上海 201620;东华大学环境科学与工程学院,上海 201620;东华大学环境科学与工程学院,上海 201620;东华大学环境科学与工程学院,上海 201620;东华大学环境科学与工程学院,上海 201620【正文语种】中文【中图分类】X703土壤氮循环是土壤物质循环的重要组成部分,包括氨化作用、硝化作用、反硝化作用、固氮作用等,其中微生物硝化-反硝化作用在生态氮循环过程中占重要地位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
土壤硝化作用强度测定
一、原理
将定量的土壤接种到硝化细菌培养基中,由于土壤中硝化细菌的作用,是亚硝酸氧化成硝酸,用培养基中亚硝酸的消失量占原始培养基中亚硝酸含量的百分比作为硝化作用强度的指标。
亚硝酸能与格利斯试剂反应产生一种紫红色的化合物,该显色反应不易受硝态氮的干扰。
二、药品器材
1.硝化细菌培养基:NaNO2 1g MgSO4·7H2O 0.03g MnSO4·4H2O 0.01g K2HPO40.75g
Na2CO3(无水)1g NaH2PO40.25g超纯水1000ML
2.格利斯试剂:溶液一,称取磺胺酸0.5g,溶于150ml醋酸溶液(30%)中,保存于棕色
瓶中。
溶液二,称取α-萘胺0.5g,加入50ml蒸馏水中,煮沸后,缓缓加入30%的醋酸溶液150ml,保存于棕色瓶中。
3.亚硝酸根标准溶液:称取 1.500g分析纯亚硝酸那于烧杯中,加蒸馏水溶解后定容至
1000ml,此溶液亚硝酸根离子浓度为1mg/ml。
用时以此液配成亚硝酸根标准溶液(亚硝酸根离子浓度为0.01mg/ml)。
三、步骤
1.在150ml三角瓶中装30ml硝化细菌培养基,灭菌。
2.冷却后的培养基中接种1/10土壤悬液1ml,于28℃恒温培养15d,取出三角瓶过滤。
3.用比色法测定滤液中的亚硝酸含量。
四、硝化作用强度
硝化作用强度=(原始培养基中亚硝酸根含量-培养后培养基中亚硝酸根含量)/原始培养基中亚硝酸根含量*100%。
