北师大版无机化学课件 配位平衡
合集下载
配位平衡和配位滴定法PPT课件
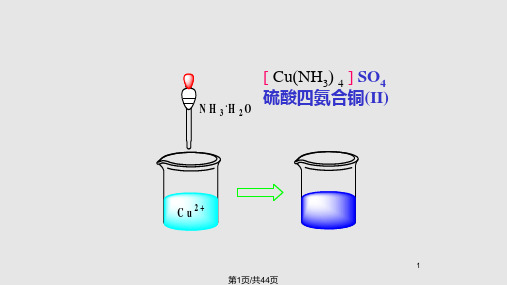
第2页/共44页
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
无机化学 第十章 配位化学与配位平衡

四、价键理论的局限性
(1)不能解释d9电子构型的Cu2+为什么会有平面四边形的配合 物如[CuCl4]2-,如果采取dsp2杂化, Cu2+必须有一个未成对 电子从3d轨道激发到外层轨道上,这个电子能量升高,应使 配合物不稳定,这与事实相悖。
(2)不能解释过渡金属配合物的颜色问题。 (3)无法解释配离子的稳定性与中心离子电子构型之间的关系。
我们只讨论配位数是6的八面体场的晶体场。
10-4-1 中心原子d轨道在配位场中的分裂 ∙ 分裂能△ ∙ 光谱化学系列
在八面体型的配合 物中,6个配位体分别占 据八面体的6个顶点,由 此产生的静电场叫做八 面体场。八面体场中d 轨道与配体间的相互关 系如图所示:
配位场中,原来简并的5个d轨道发生分裂。dz2和dx2-y2 轨 道的电子云正好与配体相碰,受到配体带负电的孤对电子的排
o = 408 kJ·mol-1
[Ir(NH3)6] 3+
o = 490 kJ·mol-1
配体对 的影响(光谱化学序列)
对于相同的中心离子而言,分裂能因配位场的强弱不同而 异。对八面体场来说,不同配位体的场强顺序为:
I- < Br- < S2- < SCN- < Cl- < NO3- < F- < OH-< C2O42< H2O < NCS- < NH3 < en < bipy < NO2-< CN - < CO
↑↑↑↑↑
Fe3+
3d
4s
4p
4d
↑↑↑↑↑
[Fe(H2O)6]3+ sp3d2杂化,外轨型。
3. 利用磁矩判断配合物是内轨或外轨型
无机化学:Chapter 8配位平衡与配位
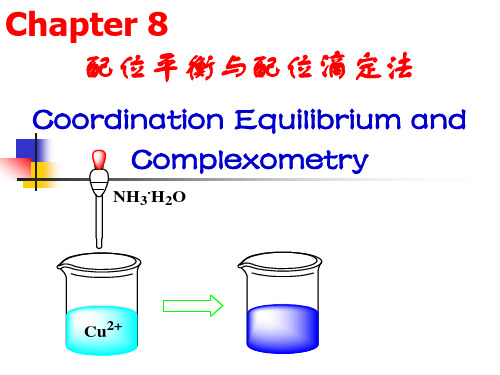
(2)组成
1.中心离子(centralion)或原子(亦称“形成体”)
配合物内界中,位于其结构的几 何中心的离子或原子。
构成 类型
①阳离子:Ag+、Pt2+、Fe2+、Al3+、Si4+
②阴离子:I-→[I(I2)]-,S2-→[S(S8)]2③中性原子:Fe、Ni
2.配位体(Ligand)
配合物内界之中,位于中心原子或离子
②设0.1molAgI完全溶于1LKCN溶液中,则有 竞争平衡:AgI + 2CN- [Ag(CN)2]- + I-
平衡时 c(CN-)= c-0.1× 2
0.1
0.1
同样可计算c(CN-)=2.58×10-4 mol·L-1,起始 KCN浓度为:c=0.1 ×2+ 2.58×10-4=0.2 mol·L-1, 即为完全溶解的最低起始浓度。
解:①设0.1molAgI完全溶于1L氨水,则有竞 争平衡:AgI + 2NH3 [Ag(NH3)2]+ + I-
平衡时 c-0.1× 2
0.1
0.1
K
j
c([ Ag (NH3 )2 ] ) c(I ) c2 (NH3 )
K sp,AgI
K
f
c-0.2=6.25 ×103(mol·L-1),c≈ 6.25 ×103(mol·L-1), 氨水不能达到如此浓度,故不能溶解。
反应后:
0.3-0. 1 ×2=0.1 0.1
2 ×0.1
平衡时: x 0.1+2x ≈0.1 0.1-x≈0.1 0.2-2x≈0.2
Kj
c(
Ag
)
c
2
无机化学:配位平衡

较它们的稳定性。
第三节 配合物的稳定性
[Cu(NH3)4]2+ = Cu2+ + 4NH3
反应平衡常数为
K
[Cu 2 ][NH3 ]4 [Cu(NH 3 )42 ]
K称为[Cu(NH3)4]2+的不稳定常数,用K不稳表示。
K不稳越大, [Cu(NH3)4]2+越容易离解,配离子越
不稳定。
K稳
1 K 不稳
第三节 配合物的稳定性
(二) 影响配合物稳定性的因素 (一)鳌合效应
(二)软硬酸碱理论 (自学) 1. 中心离子的影响 2. 配体的影响
第三节 配合物的稳定性
什么是螯合物? 中心离子与多齿配体 形成的配合物
一、螯合物的结构特点: 具有多元环状结构
二、螯合物的稳定性: 稳定常数比较
返回
第三节 配合物的稳定性 一、配体的分类
2.091013
x 4.81017 mol L1
[Cu 2 ] x 4.81017 mol L1
计算结果说明什么?
结论:配合物十分稳定,游离态的中心离子浓度很小。
返回
第三节 配合物的稳定性
K稳值越大,生成配离子的倾向越大,解 离的倾向越小。
稳定常数的大小直接反映了配离子稳定 性的大小。对于同一类型配合物,K稳值越 大,配合物越稳定。
1035
[Fe2
]
[Fe(CN )64 ] 1035[CN ]6
E
(Fe(CN
)63
/
Fe(CN
)64
)
E
(Fe3
/
Fe 2
)
0.059
log
[Fe3 [ Fe 2
] ]
0.77
第三节 配合物的稳定性
[Cu(NH3)4]2+ = Cu2+ + 4NH3
反应平衡常数为
K
[Cu 2 ][NH3 ]4 [Cu(NH 3 )42 ]
K称为[Cu(NH3)4]2+的不稳定常数,用K不稳表示。
K不稳越大, [Cu(NH3)4]2+越容易离解,配离子越
不稳定。
K稳
1 K 不稳
第三节 配合物的稳定性
(二) 影响配合物稳定性的因素 (一)鳌合效应
(二)软硬酸碱理论 (自学) 1. 中心离子的影响 2. 配体的影响
第三节 配合物的稳定性
什么是螯合物? 中心离子与多齿配体 形成的配合物
一、螯合物的结构特点: 具有多元环状结构
二、螯合物的稳定性: 稳定常数比较
返回
第三节 配合物的稳定性 一、配体的分类
2.091013
x 4.81017 mol L1
[Cu 2 ] x 4.81017 mol L1
计算结果说明什么?
结论:配合物十分稳定,游离态的中心离子浓度很小。
返回
第三节 配合物的稳定性
K稳值越大,生成配离子的倾向越大,解 离的倾向越小。
稳定常数的大小直接反映了配离子稳定 性的大小。对于同一类型配合物,K稳值越 大,配合物越稳定。
1035
[Fe2
]
[Fe(CN )64 ] 1035[CN ]6
E
(Fe(CN
)63
/
Fe(CN
)64
)
E
(Fe3
/
Fe 2
)
0.059
log
[Fe3 [ Fe 2
] ]
0.77
《配位平衡教学》课件

登录
课件界面:熟悉课件界面,了 解各个功能模块的位置和作用
课件操作流程
打开PPT课件,选择“开 始”选项卡
点击“新建幻灯片”按钮, 选择“空白”或“标题和 内容”模板
在幻灯片中输入标题和内 容,使用“插入”选项卡 添加图片、表格等元素
使用“动画”选项卡为幻 灯片添加动画效果
点击“幻灯片放映”按钮, 预览课件效果
实验目的:了解配位平衡的 基本原理和实验方法
实验步骤:配制溶液、滴定、 记录数据、分析结果等
实验注意事项:注意安全、 准确操作、认真记录等
配位平衡应用实例
化学实验:配位 平衡在化学反应 中的应用
生物医学:配位平 衡在药物设计和生 物医学中的应用
环境科学:配位 平衡在环境污染 治理中的应用
材料科学:配位平 衡在新材料设计和 合成中的应用
配位平衡教学 PPT课件内容
配位平衡基本概念
配位平衡:指在化学反应中,一种物质与另一种物质形成稳定的化学键的过程 配位平衡常数:描述配位平衡状态的常数,用于衡量配位平衡的程度 配位平衡反应:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的反应 配位平衡原理:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的原理
教学方法效果评估
学生参与度:观察学生在课堂上的参与程度,如回答问题、讨论等 学习成果:通过测试、作业等方式评估学生的学习成果 教学方法适用性:根据学生的反馈和教师的观察,评估教学方法的适用性
教学方法创新性:评估教学方法的创新性和独特性,是否对学生的学习产生积极影响
教学方法改进建议
采用互动式教学, 增加学生参与度
感谢您的观看
汇报人:
在播放过 程中,可 以通过点 击“结束” 按钮来结 束播放
课件界面:熟悉课件界面,了 解各个功能模块的位置和作用
课件操作流程
打开PPT课件,选择“开 始”选项卡
点击“新建幻灯片”按钮, 选择“空白”或“标题和 内容”模板
在幻灯片中输入标题和内 容,使用“插入”选项卡 添加图片、表格等元素
使用“动画”选项卡为幻 灯片添加动画效果
点击“幻灯片放映”按钮, 预览课件效果
实验目的:了解配位平衡的 基本原理和实验方法
实验步骤:配制溶液、滴定、 记录数据、分析结果等
实验注意事项:注意安全、 准确操作、认真记录等
配位平衡应用实例
化学实验:配位 平衡在化学反应 中的应用
生物医学:配位平 衡在药物设计和生 物医学中的应用
环境科学:配位 平衡在环境污染 治理中的应用
材料科学:配位平 衡在新材料设计和 合成中的应用
配位平衡教学 PPT课件内容
配位平衡基本概念
配位平衡:指在化学反应中,一种物质与另一种物质形成稳定的化学键的过程 配位平衡常数:描述配位平衡状态的常数,用于衡量配位平衡的程度 配位平衡反应:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的反应 配位平衡原理:指在配位平衡状态下,一种物质与另一种物质形成稳定的化学键的原理
教学方法效果评估
学生参与度:观察学生在课堂上的参与程度,如回答问题、讨论等 学习成果:通过测试、作业等方式评估学生的学习成果 教学方法适用性:根据学生的反馈和教师的观察,评估教学方法的适用性
教学方法创新性:评估教学方法的创新性和独特性,是否对学生的学习产生积极影响
教学方法改进建议
采用互动式教学, 增加学生参与度
感谢您的观看
汇报人:
在播放过 程中,可 以通过点 击“结束” 按钮来结 束播放
北师大版无机化学课件 配位平衡共40页

44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。—Байду номын сангаас贝多芬
45、自己的饭量自己知道。——苏联
北师大版无机化学课件 配位平衡
56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
60、人民的幸福是至高无个的法。— —西塞 罗
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
45、自己的饭量自己知道。——苏联
北师大版无机化学课件 配位平衡
56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
60、人民的幸福是至高无个的法。— —西塞 罗
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
无机化学教学5章化学平衡PPT课件

05
沉淀溶解平衡
沉淀溶解平衡常数
沉淀溶解平衡常数(Ksp)
表示在一定温度下,难溶电解质在水中的溶解度。
Ksp的表达式
Ksp = [Ca2+][CO32-] / [CaCO3],其中 [Ca2+][CO32-]和[CaCO3]分别代表溶液中钙离子、 碳酸根离子和碳酸钙的浓度。
Ksp的意义
用于判断沉淀的生成和溶解,以及计算溶液中离子 的浓度。
影响沉淀溶解平衡的因素
温度
温度升高,沉淀溶解平衡常数增大,沉淀溶解度 增大。
同离子效应
当溶液中存在与沉淀溶解平衡相同的离子时,会 降低沉淀的溶解度。
浓度
溶液中离子浓度的改变会影响沉淀溶解平衡常数 ,进而影响沉淀的生成和溶解。
盐效应
当溶液中加入强电解质时,会增大沉淀的溶解度 。
沉淀溶解平衡的应用
80%
影响因素
总结词
化学平衡常数受温度、压力、反应物浓度等因素的影响。
详细描述
温度对化学平衡常数的影响较大,温度升高,平衡常数一般会增大;压力对平衡常数的影响较小,但在高压条件 下,平衡常数可能会有所增大;反应物浓度对平衡常数的影响取决于反应的特性,对于可逆反应,反应物浓度的 变化会影响平衡常数的数值。
详细描述
酸碱平衡常数(通常用K表示)是温度的函数,反映了在一定温度下,酸和碱达 到平衡时各自的浓度。这个常数对于理解酸碱反应的本质和预测反应结果至关重 要。
酸碱平衡的移动
总结词
酸碱平衡的移动是化学反应动态平衡的表现,受到温度、压 力、物质的性质和浓度等多种因素的影响。
详细描述
当一个酸碱反应达到平衡状态时,平衡可能会因为温度、压 力、物质的性质或浓度的变化而发生移动。了解平衡移动的 规律对于预测和控制化学反应结果具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解:
Ag++2NH3
Ag(NH3)2+
学
x 2+2x =2 0.1-x=0.1
K稳=[Ag(NH3)2+] / [Ag+][NH3]2 =0.1 / 2x
x =1.47x10-9
J=0.001x1.47x10-9 < Ksp[AgCl]=1.77 x10-10 所以,无沉淀。
实践中,常加入过量的配位剂,降低
11.0.02200.1.100 00..110011..002200..1100 00.8.80022xx 00..1100xx 11..2222xx
学
K=—0.1—*1—.2—
0.8*x
Ag+(aq)+2NH3(aq) [Ag(NH3)2]+ (1) K稳[Ag(NH3)2+]
Ag+(aq)+2S2O32-(aq) [Ag(S2O3)2]3由于(3) = (2)-(1),所以:
2. 掌握水溶液中多重平衡体系的关 系及其计算。
3
Inorganic Chemistry
无 12.1 配合物的稳定常数
机
化
配合物的不稳定常数与稳定常数
学
逐级稳定常数与累积稳定常数
稳定常数的应用
4
Inorganic Chemistry
无 12-1-1 稳定常数与不稳定常数
机 配离子的生成反应。
化
Cu2+ + 4NH3
α{Cu(en)22+ }= y / 0.1
11
Inorganic Chemistry
无 机 化 学
12
Inorganic Chemistry
无 机 化 学
13
Inorganic Chemistry
无 2.计算配位平衡时各离子的浓度
机 例:计算0.1mol/L[Cu(NH3)4]SO4溶液中Cu2+、
8
Inorganic Chemistry
无 稳定常数K稳的应用 机
化
比较配合物的稳定性
学
计算配位平衡的浓度
判断反应的方向
9
Inorganic Chemistry
无 1. 比较配合物的稳定性
机
与根据Ksp来判断溶解度类似, (A) 对同种类型的配离子
化 如: Ag(CN)2–
学
Ag(NH3)2+
K稳 = 1.3×1021 K稳 = 1.1×107
∴ 稳定性: Ag(CN)2– > Ag(NH3)2+
AgCl↓NH3 Ag(NH3)2+
KBr AgBr↓
Na2S2O3 Ag(S2O3)23-
白色
无色
浅黄色
无色
KI AgI
黄色
KCN
Na2S
Ag(CN)2-
Ag2S↓
无色
黑色
10
Inorganic Chemistry
无 (B)不同类型,不可以直接按K稳比较,只能由K稳计 机 算来判断。由K稳值计算相同浓度(如0.1 mol•L-1)配离子
K = x2 / (1.00-2x)2 = 15.6
开平方: x / (1.00-2x) = 3.95
x= 0.444 mol/L
思考:若该题知道溶解度,如何求配合剂的最 低浓度?
23
Inorganic Chemistry
无
4.计算金属与其配离子的 φo值
例: 已知K稳[Cu(NH3)4 +] =2.1x1013,
K1=2.0×104
学
Cu(NH3)2+ + NH3 = Cu(NH3)22+ Cu(NH3)22+ + NH3 = Cu(NH3)32+
K2 =4.7×103 K3 =1.1×103
Cu(NH3)32+ + NH3 = Cu(NH3)42+ K4 =2.0×102
总反应为: Cu2+ + 4NH3 = [Cu(NH3)4]2+
溶液中中心离子的浓度,此值越小,配离子离解度越小,
表示该配合物越稳定。
化 例: CuY2- = Cu2+ + Y4-
K稳
学
0.1-x
xx
6.3×1018
Cu(en)22+ = Cu2+ + 2en
0.1-y
y 2y
4.9×1019
求得: x < y, 故 CuY2- 更稳定。
也可通过计算离解度来比较:α{CuY2- }= x / 0.1
由于(1) = (2)-(3),所以:
K
K稳[Ag(CN)2] K稳[Ag(NH3)2]
18
Inorganic Chemistry
无 例如: 机 25℃时在 [Ag(NH3)2]+溶液中,c(NH3)=1.0 molL-1, 化 c([Ag(NH3)+2])=0.10molL-1,加入Na2S2O3 使c(S2O32-
[Cu(NH3)3]2+ = [Cu(NH3)2]2+ + NH3 K不稳2 = 1 / K稳3
化 [Cu(NH3)2]2+ = [Cu(NH3)]2+ + NH3 K不稳3 = 1 / K稳2
学 [Cu(NH3)]2+ = Cu2+ + NH3
K不稳4 = 1 / K稳1
总的 离解反应: [Cu(NH3)4]2+ = Cu2+ + 4NH3
K稳= K1·K2 ·K3 ·K4= =2.1×1013
配离子总的稳定常数,也称累积稳定常数(常用β表示) 等于逐级稳定常数的乘积。
K稳 ( ) ,表示生成的配合物稳定性
6
Inorganic Chemistry
无 相反过程,称为配合物(配离子)的逐级离解 :
机 [Cu(NH3)4]2+ = [Cu(NH3)3]2+ + NH3 K不稳1 = 1 / K稳4
= - 0.054V
[Cu(NH3)42+] [Cu2+][NH3]4
=K稳
[C u 2 + ]=K 1 稳 = 4 .7 6 X 1 0 -1 4 m o l.L -1
24
Inorganic Chemistry
无 11.2 影响配合物稳定性的因素 机
化
中心离子的结构与性质
学
配位体的性质
25
Inorganic Chemistry
K稳1.11270
0.01x00.0100.0102x0.010
化
学 x00.0.0112001.12107 x8.9106
[Ag]8.9106moLl1
[N 3 ] H [Ag 3 )2 ]( 0 N .0m 1 H 0 L o 1 l
答:略。
16
Inorganic Chemistry
无 2.判断配位反应发生的方向:生成or解离
机 (1)两种配离子之间转化 AB
化 如: Ag(NH3)2++2CN学 K的求法1
Ag(CN)2- + 2NH3
K = [Ag(CN)2- ][NH3] 2 / [Ag(NH3)2+][CN- ]2 ·[Ag +] / [Ag +]
= K稳 [Ag(CN)2- ] / K稳 [Ag(NH3)2+]
= 5.8×1013
17
Inorganic Chemistry
无 K的求法2 机 [Ag(NH3)2]++2CN化 Ag+(aq)+2CN-(aq)
学 Ag+(aq)+2NH3(aq)
[Ag(CN)2]-+2NH3 (1) K
[Ag(CN)2]- (2) K稳[Ag(CN)2-]
[Ag(NH3)2]+(3) K稳[Ag(NH3)2+]
)=1.0molL-1,问 [Ag(NH3)2]+能否完全转化成
学 [Ag(S2O3)2]+ [Ag (NH 3)2]的 K稳1.12107,
[Ag (S2O3)2]3的 K稳2.8811 0。 3
分析:K稳说明[Ag(NH3)2]+肯定向[Ag(S2O3)2]+转化 依据:求平衡时[Ag(NH3)+2]的浓度
和NH3的浓度(已知K稳=4.8×1012)。
化 解:设[Cu2+]=x
学
Cu2++4NH3[Cu(NH3)4]2+
起始 0
0
0.1
平衡 x
4x
0.1-x0.1
(与酸碱平衡近似计算类似)
所以:
0.1
K稳=x—·(—4x—)4 —
答:[Cu2+]=6.03×10-4mol/L,[NH3I]n=o2r.g4a1n×ic1C0h-3emmoils1/4tLry
(2)
K稳[Ag(S2O3)23-]
KK[A(gS2O 3)2]3 K[A(gN3 H )2]
2 1..8 1 8 21 11 7 0 032I.n5or 7 g1 an6 i0 c Chemis20try
无 机
(0.10x)1(.22x)2 x(0.802x)2
2.57106
化K很大 x很 ,, 小则0有 .x100.81.2022 2.57106
19
Inorganic Chemistry
可能发生的反应:
无 (3) AAgg((N3N )32)HH 222S2O S2O 3232 机反 反应 应c前 c前 00.1.100 11.0.0
