盐酸沙拉沙星溶液(成品)检验操作规程
荧光偏振免疫分析方法快速检测沙拉沙星残留

荧光偏振免疫分析方法快速检测沙拉沙星残留宋佩;孟萌;Sergei A Eremin;张太昌;田溪;薛虎寅;张昱;尹永梅;郗日沫【摘要】以异硫氰酸荧光素(FITC)标记沙拉沙星合成荧光标记物,采用薄层色谱法提纯,优化了反应时间、标记物和抗体的工作浓度,建立了沙拉沙星的快速荧光偏振免疫分析法( FPIA).本方法测定沙拉沙星在缓冲液中的半数抑制浓度(IC50)为43.2 μg/L;检测范围为5.7~327 μg/L,可以达到国家规定的动物性食品中兽药最高残留限量(80 μg/kg)的要求.本研究考察了FPIA测定沙拉沙星的动力学过程及对其它4种喹诺酮类药物的交叉反应.结果表明,环丙沙星、恩诺沙星、加替沙星及氧氟沙星的交叉反应率分别为3.3%,1.8%,1.7%和0.7%.在牛奶和猪尿中沙拉沙星的回收率分别在71%~94%和74%~102%之间.本方法操作简单快捷,整个检测过程只需5 min、而且灵敏度较高、特异性强,适用于动物性食品中沙拉沙星残留的快速筛选检测.%To develop a rapid and sensitive fluorescence polarization immunoassay (FPIA) for the determination of sarafloxacin (SAR), fluorescein-labelled tracer (SAR-FITC) was synthesized and purified by TLC. The reaction time, tracer and polyclonal antibody concentration were optimized, and the FPIA method showed a dynamic range from 5. 7 to 327.6 μg/L with IC50 value of 43. 23 μg/L to SAR in buffer. The specificity of the FPIA for SAR was investigated using other 4 quinolones and the cross-reactivity for ciprofloxacin, enrofloxacin, gatifloxacin, ofloxacin were 3. 3%, 1.8%, 1. 7%, 0. 7%, respectively. The recoveries in milk samples ranged from 71% -94%, and those of pig urine samples were in the range of 74% -102%. The FPIA developed in this study is a rapid and convenient method,which is suitable to be used as a screening method to detect residues of sarafloxacin.【期刊名称】《分析化学》【年(卷),期】2012(040)008【总页数】5页(P1247-1251)【关键词】荧光偏振免疫分析;沙拉沙星;喹诺酮类药物;荧光标记【作者】宋佩;孟萌;Sergei A Eremin;张太昌;田溪;薛虎寅;张昱;尹永梅;郗日沫【作者单位】南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071;南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071;Faculty of Chemistry, M.V.Lomonosov Moscow State University, Moscow 119991, Russia;南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071;南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071;南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071;南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071;南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071;南开大学药学院,南开大学药物化学生物学国家重点实验室,天津市分子药物研究重点实验室,天津300071【正文语种】中文沙拉沙星(Sarafloxacin,SAR,图1)属于动物专用的氟喹诺酮类药物,其盐酸盐主要用于治疗鸡与猪的细菌及支原体感染所致的疾病[1]。
盐酸沙拉沙星溶液内控质量标准

GMP管理文件
一、目的:制定盐酸沙拉沙星溶液(成品)的内控标准,规范公司盐
酸沙拉沙星溶液的生产。
二、适用范围:适用于盐酸沙拉沙星溶液的生产与检验。
三、责任者:生产部、检验员、仓库保管员
四、正文:
盐酸沙拉沙星溶液
本品为盐酸沙拉沙星的水溶液.含沙拉沙星(C20H17F2N3O3)应为标示量的91.0%~109.0%.
【性状】本品为淡黄色或黄色澄清液体.
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰保留时间应与对照品溶液的主峰保留时间一致.
(2)本品显氯化物的鉴别反应.
【检查】PH值应为9.6~10.0.
【含量测定】照高效液相色谱法测定.
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以0.05mol/l枸橼酸-0.05mol/l醋酸铵-乙腈(80:10:18)用高氯酸调节PH
值至2.4为流动相;检测波长为274nm。
理论板数按沙拉沙星计算应不低于1600。
测定法精密量取本品适量,用0.1mol/l氢氧化钠溶液制成每1ml中含20ug的溶液,精农牧民量取20ul注入液相色谱仪,记录色谱图;另取沙拉沙星对照品适量,同法测定,按外标法以峰面积计算,即得。
【作用与用途】同盐酸沙拉沙星。
【用法与用量】混饮每1l水鸡20~50mg(以有效成计)连用3~5日
【停药期】(1)100ml:1g (2)100ml:2.5g (3)100ml:5g
【规格】遮光,密封保存。
盐酸沙拉沙星注射液(成品)检验记录
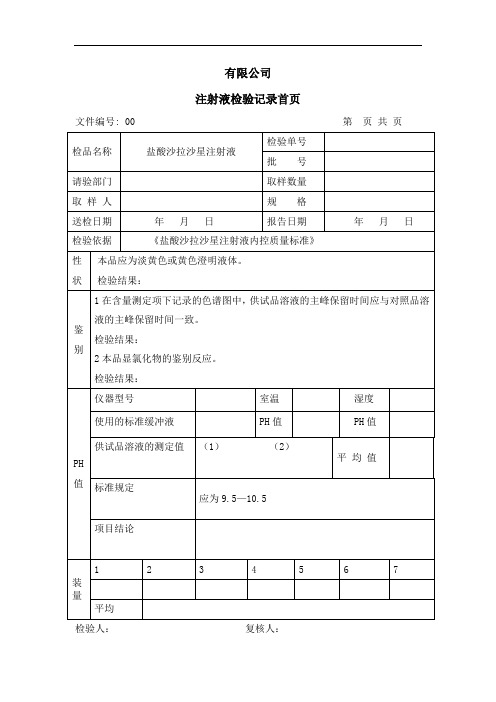
盐酸沙拉沙星注射液
检验单号
批 号
请验单位
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<盐酸沙拉沙星注射液内控质量标准>>
检验项目 标准规定 检验结果 项目结论
(1)性状 本品应为淡黄色或黄色澄明液体。规定
(2)鉴别 (1)在含量测定项下记录的色
谱图中,供试品溶液的主峰保留
负责人: 复核人: 检验人:
有限公司
注射液检验记录报告单
文件编号: 00 第 3 页 共 3页
检品名称
盐酸沙拉沙星注射液
检验单号
批 号
请验单位
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<盐酸沙拉沙星注射液内控质量标准>>
检验项目 标准规定 检验结果 项目结论
(1)性状 本品应为淡黄色或黄色澄明液体。规定
按无水物计,样品含量X(%)
含 量 平 均 值(%)
A-B
相对偏差 ×100%
A+B
标准规定:按干燥品计,含C20H17F2N3O3的量应为标示量的92.0%.~ 108.0%
项目结论:本品按《盐酸沙拉沙星注射液内控质量标准》检验,结果
规定.
检验人: 复核人:
有限公司
注射液检验记录报告单
文件编号:00 第 3 页 共 3页
(2)鉴别 (1)在含量测定项下记录的色
谱图中,供试品溶液的主峰保留
时间应与对照品溶液的主峰保留
时间一致。规定
(2)本品显氯化物的鉴别反应。规定
液相法测定盐酸沙拉沙星脂质体含量和包封率

药物的含量和 包封率 。
一
方 量的大豆 卵磷脂 、 胆固醇 , 溶于适量 的无水 乙醇中 , 得到
类脂溶液。取盐酸 沙拉沙 星溶 液于圆底烧瓶 中 , 6 0  ̄ C 水浴 加热。在搅拌下 , 缓缓将上述类脂溶液滴注到盐酸 沙拉 沙 星溶液 , 搅拌 1 0 ai r n , 旋转蒸发除去 乙醇 , 过0 . 4 5 1 T I 滤膜 , 灌装 , 充氮气 , 封 口, 即得盐酸沙拉 沙星脂质体。
MS - P A数显加热型磁 力搅拌器 , 上海 沃元科技有 限公司 ; 循 环 水 式 多 用 真 空 泵 ,郑 卅I 长城 科工 贸有限公 司 ; 1 < E 一 5 2 9 9 旋转 蒸发器 , 上海 亚荣生化仪器 厂 ; 微量可调加 样器 , 德国 E p p e n d o f公司。
培公司研制的动物专用的第三代氟喹 诺酮 类抗 菌药物 , 具 有抗菌谱广 , 抗菌活性强 , 对革兰氏阴性菌 、 革兰 氏阳性菌
及霉形 体等均表现 出 良好的抗菌作 用 ,尤 其是对大肠 杆 菌、 沙 门氏菌 、 克雷伯氏菌 、 变形杆菌 、 多杀性巴氏杆菌 、 弯 曲杆菌等肠杆菌 。由于盐酸沙拉沙星溶解度小 , 化学稳定 性差 , 有引湿性 , 遇光 、 热色渐变深 。市信 的盐酸 沙拉 沙星 注射液 p H高 , 肌 肉注射后刺激性较大。 目前 , 临床现有的
相, 定容 至刻度 , 用 0 . 4 5 u m 滤膜 过 滤, 吸取上清 液 2 0 u L , 按照 以上 色
1
.
空岛糍艇 体
谱条件 , 测定药物含 量。 标准 曲线 的绘 制 称取 沙拉沙
星对 照品 2 5 . 0 mg ,溶于 O . 1 M 氢氧 化钠溶液 中 , 配制成 1 0 0 u g / mL的
JAP-126 沙拉沙星和达氟沙星检测方法

沙拉沙星和达氟沙星检测方法1.分析目标化合物农药等成分物质 分析目标化合物 沙拉沙星 沙拉沙星达氟沙星 达氟沙星2.仪器设备带荧光检测器的高效液相色谱仪和液相色谱--质谱仪。
3.试剂除下列试剂外,使用附录2所列试剂。
二乙烯基苯基-N-乙烯基吡咯烷酮共聚物小柱(60mg):在内径 8~9 mm聚乙烯管中装填60mg二乙烯基苯基-N-乙烯基吡咯烷酮共聚物或具有同等分离特性的物质。
4.标准品盐酸沙拉沙星:含沙拉沙星90%以上。
甲磺酰酸达氟沙星 :含达氟沙星77%以上,熔点为327℃。
5.试验溶液的制备a 肌肉和脂肪① 提取方法肌肉:尽可能除去脂肪层,搅碎混合均匀后,称取其5.0g。
脂肪:尽可能除去肌肉层,搅碎混合均匀后,称取其5.0g。
加入100mL乙腈:0.3%偏磷酸溶液(2:3)的混合溶液,搅拌后,用涂布2~3mm 厚硅藻土的滤纸,抽滤于磨口减压浓缩器中。
取出滤纸上的残留物,加入20mL乙腈:0.3%偏磷酸溶液(2:3)的混合溶液,搅拌后,按上述同样操作,合并滤液于减压浓缩器中,40℃以下浓缩至约30mL。
② 净化方法在二乙烯基苯基-N-乙烯基吡咯烷酮共聚物小柱(60mg)中顺次注入5mL甲醇和10mL水,弃去流出液。
柱中注入①提取方法所得的溶液后,注入水10mL,弃去流出液。
注入10mL甲醇,收集流出液于磨口减压浓缩器中,40℃以下除去甲醇。
残留物中加入1.0mL乙腈:水(1:4)混合溶液溶解,此为试验溶液。
b 肝脏和肾脏① 提取方法搅碎混合均匀后,称取其5.00g。
加入100mL乙腈:0.3%偏磷酸溶液(2:3)的混合溶液,搅拌后,加入5g硅藻土,振荡混匀后,用涂布2~3mm 厚硅藻土的滤纸,抽滤于磨口减压浓缩器中。
取出滤纸上的残留物,加入20mL乙腈:0.3%偏磷酸溶液(2:3)的混合溶液,搅拌后,按上述同样操作,合并滤液于磨口减压浓缩器中,40℃以下浓缩至约30mL。
② 净化方法采用a 肌肉和脂肪中② 净化方法。
2017年版《兽药质量标准》勘误表

352
驱球止痢合剂说明书
【规格】
【规格】每1ml相当于原生药2g。
生物制品卷
序号
页码
标准名称
原内容
修正内容
1
320
猪白细胞干扰素
附加说明:
1.本标准由山东省乐至县世红生物技术有限公司提出。
附加说明:
1.本标准由四川省乐至县世红生物技术有限公司提出。
2
352
猪伪狂犬病活疫苗(HB-98株)
反应体系:
【主要成分与含量】疫苗中含有鸡传染性法氏囊病低毒力A80株,每0.1ml病毒含量应≥106.0ELD50。
中国兽医药品监察所办公室2018年3月23日印发
【药物相互作用】……②Ca2+、Mg2+、Fe3+和Al3+等重金属离子可与本品可发生螯合,……
590、
591
盐酸沙拉沙星可溶性粉
592、593
盐酸沙拉沙星注射液
594、
595、596
盐酸沙拉沙星溶液
596、597、598
盐酸环丙沙星可溶性粉
599、600
盐酸环丙沙星注射液
16
620、621、622
【规格】按C22H24N2O7计算……。
【规格】按C14H24N2O7计算……。
13
577
盐酸吖啶黄注射液说明书
兽用非处方药
兽用处方药
14
578
盐酸多西环素子宫注入剂说明书
兽用处方药
兽用非处方药
15
588、
589
盐酸沙拉沙星片
【药物相互作用】……②Ca2+、Mg2+、Fe3+和Ab3+等重金属离子可与本品可发生螯合,……
盐酸沙拉沙星可溶性粉生产工艺规程

制药有限公司盐酸沙拉沙星可溶性粉工艺规程颁发单位:GMP办公室工艺规程批准程序目录1、产品概述 (3)2、生产的工艺流程图 (5)3、操作过程及工艺条件 (6)4、工艺过程中所需SOP名称及要求 (9)5、工艺卫生及环境卫生 (9)6、工艺验证及具体要求 (10)7、设备一览表及主要设备生产能力 (10)8、物料平衡及经济技术指标计算 (10)9、技术安全及劳动保护 (11)10、岗位定员 (12)1.产品概述1.1 产品名称:通用名:盐酸沙拉沙星可溶性粉商品名:1.2 性状:本品为白色或淡黄色粉末。
1.3 规格:2.5%1.4 处方:盐酸沙拉沙星2.5g,口服葡萄糖加至100g。
1.5 依据:2005版《中国兽药典》一部。
1.6 适应症:抗菌药,主要畜禽细菌感染1.7 有效期:二年1.8 成品贮存方法及注意事项:遮光、密封,在干燥处保存。
1.9 原辅材料、半成品和成品质量标准:盐酸沙拉沙星质量标准见盐酸沙拉沙星内控质量标准。
口服葡萄糖质量标准见口服葡萄糖内控质量标准。
半成品质量标准见盐酸沙拉沙星可溶性粉半成品内控质量标准。
成品内控质量标准见盐酸沙拉沙星可溶性粉内控质量标准。
1.10 原辅材料贮存注意事项:盐酸沙拉沙星:遮光、密封,在干燥处保存。
口服葡萄糖:密封保存。
1.11 半成品检查方法及岗位控制:a质量控制要点:b 半成品检查方法见盐酸沙拉沙星可溶性粉半成品检验操作规程。
1.12 包装要求:应符合铝箔袋质量内控标准要求。
1.13 用法用量:1.14 标签:见样本。
1.15 批准文号:2.生产的工艺流程图注:加粗部分为主要控制点3 .操作过程及工艺条件3.1 生产前准备:3.1.1 上一批次是否进行清场。
清场者、检查者是否签字,将“清场合格证”副件归入本批生产记录。
未取得清场合格证不得进行下一批次的生产。
3.1.2 检查生产场所的环境、设施卫生是否符合该区域清洁卫生要求。
不得有上批生产遗留物。
成品检验操作规程

河南惠通天下生物工程有限公司GMP管理文件一、目的:规范氧氟沙星可溶性粉的检验操作规程。
二、适用范围:适用于氧氟沙星可溶性粉的质量检验。
三、责任者:QC负责执行,质量管理部主管负责监督。
四、正文:本品为氧氟沙星与葡萄糖或乳糖配制而成。
含氧氟沙星(C18H20FN3O4)应为标示量的92.0~108.0%。
1.性状本品为白色或微黄色粉末。
2.鉴别2.1吸收度2.1.1仪器及试剂分光光度计、电子天平、容量瓶(100ml)、盐酸溶液(0.1mol/L)。
2.1.2操作方法及结果判断取含量测定项下的照分光光度法(附录17页)侧定,在293nm的波长处有最大吸收。
则符合规定,反之,则不符合规定。
2.2薄层法2.2.1仪器及试剂电子天平、紫外灯、展开缸、氯仿、甲醇、氨溶液、硅胶GF254薄层板。
2.2.2操作方法及结果判断取本品适量(约相当于氧氟沙星40mg),加氯仿10ml,振摇使氧氟沙星全部溶解,滤过,取滤液作为供试品溶液;另取氧氟沙星对照品适量,加氯仿制成每1ml中含4mg 的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4→100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色与位置应与对照品溶液的主斑点相同,则符合规定,反之,则不符合规定。
3.检查3.1溶解性3.1.1仪器及试剂天平、烧杯,玻璃棒。
3.1.2操作方法及判定结果取本品1.0g,加水50ml,搅拌,应全部溶解。
全部溶解则符合规定,反之,则不符合规定。
3.2干燥失重3.2.1仪器及试剂恒温干燥箱、电子天平、干燥器、扁形称量瓶。
3.2.2操作方法照干燥失重检查法操作规程,依法检查,取本品1g,置与供试品同样条件下干燥至恒重的扁形称量瓶中,精密称定,放入105℃的恒温干燥箱中进行干燥,干燥后取出置干燥器中放冷至室温一般约30分钟,精密称定,接着继续按上法干燥,直至恒重。
盐酸沙拉沙星可溶性粉成品检验记录
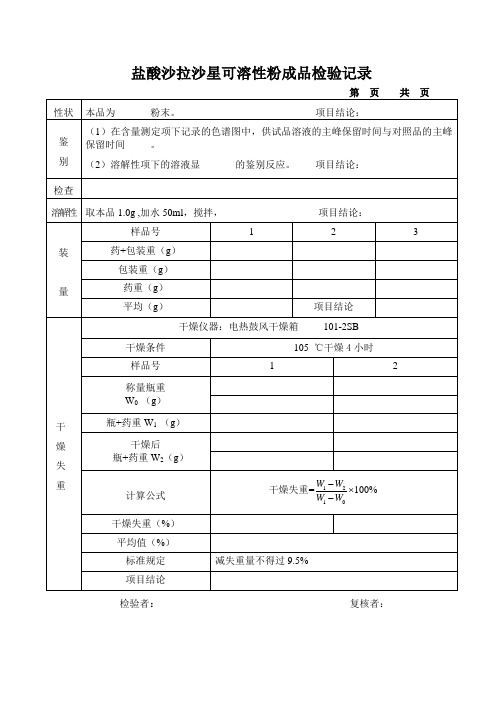
页
共
页
本品为
粉末。
项目结论:
(1)在含量测定项下记录的色谱图中,供试品溶液的主峰保留时间与对照品的主峰 保留时间 。 (2)溶解性项下的溶液显 的鉴别反应。 项目结论:
项目结论: 1 2 3
项目结论 101-2SB
105 ℃干燥 4 小时 1 2
柱温 ————
检测波长 ———— 274nm 进样量:20μι
供试品溶液的制备:精密称取本品约 2g,置 50ml 量瓶中,加 0.1mol/L 的氢氧化钠溶液溶解并 稀释至刻度, 精密量取 2ml, 100ml 量瓶中, 0.1mol/L 的氢氧化钠溶液溶解并稀释至刻度, 置 用 制成每 1ml 中含 20ug 沙拉沙星的溶液,精密量取 20ul 注入液相色谱仪,记录色谱图。 稀释倍数 DT:2500 对照品溶液的制备:精密称取沙拉沙星对照品 50mg,同法制成每 1ml 中含 20ug 沙拉沙星的溶 液,精密量取 20ul 注入液相色谱仪,记录色谱图。 内容 样品编号 样品质量 WT(g) 样品峰面积 AT 对照品质量 WS(g) 对照品峰面积 AS 1 稀释倍数 DS:2500 2
计算公式
X
AT WS N DT 100% AS WT DS S
样品规格 S= 对照品含量 CS=
% %
样品标示量的百分含量 X(%) 含量平均值(%)规定 项目结论 检验者: 含沙拉沙星应为标示量的 92.0%~108.0% 复核者:
盐酸沙拉沙星可溶性粉成品检验记录
第 性状 鉴 别 检查 溶解性 取本品 1.0g ,加水 50ml,搅拌, 样品号 装 药+包装重(g) 包装重(g) 量 药重(g) 平均(g) 干燥仪器:电热鼓风干燥箱 干燥条件 样品号 称量瓶重 W0 (g) 干 燥 失 重 瓶+药重 W1 (g) 干燥后 瓶+药重 W2(g)
盐酸沙拉沙星片工艺

盐酸沙拉沙星片工艺
盐酸沙拉沙星片是一种抗生素,用于治疗细菌感染。
它的生产工艺通常包括以下步骤:
1. 原料准备,首先,需要准备原料,包括沙拉沙星原料药和盐酸。
这些原料需要符合药典规定的质量标准,并经过严格的质量检验。
2. 反应制备,将沙拉沙星原料药与盐酸按一定的摩尔比例加入反应釜中,在适当的温度、压力和pH条件下进行反应,生成盐酸沙拉沙星。
3. 结晶分离,反应结束后,通过控制温度和搅拌速度,使盐酸沙拉沙星逐渐结晶沉淀。
然后进行过滤、洗涤和干燥等工艺步骤,得到成品盐酸沙拉沙星片。
4. 质量控制,在生产过程中需要进行严格的质量控制,包括对原料、中间体和成品的质量监控,确保产品符合药典规定的质量标准。
5. 包装储存,最后,将成品盐酸沙拉沙星片进行包装,并进行质量检验,然后进行储存和出厂。
需要注意的是,生产过程中需要严格遵守相关的药品生产管理规范,确保产品的质量和安全性。
同时,还需要关注环保要求,合理处理生产过程中产生的废水、废气和废渣,保护环境。
紫外分光光度法测定盐酸沙拉沙星可溶性粉中沙拉沙星方法的建立

紫外分光光度法测定盐酸沙拉沙星可溶性粉中沙拉沙星方法的建立邵耀东;逄树君;杨振华;张凤;徐峰【摘要】为了快捷简便地测定盐酸沙拉沙星可溶性粉生产过程中沙拉沙星的含量,采用紫外分光光度法测定沙拉沙星的含量.结果表明,沙拉沙星对照品质量浓度在2.4 μg/mL~12.0 μg/mL范围内与吸收度呈良好的线性关系,线性回归方程A=0.088C+0.09,r=0.999 9(n=5),平均回收率为99.74%,RSD=0.47%(n=5),与高效液相色谱法比较结果一致.【期刊名称】《动物医学进展》【年(卷),期】2010(031)003【总页数】3页(P68-70)【关键词】盐酸沙拉沙星可溶性粉;含量测定;紫外分光光度法【作者】邵耀东;逄树君;杨振华;张凤;徐峰【作者单位】青岛康地恩药业有限公司,山东青岛,266111;青岛六和药业有限公司,山东青岛,266111;青岛康地恩药业有限公司,山东青岛,266111;青岛康地恩药业有限公司,山东青岛,266111;青岛康地恩药业有限公司,山东青岛,266111;青岛六和药业有限公司,山东青岛,266111【正文语种】中文【中图分类】S859.796沙拉沙星是动物专用的氟喹诺酮类药物,药用其盐酸盐,作用于各种革兰阴性菌和革兰阳性菌。
盐酸沙拉沙星可溶性粉用途广泛,主要用于鸡细菌性和支原体感染性疾病,如鸡的大肠埃希菌病、沙门菌病、巴氏杆菌病、支原体病和葡萄球菌感染等[1-4]。
在农业部《兽药质量标准》2003年版[5]中“盐酸沙拉沙星可溶性粉”含量测定是用高效液相色谱法,该方法专属性强,测量准确度高,但是费时、操作繁琐、技术性较高。
紫外分光光度法测定盐酸沙拉沙星可溶性粉的含量操作简单、快速,可以用于盐酸沙拉沙星可溶性粉生产过程中半成品含量的控制。
笔者参照其他喹诺酮类药物制剂含量测定方法[6-13],建立了紫外分光光度法测定盐酸沙拉沙星可溶性粉含量的方法,现报道如下。
盐酸沙拉沙星质量标准+盐酸沙拉沙星检验操作规程

盐酸沙拉沙星质量标准文件类别SMP 起 草: 年 月 日 审 核: 年 月 日 批 准: 年 月 日 执行日期: 年 月 日 文件名称盐酸沙拉沙星质量标准 文件编码 SMP-QMP20402 目的:制定盐酸沙拉沙星的质量标准。
适用范围:盐酸沙拉沙星的检验责任人:化验员、化验室主任、质量部长。
内容:本品为1-(4-氟苯基)-6-氟-4-氧代-1,4二氧-7-(1-哌嗪基)-3-喹啉羧酸盐酸盐。
按干燥品计算,含C 20H 17F 2N 3O 3·HCL 不得小于98.0%。
【性状】本品为类白色至淡黄色结晶性粉末;无臭,味微苦;有引湿性;遇光、遇热色渐变深。
本品在水或乙醇中几乎不溶或不溶,在氢氧化钠试液中溶解。
【鉴别】 (1)取本品约10mg ,置干燥试管中,加丙二酸约30mg 与加醋酐1.0ml ,在水浴中加热5~10分钟,溶液即显红棕色。
(2)取本品适量,加0.1mol/L 的氢氧化钠溶液制成每1ml 中含6μg 的溶液,照紫外-可见分光光度法测定,在274nm 、323nm 与334nm 波长处应有最大吸收。
(3)本品显氯化物的鉴别反应。
【检查】 酸度 取本品0.1g ,加水100ml ,置超声浴中超声使溶解,依法测定,pH 应为3.5~5.0。
溶液的澄清度与颜色 取本品0.1g ,加0.1mol/L 氢氧化钠溶液10ml 超声溶解后,溶液应澄清无色;如显色,与黄色或黄绿色3号标准比色液比较,不得更深。
氟 取本品约25mg,精密称定,照氟检查法测定,按干燥品计算,含氟量不得少于8.1%。
有关物质 照高效液相色谱法测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以0.05mol/L 枸橼酸-0.05mol/L 醋酸铵-乙腈(80:10:18)用高氯酸调节pH 值至2.4为流动相;检测波长为274nm 。
理论板数按盐酸沙拉沙星峰计算应不低于1500。
有关物质峰与主峰的分离度应符合要求。
注射用水检验操作规程企业版(2015版药典)

注射⽤⽔检验操作规程企业版(2015版药典)注射⽤⽔检验操作规程1.⽬的建⽴注射⽤⽔检验作业指导书,规各项操作,检验⽣产、检验⽤⽔质量,以确保产品质量和实验⽤⽔符合要求。
2.适⽤围本规程适⽤于质量部检验⼈员。
3.引⽤标准GB/T 6682-2008 分析实验室⽤⽔规格和试验⽅法《中华⼈民国药典》2015版纯化⽔和注射⽤⽔相关标准及检验⽅法GBT 14233.1-2008 医⽤输液、输⾎、注射器具检验⽅法第1部分:化学分析⽅法GBT 14233.2-2005 医⽤输液、输⾎、注射器具检验⽅法第2部分:⽣物试验⽅法4.职责质量部检验员需按照本规程进⾏注射⽤⽔检验的操作。
5.操作要求5.1 企业⽤⽔使⽤情况5.1.1⽣活饮⽤⽔1)⼀般⽣产车间和检验车间的仪器和设备卫⽣清洁;2)产品前期处理中作为⼀般溶剂;3)产品前期清洗;4)制备纯化⽔的原料⽔。
5.1.2纯化⽔1)洁净室仪器和设备卫⽣清洁;2)产品洁净环境处理过程中作为⼀般溶剂;3)检验室实验⽤⽔,作为⼀般溶剂;4)洗⾐房清洗专⽤;5)制备注射⽤⽔的原料⽔。
5.1.3注射⽤⽔1)洁净室产品末道清洗和保湿⽤⽔;2)冻⼲产品回潮和恒湿⽤⽔;3)局部100级⼯作环境清洁、消毒中作为⼀般溶剂;4)返⼯⼯序清洁使⽤。
5.2取样及贮存5.2.1 容器1)所有⽤⽔均可使⽤密闭的、专⽤聚⼄烯容器。
⽣活⽤⽔和纯化⽔可使⽤密闭、专⽤的玻璃容器。
如:具硅胶塞三⾓烧瓶。
2) 新容器在使⽤前需⽤盐酸溶液(质量分数为20%)浸泡2d~3d,再⽤待测反复冲洗,并注满待测⽔浸泡6h以上。
5.2.2 取样1)按本操作规程进⾏试验,⾄少应取3L有代表性⽔样。
2) 取样前⽤待测⽔反复清洗容器,取样时要避免沾污。
⽔样应注满容器。
5.2.3 取样1)企业各⽤⽔在贮存期间,其污染的主要来源是容器可溶成分的溶解、空⽓中的⼆氧化碳和其他杂质。
因此,按照国家标准,纯化⽔和注射⽤⽔可适量制备,分别贮存在预先经同级⽔清洗过的相应容器中。
盐酸沙拉沙星注射液(成品)检验操作规程

GMP管理文件一、目的:为规定盐酸沙拉沙星注射液生产过程中的质量控制和检验操作要求,特制定此操作规程。
二、适用范围:适用于盐酸沙拉沙星注射液半成品的检验。
三、责任者:生产部经理、检验员、生产人员四、正文:质量标准:见盐酸沙拉沙星注射液(成品)内控质量标准技术要求:1.1物理性状:本品为淡黄色澄明液体。
1.2该产品应符合以下标准:2.鉴别2.1仪器与用具高效液相色谱仪2.1操作方法2.2.1 在含量测定项下记录的色谱图中,供试品溶液的主峰保留时间应与对照品溶液的主峰保留时间一致。
2.2.2本品显氯化物的鉴别反应。
3.检查3.1仪器与用具酸度计、量筒3.2操作方法酸度取本品适量依法检查,PH值应为9.6~10.0。
装量取本品5瓶,用量筒称量,应符合规定。
其他应符合注射项下有关的各项规定。
4.含量测定4.1仪器与用具分析天平、高效液相色谱仪4.2试剂与溶液0.05mol/l枸橼酸-0.05mol/l醋酸铵-乙腈(80:10:18)用高氯酸调节PH值至2.4。
4.3操作方法精密称取本品适量,用0.1mol/l氢氧化钠溶液制成每1ml中含20ug 的溶液,精密量取20ul注入液相色谱仪,记录色谱图;另取沙拉沙星对照品适量,同法测定,按外标法以峰面积计算,4.4结果计算X=AS*WC*N/AC*VC式中:AC----样品峰面积WC----对照品取量(g)N-----对照品含量(%)AC----对照品峰面积VS----样品取量(g)取两个样做平行试验,以平均值为最后结果。
5.取样规则:见《取样操作规程》6.制剂:盐酸沙拉沙星注射液。
7.贮存:遮光,密封保存。
盐酸沙拉沙星可溶性粉(成品)检验操作规程

GMP管理文件
一、目的:为规定盐酸沙拉杀星可溶性粉生产过程中的质量控制
和检验操作要求,特制定此操作规程。
二、适用范围:适用于盐酸沙拉杀星可溶性粉品的检验。
三、责任者:生产部经理、检验员、生产人员
四、正文:
质量标准:见盐酸沙拉杀星可溶性粉(成品)内控质量标准
操作内容:
【性状】本品为白色或淡黄色的粉末。
【鉴别】(1)取含量测定项下记录的色谱图,供试品溶液的主峰保留时间应与对照品溶液的主峰保留时间一致。
(2)溶解性项下的溶液显氯化物的鉴别反应。
【检查】溶解性取本品1.0g,加水50ml,搅拌,应全部溶解。
干燥失重取本品,在105℃干燥4小时,减失重量不得过10.0%.
装量按最低装量检查法检查,应符合规定.
【含量测定】照高校液相色谱法测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;
以0.05 mol/L枸橼酸-0.05 mol/L醋酸铵-乙腈(80:10:18)用高氯酸调节pH值至2.4为流动相;检测波长为274nm,理论板数按沙拉沙星峰计算应不低于1500.
测定法精密称取本品适量,用0.1mol/L氢氧化钠溶液制成每1ml 含20ug的溶液,精密量取20ul注入液相色谱仪,记录色谱图;另取沙拉沙星对照品适量,同法测定,按外标法以峰面积计算,即得。
氧氟沙星注射液(成品)检验操作规程

GMP管理文件一、目的:为规定氧氟沙星注射液生产过程中的质量控制和检验操作要求,特制定此操作规程。
二、适用范围:适用于氧氟沙星注射液成品的检验。
三、责任者:生产部经理、检验员、生产人员四、正文:质量标准:见氧氟沙星注射液(成品)内控质量标准操作内容:【性状】本品为淡黄色或淡黄绿色澄明液体一。
【鉴别】(1)取本品适量(约相当于氧氟沙星20mg),置水浴上蒸干,加丙二酸30mg,加醋酐约10滴,置沸水浴上加热3分钟,显红棕色。
(2)取本品适量,加0.1mol/l盐酸溶液制成每1ml中含氧氟沙星10mg的溶液,作为供试品溶液;另取氧氟沙星对照品适量,加0.1mol/l盐酸溶液制成每1ml中含10mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4→100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点相同。
(3)取含量测定项下的溶液,照分光光度法测定,在294nm波长处有最大吸收。
【检查】 PH值应为3.6~4.9。
颜色取本品,加水稀释成每1ml中含2mg的溶液,与黄色5号或黄绿色5号标准比色液比较,不得更深。
热原取本品,加灭菌注射用水制成每1ml中含氧氟沙星10mg的溶液,依法检查,剂量按家兔每1kg体重注射2ml,应符合规定。
其他应符合注射剂项下有关的各项规定。
【含量测定】精密量取本品适量(约相当于氧氟水沙星60mg),置200ml量瓶中,加0.1mol/l盐溶液稀释至刻度,摇匀;精密量取2ml,置100ml量瓶中,用0.1mol/l盐酸溶液稀释至刻度,摇匀,照分光光度法,在294nm波长处测定吸收度;另取在105℃干燥至恒重的氧氟沙星对照品约60mg,同法测定;计算,即得。
兽药盐酸沙拉沙星质检报告

产品检验报告产品名称盐酸沙拉沙星可溶性粉检验日期2012年04月25日规格100g/桶报告日期2012年05月02日检品来源仓库待验区检验项目全检批号20120425 数量100kg检验依据《兽药质量标准》2005年版检验项目标准规定检验结果项目结论【性状】本品应为类白色至淡黄色结晶性粉末本品为淡黄色结晶性粉末符合规定无臭,味微苦,有引湿性无臭,味微苦,有引湿性【鉴别】(1)应符合规定符合规定符合规定(2)在274、323、334nm的波长处在274、323、334nm的波长应有最大吸收处有最大吸收符合规定(3)本品的红外吸收图谱应与对照图谱一致符合规定符合规定(4)应显氯化物的鉴别反应符合规定符合规定【检查】酸度应为3.0~5.0 3.9 符合规定澄清度与颜色应符合规定符合规定符合规定氟应符合规定符合规定符合规定有关物质应符合规定符合规定符合规定干燥失重减失重量不得过8.0% 减失重量为4.2% 符合规定炽灼残渣不得过0.2% 测得的结果为0.06% 符合规定重金属应符合规定符合规定符合规定检验结论:依据《兽药质量标准》2005年版检验,结果符合规定。
备注:/检验人复核人负责人产品检验报告产品名称硫酸安普霉素可溶性粉检验日期2012年04月25日规格100g/袋报告日期2012年05月02日检品来源仓库待验区检验项目全检批号20120425 数量100kg检验依据《兽药质量标准》2005年版检验项目标准规定检验结果项目结论【性状】本品应为类白色至淡黄色结晶性粉末本品为淡黄色结晶性粉末符合规定无臭,味微苦,有引湿性无臭,味微苦,有引湿性【鉴别】(1)应符合规定符合规定符合规定(2)在274、323、334nm的波长处在274、323、334nm的波长应有最大吸收处有最大吸收符合规定(3)本品的红外吸收图谱应与对照图谱一致符合规定符合规定(4)应显氯化物的鉴别反应符合规定符合规定【检查】酸度应为1.5~3.0 2.0 符合规定澄清度与颜色应符合规定符合规定符合规定氟应符合规定符合规定符合规定有关物质应符合规定符合规定符合规定干燥失重减失重量不得过0.05% 减失重量为0.02% 符合规定炽灼残渣不得过0.5% 测得的结果为0.2% 符合规定重金属应符合规定符合规定符合规定检验结论:依据《兽药质量标准》2005年版检验,结果符合规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GMP管理文件
一、目的:为规定盐酸沙拉沙星溶液生产过程中的质量控制和检
验操作要求,特制定此操作规程。
二、适用范围:适用于盐酸沙拉沙星溶液成品的检验。
三、责任者:生产部经理、检验员、生产人员
四、正文:
质量标准:见盐酸沙拉沙星溶液(成品)内控质量标准
操作内容:
【性状】本品为淡黄色或黄色澄清液体.
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰保留时间应与对照品溶液的主峰保留时间一致.
(2)本品显氯化物的鉴别反应.
【检查】PH值应为9.6~10.0.
【含量测定】照高效液相色谱法测定.
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以0.05mol/l枸橼酸-0.05mol/l醋酸铵-乙腈(80:10:18)用高氯酸调节PH值至2.4为流动相;检测波长为274nm。
理论板数按沙拉沙
星计算应不低于1600。
测定法精密量取本品适量,用0.1mol/l氢氧化钠溶液制成每1ml 中含20ug的溶液,精农牧民量取20ul注入液相色谱仪,记录色谱图;另取沙拉沙星对照品适量,同法测定,按外标法以峰面积计算,即得。
