海水腐蚀情况讲解
海洋腐蚀因素分析报告

海洋腐蚀因素分析报告随着全球海洋经济的发展,海洋设施的建设和海上活动的增加,海洋腐蚀问题日益引起人们的关注。
本文通过对海洋腐蚀的因素进行分析,旨在为相关领域提供参考和解决方案。
首先,海水中的盐分是导致海洋腐蚀的主要因素之一。
海水中含有大量的氯离子和硫酸根离子,它们会与金属表面发生化学反应,使金属产生腐蚀。
此外,海水中的氧气也会参与腐蚀反应,加速金属的氧化过程。
其次,海洋环境中的温度和湿度也对腐蚀起着重要作用。
海洋环境中的高温和高湿度会导致金属表面的水分蒸发缓慢,形成细小的水滴,进而加速金属腐蚀的发生。
此外,海洋环境中的温度变化较大,金属表面会发生热胀冷缩的变化,加剧了金属腐蚀的程度。
第三,海洋环境中的微生物也是导致海洋腐蚀的重要因素。
海水中富含微生物,它们能够附着在金属表面并分泌酸性物质,进一步加速金属的腐蚀。
此外,海洋中的微生物还能够形成生物膜,使金属表面形成一层保护膜,导致金属腐蚀的加剧。
最后,海洋环境中的海浪和海风也是导致海洋腐蚀的因素之一。
海浪的冲击力和海风中的盐粒会磨损金属表面的保护层,使金属暴露在腐蚀介质中,从而导致金属的腐蚀加剧。
针对以上海洋腐蚀因素,我们可以采取一些措施来减缓腐蚀的发生。
首先,可以采用防腐涂层来保护金属表面。
防腐涂层可以在金属表面形成一层保护膜,隔绝金属与腐蚀介质的直接接触。
其次,可以选择抗腐蚀材料来替代易腐蚀的金属材料。
抗腐蚀材料具有较高的耐腐蚀性能,能够减缓腐蚀的发生。
此外,定期检查和维护海洋设施也是减少腐蚀的有效手段,及时发现问题并采取相应措施。
总之,海洋腐蚀是一个复杂而严重的问题,涉及到海洋经济和海洋环境保护等诸多领域。
通过对海洋腐蚀因素的分析,我们可以更好地理解其产生的原因,并采取相应的措施来减少腐。
海洋腐蚀因素分析报告

海洋腐蚀因素分析报告近年来,海洋腐蚀问题日益凸显,给海洋工程、航运业以及海洋资源开发带来了巨大的挑战。
为了更好地理解海洋腐蚀的原因和影响,本报告通过对海洋环境、材料特性以及外界因素等方面进行分析,总结了海洋腐蚀的主要因素,以期为相关行业提供参考和解决方案。
海洋环境是海洋腐蚀的主要因素之一。
海洋水中存在大量的盐离子、氧气和微生物等物质,这些物质与金属材料发生化学反应,导致腐蚀的发生。
此外,海洋中的水流、温度和压力等因素也会对腐蚀速度产生影响。
例如,在流速较快的海域,水流会冲刷金属表面,加剧腐蚀的程度。
材料特性是决定腐蚀程度的关键因素。
不同材料的耐腐蚀性能不同,其中金属材料常见的有铁、铝、镍等。
这些金属在海洋环境中会发生电化学反应,从而引发腐蚀。
另外,材料的表面处理、保护涂层等也会对腐蚀起到一定的保护作用。
外界因素也对海洋腐蚀产生重要影响。
例如,海洋中的污染物、化学药剂以及气候变化等因素都会加剧腐蚀的程度。
污染物和化学药剂会与金属发生化学反应,加速腐蚀的发生;而气候变化会导致海洋环境的变化,进而影响腐蚀的速度。
为了应对海洋腐蚀问题,我们需要采取有效的措施。
首先,可以通过选择适合海洋环境的耐腐蚀材料来减少腐蚀的发生。
其次,进行材料的表面处理和涂层保护等措施,提高材料的耐腐蚀性能。
此外,定期检查和维护,及时修复腐蚀损坏的部位,也是减少腐蚀的有效手段。
综上所述,海洋腐蚀是一个复杂而严重的问题,受到海洋环境、材料特性和外界因素的共同影响。
只有深入了解其成因,采取相应的措施,才能有效应对海洋腐蚀问题,保障相关行业的安全和可持续发展。
海水腐蚀

认为是氧浓差电池引起潮差区钢样受阴极 保护。
在全浸区中部(约第8-9段),该区域腐蚀比较严 重,而且随深度加深,腐蚀加大,表明该区域为 阳极区。 这是为什么呢? 查阅文献显示,吃水线区试样的锈层结构与全浸 区不同,不同的锈层结构导致了腐蚀电位的差异,因 而使吃水线区的电位比全浸区高,电位差形成了电 偶电流的驱动力,使吃水线区得到了阴极保护 ,而 全浸区中部成为阳极发生加速腐蚀。
实验结果讨论
在大气区(14段及其上部分),金属虽然和 大气接触,但是该处金属表面平均湿度很 小,因此该区域在电化学腐蚀中扮演的角 色是阴极,故该处腐蚀较小。
对于飞溅区(约11-13段),其处于活跃带, 即有间歇性的风也有海浪的活动。该区域 大部分时间处于湿润状态,表层只有一层 很薄的水分,这样该区域氧充足,在电化 学反应中相对于大气区属于阳极,因而发 生严重的腐蚀。
(2)对锈蚀的表面和质量损失剖面图的观 察表明,吃水线以上的腐蚀机理是氧分压 差,与经典的描述浸泡区的局部腐蚀机理 相符。然而,飞溅区和浸泡阳极区的点蚀 图有很大区别。
海水腐蚀区带环境条件
海水全浸区:
① 浅海区:海水通常为氧饱和,海生物污损、 海水流速、水温、污染等都有可能起重要作 用 ② 大陆架区:无植物污损,动物污损也大大减 少。氧含量有所降低,水温也较低 ③ 深海区:氧含量不一,温度接近0℃,海水流 速低,pH值比表层低。 海泥区:往往存在细菌,如硫酸盐还原菌。海 底沉积物的特征和形状不同。
实验部分
钢条标记为A-G,浸入到海水的深度分别为 0.3m,0.4m,0.5m,„„,0.9m。钢条上半部分暴露 在空气中。钢条经过冷轧处理。经过12个月,钢条 被带回实验室,清除表面蓬松的锈,每一段都被切 成100mm长的条状并按顺序编号,并按照ASTM G32004标准清洗,并测量其质量。
金属海水腐蚀

• 定义
海水腐蚀指金属在海洋环境中遭受腐蚀而 失效破坏的现象
海洋占地球表面积的71%,海水是自然界 中量最大,而且具有很强腐蚀性的天然电解 质
各种海上运输工具、海上采油平台、海 岸设施、军用设施,都可能遭受海水腐蚀
我国沿海工厂常使用海水做为冷却水, 海水泵的铸铁叶轮仅能使用3个月
•海水的组成和性质
➢ 流速
铁、铜等金属存在一个临界流速,超过它, 腐蚀明显加快
但对海水中能钝化的金属,一定的流速能促 进钛、镍合金和高铬不锈钢的钝化和耐蚀性
海水流速很高时,出现了冲刷腐蚀
➢ 生物因素
生物因素对腐蚀影响很复杂。但多数增加了 腐蚀
船舶和海洋设施的保护
(1)材料
低合金海水用钢与碳钢的比较
环境
海洋大气区 飞溅区 潮汐区 全浸区 海泥区
(5)海水中易出现点腐蚀&缝隙腐蚀,在高 速流水中,易产生冲击腐蚀和空蚀
•影响海水腐蚀的因素
➢ 盐度
当盐的浓度超过一定值,氧的溶解度降低,腐蚀速 率下降
➢ pH值
海水一般处于中性,对腐蚀影响不大。在深海中, pH值略有下降,不利于生成保护性碳酸盐
➢ 碳酸盐饱和度
在海水的pH值下,碳酸盐一般达到饱和,易于沉积; 当施加阴极保护时,更易于碳酸盐沉积析出。河口处的 稀释海水,碳酸盐并非饱和,不宜析出形成保护层,腐 蚀增加
➢ 氧含量
氧含量增加,促进腐蚀。波浪和绿色植物的 光合作用提高氧的含量;海洋动物的呼吸作用 及生物分解需要消耗氧,氧含量降低。污染海 水中氧含量可大大下降
➢ 温度
海水温度每升高10℃,腐蚀速率提高约一倍; 但随温度升高,氧含量降低。一般讲,铁、铜 和它们的合金在炎热的环境和季节里,海水的 腐蚀速率要更快些
第4章-海洋腐蚀

3.点蚀试验法 抗点蚀的标准试验法是把橡胶带绕在不锈钢样板上
(隔绝氧气),浸在含少量硫酸的三氯化铁水溶液中,低级 的不锈钢在几小时内就会发生点蚀。
4.钼的抗点蚀作用 在不锈钢中,添加少量钼能有效地抵抗点蚀和缝隙腐
蚀。
5.点蚀的临界温度 对于不锈钢来说,存在着一个临界点蚀温度(CPT),
如果低于这个温度,即使在最易发生点蚀的实验室环境中, 也不会发生点蚀。
移
度的关系式就是搭菲尔方程式 :
E = a+βlogIw
随着点蚀孔的不断扩大,则不管电位变 化的速度如何,孔内外浓度差总是等 于 1.8mol/l。这说明,在孔内外浓度差达到 极限值时,点蚀孔的内壁就会完全钝化。由 于点蚀孔半径r大幅度增加,孔壁电流密度Iw。 迅速降低,使点蚀孔内溶解物的供应越来越 不足,孔内外浓度差也降低,且在很小的体 积范围内,质量迁移速度很高,就不能维持 扩大点蚀孔所需要的盐浓度,因此点蚀就停 止。
三、海上腐蚀环境的分区
海洋环境的腐蚀情况可分五大区,即海上大气区、 飞溅区(或飞沫区)、潮差区、全浸区和海底土壤区五部分。
海 上 腐 蚀 环 境 的 分 区
1)海上大气区:指高出海平面2米以上的部分,波浪打不 到,潮水不能淹没的地方。它的腐蚀因素虽然和内陆的大 气腐蚀相类似(如空气中的氧气和日光等),但海上的湿度 通常高于大陆,还存在着“气溶胶”形式的盐雾(见上节), 故其腐蚀环境比一般的大气腐蚀要严重些。钢铁腐蚀速度 约为20~70微米/年(荷兰)。
生物因素
污损生物 藻类 藤壶等附着动物 海中植物的生活 产生氧气 消耗二氧化碳 海中动物的生活 消耗氧气 发生二氧化碳 海中微生物的生活 产生硫化氢 产生有机酸
二、海盐腐蚀
如果海上或近海的设备被海水所湿润,然后再干燥, 则白色的海盐结晶就会留在它的表面。这种海盐内含氯化 钙等吸湿性盐类,故其吸湿性远超过纯氯化钠,因而海盐 能经常吸收空气中的水分,使其表面保持潮湿,即使在干 燥的季节中也是难免,这种晶体表面的湿存水是高浓度的 盐溶液,此时的氧气浓度也比海水中高得多,所以这种海 盐腐蚀比一般海水浸渍腐蚀严重得多。
海水 海洋大气腐蚀特点及防腐

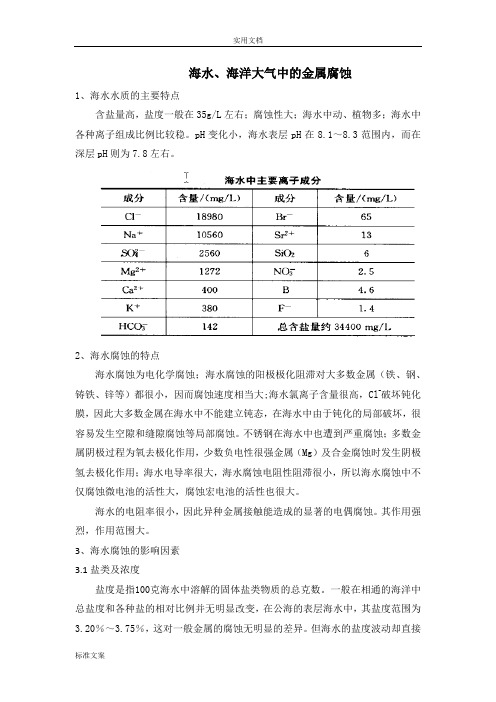
海水、海洋大气中的金属腐蚀1、海水水质的主要特点含盐量高,盐度一般在35g/L左右;腐蚀性大;海水中动、植物多;海水中各种离子组成比例比较稳。
pH变化小,海水表层pH在8.1~8.3范围内,而在深层pH则为7.8左右。
2、海水腐蚀的特点海水腐蚀为电化学腐蚀;海水腐蚀的阳极极化阻滞对大多数金属(铁、钢、铸铁、锌等)都很小,因而腐蚀速度相当大;海水氯离子含量很高,Cl-破坏钝化膜,因此大多数金属在海水中不能建立钝态,在海水中由于钝化的局部破坏,很容易发生空隙和缝隙腐蚀等局部腐蚀。
不锈钢在海水中也遭到严重腐蚀;多数金属阴极过程为氧去极化作用,少数负电性很强金属(Mg)及合金腐蚀时发生阴极氢去极化作用;海水电导率很大,海水腐蚀电阻性阻滞很小,所以海水腐蚀中不仅腐蚀微电池的活性大,腐蚀宏电池的活性也很大。
海水的电阻率很小,因此异种金属接触能造成的显着的电偶腐蚀。
其作用强烈,作用范围大。
3、海水腐蚀的影响因素3.1盐类及浓度盐度是指100克海水中溶解的固体盐类物质的总克数。
一般在相通的海洋中总盐度和各种盐的相对比例并无明显改变,在公海的表层海水中,其盐度范围为3.20%~3.75%,这对一般金属的腐蚀无明显的差异。
但海水的盐度波动却直接影响到海水的比电导率,比电导率又是影响金属腐蚀速度的一个重要因素,同时因海水中含有大量的氯离子,破坏金属的钝化,所以很多金属在海水中遭到严重腐蚀。
盐类以Cl-为主,一方面:盐浓度的增加使得海水导电性增加,使海水腐蚀性很强;另一方面:盐浓度增大使溶解氧浓度下降,超过一定值时金属腐蚀速度下降。
3.2 pH值海水pH在7.2-8.6之间,为弱碱性,对腐蚀影响不大。
3.3碳酸盐饱和度在海水pH条件下,碳酸盐达到饱和,易沉积在金属表面形成保护层。
若未饱和,则不会形成保护层,使腐蚀速度增加。
3.4含氧量海水腐蚀是以阴极氧去极化控制为主的腐蚀过程。
海水中的含氧量是影响海水腐蚀性的重要因素。
海水海洋大气腐蚀特点及防腐

海水海洋大气腐蚀特点及防腐海水和海洋大气对金属的腐蚀是工程中常见的问题。
在以下1200字以上的文章中,我将介绍海水和海洋大气腐蚀的特点和常用的防腐措施。
首先,海水腐蚀的特点有以下几点。
第一,在海洋环境中,氯离子是最主要的腐蚀物质。
氯离子和金属中的阳离子反应生成金属氯化物,导致金属的腐蚀。
第二,海水中的溶解氧也能促进金属的腐蚀,尤其是在存在水分的情况下。
氧气与金属反应形成氧化物,使金属表面产生腐蚀。
第三,海水中的微生物和海藻可以加速金属腐蚀。
微生物和海藻通过产生酸性物质和吸附金属表面来腐蚀金属。
其次,海洋大气腐蚀的特点如下。
第一,海洋大气中含有大量的盐雾,盐雾中的氯离子和金属氧化物反应会导致金属的腐蚀。
第二,海洋大气中的湿度较高,会加速金属的腐蚀。
湿度高时金属表面的水分含量增加,氧气和水分反应形成氢氧化物,使金属表面发生腐蚀。
第三,海洋大气中的硫化物和氮氧化物也会加速金属的腐蚀。
为了保护金属材料免受海水和海洋大气的腐蚀,常用的防腐措施包括以下几种。
第一,使用防腐涂料。
防腐涂料具有良好的抗腐蚀性能,可以形成一层保护膜,隔绝金属与海水或海洋大气的接触,防止金属腐蚀。
第二,使用防蚀合金。
防蚀合金通过增加合金元素的含量来提高材料的抗腐蚀性能,减少金属的腐蚀速率。
第三,采用阴极保护。
阴极保护是通过在金属表面施加电流,使金属表面形成保护性的氧化膜,减缓金属的腐蚀。
此外,还可以采用其他措施来防止海水和海洋大气的腐蚀。
例如,加强金属的维护保养,及时清洗金属表面的污垢和盐结物;使用耐腐蚀材料,如不锈钢和镀锌钢等;提高金属的表面处理质量,如去除金属表面的氧化膜和锈蚀;使用软件控制技术,及时监测和预测金属腐蚀的发展趋势,采取相应的防腐措施。
综上所述,海水和海洋大气对金属的腐蚀是工程中需要重视的问题。
了解海水和海洋大气腐蚀的特点和采取适当的防腐措施是保护金属材料免受腐蚀的关键。
通过使用防腐涂料、防蚀合金、阴极保护等措施,结合加强维护保养和改进技术手段,可以有效地减少金属的腐蚀,延长金属的使用寿命。
海水腐蚀知识点总结

海水腐蚀知识点总结一、海水腐蚀概述海水腐蚀是指海水中所含的各种物质对金属材料产生的侵蚀、腐蚀现象。
海水中除了含有一定量的氯化物之外,还有氯离子、硫酸盐离子、碳酸盐离子等化学物质。
这些化学物质都对金属材料起着不同程度的腐蚀作用,加速了金属材料的腐蚀速度。
海水腐蚀对海洋工程、船舶、海洋资源开发等领域的设备和设施造成了严重的腐蚀损害,因此具有重要的工程实际意义。
二、海水腐蚀的主要因素1.化学因素(1)氯离子腐蚀氯离子在海水中是一种重要的化学物质,它对金属材料的腐蚀作用非常显著。
氯离子对金属材料的腐蚀作用可以通过以下反应进行描述:Fe + 2Cl- → FeCl2 + 2e-随着氯离子浓度的增加,金属表面的腐蚀将会明显增加。
(2)硫酸盐离子腐蚀海水中还含有一定量的硫酸盐离子,它会加速金属材料的腐蚀速度。
例如,在含有硫酸盐离子的海水中,铁材料的腐蚀速度会明显加快。
(3)其它离子腐蚀海水中还含有一定量的碳酸盐离子、硫酸根离子、氢离子等。
这些离子也会对金属材料起着不同程度的腐蚀作用。
2.生物因素海水中有很多生物,它们对金属材料也会产生一定的腐蚀作用。
例如,海水中的藻类、微生物等会在金属表面形成生物膜,加速金属材料的腐蚀。
3.物理因素海水中的温度、氧气含量、PH值等也会对金属材料产生一定的影响。
温度的变化会影响金属的腐蚀速度,氧气含量会影响金属的腐蚀类型,PH值会影响金属的稳定性等。
三、海水腐蚀的类型1.普通腐蚀普通腐蚀也被称为一般腐蚀,是金属材料在海水中受到的最常见的一种腐蚀形式。
它表现为金属表面的均匀腐蚀,通常发生在整个金属表面,形成一定程度的腐蚀坑。
2.局部腐蚀局部腐蚀是指金属表面部分区域的腐蚀。
它包括点蚀、节理蚀、缝隙腐蚀等形式,通常会在局部区域形成较深的腐蚀坑。
3.应力腐蚀应力腐蚀是指金属在海水中受到应力作用而引起的腐蚀。
它主要发生于金属材料受到应力的情况下,通常在应力集中部位发生较为严重的腐蚀。
四、海水腐蚀的防护措施1.合理选材在海水环境下,选择适合的耐腐蚀金属材料非常重要。
海洋环境下金属结构腐蚀状况分析

海洋环境下金属结构腐蚀状况分析随着海洋资源的开发利用和海洋工程建设的不断推进,金属结构在海洋环境中扮演着重要的角色。
然而,由于海洋环境的特殊性质,金属结构很容易受到腐蚀的损害。
本文将对海洋环境下金属结构腐蚀的状况进行分析,以期提供对相关领域从业人员的参考和借鉴。
一、海洋环境下金属结构腐蚀的原因1.1 水的电化学性质海洋水电解液中含有大量溶解的盐类,如氯离子、溴离子等,这些离子会与金属表面进行电化学反应,导致金属结构的腐蚀。
1.2 海洋环境中的氧气海洋中氧气的含量相对较高,可以与金属表面发生化学反应,形成金属氧化物,从而加速金属结构的腐蚀。
1.3 海洋环境中的水流和波浪海洋中的水流和波浪会带来机械冲刷和摩擦作用,使金属表面的防腐涂层磨损,从而暴露出金属结构,易于腐蚀。
二、海洋环境下金属结构腐蚀的类型2.1 电化学腐蚀在海洋环境中,金属结构的腐蚀主要是由于电化学反应所引起的。
电化学腐蚀包括:金属的阳极腐蚀、金属的脱落腐蚀和金属的局部腐蚀等。
2.2 化学腐蚀海洋环境中的酸性物质、盐类等化学物质也会对金属结构进行化学腐蚀,例如硫化物腐蚀、硝酸盐腐蚀等。
2.3 动力腐蚀海洋环境中的水流和波浪对金属结构进行机械冲刷和摩擦作用,引起金属表面的腐蚀,这种腐蚀被称为动力腐蚀。
三、海洋环境下金属结构腐蚀的影响3.1 结构安全金属结构腐蚀会导致金属的强度降低,使得结构的承载能力下降,可能会引发结构的坍塌和事故。
3.2 经济损失金属结构因腐蚀而提前失效,需要进行维修和更换,给企业和个人带来巨大的经济负担。
3.3 环境污染金属结构腐蚀会产生大量的腐蚀物,对海洋环境造成污染,影响海洋生态系统的平衡。
四、海洋环境下金属结构腐蚀的预防与控制4.1 选择合适的材料在设计和施工金属结构时,应选择适应海洋环境腐蚀要求的材料,如不锈钢、带有防腐涂层的钢等。
4.2 进行防腐处理在金属结构投入使用之前,应对其表面进行防腐处理,如电镀、镀锌、热浸镀等,以增加金属结构的抗腐蚀能力。
(完整版)海水腐蚀情况讲解

海水腐蚀情况海水腐蚀的原因浸入海水中的金属,表面会出现稳定的电极电势。
由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。
其中电势较高的部位为阴极,较低的为阳极。
电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。
当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。
例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。
海洋环境对腐蚀的影响盐度海水含盐量较高,水中的含盐量直接影响水的电导率和含氧量,随着水中含盐量的增加,水的电导率增加但含氧量却降低。
海水中的盐度并不和NaCl 的行为相一致,这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。
河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。
海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
电导率海水中不仅含盐量高,而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。
这就决定了海水腐蚀过程中,不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。
研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。
溶解氧海水溶解氧的含量越多,金属在海水中的电极电位越高,金属的腐蚀速度越快。
但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。
此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。
(常压下氧在海水中的溶解度如下)(表一)酸碱度一般来说,海水的pH升高,有利于抑制海水对钢铁的腐蚀。
但是海水pH远没有含氧量对付腐蚀的影响大,尽管表层海水pH比深层海水高,但由于表层海水中的植物光合作用,含氧量远比深处海水高,所以表层海水的腐蚀性远比深层海水要强,这与实际的实验结论是一致的。
海水腐蚀原理

海水腐蚀原理
海水腐蚀是指海水对金属、混凝土和其他材料的腐蚀作用。
其主要原理包括以下几个方面:
1. 盐分和水分的作用:海水中含有丰富的盐分和水分,其中的氯离子特别具有强烈的腐蚀性。
当金属暴露在海水中时,水分与氯离子反应并形成酸性物质,从而加速金属的腐蚀。
2. 电位差造成的电化学腐蚀:海水本身含有多种阳离子和阴离子,这些离子在金属表面形成一个微小的电化学体系。
当不同金属或金属与水中其他物质相接触时,会形成电位差,从而引起电化学腐蚀。
例如,在船舶和海洋设施中使用的不同类型的金属接触时,会产生电位差,促使其中一种金属腐蚀。
3. 海水中的氧气:海水中溶解了大量氧气,而氧气是引起金属腐蚀的重要因素。
当金属暴露在海水中时,氧气可以与金属表面形成氧化物层,这将进一步使金属受到氧化腐蚀。
4. 海洋环境条件:海洋环境的恶劣程度也会对海水腐蚀产生影响。
例如,高温、潮湿的气候、海洋生物的存在以及水流的流速等,都会加速金属的腐蚀过程。
综上所述,海水腐蚀是由盐分和水分的作用、电位差引起的电化学腐蚀、氧气的存在以及海洋环境条件等多个因素共同作用所导致的。
这些因素相互影响,加速了金属在海水中的腐蚀速度。
为了减缓海水腐蚀的发生,我们需要在设计和选择材料时考虑到这些因素,并采取相应的防护措施。
海水腐蚀的原理

海水腐蚀的原理
海水腐蚀的原理是由于海水中存在的盐类和其他化学物质,以及海洋环境中的氧气和湿度等因素的作用下,金属材料会发生氧化、腐蚀的过程。
海水中的氯离子特别具有强烈的腐蚀性,能够与金属表面的阳离子发生反应,形成金属离子和氯化物。
当金属与海水接触时,海水中的氯化物会溶解并与金属表面的阳离子发生化学反应。
这种反应会导致金属表面形成氧化物、氢氧化物或氯化物的腐蚀产物,同时还会释放出电子。
这些腐蚀产物会进一步加速金属材料的腐蚀过程,形成更大的腐蚀面积。
此外,海洋环境中的湿度和氧气也会加速金属的腐蚀。
氧气与金属表面的阳离子相互作用,形成氧化物层,从而促进金属腐蚀的发生。
湿度会增加金属表面的氧气含量,使腐蚀过程更为迅速。
总之,海水腐蚀的原理是由于海水中的盐类和化学物质与金属表面的阳离子发生化学反应,形成腐蚀产物,并受湿度和氧气的影响,加速金属材料的腐蚀过程。
海水、海洋大气腐蚀特点及防腐
海水、海洋大气中的金属腐蚀1、海水水质的主要特点含盐量高,盐度一般在35g/L左右;腐蚀性大;海水中动、植物多;海水中各种离子组成比例比较稳。
pH变化小,海水表层pH在8.1~8.3范围内,而在深层pH则为7.8左右。
2、海水腐蚀的特点海水腐蚀为电化学腐蚀;海水腐蚀的阳极极化阻滞对大多数金属(铁、钢、铸铁、锌等)都很小,因而腐蚀速度相当大;海水氯离子含量很高,Cl-破坏钝化膜,因此大多数金属在海水中不能建立钝态,在海水中由于钝化的局部破坏,很容易发生空隙和缝隙腐蚀等局部腐蚀。
不锈钢在海水中也遭到严重腐蚀;多数金属阴极过程为氧去极化作用,少数负电性很强金属(Mg)及合金腐蚀时发生阴极氢去极化作用;海水电导率很大,海水腐蚀电阻性阻滞很小,所以海水腐蚀中不仅腐蚀微电池的活性大,腐蚀宏电池的活性也很大。
海水的电阻率很小,因此异种金属接触能造成的显著的电偶腐蚀。
其作用强烈,作用范围大。
3、海水腐蚀的影响因素3.1盐类及浓度盐度是指100克海水中溶解的固体盐类物质的总克数。
一般在相通的海洋中总盐度和各种盐的相对比例并无明显改变,在公海的表层海水中,其盐度范围为3.20%~3.75%,这对一般金属的腐蚀无明显的差异。
但海水的盐度波动却直接影响到海水的比电导率,比电导率又是影响金属腐蚀速度的一个重要因素,同时因海水中含有大量的氯离子,破坏金属的钝化,所以很多金属在海水中遭到严重腐蚀。
盐类以Cl-为主,一方面:盐浓度的增加使得海水导电性增加,使海水腐蚀性很强;另一方面:盐浓度增大使溶解氧浓度下降,超过一定值时金属腐蚀速度下降。
3.2 pH值海水pH在7.2-8.6之间,为弱碱性,对腐蚀影响不大。
3.3碳酸盐饱和度在海水pH条件下,碳酸盐达到饱和,易沉积在金属表面形成保护层。
若未饱和,则不会形成保护层,使腐蚀速度增加。
3.4含氧量海水腐蚀是以阴极氧去极化控制为主的腐蚀过程。
海水中的含氧量是影响海水腐蚀性的重要因素。
金属海水腐蚀

金属海水腐蚀是一种广泛存在的自然 现象,由于海水中含有丰富的溶解氧 和盐分,这些因素促进了金属的腐蚀 过程。
金属海水腐蚀的危害
01
02
03
设备损坏
金属海水腐蚀会导致各种 设备和设施的损坏,如船 舶、码头、石油平台和海 底管道等。
安全隐患
金属海水腐蚀可能引发各 种安全事故,如船舶沉没、 石油泄漏和管道破裂等。
02
金属海水腐蚀的影响因 素
金属材料的种类和特性
金属材料的种类和特性对海水腐蚀的敏感度有显著影响。例如,铁、铜、铝等金 属在海水中容易发生腐蚀,而某些合金或不锈钢则具有较好的耐腐蚀性能。
金属材料的微观结构和表面状态也对腐蚀速率有影响。例如,粗糙的表面或存在 缺陷的金属材料更容易受到腐蚀。
海水的成分和特性
控制温度
通过控制海水温度的方法,减缓金 属的腐蚀速率。
控制流速
通过控制海水的流速,减少对金属 表面的冲刷和磨损,降低腐蚀速率。
04
金属海水腐蚀的监测和 检测方法
物理检测方法
外观检查
通过观察金属表面的变化,如变色、锈迹、裂纹 等,初步判断腐蚀程度。
厚度测量
定期测量金属的厚度,以评估腐蚀造成的损失。
01
合金化
通过在金属中添加合金元素,改 变其成分和结构,提高耐腐蚀性。
02
控制金属的微观结 构
通过控制金属的晶粒大小、相组 成和微观结构,提高其耐腐蚀性 能。
03
选择适当的金属材 料
根据使用环境和腐蚀介质,选择 具有优异耐腐蚀性能的金属材料。
控制环境因素
控制盐度
通过降低海水中盐度的方法,减 缓金属的腐蚀速率。
经济损失
金属海水腐蚀会导致大量 的经济损失,包括设备维 修、更换和事故赔偿等。
海上腐蚀

海上腐蚀浸入海水中的金属,表面会出现稳定的电极电势。
由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。
电势较高的金属,如铁,腐蚀时阳极进行铁的氧化(阳极被溶解):释放的电子从阳极流向阴极,使氧在阴极被还原 ;氢氧离子经海水介质移向阳极,与亚铁离子生成氢氧化亚铁 ;易与海水中的溶解氧反应生成氢氧化铁。
后者经部分脱水成为铁锈它的结构疏松,性能降低。
电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。
当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。
例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。
(腐蚀竞争)工业用的大多数金属,金属状态不稳定,在海水中有转变成化合物或离子态物质的倾向。
但是金和铂等贵金属,金属状态稳定,在海水中不发生腐蚀。
海洋环境对金属腐蚀的影响金属在海水中的腐蚀,影响因素很多,包括化学、物理和生物等因素。
化学因素: ①溶解氧。
海水溶解氧的含量越多,金属的腐蚀速度越快。
但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。
此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。
②盐度。
海水含盐量较高,其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。
河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。
海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
③酸碱度。
用pH值表示。
pH值越小,酸性越强,反之亦然。
海水的pH值通常变化甚小,对金属的腐蚀几乎没有直接影响。
但在河口区或当海水被污染时,pH值可能有所改变,因而对腐蚀有一定的影响。
(完整版)海水腐蚀情况讲解

海水腐蚀情况海水腐蚀的原因浸入海水中的金属,表面会出现稳定的电极电势。
由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。
其中电势较高的部位为阴极,较低的为阳极。
电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。
当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。
例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。
海洋环境对腐蚀的影响盐度海水含盐量较高,水中的含盐量直接影响水的电导率和含氧量,随着水中含盐量的增加,水的电导率增加但含氧量却降低。
海水中的盐度并不和NaCl 的行为相一致,这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。
河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。
海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
电导率海水中不仅含盐量高,而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。
这就决定了海水腐蚀过程中,不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。
研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。
溶解氧海水溶解氧的含量越多,金属在海水中的电极电位越高,金属的腐蚀速度越快。
但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。
此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。
(常压下氧在海水中的溶解度如下)(表一)酸碱度一般来说,海水的pH升高,有利于抑制海水对钢铁的腐蚀。
但是海水pH远没有含氧量对付腐蚀的影响大,尽管表层海水pH比深层海水高,但由于表层海水中的植物光合作用,含氧量远比深处海水高,所以表层海水的腐蚀性远比深层海水要强,这与实际的实验结论是一致的。
海洋腐蚀讲座心得体会范文

近年来,随着我国海洋经济的快速发展,海洋工程设施的建设和运营日益增多。
然而,海洋腐蚀问题一直是制约海洋工程发展的重要因素。
为了更好地了解海洋腐蚀的原理、防治措施及发展趋势,我参加了本次海洋腐蚀讲座。
通过聆听专家的讲解,我对海洋腐蚀有了更深入的认识,以下是我的一些心得体会。
一、海洋腐蚀的基本原理讲座中,专家详细介绍了海洋腐蚀的基本原理。
海洋腐蚀是指在海洋环境中,金属和合金表面受到海水、空气、微生物等因素的共同作用,导致材料表面产生腐蚀现象。
海洋腐蚀的主要类型包括电化学腐蚀、生物腐蚀和机械腐蚀。
其中,电化学腐蚀是最为常见的一种腐蚀形式,其腐蚀过程包括阳极溶解、阴极还原和电解质迁移等步骤。
二、海洋腐蚀的危害海洋腐蚀对海洋工程设施的危害是巨大的。
首先,海洋腐蚀会导致结构强度降低,影响设施的安全运行。
其次,腐蚀会导致材料性能下降,缩短设施的使用寿命。
此外,腐蚀还会造成经济损失,增加维护成本。
因此,预防和控制海洋腐蚀对于保障海洋工程设施的安全、延长其使用寿命具有重要意义。
三、海洋腐蚀的防治措施针对海洋腐蚀问题,讲座中提出了多种防治措施。
以下是一些主要的防治方法:1. 材料选择:选用耐腐蚀性能强的材料,如不锈钢、铝合金等。
此外,表面处理也是提高材料耐腐蚀性能的重要手段,如镀锌、涂层等。
2. 阴极保护:阴极保护是一种常用的防腐措施,通过在金属表面施加外部电流,使金属表面保持负电位,从而减缓腐蚀速度。
3. 环境控制:优化海洋工程设施周围的环境,如控制微生物数量、降低海水盐度等,以减缓腐蚀速率。
4. 检测与维护:定期对海洋工程设施进行腐蚀检测和维护,及时发现并处理腐蚀问题,防止腐蚀扩大。
四、海洋腐蚀的研究与发展趋势随着科技的进步,海洋腐蚀的研究与发展呈现出以下趋势:1. 腐蚀机理研究:深入研究海洋腐蚀的机理,揭示腐蚀过程中的关键因素,为防腐措施的制定提供理论依据。
2. 新材料研发:开发新型耐腐蚀材料,提高材料的耐腐蚀性能,延长设施的使用寿命。
金属在海水环境中的腐蚀

4.2.1.1 盐类及导电率
• 海水为腐蚀性介质,特点是含多种盐类,盐分 中主要是NaCl,常把海水近似地看作质量分 数为3%或3.5%的NaCl溶液。
• 盐度是指1000g海水中溶解固体盐类物质的总 克数,一般海水的盐度在3.2%~3.75%之间, 通常取3.5%为海水的盐度平均值。
• 微生物的生理作用会产生氨、CO2和H2S 等腐蚀物质,如硫酸盐还原菌作用产生 S2- ,会加速金属腐蚀。
4.2.3 海水中常用金材料的耐蚀性
• 金属材料在海水中的耐蚀性差别很大; • 钛合金和Ni-Cr合金耐蚀性最好; • 铸铁和碳钢耐蚀性较差。 • 不锈钢的均匀腐蚀速度很小; • 在海水中易产生点蚀。 • 常用金属材料耐海水腐蚀性能表4-6。
范围内变化。
• 由表4-4可见,盐的浓度和温度愈高,氧 的溶解度愈小。
表4-4 氧在海水中的溶解度
4.2.1.3 海水的电化学特点
1)多数金属,除特别活泼金属镁及其合金外,海水中的腐蚀 过程都是氧去极化过程, 腐蚀速度由氧扩散过程控制。
2)大多数金属(铁、钢、锌等),在海水中发生腐蚀时,阳 极过程的阻滞作用很小, 海水中Cl-离子浓度高,海水中用 增加阳极阻滞方法来减轻海水腐蚀的可能性不大, 添加 合金元素钼, 才能抑制Cl-对钝化膜的破坏作用,改进材 料在海水中的耐蚀性。
• 海平面至-800m深处,含O逐渐减少并达到最低值;
• 海洋动物要消耗氧气;-800m再降-1000m,溶氧 量又上升,接近海水表面的氧浓度,因为深海水 温度较低、压力较高的缘故。
4)温度 海水T每升高10℃,化学反应速度提高约 10%,海水中金属的腐蚀速度将随之增加。
• 但T升高, 氧在海水中的溶解度下降,每升高10℃, 氧的溶解度约降低20%,使金属的腐蚀速度略有 降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
海水腐蚀情况海水腐蚀的原因浸入海水中的金属,表面会出现稳定的电极电势。
由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。
其中电势较高的部位为阴极,较低的为阳极。
电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。
当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。
例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。
海洋环境对腐蚀的影响盐度海水含盐量较高,水中的含盐量直接影响水的电导率和含氧量,随着水中含盐量的增加,水的电导率增加但含氧量却降低。
海水中的盐度并不和NaCl 的行为相一致,这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。
河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。
海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
电导率海水中不仅含盐量高,而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。
这就决定了海水腐蚀过程中,不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。
研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。
溶解氧海水溶解氧的含量越多,金属在海水中的电极电位越高,金属的腐蚀速度越快。
但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。
此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。
(常压下氧在海水中的溶解度如下)(表一)酸碱度一般来说,海水的pH升高,有利于抑制海水对钢铁的腐蚀。
但是海水pH远没有含氧量对付腐蚀的影响大,尽管表层海水pH比深层海水高,但由于表层海水中的植物光合作用,含氧量远比深处海水高,所以表层海水的腐蚀性远比深层海水要强,这与实际的实验结论是一致的。
物理因素除此之外还有其他物理因素,如流速、潮汐、温度等。
海水对金属的相对流速增大时,溶解氧向阴极扩散得更快,使金属的腐蚀速度增加;靠近海面的大气中,有多量的水分和盐分,又有充足的氧,对金属的腐蚀性比较强,因此,在平均高潮线上面海水浪花飞溅到的地方(飞溅区),金属表面经常处于潮湿多氧的情况下,腐蚀最为严重;水温升高,会使腐蚀加速。
但是温度升高,氧在海水中的溶解度降低,使腐蚀减轻。
海水腐蚀的特点(1)由于海水的导电性好,腐蚀中的欧姆电阻小,因此异金属接触能造成阳极性金属发生显著的电偶腐蚀破坏。
(2)海水中含有大量的氯离子,容易造成金属钝态局部腐蚀,容易发生小孔腐蚀、缝隙腐蚀、应力腐蚀,在流速很高的海水中,易发生磨损腐蚀。
(3)碳钢在海水中发生吸氧腐蚀,受氧扩散控制,而阳极极化性能很小,所以凡是能使氧极限扩散电流密度增大的因素,都会是碳钢的腐蚀速度增大。
(4)根据海水与金属接触的情况,可将海洋环境分为:海洋大气区、飞溅区、潮汐区、全浸区和海泥区。
如图所示:金属在各区域中的腐蚀情况存在明显区别。
图一耐海水腐蚀材料的研究现状碳钢及低合金钢的海水腐蚀性能由于海生物的附着和锈层的稳定,碳钢及低合金钢在海水中耐蚀性能的差异主要表现在局部腐蚀上(点蚀) , 由于点蚀的不可预测性、自催化性、隐蔽性和发生的几率极高, 在所有腐蚀失效中最具有破坏性, 点蚀深度是评价钢铁材料的主要依据。
近期,研究者用现场海水暴露制备试样对碳钢的微生物腐蚀做了详细的研究,研究发现:在海水中碳钢的腐蚀速度经历下降-上升的变化趋势,其趋势与3.5%的NaCl溶液保持一致;微生物因素,主要是内锈层中的硫酸盐还原菌,改变了碳钢的海水腐蚀机制,从而加速碳钢的腐蚀;碳钢在海水中的腐蚀机制可分为氧扩散控制、过渡和硫酸盐还原菌活性控制3个阶段。
在海水和3.5%NaCl溶液中的Rt随时间变化Q235在海水和3.5%NaCl溶液中的icorr随时间的变化不锈钢的海水腐蚀性能不锈钢在海水中的局部腐蚀主要取决于钢的化学成分和热处理状态,不锈钢是易钝金属, 其腐蚀规律与碳钢和低合金钢不同, 海水中大量的Cr-对依靠钝化防腐蚀的合金破坏极大, 一般是全浸区最重(Cl- 离子最多), 潮差区次之, 飞溅区最轻。
不同海域的环境因素及海生物附着对不锈钢的腐蚀敏感性产生重要影响。
不锈钢在海水中的耐蚀性通常高Cr钢优于低Cr钢,Ni一Cr钢优于C钢,随Ni、Cr含量的提高,耐蚀性增加,降低含C量可提高不锈钢耐蚀性,不锈钢中加人Mo能提高钝化膜对Cl-的抵抗力。
现阶段对于高强耐海水腐蚀不锈钢的研究着眼于研制出一种既具有高的强韧性, 又有优良的耐海水腐蚀性能和良好的可焊性的新型不锈钢。
双真空熔炼保证钢中低的C、N、O 等杂质元素含量,使钢体韧化;铁素体不锈钢通常所适用的热处理是退火(从高温处急冷),适当的热处理工艺与双真空熔炼配合可以避免脆断情况的发生。
为了解决双真空熔炼中相脆性、导热率等焊接工艺难题,研究者采用TIG低热输入焊接方法来防止过热, 降低相析出倾向和元素烧损;采用与母材成分相同的焊接材料以有利于保证焊缝金属的化学成分和组织与母材的相近;对焊板进行预先固溶退火处理, 消除原始组织中的脆性相和不均匀性。
使接头具有合格的力学性能,并兼具和母材相当的耐海水腐蚀性能。
熔炼方法对钢纯洁度的影响双真空钢的锻造加热工艺●镍基耐海水腐蚀材料的研究概况纯镍在海水中的性能是可变的,在快速流动的海水中, 镍能在全浸的条件下保持钝态, 其腐蚀速度小于0.127mm/a。
在静止海水中, 镍表面被污损生物(藤壶或贝类)所覆盖, 在这些沉积物下以及在缝隙处会丧失其钝态。
因此, 镍在海水中尤其是在低速流动的海水中并不具有良好的抗蚀性,这就需要添加各种抗点蚀、缝隙腐蚀的合金元素以提高镍的抗蚀性能镍在不锈钢中的主要作用在于它改变了钢的晶体结构。
普通碳钢的晶体结构称为铁氧体,呈体心立方(BCC)结构,加入镍,促使晶体结构从体心立方(BCC) 结构转变为面心立方。
在不锈钢中增加镍的一个主要原因就是形成奥氏体晶体结构,从而改善诸如可塑性、可焊接性和韧性等不锈钢的属性,所以镍被称为奥氏体形成元素。
但是,镍对铜、铬、铝等元素有较高的固溶度, 因而能够组成成分范围广泛的合金,所以, 镍在海洋领域的主要用途是作为一种合金组分,各种镍基合金的耐腐蚀性能见下表:●锰基耐海水腐蚀材料的研究概况细镍粉有致癌和过敏作用,这就促使粉末冶金工作者寻找价廉而又能达到同样效果的其它合金元素。
锰作为钢中重要的合金元素,其强化作用在许多合金元素之上,且锰的矿藏丰富、价格低廉、容易获取,是最便宜的合金元素之一。
BENESOVSKY和KIEFFER于1950年阐述了关于Fe-Mn系粉末冶金材料的基础知识,此后陆续有一些关于Fe-Mn系合金的报道,并于20世纪70年代逐渐增多。
抗裂性和韧性是评定海洋结构用焊接材料优劣的主要性能指标。
【7】锰是金属材料中重要合金元素之一。
它在钢中通常以固溶体及化合态形式存在。
锰是良好的脱氧剂和脱硫剂,能降低由于钢中硫所引起的热脆性,从而改善钢的热加工性能,提高钢的可锻性。
增加锰的含量,可提高钢的强度和硬度;【8】可以改善焊缝抗裂性能。
下图是不同Mn 、Si含量下焊缝金相组织特点:铜基耐海水腐蚀材料的研究概况研究表明:含Cu低合金钢不仅比碳钢表现出良好的耐全面腐蚀的能力,而且表现出优异的耐点蚀性能。
实验钢的化学成分(质量分数/%)如下图所示:实海挂片实验后钢的平均腐蚀速率和点蚀深度通过一系列表征,研究者对A钢与C钢的内锈层做了详细的研究,研究发现:尽管含Cu低合金钢和碳钢的宏观阴极区的锈层主要组成相同,但其内锈层明显比碳钢致密。
从宏观阴极区的合金元素组成和分布看,Cu的含量相对较多,在条带中分布也较均匀,没有发现明显的富集。
结合SEM和XRD分析结果可知,含Cu低合金钢内锈层中的针状物质主要为α-FeOOH,且Cu可成为氧化物结晶的核心,从而促进α-FeOOH的形成。
由于α-FeOOH在锈层中是一种相对稳定的相,它有利于致密锈层的形成,因此,Cu的添加可提高锈层对宏观阴极区基体的保护能力。
A钢(a)和C钢(b)蚀坑内锈层的SEM形貌两种钢内锈层的X射线衍射谱阳极电流密度随阴极电位变化曲线另外,在相同的外部阴极极化电位下含Cu低合金钢的阳极电流密度明显小于碳钢。
由于该阳极电流是蚀坑外部宏观阴极区电位和蚀坑内电位的电偶作用产生的,因此,模拟闭塞腐蚀电池实验的结果也表明Cu可提高蚀坑内的电位。
由此可认为,Cu的添加可有效提高钢的耐点蚀性能。
海水腐蚀的防护合理选材合理选材的要求是既能保证结构的承载能力,又能保证在使用期内金属不发生腐蚀破坏,同时还要兼顾经济效益。
阴极保护采用阴极保护是在海水全浸的条件下防止金属腐蚀的有效办法。
采用牺牲阳极或外加电流对金属构件实施电化学保护,投资少、保护周期长、与涂层的联合保护效果更佳。
表面覆盖层保护低碳钢和低合金钢在海洋环境中不耐腐蚀,采用有机防腐涂层是最普遍的防蚀方式,除油性和油改性漆、环氧类涂料、乙烯基树脂、氯化橡胶类涂料之外。
近年来,以水性无机富锌涂料、氟碳树脂超耐候性涂料、长效玻璃鳞片防腐涂料为代表的海洋重防腐涂料的研制和应用比较多。
另:海水中主要腐蚀物质是氯化物,316L加了Mo就提高了耐氯化物的引起的点腐蚀的能力。
所以考虑成本选316L,不考虑成本用316N(因为你的电机在水下深处工作,这还得考虑潜在的力学性能!!加了N提高了强度,而且不降低塑性便于加工,就是价格高不好买)8mm厚度就可以了。
316L不锈钢管能耐海水腐蚀,能防海水腐蚀不锈钢管316、304L ,其次304。
这个可以看出来不同型号的不锈钢,耐腐蚀情况不一样。
