配位滴定法第五节金属指示剂PPT精品文档33页
合集下载
分析化学第五章 配位滴定法PPT

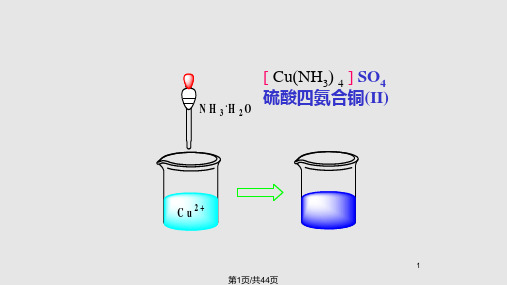
NaOH 无蓝色沉淀Cu(OH)2生成
NaS 有黑色沉淀CuS生成
无Cu2+??
有Cu2+??
解离
[Cu(NH3 )4 ] 2
Cu2 4NH3
配合
2022/10/18
四、 配位平衡常数
1. 稳定常数
Cu2 4NH3
[Cu(NH3 )4 ] 2
K0 MY
c([Cu(NH 3
)2 4
])
c(Cu2 ) c4 (NH3 )
(2)配位比简单,EDTA与大多数金属离子形成 配合物的配位比为1:1
(3)反应速率快,符合滴定要求 (4)与无色金属离子配位形成的配合物是无色的,与
有色金属离子配位形成的配合物颜色加深
2022/10/18
例: Cu2+显浅蓝色而CuY2-为深蓝色, Ni2+显浅绿色, 而NiY2-为蓝绿色, Mn2+显粉红色,而MnY2-为紫红色 Fe3+显棕黄色,而FeY-为黄色
2.在一定反应条件下,只形成一种配位数的配合物; 3.配位反应速度要快; 4.有适当的方法确定反应的等量点。
2022/10/18
三、配位剂的分类 无机配位剂(不适合用于配位滴定)
有机配位剂 (易形成具有环状结构的 螯合物,非常稳定。使用最多的是氨羧配 位剂,其中应用最广泛的是EDTA)
2022/10/18
4. 指示剂与金属离子配合物应易溶于水,指示剂比 较稳定,便于贮藏和使用
2022/10/18
三、 常用的金属指示剂
1. 铬黑T(BET)
铬黑T是弱酸性偶氮染料
1-(1-羟基-2萘偶氮)-6硝基-2-萘酚-4-磺酸钠
H
H
H 2 In
(五)金属指示剂 配位滴定中用于指示滴定终点 的指示剂,

锌离子标准溶液的配制: 标定前应先用稀盐酸洗去表面 氧化物,再分别用水,丙酮漂洗,烘干, 精确称取一定量锌用1:1盐酸溶解, 加水定容,即可配出锌离子标准 溶液。
标定:标定时取一定体积的锌离子 标准溶液,加适当的缓冲剂调节溶 液pH值,加二甲酚橙或铬黑T指示 剂,用 EDTA标准溶液滴定,按下式 计算其准确浓度。
m(Zn) 1000 Ar(Zn) c(EDT A) V (EDT A)
保存:配制好的EDTA标准溶液
应贮存在聚乙烯瓶或玻璃瓶中,防
止EDTA溶解玻璃成分而使溶液
浓度降低。
(八) 配位滴定方式
滴定分析中的四种滴定方式即:
直接滴定法,返滴定法,置换滴定法,
间接滴定法均可应用于配位滴定。
(九)配位滴定在医学检验中的应用 在医学检验中如血清钙, 胸水腹 水中钙镁离子的含量的测定; 在药 物分析中如氢氧化铝, 硫酸锌, 葡 萄糖酸钙,磺胺嘧啶锌等药物含量 的测定均可用配位滴定法测定。
解蔽作用: 利用一种试剂, 使已被 掩蔽剂掩蔽的金属离子释放出来, 这一过程称为解蔽。所利用的试剂 称为解蔽剂。
例如测定铜合金中的锌和铅时, 试 样溶解后加氨水中和,加入KCN,Cu2+ 被CN 还原为Cu+, Cu+和Zn2+因生成 [Cu(CN)4]3-和[Zn(CN)4]2- 配离子而被 KCN掩蔽,可以在pH=10时,以铬黑T作 指示剂,用EDTA标准溶液滴定Pb2+。
可以看出,在Mg2+存在下测定Ca2+ 时,可用EGTA直接滴定,△lgK=10.975.21=5.76>5,滴定误差小于0.3% ,比 用EDTA滴定提高了选择性。
②EDTP(乙二胺四丙酸) EDTP和EDTA与某些金属离子形成的 配合物的稳定常数对数值比较如下: 金属离子 Cu2+ Zn2+ Cd2+ Mn2+ IgKM-EDTP 15.4 7.8 6.0 4.7 IgKM-EDTP 18.80 16.50 16.46 13.87
第五章-配合滴定(第二部分)PPT优秀课件

常用基准物:ZnO或Zn粒(以HCl溶解) 、CaCO3等 指示剂: EBT pH 8.0~10.0 氨性缓冲溶液 酒红— —纯蓝 。 二甲酚橙(XO), pH< 6 HAc-NaAc,酒红色变 黄色。
18
二、配位滴定的主要方式
1.直接法
适用条件:
1)M与EDTA反应快,瞬间完成
2)M对指示剂不产生封闭效应——定量
1000
习题:p129, 1, 2, 3, 9
23
个人观点供参考,欢迎讨论
20
4.间接滴定法 适用条件:M与EDTA的配合物不稳定或难以反应 例如PO43-与EDTA不反应。 Bi3+(过量) + PO43- = BiPO4↓ + Bi(剩余) Bi(剩余) + Y = BiY
nPO4 3 nBi nEDTA
21
三、配合滴定在环境监测中的应用-水的硬度测定 硬度有不同的定义,如总硬度,碳酸盐硬度,非碳酸 盐硬度等。 总硬度是Ca、Mg的总浓度,碳酸盐硬度是与水中 CO32-、HCO3-结合的Ca、Mg,非碳酸盐硬度是除碳 酸盐硬度外,与NO3-、Cl-、SO42-结合的Ca、Mg
pCa=6.49 d. 化学计量点后
EDTA溶液过量0.02mL
[Y]=0.01000 0.02/(20.00+20.02) =510-6 mol/L 由上式KMY= [CaY]/ ([Ca2+] [Y]) 由稳定常数表达式,得:pCa=7.69
4
(2) 溶液pH小于12时滴定(如pH=9)
当溶液pH小于12时,存在酸效应;
Fe3+→Fe2+
K Fe( III )Y
25.1
K 14.3 Fe(II )Y
18
二、配位滴定的主要方式
1.直接法
适用条件:
1)M与EDTA反应快,瞬间完成
2)M对指示剂不产生封闭效应——定量
1000
习题:p129, 1, 2, 3, 9
23
个人观点供参考,欢迎讨论
20
4.间接滴定法 适用条件:M与EDTA的配合物不稳定或难以反应 例如PO43-与EDTA不反应。 Bi3+(过量) + PO43- = BiPO4↓ + Bi(剩余) Bi(剩余) + Y = BiY
nPO4 3 nBi nEDTA
21
三、配合滴定在环境监测中的应用-水的硬度测定 硬度有不同的定义,如总硬度,碳酸盐硬度,非碳酸 盐硬度等。 总硬度是Ca、Mg的总浓度,碳酸盐硬度是与水中 CO32-、HCO3-结合的Ca、Mg,非碳酸盐硬度是除碳 酸盐硬度外,与NO3-、Cl-、SO42-结合的Ca、Mg
pCa=6.49 d. 化学计量点后
EDTA溶液过量0.02mL
[Y]=0.01000 0.02/(20.00+20.02) =510-6 mol/L 由上式KMY= [CaY]/ ([Ca2+] [Y]) 由稳定常数表达式,得:pCa=7.69
4
(2) 溶液pH小于12时滴定(如pH=9)
当溶液pH小于12时,存在酸效应;
Fe3+→Fe2+
K Fe( III )Y
25.1
K 14.3 Fe(II )Y
第五章 配位滴定.ppt

配位剂
无机配位剂:F-, Cl-, CN-, NH3;很少用于滴定分析 有机配位剂:氨羧类配位剂(最常用)
氨羧配位剂:含有氨基二乙酸——N(CH2COOH)2 基团的有机化合物。分子中含有氨基氮和羧基氧两 种配位能力很强的配位原子。
N
O
CO
乙二胺四乙酸 (EDTA) :
§ 5-2 EDTA与金属离子的配合物 及其稳定性
指示剂的封闭 如:铬黑T能被Fe3+,Al3+,Cu2+等离子封闭。 (3)MIn易溶于水,不应形成胶体或沉淀。
指示剂的僵化,加入有机溶剂或加热消除
§5-6 混合离子的分别滴定
一、控制溶液酸度分步滴定 若:M,N离子共存,能否滴定M而N不干扰?
前提:KMY KNY 分步滴定判别式
lg K 5
金属指示剂:有机配位剂; 多为有机染料、弱酸;
一、金属离子指示剂的变色原理
指示剂加入: M
+ In
= MIn (略去电荷)
(指示剂色) (配合物色)
滴定时 MIn + Y = MY + In
(配合物色)
(指示剂色)
变色实质:EDTA置换少量与指示剂配位的金属离子 释放指示剂,从而引起溶液颜色的改变。
K'Mf (YMY )
[MY ] [M ]aMM(L)[Y ]aY (H )
K fM( MYL) a a MM( L) Y ( H )
lg K ' fM( MYY ) lg K fM( MYY ) lg aMM( L) lg aY ( H ) lgK ' fM(YMY ) lg K fM( MYY ) lg aY ( H ) 只有酸效应存在
(五)金属指示剂ppt

根据掩蔽所利用的反应类型不 掩蔽法分为配位掩蔽法、 同, 掩蔽法分为配位掩蔽法、沉 淀掩蔽法和氧化还原掩蔽法, 淀掩蔽法和氧化还原掩蔽法 其 中以配位掩蔽法应用较多。 中以配位掩蔽法应用较多。
配位掩蔽法: ① 配位掩蔽法 加入某种配位剂 作掩蔽剂与N离子形成稳定的配合 作掩蔽剂与 离子形成稳定的配合 从而降低溶液中N离子的浓度 离子的浓度, 物, 从而降低溶液中 离子的浓度 达到选择性滴定M的目的方法 的目的方法。 达到选择性滴定 的目的方法。
4. 常用金属指示剂
铬黑T(EBT) , 属偶氮类染料 化 属偶氮类染料, 铬黑 学名称1-(1-羟基 萘偶氮基 羟基-2-萘偶氮基 学名称 羟基 萘偶氮基)-6硝基-2-萘酚 磺酸钠,结构式为 萘酚-4-磺酸钠 硝基 萘酚 磺酸钠 结构式为
铬黑T是黑褐色粉末 溶于水后 铬黑 是黑褐色粉末,溶于水后 是黑褐色粉末 磺酸基上的Na 全部离解,形成 磺酸基上的 +全部离解 形成 H2In-离子。在水溶液中 2In- 离 离子。在水溶液中,H 子存在下列平衡: 子存在下列平衡
′ K MIn MIn [MIn] = K MIn = = [M ][In′] [M][In]⋅α In(H) α In(H)
[MIn] = lg K − lg α ′ lg K MIn = pM + lg MIn In(H) [In′] 是指示剂的变色点, 当 [MIn] = [In′]时,是指示剂的变色点 是指示剂的变色点
指示剂出现封闭现象的原因以 及消除方法: 及消除方法 ′ ′ (1) K MIn > K MY 。对于这种情况通 常加入适当掩蔽剂掩蔽这些干扰 离子,消除对指示剂的封闭现象 消除对指示剂的封闭现象. 离子 消除对指示剂的封闭现象
2011-分析化学课件-第五章 配位滴定法

第五章 配位滴定法
18
图5-2 EDTA-Co(III)螯合物的立体结构
第五章 配位滴定法
19
EDTA与金属离子形成的配合物具有下列特点 1.配位比较简单,绝大多数为1:1,没有逐级 配位的现象。 2.配位能力强,配合物稳定,滴定反应进行 的完全程度高。 3.配合物大多带电荷,水溶性较好。 4.配位反应的速率快,除Al、Cr、Ti等金属 外,一般都能迅速地完成。
第五章 配位滴定法
33
二、溶液中各级配合物型体的分布 前面已经指出,当金属离子与单基配体配位 时,由于各级形成常数的差别不大,因此, 在同一溶液中其各级形成的配合物,往往是 同时存在的,而且其各型体存在的比值与游 离配位剂的浓度有关。 当我们知道了溶液中金属离子的浓度、游离 配位剂的浓度及其相关配合物的累积形成常 数值时,即可计算出溶液中各种型体的浓度。
第二节 配合物在水溶液中的解离平衡
21
第五章 配位滴定法
22
一、配合物的形成常数 在配位反应中,配合物的形成和解离,同处 于相对的平衡状态中。其平衡常数,以形成 常数或稳定常数来表示。
第五章 配位滴定法
(一) ML (1:1)型配合物 M + L = ML
23
[ ML ] K ML [ M ][ L] [ M ][ L] 1 K离 [ ML ] K ML
第五章 配位滴定法
28
3.总形成常数和总解离常数 第n级累积形成常数又称配合物的总形成常数; 第n级累积解离常数又称配合物总解离常数。 总形成常数与总解离常数互为倒数关系,即 K离解=1/ K形 累积形成常数的应用:由各级累积形成常数计算溶 液中各级配合物型体的平衡浓度。 [ML]= 1[M][L] [ML2]= 2[M][L]2 ︰ [MLn]= n[M][L]n
配位平衡和配位滴定法PPT课件
第2页/共44页
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
形成配合物的条件
配位键是配合物与其它物质最本质的区别
第3页/共44页
第4页/共44页
(1)中心原子:
中心原子又称中心体。根据配位化合物的 定义,中心原子是配合物中具有接受孤对 电子或能提供空轨道的离子或原子。
例: [SiF6]2-
[FeF6]3- Fe(CO)5 Ni(CO)4
22
第22页/共44页
4.无外界的配合物
[Ni(CO)4] 四羰基合镍 [Pt(NH3)2Cl2] 二氯•二氨合铂(Ⅱ)
第23页/共44页
练习:命名下列配合物
Cu(3)N 4SH O 4 硫酸四氨合铜(Ⅱ) K3Fe(NC 6S) 六异硫氰根合铁(Ⅲ)酸钾
Cu(3)N 4(H O2H)氢氧化四氨合铜(Ⅱ) Co2)(3(N N 3)O 3H三硝基•三氨合钴(Ⅲ)
EDTA配合物的结构
第10页/共44页
第11页/共44页
不是配体
(3) 配位数(coordination number) 的数目 配合物中,直接与中心原子配合的配位原 子的数目称为中心原子的配位数。
单齿配体: 配位数 = 配体的总数 多齿配位体:配位数 = 配体数*齿数
第12页/共44页
[Ca(EDTA)]2-或CaY2-
④同一金属离子,配体离子半径越大,配位数越小
如[AlF6]3- , [AlCl4]-
第16页/共44页
4、 配离子的电荷
配离子的电荷数 = 中心离子与配位体电荷的 代数和
如[Fe(CN)6]x x = 3 + (-1) 6 = 3
可由外界离子所带的电荷总数求得
[Co(en)3]Cl3
[Co(en)3]3+
第05章配位滴定法资料

2020年10月8日3时32分
分析化学中的络合物
简单配体络合物
螯合物
多核络合物
Cu(NH
3
)
2 4
O
C H2C O CH2
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
OH
[(H2O)4Fe
Fe(H2O)4]4+
OH
2020年10月8日3时32分
五、无机配位剂与有机配位剂
1、单基配位体:提供一对电子以形成配价键的配位体。 2、多基配位体:提供两对或更多对电子以形成配价键 的配位体。
第五章:配位滴定法
§5.1概述 §5.2EDTA与金属离子的配合物及稳定性 §5.3外界条件对EDTA与金属离子配合物及稳
定性的影响 §5.4配位滴定曲线 §5.5金属离子指示剂及其它指示终点的方法 §5.6混合离子的分别滴定 §5.7配位滴定方式及其应用 习题
2020年10月8日3时32分
§5.1 概述
阳离子
lgKMY
阳离子
lgKMY
阳离子
lgKMY
Na+
1.66
Ce4+
15.98
Cu2+
18.80
Li+
2.79
Al3+
16.3
Ga2+
20.3
Ag+
7.32
Co2+
16.31
Ti3+
21.3
Ba2+
7.86
Pt2+
16.31
Hg2+
21.8
Mg2+
分析化学中的络合物
简单配体络合物
螯合物
多核络合物
Cu(NH
3
)
2 4
O
C H2C O CH2
H2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
OH
[(H2O)4Fe
Fe(H2O)4]4+
OH
2020年10月8日3时32分
五、无机配位剂与有机配位剂
1、单基配位体:提供一对电子以形成配价键的配位体。 2、多基配位体:提供两对或更多对电子以形成配价键 的配位体。
第五章:配位滴定法
§5.1概述 §5.2EDTA与金属离子的配合物及稳定性 §5.3外界条件对EDTA与金属离子配合物及稳
定性的影响 §5.4配位滴定曲线 §5.5金属离子指示剂及其它指示终点的方法 §5.6混合离子的分别滴定 §5.7配位滴定方式及其应用 习题
2020年10月8日3时32分
§5.1 概述
阳离子
lgKMY
阳离子
lgKMY
阳离子
lgKMY
Na+
1.66
Ce4+
15.98
Cu2+
18.80
Li+
2.79
Al3+
16.3
Ga2+
20.3
Ag+
7.32
Co2+
16.31
Ti3+
21.3
Ba2+
7.86
Pt2+
16.31
Hg2+
21.8
Mg2+
第五章配位滴定法ppt课件

[ H ]4[ Y4 ] Ka 3Ka 4Ka 5Ka 6
(4)
22
由EDTA的第二步离解可得出: 将(4)代入
[ H5Y ]
[ H ] [ H4Y ] Ka2
[ H ] [ H ]4[ Y4 ] Ka 2Ka 3Ka 4Ka 5Ka 6
[ H ]5[ Y4 ] Ka 2Ka 3Ka 4Ka 5Ka 6
24
[Y]
Y(H) [ Y4- ]
= 1 +[ H ] Ka6
[H ]2 Ka 5Ka 6
[H ]3 Ka 4Ka 5Ka 6
[H ]4 Ka 3Ka 4Ka 5Ka 6
[H ]5
[H ]6
Ka 2Ka 3Ka 4Ka 5Ka 6 Ka 1Ka 2Ka 3Ka 4Ka 5Ka 6
26
表5-2 不同pH值时的1gαY(H)
返回
pH
1gαY(H)
pH
1gαY(H)
pH
1gαY(H)
0.0
23.64
3.8
8.85
7.4
2.88
0.4
21.32
4.0
8.44
7.8
2.47
0.8
19.08
4.4
7.64
8.0
2.27
1.0
18.01
4.8
6.84
8.4
1.87
1.4
16.02
5.0
15
(2)配合物的稳定性 EDTA与金属离子反应式简写成:
M+Y=MY
K
=
MY
[MY] [M][Y]
配合物的稳定性取决于 金属离子和配合剂的性质。
第05章配位滴定法

有利于和不利于MY配合物生成的副反应? 如何控制不利的副反应?控制酸度;掩蔽; 外界影响如何量化?
2019/12/22
主反应:
M
+
Y
副反应: L
OH- H +
N
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MY
H+
OH-
MHY
M(OH)Y
MLn
M(OH)n H6Y
辅助配 位效应
羟基配 酸效应 干扰离
4 1 0 11 .3 0 4 6 0 1 .25 4 2.7
2 0
1010 5 1.3 0 4 6.2 4 2.7 5 2.0
7
2 5
10 10 10 10 10 1.3 0 4 6.2 4 2.7 5 2.0 7 1.6
3 0 1.3 0 4 6.2 4 2.7 5 2.0 7 1.60.9
氨羧试剂的特点:
1. 配位能力强;氨氮和羧氧两种配位 原子;
2. 多元弱酸;EDTA可获得两个质子, 生成六元弱酸;
3. 配合物的稳定性高; 与金属离子能形 成多个多元环 ;
4. 1∶1配位;计算方便; 5. 配合物水溶性好(大多带电荷)。 右下图为 NiY 结构模型
2019/12/22
§5.2 EDTA与金属离子的配合物及其稳定性
13.51
5.8
4.98
2.4
12.19
6.0
4.65
2.8
11.09
6.4
4.06
3.0
10.60
6.8
3.55
3.4
9.70
7.0
3.32
酸效应系数的大小说明什么问题?
2019/12/22
主反应:
M
+
Y
副反应: L
OH- H +
N
ML
MOH HY
NY
ML2
M(OH)2? H2Y
MY
H+
OH-
MHY
M(OH)Y
MLn
M(OH)n H6Y
辅助配 位效应
羟基配 酸效应 干扰离
4 1 0 11 .3 0 4 6 0 1 .25 4 2.7
2 0
1010 5 1.3 0 4 6.2 4 2.7 5 2.0
7
2 5
10 10 10 10 10 1.3 0 4 6.2 4 2.7 5 2.0 7 1.6
3 0 1.3 0 4 6.2 4 2.7 5 2.0 7 1.60.9
氨羧试剂的特点:
1. 配位能力强;氨氮和羧氧两种配位 原子;
2. 多元弱酸;EDTA可获得两个质子, 生成六元弱酸;
3. 配合物的稳定性高; 与金属离子能形 成多个多元环 ;
4. 1∶1配位;计算方便; 5. 配合物水溶性好(大多带电荷)。 右下图为 NiY 结构模型
2019/12/22
§5.2 EDTA与金属离子的配合物及其稳定性
13.51
5.8
4.98
2.4
12.19
6.0
4.65
2.8
11.09
6.4
4.06
3.0
10.60
6.8
3.55
3.4
9.70
7.0
3.32
酸效应系数的大小说明什么问题?
配位滴定法-PPT课件全

[Ca’]1 =
0.02
0.1000(初始钙浓度) 20.00+19.98
= 0.02 0.1000(初始钙浓度) / 2 39.98 / 2
0.02
C sp ca2
39.98 / 2
1.0
103
C sp ca2
PCa’1
3.0
log
C sp ca2
滴定至100.1%时
[Ca’]2
=
[CaY [Y’]2 K
sp
100%
cM(SP)
稳定常数定义可知
化学计量点时:
K' MY
[MY ]sp [M ']sp[Y ']sp
滴定终点时:
K' MY
[MY ]ep [M ']ep[Y ']ep
取对数后分别为
pM
' sp
pYs'p
lg
K
' MY
lg[MY ]sp
pM
' ep
pYe'p
lg
K
' MY
lg[MY ]ep
接近化学计量点 [MY ]sp [MY ]ep
pM ' pY ' 0
化学计量点时[MY] sp
CM (sp)
K' MY
[MY ]sp [M ']sp[Y ']sp
所以 [M ']sp =[Y ']sp =
CM (sp) K'
MY
Y' M'
TE(%) ep
ep 100%
cM(sp)
Y' 10pY' M' 10pM'
分析化学第五章配位滴定法PPT

滴定曲线与滴定终点
滴定曲线是指滴定过程中溶液的pH 值随滴定剂加入量的变化曲线。
滴定终点是指滴定过程中指示剂颜色 突变的位置,是滴定的关键点,其准 确判断对于保证滴定结果的准确性至 关重要。
滴定误差与准确度
01
滴定误差是指由于多种因素导致的滴定结果与真实值之间的偏 差。
02
准确度是指滴定结果的可靠性,即多次重复测定结果的平均值
配位滴定法的应用
01
02
03
金属离子分析
配位滴定法广泛应用于金 属离子分析,如铁、钴、 镍、铜、锌等离子的测定。
环境监测
在环境监测中,配位滴定 法可用于测定水体中重金 属离子的含量,评估环境 质量。
食品分析
在食品分析中,配位滴定 法可用于检测食品中微量 元素和重金属离子的含量, 确保食品安全。
配位滴定法的历史与发展
绿色化学在配位滴定法中的应用
无毒或低毒试剂的使用
开发无毒或低毒的配位剂和辅助试剂,减少对环境和人体的危害。
高效分离技术的研发
研究和发展高效、环保的样品前处理和分离技术,降低实验过程中 废液的产生。
循环利用和减少废弃物
优化实验流程,实现试剂和仪器的循环利用,减少废弃物的产生。
THANKS
感谢观看
配制标准溶液和待测溶液
根据实验需要,准确配制标准溶液和 待测溶液。
滴定操作
将待测溶液放入烧杯中,加入缓冲溶 液和指示剂,用标准溶液进行滴定, 并观察颜色变化。
数据记录
记录滴定过程中的数据,如滴定管读 数、实验时间等。
实验数据处理与分析
数据整理
将实验数据整理成表格, 列出各项数据。
数据分析
根据实验数据,计算待测 溶液的浓度、相对误差和 不确定度等。
配位化合物与配位滴定法精品PPT课件

7
二、 配合物的组成 1. 内界和外界
配合物一般由内界和外界两部分组成。 内界:即配位单元,是配合物的特征部分; 外界:除内界以外的部分。 若所含配位单元是电中性的配合物,则只有内
界没有外界 ,如[Ni(CO)4]、[Pt(NH3)2Cl2]
注意:配合物内界与外界之间是静电作用,在 水中易解离;内界的中心原子与配体之间是配
17
配体数: 配合物中含有配体的数目,如: Ni(CO)4中为4,[Fe(C2O4)3]3-中是3。
配位数与配体数是有区别的:
(1)简单配合物中,配位数等于配体数,如 [Ag(CN)2]-中配位数和配体数均为2。
(2)在螯合物中,配位数等于配体的数目与其 基数的乘积。如[Cu(en)2]2+中配体数是2,其配 位数则为4; [Fe(C2O4)3]3-中配体数是3,其配 位数却为6。
4
一、 配合物的定义
《无机化学命名原则》中定义:配位化合 物(简称配合物)是由可以给出孤对电子或 多个不定域电子的一定数目的离子或分子 (称为配体)和具有接受孤对电子或多个不 定域电子的空位的原子或离子(统称中心原 子)按一定的组成和空间构型所形成的化合 物。
5
一般将中心原子(或离子)与它周围按一定 几何构型围绕着的阴离子或中性分子配体以配位 键结合的复杂分子或离子,称为配位单元。
14
双基配体:草酸根 1
C
2O
2 4
O O 2– CC
OO
••
••
六基配体:乙二胺四乙酸根(简称 EDTA)
••
O OC H2C
• • 4–
CH2 CO O
•• ••
N CH2 CH2 N
O OC H2C
••
二、 配合物的组成 1. 内界和外界
配合物一般由内界和外界两部分组成。 内界:即配位单元,是配合物的特征部分; 外界:除内界以外的部分。 若所含配位单元是电中性的配合物,则只有内
界没有外界 ,如[Ni(CO)4]、[Pt(NH3)2Cl2]
注意:配合物内界与外界之间是静电作用,在 水中易解离;内界的中心原子与配体之间是配
17
配体数: 配合物中含有配体的数目,如: Ni(CO)4中为4,[Fe(C2O4)3]3-中是3。
配位数与配体数是有区别的:
(1)简单配合物中,配位数等于配体数,如 [Ag(CN)2]-中配位数和配体数均为2。
(2)在螯合物中,配位数等于配体的数目与其 基数的乘积。如[Cu(en)2]2+中配体数是2,其配 位数则为4; [Fe(C2O4)3]3-中配体数是3,其配 位数却为6。
4
一、 配合物的定义
《无机化学命名原则》中定义:配位化合 物(简称配合物)是由可以给出孤对电子或 多个不定域电子的一定数目的离子或分子 (称为配体)和具有接受孤对电子或多个不 定域电子的空位的原子或离子(统称中心原 子)按一定的组成和空间构型所形成的化合 物。
5
一般将中心原子(或离子)与它周围按一定 几何构型围绕着的阴离子或中性分子配体以配位 键结合的复杂分子或离子,称为配位单元。
14
双基配体:草酸根 1
C
2O
2 4
O O 2– CC
OO
••
••
六基配体:乙二胺四乙酸根(简称 EDTA)
••
O OC H2C
• • 4–
CH2 CO O
•• ••
N CH2 CH2 N
O OC H2C
••
分析化学(配位滴定法)幻灯片

当酸效应和共存离子效应同时发生时, EDTA总的副反应系数是
2020/6/16
10
Y
[Y'] [Y]
[H6Y2 ] [H5Y ] [Y4 ]
[Y4 ] [NY]
[H6Y2
]
[H5Y ] [Y4 ]
[Y
4
]
[NY] [Y [Y4 ]
4
]
[Y [Y
4 4
] ]
Y Y(H) Y(N) 1
MIn MY MY + In
(二)必备条件 1. MIn与In颜色明显不同
铬黑T(EBT):
2020/6/16
27
pH <6.3 6.3~11.6 >11.6
H2In - = HIn 2- = In 3-
紫红
蓝
橙
M-EBT的颜色也是紫红色
铬黑T使用的酸度范围应在pH6.3~11.6之间
在PH=10时,用EDTA滴定Mg2+,以EBT为指示剂
lgαZn(NH3)=5.1
18
18
αZn=αZn(NH3)+αZn(OH)-1 =105.1+105.4-1≈105.6
lgαZn=5.6
lgK/ZnY=lgKZnY-lgαY-lgαM lgK/ZnY=16.5-0.07-5.6=10.83
第二节 基本原理
一、滴定曲线
PH=10时,用0.02mol/L的EDTA滴定20.00ml 0.02 mol/L的Ca2+ 。
K
' CaY
=
[CaY' ] [Ca' ][Y' ]
=
[CaY' ] [Ca' ]2
2020/6/16
10
Y
[Y'] [Y]
[H6Y2 ] [H5Y ] [Y4 ]
[Y4 ] [NY]
[H6Y2
]
[H5Y ] [Y4 ]
[Y
4
]
[NY] [Y [Y4 ]
4
]
[Y [Y
4 4
] ]
Y Y(H) Y(N) 1
MIn MY MY + In
(二)必备条件 1. MIn与In颜色明显不同
铬黑T(EBT):
2020/6/16
27
pH <6.3 6.3~11.6 >11.6
H2In - = HIn 2- = In 3-
紫红
蓝
橙
M-EBT的颜色也是紫红色
铬黑T使用的酸度范围应在pH6.3~11.6之间
在PH=10时,用EDTA滴定Mg2+,以EBT为指示剂
lgαZn(NH3)=5.1
18
18
αZn=αZn(NH3)+αZn(OH)-1 =105.1+105.4-1≈105.6
lgαZn=5.6
lgK/ZnY=lgKZnY-lgαY-lgαM lgK/ZnY=16.5-0.07-5.6=10.83
第二节 基本原理
一、滴定曲线
PH=10时,用0.02mol/L的EDTA滴定20.00ml 0.02 mol/L的Ca2+ 。
K
' CaY
=
[CaY' ] [Ca' ][Y' ]
=
[CaY' ] [Ca' ]2
配位滴定法PPT讲解

Ca2+、Mg2+共 存
总硬CaCO3 (
ppm)
CEDTA
VEDTA M CaCO3 V水样
103
(2)测钙硬:钙指示剂 吸Vml水样+ NaOH(pH=12~13)
Mg2+
Mg(OH)2
用EDTA滴定Ca2+
钙硬CaCO3 (
ppm)
CEDTA
VEDTA M CaCO3 V水样
103
3.水硬的表示方法: CaCO3(ppm):每升水中CaCO3毫克数。 CaO (ppm):每升水中CaO毫克数。
二、金属离子M的配位效应:
M+ Y
OH
MY 主反应
M(OH)
…
M(OH)n
羟基配位效应: 金属离子在水中和 OH- 生成各种羟基配离子,使金属 离子参加主反应的能力下降的现象。
1. 羟基配位效应系数M(OH) :
M(OH)
[M' ] [M] [M]
[MOH]
[M(OH) 2 ] [M(OH) [M]
配位滴定法
一、配位剂的分类:
1.无机配位剂:
例:CN-
Cd2++ CN-
CN-
CN-
[Cd(CN)]+
Cd(CN)2
[Cd(CN)3]-
CN-
逐级配位 现象
[Cd(CN)4]2-
2.有机配位剂:
氨羧配位剂:含氨基二乙酸基团 CH2COOH
N CH2COOH
常用氨羧配位剂是乙二胺四乙酸,即EDTA
二、逐级配合物
二、分别滴定的方法: (一)控制酸度:△lgCK’≥5 具体方法:1.确定首先被滴定的是KMY最大的离子。
总硬CaCO3 (
ppm)
CEDTA
VEDTA M CaCO3 V水样
103
(2)测钙硬:钙指示剂 吸Vml水样+ NaOH(pH=12~13)
Mg2+
Mg(OH)2
用EDTA滴定Ca2+
钙硬CaCO3 (
ppm)
CEDTA
VEDTA M CaCO3 V水样
103
3.水硬的表示方法: CaCO3(ppm):每升水中CaCO3毫克数。 CaO (ppm):每升水中CaO毫克数。
二、金属离子M的配位效应:
M+ Y
OH
MY 主反应
M(OH)
…
M(OH)n
羟基配位效应: 金属离子在水中和 OH- 生成各种羟基配离子,使金属 离子参加主反应的能力下降的现象。
1. 羟基配位效应系数M(OH) :
M(OH)
[M' ] [M] [M]
[MOH]
[M(OH) 2 ] [M(OH) [M]
配位滴定法
一、配位剂的分类:
1.无机配位剂:
例:CN-
Cd2++ CN-
CN-
CN-
[Cd(CN)]+
Cd(CN)2
[Cd(CN)3]-
CN-
逐级配位 现象
[Cd(CN)4]2-
2.有机配位剂:
氨羧配位剂:含氨基二乙酸基团 CH2COOH
N CH2COOH
常用氨羧配位剂是乙二胺四乙酸,即EDTA
二、逐级配合物
二、分别滴定的方法: (一)控制酸度:△lgCK’≥5 具体方法:1.确定首先被滴定的是KMY最大的离子。
配位滴定法第五节金属指示剂

随着科学技术的不断发展,金属指示剂的研究和应用 也在不断深入。
未来金属指示剂的发展方向将更加注重选择性、灵敏 度和稳定性,以满足更广泛的应用需求。
新型金属指示剂的研发将致力于提高滴定分析的精度 和准确度,降低干扰因素对测定结果的影响,为化学
分析领域的发展做出更大的贡献。
THANKS
感谢观看
金属指示剂的选择原则
01 根据待测金属离子的种类选择合适的指示剂 。
02
根据实验要求选择灵敏度高、稳定性好的指 示剂。
03
根据实验条件选择对光照、温度等因素不敏 感的指示剂。
04
根据实验操作简便性选择易于使用和维护的 指示剂。
03
金属指示剂的作用原理
金属指示剂与金属离子的反应原理
01
金属指示剂是一种有机染料,能够与被滴定的金属离子发生显 色反应。
的敏锐度。
配位能力强、颜色变化 敏锐的金属指示剂能够 更准确地指示滴定终点
。
此外,溶液的酸度、温 度、干扰离子等因素也 会影响金属指示剂的反
应灵敏度。
04
金属指示剂的应用实例
锌盐中铝的测定
总结词
金属指示剂在锌盐中铝的测定中起到关键作用,通过颜色的变化指示滴定终点。
详细描述
在锌盐中铝的测定中,使用金属指示剂可以准确判断滴定终点。当达到滴定终 点时,指示剂会发生颜色变化,从而指示滴定完成。通过观察指示剂的颜色变 化,可以确定铝的含量。
详细描述
金属指示剂的选择性问题主要表现在不同金属离子对同一指示剂的影响不同,导致滴定结果出现偏差。为了 解决这一问题,需要选择合适的金属指示剂,并了解其对不同金属离子的响应情况,以便在实验中选择最合 适的指示剂。同时,可以采用一些方法来消除或减小不同金属离子对滴定结果的影响,例如加入掩蔽剂或采
未来金属指示剂的发展方向将更加注重选择性、灵敏 度和稳定性,以满足更广泛的应用需求。
新型金属指示剂的研发将致力于提高滴定分析的精度 和准确度,降低干扰因素对测定结果的影响,为化学
分析领域的发展做出更大的贡献。
THANKS
感谢观看
金属指示剂的选择原则
01 根据待测金属离子的种类选择合适的指示剂 。
02
根据实验要求选择灵敏度高、稳定性好的指 示剂。
03
根据实验条件选择对光照、温度等因素不敏 感的指示剂。
04
根据实验操作简便性选择易于使用和维护的 指示剂。
03
金属指示剂的作用原理
金属指示剂与金属离子的反应原理
01
金属指示剂是一种有机染料,能够与被滴定的金属离子发生显 色反应。
的敏锐度。
配位能力强、颜色变化 敏锐的金属指示剂能够 更准确地指示滴定终点
。
此外,溶液的酸度、温 度、干扰离子等因素也 会影响金属指示剂的反
应灵敏度。
04
金属指示剂的应用实例
锌盐中铝的测定
总结词
金属指示剂在锌盐中铝的测定中起到关键作用,通过颜色的变化指示滴定终点。
详细描述
在锌盐中铝的测定中,使用金属指示剂可以准确判断滴定终点。当达到滴定终 点时,指示剂会发生颜色变化,从而指示滴定完成。通过观察指示剂的颜色变 化,可以确定铝的含量。
详细描述
金属指示剂的选择性问题主要表现在不同金属离子对同一指示剂的影响不同,导致滴定结果出现偏差。为了 解决这一问题,需要选择合适的金属指示剂,并了解其对不同金属离子的响应情况,以便在实验中选择最合 适的指示剂。同时,可以采用一些方法来消除或减小不同金属离子对滴定结果的影响,例如加入掩蔽剂或采
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
{ { cc((P B2 3 b i))//c c } }K K ff((B Pb i))Y Y0 0..0 0 1 1 1 11 20 08 8 160
满足分布滴定条件 可以在pH=1时,二甲酚橙为指示剂滴定Bi3+ 之后调节pH=5.0-6.0继续滴定Pb2+
二、掩蔽作用
在滴定体系中加入掩蔽剂,使之选择性的与干 扰离子作用,而消除干扰离子对滴定的影响。 分为: 1、配位掩蔽法 2、沉淀掩蔽法 3、氧化还原掩蔽法
例如 pH=10以铬黑T为指示剂滴定水中Ca2+、Mg2+ 总量 时,Fe3+、Al3+、Cu2+、Co2+、Ni2+等会封闭铬黑T。 加三乙醇胺掩蔽Fe3+、Al3+;加KCN掩蔽Cu2+、Co2+、 Ni2+ 。 回滴法测定Al3+
2、金属指示剂的僵化现象
金属指示剂和金属离子形成的配合物,溶 解度较小,滴定剂对金属-指示剂配合物中的 指示剂置换过程缓慢,导致变色不敏锐,终 点拖长。
lg
K
f
(MIn)
lg
aIn( H
)
M + In = MIn ↕H+ HIn ↕H+ H2In
当c(MIn) c(In')时,可得到指示剂的变色点,理论变色点
pM
(变)
lgK
' f
(MIn)
lg
K
f
(MIn)
lg
aIn(
H
)
理论变色范围
pM 1
四、金属指示剂使用中的一些问题
1、金属指示剂封闭现象 金属离子与有些金属指示剂形成比该金属离子
3、金属指示剂配合物Min要有适当的稳定性。理论 上应稍低于MY的稳定性。
4、金属指示剂要有一定稳定性。
三、金属指示剂变色点pM(滴定终点)的计算
K
' f
(MIn)
c(MIn) / c {c(M ) / c }{c(In') / c }
K
f
(MIn)
aIn(H )
pM
lg
c(MIn) / c c(In' ) / c
沉淀中存在沉淀不完全、共沉淀和沉淀吸附等 现象,应用不够广泛。
沉淀掩蔽剂
常见沉淀掩蔽剂及其使用条件(P388)
掩蔽剂 硫酸盐
被掩蔽离子
Ba3+,Sr2
待测离子
Ca2+,Mg2+
NH4F
Ba3+,Sr2+,Ca2+,Mg2+
H2SO4
Pb2+
硫化钠 或铜试剂 KI
Cu2+,Pb2+,Bi3+,Hg2+Cd2+ Cu2+
在滴定Fe3与ZrO2、Bi3、Th4、Sc3、In3、Sn4、Hg2
等lg{K( f MY)}值与之相近的离子时 共。 存 使用还原试剂将 Fe3 Fe2 消除干扰
三、解蔽作用
使用掩蔽剂将多组分离子中的干扰离子掩蔽住, 滴定完待测离子后,再使用试剂将掩蔽的干扰离 子释放出来。
滴定溶P液b2和 中Zn2含量时,可 KC利 掩 N用 蔽 Zn2 配位掩蔽 Zn24CN [Zn(CN)4]2 解蔽作用 [Zn(CN)4]24HCHO 4H2OZn24HOC2CHN4OH
解决办法: 加热或加入助溶剂,增加MIn溶解度.
3、金属指示剂的氧化变质现象
金属指示剂是包含双键的有色有机化合物,在空气 中易分解聚合,在水溶液中不稳定,不能久存。
解决办法: 配置指示剂溶液中加入抗氧化剂和掩蔽剂 最好现配现用
五、常用金属指示剂
1、铬黑T 简称EBT,一种偶氮染料结构式如下
O NaO S
使用条件
酸性溶液后调节 pH>10.0 pH>4.0
pH>8.0
pH=5.0-6.0 pH=5.0-6.0
中型溶液
2、沉淀掩蔽法
通过选择性沉淀剂使干扰离子形成沉淀,从而 消除其干扰的掩蔽方法称为沉淀掩蔽法。
举例: 在pH=12.0时,用EDTA滴定Ca2+和Mg2+混合 溶液中的Ca2+,Mg2+与OH生成沉淀,达到消除 Mg2+干扰的目的。 缺点:
配位滴定剂EDTA的配位广泛性,导致EDTA对 于金属离子的选择性不高。
提的酸度
溶液中共存离子效应 准确滴定条件:
{{cc((M N''))//cc}}K Kff ((N MY)Y)106
控制酸度分步滴定金属离子具体应用
浓度都为0.01molL-1的Bi3+和Pb2+混合液,能否被分步滴定?
O
OH HO NN
O2N
2、钙指示剂
钙指示剂简称NN结构式如下:
O NaO S
O
OH HO NN
COOH
3、其他常用指示剂(P384)
酸性铬蓝K、酸性铬蓝K-萘酚绿B、邻苯二酚紫、 磺基水杨酸、甲基百里酚蓝
第六节 提高配位滴定的选择性
前面讨论的的通常是单一金属离子的滴定问题。 实际分析工作中分析对象一般为多组分体系。
1、配位掩蔽法
常见配位掩蔽剂及其使用条件(P387)
掩蔽剂 三乙醇胺
被掩蔽离子
Al3+,Fe3+,Sn4+,TiO2+,Mn2+
氟化物 氰化物 乙酰丙酮 邻二氮菲 柠檬酸
Al3+, Sn4+,TiO2+,ZrO2+ Cd2+,Hg2+,Cu2+,Co2+,Ni2+,Fe2+,Zn2+ Al3+,Fe3+ Cu2+,Co2+,Ni2+,Zn2+ Bi3+,Fe3+,Sn4+,Th4+,Ti4+,ZrO2+
与EDTA所形成配合物稳定性更高的配合物 Kf’(MIn)> Kf (MIn)
过量的EDTA也无法将Min中的金属离子置换 出,无法引起颜色变化
一些金属离子与金属指示剂的封闭现象
Al3,Fe3,Cu2, Ni2,Ti4 这些离子对于T铬 和黑 二甲酚橙有封闭作用
解决办法 离子为被测离子时以,采可用反滴法 离子为共存离子时以,加可入掩蔽剂或预分离
NaOH
Mg2+
Zn2+,Cd2+, Mn2+ Bi3+ Ca2+,Mg2+
Zn2+ Ca2+
pH 指示剂
10
铬黑T
10
铬黑T
1 二甲酚橙
10
铬黑T
5-6
PAN
12 钙指示剂
3、氧化还原掩蔽法
通过氧化还原反应,改变干扰离子的价态从而消除 干扰的方法。
lg{Kf [Fe(III)Y]}25.1, lg{Kf [Fe(II)Y]}14.33,
金属指示剂作用原理
络合滴定前加入金属指示剂
M + In = MIn
甲色 乙色
滴定过程中的变化
MIn +Y = MY + In
乙色
甲色
二、金属指示剂应具备的条件(P382)
1、在适宜的pH范围内,指示剂In与金属-指示剂配 合物Min的颜色要具有明显的差异。
2、金属指示剂与金属离子的反应必须迅速、灵敏 和良好的可逆性。
满足分布滴定条件 可以在pH=1时,二甲酚橙为指示剂滴定Bi3+ 之后调节pH=5.0-6.0继续滴定Pb2+
二、掩蔽作用
在滴定体系中加入掩蔽剂,使之选择性的与干 扰离子作用,而消除干扰离子对滴定的影响。 分为: 1、配位掩蔽法 2、沉淀掩蔽法 3、氧化还原掩蔽法
例如 pH=10以铬黑T为指示剂滴定水中Ca2+、Mg2+ 总量 时,Fe3+、Al3+、Cu2+、Co2+、Ni2+等会封闭铬黑T。 加三乙醇胺掩蔽Fe3+、Al3+;加KCN掩蔽Cu2+、Co2+、 Ni2+ 。 回滴法测定Al3+
2、金属指示剂的僵化现象
金属指示剂和金属离子形成的配合物,溶 解度较小,滴定剂对金属-指示剂配合物中的 指示剂置换过程缓慢,导致变色不敏锐,终 点拖长。
lg
K
f
(MIn)
lg
aIn( H
)
M + In = MIn ↕H+ HIn ↕H+ H2In
当c(MIn) c(In')时,可得到指示剂的变色点,理论变色点
pM
(变)
lgK
' f
(MIn)
lg
K
f
(MIn)
lg
aIn(
H
)
理论变色范围
pM 1
四、金属指示剂使用中的一些问题
1、金属指示剂封闭现象 金属离子与有些金属指示剂形成比该金属离子
3、金属指示剂配合物Min要有适当的稳定性。理论 上应稍低于MY的稳定性。
4、金属指示剂要有一定稳定性。
三、金属指示剂变色点pM(滴定终点)的计算
K
' f
(MIn)
c(MIn) / c {c(M ) / c }{c(In') / c }
K
f
(MIn)
aIn(H )
pM
lg
c(MIn) / c c(In' ) / c
沉淀中存在沉淀不完全、共沉淀和沉淀吸附等 现象,应用不够广泛。
沉淀掩蔽剂
常见沉淀掩蔽剂及其使用条件(P388)
掩蔽剂 硫酸盐
被掩蔽离子
Ba3+,Sr2
待测离子
Ca2+,Mg2+
NH4F
Ba3+,Sr2+,Ca2+,Mg2+
H2SO4
Pb2+
硫化钠 或铜试剂 KI
Cu2+,Pb2+,Bi3+,Hg2+Cd2+ Cu2+
在滴定Fe3与ZrO2、Bi3、Th4、Sc3、In3、Sn4、Hg2
等lg{K( f MY)}值与之相近的离子时 共。 存 使用还原试剂将 Fe3 Fe2 消除干扰
三、解蔽作用
使用掩蔽剂将多组分离子中的干扰离子掩蔽住, 滴定完待测离子后,再使用试剂将掩蔽的干扰离 子释放出来。
滴定溶P液b2和 中Zn2含量时,可 KC利 掩 N用 蔽 Zn2 配位掩蔽 Zn24CN [Zn(CN)4]2 解蔽作用 [Zn(CN)4]24HCHO 4H2OZn24HOC2CHN4OH
解决办法: 加热或加入助溶剂,增加MIn溶解度.
3、金属指示剂的氧化变质现象
金属指示剂是包含双键的有色有机化合物,在空气 中易分解聚合,在水溶液中不稳定,不能久存。
解决办法: 配置指示剂溶液中加入抗氧化剂和掩蔽剂 最好现配现用
五、常用金属指示剂
1、铬黑T 简称EBT,一种偶氮染料结构式如下
O NaO S
使用条件
酸性溶液后调节 pH>10.0 pH>4.0
pH>8.0
pH=5.0-6.0 pH=5.0-6.0
中型溶液
2、沉淀掩蔽法
通过选择性沉淀剂使干扰离子形成沉淀,从而 消除其干扰的掩蔽方法称为沉淀掩蔽法。
举例: 在pH=12.0时,用EDTA滴定Ca2+和Mg2+混合 溶液中的Ca2+,Mg2+与OH生成沉淀,达到消除 Mg2+干扰的目的。 缺点:
配位滴定剂EDTA的配位广泛性,导致EDTA对 于金属离子的选择性不高。
提的酸度
溶液中共存离子效应 准确滴定条件:
{{cc((M N''))//cc}}K Kff ((N MY)Y)106
控制酸度分步滴定金属离子具体应用
浓度都为0.01molL-1的Bi3+和Pb2+混合液,能否被分步滴定?
O
OH HO NN
O2N
2、钙指示剂
钙指示剂简称NN结构式如下:
O NaO S
O
OH HO NN
COOH
3、其他常用指示剂(P384)
酸性铬蓝K、酸性铬蓝K-萘酚绿B、邻苯二酚紫、 磺基水杨酸、甲基百里酚蓝
第六节 提高配位滴定的选择性
前面讨论的的通常是单一金属离子的滴定问题。 实际分析工作中分析对象一般为多组分体系。
1、配位掩蔽法
常见配位掩蔽剂及其使用条件(P387)
掩蔽剂 三乙醇胺
被掩蔽离子
Al3+,Fe3+,Sn4+,TiO2+,Mn2+
氟化物 氰化物 乙酰丙酮 邻二氮菲 柠檬酸
Al3+, Sn4+,TiO2+,ZrO2+ Cd2+,Hg2+,Cu2+,Co2+,Ni2+,Fe2+,Zn2+ Al3+,Fe3+ Cu2+,Co2+,Ni2+,Zn2+ Bi3+,Fe3+,Sn4+,Th4+,Ti4+,ZrO2+
与EDTA所形成配合物稳定性更高的配合物 Kf’(MIn)> Kf (MIn)
过量的EDTA也无法将Min中的金属离子置换 出,无法引起颜色变化
一些金属离子与金属指示剂的封闭现象
Al3,Fe3,Cu2, Ni2,Ti4 这些离子对于T铬 和黑 二甲酚橙有封闭作用
解决办法 离子为被测离子时以,采可用反滴法 离子为共存离子时以,加可入掩蔽剂或预分离
NaOH
Mg2+
Zn2+,Cd2+, Mn2+ Bi3+ Ca2+,Mg2+
Zn2+ Ca2+
pH 指示剂
10
铬黑T
10
铬黑T
1 二甲酚橙
10
铬黑T
5-6
PAN
12 钙指示剂
3、氧化还原掩蔽法
通过氧化还原反应,改变干扰离子的价态从而消除 干扰的方法。
lg{Kf [Fe(III)Y]}25.1, lg{Kf [Fe(II)Y]}14.33,
金属指示剂作用原理
络合滴定前加入金属指示剂
M + In = MIn
甲色 乙色
滴定过程中的变化
MIn +Y = MY + In
乙色
甲色
二、金属指示剂应具备的条件(P382)
1、在适宜的pH范围内,指示剂In与金属-指示剂配 合物Min的颜色要具有明显的差异。
2、金属指示剂与金属离子的反应必须迅速、灵敏 和良好的可逆性。
