材料专业《物理化学》期未试卷A答案(2007~2008学年第二学期)
07-08-2大物期末试卷A答案.

07-08学年第 2学期工科大学物理 (I期末试卷 A 卷参考答案一.选择题(每题 3分 , 共 30分1.[C]2.[A]3.[B]4.[D]5.[D]6.[C]7.[C]8.[C]9.[A] 10.[B ]二.填空题(每题 3分 , 共 30分1. 0.1 m/s2 3分;2. θcos /mg 1分θθc o ss i n gl2分; 3. 5.26×1012 m 1分; 4. θαμθμsin sin ctg Fh mgh +- 3分;5.02cos 1(x t m F +-ωω(SI 3分; 6. v v v v '+-'+'+=+M u m u m M m ( ( 2( 3分;7. 抛物线 3分; 8. ② 1分③ 1分① 1分;9. c 1分 c 2分; 10. 1.29×10-5 s 3分三.计算题(每题 10分 , 共 40分1. 解:各物体受力情况如图. 图 2分 F -T =ma 1分 T '=ma 1分 (T T '- R = β221mR 1分a =R β 1分由上述方程组解得:β =2F / (5mR =10 ra d·s -2 2分T =3F / 5=6.0 N 1分T '=2F / 5=4.0 N 1分2. 解:设沙子落到传送带时的速度为 1v , 随传送带一起运动的速度为 2v , 则取直角坐标系, x 轴水平向右, y 轴向上.i j j gh32==-=21v v , -4设质量为∆m 的砂子在∆t 时间内平均受力为 F, 则3(j i tm t m m t p F4+∆∆=∆⨯∆-⨯∆=∆∆=12v v 3分由上式即可得到砂子所受平均力的方向 , 设力与 x 轴的夹角为α则tg =α-1(4/3= 53°, 力方向斜向上 2分aa T ’3. 解 :设坐标系如图所示.将半圆柱面划分成许多窄条. d l 宽的窄条的电荷线密度为θλλλd d d π=π=l R取θ位置处的一条,它在轴线上一点产生的场强为θελελd 22d d 020RR E π=π= 3分如图所示 . 它在 x 、 y 轴上的二个分量为:d E x =dE sinθ , dE y =-d E cosθ 2分对各分量分别积分RR E x 02002d s in 2ελθθελππ=π=⎰ 2分0d cos 2002=π-=⎰πθθελRE y 2分场强 i Rj E i E E y x02ελπ=+= 1分4. 解:(1 在环内作半径为 r 的圆形回路 , 由安培环路定理得NI r B μ=π⋅2, 2/(r NI B π=μ 3分在 r 处取微小截面 d S = b d r , 通过此小截面的磁通量r b rNIS B d 2d d π==μΦ穿过截面的磁通量⎰=SS B d Φr b rNId 2π=μ12ln2R R NIbπ=μ 5分 (2 同样在环外 ( r < R 1 和 r > R 2 作圆形回路 , 由于0=∑iI02=π⋅r B∴ B = 0 2分5. 解:(1 222 /(/c c m mc E e v -== =5.8×10-13 J 2分(2 20v 21e K m E == 4.01×10-14 J 22c m mc E e K -=22]1 /(/1[(c m c e --=v = 4.99×10-13 J∴ =K K E E /08.04×10- 2 3分。
本科班物化试卷A

本试卷共6页第1页 本试卷共6页第2页黄淮学院化学化工系2007-2008学年度第二学期期末考试《 物理化学》(A )卷注意事项:本试卷适用于本科3年级化学专业学生使用1.在298K 时,下列离子中无限稀释摩尔电导率Λ∞m 最大的是 ( )。
A H + B Li + C OH - D Fe 3+2.含0.02mol •l -1 KCl 和0.01 mol •l -1 K 3[Fe(CN)6]的混合水溶液的离子强度为( ) mol •l -1 。
A 0.02B 0.04C 0.06D 0.083.若Na 2SO 4的质量摩尔浓度为m ,则m 与 m ± 的关系是 ( )。
A m ±=m B m ±=4m Cmm 314=± D m ±=m/m º4.在稀溶液中,离子强度对反应速率的影响称为( )。
A 笼效应 B 溶剂效应 C 原盐效应 D 扩散效应5.对带正电的Fe 2O 3 溶胶,加入下列离子后将发生聚沉,聚沉能力最强的离子是 ( )。
A F –B Cl –C Br – I –6.下列电极中,对阴离子可逆的电极为( ) 。
A 铜电极B 标准氢电极C 甘汞电极D 玻璃电极 7.丁铎尔效应是由于光照射胶体溶液时发生( )现象引起的。
A 反射 B 折射 C 衍射 D 散射8.若不在等电点时,浓度为C 的蛋白质分子所带电荷为Z ,则该电解质溶液的渗透压为 ( )。
A cRTB ZcRTC (Z+1)cRTD (Z -1)cRT9.如果任意时刻,反应物的浓度为c ,实验结果表明 lnc 对t 作图为一直线,则该反应为 ( ) 。
A 零级反应B 一级反应C 二级反应D 三级反应10.表面张力是物质的表面性质,其值与很多因互有关,但下列因素中与表面张力无关的是( ) 。
A 温度B 压力C 组成D 表面积大小 11.下列诸物性中,属于化学吸附的特性是 ( )。
2007-2008年下学期物理化学A考试卷

广西工学院 2007 — 2008 学年第 2 学期课程考核试题考核课程物理化学( A 卷)考核班级生化系2006级学生数印数考核方式闭卷考核时间 120 分钟一、填空题(15小题,共23.0分)1.理想气体微观模型的要点是及。
2. 范德华方程是在理想气体状态方程基础上分别进行_____修正和_____修正所得到的,其压力适用范围为______。
3.临界温度是气体能够液化的_____温度,超过此温度无论加多大压力均不能使气体液化。
4.在同样T,p下,A气体的压缩因子Z = 0.8,B的Z = 0.5,则气体______对理想气体偏离更大?5.关系式= 常数只适用于。
( γ= C p/ C V)6.热力学第一定律数学表达式ΔU = Q+W只适用于系统7.物理量T,p,V,U,H,Q,W中,属于状态函数的有,属于广度性质的有,属于强度性质的有。
8. 使一过程的ΔS = 0,应满足的条件是 。
9.某实际气体经可逆过程(R)与不可逆过程(I)两条途径由同一始态到达相同的终态,则ΔS RΔS I。
(选填>,=,<)10. 亨利定律的数学表达式之一为________________。
11. 气相反应2NO(g) + O2(g) == 2NO2(g) 是放热反应, 当反应在一定温度、一定压力下达平衡时, 若升高温度, 则平衡向______移动; 若增大压力, 则平衡向_____移动( 选填左,右)。
12. 等温等压下影响表面吉布斯函数的因素是_________和__________。
13. 已知0.2mol·kg-1的CuSO4水溶液中Cu2+的迁移数为0.379,则SO42-离子迁移数为_____________ 。
14. 0.1 mol ·kg -1LaCl 3电解质溶液的离子强度等于_____________。
15. 25℃时NaCl溶液的,Cl-的,则Na +和Cl -的迁移数t (Na +)= ,t (Cl -) = 。
2007物理化学试卷下A-推荐下载

(B) 成反比
(D) 无关
(
()
()
()
()
()
)
(B) 作用点相同而方向和大小不同
(C) 作用点相同而产生的原因不同
(D) 产生的原因相同而方向不同 12. 某反应的速率常数 k = 7.7×10-4 s-1,又初始浓度为 0.1 mol·dm-3,则该
反应的半衰期为
(A) 86 580 s (C) 1 800 s
10. 某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期
与
反应物初始浓度
(A) 成正比
(C) 平方成反比
11. 液体的附加压力和表面张力的联系与区别在于
(A) 产生的原因和方向相同而大小不同
(B) (Pt)H2|NaOH(aq)|O2(Pt);
(B) - 0.4395 V (D) 0.807 V
过程中,极化作用使腐蚀速度 ________ 。
5. 电解氢氧化钾溶液,制备氢气和氧气的阳极反应是__
_____________;阴极反应是 __________________ 。
6. 有下列溶液:
(1) 0.001 mol·kg-1 KCl (3) 0.001 mol·kg-1 HCl
其中摩尔电导率最大的是 ; 最小的是 。
13. 下述电动电位描述错误的是
(A) 表示胶粒溶剂化层界面至均匀相内的电位差
(B) 电动电位值易随少量外加电解质而变化
(C) 其值总是大于热力学电位值
(D) 当双电层被压缩到溶剂化层相合时,电动电位值变为零
14. 400 K 时,某气相反应的速率常数 kp= 10-3(kPa)-1·s-1,如速率常数用
(A) (Pt)H2|H+(aq)||OH-|O2(Pt);
2007-2008(二)物化试卷A
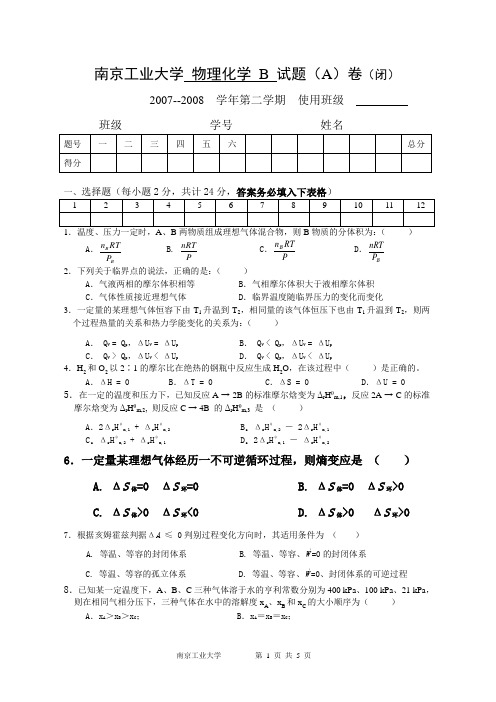
南京工业大学 物理化学 B 试题(A )卷(闭)2007--2008 学年第二学期 使用班级班级 学号 姓名题号 一 二 三 四 五 六 总分 得分一、选择题(每小题2分,共计24分,答案务必填入下表格) 1 2 3 4 5 6 7 8 9 1011121.温度、压力一定时,A 、B 两物质组成理想气体混合物,则B 物质的分体积为:( )A .B B P RT n B. P nRTC .P RTn B D .B P nRT2.下列关于临界点的说法,正确的是:( )A .气液两相的摩尔体积相等B .气相摩尔体积大于液相摩尔体积C .气体性质接近理想气体D .临界温度随临界压力的变化而变化3.一定量的某理想气体恒容下由T 1升温到T 2,相同量的该气体恒压下也由T 1升温到T 2,则两个过程热量的关系和热力学能变化的关系为:( ) A . Q V = Q p ,ΔU V = ΔU p B . Q V < Q p ,ΔU V = ΔU p C . Q V > Q p ,ΔU V < ΔU p D . Q V < Q p ,ΔU V < ΔU p4.H 2和O 2以2∶1的摩尔比在绝热的钢瓶中反应生成H 2O ,在该过程中( )是正确的。
A .ΔH = 0B .ΔT = 0C .ΔS = 0D .ΔU = 05.在一定的温度和压力下,已知反应A → 2B 的标准摩尔焓变为Δr H θm,1,反应2A → C 的标准摩尔焓变为Δr H θm,2, 则反应C → 4B 的Δr H θm,3 是 ( )A .2Δr H θm,1 + Δr H θm,2 B .Δr H θm,2 - 2Δr H θm,1C .Δr H θm,2 + Δr H θm,1D .2Δr H θm,1 - Δr H θm,26.一定量某理想气体经历一不可逆循环过程,则熵变应是 ( )A. ΔS 体=0 ΔS 环=0B. ΔS 体=0 ΔS 环>0C. ΔS 体>0 ΔS 环<0D. ΔS 体>0 ΔS 环>07.根据亥姆霍兹判据ΔA ≤ 0判别过程变化方向时,其适用条件为 ( )A. 等温、等容的封闭体系B. 等温、等容、W ¹=0的封闭体系C. 等温、等容的孤立体系D. 等温、等容、W ¹=0、封闭体系的可逆过程8.已知某一定温度下,A 、B 、C 三种气体溶于水的亨利常数分别为400 kPa 、100 kPa 、21 kPa ,则在相同气相分压下,三种气体在水中的溶解度x A 、x B 和x C 的大小顺序为( )A .x A >xB >xC ; B .x A =x B =x C ;C .x A <x B <x C ;D .x B <x A <x C9.A 、B 两组分在等温等压下混和形成理想液态混合物,则有( )A .Δmix H = 0B .Δmix S = 0C .Δmix A = 0D .Δmix G=010.1mol101.325kPa 、100℃H 2O(l)的化学势为1μ,1mol 同温同压下H 2O(g)的化学势为2μ,则( )A. 1μ>2μB.1μ <2μC. 1μ=2μD.无法判断 11.已知反应2 NH 3(g) = N 2(g)+ 3 H 2(g) 的标准平衡常数为 0.25。
2007-2008物理化学(下册)期末试题

2007-2008学年第二学期物理化学(下册)期末考试试卷班级 姓名 学号 08年6月一、填空(在以下各小题画有“ ”处填上正确答案。
)1.在298K ,101325Pa 下,将直径d =0.1mm 的毛细管插入水中,已知水的表面张力γ水-气=0.0728N/m ,水的密度ρ=1.0g/cm 3,接触角θ=0˚,重力加速度g =9.8m/s 2,则平衡后液面上升高度h = m 。
2.在400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,若速率常数用 k C 表示,则k C = (mol ·m -3)-1·s -1。
3.设计一个可求AgI 溶液K sp 的电池: 。
4.某温度下,反应A —→B 为一级反应,若21t 和41t 分别代表该反应物A 消耗掉50%和75%所需时间,则比值21t :41t =________________。
5.若某1-1型电解质溶液的摩尔电导率为正负离子的摩尔电导率之和,这一规律所适用于: 。
6.由AgNO 3和KI 生成AgI 溶胶,若Al(NO 3)3,Mg(NO 3)2和NaNO 3对该溶胶的聚沉值分别为0.067mol ·dm -3,2.60 mol ·dm -3和140 mol ·dm -3,则该AgI 的胶团结构为: 。
7.一维简谐振子振动能级的简并度为 ,线型刚性转子转动能级的简并度为 。
8.一个双原子分子的振动配分函数表示为1/[1-exp(- v /T )],该配分函数是以 为能量零点的振动配分函数。
二、选择题:(请将答案填在答案表格中)1. 在25℃时,若电池Pb(Hg)(a 1)∣Pb(NO 3)2(aq) ∣Pb(Hg)(a 2)中,a 1> a 2,则电池电动势E A. >0 B. <0 C. =0 D. 无法确定2.某电池电动势与温度的关系为: E /V=1.01845-4.05×10-5(T /K-293) -9.5×10-7(T/K-293)2 在298K 时,若该电池可逆放电,则过程热:A.Q > 0B. Q < 0C. Q = 0D.不能确定3.在溶胶的光学性质中,散射光的强度I 与入射光的波长λ、分散相及分散介质的折射率n 、n 0之间的关系中正确的是:A .I 与λ4成正比,I 与(n 2-n 20)2成正比B .I 与λ4成反比,I 与(n 2+n 20)2成正比C .I 与λ4成正比,I 与(n 2-n 20)2成反比D .I 与λ4成反比,I 与(n 2-n 20)2成正比4.(N 、U 、V )确定的离域子系统中,某种分布的微观状态数W D 为:A .∏i i n i n g N i!!B .∏ii ni n g i !C .∑ii g in n i!D .∑ii ni n g i !5.已知某复合反应的反应历程为D C B B A kk k −→−+===-211,则B 的浓度随时间的变化率=dtdc BA .k 1c A − k 2cB cC B .k 1c A −k -1c B −k 2c B c C C .k 1c A −k -1c B + k 2c B c CD .−k 1c A + k -1c B + k 2c B c C6.HI 分解反应在没有催化剂条件下时活化能为184.1kJ ·mol -1,反应速率常数为k 非,平衡转化率为α非,反应热为Q非,平衡常数为K 非。
《物理化学》期未试卷A答案

2009 — 2010 学年 第 一 学期化学与材料学院2007级应化、材料专业《物理化学》期末试卷(A)答案题号 分数 一 二三 四(1)四(2) 四(3) 四(4) 总分 评卷人复核人考生考试诚信承诺书在我填写考生信息后,表示我已阅读与理解《龙岩学院考试纪律与违纪处分办法》得有关规定,承诺在考试中自觉遵规守纪,如有违反将接受处理;我保证在本科目考试中,本人所提供得个人信息就是真实、准确得。
考生签名:ﻬ一、选择题(每小题1分,共20分;填上正确答案)1。
对于一定量得理想气体,有可能发生得过程就是 ( A,C )(A) 对外做功且放出热量 (B) 恒容绝热升温,无非膨胀功 (C) 恒压绝热膨胀 (D) 恒温绝热膨胀2.某气体得状态方程为pV m =RT +bp (b 为大于零得常数),此气体向真空绝热膨胀后得温度将( A ) (A) 不变 (B) 上升 (C) 下降 (D) 不确定3.有一容器四壁导热,上部有一可移动得活塞,在这容器中同时放入锌粒与盐酸,发生化学反应后活塞将上移一定距离,以锌粒与盐酸为系统,则 ( A )(A ) Q 〈 0,W 〈 0,ΔU < 0 (B) Q 〈 0,W= 0,U 〉 0试卷类别:开卷( )闭卷( √) 考试用时: 120 分钟考试时间: 2010 年 1 月 9 日 下 午 考试地点: 文(202)注意事项1、学生得院(系)别、专业、班级、姓名、学号必须填写在考生信息栏内指定得位置。
2、学生在考试之前必须填写考试时间与地点。
3、答题字迹要清楚,并保持卷面清洁。
息考生 信栏院(系) 班级 姓名 学号………………………………………………装……………………订……………………线……………………………………息生 信栏姓名 学号装……………………订……………………线……………………………………(C) Q = 0,W〈 0,ΔU 〈 0 (D ) Q = 0,W< 0,ΔU = 0 4。
2008材料物理考题A

课程号: 0302053《材料物理A 》期末考试试卷(A )考试形式:闭卷考试 考试时间:120分钟班号 学号 姓名 得分二、简答题(每小题5分,共40分)1.简述铁电体、压电体、热电体、介电体的关系。
2.简述半导体的分类。
本征半导体,其载流子 3.简述热应力产生的原因(举例说明)。
4.简述提高无机材料透光性的措施有哪些?5.本征离子电导的导电离子(载流子)主要由什么缺陷提供?其载流子浓度:n =N exp(E /2kT )中E 的物理意义是什么?6.离子迁移率 ,试分析影响离子迁移率的主要因素是什么? 7.画出软磁、硬磁及矩磁材料的磁滞回线。
并简单说明硬磁材料的应用。
8.说出四种无机材料的韧化机制。
三、计算题(共20分) 1.(5分)一部热机部件由反应烧结氮化硅制成,其热导率λ=0.184J /(cm.s.℃),其厚度=120mm 。
如果表面热传递系数h=0.05 J /(cm 2.s.℃),假设形状因子S=1,R=547℃,估算可兹应用的热冲击最大允许温差。
2.(5分)一透明Al 2O 3板厚度为1mm ,折射率n=1.76,用以测定光的吸收系数。
如果光通过板厚之后,其强度降低了15%,计算吸收及散射系数的总和。
3.(10分)有一无机绝缘长方形薄片材料,长为a ,宽为b ,若采用直流四探针法测其绝缘电阻,相邻电极间的距离均为L 。
(1)请画出测量试件体电阻和表面电阻的接线电路图。
(2)若采用200V 直流电源测出试件的表面电阻为100M Ω,试计算该材料的表面电阻率。
四、综述题(共10分)绘出典型铁电体的极化曲线和电滞回线,说明其主要参数的物理意义和造成P —E 非线性关系的原因。
⎪⎭⎫⎝⎛-⋅==kT U kT q E 020exp 6δνυμ附:基本公式1. 第一、第二和第三热断裂抵抗因子分别为2. 介质对光吸收的一般规律: 3.光散射方程:4.反射系数(m) :5.费米分布函数: 1]/)exp(1[)(--+=kT E E E f f 6.体电阻率的理论表达式:体电阻率的实验表达式:7.薄圆片式样表面电阻率表达式:8.导带中导电电子的浓度:价带中空穴的浓度:9.滑移面上F 方向的应力为 :10.理论断裂强度:aE m γσ=11.格利菲斯裂纹断裂强度:cE c γσ=12.胡克定律:εσE =()αμσE R f -=1h r R T m 31.01max ⨯'=∆()αμσE T f -=∆1max ()αμλσE R f -='1()pp f C R C E R ρρλαμσ'=⋅-=''1()2max 31m f p r E C dt dT ⋅-⋅-=⎪⎭⎫ ⎝⎛αμσρλ2212111⎪⎪⎭⎫ ⎝⎛+-=⎪⎭⎫ ⎝⎛'=n n w w m 令xe I I α-=0Sx e I I -=0IVh r V ⋅=21πρIVh r r V ⋅+=4)(221πρI Vr r s ⋅=12ln 2πρ⎪⎪⎭⎫ ⎝⎛--=kT E E N n f c c e exp ⎪⎪⎭⎫⎝⎛--=kT E E N n V f V h exp 2/32*22⎪⎪⎭⎫⎝⎛=h kTm N e c π2/32*22⎪⎪⎭⎫⎝⎛=h kT m N h VπAF A F φφσcos cos /==。
《物理化学》期未试卷A答案

2009 — 2010 学年 第 一 学期化学与材料学院2007级应化、材料专业 《物理化学》期末试卷(A )答案题号 分数 一 二 三 四(1) 四(2) 四(3) 四(4)总分 评卷人复核人考生考试诚信承诺书在我填写考生信息后,表示我已阅读和理解《龙岩学院考试纪律与违纪处分办法》的有关规定,承诺在考试中自觉遵规守纪,如有违反将接受处理;我保证在本科目考试中,本人所提供的个人信息是真实、准确的。
考生签名:试卷类别:开卷( )闭卷( √) 考试用时: 120 分钟考试时间: 2010 年 1 月 9 日 下 午 考试地点: 文(202)注意事项1、学生的院(系)别、专业、班级、姓名、学号必须填写在考生信息栏内指定的位置。
2、学生在考试之前必须填写考试时间和地点。
3、答题字迹要清楚,并保持卷面清洁。
息考 生信栏院(系) 班级 姓名 学号………………………………………………装……………………订……………………线……………………………………一、选择题(每小题1分,共20分;填上正确答案)1.对于一定量的理想气体,有可能发生的过程是 ( A ,C ) (A) 对外做功且放出热量 (B) 恒容绝热升温,无非膨胀功 (C) 恒压绝热膨胀 (D) 恒温绝热膨胀2.某气体的状态方程为pV m =RT +bp (b 为大于零的常数),此气体向真空绝热膨胀后的温度将( A ) (A) 不变 (B) 上升 (C) 下降 (D) 不确定3.有一容器四壁导热,上部有一可移动的活塞,在这容器中同时放入锌粒和盐酸,发生化学反应后活塞将上移一定距离,以锌粒和盐酸为系统,则 ( A ) (A) Q < 0,W< 0,ΔU < 0 (B) Q < 0,W= 0,ΔU > 0 (C) Q = 0,W< 0,ΔU < 0 (D) Q = 0,W< 0,ΔU= 04.使气体致冷的节流膨胀,其焦耳-汤姆逊系数μJ-T 必须 ( A ) (A) > 0 (B) < 0 (C) = 0 (D) 难判断5.下列哪个关系式既是化学势又是偏摩尔量 ( B )6.1 mol A 与n mol B 组成的溶液,体积为0.65 dm 3,当x B = 0.8时,A 的偏摩尔体积V A,m = 0.090 dm 3·mol -1,那么B 的偏摩尔V B,m为 ( A ) (A) 0.140 dm 3·mol-1(B) 0.072 dm 3·mol -1 (C) 0.028 dm 3·mol -1(D) 0.010 dm 3·mol -17.下列过程中能适用方程 的是 ( A )(A) I 2(s)I 2(g) (B) Hg 2Cl 2(s)2HgCl(s) (C) C(石墨)C(金刚石) (D) N 2(g,T 1,p 1)N 2(g,T 2,p 2)8.有四杯含有不同溶质相同质量摩尔浓度(m=1.0mol ·kg -1)的水溶液,分别测定其沸点,沸点升高最多的是 ( A ) (A) Al 2(SO 4)3 (B) MgSO 4 (C) K 2SO 4 (D) C 6H 5SO 3H9.可逆机的效率为η,冷冻机的冷冻系数为β,则η和β的数值满足 ( D ) (A) η<1,β<1 (B) η≤1,β≤1 (C) η<1,β>1 (D) η<1,β≤1或β>110.下图中哪个是理想气体卡诺循环的T-S 图? ( A )11.按下图的路线循环一周,哪种情况环境做的功W 为最大。
2007-2008 物理化学(Ⅱ) A卷附标准答案

第 2页 共 2页北民族大学试卷(答案)课程代码:13100342 课程:物理化学(Ⅱ) (A 卷答案)一、选择题(每小题2分,共20分)1.电解质溶液的摩尔电导率随溶液浓度的增加而 ( 2 ) ⑴增加 ⑵减小 ⑶先减小后增大 ⑷先增大后减小2.用对消法(补偿法)测定可逆电池的电动势,主要为了 ( 3 ) ⑴消除电极上的副反应 ⑵减少标准电池的损耗⑶在可逆情况下测定电池电动势 ⑷简单易行3.若算得电池反应的电池电动势为负值,表示此反应是 ( 2 ) ⑴正向进行 ⑵逆向进行 ⑶不可能进行 ⑷反应方向不确定4.电解时,在阳极上首先发生氧化作用而放电的是 ( 4 ) ⑴标准还原电极电势最大者 ⑵标准还原电极电势最小者⑶考虑极化后,实际上的不可逆还原电极电势最大者 ⑷考虑极化后,实际上的不可逆还原电极电势最小者5.有关基元反应的描述在下列诸说法中哪一个是不正确的 ( 3 ) ⑴基元反应的级数一定是整数 ⑵基元反应进行时无中间产物,一步完成⑶基元反应不一定符合质量作用定律 ⑷基元反应一定符合质量作用定律6.反应1A B k −−→(Ⅰ),2A D k −−→ (Ⅱ) ,已知反应Ⅰ的活化能E 1大于反应Ⅱ的活化能E 2,以下措施中哪一种不能改变获得B 和D 比例 ( 2 )⑴提高反应温度 ⑵延长反应时间 ⑶加入适当催化剂 ⑷降低反应温度 7.任一基元反应,反应分子数与反应级数的关系是 ( 1 ) ⑴一般反应级数等于反应分子数 ⑵反应级数小于反应分子数⑶反应级数大于反应分子数 ⑷反应级数大于或小于反应分子数8.通常表面活性物质就是指当加入液体后 ( 4 ) ⑴能降低液体表面张力 ⑵能增加液体表面张力⑶不影响液体表面张力 ⑷能显著降低液体表面张力9.丁铎尔效应是发生了光的什么结果? ( 1 ) ⑴散射 ⑵反射 ⑶折射 ⑷透射10.对于有过量的KI 存在的AgI 溶胶,下列电解质中聚沉能力最强的是( 4 ) ⑴NaCl ⑵ K 3[Fe (CN )6] ⑶MgSO 4 ⑷FeCl 3二、判断题(每小题2分共20分)1.对于一个在定温、定压下,不做非体积功的化学反应来说,△G 越负,反应速率越快(×)2.在任意条件下,任意一基元反应的活化能不会小于零,但对于非基元反应,活化能可以是正值,也可以是负值,甚至为零。
海南大学《物理化学》2007-2008学年第二学期期末试卷A卷

海南大学材料与化学工程学院 2007-2008 学年度第 2 学期《物理化学 (上)》 考试试题(A 卷)科目: 《物理化学》 (上) 试题(A 卷)学院: 材料与化学工程学院 专业班级: 考试说明: 本课程为闭卷考试, 可携带 计算器 。
得分 阅卷教师一、 填空题: (每题 2 分, 共 20 分) 在以下各小题中画有_______处填上答 案。
1、物理量Q (热量)、 V (系统体积)、 W(功)、 P (系统压力)、 U (热力学能)、 T (热力学温度), 其中属于状态 函数的是 ; 与过程有关的量是 ; 状态函数中属于强度性质的是 ; 属于容量性质是 。
2、CO2处于临界状态时, 若其饱和液体的摩尔体积为V l , 饱和蒸气的摩尔体积为Vg ,则Vg V 1 (填>,<或=); 其临界温度Tc 是CO 2能够液化的 温度(填最高、最低或无关)。
( ) 1、非挥发性的溶质溶于溶剂中形成稀溶液之后将会引起: 蒸气压升高; C 沸点降低;D 熔点降低。
p ( )2、 p 1V ln 2 V 1计算式的适用条件: A 、无相变、无化学变化的任何过程; B 、任何可逆过程;C 、无其它功的任何过程;D 、理想气体任何过程。
得分 阅卷教师把 2mol CO 与 1mol O 2 放入 25℃的密闭容器内, 其容积为 73.39dm 3, 加入催化剂后, CO 和 O 2 恒温地 反应变为 CO 2, 查得 CO 在 25℃时的标准生成焓为-110.42kJ.mol -1,CO 2 为-393.14kJ.mol -1, 假设 CO 2、CO 和 O 2 均为理想气体,求△U ,△H 、 Q 、W 。
解: (1)理想气体恒温过程:△U =O(2) 因为反应为 2CO+O 2=2CO 2故 △H = 2△f H θm (CO 2 )—[ 2△f H θm (CO)+ △f H θm (O 2] =-565.44kJ (3) Q=△H = -565.44kJ(4) W=P △V =△nR T =8.314×298×( - 1 )J=-2477.57J 四、 计算题 (共 30分)二、 选择题(每题2分, 共 18分 选择正确答案的编号, 填在各题前的括号内) 三 、 讨论下题解法是否有错, 如有, 请改正之。
05、06材料专业《物理化学》期未试卷A答案(2007~2008学年第二学期)

05、06级材料专业《物理化学》期未试卷A(2007 ~2008 学年 第二学期)一、选择题(每题1分;填上正确答案)(15分)1、 已知下列两电极反应的标准电极电势为:Sn 2+(aq) +2e -→Sn(s) φөSn 2+/Sn = -0.14VSn 4+(aq) +2e -→Sn 2+(aq) φөSn 4+/Sn 2+= 0.15V由此计算Sn 4+(aq) +4e -→Sn(s) 的φөSn 4+/Sn 值为: (D )(A )0.01V ; (B )0.29V ; (C )-0.01V ; (D )0.005V2、25℃时,电池反应Ag(s)+1/2Hg 2Cl 2(s) = AgCl(s)+Hg(l)的电池电动势为0.0193V ,反应时所对应的△r S m 为32.9J·K -1·mol -1,则电池电动势的温度系数 (əE /əT )p 为: V·K -1 (D )(A )1.70×10-4;(B )1.10×10-6;(C )1.01×10-1;(D )3.40×10-43、在等温、等压下电池以可逆方式对外作电功的热效应为Q r ,则: (C )(A )Q r =0; (B )Q r =△H ; (C )Q r =T △S ; ( D )Q r =△U4、弯曲表面上附加压力的计算公式:△p =2σ/r中,r 的符号: (A ) (A )液面为凸面时为正,凹面为负;(B )总为正; (C )液面为凸面时为负,凹面为正;(D )总为负5、液体在毛细管中上升的高度与下列哪一个因素无关: (D )(A )温度; (B )液体密度; (C )重力加速度; (D )大气压力6、两个活化能不同反应,如E 1>E 2,且都在相同的升温区间内升温,则(B ) (A )dln k 2/d T > dln k 1/d T ; (B )dln k 2/d T < dln k 1/d T (C )dln k 2/d T = dln k 1/d T ; (D )d k 2/d T > d k 1/d T7、有关基元反应的描述在下列诸说法中哪一个是不正确的? (D )(A )元反应的级数一定是整数;(B )元反应的级数一般不大于3(C )元反应进行时无中间产物;(D )元反应不一定符合质量作用定律8、某二级反应,反应物消耗1/3需时10min ,若再消耗1/3还需时为: (C )(A )10 min ;(B )20 min ;(C )30 min ;(D )40 min9、温度与表面张力的关系是: (A )(A )温度升高表面张力降低; (B )温度升高表面张力增加;(C )温度对表面张力没有影响; (D )不能确定。
2007-2008(2)基础物理1期末试卷A答案

07-08学年第2学期基础物理学(1)期末试卷A 卷参考答案一.选择题(每题3分, 共30分)1.[D]2.[D]3.[B]4.[E]5.[B]6.[D]7.[D]8.[A]9.[C] 10.[B] 二.填空题(每题3分, 共30分,注:单位错误总共扣1分) 1. 16 R t 2 2分4 rad /s 2 1分2. q v 2分竖直向下 1分3. 5.26×1012 m 3分(数量级错误扣1分)4. 0.8 m 1分0.2 m 1分 125 Hz 1分5. ])/(2cos[π++πλνx t A 2分)212cos()21/2cos(2π+ππ+πt x A νλ 1分6. 答案见图 2分 > 1分7. σ 2分 σ / ( ε 0ε r ) 1分8. I / (2πr ) 2分μI / (2πr ) 1分9. ② 1分 ③ 1分 ① 1分 10. x 轴正方向 2分x 轴负方向 1分三.计算题(每题10分, 共40分)1. 解:(1) 设沙袋抛到船上后,共同运动的初速度为V ,并设此运动方向为x 轴正方向,忽略沙袋撞击船时受水的阻力,则可认为沙袋+船在沙袋落到船上前后水平方向动量守恒,因而有0)(v m V m M =+ 2分mM m V +=0v 2分(2) 由 tm M t x k d d )(d d v+=- 得 v d d kmM x +-= 2分 ⎰⎰+-=0d d V v k m M x x )0(V -+-=k mM 2分 km x 0v =2分2. 解:球体对中心轴的转动惯量为J c = (2/5)mR 2质心沿斜面平动,有: m g sin θ - f = ma c 1分 N - mg cos θ = 0 1分 绕质心转动有: f R = J c β2分 只滚不滑时有条件: a c = R β 2分由以上四式可得: θθs i n 72s i n 2=+=mg mRJ J f c c1分 欲使物体只滚不滑,则必须是:f ≤μ N =μ mg cos θ 2分所以有 ( 2/ 7 ) m g sin θ≤μ m g cos θtg θ ≤3.5 μ ,θ ≤tg -1(3.5μ) 1分3. 解:与阴极同轴作半径为r (R 1<r <R 2 )的单位长度的圆柱形高斯面,设阴极上电荷线密度为λ.按高斯定理有 2πrE = λ/ ε0得到 E = λ / (2πε0r ) (R 1<r <R 2) 2分方向沿半径指向轴线.两极之间电势差⎰⎰π-=⋅=-21d 2d 0R R BA B A r rr E U U ελ 120ln 2R R ελπ-= 2分 得到 ()120/ln 2R R U U A B -=πελ, 所以 ()rR R U U E A B 1/ln 12⋅-=2分在阴极表面处电子受电场力的大小为()()11211/c R R R U U eR eE F A B ⋅-== 2分=4.37×10-14 N 2分方向沿半径指向阳极.4. 解:两个载同向电流的长直导线在如图坐标x 处所产生的磁场为)11(2210r r x x B +-+π=μ 2分 选顺时针方向为线框回路正方向,则)d d (21111210⎰⎰⎰+++-+π==br r br r r r x xxx IaBdS μΦ 3分)ln(222110r b r r b r Ia+⋅+π=μ 2分 ∴ tIr r b r b r a t d d ]))((ln[2d d 21210++π-=-=μΦt r r b r b r a I ωωμcos ]))((ln[2212100++π-= 3分。
白城师范学院《物理化学》2007-2008学年第二学期期末试卷A卷

白城师范学院课程考试试题纸2007—2008学年第二学期(期(A卷)(考( ) 9 、质量作用定律适用于:A 对峙反应B 复合反应C 任意反应D 基元反应( ) 10、某反应在一定条件下的平衡转化率为25.3%,当有催化剂存在时,其转化率应是A 大于25.3%B 小于25.3%C 等于25.3%D 不确定( ) 11、对于一个化学反应,反应速度越快,则得分评卷人( ) 10 、物质的表面张力与表面积的大小有关。
得分评卷人温度升高1K,电池电动势增加1.45 × 10-4,求1mol Pb 溶解时(1)自此电池最多能得多少功(2)25ºC 时反应的∆H.(3)25ºC 时反应的∆S.(4)1mol Pb 可逆溶解时电池吸热多少?5. (5 分)反应H2+I2 →2HI 的反应机理可能是:①I2+M 2I·+M;慢②H2+2I· 2HI;慢③2I· + M I2+M;快已知k3 >> k 2应用稳态近似证明:d[HI]/dt=k[H2][I2]白城师范学院课程考试试题参考答案及评分标准课程名称:物理化学(A 卷)考试方式:(考试)专业年级:化学2005 级本1 、2 班学年学期: 2007-2008 第二学期命题教师所在院部:化学教师签字:孙英华教研室主任签字:注:标准答案需写清题号;每小题得分、共得分;参考答案要点;评分标准等。
一.选择题(共40分每题2分)1、B2、B3、D4、A5、D6、D7、A8、B9、D10、C11、A12、A13、B14、C15、C16、B17、D18、C19、D20、D.二.判断题(共10分,每题1分)1.T2.F3.T4.F5.T6、F7、T8、F9、F10、F三.填空题(共10分,每题1分)1、0.4mol/kg,0.292、浓差极化,电化学极化3、链的开始,链的传递,链的终止4、P凸>P平>P凹,5、1/86、大于四.计算题(共40分)1.(5分)高空中如果没有灰尘,水蒸汽可以达到相当高的过饱和程度而不致凝结成水(2分)。
2007-2008 物理化学(Ⅱ) A卷附标准答案

第 2页 共 2页北民族大学试卷(答案)课程代码:13100342 课程:物理化学(Ⅱ) (A 卷答案)一、选择题(每小题2分,共20分)1.电解质溶液的摩尔电导率随溶液浓度的增加而 ( 2 ) ⑴增加 ⑵减小 ⑶先减小后增大 ⑷先增大后减小2.用对消法(补偿法)测定可逆电池的电动势,主要为了 ( 3 ) ⑴消除电极上的副反应 ⑵减少标准电池的损耗⑶在可逆情况下测定电池电动势 ⑷简单易行3.若算得电池反应的电池电动势为负值,表示此反应是 ( 2 ) ⑴正向进行 ⑵逆向进行 ⑶不可能进行 ⑷反应方向不确定4.电解时,在阳极上首先发生氧化作用而放电的是 ( 4 ) ⑴标准还原电极电势最大者 ⑵标准还原电极电势最小者⑶考虑极化后,实际上的不可逆还原电极电势最大者 ⑷考虑极化后,实际上的不可逆还原电极电势最小者5.有关基元反应的描述在下列诸说法中哪一个是不正确的 ( 3 ) ⑴基元反应的级数一定是整数 ⑵基元反应进行时无中间产物,一步完成⑶基元反应不一定符合质量作用定律 ⑷基元反应一定符合质量作用定律6.反应1A B k −−→(Ⅰ),2A D k −−→ (Ⅱ) ,已知反应Ⅰ的活化能E 1大于反应Ⅱ的活化能E 2,以下措施中哪一种不能改变获得B 和D 比例 ( 2 )⑴提高反应温度 ⑵延长反应时间 ⑶加入适当催化剂 ⑷降低反应温度 7.任一基元反应,反应分子数与反应级数的关系是 ( 1 ) ⑴一般反应级数等于反应分子数 ⑵反应级数小于反应分子数⑶反应级数大于反应分子数 ⑷反应级数大于或小于反应分子数8.通常表面活性物质就是指当加入液体后 ( 4 ) ⑴能降低液体表面张力 ⑵能增加液体表面张力⑶不影响液体表面张力 ⑷能显著降低液体表面张力9.丁铎尔效应是发生了光的什么结果? ( 1 ) ⑴散射 ⑵反射 ⑶折射 ⑷透射10.对于有过量的KI 存在的AgI 溶胶,下列电解质中聚沉能力最强的是( 4 ) ⑴NaCl ⑵ K 3[Fe (CN )6] ⑶MgSO 4 ⑷FeCl 3二、判断题(每小题2分共20分)1.对于一个在定温、定压下,不做非体积功的化学反应来说,△G 越负,反应速率越快(×)2.在任意条件下,任意一基元反应的活化能不会小于零,但对于非基元反应,活化能可以是正值,也可以是负值,甚至为零。
物理化学试卷答案

Q + 0 0
W 0
rU 0 0
rH 0 0
〈自发 ∆AT ,V ≤ 0 = 平衡 (没有下标也给 2 分,没有第一句话,只写后面的不等式 的且有下标的给 2 分) ;吉布斯函数判据:适用于等温等压且没有非体积功 7、任意组分在全部浓 〈自发 的封闭系统(1 分) , ∆GT,P ≤ 0 = 平衡 (没有下标也给 2 分,没有第一句 话,只写后面的不等式的且有下标的给 2 分) 。 3、简述理想气体的基本特征和理想液态混合物的微观特征。
四、简答题(第一题 6 分,第二题 9 分,第三题 4 分,共 19 分)
1、简述热力学第一定律、热力学第二定律、热力学第三定律的内容。 答:热力学第一定律:即能量守恒定律,能量既不可以无中生有,也不可以 消灭, 只能从一种形式转化为另一种形式, 在转化过程中能量的总值不变 (第 一类永动机不可能制造成功;隔离(封闭)系统中的能量可以相互转化,但 是能量的总值不变) (2 分) ;热力学第二定律:不可能把热由低温热源传到 高温热源,而不留下任何痕迹(不可能从单一热源吸热使之完全变为功,而 不留下任何痕迹;第二类永动机不可能实现。 ) (2 分) ;热力学第三定律:0K 时任何纯物质的完美晶体的熵值为 0,即 S*(完美晶体,0K)=0(2 分) 。 2、简述熵判据、亥姆霍兹函数判据和吉布斯函数判据的内容及适用条件。 〉自发 答:熵判据:适用于隔离系统(1 分) , ∆S 隔离 ≥ 0 = 平衡 (没有下标也给 2 分,没有第一句话,只写后面的不等式的且有下标的给 2 分) ;亥姆霍兹函 数判据:适用于等温等容且没有非体积功的封闭系统(1 分) ,
解: (1) (5)为凝聚系统的等温过程,吉布斯函数随压力的变化很小,可 近似看作零,即ΔG1≈0,ΔG5≈0; (2) (4)过程为可逆相变,故ΔG2=0, ΔG4=0; (3)为等温可逆过程,ΔG3=nRTln(P5/P4)=-105J(每步ΔG 计算正确给 1 分 共 5 分,设计途径给 3 分,ΔG 总 1 分。也可以 ΔG=ΔG1+ΔG2+ΔG3+ΔG4+ΔG5=0+0+(-105)+0+0=-105 J。
四川大学2007级物理化学I-2期末试题-A_answer_

2007级化学学院物理化学(I)-2期末考试试题-A 卷一. 选择题(16分)1. 对于连串反应12R B P k k ⎯⎯→⎯⎯→,巳知E a,1 > E a,2,若想提高产品B 的百分数,应采取措施 C 。
A. 增加原料RB. 及时移去PC. 升高温度D. 降低温度2. 某二级反应,反应物消耗1/2需时间10min ,若继续消耗1/2,还需时间 B 。
A. 10minB. 20minC. 30minD. 40min3. 质量摩尔浓度为m 的H 3PO 4溶液,设其完全电离,离子平均活度系数为γ±, 则溶液中H 3PO 4的活度a B 为 D .A .444±⎟⎠⎞⎜⎝⎛γθm m B. 44±⎟⎠⎞⎜⎝⎛γθm m C. 427±⎟⎠⎞⎜⎝⎛γθm m D. 4427±⎟⎠⎞⎜⎝⎛γθm m4. 298.15K ,在电池 Pb(s)|Pb(NO 3)2(0.01mol •kg -1)‖CuSO 4(0.01 mol •kg -1)|Cu(s) 的溶液中通入NH 3(g),电池电动势E 如何变化 B 。
A. 增大B. 减少C. 不变D. 不能确定5. λ∞m (H +)=350×10-4 S •m 2•mol -1,λ∞m (Ac -)=40×10-4 S •m 2•mol -1,某HAc 溶液的摩尔电导率Λm (HAc)=5.82×10-4 S •m 2•mol -1,则该溶液中HAc 的电离度α为 A 。
A. 0.015B. 0.150C. 0.300D. 0.4216. 两液体A 和B 表面张力γA =2γB ,密度ρA =2ρB ,一毛细管插入A 中液面上升1.5cm ,若将此毛细管插入B 中,液面上升 D 。
A. 6.0cmB. 4.0cmC. 3.0cmD. 1.5cm7. 如图所示,a 、b 、c 为内径相同的玻璃毛细管。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
05、06级材料专业《物理化学》期未试卷A(2007 ~2008 学年第二学期)一、选择题(每题1分;填上正确答案)(15分)1、已知下列两电极反应的标准电极电势为:Sn2+(aq) +2e-→Sn(s) φөSn2+/Sn= -0.14VSn4+(aq) +2e-→Sn2+(aq) φөSn4+/Sn2+= 0.15V由此计算Sn4+(aq) +4e-→Sn(s) 的φөSn4+/Sn值为:(D)(A)0.01V;(B)0.29V;(C)-0.01V;(D)0.005V2、25℃时,电池反应Ag(s)+1/2Hg2Cl2(s) = AgCl(s)+Hg(l)的电池电动势为0.0193V,反应时所对应的△r S m为32.9J·K-1·mol-1,则电池电动势的温度系数(əE /əT )p为:V·K-1(D)(A)1.70×10-4;(B)1.10×10-6;(C)1.01×10-1;(D)3.40×10-43、在等温、等压下电池以可逆方式对外作电功的热效应为Q r,则:(C)(A)Q r=0;(B)Q r=△H;(C)Q r=T△S;(D)Q r=△U4、弯曲表面上附加压力的计算公式:△p=2σ/r中,r的符号:(A)(A)液面为凸面时为正,凹面为负;(B)总为正;(C)液面为凸面时为负,凹面为正;(D)总为负5、液体在毛细管中上升的高度与下列哪一个因素无关:(D)(A)温度;(B)液体密度;(C)重力加速度;(D)大气压力6、两个活化能不同反应,如E1>E2,且都在相同的升温区间内升温,则(B)(A)dln k2/d T > dln k1/d T;(B)dln k2/d T < dln k1/d T(C)dln k2/d T = dln k1/d T;(D)d k2/d T > d k1/d T7、有关基元反应的描述在下列诸说法中哪一个是不正确的?(D)(A)元反应的级数一定是整数;(B)元反应的级数一般不大于3(C)元反应进行时无中间产物;(D)元反应不一定符合质量作用定律8、某二级反应,反应物消耗1/3需时10min,若再消耗1/3还需时为:(C)(A)10 min;(B)20 min;(C)30 min;(D)40 min9、温度与表面张力的关系是:(A)(A)温度升高表面张力降低;(B)温度升高表面张力增加;(C)温度对表面张力没有影响;(D)不能确定。
10、对于反应A Y,如果反应物A的浓度减少一半,A的半衰期也缩短一半,则该反应的级数为:(A)(A)零级;(B)一级;(C)二级;(D)三级11、在反应 A B C,A D中,活化能E1>E2>E3,C是所需要的产物,从动力学角度考虑,为了提高C的产量,温度如何选择:(A)(A)较高反应温度;(B)较低反应温度(C)适中反应温度;(D)任意反应温度12、质量摩尔浓度为b的K3PO4溶液,离子平均活度因子为γ±,则电解质的活度是a B:(D)(A)a B=3( b / bө)4γ±4;(B)a B=3( b / bө)γ±4;(C)a B=27( b / bө) γ±4;(D)a B=27( b / bө)4γ±413、低温下,反应CO(g)+NO2(g)==CO2(g)+NO(g)的速率方程是υ= k{c(NO2) }2试问下列机理中,哪个反应机理与此速率方程一致:(C)(A) CO + NO2CO2 + NO;(B) 2NO2 N2O4(快),N2O4+2CO2CO2 + 2NO (慢);(C) 2NO 2 2NO + O 2 (慢),2CO + O 22CO 2 (快) 。
14、等温等压条件下的润湿过程是: (A )(A )表面吉布斯自由能降低的过程; (B )表面吉布斯自由能增加的过程;(C )表面吉布斯自由能不变的过程; (D )表面积缩小的过程。
15、今有一球形肥皂泡,半径为r ,肥皂水溶液的表面张力为σ,则肥皂泡内附加压力是:(C )(A )r p σ2=∆; (B )r p 2σ=∆; (C )r p σ4=∆; (D )二、判断题(每题1分;对打√,错打×)(10分)1、液体的表面张力的存在力图扩大液体的表面积。
(×)2、化学吸附无选择性。
(×)3、原电池的正极即为阳极,负极即为阴极。
(×)4、光的量子效率不可能大于1。
(×)5、零级反应的半衰期为 (√) 020,2/1k A c t =6、由拉普拉斯公式可知,当p = 0 时,则σ = 0 。
(×)7、表面张力在数值上等于等温等压条件下系统增加单位表面积时环境对系统所做的可逆非体积功。
(√)8、活化能数据在判断反应机理时的作用之一是,在两状态之间若有几条能峰不同的途径,从统计意义来讲, 过程总是沿着能峰最小的途径进行。
(√)9、用Λm对c作图外推方法,可求得NaAc的无限稀释摩尔电导率。
(√)10、在临界胶束浓度(CMC)前后溶液的表面张力有显著变化。
(×)三、填空题(每题1分,在题中“____”处填上答案)(15分)1、纯水、盐水、皂液相比,其表面张力的排列顺序是σ(盐水)> σ(水)> σ(皂液)。
(选填< 或>)2、判别溶胶与溶液的最简便的方法是Tyndall效应。
3、对反应A P,实验测得反应物的半衰期与与初始浓度c A,0成反比,则该反应为二级反应。
4、Tyndall效应是因为光的散射作用而产生的。
5、溶胶粒子的半径一般在1~100nm 之间。
6、ζ电势与热力学电势φ0不同,φ0的数值主要取决于总体上溶液中与固体成平衡的离子浓度;而ζ电势则随着溶剂化层中离子的浓度而改变,少量外加电解质对ζ电势的数值会有显著影响,甚至可以改变其符号。
7、液体表面张力的方向总是沿液体表面的切线方向;液体表面分子所受合力的方向总是沿液体表面的法线方向,指向液体内部。
8、反应A + B Y的速率方程为:–dc A/dt =k A c A2c B/c Y2,则该反应的总级数是一级。
若浓度以mol·dm-3,时间以s为单位,则反应速率系(常)数k A的单位是s-1⎽。
9、由于极化,原电池的正极电势将比平衡电势低⎽,负极电势将比平衡电势高;而电解池的阳极电势将比平衡电势高,阴极电势将比平衡电势低。
(选填高或低)10、0.001 mol·kg-1的K3[Fe(CN)6]水溶液的离子强度 6.0×10-3 mol·kg-1。
11、过饱和蒸气的存在可用Kelvin 公式解释,毛细管凝结现象可用Kelvin 公式解释。
(选填Laplace、Kelvin、Langmuir)12、连串反应A Y Z,它的两个反应均为一级的,t时刻A,Y,Z三种物质的浓度分别为c A,c Y , c Z , 则ddYct= k1c A- k2c Y。
13、电池Pb(s)│PbSO4(s) │SO42- (a SO42-) ║ Cu2+(a Cu2+)│Cu(s)的:(1)阳极反应是Pb(s) + SO42- (a SO4)-2e-= PbSO4(s) ;(2)阴极反应是Cu2+(a Cu2+)+2e-= Cu(s) ;(3)电池反应是 Pb(s) + SO 42- (a SO 42-) +Cu 2+(a Cu 2+) = Cu(s) +PbSO 4(s) 。
14、对基元反应 2A Y, 则d c Y / d t = k c A ,–d c A / d t = 2k c A 。
15、某反应速率常数为0.108 min -1,则反应物浓度从1.0 mol·dm -3变到0.6 mol·dm -3与浓度从0.01 mol·dm -3变到0.006 mol·dm -3所需时间之比为 1:1 。
四、简答题(10分)1、(本题5分)用FeCl 3在热水中水解来制备Fe(OH)3溶胶,试写出Fe(OH)3溶胶的胶团结构,并标出胶核、胶粒和胶团。
解:Fe(OH)3溶胶的胶团结构表示式:2、(本题5分)简答朗格缪尔单分子层吸附理论的基本假设。
答:①、单分子层吸附;②、固体表面是均匀的;③、被吸附在固体表面上的分子相互之间无作用力;④吸附平衡是动态平衡。
五、计算题(50分)1、(本题10分)已知25℃时AgBr 的溶度积K өsp =4.88×10-13,φөBr 2/Br -=1.065V , φөAgBr/Ag =0.0711V 。
试计算 25℃时:(1)银电极的标准电极电势φөAg +/Ag =? (2)AgBr(s)的标准生成吉布斯函数。
解:(1)负极反应:Ag (s)-e -→Ag +(aq)φAg +/Ag =φөAg +/Ag +nF /RTlna Ag + (1分)正极反应:AgBr(s)+e -→Ag (s)+Br -(aq)φAgBr/Ag =φөAgBr/Ag -nF /RTlna Br - (1分)电池反应:AgBr(s)==Ag +(aq)+Br -(aq)E =φөAgBr/Ag -φөAg +/Ag -nF /RTlna Ag +a Br -=φөAgBr/Ag -φөAg +/Ag - nF /RTlnK өsp =0 (1分)φөAg +/Ag =φөAgBr/Ag -RT/nFlnK өsp =0.0711-8.314×298.15/96484.5ln 4.88×10-13 =0.0711-0.02569×(-28.348)=0.799V (2分)(2)负极反应:Ag (s)+Br --e -→AgBr(s) (1分)正极反应:1/2Br 2(l)+e -→Br -(aq) (1分)电池反应:Ag(s)+1/2Br 2(l)==AgBr(s) (1分)△r G өm =-nFE ө=-nF (φ өBr 2/Br --φөAgBr/Ag ) (1分)=-1×96484.5×(1.065-0.0711)=-95895.9J · mol -1=-95.90kJ · mol -1 (1分) 2、(本题10分)已知在273.15K时,用活性炭吸附CHCl 3,其饱和吸附量为 93.8dm 3·kg -1,若CHCl 3的分压为13.375kPa ,其平衡吸附量为82.5dm 3·kg -1。
试求:(1)朗格谬尔吸附等温式中的a 值;(2)CHCl 3的分压为6.6672kPa 时,平衡吸附量为若干?解:(1) (4分)82.5/93.8=a ×13.375/(1+a ×13.375),解得a =0.54586kPa -1 (3分) apap +=∞ΓΓ1(2) dm 3·kg -1 (3分) 3、(本题10分)气相反应 H 2+Cl 2→2HCl 的机理为:Cl 22Cl· Cl·+H 2HCl+H· H·+Cl 2HCl+Cl· 2Cl·Cl 2 试证:证明:dc Cl·/dt =k 1c Cl2- k 2c H2c Cl·+ k 3c Cl2c H·- k 4c Cl·2 =0 (2分) dc H·/dt =k 2c H2c Cl·-k 3c Cl2c H· =0 (2分)c Cl·=(k 1/k 4)1/2 c Cl21/2 (1分)c H·=(k 2/k 3) (k 1/k 4)1/2 c H2 c Cl2-1/2 (1分)dc HCl·/dt = k 2c H 2c Cl· + k 3c Cl 2c H· (2分)= k 2 (k 1/k 4)1/2 c Cl 21/2c H 2+ k 3(k 2/k 3) (k 1/k 4)1/2c H 2c Cl 21/2 (1分)= 2k 2 (k 1/k 4)1/2 c Cl21/2c H2 (1分)4、(本题10分) 在298K 恒容下一理想气体反应 A(g)→2D(g),反应开始时只有 A ,反应可以进行到底,测得不同时间容器内的压力为: t /s100 300 ∞ p /kPa15 17.5 20 求速率方程-dc A /dt =k A c A α中的k A 和α。
