第12章 二羰基化合物
二羰基化合物

2 CH3(CH2)3CO2C2H5
NaOC2H5
CH3(CH2)3COCHCO2C2H5 CH2CH2CH3 O CH3CH2CHC CH3 CH3 C CO2C2H5 CH2CH3
2 CH3CH2CHCO2C2H5 CH3
Ph3C Na
?
①亲核试剂生成 ②亲核加成
③消除
结果
复习第13章的内容——酰基上的亲核取代
苯甲酰乙酸乙酯
分子内酯缩合——Dieckmann (狄克曼)反应
二元酸酯若分子中的酯基被四个以上的碳原子隔 开时,就发生分子中的酯缩合反应,形成五员环或更 大环的酯,这种环化酯缩合反应称为狄克曼酯缩合。
CH2CH2COOC2H5 CH2CH2COOC2H5 O
(1) NaOC2H5, C6H6, 80℃ (2) H3O+, 80%
OC2H5
取代丙酮 (甲基酮)
乙酰乙酸乙酯
(1) 稀OH (2) H ,
+
CH2 R
实验条件较温 和,产率较好.
应用 1:制备取代丙酮(甲基酮)类化合物
O OC2H5 O OC2H5 R O H3C R
O H3C
R X NaOEt H3C
O
(1) 稀 OH (2) H+,
互变异构
OH H3C C CH 76%
O C CH3
O C H O C C H
O C OC2H5
C CH2 C
分子内氢键
烯醇式的特征:IR: 有OH吸收峰,1H NMR: 有OH和烯质子信号, 化学试验:与FeCl3显色
但下面的烯醇式存在
为什么乙酰乙酸乙酯是由酮式和烯醇式两种互 变异构体组成的? 因为,其烯醇式结构有一定的稳定性:
12羰基化合物

入HCl气体来催化反应。有机化学 第十章
35
反应机理:
Hδ C
Oδ + H O R
快
R
H
H
R' 慢
C O +O
R
H
H
R' H O
HC OH
R' OH
R' O R'
H C O H +H O H
R
R
R' O
H
O
R' H
HC OH
R' O
HC
H O
H
H2O
H C
O
R
R'
R
R
R'
H
OH
CO
R
R'
R' H
O HC
甲醛分子的结构
在醛(Aldehydes)和酮(Ketones)分子中,都含有一 个共同的官能团—羰基,故统称为羰基化合物。
醛分子中,羰基至少要与一个氢原子直接相连,故
醛基一定位于链端。
有机化学 第十章
3
醛分子的结构
有机化学 第十章
4
(二)命名
1. 普通命名法
CH3CH2CHO
丙醛
CH2=CHCHO
应用:提纯醛酮 鉴别醛酮
C=O + H2N-Z
重结晶 稀酸
C=N-Z
C=O
H2N-OH 羟胺
(产物:肟)
H2N-NH2 肼
H2N-NH-C6H5 苯肼
(产有物机化:学 第腙十章)
(产物:苯腙) 33
H2N-NH-C6H3(NO2)2
O H2N NHCNH2
课堂_第十二章_醛和酮 (2)

CH3CH2MgX
CH2CH3 CH3 C CH2CH3
OMgBr
CH2CH3 CH3 C OH CH 2CH 3
所有的格氏试剂均需自制。
空间位阻的影响
O (CH3)3CCC(CH3)3 =
OH (CH3)3CCC(CH3)3 80% C2H5
+ C2H5MgBr
= =
O (CH3)3CCC(CH3)3 + CH3CH2CH2MgBr O (CH3)3CCC(CH3)3 + (CH3)2CHMgBr
第十二章
醛和酮
本章提纲
一、 醛酮的定义和分类 二、 醛酮的结构 三、 醛酮的物理性质 四、 醛酮的反应 五、 醛酮的制备
第一节 醛酮的定义和分类
一、定义:羰基和烃基(或氢原子)相连的烃 的衍生物
羰基: 酮: 醛: 醛基:
O C
O R C R'
O R C H
O C H
(甲酰基)
对应的醛和酮是同分异构体
C=C C OH R
(CH3)2CHCH2MgX + CH2O 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用甲醛在分子中引入羟甲基
解二
O
(CH3)2CHMgX + 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
R C=O
+
R HC(OC2H5)3 C
OC2H5
+
R R
R
C=O
+
HC(OC2H5)3
OC2H5 R R OC2H5 + HCOOC2H5 C OC2H5 R
二羰基化合物详解演示文稿

CH3CH2 C OC2H5
草酸酯,无α-H
C H3 C H C O O C2H5 CO
- CO
C O O C2H5
CH3
(1)C2H5ONa
(2)
+
H
CH3CH
COOC2H5 COOC2H5
第22页,共53页。
④ 分子内的酯缩合反应 ——Dieckmann反应
C O O C 2H5
CH2CH2COOC2H5
烃基化反应;
(2)碳负离子与羰基化合物的反应,即羰基化合物和β-二羰 基化合物的缩合反应。当与酰卤或酸酐作用时可得酰基化产
物;
(3)碳负离子与α,β-不饱和羰基化合物的共轭加成(或
1,4-加成)。
第12页,共53页。
三、丙二酸二乙酯的合成及应用 1、丙二酸二乙酯的制法 2、丙二酸二乙酯在有机合成上的应用
四、乙酰乙酸乙酯的合成及应用
1、乙酰乙酸乙酯的合成——Claisen酯缩合反应
2、乙酰乙酸乙酯的性质
① 成酮分解 ② 成酸分解
OO CH3CCH2COC2H5
3、乙酰乙酸乙酯在合成上的应用
① 制备甲基酮
② 制备二元酮
第18页,共53页。
四、乙酰乙酸乙酯的合成及应用
1、乙酰乙酸乙酯的合成 ——Claisen酯缩合反应
O CH3C CH
O COC2H5
-
+
Na
O
O
RX CH3C CH COC2H5
一烃基乙酰乙酸乙酯
成酮
O
O
CH3C CH CO C2H5
5N % aO H
成酮分解
RO
+ + CH3C CH2 R
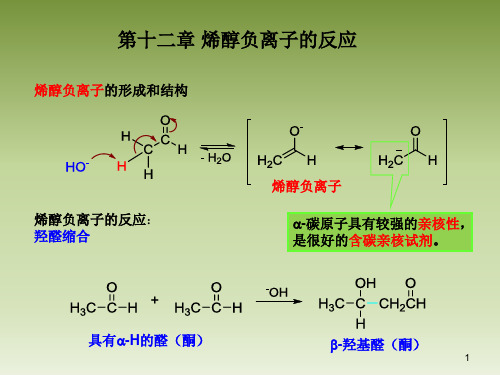
第十二章 烯醇负离子的反应(兼容)
甲基酮
1,3-二酮
22
可看作在丙酮的碳原子上连有一个 临时的吸电子酯基
1,4-二酮
23
二、丙二酸二乙酯 1. 制备
2. 丙二酸二乙酯合成法(the Malonic Ester Synthesis)及其应用
可看作在乙酸乙酯的 -碳原子上连有一个 临时的吸电子酯基
-单烷基 取代乙酸
24
-二烷基 取代乙酸 丙二酸酯法可有效合成3-6元环烷基羧酸!
亲电性 碳原子
1,2-加成
亲电性 碳原子
1,4-加成(共轭加成)
29
Michael加成:碳负离子对,-不饱和羰基化合物(或其它缺电子双键) 的共轭加成。
Michael受体(acceptor): ,-不饱和羰基化合物(亲电试剂) Michael给体(donor):碳负离子、烯醇负离子(亲核试剂)
Michael给体
Michael受体
-二酮
共轭醛
-酮酯
共轭酮
二烷基铜锂 烯胺
R2CuLi
共轭酯 共轭酰胺
-酮腈
共轭腈
-硝基酮
硝基乙烯
30
1,5-二羰基化合物 -酮酸
31
Robinson环化反应 共轭加成与分子内aldol反应的组合。
利用烯胺化学,可在酮的取代较少的-碳上发生反应。
32
The End
33
缩合反应(condensation reaction) 两个或多个有机分子在一定条件下(通常为酸或碱性条件)形成新的 较大的分子的反应。 通过缩合反应,形成了新的碳碳键。
能提供烯醇负离子的化合物包括: 醛、酮、酯、活泼亚甲基化合物等。
一、烯醇负离子与羰基的亲核加成反应
1. Knoevenagel反应
有机化学:第十二章 醛和酮分析

主要内容
1、掌握醛酮的分类和命名 2、理解醛酮的亲核加成反应机理 3、掌握醛酮的化学性质
醛、酮和醌的分子结构中都含有羰基,总称为羰基化合物。 羰基至少和一个氢原子结合的化合物叫醛 (-CHO 又叫醛 基 ,) ,羰基和两个烃基结合的化合物叫酮。醌是一类不饱 和环二酮,在分子中含有两个双键和两个羰基。
盖形成π 键。因此C=O双键是由一个σ 键和一个π 键组成的。
O
C
(a) sp2杂化的碳
(b)羰基的结构
C=O双键中氧原子的电负性比碳原子大,所以 π 电子云的分
布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳
原子上带部分正电荷。
C
O
π C O
δ C
δ O
电负性 C < O
π 电子云偏向氧原子
选含羰基的最长碳链为主链,从靠近羰基一端给主链编 号。醛基因处在链端,因此编号总为1。酮羰基的位置要标
出(个别例外)。
CH3 CHCH3
CH3 O CH3 CH C H H3C
O C CH2CH3 CH3CH2
O C
2-甲基丙醛
2—丁酮
2-甲基-3-戊酮
不饱和醛酮的命名是从靠近羰基一端给主链编号:
①电子效应
②空间效应。
醛常比酮活泼:
1 烷基有斥电子诱导效应 ,使羰基C正电性减少。
R1 R2 C O R O C H
2 烷基体积增大,空间位阻也增大。
1.与HCN的加成
C O + HCN C OH
HCN 是弱酸 不易电离, 可以提高溶 液 的 的 PH 值
CN α 羟基睛
反应范围:醛、脂肪族甲基酮、C8以下的环酮。ArCOR和ArCOAr 难反应。 芳香酮难与HCN反应的原因:
12.5β-二羰基化合物的烃化和酰化反应

12-05 β-二羰基化合物的烃化和酰化反应
2.酰基化反应
β-二羰基化合物的活性亚甲基在碱性条件下还能够发生酰基 化反应,能够用于酰基化反应的试剂是酯、酰卤、酸酐 如:
NaH CH3COCH2COOC2H5 CH3COOCOCH3 CH3COCHCOOC2H5 C CH3 O
CH3
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
在一般条件下, β-二羰基化合物的烃基化反应均发生在活性的亚甲基 上,但是在强碱条件下如有机锂、氨基钠等作用下, β-二羰基化合物 可以被转化为双负离子,在与1mol的卤代烃反应时,碱性更强的端基 碳负离子将优先发生γ-烃基化 如:
O CH3COCH2COCH3 2 NaNH2 / NH3(l) H2C C C H O C CH3 RX R O H2CC H2 C O CCH2 CH3
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
能够用于 β-二羰基化合物的烃化的烃基化试剂有磺酸酯、硫酸酯和卤
代烃,其中卤代烃最为普遍。不过,三级卤代烃由于在碱性条件下容易 发生消除反应,不宜被用于烃基化试剂 如:
CH3COCH2COOC2H5 C2H5ONa CH3I CH3COCHCOOC2H5
12-05 β-二羰基化合物的烃化和酰化反应
主讲人:王刚
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
β-二羰基化合物的烃基化反应是以醇钠为碱在醇溶液中进行
反应为SN2反应 β-二羰基化合物的烃基化反应是有机化学增长碳链的方法之一
X Y R'ONa X Y
RZ
+
H2C
R
CH
(X,Y=NLeabharlann 2, R''CO, R''OCO, CN 等)
12羰基化合物

O CH3CCH3
Ba(OH)2
OH O (CH3)2CCH2CCH3
O
-H2O
(CH3)2C=CHCCH3
(2)反应机理
酸催化下的反应机理
+
OH
O CH3CCH3
H+
+
OH
-H+
OH CH3C=CH2
CH3CCH3
CH3C-CH2-H
烯醇化
+
亲核加成
O OH
OH
OH
-H+
-H2O
CH3-C-CH2-C(CH3)2
所得加成产物在酸或碱存在下水解为原来的醛、酮,因此该 反应可用来分离提纯某些醛、酮。
这个反应也用来制备氰醇:
与氨的衍生物加成
Hydroxylamine
H2N OH
C N OH 肟
Oxime
H2N NH2
Hydrazine
C N NH2 腙 C O
Hydrazone
Phenylhydrazine
H2N NHPh O
1 + 2 = 791kJ / mol 4 + 3 = 728kJ / mol
在一般情况下,烯醇式在平衡体系中的含量是比 较少的,但随着-H活性 的增强,烯醇式也可能成为平 衡体系中的主要存在形式。
O CH3CCH3
O
O
O
C2H5OCCH 2COC 2H5
烯醇式含量 1.5 10-4
O
7.3
通过控制卤素的用量,可将卤化反应 控制在一元、二元、三元阶段。
卤化反应不能控制在一元卤化阶 段。
实例
O O
Cl
*1
+ Cl2
羰基化合物的亲核加成和亲核取代反应

Nu E
2) 羰基氧被N取代 C O
H2NY
C OE Nu
Y CN
3) 羰基氧被C取代
CO
4) 亲核取代反应
CO Y
Ph3P CR1R2
R1 CC
R2
Nu
CO + Y
Nu
一、羰基的结构及反应特性
4、亲核反应活性 烷基给电子作用和体积位阻效应
一、羰基的结构及反应特性
4、 亲核反应活性
空间位阻影响
一、羰基的结构及反应特性
MO 位阻较小
Nu
E
L
S
R
OE
M
S
+
R
Nu
L
主要产物
OE
M
S
Nu
R
L
次要产物
二、羰基的亲核加成
2. 含O, S亲核试剂
包括H2O, ROH, RSH, 和NaHSO3 (1) H2O
水合物
酸或碱催化,加快平衡的达到,但不影响平衡移动。
二、羰基的亲核加成
(1) H2O
O +
H3C CH3 99.8%
Et
CH3
1,4-加成 100%
O CH CH C
1.
MgBr
2.H3O
O CH CH2 C
1,4-加成 92%
O
1.
MgBr
CH CH C CH3
2.H3O
O CH CH2 C CH3 +
OH CH CH C H
1,4-加成 12%
1,2-加成 80%
三、羧酸及其衍生物的亲核取代反应
1.亲核取代反应的机理
4、亲核反应活性
O C RX
二羰基化合物习题答案

二羰基化合物习题答案二羰基化合物习题答案化学是一门既有理论又有实践的科学,其中有一类化合物备受关注,那就是二羰基化合物。
二羰基化合物是指分子中含有两个羰基(C=O)官能团的化合物。
这类化合物在有机合成、药物研发和材料科学等领域中具有重要的应用价值。
本文将为大家提供一些二羰基化合物的习题答案,帮助大家更好地理解和掌握这一知识点。
1. 下列化合物中,哪个是二羰基化合物?A. 乙酰丙酮B. 乙醛C. 甲酸D. 丙酮答案:A. 乙酰丙酮。
乙酰丙酮是一种二羰基化合物,其分子中含有两个羰基官能团。
2. 以下哪个反应可以制备二羰基化合物?A. 羰基化反应B. 羟醛化反应C. 羟酰化反应D. 羧酸还原反应答案:C. 羟酰化反应。
羟酰化反应是一种常见的制备二羰基化合物的方法,通过将醛或酮与羧酸反应,可以生成二羰基化合物。
3. 下列化合物中,哪个是二羰基化合物的衍生物?A. 羧酸B. 酮C. 醛D. 酯答案:A. 羧酸。
羧酸是二羰基化合物的衍生物,它是通过羰基化反应将醛或酮氧化得到的。
4. 以下哪个化合物可以发生互变异构?A. 丙酮B. 乙醛C. 甲醛D. 甲酸答案:A. 丙酮。
丙酮是一种二羰基化合物,它可以发生互变异构,即在一定条件下,两个羰基官能团可以相互交换位置。
5. 下列化合物中,哪个是二羰基化合物的还原产物?A. 醛B. 酮C. 酯D. 醇答案:D. 醇。
醇是二羰基化合物的还原产物,当二羰基化合物被还原时,羰基官能团会被还原成醇官能团。
通过以上习题的解答,我们对二羰基化合物有了更深入的了解。
二羰基化合物在有机化学中具有重要的地位,它们不仅可以作为反应物参与各种有机反应,还可以通过一系列的反应转化为其他有机化合物。
因此,掌握二羰基化合物的性质和反应机制对于有机化学的学习非常重要。
在实际应用中,二羰基化合物广泛存在于药物、染料和材料等领域。
例如,许多药物中含有二羰基结构,这种结构可以增强药物的活性和稳定性。
此外,某些二羰基化合物还可以用作染料的合成原料,赋予染料鲜艳的颜色。
12.4β-二羰基化合物酮式和烯醇式的互变异构

12-04 β-二羰基化合物酮式和烯醇式
的互变异构
产生原因:① CH2解离出H与CH3CO中的O结合,形成烯醇式 021/4/9
12-04 β-二羰基化合物酮式和烯醇式的互变异构
溶剂对异构体的影响:
在极性溶剂中,烯醇式会很少,因为自身不易形成氢键 在非极性溶剂中,烯醇式含量多,由于有利于烯醇式自身形成氢键
2021/4/9
感谢您的阅读收藏,谢谢!
12-04 β-二羰基化合物酮式和烯醇式的互变异构
β-丁酮酸乙酯可以发生一系列的化学反应:
-丁酮酸酯的化学反应: ① 与Na反应生成氢气 ② 遇溴水褪色 ③ FeCl3溶液显紫红色 ④ 遇到饱和NaHSO3得无色晶体
2021/4/9
12-04 β-二羰基化合物酮式和烯醇式的互变异构
β-丁酮酸乙酯存在互变异构:
主讲人:王刚
12-04 β-二羰基化合物酮式和烯醇式的互变异构
CH3CCH2COH OO
不稳定,易脱羧
SOCl2
CH3CCH2CCl OO
C2H5OH
CH3CCH2COC2H5 OO
稳定
虽然β-丁酮酸是一个不稳定的化合物,受热容易脱羧 但是它的酯却是非常稳定,实际发现β-丁酮酸乙酯的性质是活泼的
2021/4/9
有机化学:第十二章缩合反应(含本章总结习题课)

当α C
NaOC2H5 , NaOH
H 只有一个时, 不易反应, 须加强碱:
(C6H5)3CNa , LDA, 叔丁醇钠 等.
4.2 混合酯缩合反应
一般选用
一个酯有 α H 一个酯没有 α H
用强碱
O C
OCH3
+ CH3
O C
NaH
OCH3
H+
O
O
C CH2 C OCH3
+ CH3OH
OO
O
C2H5O C C OC2H5 + CH3CH2C OCH3
O
O
NaOC2H5
CH3 C OC2H5 + CH3 C CH3
O
O
CH3 C CH2 C CH3 + C2H5OH
O
NaNH2 CH3I
O
不对称酮的酰基化及烃基化的区域选择性:
1.热力学控制:用三甲基氯硅烷实现
O CH3 (C2H5)3N
DMF
(CH3)3SiCl
CH3Li
O-Li+ CH3
CH3I
CH3COOH + HCHO + H N
H+ CH2COOH CH2 N
( HOOCCH2CH2
N
)
OH + HCHO + H N
OH H+
CH3CN + HCHO + H N
CH2 N H+
NCCH 2CH2 N
不对称酮 曼尼希碱
得 混合物. 霍夫曼消除反应
NCCH2CH2 N 或 碱 NC-CH=CH2 + H-N
2EtOEtOH
第十二章 杂环化合物

0.1431 0.1361
0.1362 O 0.70D
0.1423 0.1370
0.1714 S 0.51D
芳香性:苯 > 噻吩 > 吡咯 > 呋喃
N H
1.58D
键长
0.1429
0.1371
0.1383 N H
1.81D
8
2、吡咯、呋喃、噻吩的化学性质 (1) 亲电取代反应(Electrophilic Substitution)
N S
浓H2SO4,SO3
N S
1,2-唑取代 在4-位
Br
N
Br2
N AcOH-H2O
H
N N H
N
O2N N
HNO3,H2SO4
N
N
H
H
O2N NH 咪唑环取代在4-位
N
N 发烟H2SO4
S
HgSO4, 250℃ HO3S
N
噻唑环取代以5-位为主
S
25
唑的烷基化或酰基化通常发生在氮原子上。
N CH3I S
碱性:
NH O pKa -2.03
H N O 1.3
H N S 2.4
NH N H 2.5
1,2-唑与1,3-唑的亲电取代反应的活性顺序有:
H N N H 7.0
1,2-唑 1,3-唑
N>
N H
N >
N H
N>
N
S
O
N
> S
N O
24
亲电取代反应
N HNO3,H2SO4 O
O2N N
O
HO3S
H2S
O
NH
3
H2O
H 2S
二羰基化合物-2

OH CH 3-C=CHCOOC 2H 5
烯醇式(7.5%)
能与钠作用放出氢气; 能与乙酰氯作用生成酯; 能使Br 2/CCl4褪色; 能与FeCl3作用呈现紫红色。
乙酰乙酸乙酯既有羰基的性质,又有羟基和双键的性质, 表明它是由酮式和烯醇式两种互变异构体组成的。
1. β-二羰基化合物的酸性及互变异构
R'
X
NaH
β -二酮类化合物
制备取代乙酸(略)
3.2 乙酰乙酸乙酯在有机合成中的应用
O
以乙酸乙酯为原料合成4-苯基-2-丁酮
CH3CCH2CH2C6H5
3.2 乙酰乙酸乙酯在有机合成中的应用
选用不超过4个碳的合适原料制备
O CCH3
3.2 乙酰乙酸乙酯在有机合成中的应用
CH 3
制备
CH 3CH 2CH 2CHCOOH
O O OEt X (CH2)n X 或 I2 NaOEt (1) OH (2) H , Δ
+
O HO (CH2)n HO O
2
EtO
丙二酸二乙酯 : 二卤代烃=2 : 1
制备非对称二元羧酸
O EtO O OEt O RX NaOEt EtO R
O OEt (1) OH R EtO O (2) H+, R HO HO O
制备取代乙酸
O EtO O OEt R X NaOEt EtO R O O OEt (1) OH (2) H+, Δ O R OH
单取代乙酸
R' X
NaOEt O (1) OH R OH R' OEt (2) H , Δ
+
O EtO R
O
R'
第12章二羰基化合物-2

H3C
O 或 H3C
N(CH3)2
NaOC2H5 Michael加成
O
EtO2C
OEt
CH3
O
NaOEt
O EtO2C
O
稀 OH
H+
O O
CH3I NaOEt
O CH3
O
(ii) 第二个环的形成——Robinson关环
O H3C
O
O H3C
KOH 或 NaOEt
O
O CH3O
KOH 或 NaOEt
CO2Et
+ CO2Et
H2O
特点:
➢类似Aldol缩合 ➢双活化基团的羰基化合物为烯醇负离子供体 ➢ 弱碱催化(一般为胺类化合物或吡啶)
➢Knoevenagel反应举例:
PhCH2NH2
O CHO + CH2(CN)2
CN
O CH C
+ H2O
CN
O + NCCH2CO2Et RNH3OACH3
H3C 1 2 3
b
C2H5O 5 O H3C 1 2 3 4
O CO2Et
23
O
O
1
CH3
+
O
4 5' 5
O O
+ CH3I
O
C2H5O
5 4
3
+
OO
H3C
1 2
OC2H5
➢ Wieland-Miesher 酮的合成路线
O
(i) 中间体 H3C
O
的合成(方法 a )
O C2H5O
O
O
+
OC2H5
H O
O O
第十二章 β-二羰基化合物

R C R'
COOEt COOEt R CH R' COOH
R C R'
COOH COOH
H+ , -CO2
eg.
CH2(COOC2H5)2
C2H5ONa
Na+
CH(COOC2H5)2
-
(CH3)2CHCH2Br
(CH3)2CHCH2CH(COOEt)2
NaOH H2O
H+ (CH3)2CHCH2CH2COOH —CO2
第十二章 β-二羰基化合物 在有机合成中的应用
β-二羰基化合物
化合物中含有两个羰基,且中间被一个碳原子隔开
O R C CH2 O C R' R O C CH2 O C O OR' RO C CH2 O C OR'
β -二酮
β -酮酸酯
丙二酸酯
O CH3 C CH2
O C OC2H5
NC
CH2
COOC2H5
1.
√
2.
3.
对于目标分子,我们计划要合成的分子结构设计主要包括 1) 碳骨架的建立; 2) 官能团的转化; 3) 立体化学选择性和控制。 1.碳骨架的建立
例如:
CH3 CH3CHCH2CH2COOH
通常尽可能选择靠近官能团的位置,形成新的碳碳链
例5:
√
2.官能团的导入和转化:
CH3
例6. CH3CH2CH2CH2CHCH2CH2CH3 合成
草酸二乙酯
(2) H - CO 1750C
C6H5CHCOOC2H5 CO COOC2H5 C6H5CHCOOC2H5 COOC2H5
α-苯基丙二酸二乙酯
(80~85%)
二羰基化合物

COOC2H5 COOC2H5
7
• 2.水解脱羧
丙二酸二乙酯及其取代衍生物水解生成丙二酸, 丙二酸不稳定,易脱羧成为羧酸。
COOC2H5 R CH
COOC2H5
COONa
NaOH
(1) H
R CH
H2O
COONa (2)
R CH2COOH CO2
R COOC2H5 C
R' COOC2H5
• 1°形成共轭体系,降低了体系的内能。
O
O
CH3-C-CH2-C-OC2H5
OH O CH3-C=CH-C-OC2H5
2°烯醇结构可形成分子内氢键(形成较稳定的六元环体系)
OH O CH3-C=CH-C-OC2H5
2021/4/15
H
O
O
CH3 C
C OC2H5
CH
24
乙酰乙酸乙酯在不同条件下进行分解和取代反应可得到酮、羧酸等不同的产物.
黄() 2,4-二硝基苯肼
FeCl3 蓝紫色(具烯醇结构)
O
O
CH3-C-CH2-C-OC2H5
酮式 (93%)
室温
OH O CH3-C=CH-C-OC2H5
烯醇式(7%)
◆三乙可与金属钠作用放出H2,形成钠盐;使溴水褪色;
与2F02e1/4C/15l3作用显色.这是烯醇式结构的典型性质.
23
生成的烯醇式稳定的原因
12
用丙二酸酯法合成1,4-环己二酸
2 2
2021酯/4/1的5 水解、酸化、脱羧
13
(3)合成环状一元羧酸
◆利用二卤化物[Br(CH2)nBr,n=3~7]与丙二酸酯的 成环反应(较稳定的五、六元环):
β二羰基化合物

β二羰基化合物一、概述β二羰基化合物是一类含有两个羰基官能团的有机化合物,其分子中两个羰基官能团的位置相对,呈现出β位取代的结构。
这种结构使得β二羰基化合物具有独特的化学性质和广泛的应用价值。
二、合成方法1. 光氧化法将α,β-不饱和酮暴露在紫外线或可见光下,可以通过光氧化反应制备出β二羰基化合物。
这种方法具有反应条件温和、高产率等优点。
2. 溴素法将α,β-不饱和酮与溴素反应,可以得到溴代产物。
再经过碱性条件下的消除反应,可以制备出β二羰基化合物。
3. 重排法在适当条件下,α,β-不饱和酮可以发生重排反应,生成β二羰基化合物。
这种方法具有操作简单、产率高等优点。
三、性质及应用1. 化学性质由于其分子中含有两个羰基官能团,因此β二羰基化合物具有较强的亲电性。
它们可以发生加成反应、环加成反应、氧化反应等多种反应,可以用于合成许多有机化合物。
2. 应用价值β二羰基化合物广泛应用于医药、农药、染料等领域。
例如,β二羰基酮类化合物是一类重要的抗癌药物;β二羰基酸类化合物是一类重要的杀虫剂;β二羰基染料则具有良好的着色性能和稳定性能。
四、典型实例1. 乙酰丙酮乙酰丙酮是一种最为常见的β二羰基化合物。
它的分子中含有两个羰基官能团和一个甲基官能团,具有较强的亲电性和较好的稳定性,可以作为配位体或还原剂使用。
2. 丁酮丁酮是另一种常见的β二羰基化合物。
它的分子中含有两个羰基官能团和一个烷基官能团,具有较强的亲电性和较好的稳定性,可以作为溶剂或中间体使用。
五、结论β二羰基化合物是一类具有独特结构和广泛应用价值的有机化合物。
它们可以通过光氧化法、溴素法、重排法等多种方法制备,具有较强的亲电性和较好的稳定性。
在医药、农药、染料等领域具有广泛应用前景。
第12章β-二羰基化合物

C2H5OH + CO2 C2H5OH + CO2
C2H5OH + CO2
b、酸式分解 、
O O 浓 NaOH CH3 C CH2 C OC2H5
2 CH3COOH + C2H5OH
O O 浓 OH CH3COOH + RCH2COOH + C2H5OH CH3 C CH C OC2H5 R O O 浓 OH CH COOH + RCOCH COOH + C H OH 2 5 2 CH3 C CH C OC2H5 3 COR
-
Na+
Br(CH2)4Br
O O CH3-C-CH-C-OC2H5
O CH2(CH2)3Br C-CH3
COCH3 COOC2H5
成酮分解
三、 丙二酸二乙酯的合成及应用
1、丙二酸二乙酯的制法
O C-OC2H5 CH2 C-OC2H5 O
丙二酸二乙酯
CH2COONa Cl
氯乙酸钠
NaCN
CH2COONa CN
CH2CH2COOEt CH2CH2COOEt
EtONa
苯,80 C
。
COOEt O-
H 、 乙酰乙酸乙酯的化学性质 (1)酮式分解和酸式分解 (1)酮式分解和酸式分解
a、酮式分解 、
O O O NaOH 稀 CH3 C CH2 C OC2H5 CH3 C CH3 O O O CH3 C CH C OC2H5 稀 OH CH3 C CH2R R O O O O OH CH3 C CH C OC2H5 稀 CH3 C CH2 C R COR
+
H-C-OEt + CH3CH2COOEt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-OC H 2 5
HCOCH2COOC2H5 + CH3COCH2COOC2H5 + C2H5OH -OC H 2 5 COOC2H5 CH3COOC2H5 COOC H
2 5
COOC2H5 CH3COCH2COOC2H5 + C2H5OH COCH2COOC2H5
COOC2H5 COOC2H5
+ CH3CH2COOC2H5
CH3COCH2COOC2H5 5%NaOH CH3COCH2COO
-
H+
CH3COCH3
CO2
H CH2
CH3
O C
H CH2
O C
O
H CH2
O
CH3
C
O C
O
CH3
O C
O C
O
CH3COCH3
化学工业出版社
(乙)酸式分解
O CH3C CH2COOC2H5
40%NaOH
Δ
O 2CH3CONa + C2H5OH
CH3
O O C CH2 COEt + OC2H5
第四步 β–酮酸酯脱质子:
O O O O CH3 C CH COEt + OC2H5 H CH3 C CH COEt + C2H5OH
第五步 碳负离子的质子化(酸化):
O CH3C H O H CH COEt + H O O CH3C H O CH COEt + H2O
O O C CH2 C OC2H5 OH
酸式分解的机理:
CH3 O O C CH2 C OC2H5 OH CH3
-OH
O O CH3C + CH2C OC2H5 OH
O O CH3C O- + CH3C OC2H5
O 2 CH3C O + C2H5OH
化学工业出版社
乙酰乙酸乙酯与伯卤代烷的亲核取代反应:
(2) 乙酰乙酸乙酯实验室制法: 利用克莱森(Claisen)酯缩合反应制备
2 CH3COOC2H5
C2H5ONa
H+
- + [CH3COCHCOOC2H5] Na
CH3COCH2COOC2H5 (75%)
化学工业出版社
Claisen 酯缩合反应机理:
第一步 碱进攻α–H,产生烯醇负离子:
O CH2 COEt H O CH2 COEt O CH2 COEt
COCH3 Br(CH2)4Br + [CH3COCHCOOC2H5] Na Br(CH2)4CH COOC2H5
①稀OH -,②H+,③Δ 酮式分解
C2H5ONa
COCH3 COOC2H5
O C CH3
化学工业出版社
制备各种二酮:
CH3COCH2COOC2H5
+
NaH
[CH3COCHCOOC2H5]- Na+ + H2
反应特点: • 底物:含有两个α–氢的酯 • β–酮酸酯的去质子与酸化 • C―C键的生成 • 生成含两个官能团的产物分子
化学工业出版社
一般只含有一个α—氢的酯因α—H的酸性更加 弱而较难进行酯缩合反应。 需要比C2H5ONa更强的碱(如氢化钠,氨基钠或 三苯甲基钠等)作用下才能进行。
O
2 (CH3)2CHCOC2H5
+ H3 O
(C6H5)3CNa
O CH3 O (CH3)2CH C C C OC2H5 CH3
化学工业出版社
交叉Claisen酯缩合:
COOCH3
NaH
+
CH3CH2COOC2H5
O C
CH3 C COOC2H5 _
+ H
O C
CH3 CH COOC2H5
化学工业出版社
HCOOC2H5
CH3COOC2H5
化学工业出版社
往亚甲基上引酰基时,得到酰基化产物。为了避免 酰卤或酸酐被醇解,这个反应一般是用非质子极性 溶剂如DMF、DMSO而不用醇,强碱用NaH而不是 用醇钠。
O O CH3CCH2COC2H5
NaH DMF
O
O
+
CH3CCHCOC2H5 Na
O
RCCl
O
O
CH3CCHCOC2H5 R C O
0.04 13.50
化学工业出版社
某些化合物中烯醇式含量
酮式 烯醇式 烯醇式含量/%
CH3COC2H5 O CH3CH O CH3CCH3 O C2H5OCCH2COC2H5 O O CH3CCH2COC2H5 O O CH3CCH2CCH3 O O C6H5CCH2CCH3 O O
CH2 COC2H5 OH CH2 CH OH CH2 CCH3 OH C2H5OCCH COC2H5 O OH CH3C CHCOC2H5 OH O CH3C CHCCH3 OH O C6H5C CHCCH3 OH O
+
Br(CH2)nCOOC2H5
- + CH3COCHCOOC2H5 ①稀OH ,②H ,③Δ CH COCH (CH ) COOH 3 2 2 n (CH2)nCOOC2H5 酮式分解
注意,在制备酮酸时不可引入卤代酸,因为卤代酸中的 羧基是酸性基团,因其会分解乙酰乙酸乙酯的钠盐,使 反应难以进行。
CH2
COOC2H5 CH2 CH C O CH2 CH2
+
C2H5OH
化学工业出版社
COOC2H5 O
H2O
COOH O
H
+
O
COOC2H5 O
+
COOC2H5 O
CO2
H2O
H
+
O
+ CO
2
狄克曼缩合反应是合成五、六元碳环 的重要方法 化学工业出版社
12.3.2 乙酰乙酸乙酯的性质 (甲)酮式分解
CH3COCH2COOC2H5
RX
C2H5ONa
[CH3COCHCOOC2H5] - Na+
[CH3COCCOOC2H5] - Na+ R
CH3COCHCOOC2H5 R
R' CH3COCCOOC2H5 R
(CH3)3COK
R'X
上述反应为SN2反应,所以用伯卤代烷、苄基卤、烯丙基卤时 产率较高,仲卤代烷产率较低,叔卤代烷主要发生消除反应得 到烯烃。乙烯型和苯基型卤代烃由于卤素不活泼,也不发生上 述反应。
CH3 C CHCOOC2H5 OH
互变异构
共振杂化体与互变异构本质区别!
化学工业出版社
12.3 乙酰乙酸乙酯
12.3.1 合成
CH2 C CH2 O C O
(1)乙酰乙酸乙酯的工业制法
H2SO4
O
+ C2H5OH
[
O
重 排
CH2 CCH2COC2H5
OH
]
CH3 CCH2COC2H5
O
]
化学工业出版社
烯醇式含量
(%) 0.40 0.83 1.52 2.18
溶剂
烯醇式含量
(%)
丙酮 三氯甲烷 硝基苯 乙酸乙酯
7.3 8.2 10.1 12.9
甲醇
乙醇 丙醇
6.87
10.52 12.45
苯
乙醚 二硫化碳
16.2
27.1 32.4
戊醇
15.33
己烷
46.4 化学工业出版社
由上表可以看出,烯醇式的含量和溶剂的 极性密切相关。 非质子溶剂对烯醇式有利,因为在非质子 溶剂中有利于形成分子内氢键。 质子溶剂对酮式有利,这可能是由于质子 溶剂能与酮式的羰基氧原子形成氢键, 分子内氢键就难于形成,因而降低了烯醇 式的含量。 如乙酰乙酸乙酯的烯醇式含量 在己烷中为46.4%,而在乙醇中只有10.52%。
化学工业出版社
12.4 丙二酸二乙酯
12.4.1丙二酸二乙酯的合成
CH2COONa Cl
NaCN
CH2COONa CN
C2H5OH H2SO4
COOC2H5 CH2 COOC H 2 5
O CH 3C CH 2 O CCH 3
2,4-戊二酮(乙酰丙酮)
2,4-戊二酮 ( 乙酰丙 酮)
化学工业出版社
O β-酮酸及其酯 如:
O
CH3CCH2COC2H5
3-丁酮酸乙酯(乙酰乙酸乙酯) β-二元酸及其酯 如:
O C2H5OC CH2
O COC2H5
化学工业出版社
丙二酸二乙酯
12.2 烯醇式和酮式的互变异构形象
[CH3COCHCOOC2H5]- Na+
+
C6H5COCl
CH3COCHCOOC2H5 COC6H5
①稀OH -,②H+,③Δ 酮式分解
CH3COCH2COC6H5
1-苯基-1, 3-丁二酮
化学工业出版社
2[CH3COCHCOOC2H5] Na+
①稀OH -,②H+,③Δ 酮式分解
CH3COCHCOOC2H5 CH2Cl2 CH2 CH3COCHCOOC2H5
烯醇式
酮式
沸点:41℃(267Pa)
CH CH3 C O H C OC2H5 O
33℃(267Pa)
CH3 C CH COC2H5 OH O
分子内氢键
p-π共轭 使烯醇式稳定
化学工业出版社
乙酰乙酸乙酯烯醇式含量随溶剂、浓度、温度的不同而不同。
表12 1 乙酰乙酸乙酯烯醇式在各种溶剂中的含量
溶剂
水 25%乙醇 50%甲醇 50%乙醇
CH3 C CH2COOC2H5 O
