第13章 β-二羰基化合物
第14章β-二羰基化合物

的酯在强碱 有α-H的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 发生缩合反应,失去一分子醇 生成β-羰基酯 一分子醇, 羰基酯的反应叫做酯 发生缩合反应,失去一分子醇,生成 羰基酯的反应叫做酯 缩合反应,又称为克莱森( 缩合反应,又称为克莱森(Claisen)缩合。 )缩合。
有机化学
上页 下页
重要β 二羰基化合物 重要 –二羰基化合物
O O C 2 H 5 O-C-CH 2 -C-OC 2 H 5
丙二酸二乙酯
O O CH3-C CH2-C-OC2H5
乙酰乙酸乙酯
有机化学
上页
下页
三、 丙二酸酯在有机合成上的应用
一.丙二酸二乙酯的制备 丙二酸二乙酯的制备
O O O O NaCN C H OH CH2-C-OH CH2-C-ONa 2 5 C2H5O-C-CH2-C-OC2H5 OH H2SO4 Cl CN
OH O CH3-C=CH-C-OC H5 2 烯醇式 (7%)
有机化学
上页
下页
二、 β –二羰基化合物碳负离子的反应 二羰基化合物碳负离子的反应
碳负离子是带部分负电荷的碳原子或氧原子, 碳负离子是带部分负电荷的碳原子或氧原子,都具 是带部分负电荷的碳原子或氧原子 亲核性, 有亲核性,在碳原子和氧原子上都有可能发生亲核 反应,主要发生在碳原子上 常见的反应有下列几种: 在碳原子上。 反应,主要发生在碳原子上。常见的反应有下列几种: (1)碳负离子与卤代烷的反应 卤代烷的反应 )碳负离子与卤代烷 羰基化合物的缩合反应 (2)碳负离子和羰基化合物的缩合反应 )碳负离子和羰基化合物 不饱和羰基化合物的共轭加成 (3)碳负离子和 ,β-不饱和羰基化合物的共轭加成 )碳负离子和α, 不饱和 反应
β-二羰基化合物

+
CH2(COOH)2
CH3COOH
②α -H的取代反应
CH2(COOC2H5)2 C2H5ONa CH COOC2H5 CH3Br COOC2H5 CH3 CH COOC2H5 COOC2H5
3.合成应用 ●合成一元酸
例如:以C≤2的醇为原料经丙二酸二乙酯合成2-丁酸
CH3 C COOH COOH
① NaOH,H2O ② H
+
CH3CH2
- CO2
CH3 CH3CH2 CH COOH
③ 合成环状羧酸
例:以丙二酸二乙酯、不超过2个碳的醇及其它无机试剂为原料, 合成
CH3CH2OH CH3CH2OH Na
COOH
C2 H5ONa H2C CH2 Br2 BrCH2CH2Br
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。
(2) 将TM的结构与丙酮进行比较,确定引入基团 (3) 最后确定合成路线。
注意:当引入基团不同时,通常是先引入活性较高和体积较大
的基团
▲合成一元羧酸
如上述合成的α-丙基乙酰乙酸乙酯中间体进行酸式分解:
O O ① C2H5ONa O O CH3 C CH2 C OC2H5 CH3 C CH C OC2H5 ② CH3CH2CH2Br CH2CH2CH3
O O C2H5 O CH3 C CH2 C OC2H5 O O
O O [ CH C CH C OC H 3 2 5 C2H5OH
CH3 C CH C OC2H5
]
+
再如:
O 2 CH3 CH2 CH2 C OC2H5 ① ② O C2H5ONa H
+
第十四章_β-二羰基化合物
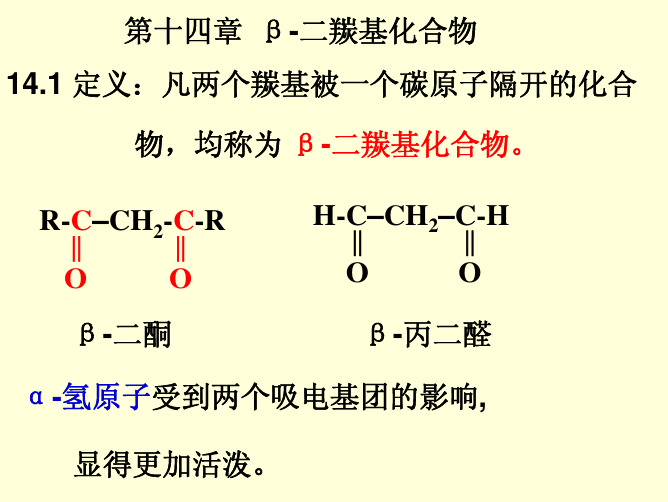
物,均称为 β-二羰基化合物。
R-‖C–CH2-‖C-R
O
O
β-二酮
H-‖C–CH2–C‖-H
O
O
β-丙二醛
α-氢原子受到两个吸电基团的影响,
显得更加活泼。
14.2 命名
HO-‖C–CH2-‖C-OH
O
O
β- 丙二酸
R-‖C–CH2–C‖-OR’
CH3︱CH=CH‖COC2H5 OH O
NaOC2H5 H+
CH3‖C CH-‖COC2H5 OO
Na
+
CH3‖CCH2C‖OC2H5 OO
①5%NaOH CH3COCH2COOH
②H+
CH3COCH3
△,-CO2
?
CH3‖CCH2C‖OC2H540%△NaOH OO
CH3‖COON+a
C2H5OH
CH3‖CO︱CCHH‖O2CCOHC2C2HO①5O5C%2H︱CNHaO2CHH2CCHO3‖OCO︱CCHHH2‖OCCOHN2CaOONa ②H+ , ③△ CH3‖CCH2
O
CH3‖C︱CCHH‖2CCOHC2C2HO5OC酮2式H 分解 OO
C︱H2CH2COOH CH3‖CCH2
O
︱CH2CH2COO酸C2式H分5 解
CH3‖CCH2C‖OC2H5 OO
H2N-OH H+
CH3‖CCH2COOC2H5 N-OH
Na CH3︱C= CH ‖COC2H5 ONa O
CH3︱C = CHC‖OC2H5 OH O
+ H2
CH3‖C-CH-‖COC2H5Na +
课件有机化学第13章 取代酸和二羰基化合物

第十三章 取代酸 和β-二羰基化合物Substituted Carboxylic Acids and β-Dicarbonyl Compounds1CONTENT1 2 3 4 5取代酸的酸性(自学) 羟基酸 羰基酸(氧代酸) β-酮酸酯 β-二羰基化合物的反应213.1 取代酸的酸性(自学)• 有利离解出质子的因素使酸性增强 • 不利离解出质子的因素使酸性减弱O吸电子基O给电子基C OC O提高羧酸根阴离子 稳定性的因素降低羧酸根阴离子 稳定性的因素313.2 羟基酸1. 羟基酸的命名和物理性质(自学)许多羟基酸来自于动植物,常用俗名来表示2-羟基丙酸(乳酸)2-羟基丁二酸(苹果酸)413.2 羟基酸2. 羟基酸的制备• 卤代酸水解CH3CH2CHCOOH Br NaOH/H2O H+ CH3CH2CHCOOH OHCH3 CH3C OH CN CH3 CH3C OH COOH• 羟基腈水解CH3COCH3 HCN H• Reformatsky反应O + BrCH2CO2Et Zn Benzene H2O H+ OH CH2CO2H513.2 羟基酸3. 羟基酸的反应• 氧化反应OHCH3CH2COOHTollens 试剂CH3COCOOHCH3COOH• 脱水反应(1) α-羟基酸OH RCHCOOHOO C R CH O CH R O C OC R CH OH O H H O HO CH R C O6(2) β-羟基酸OH RCHCH2CO2H H+ RCH CHCO2H(3) γ-羟基酸OH RCHCH 2CH2CO2H R O O713.3 羰基酸(氧代酸)CH3COCH2COOH 3-氧代丁酸• 酸性大于羧酸 • α或β-酮酸受热易脱羧RCOCH2COOHNa2Cr2O7/H2SO4RCOCH3RCHCH2COOH OH813.4 β -酮酸酯1. β -酮酸酯的形成Claisen 酯缩合:含α−氢的酯在碱(醇钠)的作 用下,两分子酯发生缩合反应,生成 β −羰基酸 酯同时消去一分子醇O 2 CH3COEt 乙酸乙酯 Ethyl acetate EtONa EtOH H2 O H+OOCH3C CHCOEt + EtOH 乙酰乙酸乙酯 Ethyl acetoacetate9反应机理pKa 24.5CH3CO2Et + EtO CH2CO2Et O − CH3 C OEt + CH2CO2Et CH O−−−+ EtOH O C−3OEtCH3 C CH2CO2Et + EtO O O + − Na EtO − CH C CH3 C CH2CO2Et CHCO2Et + EtOH 3pKa ~11CH2CO2EtOH+CH3 C CH2CO2Et10作业•P283: 13.1(1);•P285: 13.2;•P293: 13.5,13.6;•P297: 13.10,13.11;习题•P306: 3,5(1),(2),6。
第14章_β-二羰基化合物和有机_[1]...
![第14章_β-二羰基化合物和有机_[1]...](https://img.taocdn.com/s3/m/489a41b68762caaedd33d446.png)
不含α-H的酯如草酸二乙酯、甲酸酯、碳酸二乙酯 苯甲酸酯等在酰化反应中可分别引入-COCO2C2H5, -CHO, -COOC2H5, -COPh基团。
2. 酰基化反应
使用草酸酯得到的产物既是β-酮酯,又是α-酮 酯。由于α-酮酯在加热时可脱去羰基,为合成取 代丙二酸酯及相关化合物提供一条方便的途径。
3. 迈克尔加成反应
活泼氢化合物在催化量碱(常用醇钠,季铵碱及 苛性碱等)作用下与α, β-不饱和化合物发生1, 4-加成的反应称为Michael加成反应。
催化量 C2H5ONa + CH2=CHCCH3 C2H5OH O O (H5C2O2C) 2CH CH2CH2CCH3
CH2(CO2C2H5)2
COOC2H5 C2H5ONa PhCH2CO2C2H5 + COOC2H5 COOC2H5 C CO2C2H5 O 178° C
Ph HC
PhCH(COOC2H5)2
Ph HC
COOC2H 5 C CO 2C 2H 5 O
H 3O+
COOH Ph CH C COOH - CO2 O
PhCH2COCOOH
CH 3 O O
2-甲基-1,3-环戊二酮
练习14.2
14.1.2 β-二羰基化合物活泼氢的酸性
• β-二羰基化合物的两个羰基之间的α-氢原子的 酸性,由于其相应阴离子的共振稳定化而大大增 强。 pKa在9~13之间。 在碱的作用下,活性亚甲基上的质子具有酸性,易 脱去形成二羰基碳负离子或烯醇负离子,存在着酮 式和烯醇式的互变异构。
+ NaX
C
OC2H5 + C2H5OH
二烃基乙酰乙酸酯
α-烃基乙酰乙酸乙酯的应用
有机化学二羰基化合物
碳氧双键处于共轭体系,发生了电子的离域,使体
系能量降低而趋于稳定。
:OH
H3C C CH
O C OC2H5
2024/7/26
4
第5页/共53页
影响烯醇式含量的其它因素:
① 活泼亚甲基上连有吸电子基团,烯醇式含 量↑,连有供电子基团,烯醇式含量↓。
O
O
O
O
H3C
C
CH
C OC2H5 > H3C
C
CH2
2+
Hg
+
H
OH CH CH2
O CH3C H
β-二羰基化合物的烯醇式结构稳定性:乙酰乙酸乙酯
实验事实:
① 能与NaHSO3、HCN等发生加成反应; ② 能与羟胺、苯肼反应,生成肟、苯腙等; ③ 能被还原成β-羟基酸酯; ④ 经水解、酸化后,可以脱羧生成丙酮。
O
O
H3C C CH2 C OC2H5
有羰基
O CH3C CH
O COC2H5
Na+
Br(CH2)4Br
O CH3C
C2H5ONa
COCH3
成酮分解
COOC2H5
O CH COC2H5 CH2(CH2)3Br
O
CCH3
2024/7/26
28
第29页/共53页
② 制二酮
2024/7/26
制β-二酮(1,3-二酮)
O CH3C CH
O COC2H5
第11页/共53页
三、丙二酸二乙酯的合成及应用
1、丙二酸二乙酯的制法 2、丙二酸二乙酯在有机合成上的应用
① 制备烃基取代乙酸 ② 制备二元羧酸
2024/7/26
β-二羰基化合物酮式和烯醇式的互变异构
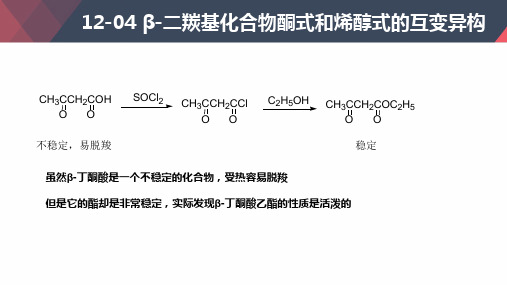
CH3CCH2COH O O 不稳定,易脱羧
SOCl2
CH3CCH2CCl O O
C2 H5OH
CH3CCH2COC2H5 O O 稳定
虽然β-丁酮酸是一个不稳定的化合物,受热容易脱羧 但是它的酯却是非常稳定,实际发现β-丁酮酸乙酯的性质是活泼的
12-04 β -二羰基化合物酮式和烯醇式的互变异构
β-丁酮酸乙酯可以发生一系列的化学反应:
-丁酮酸酯的化学反应: ① 与Na反应生成氢气
② 遇溴水褪色
③ FeCl3溶液显紫红色 ④ 遇到饱和NaHSO3得无色晶体
Байду номын сангаас
12-04 β -二羰基化合物酮式和烯醇式的互变异构
β-丁酮酸乙酯存在互变异构:
产生原因:① CH2解离出H与CH3CO中的O结合,形成烯醇式 ② 烯醇式中由于分子中形成共轭体系,且通过氢键形成六元环
12-04 β -二羰基化合物酮式和烯醇式的互变异构
溶剂对异构体的影响:
在极性溶剂中,烯醇式会很少,因为自身不易形成氢键
在非极性溶剂中,烯醇式含量多,由于有利于烯醇式自身形成氢键
12.5β-二羰基化合物的烃化和酰化反应

12-05 β-二羰基化合物的烃化和酰化反应
2.酰基化反应
β-二羰基化合物的活性亚甲基在碱性条件下还能够发生酰基 化反应,能够用于酰基化反应的试剂是酯、酰卤、酸酐 如:
NaH CH3COCH2COOC2H5 CH3COOCOCH3 CH3COCHCOOC2H5 C CH3 O
CH3
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
在一般条件下, β-二羰基化合物的烃基化反应均发生在活性的亚甲基 上,但是在强碱条件下如有机锂、氨基钠等作用下, β-二羰基化合物 可以被转化为双负离子,在与1mol的卤代烃反应时,碱性更强的端基 碳负离子将优先发生γ-烃基化 如:
O CH3COCH2COCH3 2 NaNH2 / NH3(l) H2C C C H O C CH3 RX R O H2CC H2 C O CCH2 CH3
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
能够用于 β-二羰基化合物的烃化的烃基化试剂有磺酸酯、硫酸酯和卤
代烃,其中卤代烃最为普遍。不过,三级卤代烃由于在碱性条件下容易 发生消除反应,不宜被用于烃基化试剂 如:
CH3COCH2COOC2H5 C2H5ONa CH3I CH3COCHCOOC2H5
12-05 β-二羰基化合物的烃化和酰化反应
主讲人:王刚
12-05 β-二羰基化合物的烃化和酰化反应
1.烃基化反应
β-二羰基化合物的烃基化反应是以醇钠为碱在醇溶液中进行
反应为SN2反应 β-二羰基化合物的烃基化反应是有机化学增长碳链的方法之一
X Y R'ONa X Y
RZ
+
H2C
R
CH
(X,Y=NLeabharlann 2, R''CO, R''OCO, CN 等)
第14章 β-二羰基化合物(2012)

CO2H
Michael加成 加成
亲核取代 -CH(COOC H ) 2 5 2 亲 核加 成 (α,β-不饱和醛酮的亲核加成----Michael加成) 不 加
Michael加成是非常有用的合成 5—二羰基化合物的反应 加成是非常有用的合成1, 加成是非常有用的合成 二羰基化合物的反应
O CH2(COOC2H5)2 + NaOC2H5 HOC2H5 CH(COOC2H5)2 O - CO2 CH2COOH 90% 酸化 水解 CH(COOC2H5)2 OH
14.3 乙酰乙酸乙酯的反应及其在有机合成中的应用 乙酰乙酸乙酯的反应及其在有机合成中的应用
1. 乙酰乙酸乙酯的酯缩合逆反应 乙酰乙酸乙酯的酯缩合逆反应
O O
O-
O
CH3C-CH2-COC2H5
C2H5O-
CH3C-CH2-COC2H5 OC2H5
O CH3-COC2H5
O
+
-
CH2-COC2H5 O CH3-COC2H5
3. 乙酰乙酸乙酯的酸式分解 乙酰乙酸乙酯的酸式分解
OO-
O
O
CH3C-CH2-COC2H5
-OH(浓) (
CH3C-CH2-C-OC2H5 OH OH
O
O CH3-COH
+ -CH2-COH + C2H5OH2O H2用下, 在浓碱作用下,α−与β−位碳原子间断裂生成二分子羧酸。 位碳原子间断裂生成二分子羧酸。
生成的烯醇式稳定的原因 (1)形成共轭体系,降低了体系的内能 )形成共轭体系,
(2)烯醇结构可形成分子内氢键(形成较稳定的六元环体系) )烯醇结构可形成分子内氢键(形成较稳定的六元环体系)
苯酚的烯醇与酮式互换
有机化学第十三章 取代羧酸
C HO 浓NaOH CH2OH COOH ’ COOH C anniz z aro 反 应 COOH + COOH
三
丙酮酸: 最简单的α -酮酸
CH3
O C COOH
CH3 CH3
O 浓 H2SO4 CO + CH3 COOH(脱羰) C COOH O 稀 H2SO4 CO + CH CHO (脱羧) 2 3 C COOH
OH O C6H5C=CHCCH 3 90.0%
2 乙酰乙酸乙酯的分解反应 稀OH-
O O CH3C-CH 2-COC 2H5
浓OH-
O CH3CCH3
酮式分解
O CH3C-OH + 其余 酸式分解
3 α-H的活性:被取代
O O CH3C-CH2-COC 2H5
RONa
O Na+ O CH3C-CH--COC 2H5
稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( “醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
有机化学II14二羰基化合物

OO CH3C C- H C OC2H5
电子的分布不同
CH3 C CH2COOC2H5 O 互变异构
CH3 C CHCOOC2H5 OH
质子的转移
共振杂化体与互变异构本质区别!
酯缩合反应 Claisen 酯缩合
-酮酸酯
2 CH3COOCH2CH3
NaOC2H5
CH3COCH2COOC2H5 + C2H5OH
C CH2
C
O
O CH3 C
H O
C CH2 O
H O
O
CH3 C CH2 C O
CH3COCH3
(乙)酸式分解
O
O
CH3C CH2COOC2H5
40%NaOH
Δ
2CH3CONa + C2H5OH
酸式分解的机理:
O
O
CH3 C CH2 C OC2H5
OH
O-
O
CH3 C CH2 C OC2H5
OH
CO2C2H5
CO2C2H5
+
CO2C2H5 +
O NaOC2H5
OO C CO2C2H5
O C CH3
NaOC2H5
O
O
C CH2 C
O CH3CH2CO2C2H5 + H3C C CH3
NaOC2H5
O
O
H3C C CH2 C CH2CH3
β-二羰基化合物碳负离子的反应
1、与卤烷反应
OO CH3CCH2COC2H5
CH3COCHCOOC2H5 (CH2)nCOOC2H5
1)稀OH -,2)H+,3)Δ
酮 式 ·分 解
β二羰基化合物
第十三章β-二羰基化合物
一、命名下列化合物:
1. CH3COCH2CHO
2.
3. 4.
二、写出下列化合物的结构式:
1.α-丁内酯
2.苯甲酰乙酸乙酯
3.甲基乙基乙烯酮
4.氰乙酸乙酯
三、完成下列反应:
1.
2.
3.
4.
O
COOCH2CH3
6. 四、 写出下列反应的历程:
1.
2.
五 、
比较下列化合物的酸性。
1.
2.
3.
4.
5.
六、鉴别下列化合物。
1. 乙酰乙酸乙酯、丙二酸二乙酯、丙酮、3-戍酮
2. 乳酸、3-羟基丙酸、异丙醇
C 6H 5CH CN COOEt
+H 2C C CCH 3O RONa
b CH 3COCH 2COOC 2H 5CH 3COCHCOOC 2H 5CH 2CH 3a
3.
七 、 完成下列转变:
1. 2.
3.
4.
5.
6.
7.
8.
9.
CH 3COCH 2COOC 2H 5
CH 3COONH 4CH 3COOCH 2CH 3CH 2=CHCOOCH 3O O
H 2C COOEt
COOEt
10.
1 应用丙二酸二乙酯选用适当有机化合物及无机物合成2-甲基丁酸
2 应用乙酰乙酸乙酯选用适当有机化合物及无机物合成环丁基乙酮 COOH
CH 3COCH 2COCH 3。
第13章 不饱和醛酮和取代醛酮

3-丁烯醛
OH
:
:
:
H2O +
:
CH2 CH CH CH O :
:
:
CH2 CH CH CH O :
在酸性溶液中3-丁烯醛通过烯醇转化为2-丁烯醛:
CH2 CH CH2 CH O : H+ H+
: : :
CH2 CH CH CH OH CH3 CH CH CH OH
+
: :
CH2 CH CH CH O:
CH3CH CHCH O:
2-丁烯醛
CH2 CH CH2 CH OH
+
CH2 CH CH2 CH OH
+
H+ H+
: :
: :
: :
CH3 CH CH CH OH
+
CH3 CH CH CH OH
+
:
:
CH3CH CHCH O:
13.1.1 α,β-不饱和醛酮的反应
H+
简单的烯烃与氢氰酸不起加成反应,因为生成的活性中间体——碳负离 子,非常不稳定。
R CH CH R' + CN R CH CH R' CN
:
α, β-不饱和醛酮与其他弱碱性的亲核试剂也容易起1, 4-加成反应:
O CH3 C CH CH C6H5 + HN
4-苯基-3-丁烯-2-酮 六氢吡啶
13.1.1.5 还原 α, β-不饱和醛酮用氢化铝锂还原生成α, β-不饱和醇:
CH3 CH CHCHO
2-丁烯醛
+
第十三章 β-二羰基化合物

ClCH2COONa NaCN CNCH2COONa C2H5OH H2SO4 COOC2H5 CH2 COOC2H5
应用:合成取代乙酸
COOC2H5 CH2 COOC2H5
COOC2H5 H3CH2C CH COOC2H5
OH , H2O H
+ -
C2H5ONa
COOC2H5 CH COOC2H5
H2SO4 CH3COCH2COOC2H5
2 CH3CH2CHCOOC2H5 CH3
1) (C6H5)3CNa 2) H
+
O CH3 CH3CH2CH C C COOC2H5 CH3 CH2CH3
b)交叉酯缩合:两种不同的酯,其中一个不 含-H。
COOCH2CH3 COOCH2CH3 + C6H5CH2COOC2H5
O CH3 C CH C=O CH3 O C OH CH3 CH3 C C CH3 O C CH3
C=O
酮式(不稳定)
烯醇式(稳定)
O H O 2 C C C CH3 酮式 ~ 10%
OH O C C C CH3 H 烯醇式 90%
乙酰乙酸乙酯的性质: 能与羟氨,苯肼反应、能与亚硫酸氢钠,氢氰 酸反应、能被还原成β-羟基酸酯、与稀碱作
CH3CH2ONa O
CH3ONa
2)乙酰乙酸乙酯的性质
酮式分解(稀碱)
5%NaOH
CH3COCH2COOC2H5
H+
CH3COCH2COONa CH3COCH3 + CO2
CH3COCH2COOH
酸式分解(浓碱)
40%NaOH
CH3COCH2COOC2H5
2CH3COONa + C2H5OH
第十四章 β-二羰基化合物

二取代乙酸 试剂:CH3 X
CH3CH2CH2 X
CH2(COOC2H5)2
CH3CH2
CHCOOH CH3
2-甲基丁酸
CH2(COOC2H5)2
① C2H5ONa ② CH3I ① C2H5ONa ② CH3CH2Br
CH3CH2CH(COOC2H5)2
NaOH H2O H+
CH3CH2C(COOC2H5)2 CH3
OH H2C
O C O CH2 C OC2H5
O CH3 CH
OH O CH C OC2H5
CH
CH3
×
CH3 C
2. 乙酰乙酸乙酯在合成上的应用
(1)乙酰乙酸乙酯的合成 乙酰乙酸乙酯可用Claisen酯缩合反应合成。
O CH3 C OC2H5
+
O ① C2H5ONa CH3 C OC2H5
=
O O CH3 C CH2 C OC2H5
R X
O O CH3 C CH C OC2H5 Na+
RCOX
O O CH3 C CH C OC2H5 R O O CH3 C CH C OC2H5 R C =O
这是一个亲核取代反应,主要生成烃基化和酰基化产物。 这里卤代烷常用伯卤代烷或仲卤代烷,叔卤代烷容易消除而 不能用;乙烯型和芳基型卤代烃也不能用。
α-碳原子上的两个氢原子均可被烃基取代。
O O O R’ O ① C2H5ONa CH3 C C C OC2H5 CH3 C CH C OC2H5 X
② R’
R
R
(5)乙酰乙酸乙酯在合成上的应用
① dil. OH
O O CH3 C CH C OC2H5 R ( 酸式分解 ) ( 酮式分解 )
二羰基化合物-2

OH CH 3-C=CHCOOC 2H 5
烯醇式(7.5%)
能与钠作用放出氢气; 能与乙酰氯作用生成酯; 能使Br 2/CCl4褪色; 能与FeCl3作用呈现紫红色。
乙酰乙酸乙酯既有羰基的性质,又有羟基和双键的性质, 表明它是由酮式和烯醇式两种互变异构体组成的。
1. β-二羰基化合物的酸性及互变异构
R'
X
NaH
β -二酮类化合物
制备取代乙酸(略)
3.2 乙酰乙酸乙酯在有机合成中的应用
O
以乙酸乙酯为原料合成4-苯基-2-丁酮
CH3CCH2CH2C6H5
3.2 乙酰乙酸乙酯在有机合成中的应用
选用不超过4个碳的合适原料制备
O CCH3
3.2 乙酰乙酸乙酯在有机合成中的应用
CH 3
制备
CH 3CH 2CH 2CHCOOH
O O OEt X (CH2)n X 或 I2 NaOEt (1) OH (2) H , Δ
+
O HO (CH2)n HO O
2
EtO
丙二酸二乙酯 : 二卤代烃=2 : 1
制备非对称二元羧酸
O EtO O OEt O RX NaOEt EtO R
O OEt (1) OH R EtO O (2) H+, R HO HO O
制备取代乙酸
O EtO O OEt R X NaOEt EtO R O O OEt (1) OH (2) H+, Δ O R OH
单取代乙酸
R' X
NaOEt O (1) OH R OH R' OEt (2) H , Δ
+
O EtO R
O
R'
香料基础化学第13章缩合

第二节 醛酮缩合
Mannich碱或其盐酸盐在活泼镍催化下可以发生氢解 反应,从而制得比原反应物多一个碳原子的同系物。如 维生素K的中间体2-甲基萘醌的制备。
Mannich碱可被强的亲核试剂置换而发生置换反应。 如植物生长素β-吲哚乙酸的制备。
第三节 醛酮与羟酸及其衍生物的缩合
一、珀金反应 1.珀金反应及反应历程 芳香醛与脂肪酸酐在碱性催化剂作用下缩合,生成β-芳 丙烯酸类化合物的反应称为珀金(Perkin)反应。反应 如下:
后可以发生自身缩合,生成α-羟基酮。该反应称为安息
香缩合。反应如下:
第二节 醛酮缩合
其反应历程为:氰负离子对羰基进行亲核加成,形 成氰醇负离子,然后酸性氢转移得氰醇负离子。其向另 一分子芳醛的羰基进行亲核加成,得到的加成产物经质 子转移后脱去氰基。生成α-羟基酮。
第二节 醛酮缩合
3.异分子醛、酮交叉缩合
(1)芳醛与含活泼α-H的醛、酮的缩合 芳醛与含 活泼α-H的醛、酮在碱催化下缩合生成β-不饱和醛、酮。
该反应称为克莱森-斯密特(Claisen-Schmidt)反应。 通式如下:
反应先生成中间产物β-羟基芳丙醛(酮),但其极
不稳定,在强碱或强酸催化下立即脱水生成稳定的芳丙 烯醛(酮)。例如:
第二节 醛酮缩合
数情况下加成和脱水反应同时进行,由于加成产物不稳
定而难以分离,最终得到的是其脱水产物α、β-不饱和
醛。如:
第二节 醛酮缩合
对具有活泼α-H的酮分子间的自身缩合,因其反应
活性较醛低,自身缩合的速度较慢,其加成产物结构更 加拥挤,稳定性差,反应的平衡偏向左边。要设法打破 平衡或用碱性较强的催化剂(如醇钠),才可以提高β羟基或其脱水产物的收率。例如,当丙酮的自身缩合反 应达到平衡时,加成缩合物(1)的浓度仅为丙酮的 0.01%,为打破这种平衡,可利用索氏(Soxhlet)抽提器, 将氢氧化钡放在上面抽提器内,丙酮反复回流并与催化 剂接触发生自身缩合。而脱水产物(2)留在下面烧瓶中, 避免了可逆反应,从而提高了收率。
有机化学:β-二羰基化合物(2H含合成)

1.2 碳链的减短
烯烃、炔烃被KMnO4/H+氧化:羧酸 芳环侧链被KMnO4/H+氧化:羧酸 烯烃、炔烃被O3氧化:醛或羧酸 甲基酮的卤仿反应:羧酸 二元羧酸、酮酸的脱羧反应:一元羧酸、酮 酰胺的霍夫曼降级反应:伯胺
1.3 利用重排反应改变碳胳
如何由环戊酮合成螺[4.5]癸烷 ?
Mg-Hg OH HO Zn-Hg HCl H+ O
氯乙酸
丙二酸二乙酯
二、性质 丙二酸二乙酯分子中亚甲基上的氢原子比较活泼, 具有弱酸性,在性质上与乙酰乙酸乙酯相似。
CO2C2H5 CH2 CO2C2H5
C2H5ONa
CO2C2H5 CH CO2C2H5
-
Na
三、在有机合成上的应用
1、合成增长碳链及支链的一元羧酸
CO2C2H5 CH2 CO2C2H5 1)NaOEt 2)RX CO2C2H5 R CH CO2C2H5 1)OH-,H2O 2)H+;3)
CHO CH=CHCOC(CH3)3
CH3COC(CH3)3 OH-,
α,β-不饱和酮
格氏试剂与羰基化合物的反应
O R'C H(R'') 1)RMgX 2)H2O,H
+
R R' C-OH H(R'')
仲醇或叔醇
O R'C Cl
1)RMgX 2)H2O,H
+
1)RMgX R'COR 2)H2O,H
+
1,4-环己烷二甲酸
2.3 合成脂环羧酸
O 四元脂环
4、迈克尔(Michael )加成反应
O C2H5ONa C2H5OH CH(CO2C2H5)2
第14章-β-二羰基化合物

与酰卤作用,引入酰基 酮式分解得-二酮
14.6 * 碳负离子和,-不饱和羰基化合物的共轭加成 ——麦克尔(Michael)反应
◆-二羰基化合物和碱作用生成稳定的碳负离子,可和
,-不饱和羰基化合物发生共轭(1,4)加成反应, 结果碳负离子加到碳原子上,碳原子上加H: 例如:
* *
• 水解、加热脱羧——1,5-二羰基化合物
第十四章 -二羰基化合物
本章主要内容: 1. -二羰基化合物的概念与典型化合物 2. -二羰基化合物的结构及反应特征 3.丙二酸二乙酯的制备与应用 4.乙酰乙酸乙酯的制备(Claisen酯缩合)与应用 5.碳负离子和,-不饱和羰基化合物的共轭
加成(Michael加成反应)
14.1 -二羰基化合物的概念与典型化合物
◆分子中含有两个羰基官能团的化合物叫二羰基化合物; 其中两个羰基为一个亚甲基相间隔的化合物叫-二羰 基化合物。
◆-二羰基化合物的亚甲基对两个羰基来说都是位置, 所以-H特别活泼。 也叫含有活泼亚甲基的化合物。
14.2 -二羰基化合物的结构及反应特征
① 酸性:亚甲基同时受到两个羰基的影响,使-H 有较强的酸性(比醇和水强)。
室温
FeCl3 蓝紫色(具烯醇结构)
OH O CH3-C=CH-C-OC2H5
烯醇式(7%)
◆三乙可与金属钠作用放出H2,形成钠盐;使溴水褪色; 与FeCl3作用显色.这是烯醇式结构的典型性质.
◆ 烯醇式结构稳定的原因:
(a).形成共轭体系,降低了体系的内能:
OO
O H O
C H 3-C -C H 2-C -O C 2H 5
凡有-H原子的酯,在乙醇钠或其他碱性催化剂 (如氨基钠)存在下,都能进行克莱森酯缩合反应。 克莱森(酯)缩合反应是合成-二羰基化合物的方法。
Beta二羰基化合物
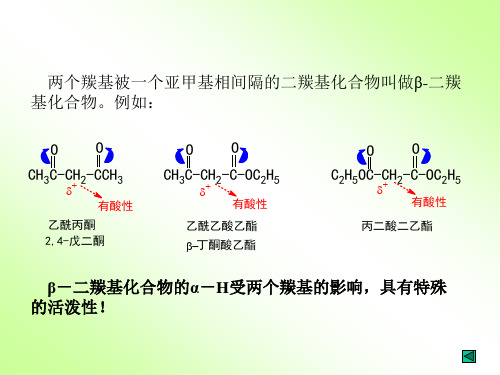
② 酮的酸性一般大于酯,所以在乙醇钠的作用下,酮更 易生成碳负离子。
例如:
O CH3-C-CH 3 C2H5ONa
O CH3-C-C-H 2
O-
CH3-C=CH 2
O
O
CH3-C-OC2H5 + -CH2-C-CH3
O- O CH3-C-CH2-C-CH3
OCH2CH3
OO CH3-C-CH2-C-CH3
R
C
CC
C O CH3
O
EtOH
OO
RC
C OEt
溴化后可以形成卡宾,可以合成小环化合物
O
C O CH3
H2C C
C O CH3
Br2
O
O
Br H
C O CH3
C
C
C O CH3
CuX
O
CH=CH2
O
C O CH3
Ar
CC
C O CH3
O
O
C O CH3
C
C
C O CH3
O
14.4Knoenenagel反应:
CF3
CH3
2. 烯醇式含量与溶剂有关,在极性溶剂(如:水或质
子性溶剂)中烯醇式含量↓,而在非极性溶剂中烯醇式
含量↑。如:
O
O
OH O
=
CH3 C CH2 C OC2H5
酮式
= CH3 C CH C OC2H5
烯醇式
H2O
99.6 %
0.4 %
C2H5O H
89.48 %
10.52 %
C6H12
53.6 %
46.4 %
这是因为在极性溶剂中,酮式或烯醇式均易 与水形成分子间氢键,从而减少了烯醇式形 成分子内氢键的几率;而在非极性溶剂中则 有利于烯醇式分子内氢键的形成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解:(B)没有烯醇结构。故可以采用①FeCl3溶液、 ② Br2/CCl4溶液鉴别。
P255 习题
2.用简单的化学方法鉴别下列化合物
(1)CH3COCH2COOH与HOOCCH2CH2CH2COOH
含有α-氢的酯都可发生Clainsen缩合反应,但两种不同的都含α-氢的酯缩合 后会产生四种产物。
O O RCH2CCHCOC2H5 R O O O 1.C2H5ONa 2.H+ O O
R'CH2CCHCOC2H5 R' O RCH2COC2H5 + R'CH2COC2H5
RCH2CCHCOC2H5 R' O O
(皂化反应)
CH3 C CH2 C ONa
第二步:后酸(化)
O
O
CH3 C CH2 C ONa
第三步:再加热
O O
H3+O
O
O
CH3 C CH2 C OH
O
CH3 C CH2 C OH
CH3 C CH3 + CO2 (2)乙酰乙酸乙酯类化合物的酸式分解 当用氢氧化钠或氢氧化钾的浓碱溶液(40%的NaOH或KOH)和乙酰 乙酸乙酯类化合物反应时,则发生另一种分解反应,生成两分子羧酸,这 个反应叫乙酰乙酸乙酯类化合物的酸式分解反应。
R'CH2CCHCOC2H5 R
若将一个含α-氢的酯和另一个不含α-氢的酯缩合,控制合适条件可生成主 要产物。 例如,苯甲酰乙酸乙酯可通过苯甲酸乙酯和乙酸乙酯的缩合反 应来制备:
O O O 1.C2H5ONa 2.H+ O C OC2H5 + CH3 C OC2H5 C CH2 C OC2H5
为避免乙酸乙酯的自身缩合,可将苯甲酸乙酯和催化剂(乙醇钠)首 先加入到反应容器中,待达到反应温度时,再将乙酸乙酯慢慢滴加到苯甲 酸乙酯和催化剂的混合溶液中去。
CH3COCH2COOH HOOCCH2CH2CH2COOH
(2) CH3 C O CH2 C O
FeCl3
C O
显色反应 (-)
CH3
CH3 与 CH3
O O CH3CCH2CCH3
=
=
CH3CCH3
=
O
FeCl3
显色反应 (-)
烯醇式结构有一定的稳定性的原因:
1、通过烯醇羟基氢原子构成分子内氢键,形成一个稳定的 六元环状化合物; 2、烯醇式羟基氧原子上的未共用电子对与碳碳双键和碳氧 双键是共轭体系,发生了电子离域,降低了分子的能量。
O O 1.5%NaOH(稀碱) 2.H+/ O CH3 C CH3 + CO2 + C2H5OH
CH3 C CH2 C OC2H5
O
O
CH3 C CH C OC2H5 R
O R' O CH3 C C C OC2H5 R
1.5%NaOH(稀碱) 2.H+/
O CH3 C CH2R + CO2 + C2H5OH
COOC2H5 COOC2H5
1.C2H5ONa 2. H+
?
COOC2H5 COCH2COOC2H5
CH3COOC2H5 +
1.C2H5ONa 2.H+
乙酸乙酯 + 甲酸 乙酯 (2)
CH3COOC2H5 + HCOOC2H5 2.H
+
1.C2H5ONa 2. H+
?
1.C2H5ONa
HCOCH2COOC2H5
?
CH3CHCOOC2H5 CH3CH2CO
(3) 2CH3CH2COOC2H5
1.C2H5ONa 2. H+
13.2.2 乙酰乙酸乙酯在有机合成中的应用
(1)乙酰乙酸乙酯类化合物的酮式分解 用氢氧化钠或氢氧化钾的稀碱溶液(5%的NaOH或KOH)对乙酰乙酸 乙酯类化合物进行水解,首先生成β-酮酸,β-酮酸在加热情况下分解成甲 基酮和二氧化碳,这个反应叫乙酰乙酸乙酯类化合物的酮式分解反应。
1.5%NaOH(稀碱) 2.H+/
O CH3 C CH R + CO2 + C2H5OH R'
从上述反应可知,利用乙酰乙酸乙酯类化合物的酮式分解反应可以制备各 种甲基酮类化合物。 乙酰乙酸乙酯的酮式分解反应过程如下:(共三步) 第一步:先碱(5% NaOH )
O O 5%NaOH O O
CH3 C CH2 C OC2H5
(4)与稀碱作用,再酸化,然后加热分解得到丙酮。
O CH3CCH2COOC2H5 稀OH皂化反应 O CH3CCH2COOH -CO2 脱羧反应P223 O CH3CCH3
怎么证明为烯醇式? A、含有羟基: (1)与Na作用放出H2。 (2)与PCl5作用生成氯代物。
OH CH3C=CHCOOC2H5 PCl5 Cl CH3C=CHCOOC2H5 3-氯-2-丁烯酸乙酯
O
d
+
O
O
d
+
O
O
d
O
CH3C-CH2-CCH3
ÓÓ á Ó ÓÓ± ÓÓ 2,4-Ó ì ÓÓ
CH3C-CH2-C-OC2H5
ÓÓ á Ó ÓÓÓÓ á ÓÓ á ÓÓ b-ÓÓÓ
C2H5OC-CH -C-OC2H5 + 2
ÓÓ á Ó ÓÓÓ ± á ÓÓÓ
β-二羰基化合物的α-H受两个羰基的影响,具有特殊 的活泼性!
13.1 酮-烯醇互变异构
教材P50、P199~200。Kucherov(库切洛夫)反应
O RCH2CR' 酮式
互变异构
OH RCH=CR' 烯醇式
由于分子内的原子(或基团)连接位置不同而产生的异构称 为互变异构。 互变异构,也属于同分异构的一种。
鉴别乙醇、乙醛,可采用的试剂有( B、D )。
A、I2/OH-
(亲核取代反应)
这个反应条件可以适合很多种不同酯的缩合,通常把含有α-氢原子的酯, 在碱催化条件下发生缩合生成β-酮酸酯的反应叫Clainsen(克莱森 ) 酯缩合 反应。
Clainsen 缩合反应机理:(亲核取代反应)
O CH3 C OC2H5 + C2H5OO CH3 C OC2H5 + O
-
B、Cu2++OH-
C、Na
D、饱和NaHSO3
乙酰乙酸乙酯既有羰基的性质,又有羟基和双键的 性质,表明它是由酮式和烯醇式两种互变异构体组成 的:
O CH3CCH2COOC2H5 CH3
OH C=CHCOOC2H5
酮式(92.5%)
b.p.41℃(267Pa)
烯醇式(7.5%)
b.p.33℃(267Pa)
CH3
C O
CH H
C OC2H5 O
CH3-C CH-C-OC 2H5 OH O
共轭体系
六元环
表13-1一些常见羰基化合物烯醇式结构的相对含量
化合物名称 酮式结构
O CH3 C H
O
烯醇式结构
OH CH2 CH
烯醇式含 量
乙醛
极少
OH CH2 C CH3
OH CH2 C OC2H3
OH O CH3 C CH C OC2H5
CH2 C CH3
(互为互变异构体:既有电子的移动,也有原子的移动) 而以下两个结构互为共振杂化体:
O
-
O
-
CH2 C CH3
CH2 C CH3
(共振杂化体:只有电子的移动,没有原子的移动)
13.2 乙酰乙酸乙酯的合成及应用
13.2.1 乙酰乙酸乙酯的合成-Clainsen 缩合反应
13.2.2乙酰乙酸乙酯在有机合成上的应用
OH C=CHCOOC2H5
O O CH C OC2H5
CH3C=CH C
CH3C
互变异构体和共振杂化体最大的区别是后者原子核的相 对位置是不发生相对变化而只存在电子对的转移。前者 是允许原子核的位置发生变化。 书写方法,也不同!
共振杂化体 互变异构体
例如,下列两个结构互为互变异构体:
H
O
OH CH2 C CH3
O CH3-C-CH3
C2H5ONa
O CH3-C-CH2
O-
CH3-C=CH2
O O CH3-C-OC2H5 + CH2-C-CH3
亲核取代反应
O OCH3-C-CH2-C-CH3 OCH2CH3
O O CH3-C-CH2-C-CH3
O
O + H-C-OC2H5
O
NaH
O-CH OC2H5
O O -C-H + C H OH 2 5
O O CH3 C CH2 C OC2H5 1.40%NaOH(浓碱) 2.H+/ O CH3 C OH O + CH3 C OH + C2H5OH
CH3 C CH C OC2H5 + C2H5OH
-
(活泼α -H)
O
O
O H+
(酸化)
O
CH3 C CH C OC2H5
-
CH3 C CH2 C OC2H5
产物有互变异构:
O
O
OH
O
CH3 C CH2 C OC2H5
CH3 C CH C OC2H5
(烯酮式)
讨论: ① Claison酯缩合反应的本质是亲核加成 -消除反 应,最终得到β-二羰基化合物。 ② 酮的酸性一般大于酯,所以在乙醇钠的作用下, 酮更易生成碳负离子。 例如:
O CH2 C OC2H5 + C2H5OH
